1.本发明涉及医药领域,具体的说,本发明涉及邻苯二酚及衍生物在制备用于治疗睡眠障碍药物中的用途。
背景技术:
2.失眠是临床最为常见的睡眠障碍类型。长期失眠对于正常生活和工作会产生严重负面影响,甚至会导致恶性意外事故的发生。流行病学研究结果显示45.4%的中国人在过去1个月中曾经历过不同程度失眠。对于健康人,长期的睡眠障碍会增加慢性病的易感性,如冠状动脉疾病、糖尿病等。
3.术后睡眠障碍(post-operative sleep disturbances,psd)近年来越来越受到重视。有研究报道42%的患者术后出现睡眠障碍,23%的患者睡眠障碍可持续4d。而在术后第15天约有1/4的患者再次反映睡眠不足,其中24%需要药物治疗纠正睡眠障碍。psd不仅表现出睡眠质量的降低,同时睡眠节律也发生改变。研究表明,psd与术后阵发性低氧血症、术后痛觉敏化、术后认知功能障碍以及交感兴奋所致的血压波动、心律不齐等心血管并发症有关。对于术后患者,睡眠缺失使得个体生理参数紊乱,可能会对患者的治疗和管理产生负面影响,如呼吸肌顺应性下降、血压增高、伤口愈合能力下降等,对于icu患者,睡眠障碍会增加继发性并发症的风险,延长icu住院日,提高感染率和病死率。
4.根据多功能睡眠记录,正常的生理睡眠分为非快动眼睡眠(non-rapid eye movement,nrem)和快动眼睡眠(rapid eye movement,rem),一次连续的nrem和rem大约持续90~100min,每个夜晚进行4~6次循环。nrem分为n1、n2、n3三个阶段,分别占总睡眠时长的2%~5%、45%~55%、15%~20%。n1即浅睡眠,指从觉醒到睡眠的过渡阶段;n2为中等程度睡眠;n3为深度睡眠,典型脑电表现为高幅低频的δ波(0.5~2.0hz)。由此n3也称为慢波睡眠(slow-wave sleep,sws),即rechtschaffen和kales睡眠系统中的nrem 3期和4期。nrem有利于体力恢复,清除脑内代谢废物,对中枢神经系统的正常生理功能至关重要。rem占睡眠总时长的20%~25%,脑电图表现为低幅高频的锯齿状的θ波间杂有β波,伴有快速眼球运动,骨骼肌失张力,此期与梦境和记忆巩固有关。睡眠障碍患者的典型表现为:总睡眠时间减少,入睡潜伏期增加,深睡眠减少,浅睡眠增加,sws、rem明显降低,觉醒次数增多,导致睡眠质量严重下降。
5.唑吡坦、佐匹克隆和苯二氮卓类药物(如咪达唑仑)为目前临床常用的催眠药物,它们共同的特点是均作用于中枢抑制性受体gaba
a
上,通过增强gaba
a
受体偶联的离子通道开放,引起细胞膜超极化,神经元受抑制,从而产生睡眠诱导作用。该类药物可明显缩短入睡潜伏期,增加患者的睡眠总时长以及nrem睡眠时长,具有起效快,作用强的优点。但研究发现,作用于gaba
a
受体的药物会对睡眠结构产生不利影响,表现为抑制rem睡眠和sws睡眠,sws睡眠的缺失会损害记忆形成功能和增加患者罹患谵妄(精神错乱)的几率,而rem睡眠的剥夺可能会导致专注力受损,记忆改变以及谵妄(精神错乱)的发生。上述情况限制了单独作用于gaba
a
受体药物的应用,而其他临床中应用对抗失眠的药物都存在着各自的不
足和缺陷,例如褪黑素受体激动剂和食欲素受体抑制剂(苏沃雷生)虽然对改善睡眠结构有帮助,但睡眠诱导活性较弱,导致治疗效果个体差异大;5-ht受体调节剂(曲唑酮)睡眠诱导作用明显,但副作用较多,如头疼、低血压和心血管风险;部分抗癫痫、抗抑郁和抗精神病药物在被用于睡眠诱导,但没有充分的睡眠诱导研究数据,均存在相关的安全性风险。
6.综上所述,鉴于现有治疗睡眠障碍药物存在的缺陷和不足,本发明旨在提供一种安全有效的用于治疗睡眠障碍患者的新途径。
技术实现要素:
7.本发明为克服临床应用中现有治疗睡眠障碍药物药效不理想,而且存在较多不良反应的缺陷,而提供了一种安全有效的用于治疗睡眠障碍患者的新途径。该途径采用本发明所述的化合物i治疗睡眠障碍患者,克服了单独作用于gaba
a
受体的治疗睡眠障碍药物对患者带来的安全问题,同时具有较好的治疗效果。
8.为达上述目的,一方面,本发明提供了一种式i化合物或者其药学上可接受的盐或前药在制备用于治疗睡眠障碍药物中的用途,其中,所述式i化合物结构如下所示:
[0009][0010]
r1、r2、r3、r4各自独立选自乙基、丙基或丁基。
[0011]
根据本发明一些具体实施方案,其中,r1、r2、r3、r4各自独立选自正丙基或异丙基。
[0012]
根据本发明一些具体实施方案,其中,r1、r2、r3、r4各自独立选自正丁基、仲丁基或叔丁基。
[0013]
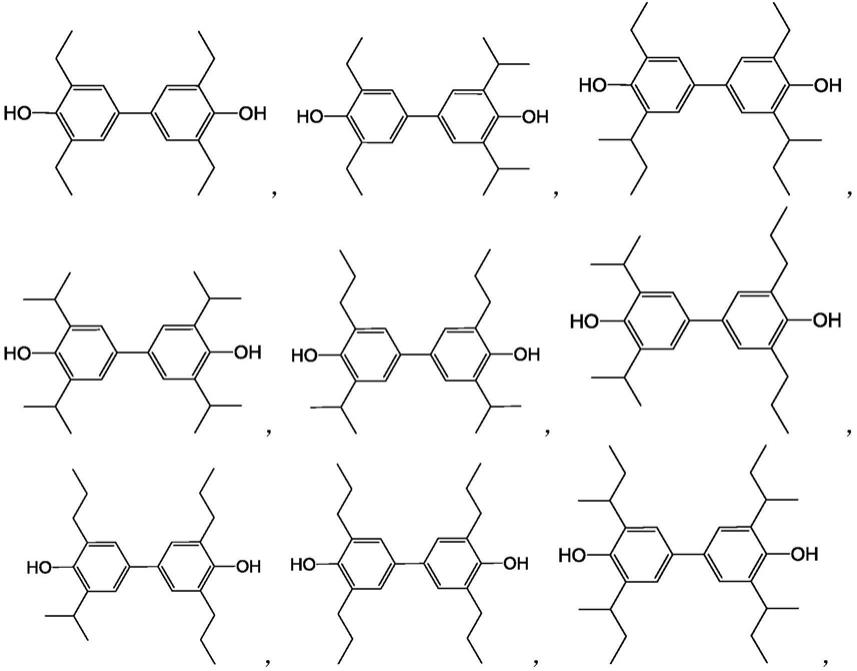
根据本发明一些具体实施方案,其中,所述式(i)化合物选自以下化合物:
[0014][0015][0016]
所述前药是指可经体内代谢转化为具有生物活性的本发明化合物。本发明的前药通过修饰本发明化合物中的酚基团来制备,该修饰可以通过常规的操作或者在体内被除去,而得到母体化合物。当本发明的前药被施予哺乳动物个体时,前药被割裂形成游离的羟基。
[0017]
根据本发明一些具体实施方案,其中,所述前药如式ii化合物所示:
[0018][0019]
r5选自
[0020]
r6选自h或r5,
[0021]
其中y
选自na
,k
或h
,r7选自ch3(ch2)n-,n选自0至3。
[0022]
根据本发明一些具体实施方案,其中,所述的药用盐为化合物i与有机酸、无机酸或碱金属所成的盐。
[0023]
根据本发明一些具体实施方案,其中,所述的药用盐选自化合物i的如下盐:硫酸盐、磷酸盐、盐酸盐、氢溴酸盐、醋酸盐、草酸盐、柠檬酸盐、琥珀酸盐、葡萄糖酸盐、酒石酸盐、对甲苯磺酸盐、苯磺酸盐、甲磺酸盐、苯甲酸盐、乳酸盐、马来酸盐、锂盐、钠盐、钾盐和钙盐中的一种或多种的组合。
[0024]
根据本发明一些具体实施方案,其中,所述的化合物i或其药学上可接受的盐或前药被配制成药物组合物,该药物组合物含有化合物i或其药学上可接受的盐或前药,和药用辅料。
[0025]
根据本发明一些具体实施方案,其中,所述式i化合物或者其药学上可接受的盐或前药被配制成含其的片剂、胶囊剂、注射剂、乳剂、脂质体、冻干粉或微球制剂;所述胶囊剂例如为软胶囊。
[0026]
根据本发明一些具体实施方案,其中,所述的化合物i或其药学上可接受的盐或前药被配制成药物组合物,该药物组合物含有化合物i或其药学上可接受的盐或前药,和其他具有治疗睡眠障碍活性的药物,所述其他具有治疗睡眠障碍活性的药物选自苯二氮卓类药物、巴比妥类药物、唑吡坦、佐匹克隆、扎来普隆、抗组胺类药物、褪黑素受体激动剂、食欲素受体抑制剂或5-ht受体调节剂。
[0027]
根据本发明一些具体实施方案,其中,所述睡眠障碍包括失眠症、术后睡眠障碍和icu患者睡眠障碍。
[0028]
根据本发明一些具体实施方案,其中,所述的化合物i或者其药学上可接受的盐或前药在制备用于诱导、延长和/或改善睡眠和/或睡眠质量的药物中的用途。
[0029]
根据本发明一些具体实施方案,其中,所述改善睡眠可通过改善睡眠结构实现。
[0030]
另外,本发明还提供了所述的式(i)化合物或其药学上可接受的盐或前药被配制成药物组合物,该药物组合物含有化合物i或其药用盐或前药,和药用辅料。
[0031]
根据需要,本发明的药物组合物还可以加入一种或多种药学上可接受的载体或赋形剂。
[0032]
本发明的药物组合物,化合物i或者其药学上可接受的盐或前药所占重量百分比可以是0.1~99.9%,其余为药物可接受的载体。
[0033]
本发明的药物组合物可以制备成任何可药用的剂型,这些剂型包括:片剂、糖衣片剂、薄膜衣片剂、肠溶衣片剂、胶囊剂、硬胶囊剂、软胶囊剂、口服液、口含剂、颗粒剂、冲剂、丸剂、散剂、膏剂、丹剂、混悬剂、粉剂、溶液剂、注射剂、栓剂、软膏剂、硬膏剂、霜剂、喷雾剂、滴剂、贴剂。本发明的制剂,优选的是片剂、胶囊剂、注射剂、乳剂、脂质体、冻干粉或微球制剂;所述胶囊剂例如为软胶囊。
[0034]
本发明的药物组合物,其口服给药的制剂可含有常用的赋形剂,诸如粘合剂、填充剂、稀释剂、压片剂、润滑剂、崩解剂、着色剂、调味剂和湿润剂,必要时可对片剂进行包衣。
[0035]
适用的填充剂包括纤维素、甘露糖醇、乳糖和其它类似的填充剂。适宜的崩解剂包括淀粉、聚乙烯吡咯烷酮和淀粉衍生物,例如羟基乙酸淀粉钠。适宜的润滑剂包括,例如硬脂酸镁。适宜的药物可接受的湿润剂包括十二烷基硫酸钠。
[0036]
可通过混合,填充,压片等常用的方法制备固体口服组合物。进行反复混合可使活性物质分布在整个使用大量填充剂的那些组合物中。
[0037]
口服液体制剂的形式例如可以是水性或油性悬浮液、溶液、乳剂、糖浆剂或酏剂,或者可以是一种在使用前可用水或其它适宜的载体复配的干燥产品。这种液体制剂可含有常规的添加剂,诸如悬浮剂、乳化剂、非水性载体、防腐剂等,如果需要,可含有常规的香味剂或着色剂。所述悬浮剂例如为山梨醇、糖浆、甲基纤维素、明胶、羟乙基纤维素、羧甲基纤维素、硬脂酸铝凝胶和/或氢化食用脂肪;所述乳化剂例如为卵磷脂、脱水山梨醇一油酸酯和/或阿拉伯胶;所述非水性载体(它们可以包括食用油)例如为杏仁油、分馏椰子油、诸如甘油的酯的油性酯、丙二醇和/或乙醇;所述防腐剂例如谓对羟基苯甲酯或对羟基苯甲酸丙酯和/或山梨酸。
[0038]
对于注射剂,制备的液体单位剂型含有本发明的活性物质(即本发明所述3,3’,5,5
’-
四异丙基-4,4
’-
二联苯酚及其药用盐、酯化物或溶剂化物)和无菌载体。根据载体和浓度,可以将此化合物悬浮或者溶解。溶液的制备通常是通过将活性物质溶解在一种载体中,在将其装入一种适宜的小瓶或安瓿前过滤消毒,然后密封。辅料例如一种局部麻醉剂、防腐剂和缓冲剂也可以溶解在这种载体中。为了提高其稳定性,可在装入小瓶以后将这种组合物冰冻,并在真空下将水除去。
[0039]
本发明的药物组合物,在制备成药剂时可选择性的加入适合的药物可接受的载体,所述药物可接受的载体选自:甘露醇、山梨醇、焦亚硫酸钠、亚硫酸氢钠、硫代硫酸钠、盐酸半胱氨酸、巯基乙酸、蛋氨酸、维生素c、edta二钠、edta钙钠,一价碱金属的碳酸盐、醋酸盐、磷酸盐或其水溶液、盐酸、醋酸、硫酸、磷酸、氨基酸、氯化钠、氯化钾、乳酸钠、木糖醇、麦芽糖、葡萄糖、果糖、右旋糖苷、甘氨酸、淀粉、蔗糖、乳糖、甘露糖醇、硅衍生物、纤维素及其衍生物、藻酸盐、明胶、聚乙烯吡咯烷酮、甘油、土温80、琼脂、碳酸钙、碳酸氢钙、表面活性剂、聚乙二醇、环糊精、β-环糊精、磷脂类材料、高岭土、滑石粉、硬脂酸钙和/或硬脂酸镁等。
[0040]
优选的,本发明所述药用辅料可以包括聚乙二醇、磷脂、植物油、维生素e和/或甘油;
[0041]
所述磷脂可以选自大豆磷脂、蛋黄卵磷脂和氢化磷脂中的一种或几种;
[0042]
所述植物油可以选自大豆油、橄榄油和红花油中的一种或几种。
[0043]
其中,所述式i化合物或者其药学上可接受的盐或前药被配制成含其的片剂、胶囊剂、注射剂、乳剂、脂质体、冻干粉或微球制剂;所述胶囊剂例如为软胶囊。
[0044]
其中,所述的化合物i或其药用盐或前药被配制成药物组合物,该药物组合物含有化合物i或其药用盐或前药,和其他具有治疗睡眠障碍活性的药物,所述其他具有治疗睡眠障碍活性的药物选自苯二氮卓类药物、唑吡坦、佐匹克隆、扎来普隆、抗组胺药物、褪黑素、食欲素受体抑制剂或5-ht受体抑制剂。
[0045]
其中,所述苯二氮卓类药物可选自地西泮、劳拉西泮、奥沙西泮、咪达唑仑、三唑仑和艾司唑仑;
[0046]
所述巴比妥类药物可选自巴比妥、苯巴比妥、异戊巴比妥和司可巴比妥;
[0047]
所述抗组胺药物可选自苯海拉明、氯苯那敏和异丙嗪;
[0048]
所述食欲素受体抑制剂为苏沃雷生;
[0049]
所述5-ht受体调节剂为曲唑酮;
[0050]
优选地,所述睡眠障碍包括失眠症,术后睡眠障碍和icu患者睡眠障碍。
[0051]
本发明还提供了一种所述的化合物i或者其药学上可接受的盐或前药,在制备用于诱导、延长和/或改善睡眠和/或睡眠质量的药物中的用途。
[0052]
根据本发明一些具体实施方案,其中,所述改善睡眠可通过改善睡眠结构实现。
[0053]
本发明所述的用途,主要是通过所述药物食欲素受体实现的。同时,本发明还发现,本发明的化合物还可同时作用于gaba
a
受体,从而实现与食欲素受体作用的协同效果。
[0054]
本发明的实施例中,体外受体靶点试验表明化合物(i)对食欲素(ox)受体有明显的抑制作用。食欲素受体近年来被发现与睡眠相关,该受体被抑制时表现出嗜睡作用,研究发现ox受体治疗失眠和睡眠障碍的潜能与当前包括gaba
a
受体调节剂在内的标准治疗手段有很大不同,这些治疗药物普遍缺乏对睡眠/觉醒机制控制的选择性,ox受体抑制剂苏沃雷生(国外已上市)可增加整体的睡眠效率和减少睡眠开始后的觉醒次数(waso),并具有明显剂量效应关系,同时睡眠波监测发现它可以延长rem和sws睡眠的时长,明显改善患者的睡眠结构。因此上述体外研究结果提示化合物(i)可能具有区别于单独作用于gaba
a
受体药物的睡眠诱导作用和改善上述药物缺陷的潜力。
[0055]
实施例中的进一步的动物研究发现化合物(i)给药后明显减少了试验大鼠的清醒时间以及浅睡眠时长,同时增加了sws慢波睡眠以及rem睡眠时长,具有改善睡眠质量的良好潜力,而阳性药物地西泮和右佐匹克隆表现出抑制sws慢波睡眠或rem睡眠的特点,对睡眠结构影响比较明显;并且本发明化合物在药效作用消退后对动物的睡眠结构影响很小,未见后遗效应和停药反弹的情况,而右佐匹克隆和地西泮给药大鼠在药效作用期过后睡眠结构仍未恢复正常,表现为浅睡眠明显延长和rem睡眠的明显缩短。
附图说明
[0056]
图1为药物治疗后的4小时(zt17-zt21)内各组相比溶剂组睡眠四相时长的变化值(mean
±
sem,n=12,***p<0.001,one-way anova test,vs.实施例化合物)。
[0057]
图2为非药效期的4小时(zt0-zt04)内各组相比溶剂组睡眠四相时长的变化值(mean
±
sem,n=12,**p<0.001,***p<0.001,one-way anovatest,vs.实施例化合物)。
具体实施方式
[0058]
以下通过具体实施例详细说明本发明的实施过程和产生的有益效果,旨在帮助阅读者更好地理解本发明的实质和特点,不作为对本案可实施范围的限定。
[0059]
制备例
[0060][0061]
实施例1
[0062]
化合物1:3,3’,5,5
’-
四异丙基-4,4
’-
联苯二酚的合成
[0063]
称17.8g(0.1mol)2,6-二异丙基苯酚加入100ml乙酸乙酯溶解,再加入2.75(0.01mol)g碳酸银和24g无水硫酸镁,室温搅拌2h,tlc监控反应,反应完毕后向缓慢加水猝灭,抽滤,滤液用乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,抽滤,滤液减压浓缩,加适量甲醇搅拌,1h后有红色晶体产生,抽滤得到12.30g固体。无需纯化直接下一步反应。
[0064]
将上述所得红色固体用100ml乙酸乙酯溶解,此外,27.66g保险粉na2s2o4用1mol/l naoh溶解后,加入上述所得枚红色固体的乙酸乙酯溶液中,室温搅拌1.5h,tlc监控,反应完毕加水猝灭。用乙酸乙酯萃取,合并有机相,有机相用无水硫酸钠干燥,过滤,滤液减压浓缩,得到粗品5g淡黄色固体,柱层析,石油醚:乙酸乙酯=10:1为洗脱剂,收集所得馏分,减压浓缩后真空干燥得到8.45g白色固体,收率为22.5%。
[0065]
ms(m h
):355;
[0066]1h nmr(300mhz,cdcl3):δ7.22(s,4h),4.81(s,2h),3.27-3.20(m,4h),1.37-1.35(d,24h)。
[0067]
实施例2
[0068]
化合物2:3,5,-二乙基-3’,5
’-
二异丙基-4,4
’-
联苯二酚的合成
[0069]
分别称8.9g(0.05mol)2,6-二异丙基苯酚和7.8g(0.05mol)2,6二丙基苯酚加入150ml乙酸乙酯溶解,再加入2.75(0.01mol)g碳酸银和24g无水硫酸镁,室温搅拌2h,tlc监控反应,反应完毕后向缓慢加水猝灭,抽滤,滤液用乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,抽滤,滤液减压浓缩,加适量甲醇搅拌,1h后有红色晶体产生,抽滤得到13.4g固体。无需纯化直接下一步反应。
[0070]
将上述所得红色固体用100ml乙酸乙酯溶解,此外,27.66g保险粉na2s2o4用1mol/l naoh溶解后,加入上述所得枚红色固体的乙酸乙酯溶液中,室温搅拌1.5h,tlc监控,反应完毕加水猝灭。用乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,过滤,滤液减压浓缩,得到粗品5g淡黄色固体,柱层析,石油醚:乙酸乙酯=10:1为洗脱剂,收集所得馏分,减压浓缩后真空干燥得到7.78g白色固体,收率为23.8%。
[0071]
ms(m h
):327;
[0072]1h nmr(300mhz,cdcl3):δ7.67(s,6h),7.55(s,6h),4.77(s,3h),3.87(s,3h),3.05(s,2h),2.50(s,12h),1.13(d,j=10.0hz,5h).
[0073]
实施例3
[0074]
化合物3:3,5,-二异丙基-3’,5
’-
二丙基-4,4
’-
联苯二酚的合成
[0075]
分别称8.9g(0.05mol)2,6-二异丙基苯酚和7.8g 2,6二乙基苯酚加入150ml乙酸乙酯溶解,再加入2.75(0.01mol)g碳酸银和24g无水硫酸镁,室温搅拌2h,tlc监控反应,反应完毕后向缓慢加水猝灭,抽滤,滤液用乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,抽滤,滤液减压浓缩,加适量甲醇搅拌,1h后有红色晶体产生,抽滤得到12.30g固体。无需纯化直接下一步反应。
[0076]
将上述所得红色固体用100ml乙酸乙酯溶解,此外,27.66g保险粉na2s2o4用1mol/l naoh溶解后,加入上述所得枚红色固体的乙酸乙酯溶液中,室温搅拌1.5h,tlc监控,反应完毕加水猝灭。用乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,过滤,滤液减压浓缩,得到粗品5g淡黄色固体,柱层析,石油醚:乙酸乙酯=10:1为洗脱剂,收集所得馏分,减压浓缩后真空干燥得到8.5g白色固体,收率为23.8%。
[0077]
ms(m h
):355;
[0078]1h nmr(300mhz,cdcl3):δ(7.67(s,2h),7.55(s,2h),4.80(s,1h),3.71(s,1h),3.05(s,1h),2.63(s,2h),1.64(s,2h),1.14(s,12h),0.94(s,3h).
[0079]
实施例4
[0080]
化合物4:3,5,-二异丙基-3’,5
’-
二丁基-4,4
’-
联苯二酚的合成
[0081]
参考化合物3的合成,最后得到黄色固体11.1g,收率29%。
[0082]
ms(m h
):383;
[0083]1h nmr(300mhz,cdcl3):δ7.67(s,8h),7.55(s,8h),4.82(s,4h),3.64(s,4h),3.05(s,3h),2.59(s,8h),1.53(s,6h),1.30(s,9h),1.14(s,53h),0.89(s,13h).
[0084]
实施例5
[0085]
化合物5:3,3’,5,5
’-
四乙基-4,4
’-
联苯二酚的合成
[0086]
参考化合物1的合成,最后得到白色固体7.7g,收率36%。
[0087]
ms(m h
):299;
[0088]1h nmr(300mhz,cdcl3):δ7.55(s,2h),4.78(s,1h),2.50(s,4h),1.12(s,3h).
[0089]
实施例6
[0090]
化合物6:3,3’,5,5
’-
四丙基-4,4
’-
联苯二酚的合成
[0091]
参考化合物1的合成工艺,最后得到浅黄色固体8.5g,收率24%。
[0092]
ms(m h
):355;
[0093]1h nmr(300mhz,cdcl3):δ7.22(s,2h),4.81(s,1h),2.63(s,2h),1.64(s,2h),0.94(s,3h).
[0094]
实施例7
[0095]
化合物7:3,3
’-
二异丙基-5,5
’-
二丙基-4,4
’-
联苯二酚的合成
[0096]
参考化合物1的合成工艺,最后得到浅黄色固体11.1g,收率31%。
[0097]
ms(m h
):355;
[0098]1h nmr(300mhz,cdcl3):δ7.38(s,4h),4.81(s,2h),),3.05(s,3h),2.63(s,9h),1.64(s,10h),1.14(s,55h),0.94(s,14h).
[0099]
实施例8
[0100]
化合物8:3,3
’-
二丙基-5-异丙基-5
’-
丙基-4,4
’-
联苯二酚的合成
[0101]
参考化合物1的合成工艺,最后得到白色固体10.6g,收率30%。
[0102]
ms(m h
):355;
[0103]1h nmr(300mhz,cdcl3):δ7.42(s,4h),4.81(s,2h),3.27-3.20(m,12h),2.63(s,6h),1.64-0.94(m,9h).
[0104]
实施例9
[0105]
化合物9:3,3
’-
二异丙基-5,5
’-
二仲丁基-4,4
’-
联苯二酚的合成
[0106]
参考化合物1的合成工艺,最后得到白色固体9.87g,收率24%。
[0107]
ms(m h
):411;
[0108]1h nmr(300mhz,cdcl3):δ7.25(s,4h),4.59(s,2h),3.27-3.20(m,4h),2.97-0.95(m,28).
[0109]
实施例10
[0110]
化合物10:3,3’,5,5
’-
四仲丁基-4,4
’-
联苯二酚的合成
[0111]
参考化合物3的合成工艺,最后得到浅黄色固体11.9g,收率29%。
[0112]
ms(m h
):411;
[0113]1h nmr(300mhz,cdcl3):δ7.30(s,4h),4.82(s,2h),3.37-3.20(m,4h),3.12-0.95(m,32).
[0114]
实施例11
[0115]
化合物11:3,3’,5,5
’-
四异丁基-4,4
’-
联苯二酚化合物的合成
[0116]
参考化合物3的合成工艺,最后得到白色固体9.23g,收率26%。
[0117]
ms(m h
):355;
[0118]1h nmr(300mhz,cdcl3):δ7.66(s,4h),4.81(s,2h),3.27-3.20(m,4h),2.9-0.85(m,32).
[0119]
实施例12
[0120]
化合物12:3,3
’-
二乙基-5,5
’-
二仲丁基-4,4
’-
联苯二酚化合物的合成
[0121]
参考化合物1的合成工艺,最后得到浅黄色固体9.24g,收率30%。
[0122]
ms(m h
):411;
[0123]1h nmr(300mhz,cdcl3):δ7.52(s,4h),4.81(s,2h),3.27-3.20(m,2h),2.87-1.05(m,26).
[0124]
实施例13
[0125]
化合物13:3,3
’-
二丁基-5,5
’-
二仲丁基-4,4
’-
联苯二酚化合物的合成
[0126]
参考化合物3的合成工艺,最后得到浅黄色固体14.2g,收率35%。
[0127]
ms(m h
):411;
[0128]1h nmr(300mhz,cdcl3):δ7.13(s,4h),4.81(s,2h),3.27-3.20(m,2h),2.37-0.35(m,34).
[0129]
实施例14
[0130]
化合物14:3-丁基-3
’-
异丁基-5-丁基-,5
’-
异丁基-4,4
’-
联苯二酚化合物的合成
[0131]
参考化合物1的合成工艺,最后得到白色固体9.9g,收率28%。
[0132]
ms(m h
):355;
[0133]1h nmr(300mhz,cdcl3):δ7.40(s,4h),4.81(s,2h),3.27-3.20(m,2h),2.37-0.55(m,34).
[0134]
实施例15
[0135]
化合物15:3-仲丁基-3
’-
异丁基-5-仲丁基-,5
’-
异丁基-4,4
’-
联苯二酚的合成
[0136]
参考化合物1的合成工艺,最后得到白色固体6.57g,收率16%。
[0137]
ms(m h
):411;
[0138]1h nmr(300mhz,cdcl3):δ7.62(s,4h),4.81(s,2h),3.27-3.20(m,4h),2.37-1.05(m,32).
[0139]
实施例16
[0140]
化合物16:3,3
’-
二异丁基-5,5
’-
二仲丁基-4,4
’-
联苯二酚的合成
[0141][0142]
1)化合物单体2-(1-甲基)丙基-6-(2-甲基)丙基苯酚的合成
[0143]
于25ml的圆底烧瓶中依次加入2-(1-甲基)丙基苯酚(1.1g,7.3mmol)和3-甲基烯丙基溴(1.97g 14.6mmol),并用二氯甲烷溶解;于另一50ml的烧瓶中加入苄基三丁基溴化铵(0.26g,0.73mmol),并用1m naoh溶液溶解;室温下,分别将上述所得溶液混合,室温搅拌2h,分离出有机相,水相用二氯甲烷萃取,合并有机相,有机相用水、饱和氯化钠洗涤,无水硫酸钠干燥,浓缩得无色液体。该液体在氮气保护下,于250℃加热2h,冷却,柱层析得无色液体;将该无色液体溶于无水乙醇中,加入pd/c还原,得到2-(1-甲基)丙基-6-(2-甲基)丙基苯酚1.0g,收率为67%.
[0144]
ms(m h
):207;
[0145]1h nmr(400mhz,cdcl3)δ7.06(t,j=7.6,hz,1h),6.94(dd,j=7.6,1.6hz,2h),5.35(s,1h),3.4-2.62(m,5h),1.68
–
1.59(m,12h).
[0146]
2)化合物16的合成
[0147]
参考化合物1的合成工艺,最后得到浅黄色固体9.15g,收率24%。
[0148]
ms(m h
):411;1h nmr(300mhz,cdcl3):δ7.52(s,4h),4.81(s,2h),3.50-3.28(m,4h),2.99-1.03(m,32).
[0149]
实施例17
[0150]
化合物17:4'-羟基-3,3',5,5'-四异丙基-[1,1'-联苯]-4-氧甲基磷酸二钠
[0151][0152]
氮气保护下,向反应瓶中加入三氯氧磷(2.5g,16.8mmol)和二氯甲烷(10ml),控制温度在0℃,将丙泊酚(5g,14mmol)和三乙胺(2g,20.2mmol)溶解于二氯甲烷(10ml)中,缓慢
滴加到反应瓶中,控制温度在10℃以下,滴加后升至室温搅拌4小时,过滤除去固体,加水淬灭反应,用二氯甲烷萃取,有机相用无水硫酸钠干燥,旋干,得粗品。柱层析分离粗品,得到产物(1.2g,18%)。将上述产品溶解到乙醇中,在冰浴下加入2m氢氧化钠(2.5ml,5.1mmol)水溶液,室温搅拌2小时,减压浓缩得到黄色粗品,用90%的异丙醇水溶液重结晶得到白色固体(1g,77%)。
[0153]1h nmr(500mhz,chloroform)δ7.67(s,1h),4.34(s,1h),3.05(s,1h),1.14(s,6h).
[0154]
实施例18
[0155]
化合物18:4'-羟基-3,3',5,5'-四异丙基-[1,1'-联苯]-4-丁酸酯
[0156][0157]
将4,4
’-
二羟基-3,3’,5,5
’-
四异丙基联苯(5g,14.10mmol)加入到10ml的丁酸酐中,氮气保护下,回流1h后,将反应液冷却至室温,减压除去丁酸酐,柱层析分离得到3,3’,5,5
’-
四异丙基联苯-4-丙酸酯(1g,16%)。白色固体。
[0158]1h nmr(500mhz,chloroform)δ7.84(s,2h),7.67(s,2h),4.33(s,1h),3.05(s,4h),2.59(s,2h),1.68(s,2h),1.14(s,24h),0.99(s,3h).
[0159]
实施例19
[0160]
化合物19:3,3’,5,5
’-
四异丙基联苯-4’4-二甲酸酯
[0161][0162]
将4,4
’-
二羟基-3,3’,5,5
’-
四异丙基联苯(10g,28.2mmol)加入到30ml的甲酸酐中,氮气保护下,回流1h后,将反应液冷却至室温,减压除去甲酸酐,柱层析分离,分别得到得到3,3’,5,5
’-
四异丙基联苯-4’4-二甲酸酯(1g,8%)和3,3’,5,5
’-
四异丙基联苯-4-甲酸酯(0.5g,4.5%)。白色固体。
[0163]
1h nmr(500mhz,chloroform-d)δ8.22(s,2h),7.32(s,4h),3.42
–
2.62(m,4h),1.19(d,j=6.8hz,24h).
[0164]
实施例20
[0165]
化合物20:1-(4
’-
羟基-3,3’,5,5
’-
四异丙基联苯-4-氧基)乙酸乙酯
[0166][0167]
于100ml圆底烧瓶中依次加入4,4
’-
二羟基-3,3’,5,5
’-
四异丙基联苯(1g,2.8mmol),氯乙酸乙酯(0.4llg,3.36mmol),氢氧化钠(0.336g,8.4mmol),60ml二氯甲烷,室温搅拌8h。反应完全后,过滤,用二氯甲皖萃取,饱和食盐水洗涤,无水硫酸钠干燥,柱层析得白色固体(0.12g,10%)。
[0168]
1h nmr(300mhz,cdcl3)δ7.57(s,2h),7.48(s,2h),5.25(s,1h),3.01-2.98(m,4h),2.21(s,3h),1.82-1.80(d,3h),1.16-1.14(d,24h)。
[0169]
试验例1
[0170]
前药血浆转化测试
[0171]
取新鲜大鼠血浆置于ep管中,分别加入化合物1、17、18、19、20(终浓度均为0.3um),并记为试验组1至4,混匀后37℃孵育5min和10min后取样品加入三倍体积的冰冷乙腈,震荡,终止反应,13000rpm下4℃离心5min,吸取上清测试分析孵育后血浆中化合物1浓度,计算化合物17、18、19、20在血浆中的前药转化率=(1-c
x
/0.3um)
×
100%,其中c
x
表示实验1至4组孵育后化合物1的浓度。结果如下表1所示。
[0172]
表1
[0173][0174][0175]
如表中结果所示,化合物1在血浆中37℃孵育条件下非常稳定,含量没有变化,血浆中孵育5min后,前药化合物17已完全转化为化合物1,化合物19基本完全转化为化合物1,而化合物18在血浆中孵育10min后也完全转化,化合物20转化率稍慢,但10min内也可达到50%左右。以上结果表明,化合物17、18、19、20均为化合物1的前药,预期给药后在动物体内可迅速转化为化合物1而产生药理作用。
[0176]
试验例2
[0177]
体外重组表达ox1和ox2受体拮抗试验
[0178]
试验系统采用人源重组表达ox1受体的cho细胞系和表达人源重组表达ox2受体的
hek-293细胞系,分别在受体激动剂orexin-a(3nm)和orexin-b(10nm)存在的条件下,加入不同浓度(1、10、50、100、200和400nm)的各实施例化合物,检测其对激动剂引起细胞内钙离子浓度变化的抑制作用(荧光检测),并计算ic
50
值,结果如表2所示。
[0179]
表2
[0180][0181][0182]
结果表明:本发明实施例化合物可明显抑制食欲素ox1和ox2受体,具有改善睡眠结构的良好潜力。
[0183]
试验例3
[0184]
本发明化合物1对大鼠睡眠的影响
[0185]
实验采用成年雄性sd大鼠12只,6~9月龄,400~600g。实验开始前一周,预先以手术的方式在大鼠皮下植入4et四通道中枢神经电信号监测植入子(dsi公司,美国),在脑部埋置皮层电极用以收集皮层脑电(eeg/ecog),在颈部肌肉下埋置电极用以收集颈肌电(emg)。术后动物自由饮食并恢复,单笼饲养于12:12明暗循环条件下:暗循环开始于4:00(授时时间zt12),明循环开始于16:00(授时时间zt0)。
[0186]
12只大鼠首次给药分为4个亚组,每组3只,在授时时间zt17分别静脉给予80mg/kg
化合物1注射液(含1%化合物1和10%hs-15的水溶液)和溶剂(等体积含10%hs-15的水溶液),口服给予10mg/kg地西泮和60mg/kg唑吡坦,给药后通过eeg/ecog-emg记录动物的睡眠波,同时视频录像监测记录动物的整体活动情况。使用somnologica science software软件(embla,美国丹佛)统计动物给药后4h药效作用期(zt17-zt21)和4小时非药效作用期(zt0-zt04)的四项睡眠时间。7天清洗期后每个亚组动物顺次更换另一种药物,4个循环后保证每只动物都给予过所有药物,每种药物治疗组n=12。
[0187]
四项睡眠判断标准为:(1)清醒活动
---
低幅高频eeg,高幅emg或伴有自发活动;(2)浅睡眠
---
相比清醒状态eeg频率构成中delta和theta波比例更高,emg幅度降低无自发活动;(3)delta睡眠(sws慢波失眠)
---
eeg构成以delta波为主,肌张力降低,无自主活动;(4)快速眼动期(rem)睡眠
---
与清醒状态相似的高强度theta波比例升高,但emg及肌张力降低且无自主活动。
[0188]
实验结果如下表3、图1所示,经过三种药物的治疗相比溶剂对照组,动物的总睡眠时长均明显得到延长,清醒时间缩短,三种药物之间没有明显差异(p>0.05)。从睡眠结构来看,地西泮和唑吡坦组显著延长了浅睡眠时长,而实施例化合物组则对浅睡眠时长没有影响;唑吡坦和实施例化合物均可延长delta睡眠时间,两者没有显著性差异(p>0.05,而地西泮组delta睡眠时长却显著缩短;而对于rem睡眠时长,两个苯二氮卓类药物组动物均明显缩短,而实施例化合物则显著延长。由此可见使用化合物1治疗后,动物的睡眠效率得到了显著改善,对结构无不良影响,延长的睡眠时间主要由delta睡眠和rem睡眠组成,睡眠质量显然优于地西泮和唑吡坦。
[0189]
表3药物治疗后的4小时(zt17-zt21)内各组相比溶剂组睡眠四相时长的变化值(mean
±
sd,n=12)
[0190][0191]
***p<0.001,one-way anovatest,vs.实施例化合物。
[0192]
在给药后7小时(zt0)开始的4小时内评估各组动物睡眠效率可知,苯二氮卓类药物在非药效作用期内,睡眠总时长仍有一定程度的延长,其中地西泮与化合物1相比具有显著性差异(p<0.05),其结构表现为delta睡眠的轻度延长和浅睡眠的明显延长,相比溶剂对照组rem睡眠时间则显著缩短。而化合物1在总的清醒时长、浅睡眠、delta睡眠和rem睡眠的时长上仅有轻微的改变,但均与溶剂对照组无明显差异,由此可见实施例化合物在药效作用消退后对动物的睡眠结构影响很小,不易出现临床中其他药物引起的过度嗜睡,也不会出现停药反弹的情况;而与之相比,地西泮和唑吡坦在作用期过后均产生了一定程度的对睡眠结构的不利影响,表现为浅睡眠的明显延长和rem睡眠的明显缩短,这与临床中观察到的苯二氮卓类药物影响睡眠结构以及停药反弹等现象一致。如表4和图2所示。
[0193]
表4、非药效期的4小时(zt0-zt04)内各组相比溶剂组睡眠四相时长的变化值
(mean
±
sd,n=12)
[0194][0195]
**p<0.001,***p<0.001,one-way anova test,vs.实施例化合物
[0196]
试验例4
[0197]
本发明化合物1对健康人的睡眠诱导作用研究
[0198]
本发明化合物1所制备的制剂目前已完成了在中国健康受试者上进行的单中心、双盲、剂量递增、安慰剂对照的i期耐受性和药代动力学研究(临床试验批件号:2016l09981)。本研究设计了8个剂量,分别为0.5,1,2,4,8,12,18和24mg/kg,静脉注射给药,其中,0.5,1,18和24mg/kg剂量组每组各4例,2,4,8和12mg/kg剂量组每组各8例,每个剂量组给予异丙双酚和安慰剂的受试者比例为3:1。实验过程中对受试者进行了睡眠观察的研究,结果如下表5所示:
[0199]
表5.受试者睡眠情况比较
[0200]
剂量组别入组人数睡眠例数睡眠百分比安慰剂12325%0.5mg/kg3001mg/kg3002mg/kg6004mg/kg6008mg/kg6350%12mg/kg6350%18mg/kg3266.7%24mg/kg3266.7%
[0201]
结果显示,8mg/kg及以上剂量受试者在给药后出现睡眠,且呈现剂量依赖性,随着剂量升高,受试者的睡眠比率也得到提升。
[0202]
试验同时还对8mg/kg组受试者进行了脑电双频指数(bis)监测,根据文献和相关临床研究bis各数值段的意义为:85~100为清醒,65~<85为镇静,<85为麻醉,结果如下表6所示:
[0203]
表6.8mg/kg组受试者bis监测值比较分析
[0204][0205]
结果显示,给药组受试者bis值明显下降,大多数给药组受试者表现出明显持续的镇静,而安慰剂组受试者未见镇静作用。
[0206]
上述结果表明,化合物1在人体上表现出明确的睡眠诱导作用,具有治疗睡眠障碍的潜力。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

