1.本发明涉及一种引物探针,具体地说是一种用于病原菌分型定量检测用引物探针组,及含有该引物探针组的试剂盒及其检测方法。
背景技术:
2.感染是临床中常见的并发症,造成患者极高的病死率。例如,腹腔感染是肝硬化患者的常见并发症,而自发性细菌性腹膜炎(spontaneous bacterial peritonitis,sbp)为最常见的感染类型,高达25%的肝硬化和腹水患者可能出现sbp,住院死亡率在20%~40%。目前,国内外sbp诊断的金标准是腹水多核细胞(polymorphonuclear neutrophils,pmn)计数>250个/ul,然而在实际工作中,这一标准与临床感染判定之间存在明显不符,且该标准多年未见更新,越来越多的专家认识到现行诊断标准存在明显不足。
3.培养是临床感染判定的金标准,但培养方法的阳性率不高(约20%),培养周期长(3
‑
5天)也明显限制了该技术对临床早期感染的判断和用药指导,在临床中,由于未能明确引发感染的病原菌,临床医生只能根据患者的临床症状或体征,进行经验性诊断和治疗,后果一是造成抗生素过度应用,二是会引发耐药,这同时也不符合现代精准用药的原则和理念。
4.核酸检测对于病原菌的诊断具有极大潜力,特别是荧光定量(quantitative pcr,qpcr)技术具有敏感,快速、价格低廉等优点,日益受到研究者重视。例如通过检测腹水、血液样本的病原菌核酸就可以作为细菌易位的替代标记,而精准的分型及定量可以有效的指导临床的诊断和用药,因此,可以实现病原菌准确分型和定量的检测方法及试剂是本领域技术人员研究的热点。
5.随着分子诊断技术的普遍应用,研究人员发现如果只是泛泛检测临床样本中的病原菌核酸,而不区分核酸是来自于具有感染性的活菌体、还是来自于“死细胞”中释放出来的或细胞外环境中存在的游离病原菌核酸,会造成检测结果与真实感染状态之间会存在明显的不一致,结果并不能准确有效反应样本中具有感染性的病原菌现状,因此,大大削弱了核酸检测对于即时感染状态的评估,特别是在使用抗菌药物的前提下,这种影响至关重要。
技术实现要素:
6.为了解决背景技术中所述的病原菌检测中分型定量不精准的问题,本发明首先提供一种能够准确鉴定病原菌种类并定量检测的引物探针组。
7.本发明所要解决的另一技术问题是提供一种含有上述引物探针组的试剂盒。
8.本发明所要解决的又一技术问题是提供一种基于上述试剂盒提出的可精准检测活病原菌的试剂盒及检测方法。
9.为了实现上述目的,本发明采用如下的技术方案:一种病原微生物分型定量检测的引物探针组,包括细菌检测引物和检测探针,所述细菌检测引物包括21
‑
16s
‑
f3序列如seq id no.1所示、21
‑
16s
‑
r3序列如seq id no.2所
示;所述细菌检测探针包括21
‑
16s
‑
g probe3序列如seq id no.3所示及21
‑
16s
‑
g
‑
probe3序列如seq id no.4所示。
10.其中较优地,还包括真菌检测引物,所述真菌检测引物包括fungif序列如seq id no.5所示、fungir序列如seq id no.6所示及fungp序列如seq id no.7所示。
11.上述引物探针组在制备病原菌分型定量检测的试剂盒中的应用。
12.一种病原菌分型定量检测的试剂盒,包括上述的引物探针组。
13.其中较优地,所述试剂盒还包括用于生物样本预处理的benzonase核酸内切酶。
14.一种病原微生物样本dna的纯化方法,利用上述试剂盒进行;在检测之前先利用benzonase核酸内切酶对病原微生物样本进行预处理。
15.其中较优地,所述预处理包括如下步骤:(1)去除病原微生物样本中的游离核酸;(2)将步骤(1)处理后的病原微生物样本在benzonase核酸内切酶作用下进行消化,消化后即可进入后续检测程序。
16.其中较优地,步骤(1)利用离心法去除游离核酸。
17.其中较优地,benzonase核酸内切酶消化温度为30~40度,消化时间为10~40分钟。
18.本发明的有益效果如下:1. 本发明通过优化引物和探针序列可以同时对一份样本中的病原菌类型进行准确分型,判定为革兰染色阳性(g )、革兰染色阳性(g
‑
)及真菌,这对临床用药具有较好的指导作用。
19.2. 目前常用的分子生物学检测技术中,对于检测16s rrna/28s rrna 多基于qpcr技术,由于缺乏标准品,因此只能对感染病原菌进行定性检测。而本试剂盒定量无需外标,能够在分型鉴定的同时对样本中的菌体核酸进行绝对定量,动态监测病原菌核酸的变化,发挥监测抗菌治疗效果的作用。
20.3. 本试剂盒相比传统16s rrna/28s rrna qpcr试剂盒,在对活病原菌核酸检测之前,采用了核酸内切酶对样本中游离的微生物核酸进行了预处理,减少了易位而来的裸露病原菌核酸及环境中游离微生物核酸的干扰。进一步再提取到病原菌核酸大概率来自于活菌体,因此能更加准确的反映出样本中存在的具有感染性的活致病原。
21.4. 本试剂盒具有分子生物学技术的优点,相对于传统qpcr,具有更好的线性和检测下限。操作简便、低成本、报告速度快、结果准确(cv<20%)等优点。可用于早期感染的辅助诊断。
22.5. 相对于检测具有感染活性的病原菌的传统培养技术而言,本技术在检测同样病原菌的情况下,具有检测快速(全部检测时间4.5小时)的优点。
附图说明
23.图1a~图1e为5组细菌探针筛选结果图;图1f~图1g为2组真菌探针筛选结果图;图2a和图2b为不同引物和探针组合结果图,图2a为fam散点图,图2b为vic散点图;图2c和图2d为不同退火温度ddpcr结果图,图2c为fam散点图,图2d为vic散点图;
图2e为真菌引物和探针检测示意图;图3为qpcr(图3左图)和ddpcr定量(图3右图)比较结果图;图4a~图4d为使用本发明提供的引物探针组进行细菌分型实验g /g
‑
菌交差干扰测试图;图4a为fam散点图,从左至右分别为表皮葡萄球菌、屎肠球菌、粪肠球菌、金葡萄菌及阴性对照;图4b为vic散点图,从左至右分别为表皮葡萄球菌、屎肠球菌、粪肠球菌、金葡萄菌及阴性对照;图4c为fam散点图,从左至右分别为大肠埃希菌、铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯菌及阴性对照;图4d为vic散点图,从左至右分别为大肠埃希菌菌、铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯菌及阴性对照。
24.图5a~图5c为使用本发明提供的引物探针组进行细菌分型定量实验不同浓度g /g
‑
混合检测干扰测试图;图5a中29.7拷贝/反应为表皮葡萄球菌,137594.2拷贝/反应为鲍曼不动杆菌;图5b中178.4拷贝/反应为表皮葡萄球菌,1385.5拷贝/反应为鲍曼不动杆菌;图5c中16969.8拷贝/反应为表皮葡萄球菌,1276.6拷贝/反应为饱满不动杆菌;图6a~图6c为使用本发明提供的引物探针组进行g ,g
‑
及真菌检测线性结果图(图6a金黄色葡萄球菌、图6b大肠杆菌、图6c白色念珠菌);图7a为利用pma、dnaasei及benzonase预处理生物样本效果图;图7b为利用benzonase内切酶对游离核酸灭活时间及效果比较图;图8为不去游离dna与去游离dna的诊断sbp价值比较;图9为腹水细菌ddpcr定量预测sbp的roc曲线。
具体实施方式
25.下面通过具体实施例对本发明进行详细说明,需要理解的是,下述实施例作为解释和说明,不以任何形式限制本发明的范围。
26.生物材料:本发明实施例所用组织样本均来自首都医科大学附属北京佑安医院。
27.本发明实施例所用试剂耗材及设备来源如下述:试剂来源:1.benzonase nuclease,货号:e1014
‑
5ku, sigma;spin away filter货号:c1006,zymo;open top collection tube 货号:c1001,zymo;2
×ꢀ
dna/rna shield货号: r1200
‑
125,zymo;dna/rna lysis buffer货号:d7001
‑1‑
50,zymo;dna/rna prep buffer货号: d7010
‑2‑
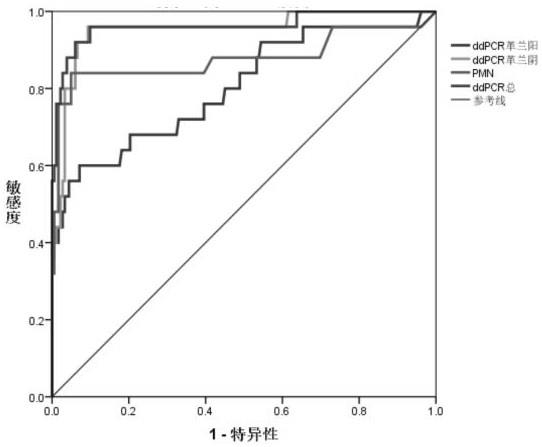
50,zymo;dna/rna wash buffer货号:d7010
‑3‑
24,zymo;2
×
probe dpcr supermix (with ung), 750μl/管 新羿生物;样本制备通用剂试剂盒(微流控生物芯片法),产品目录号:10001,新羿生物;微液滴检测通用试剂盒 产品目录号:10002,新羿生物。
28.2. 引物和探针设计后,交由上海生工合成。
29.设备来源:1.低温高速离心机:thermo heraeus fresco21
2.高速低温组织研磨仪:武汉赛斯维尔3.液滴制备仪:drop maker 新羿生物4.pcr扩增仪:longgene a300 fast thermal cycler5.芯片读取仪:chip reader新羿生物下述实施例中,未特别说明的生物化学试剂均为本领域常规试剂,可按照常规方法配制而得或商购获得,规格为实验室纯级即可;未特别说明的实验器材均为本领域常规实验器材,可商购获得。
30.实施例1引物探针组的设计本发明提供的引物探针组包括细菌检测引物和检测探针以及真菌检测引物,所述细菌检测引物包括seq id no.1所示的21
‑
16s
‑
f3、seq id no.2所示的21
‑
16s
‑
r3;所述细菌检测探针包括seq id no.3所示的21
‑
16s
‑
g probe3及seq id no.4所示的21
‑
16s
‑
g
‑
probe3。真菌检测引物包括seq id no.5所示的fungif、seq id no.6所示的fungir及seq id no.7所示的fungp。具体序列如下:细菌分型及定量引物和探针序列seq id no.121
‑
16s
‑
f3 :agcatgtggtttaattcgseq id no.221
‑
16s
‑
r3:gcgggacttaacccaaseq id no.321
‑
16s
‑
g probe3:tggtgcatggttgtcgtcseq id no.421
‑
16s
‑
g
‑ꢀ
probe3:ctgcatggctgtcgtcagc真菌分型及定量引物序列seq id no.5fungif:5
’‑
aataagcggaggaaaagaa
‑3’
seq id no.6fungir:5
’‑
ggaatttaccacccrcttrga
‑3’
seq id no.7fungp: 5
’‑
vic
‑
gcgagtgaagcggsaara
–
bhq1
‑3’
。
31.一、 引物和探针设计:1.1 首先结合临床感染中常见的g 、g
‑
菌种类,选取代表菌株的16srrna序列20条,选取代表性真菌的28srrna基因序列4条,采用bioedit软件进行比对,参考标准株列表见表1。
32.表1 参考标准株列表
1.2引物和探针设计参考常见细菌序列,分别设计g 、g
‑
细菌和真菌对应的引物和探针。利用bioedit软件,首先将g 和g
‑
代表菌株16s rrna的序列进行比对,查找两类菌的保守序列区和差异序列区。分别在两类菌的保守序列区设计通用引物,且在上下游通用引物之间尽可能涵盖一段差异序列区。在两类菌差异序列区,分别设计能检测g 和g
‑
病原菌的特异探针。类似原理,利用bioedit软件,在比对真菌18s rrna序列后,尽可能查找其保守区,并在该区段设计检测引物和探针对。引物和探针设计序列abi primer express3.0.1 软件进行设计。
33.研发过程中,共设计了细菌引物5组,真菌引物2组,如表2所示,经过筛选,从每组中选出结果较好的引物探针组进行数字pcr优化,如图1a~图1e:采用g
‑
菌验证5组细菌探针,从图中可以看出,第三组效果最佳,即图1c。采用真菌dna验证2组探针,见图1f~图1g,从图中可以看出,第二组分群较好,即图1g。
34.表2筛选引物序列列表二、引物和探针条件优化:2.1 按照表3,进行反应条件优化和筛选。
35.分别对引物探针浓度(终浓度):200/100;400/200;600/300;800/400nm进行优化。
分别对退火温度(54℃, 57℃, 60℃,63℃)进行优化。
36.表3引物探针浓度验证条件结果显示:细菌引物探针和真菌引物探针在上述实验浓度范围内及退火温度范围内均有较好表现。细菌引物探针在浓度400/200 nm,退火温度在60℃时,数字pcr分群效果最好,见图2a~图2d。真菌引物和探针浓度在400/200 nm,退火温度在60℃时,也能清晰进行分群,见图2e。
37.2.2 qpcr与ddpcr定量比较对提取好的细菌dna进行系列稀释,使用设计好的ddpcr引物谈针对,进行qpcr检测,反应条件同ddpcr,同条件下,进行ddpcr检测。结果显示,qpcr在第5个稀释度即10拷贝/ul时,已经与阴性对照无法区分。而ddpcr具有较好的区分度,证明ddpcr较qpcr具有更低的检测下限,见图3,表4。
38.表4 qpcr与ddpcr结果比较三、引物和探针性能确认3.1 引物和探针特异性验证分别对g 代表菌株表皮葡萄球菌、屎肠球菌、粪肠球菌、金葡球菌、阴性对照以及g
‑
代表菌大肠埃希菌、铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯菌及阴性对照进行检测,测试探针的特异性,结果显示探针在区分g /g
‑
两种菌时,能够清晰鉴别,分型效果良好,见图4a~图4d所示。利用不同浓度的g 菌和g
‑
菌和混合,进行检测,反应体系能够准确分型,并定量,见图5a~图5c所示。
39.3.2线性范围:分别对已知浓度的g 代表菌株金黄色葡球菌,g
‑
代表株菌大肠杆菌及真菌代表株白色念珠菌进行系列稀释,然后进行检测,测试检测方法的线性范围,结果显示,在检测范围内1~5lg(拷贝/ml),各检测体系具有良好的线性关系,见图6a~图6c所示。3.3 重复性分别对已知浓度的g 代表菌株金黄色葡球菌,g
‑
代表株菌大肠杆菌及真菌代表株
白色念珠菌进行系列稀释,然后进行检测,重复3
‑
6次,测试检测方法的重复性,结果显示,在检测范围内1~5lg(拷贝/ml),各检测体系具有良好的重复性能,cv<20%,见表5、表6和表7所示。
40.表5 g 代表菌株金黄色葡球菌重复性结果表6 g
‑
代表菌株大肠杆菌复性结果表7 真菌代表菌株白色念珠菌重复性结果四、标本预处理条件优化目前,病原菌核酸提取方案并不区分活的和死的细菌核酸,这在临床中会引入一定偏差,造成检测到核酸与临床真实感染之间不符合。因此,在定量前,去除死菌的核酸,理论上能够提高检测的敏感性,能够更加精准的反映临床的感染状态。为了解决这一问题,我们尝试采用模拟样品进行测试,在一定浓度活菌下(金黄色葡萄球菌,9.7x104/ml)掺入提取的游离细菌dna,(大肠杆菌,1x103/ml)。使用丙锭单叠氮(pma)、dnaasei内切酶及以benzonase分别来处理样品。理论上,pma穿透受损的细胞,嵌入它们的dna,然后暴露在紫外光下,染料形成共价键,阻止dna扩增,再后期提取活菌检测时,原来存在的游离核酸不影响活菌的定量结果。同时,我们也在提取活菌核酸前,分别使用内切酶dnaasei及以内切酶benzonase来分别预消化游离核酸。
41.结果显示pma并不十分有效。推断其主要理由是某些活细菌细胞的渗透率会因其生理状态而异,因此造成结果不准确。同时操作过程中需要把标本置于冰上同时紫外光照射,对实验条件要求较高,且不容易标准化,因此不适合临床检测的快速,简便需要。同时benzonase内切酶对游离核酸的效果要优于dnaasei,而对活菌的核酸没有影响,见图7a。我们对benzonase内切酶作用时间进行测试后,结果显示作用15分钟就能达到很好地效果,灭活30分钟时,效果最佳,见图7b所示。
42.五、样本中游离病原dna去除效果比较 为了检测去除游离病原菌dna对检测结果影响,我们对30例临床样本采用2种不同方法进行了检测,通过绘制roc曲线分析,结果显示,去除游离核酸后,g 菌以11.75拷贝/
反应,g
‑
菌以76拷贝/反应为cutoff值时,方法具有更好的敏感性和特异性,(g 菌敏感性为93.4%,特异性为85%;g
‑
菌敏感性为95.9%,特异性为89.8%),见图8及表8临床中真菌感染较少,未进行统计。
43.表8 曲线下方的区域曲线下方的区域实施例2 试剂盒的应用本发明提供的试剂盒的组成:(benzonase内切酶,内切酶缓冲液,2x核酸保护液,玻璃研磨珠,菌体裂解液,蛋白酶k(20ug/ul),超纯核酸收集柱,核酸结合液,洗涤液,核酸洗脱液,收集管,ddpcr预混液、引物探针混合液和depc水)。
44.本发明提供的试剂盒基本操作流程: 抽取样本后,送实验室待检。取1ml样本,高速离心,利用benzonase内切酶去除游离核酸后,机械破壁病原菌,核酸纯化后获得纯化的dna。对获取的dna分2管进行数字检测,一管用于分型定量g /g
‑
细菌,一管用于真菌定量检测。具体方法如下述,下述方法为发明人推荐较佳方法,本领域技术人员也可以根据本发明提供的试剂盒的组成采用其他本领域公知方法进行操作,也可以达到本发明所述技术效果,下述方法不作为对本发明的限定。
45.一、感染性病原菌核酸提取1.1取1ml样本,13000 rcf,4度离心10分钟,弃上清,留340ul。
46.1.2 加入40ul benzonase内切酶缓冲液,0.5ul benzonase,37度,孵育15分钟。
47.1.3 加入20ul 蛋白酶k,56度,孵育20分钟。
48.1.4 加入400ul 2
×
核酸保护液,用枪吹打混匀3次,加入玻璃研磨珠,放入振荡破碎仪中,4度,60hz运行120秒停止20秒,重复4次,震荡后,10000 rcf离心2分钟。
49.1.5在生物安全柜内,转移震荡后的400 ul离心后上清液到新1.5ep管内,加入400ul菌体裂解液,涡旋混匀5秒、2次。
50.1.6转移上一步800ul样本至超纯核酸收集柱中,10000 rcf 离心30秒;1.7更换新的收集管,弃掉旧收集管及废液。
51.1.8加入400 ul核酸结合液,10000 rcf 离心30秒;1.9更换新的收集管,弃掉旧收集管及废液。
52.2.0加入700 ul洗涤液,10000 rcf 离心30秒;2.1更换新的收集管,弃掉旧收集管及废液。
53.2.2加入 400 ul洗涤液,10000 rcf 离心至少2分钟,彻底去除洗脱液。
54.2.3取新1.5ml离心管,做好标记。转移对应的超纯核酸收集柱至离心管。
55.2.4柱子中加入50ul核酸洗脱液,室温3分钟;8000 rcf离心1分钟,溶液
‑
80℃保存。
56.二、数字pcr制备2.1充分融解预混液、模板、引物、探针和depc水,并将所有试剂在室温下平衡并彻底混匀。按下表进行配制(推荐按所需量110%进行配制):表9 体系配置表2.2参照仪器使用说明书进行操作,启动样本制备仪,进行自检。自检完成后,打开仪器上盖,先将8联排管(试剂盒提供)放入仪器相应位置,将微液滴生成芯片装入配套的生成芯片机械卡具中,压下卡具上盖固定芯片。
57.2.3在水孔中加入30μl待测样本,在油孔中加入180μl微液滴生成油,然后将芯片的水孔和油孔盖上微液滴生成芯片密封垫。将装有微液滴生成芯片的卡具放入仪器相应位置。然后压下把手固定,盖上仪器上盖。操作仪器运行,生成微液滴。
58.2.4微液滴生成完毕后,取出卡具,将含有微液滴的8联排管盖上8联排管盖(试剂盒提供),待用。
59.三、pcr扩增3.1将制备完成的8联排管置于pcr仪中,确保管帽盖严密,平整。按照如下程序,进行扩增。
60.表10 反应程序四、微液滴检测4.1参照仪器使用说明书进行操作,启动生物芯片分析仪,进行自检。自检完成后,打开仪器上盖,先将装有已反应完成的微液滴的8联排管和微液滴检测芯片分别放在检测芯片机械卡具的相应位置,压下卡具上盖固定芯片。
61.4.2在油孔1和2中分别加入430μl和500μl微液滴检测油,盖上微液滴检测芯片密封垫,然后将带有微液滴检测芯片的卡具放入生物芯片分析仪中。进行相应仪器设置及微
液滴检测。
62.五、结果分析5.1检测同时,结果可由targetingone ddpcr analyzer软件对批量的数字pcr实验数据进行观察分析和整理。
63.一般情况下,实验完成,软件会对数据进行自动判读和分析,结束给出图形和定量结果。对于特殊图形,可利用编辑工具进行调整,可查看一维图、二维图、直方图、统计结果等信息。
64.5.2 判读标准:每张芯片可以完成8个样品,包含一例随行阴性对照,与每张随行阴性对照的结果比较,以阴性对照的图形为标准,划定阈值线,高于阈值线的云点,计算为阳性。
65.实施例3 试剂盒临床试验利用本发明提供的试剂盒,我们对2020年8月1日到12月31日之间留取的214例样本进行了检测。
66.样本来源:样本来自佑安医院肝病中心一科、二科、三科及消化中心。在留取样本进行常规指标检测后,同时留取剩余样品进行ddpcr检测。
67.1.sbp的诊断标准:自发性细菌性腹膜炎
‑
症状之一:
①
、急性腹膜炎:腹痛腹部压痛或反跳痛,腹肌张力增大,呕吐腹泻或肠梗阻。
②
、全身炎症反应综合征的表现:发热或体温不升、寒战、心动过速、呼吸急促。
③
、无明显诱因肝功能恶化。
④
、肝性脑病。
⑤
、休克。
⑥
、顽固性腹水或利尿剂突发无反应或肾功能衰竭。
⑦
、急性胃肠道出血实验室检查之一:
①
、pmn≥0.25x109/l。
②
、腹水细菌培养阳性。
③
、降钙素原pct>0.5ng/ml,排除其他部位的感染。
68.细菌性腹水
‑①
、腹水细菌培养阳性。
②
、pmn<0.25x109/l。
③
、无明显腹腔内感染。
69.单纯性腹水
‑
腹水细菌培养阴性。pmn<0.25x109/l。无明显症状。
70.2、腹水细菌ddpcr预测sbp的发生:结果显示采用本方法对于sbp的诊断敏感性,要优于国内外标准,g 菌的曲线下面积为0.803;g
‑
菌的曲线下面积为0.953,两种方法综合的曲线下面积为0.963,高于传统标准pmn的0.878.见图9及表11,因为真菌较少,未做统计。
71.表11 腹水细菌ddpcr定量预测sbp的roc曲线
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。