1.本发明涉及一种新的大环内酰胺类衍生物、其制备方法及含有该衍生物的药物组合物以及其作为治疗剂特别是作为trk抑制剂的用途。
背景技术:
2.蛋白激酶(protein kinases,pks)是催化蛋白质的酪氨酸、丝氨酸和苏氨酸残基上的羟基磷酸化的酶,在信号传导过程中具有非常重要的作用,酪氨酸磷酸化机理普遍存在于信号传导过程中,调控着诸如有丝分裂、细胞周期进程和分化等多种细胞功能。当蛋白酪氨酸激酶在变异、失控的情况下表达,或在不正常的高水平下表达时,可以将正常细胞转变为肿瘤显型。此外,异常pk活性与宿主疾病相关,从诸如银屑病这类相对无生命危险的疾病到诸如成胶质细胞瘤(脑癌)这类极端致命的疾病。pks可以便利地被分解成两类,蛋白酪氨酸激酶(ptks)和丝氨酸苏氨酸激酶(stks)。
3.原肌凝蛋白相关受体酪氨酸激酶(trk)是神经营养蛋白(nt)(蛋白质的神经营养因子 (ngf)家族)的高亲和力受体。神经营养因子受体酪氨酸激酶基因ntrk1、ntrk2和 ntrk3分别编码trka、trkb和trkc蛋白,它们都是酪氨酸激酶,统称为trk家族蛋白。所有的trk蛋白都有着类似的细胞外域结构,但各自有不同的配体:ngf与trka 结合,脑源性神经营养因子(bdnf)和神经营养因子4(nt-4)与trkb结合,神经营养因子3(nt-3)与trkc结合。
4.基因表达研究表明,trk家族的成员在神经元组织中广泛表达且与神经元细胞的维持、信号传导和存活有关。ntrk基因主要在神经系统中表达,它在胚胎发育过程和成体中都有表达。当受到信号诱导而活化时,trk可以自身磷酸化,并激活下游的信号途径实现各种生理功能。trk的下游信号分子包括shc、frs2,plcγ、mapk,pi3k和pkc等,这些信号分子大多与细胞能量交换、生存和增殖等功能密切相关。如果trk功能失调,细胞的生理功能可能会失控,甚至变成癌细胞。trk蛋白的过量表达、激活、扩增、突变和trk基因融合等与许多癌症相关,trk基因融合指的是由于染色体变异,导致ntrk 基因家族成员(ntrk1、ntrk2、ntrk3)与另一个不相关的基因融合在一起。trk融合蛋白将处于持续活跃状态,引发永久性的信号级联反应,驱动trk融合肿瘤的扩散和生长。其中所述的癌症包括成神经细胞瘤、卵巢癌、乳腺癌、前列腺癌、胃癌、消化道肿瘤、肝癌、胆管癌、胰腺癌、多发性骨髓瘤、星星细胞瘤、成神经管细胞瘤、神经胶质瘤、黑色素瘤、甲状腺癌、肺癌、大细胞神经内分泌瘤、结直肠癌、乳腺类似物分泌癌(masc)、肉瘤、头颈部肿瘤和肾癌等。
5.trk抑制剂在疼痛的临床前模型中有效,特别是拮抗性ngf和trka抗体(rn-624) 在炎性和神经性疼痛动物模型和人类临床试验中有效;另外bdnf/trkb通路激活可用作各种各类型的疼痛调节剂,该疼痛包括炎性疼痛、神经性疼痛和手术疼痛。因trka和 rkb激酶可用作ngf驱动的生物反应的介质,所以trka和/或其他trk激酶抑制剂可作为慢性疼痛提供有效的治疗方式。trk抑制剂可有效治疗炎性疼痛,包括但不限于哮喘、间质性膀胱炎,溃疡性结肠炎和克隆恩病在内的炎性肠病、湿疹、牛皮癣等;trka受体对于克氏锥虫在人类宿主中的寄生虫感染中的疾病过程非常重要,因此trka抑制剂可以用于治疗查加斯氏病和有
关的原虫感染。trk/神经营养因子通路,同时是bdnf/trkb也涉及到神经变性疾病的病因,该疾病包括多发性硬化症、帕金森病和阿尔茨海默。trk抑制剂也可以用于治疗与骨重建调节失衡有关的疾病,例如骨质疏松症、类风湿性关节炎和骨转移。
6.退行发育淋巴瘤(alk)是受体酪氨酸激酶胰岛素受体超家族的成员,其与造血系统和非造血系统肿瘤的肿瘤发生有密切的关系。alk基因位于2号染色体上并且主要在神经元细胞中表达,尤其是在发育过程中。alk基因参与在间变性大细胞淋巴瘤(alcl)的大的子集中的5号染色体上核仁磷酸蛋白(npm)基因的平衡性染色体易位。在alk alcl中,作为易位的结果,npm遍在性启动子驱动融合蛋白的异位表达,其中npm部分二聚化以及alk激酶结构域经历自身磷酸化并且变成组成型活性。目前已经报道在神经母细胞瘤和胶质母细胞瘤中全长alk受体蛋白的表达异常;且alk融合蛋白已出现于退行发育大细胞淋巴瘤中。对alk融合蛋白的研究已经提升了alk-阳性恶性疾病患者的新治疗方法的可能性。ros1属于胰岛素受体超家族,类似于其它酪氨酸激酶受体分子,ros1在将生长信号从细胞的外部环境转递进入细胞核中起作用。ros1的基因变化例如基因重排、突变或者拷贝数增加产生可以导致癌症的致癌基因。发现ros1在nsclc患者中处于融合蛋白的形式(ros1的6种不同的配偶体)并且存在于大约2%的患有nsclc的患者中 (bergethon等人,2012;davies等人,2012)。在各种其它癌症中已经检测到两种其它ros1 基因重排,所述癌症包括多形性胶质母细胞瘤、胆管癌、卵巢癌、胃腺癌、结肠直肠癌、炎症性肌纤维母细胞瘤、血管肉瘤和上皮样血管内皮瘤。ros1基因重排产生具有组成型活性激酶结构域的融合蛋白,所述激酶结构域激活细胞中导致致癌特性的下游信号传导途径,所述致癌特性包括不受控制的增殖以及用延长肿瘤细胞存活抵抗细胞死亡。
7.2018年11月,美国fda批准辉瑞的alk/trk/ros1抑制剂larotrectinib上市,其为一款口服新药,用于治疗既往接受过至少一种alk抑制剂的转移性alk 非小细胞肺癌患者,同时也治疗带有trk异常变异的患者。先前的研究表明,编码trk的ntrk基因会与其他基因发生异常融合,导致癌症在身体多个部位生长,larotrectinib能选择性地对trk 进行抑制。同时还有其他在研的trk激酶抑制剂,包括loxo-195(loxo oncology inc, phase 2)和repotrectinib(tp therapeutics inc,phase 2)。目前已经公开了一系列的trk抑制剂专利申请,其中包括wo2015089139a1、wo2006082392a1和wo2007123269a1等, trk剂的研究和应用已取得一定的进展,但是提高的空间仍然巨大,仍有必要继续研究和开发新的trk抑制剂。
技术实现要素:
8.本发明针对上述的技术问题,提供了一种通式(i)所示的大环内酰胺类化合物或其立体异构体、互变异构体或其可药用的盐:
[0009][0010]
其中:
[0011]
环a选自4~18元含n杂环基或双环稠合环,其中所述的杂环基内任选含有一个或多个o或s(o)
r
;
[0012]
环b选自芳基或杂芳基;
[0013]
环c选自芳基或杂芳基;
[0014]
条件是,当环b和环c中一个环选自单环芳基或单环杂芳基时,另一个环选自双环芳基或双环杂芳基,且环b和环c中至少一个为含n的杂芳基;
[0015]
l1选自-(cr
a
r
b
)
m-,其中任意的一个-(cr
a
r
b
)-任选进一步被-n(r
c
)-,-o-或-s(o)r-所替代;l1优选为-(ch2)-或-(ch2)
2-;
[0016]
l2选自-(cr
d
r
e
)
n-,其中任意的一个-(cr
d
r
e
)-任选进一步被-n(r
f
)-、-o-或-s(o)r-所替代;
[0017]
l3选自化学键或-n(r
c
)-;
[0018]
每个r
a
、r
b
、r
d
和r
e
相同或不同,各自独立地选自氢原子、氘、卤素、羟基、烷氧基、烷基、烯基、炔基、环烷基、杂环基、芳基、杂芳基或-nr6r7,其中所述的烷基、烯基、炔基、环烷基、杂环基、芳基或杂芳基任选进一步被一个或多个选自羟基、卤素、硝基、氰基、烷氧基、环烷基、杂环基、芳基、杂芳基、-c(o)r5、-c(o)or5、-oc(o)r5、-nr6r7、
ꢀ-
c(o)nr6r7、-so2nr6r7或nr6c(o)r7的取代基所取代;
[0019]
或者,r
a
和r
b
与它们相连的-同一碳原子一起形成c
3-c8环烷基或3~8元杂环基,其中3~8元杂环基内含有一个或多个n、o或s(o)
r
,并且所述的c
3-c8环烷基或3~8元杂环基任选进一步被一个或多个选自羟基、卤素、硝基、氰基、烷基、烷氧基、环烷基、杂环基、芳基、杂芳基、=o、-c(o)r5、-c(o)or5、-oc(o)r5、-nr6r7、-c(o)nr6r7、-so2nr6r7或nr6c(o)r7的取代基所取代;
[0020]
或者,任意两个r
a
与它们分别相连的不同的碳原子一起形成c
3-c8环烷基或3~8元杂环基,其中3~8元杂环基内含有一个或多个n、o或s(o)
r
,并且所述的c
3-c8环烷基或3~8元杂环基任选进一步被一个或多个选自羟基、卤素、硝基、氰基、烷基、烷氧基、环烷基、杂环基、芳基、杂芳基、=o、-c(o)r5、-c(o)or5、-oc(o)r5、-nr6r7、-c(o)nr6r7、-so2nr6r7或nr6c(o)r7的取代基所取代;
[0021]
或者,r
d
和r
e
与它们相连的同一碳原子一起形成c
3-c8环烷基或3~8元杂环基,其中3~ 8元杂环基内含有一个或多个n、o或s(o)
r
,并且所述的c
3-c8环烷基或3~8元杂环基
任选进一步被一个或多个选自羟基、卤素、硝基、氰基、烷基、烷氧基、环烷基、杂环基、芳基、杂芳基、=o、-c(o)r5、-c(o)or5、-oc(o)r5、-nr6r7、-c(o)nr6r7、-so2nr6r7或nr6c(o)r7的取代基所取代;
[0022]
或者,任意两个r
d
与它们分别相连的不同的碳原子一起形成c
3-c8环烷基或3~8元杂环基,其中3~8元杂环基内含有一个或多个n、o或s(o)
r
,并且所述的c
3-c8环烷基或3~8元杂环基任选进一步被一个或多个选自羟基、卤素、硝基、氰基、烷基、烷氧基、环烷基、杂环基、芳基、杂芳基、=o、-c(o)r5、-c(o)or5、-oc(o)r5、-nr6r7、-c(o)nr6r7、-so2nr6r7或nr6c(o)r7的取代基所取代;
[0023]
每个r
c
和r
f
相同或不同,各自独立地选自氢原子、烷基或环烷基,其中所述的烷基或环烷基任选进一步被一个或多个选自卤素、羟基、烷氧基或环烷基的取代基所取代;r
c
和r
f
优选为氢原子;
[0024]
或者,当l1选自-(cr
a
r
b
)
m-,其中任意的一个-(cr
a
r
b
)-进一步被-n(r
c
)-替代时,r
a
或r
b
与r
c
与它们分别相连的碳原子和氮原子一起形成3~8元杂环基,其中3~8元杂环基内含有一个或多个n、o或s(o)
r
,并且所述的3~8元杂环基任选进一步被一个或多个选自羟基、卤素、硝基、氰基、烷基、烷氧基、环烷基、杂环基、芳基、杂芳基、=o、-c(o)r5、-c(o)or5、
ꢀ-
oc(o)r5、-nr6r7、-c(o)nr6r7、-so2nr6r7或nr6c(o)r7的取代基所取代;
[0025]
或者,当l2选自-(cr
d
r
e
)
n-,其中任意的一个-(cr
d
r
e
)-进一步被-n(r
f
)-替代时,r
d
或r
e
与r
f
与它们分别相连的碳原子和氮原子一起形成3~8元杂环基,其中3~8元杂环基内含有一个或多个n、o或s(o)
r
,并且所述的3~8元杂环基任选进一步被一个或多个选自羟基、卤素、硝基、氰基、烷基、烷氧基、环烷基、杂环基、芳基、杂芳基、=o、-c(o)r5、-c(o)or5、
ꢀ-
oc(o)r5、-nr6r7、-c(o)nr6r7、-so2nr6r7或nr6c(o)r7的取代基所取代;
[0026]
每个r1、r2和r3相同或不同,各自独立地选自氢原子、羟基、卤素、硝基、氰基、烷基、烷氧基、环烷基、杂环基、芳基、杂芳基、-c(o)r5、-c(o)or5、-oc(o)r5、-nr6r7、
ꢀ-
c(o)nr6r7、-so2nr6r7或nr6c(o)r7,其中所述的烷基、烷氧基、环烷基、杂环基、芳基或杂芳基任选进一步被一个或多个选自羟基、卤素、硝基、氰基、烷氧基、环烷基、杂环基、芳基、杂芳基、=o、-c(o)r5、-c(o)or5、-oc(o)r5、-nr6r7、-c(o)nr6r7、-so2nr6r7或nr6c(o)r7的取代基所取代;优选地,r1、r2和r3各自独立地选自氢原子、卤素、氰基、烷基或烷氧基,更优选地,r1、r2和r3各自独立地选自氢原子、氰基、f、cl、br、甲基、羟甲基、卤代甲基或甲氧基甲基;
[0027]
r4选自氢原子、烷基或环烷基,其中所述的烷基或环烷基任选进一步被一个或多个选自卤素、羟基、烷氧基或环烷基的取代基所取代;r4优选为氢原子;
[0028]
r5、r6和r7各自独立地选自氢原子、羟基、卤素、烷基、烷氧基、环烷基、杂环基、芳基或杂芳基,其中所述的烷基、烷氧基、环烷基、杂环基、芳基或杂芳基任选进一步被一个或多个选自羟基、卤素、硝基、氰基、烷基、烷氧基、环烷基、杂环基、芳基、杂芳基、=o、-c(o)r8、-c(o)or8、-oc(o)r8、-nr9r
10
、-c(o)nr9r
10
、-so2nr9r
10
或-nr9c(o)r
10
的取代基所取代;
[0029]
或者,r6和r7与它们相连接的原子一起形成一个4~8元杂环基,其中4~8元杂环基内含有一个或多个n、o或s(o)
r
,并且所述的4~8元杂环基任选进一步被一个或多个选自羟基、卤素、硝基、氰基、烷基、烷氧基、环烷基、杂环基、芳基、杂芳基、=o、-c(o)r8、
ꢀ-
c(o)or8、-oc(o)r8、-nr9r
10
、-c(o)nr9r
10
、-so2nr9r
10
或-nr9c(o)r
10
的取代基所取代;
[0030]
r8、r9和r
10
各自独立地选自氢原子、烷基、环烷基、杂环基、芳基或杂芳基,其中所
述的烷基、环烷基、杂环基、芳基或杂芳基任选进一步被一个或多个选自羟基、卤素、硝基、氰基、烷基、烷氧基、环烷基、杂环基、芳基、杂芳基、羧基或羧酸酯基的取代基所取代;
[0031]
m和n相同或不同,各自独立地选自1,2,3或4;
[0032]
p、q和s相同或不同,各自独立地选自0,1,2,3,4或5;且
[0033]
r选自0,1或2。
[0034]
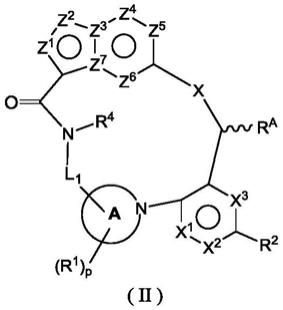
在本发明的优选方案中,通式(i)所述的化合物或其立体异构体、互变异构体或其可药用的盐,其为通式(ii)所述的化合物或其立体异构体、互变异构体或其可药用的盐,
[0035][0036]
其中:
[0037]
x选自-n(r
c
)-、-o-或-s(o)
r-;优选为nh;
[0038]
z1、z2、z4~z6相同或不同,各自独立地选自n、nh、c(=o)或c(r3);
[0039]
z3和z7相同或不同,各自独立地选自n或c;
[0040]
x1~x3相同或不同,各自独立地选自键、n、nh、c(=o)或c(r2);x1~x3中最多一个选自键;
[0041]
r
a
选自氢原子或烷基,其中所述的烷基任选进一步被一个或多个选自卤素、羟基、烷氧基或环烷基的取代基所取代;r
a
优选为甲基;
[0042]
r
c
选自氢原子、烷基或环烷基,其中所述的烷基或环烷基任选进一步被一个或多个选自卤素、羟基、烷氧基或环烷基的取代基所取代;r
c
优选为氢原子;
[0043]
或者,当x选自-n(r
c
)-时,r
a
和r
c
与它们分别相连的碳原子和氮原子一起形成4~8元杂环基,其中4~8元杂环基内含有一个或多个n、o或s(o)
r
,并且所述的4~8元杂环基任选进一步被一个或多个选自羟基、卤素、硝基、氰基、烷基、烷氧基、环烷基、杂环基、芳基、杂芳基、=o、-c(o)r5、-c(o)or5、-oc(o)r5、-nr6r7、-c(o)nr6r7、-so2nr6r7或nr6c(o)r7的取代基所取代;且
[0044]
r1~r7、l1、p和r的定义如通式(i)中所述。
[0045]
在本发明的优选方案中,通式(ii)所述的化合物或其立体异构体、互变异构体或其可药用的盐,其为通式(iii)所述的化合物或其立体异构体、互变异构体或其可药用的盐,
[0046][0047]
其中:r1、r2、r4、z1~z7、x1~x3、r
a
、x、l1和p的定义如通式(ii)中所述。
[0048]
在本发明的优选方案中,通式(ii)所述的化合物或其立体异构体、互变异构体或其可药用的盐,其为通式(iv)、(v)或(vi)所述的化合物或其立体异构体、互变异构体或其可药用的盐,
[0049][0050]
其中:r1、r2、r4、r
c
、x1~x3、r
a
、l1和p的定义如通式(ii)中所述。
[0051]
在本发明的优选方案中,通式(iv)、(v)或(vi)所述的化合物或其立体异构体、互变异构体或其可药用的盐,其中:
[0052]
r1和r2各自独立地选自氢原子、氰基、f、cl、br、甲基、羟甲基、卤代甲基或甲氧基甲基;
[0053]
r4选自氢原子或c
1-c4烷基;
[0054]
r
c
为氢原子;
[0055]
x1~x3为ch;
[0056]
r
a
选自c
1-c4烷基,优选为甲基;
[0057]
l1选自-(ch2)-或-(ch2)
2-;且
[0058]
p为0。
[0059]
在本发明的优选方案中,通式(i)、(ii)、(iii)、(iv)、(v)或(vi)所述的化合物或其立体异构体、互变异构体或其可药用的盐,其中环a选自单环杂环基;优选为4~6元单环杂环基;更优选为以下基团:
[0060]
[0061]
在本发明的优选方案中,通式(i)、(ii)、(iii)、(iv)、(v)或(vi)所述的化合物或其立体异构体、互变异构体或其可药用的盐,其中环a选自双环稠杂环基、双环桥环杂环基或双环螺环杂环基,更优选为基团:
[0062][0063]
在本发明的优选方案中,通式(i)、(ii)、(iii)、(iv)、(v)或(vi)所述的化合物或其立体异构体、互变异构体或其可药用的盐,其中环a选自8~10元双环稠合环,优选选自
[0064][0065]
通式(i)化合物的典型化合物包括,但不限于:
[0066]
[0067][0068]
或其立体异构体、互变异构体或其可药用的盐。
[0069]
进一步,本发明提供通式(ii)所述化合物或其立体异构体、互变异构体或其可药用的盐的制备方法,所述方法包括:
[0070][0071]
通式(iia)化合物在碱性条件下缩合反应,得到通式(ii)化合物;
[0072]
其中:环a、r1~r2、r4、r
a
、z1~z7、x1~x3、x、l1和p的定义如通式(ii)中所述。
[0073]
进一步,本发明提供通式(iia)所述的化合物或其立体异构体、互变异构体或其可药用的盐,
[0074][0075]
其中:环a、r1~r2、r4、r
a
、z1~z7、x1~x3、x、l1和p的定义如通式(ii)中所述。
[0076]
通式(iia)化合物的典型化合物包括,但不限于:
[0077]
[0078][0079]
或其立体异构体、互变异构体或其可药用的盐。
[0080]
更进一步,本发明提供了一种药物组合物,所述的药物组合物含有有效剂量的通式(i)、 (ii)、(iii)、(iv)、(v)或(vi)所述的化合物或其立体异构体、互变异构体或其可药用的盐,及可药用的载体、赋形剂或它们的组合。
[0081]
本发明还提供了一种抑制trk的方法,其中包括将所述的alk、trk和/或ros1受体与通式(i)、(ii)、(iii)、(iv)、(v)或(vi)所述的化合物或其立体异构体、互变异构体或其可药用的盐,或其药物组合物相接触,优选为trk受体。
[0082]
本发明还提供了一种通式(i)、(ii)、(iii)、(iv)、(v)或(vi)所述的化合物或其立体异构体、互变异构体或其可药用的盐,或其药物组合物在制备治疗由alk、trk和/或ros1 介导的疾病的药物中的用途,优选为在制备治疗trk介导的疾病的药物中的用途,其中所述的由alk、trk和/或ros1介导的疾病优选为疼痛、癌症、炎症、神经退行性疾病或锥虫感染,其中所述的癌症优选为神经细胞瘤、卵巢癌、乳腺癌、前列腺癌、胃癌、消化道肿瘤、肝癌、胆管癌、胰腺癌、多发性骨髓瘤、星星细胞瘤、成神经管细胞瘤、神经胶质瘤、黑色素瘤、甲状腺癌、肺癌、大细胞神经内分泌瘤、结直肠癌、乳腺类似物分泌癌、肉瘤、头颈部肿瘤和肾癌。
[0083]
本发明还提供了一种通式(i)、(ii)、(iii)、(iv)、(v)或(vi)所述的化合物或其立体异构体、互变异构体或其可药用的盐,或其药物组合物在制备alk、trk和/或ros1抑制剂中的用途,优选为在制备trk抑制剂中的用途。
[0084]
本发明还提供了一种通式(i)、(ii)、(iii)、(iv)、(v)或(vi)所述的化合物或其立体异构体、互变异构体或其可药用的盐,或其药物组合物在制备治疗疼痛、癌症、炎症、神经退行性疾病或锥虫感染的药物中的用途,其中所述的癌症优选为神经细胞瘤、卵巢癌、乳腺癌、前列腺癌、胃癌、消化道肿瘤、肝癌、胆管癌、胰腺癌、多发性骨髓瘤、星星细胞瘤、成神经管细胞瘤、神经胶质瘤、黑色素瘤、甲状腺癌、肺癌、大细胞神经内分泌瘤、结直肠癌、乳腺类似物分泌癌、肉瘤、头颈部肿瘤和肾癌。
[0085]
本发明的药物制剂可以经局部、口服、经皮、经直肠、经阴道、非经肠、鼻内、肺内、眼内、静脉内、肌肉内、动脉内、鞘内、囊内、皮内、腹膜内、皮下、角质层下或者通过吸入进行给药。含活性成分的药物组合物可以是适用于口服的形式,例如片剂、糖锭剂、锭剂、水或油混悬液、可分散粉末或颗粒、乳液、硬或软胶囊,或糖浆剂或酏剂。片剂含有活性成分和用于混合的适宜制备片剂的无毒的可药用的赋形剂。
[0086]
本发明的制剂适合以单位计量的形式存在,并且所述制剂可借由在制药技术中所众所周知的任何方法进行制备。能够通过与载体物质进行组合,从而产生单一剂型的活性
成分的量可以依据所治疗的宿主及特定给药模式而变化。能够通过与载体物质进行组合从而产生单一剂型的活性成分的量通常指的是能够产生治疗效果的化合物的量。
[0087]
用于本发明化合物的局部或者透皮给药的剂型可包括粉末、喷雾剂、软膏剂、糊剂、乳膏剂、洗剂、凝胶剂、溶液、贴片及吸入剂。活性化合物可在无菌条件下与药学上可接受的载剂进行混合,并且其可与可能需要的任何防腐剂、缓冲剂或者推进剂进行混合。
[0088]
当本发明的化合物以药物的形式对人类及动物进行给药时,所述化合物可进行单独提供或者以药物组合物的形式提供,所述药物组合物含有与药学上可接受的载剂进行组合的活性成分,例如0.1%至99.5%(更优选地,0.5%至90%)的活性成分。
[0089]
药学上可接受的载剂的实例包括但不限于:(1)糖,例如乳糖、葡萄糖及蔗糖;(2)淀粉,例如玉米淀粉及马铃薯淀粉;(3)纤维素及其衍生物,例如羧甲基纤维素钠、乙基纤维素及乙酸纤维素;(4)粉末状黄蓍胶;(5)麦芽;(6)明胶;(7)滑石;(8)赋形剂,例如可可脂及栓剂蜡;(9)油,例如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油及大豆油;(10)二醇,例如丙二醇;(11)多元醇,例如甘油、山梨糖醇、甘露糖醇及聚乙二醇;(12)酯,例如油酸乙酯及月桂酸乙酯;(13)琼脂;(14)缓冲剂,例如氢氧化镁及氢氧化铝;(15)海藻酸; (16)无热原水;(17)等渗盐水;(18)林格氏溶液(ringer's solution);(19)乙醇;(20)磷酸盐缓冲溶液;(21)环糊精,例如连接于纳米粒子的靶向配体,例如accurinstm;及(22)用于药物制剂中的其它无毒兼容物质,例如聚合物基组合物。
[0090]
药学上可接受的抗氧化剂的实例包括但不限于:(1)水溶性抗氧化剂,例如抗坏血酸、半胱胺酸盐酸盐、硫酸氢钠、偏亚硫酸氢钠、亚硫酸钠及其类似物;(2)油溶性抗氧化剂,例如抗坏血酸棕榈酸酯、丁基化羟基苯甲醚(bha)、丁基化羟基甲苯(bht)、卵磷脂、五倍子酸丙酯、α-生育酚及其类似物;及(3)金属螯合剂,例如柠檬酸、乙二胺四乙酸(edta)、山梨糖醇、酒石酸、磷酸及其类似物。固体剂型(例如胶囊、锭剂丸剂、糖衣锭、粉末、颗粒剂及其类似物)可包括一种或者多种药学上可接受的载剂,例如柠檬酸钠或者磷酸二钙,和/或以下任意其中之一:(1)填充剂或增量剂,例如淀粉、乳糖、蔗糖、葡萄糖、甘露糖醇及/或者硅酸;(2)黏合剂,例如羧甲基纤维素、海藻酸盐、明胶、聚乙烯吡咯啶酮、蔗糖和/或阿拉伯胶;(3)保湿剂,例如甘油;(4)崩解剂,例如琼脂、碳酸钙、马铃薯或木薯淀粉、海藻酸、某些硅酸盐及碳酸钠;(5)溶解阻滞剂,例如石蜡;(6)吸收加速剂,例如四级铵化合物;(7)湿润剂,例如十六醇及甘油单硬脂酸酯;(8)吸收剂,例如高岭土及膨润土;(9) 润滑剂,例如滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、月桂基硫酸钠及其混合物;和 (10)着色剂。液体剂型可包括药学上可接受的乳液、微乳液、溶液、悬浮液、糖浆及酏剂。除活性成分之外,液体剂型可含有通常用于本技术领域中的惰性稀释剂,例如水或其它溶剂;增溶剂及乳化剂,例如乙醇、异丙醇、碳酸乙酯、乙酸乙脂、苯甲醇、苯甲酸苯甲酯、丙二醇、1,3-丁二醇、油(特别是棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油、及芝麻油)、甘油、四氢呋喃甲醇、聚乙二醇以及脱水山梨醇的脂肪酸酯、及其混合物。
[0091]
除活性化合物之外,悬浮液也可含有悬浮剂,例如乙氧基化异硬脂醇、聚氧化乙烯山梨糖醇及脱水山梨醇酯、微晶纤维素、氢氧化铝氧化物、膨润土、琼脂及黄蓍胶及其混合物。
[0092]
除活性化合物之外,软膏剂、糊剂、乳膏剂以及凝胶剂也可含有赋形剂,例如动物脂肪及植物脂肪、油、蜡、石蜡、淀粉、黄蓍胶、纤维素衍生物、聚乙二醇、聚硅氧、膨润土、硅
酸、滑石及氧化锌或者其混合物。
[0093]
除活性化合物之外,粉末及喷雾剂也可以含有赋形剂,例如乳糖、滑石、硅酸、氢氧化铝、硅酸钙及聚酰胺粉末或者上述这些物质的混合物。所述喷雾剂可以含有其它的常用推进剂,例如氯氟烃、以及挥发性的未被取代的烃,例如丁烷及丙烷。
[0094]
发明的详细说明
[0095]
除非有相反陈述,否则本发明在说明书和权利要求书中所使用的部分术语定义如下:
[0096]“化学键”指纯净物分子内或晶体内相邻两个或多个原子(或离子)间强烈的相互作用力的统称。使离子相结合或原子相结合的作用力通称为化学键。化学键主要有三种基本类型,即离子键、共价键和金属键。
[0097]“烷基”当作一基团或一基团的一部分时是指包括c
1-c
20
直链或者带有支链的脂肪烃基团。优选为c
1-c
10
烷基,更优选为c
1-c6烷基。烷基基团的实施例包括但不限于甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、仲丁基、正戊基、1,1-二甲基丙基、 1,2-二甲基丙基、2,2-二甲基丙基、1-乙基丙基、2-甲基丁基、3-甲基丁基、正己基、1-乙基-2-甲基丙基、1,1,2-三甲基丙基、1,1-二甲基丁基、1,2-二甲基丁基、2,2-二甲基丁基、1,3
-ꢀ
二甲基丁基、2-乙基丁基、2-甲基戊基、3-甲基戊基、4-甲基戊基、2,3-二甲基丁基等。烷基可以是取代或未取代的。
[0098]“烯基”指由至少两个碳原子和至少一个碳-碳双键组成的如上定义的烷基,代表性实例包括但不限于乙烯基、1-丙烯基、2-丙烯基、1-,2-或3-丁烯基等。烯基可以是任选取代的或未取代的。
[0099]“炔基”是指含有一个碳碳三键的脂肪烃基团,可为直链也可以带有支链。优先选择的是c
2-c
10
的炔基,更优选c
2-c6炔基,最优选c
2-c4炔基。炔基基团的实施例包括,但不限于乙炔基、1-丙炔基、2-丙炔基、1-、2-或3-丁炔基等。炔基可以是取代或未取代的。
[0100]“环烷基”是指饱和或部分饱和的单环、稠环、桥环和螺环的碳环。优选为c
3-c
12
环烷基,更优选为c
3-c8环烷基,最优选为c
3-c6环烷基。单环环烷基的实施例包括但不限于环丙基、环丁基、环戊基、环戊烯基、环己基、环己烯基、环己二烯基、环庚基、环庚三烯基、环辛基等,优选环丙基、环己烯基。环烷基可以是任选取代的或未取代的。
[0101]“螺环烷基”指5至18元,两个或两个以上环状结构,且单环之间彼此共用一个碳原子(称螺原子)的多环基团,环内含有1个或多个双键,但没有一个环具有完全共轭的π电子的芳香系统。优选为6至14元,更优选为7至10元。根据环与环之间共用螺原子的数目将螺环烷基分为单螺、双螺或多螺环烷基,优选为单螺和双螺环烷基,优选为4元/5 元、4元/6元、5元/5元或5元/6元。“螺环烷基”的非限制性实施例包括但不限于:螺[4.5] 癸基、螺[4.4]壬基、螺[3.5]壬基、螺[2.4]庚基。
[0102]“稠环烷基”指5至18元,含有两个或两个以上环状结构彼此公用一对碳原子的全碳多环基团,一个或多个环可以含有一个或多个双键,但没有一个环具有完全共轭的π电子的芳香系统,优选为6至12元,更优选为7至10元。根据组成环的数目可以分为双环、三环、四环或多环稠环烷基,优选为双环或三环,更优选为5元/5元或5元/6元双环烷基。“稠环烷基”的非限制性实施例包括但不限于:二环[3.1.0]己基、二环[3.2.0]庚-1-烯基、二环 [3.2.0]庚基、十氢化萘基或十四氢菲基。
[0103]“桥环烷基”指5至18元,含有两个或两个以上环状结构,彼此共用两个不直接相连接碳原子的全碳多环基团,一个或多个环可以含有一个或多个双键,但没有一个环具有完全共轭的π电子的芳香系统,优选为6至12元,更优选为7至10元。优选为6至14 元,更优选为7至10元。根据组成环的数目可以分为双环、三环、四环或多环桥环烷基,优选为双环、三环或四环,更有选为双环或三环。“桥环烷基”的非限制性实施例包括但不限于:(1s,4s)-二环[2.2.1]庚基、二环[3.2.1]辛基、(1s,5s)-二环o[3.3.1]壬基、二环[2.2.2]辛基、 (1r,5r)-二环[3.3.2]癸基。
[0104]“杂环基”、“杂环”或“杂环的”在本技术中可交换使用,都是指非芳香性杂环基,其中一个或多个成环的原子是杂原子,如氧、氮、硫原子等,包括单环、稠环、桥环和螺环。优选具有4至6元单环或7至10元双-或三环,其可以包含1,2或3个选自氮、氧和/或硫中的原子。“杂环基”的实例包括但不限于吗啉基,氧杂环丁烷基,硫代吗啉基,四氢吡喃基,1,1-二氧代-硫代吗啉基,哌啶基,2-氧代-哌啶基,吡咯烷基,2-氧代-吡咯烷基,哌嗪-2-酮,8-氧杂-3-氮杂-双环[3.2.1]辛基和哌嗪基。杂环基可以是取代或未取代的。
[0105]“螺杂环基”指5至18元,两个或两个以上环状结构,且单环之间彼此共用一个原子的多环基团,环内含有1个或多个双键,但没有一个环具有完全共轭的π电子的芳香系统,其中一个或多个环原子选自氮、氧或s(o)
r
(其中r选自0、1或2)的杂原子,其余环原子为碳。优选为6至14元,更优选为7至10元。根据环与环之间共用螺原子的数目将螺环烷基分为单螺杂环基、双螺杂环基或多螺杂环基,优选为单螺杂环基和双螺杂环基。更优选为4元/4元、4元/5元、4元/6元、5元/5元或5元/6元单螺杂环基。“螺杂环基”的非限制性实施例包括但不限于:1,7-二氧杂螺[4.5]癸基、2-氧杂-7-氮杂螺[4.4]壬基、7-氧杂螺[3.5] 壬基和5-氧杂螺[2.4]庚基。
[0106]“稠杂环基”指5至18元,含有两个或两个以上环状结构彼此共用一对原子的全碳多环基团,一个或多个环可以含有一个或多个双键,但没有一个环具有完全共轭的π电子的芳香系统,其中一个或多个环原子选自氮、氧或s(o)
r
(其中r选自0、1或2)的杂原子,其余环原子为碳。优选为6至14元,更优选为7至10元。根据组成环的数目可以分为双环、三环、四环或多环稠杂环基,优选为双环或三环,更优选为5元/5元或5元/6元双环稠杂环基。“稠杂环基”的非限制性实施例包括但不限于:八氢吡咯并[3,4-c]吡咯基、八氢
ꢀ-
1h-异吲哚基,3-氮杂二环[3.1.0]己基,八氢苯并[b][1,4]二噁英(dioxine)。
[0107]“桥杂环基”指5至18元,含有两个或两个以上环状结构,彼此共用两个不直接相连接的原子的多环基团,一个或多个环可以含有一个或多个双键,但没有一个环具有完全共轭的π电子的芳香系统,其中一个或多个环原子选自氮、氧或s(o)
r
(其中r选自0、1或 2)的杂原子,其余环原子为碳。优选为6至14元,更优选为7至10元。根据组成环的数目可以分为双环、三环、四环或多环桥杂环基,优选为双环、三环或四环,更有选为双环或三环。“桥杂环基”的非限制性实施例包括但不限于:2-氮杂二环[2.2.1]庚基,2-氮杂二环[2.2.2]辛基和2-氮杂二环[3.3.2]癸基。
[0108]“芳基”是指含有一个或者两个环的碳环芳香系统,其中所述环可以以稠合的方式连接在一起。术语“芳基”包括单环或双环的芳基,比如苯基、萘基、四氢萘基的芳香基团。优选芳基为c
6-c
10
芳基,更优选芳基为苯基和萘基,最优选为萘基。芳基可以是取代或未取代的。
[0109]“杂芳基”是指芳香族5至6元单环或8至10元双环,其可以包含1至4个选自氮、氧和/或硫中的原子。优选为双环杂芳基,“杂芳基”的实施例包括但不限于呋喃基,吡啶基,2-氧代-1,2-二氢吡啶基,哒嗪基,嘧啶基,吡嗪基,噻吩基,异噁唑基,噁唑基,噁二唑基,咪唑基,吡咯基,吡唑基,三唑基,四氮唑基,噻唑基,异噻唑基,1,2,3
-ꢀ
噻二唑基,苯并间二氧杂环戊烯基,苯并噻吩基、苯并咪唑基,吲哚基,异吲哚基,1, 3-二氧代-异吲哚基,喹啉基,吲唑基,苯并异噻唑基,苯并噁唑基、苯并异噁唑基、
[0110][0111]
杂芳基可以是取代或未取代的。
[0112]“稠合环”是指两个或两个以上环状结构彼此共用一对原子的多环基团,一个或多个环可以含有一个或多个双键,但至少一个环不具有完全共轭的π电子的芳香系统,同时,同时,至少一个环不具有完全共轭的π电子的芳香系统,其中环原子中选自0个、一个或多个环原子选自氮、氧或s(o)
r
(其中r选自0、1或2)的杂原子,其余环原子为碳。稠合环优选包括双环或三环的稠合环,其中双环稠合环优选为芳基或杂芳基与单环杂环基或单环环烷基的稠合环。优选为7至14元,更优选为8至10元。“稠合环”的实施例包括但不限于:
[0113][0114]“烷氧基”是指(烷基-o-)的基团。其中,烷基见本文有关定义。c
1-c6的烷氧基为优先选择。其实例包括,但不限于:甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、叔丁氧基等。
[0115]“羟基”指-oh基团。
[0116]“卤素”是指氟、氯、溴和碘。
[0117]“氨基”指-nh2。
[0118]“氰基”指-cn。
[0119]“硝基”指-no2。
[0120]“羧基”指-c(o)oh。
[0121]“羧酸酯基”指-c(o)o-烷基或-c(o)o-环烷基,其中烷基、环烷基的定义如上所述。
[0122]“dmso”指二甲基亚砜。
[0123]“ts”指对甲苯磺酰基。
[0124]“离去基团(leaving group)”,或称离去基,在化学反应中从一较大分子中脱离的原子或官能基,是亲核取代反应与消除反应中应用的术语。在亲核取代反应中,被亲核试剂进攻的反应物称为底物(substrate),而从底物分子中带着一对电子断裂出去的原子或原子团称为离去基团。易接受电子、承受负电荷能力强的基团是好的离去基团。当离去基团共轭酸的 pka越小,离去基团越容易从其他分子中脱离。原因是因为当其共轭酸的pka越小,相应离去基团不需和其他原子结合,以阴离子(或电中性离去基团)的形式存在的趋势也就增强。常见的离去基团包括但不限于卤素、-ots或-oh。
[0125]“取代的”指基团中的一个或多个氢原子,优选为最多5个,更优选为1~3个氢原子彼此独立地被相应数目的取代基取代。不言而喻,取代基仅处在它们的可能的化学位置,本领域技术人员能够在不付出过多努力的情况下确定(通过实验或理论)可能或不可能的取代。例如,具有游离氢的氨基或羟基与具有不饱和(如烯属)键的碳原子结合时可能是不稳定的。
[0126]
本说明书所述的“取代”或“取代的”,如无特别指出,均是指基团可被一个或多个选自以下的基团取代:烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、疏基、羟基、硝基、氰基、环烷基、杂环基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、氨基、卤代烷基、羟烷基、羧基、羧酸酯基、=o、-c(o)r5、-c(o)or5、-oc(o)r5、
ꢀ-
nr6r7、-c(o)nr6r7、-so2nr6r7或nr6c(o)r7的取代基所取代;
[0127]
r5、r6和r7各自独立地选自氢原子、羟基、卤素、烷基、环烷基、杂环基、芳基或杂芳基,其中所述的烷基、烷氧基、环烷基、杂环基、芳基或杂芳基任选进一步被一个或多个选自羟基、卤素、硝基、氰基、烷基、烷氧基、环烷基、杂环基、芳基、杂芳基、=o、
ꢀ-
c(o)r8、-c(o)or8、-oc(o)r8、-nr9r
10
、-c(o)nr9r
10
、-so2nr9r
10
或-nr9c(o)r
10
的取代基所取代;
[0128]
或者,r6和r7与它们相连接的原子一起形成一个4~8元杂环基,其中4~8元杂环基内含有一个或多个n、o或s(o)
r
,并且所述的4~8元杂环基任选进一步被一个或多个选自羟基、卤素、硝基、氰基、烷基、烷氧基、环烷基、杂环基、芳基、杂芳基、=o、-c(o)r8、
ꢀ-
c(o)or8、-oc(o)r8、-nr9r
10
、-c(o)nr9r
10
、-so2nr9r
10
或-nr9c(o)r
10
的取代基所取代;
[0129]
r8、r9和r
10
各自独立地选自氢原子、烷基、环烷基、杂环基、芳基或杂芳基,其中所述的烷基、环烷基、杂环基、芳基或杂芳基任选进一步被一个或多个选自羟基、卤素、硝基、氰基、烷基、烷氧基、环烷基、杂环基、芳基、杂芳基、羧基或羧酸酯基的取代基所取代。
[0130]
本发明化合物可以含有不对称中心或手性中心,因此以不同的立体异构体形式存在。所预期的是,本发明化合物的所有立体异构体形式,包括但不限于非对映异构体、对映异构体和阻转异构体(atropisomer)和几何(构象)异构体及它们的混合物,如外消旋体混
合物,均在本发明的范围内。
[0131]
除非另外指出,本发明描述的结构还包括此结构的所有异构体(如,非对映异构体、对映异构体和阻转异构体和几何(构象)异构体形式;例如,各不对称中心的r和s构型,(z) 和(e)双键异构体,以及(z)和(e)构象异构体。因此本发明化合物的单个立体异构体以及对映体混合物、非对映异构体混合物和几何(构象)异构体混合物均在本发明范围内。
[0132]“可药用的盐”是指上述化合物能保持原有生物活性并且适合于医药用途的某些盐类。式(i)所表示的化合物的可药用的盐可以为金属盐、与合适的酸形成的胺盐。
[0133]“药物组合物”表示含有一种或多种本文所述化合物或其生理学上可药用的盐或前体药物与其他化学组分的混合物,以及其他组分例如生理学可药用的载体和赋形剂。药物组合物的目的是促进对生物体的给药,利于活性成分的吸收进而发挥生物活性。
[0134]
本发明化合物的合成方法
[0135]
为了完成本发明的目的,本发明采用如下技术方案:
[0136]
本发明通式(ii)所述的化合物或其立体异构体、互变异构体或其可药用的盐的制备方法,包括以下步骤:
[0137][0138]
通式(iia)化合物和通式(iib)化合物在碱性条件下反应,得到通式(iic)化合物;通式(iic) 化合物在碱性条件下水解,得到通式(iid)化合物;通式(iid)化合物进一步脱去保护基pg,得到通式(iia)化合物;通式(iia)化合物在缩合试剂存在下,在碱性条件下缩合反应,得到通式(ii)化合物;
[0139]
其中:
[0140]
r4选自氢原子;
[0141]
r
g
选自烷基;
[0142]
r
h
为离去基团,优选为卤素;
[0143]
pg为氨基保护基,优选为叔丁氧基羰基;
[0144]
环a、r1~r2、r
a
、z1~z7、x1~x3、x、l1和p的定义如通式(ii)中所述。
[0145]
所述的碱性条件由有机碱或无机碱提供,所述的有机碱选自n,n-二异丙基乙胺、
吡啶、三乙胺、哌啶、n-甲基哌嗪和4-二甲氨吡啶,所述的无机碱选自磷酸钾、三水合磷酸钾、乙酸钾、氢氧化钠、氢氧化钾、氢氧化锂、碳酸钠、碳酸钾、碳酸铯、氢化钠和氢化钾,优选为n,n-二异丙基乙胺、氢氧化钠、氢氧化钾或氢氧化锂。
[0146]
所述的缩合试剂选自2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯、二环己基碳二亚胺、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、n,n
’-
二环己基碳化二亚胺、n,n
’-ꢀ
二异丙基碳二酰亚胺、1-羟基-7-偶氮苯并三氮唑、2-(7-偶氮苯并三氮唑)
--
n,n,n',n'-四甲基脲六氟磷酸酯、五氟苯基二苯基磷酸酯、苯并三氮唑-1-基氧基三(二甲基氨基)磷鎓六氟磷酸盐或六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷;优选为五氟苯基二苯基磷酸酯。
具体实施方式
[0147]
以下结合实施例用于进一步描述本发明,但这些实施例并非限制着本发明的范围。
[0148]
实施例
[0149]
实施例给出了式(i)所表示的代表性化合物的制备及相关结构鉴定数据。必须说明,下述实施例是用于说明本发明而不是对本发明的限制。1h nmr图谱是用bruker仪器 (400mhz)测定而得,化学位移用ppm表示。使用四甲基硅烷内标准(0.00ppm)。1h nmr 的表示方法:s=单峰,d=双重峰,t=三重峰,m=多重峰,br=变宽的,dd=双重峰的双重峰, dt=三重峰的双重峰。若提供偶合常数时,其单位为hz。
[0150]
质谱是用lc/ms仪测定得到,离子化方式可为esi或apci。
[0151]
薄层层析硅胶板使用烟台黄海hsgf254或青岛gf254硅胶板,薄层色谱法(tlc) 使用的硅胶板采用的规格是0.15mm~0.2mm,薄层层析分离纯化产品采用的规格是 0.4mm~0.5mm。
[0152]
柱层析一般使用烟台黄海硅胶200~300目硅胶为载体。
[0153]
在下列实施例中,除非另有指明,所有温度为摄氏温度,除非另有指明,各种起始原料和试剂来自市售或者是根据已知的方法合成,市售原料和试剂均不经进一步纯化直接使用,除非另有指明,市售厂家包括但不限于aldrich chemical company,abcr gmbh& co.kg,acros organics,广赞化工科技有限公司和景颜化工科技有限公司。
[0154]
cd3od:氘代甲醇。
[0155]
cdcl3:氘代氯仿。
[0156]
dmso-d6:氘代二甲基亚砜。
[0157]
氩气氛是指反应瓶连接一个约1l容积的氩气气球。
[0158]
实施例中无特殊说明,反应中的溶液是指水溶液。
[0159]
对化合物进行纯化,采用硅胶柱层析洗脱剂体系和薄层色谱法,其中洗脱剂体系选自: a:石油醚和乙酸乙酯体系;b:二氯甲烷和甲醇体系;c:二氯甲烷和乙酸乙酯体系;其中溶剂的体积比根据化合物的极性不同而不同,也可以加入少量的酸性或碱性试剂进行调节,如醋酸或三乙胺等。
[0160]
对化合物纯化的制备液相条件:分离柱akzonobel kromasil;250
×
21.2mm i.d.; 5μm,20ml/min;流动相a:0.05%tfa h2o,流动相b:ch3cn。
[0161]
实施例1
[0162]
6-fluoro-3-methyl-2,10,15,19,20,23
-ꢀ
hexaazapentacyclo[15.5.2.2
10,13
.0
4,9
.0
20,24
]hexacosa-1(23),4,6,8,17(24),18,21-heptaen-16-one 6-氟-3-甲基-2,10,15,19,20,23-六氮杂五环[15.5.2.2
10,13
.0
4,9
.0
20,24
]二十六烷
ꢀ-
1(23),4,6,8,17(24),18,21-庚烯-16-酮
[0163][0164]
第一步
[0165]
((1-(4-氟-2-甲酰基苯基)哌啶-4-基)甲基)氨基甲酸叔丁酯
[0166]
将(哌啶-4-基甲基)氨基甲酸叔丁酯1a(2.14g,0.01mol)溶于10ml的n,n-二甲基甲酰胺中,加入2,5-二氟苯甲醛1b(1.42g,0.01mol)和碳酸钾(4.83g,0.035mol),110℃搅拌 4小时。lc-ms监测原料反应完毕,加水30ml,以乙酸乙酯(30ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,过滤,减压浓缩,得到的残留物通过硅胶柱层析进一步分析纯化 (洗脱剂:a体系),得到((1-(4-氟-2-甲酰基苯基)哌啶-4-基)甲基)氨基甲酸叔丁酯1c(2.7g),产率:80%。
[0167]
ms m/z(esi):337.2[m 1]
[0168]
第二步
[0169]
(r,e)-((1-(2-(((叔丁基亚磺酰基)亚氨基)甲基)-4-氟苯基)哌啶-4-基)甲基)氨基甲酸叔丁酯
[0170]
将((1-(4-氟-2-甲酰基苯基)哌啶-4-基)甲基)氨基甲酸叔丁酯1c(2.7g,8.0mmol)、(r)-2
-ꢀ
甲基丙烷-2-亚磺酰胺1d(1.1g,8.8mmol)、钛酸四乙酯(3.7g,16.0mmol)溶于20ml的四氢呋喃中,80℃下反应过夜。lc-ms监测反应完毕,加水30ml,以乙酸乙酯(30ml
×
3) 萃取,合并有机相,以无水硫酸钠干燥,过滤,减压浓缩,得到的残留物通过硅胶柱层析进一步分析纯化(洗脱剂:a体系),得到(r,e)-((1-(2-(((叔丁基亚磺酰基)亚氨基)甲基)-4
-ꢀ
氟苯基)哌啶-4-基)甲基)氨基甲酸叔丁酯1e(3.3g),产率:95%。
[0171]
ms m/z(esi):440.2[m 1]
[0172]
第三步
[0173]
((1-(2-(1-(((r)-叔丁基亚磺酰基)氨基)乙基)-4-氟苯基)哌啶-4-基)甲基)氨基甲酸叔丁酯
[0174]
将(r,e)-((1-(2-(((叔丁基亚磺酰基)亚氨基)甲基)-4-氟苯基)哌啶-4-基)甲基)氨基甲酸叔丁酯1e(3.3g,7.5mmol)加入至20ml的四氢呋喃中,冷却至-75℃,滴加甲基溴化镁(2 ml,20mmol,10mol/l),滴加完成后转移至室温反应,室温下反应2小时。tlc监测反应结束,将反应液中加入50ml冰水中淬灭反应,以乙酸乙酯(30ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,过滤,减压浓缩,得到的残留物通过硅胶柱层析进一步分析纯化 (洗脱剂:a体系),得到((1-(2-(1-(((r)-叔丁基亚磺酰基)氨基)乙基)-4-氟苯基)哌啶-4-基) 甲基)氨基甲酸叔丁酯1f(1.7g),产率:50%。
[0175]
ms m/z(esi):456.2[m 1]
[0176]
第四步
[0177]
((1-(2-(1-氨基乙基)-4-氟苯基)哌啶-4-基)甲基)氨基甲酸叔丁酯
[0178]
将((1-(2-(1-(((r)-叔丁基亚磺酰基)氨基)乙基)-4-氟苯基)哌啶-4-基)甲基)氨基甲酸叔丁酯1f(1.7g,3.7mmol)溶于40ml四氢呋喃和水(v/v=4:1)的混合溶剂中,加入碘单质(189 mg,0.75mmol),50℃下反应3小时,lc-ms监测反应完毕,硫代硫酸钠溶液淬灭,加水 30ml,以乙酸乙酯(30ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,过滤,减压浓缩,得到的残留物通过硅胶柱层析进一步分析纯化(洗脱剂:a体系),得到((1-(2-(1-氨基乙基)-4-氟苯基)哌啶-4-基)甲基)氨基甲酸叔丁酯1g(600mg),产率:35%。
[0179]
ms m/z(esi):352.2[m 1]
[0180]
第五步
[0181]
5-((1-(2-(4-(((叔丁氧基羰基)氨基)甲基)哌啶-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶
ꢀ-
3-甲酸乙酯
[0182]
将((1-(2-(1-氨基乙基)-4-氟苯基)哌啶-4-基)甲基)氨基甲酸叔丁酯1g(600mg,1.7mmol)、 5-氯吡唑并[1,5-a]嘧啶-3-羧酸乙酯1h(385mg,1.7mmol)和n,n-二异丙基乙胺(1.3g, 10.2mmol)溶于20ml的正丁醇中,110℃下反应6小时。lc-ms监测反应完毕,冷却至室温,加水30ml,以乙酸乙酯(30ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,减压浓缩,得到的残留物通过硅胶柱层析进一步分析纯化(洗脱剂:a体系),得到5-((1-(2-(4-(((叔丁氧基羰基)氨基)甲基)哌啶-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶-3-甲酸乙酯1i (600mg),产率:61%。
[0183]
ms m/z(esi):541.3[m 1]
[0184]
第六步
[0185]
5-((1-(2-(4-(((叔丁氧基羰基)氨基)甲基)哌啶-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶
ꢀ-
3-羧酸
[0186]
将5-((1-(2-(4-(((叔丁氧基羰基)氨基)甲基)哌啶-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a] 嘧啶-3-甲酸乙酯1i(600mg,1.1mmol)溶于6ml四氢呋喃、甲醇和水(v:v:v=10:1:1)的混合溶剂中,加入一水合氢氧化锂(466mg,11.1mmol),70℃下搅拌过夜。lc-ms监测反应完毕,冷却,缓慢滴加稀盐酸调至酸性,加水30ml,以乙酸乙酯(30ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,减压浓缩,得到5-((1-(2-(4-(((叔丁氧基羰基)氨基)甲基)哌啶
ꢀ-
1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶-3-羧酸1j的粗品,产物不经纯化进行下一步反应。
[0187]
第七步
[0188]
5-((1-(2-(4-(氨基甲基)哌啶-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶-3-羧酸
[0189]
将上一步得到的5-((1-(2-(4-(((叔丁氧基羰基)氨基)甲基)哌啶-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶-3-羧酸1j粗品溶于5ml的盐酸二氧六环溶液中,室温下反应2小时。 lc-ms监测反应完毕,反应液减压浓缩,得到5-((1-(2-(4-(氨基甲基)哌啶-1-基)-5-氟苯基) 乙基)氨基)吡唑并[1,5-a]嘧啶-3-羧酸1k的粗品,产物不经处理进行下一步反应下一步。
[0190]
第八步
[0191]
6-氟-3-甲基-2,10,15,19,20,23-六氮杂五环[15.5.2.2
10,13
.0
4,9
.0
20,24
]二十六烷
ꢀ-
1(23),4,6,8,17(24),18,21-庚烯-16-酮
[0192]
将上一步得到的5-((1-(2-(4-(氨基甲基)哌啶-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶-3-羧酸1k粗品、五氟苯基二苯基磷酸酯(461mg,1.20mmol)和n,n-二异丙基乙胺(1.1 g,8mmol)溶于2.5ml二氯甲烷和n,n-二甲基甲酰胺(v:v=1:4)混合溶剂中,室温下反应过夜。lc-ms监测反应完毕,加水20ml,以二氯甲烷(20ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,减压浓缩,通过制备液相得到6-氟-3-甲基-2,10,15,19,20,23-六氮杂五环[15.5.2.2
10,13
.0
4,9
.0
20,24
]二十六烷-1(23),4,6,8,17(24),18,21-庚烯-16-酮1(118mg)。
[0193]
ms m/z(esi):395.2[m 1]
[0194]1h nmr(400mhz,dmso-d6)δ8.59(d,j=7.5hz,1h),8.11(s,1h),8.06(d,j=7.2hz,1h), 7.98(s,1h),7.36(d,j=10.4hz,1h),7.20-7.26(m,1h),7.10(d,j=8.8hz,1h),6.49(d,j= 7.8hz,1h),5.58-5.62(m,2h),2.70-2.79(m,4h),2.43-2.47(m,1h),1.98-2.03(m,3h), 1.51-1.61(m,4h),1.45(d,j=6.5hz,3h).
[0195]
实施例2
[0196]
(13s)-6-fluoro-3-methyl-2,10,15,19,20,23
-ꢀ
hexaazapentacyclo[15.5.2.1
10,13
.0
4,9
.0
20,24
]pentacosa-1(23),4(9),5,7,17(24),18,21-heptaen-16-one (13s)-6-氟-3-甲基-2,10,15,19,20,23-六氮杂五环[15.5.2.1
10,13
.0
4,9
.0
20,24
]二十五烷
ꢀ-
1(23),4(9),5,7,17(24),18,21-庚烯-16-酮
[0197][0198][0199]
第一步
[0200]
((1-(4-氟-2-甲酰基苯基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯
[0201]
将(吡咯烷-3-基甲基)氨基甲酸叔丁酯2a(1.0g,5.0mmol)溶于10ml的n,n-二甲基甲酰胺中,加入2,5-二氟苯甲醛1b(780mg,5.5mmol)和碳酸钾(2.42g,17.5mmol),110℃搅拌4小时。lc-ms监测原料反应完毕,加水30ml,以乙酸乙酯(30ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,过滤,减压浓缩,得到的残留物用硅胶柱层析法(洗脱剂: a体系)纯化,得到((1-(4-氟-2-甲酰基苯基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯2b(800mg),产率:50%。
[0202]
ms m/z(esi):323.2[m 1]
[0203]
第二步
[0204]
(((s)-1-(2-((e)-(((r)-叔丁基亚磺酰基)亚氨基)甲基)-4-氟苯基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯
[0205]
将((1-(4-氟-2-甲酰基苯基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯2b(630mg,2.0mmol)、 (r)-2-甲基丙烷-2-亚磺酰胺1d(355mg,2.9mmol)、钛酸四乙酯(892mg,2.7mmol)溶于5 ml的四氢呋喃中,回流反应4小时。lc-ms监测反应完毕,减压浓缩,得到的
残留物用硅胶柱层析法(洗脱剂:a体系)纯化,得到(((s)-1-(2-((e)-(((r)-叔丁基亚磺酰基)亚氨基) 甲基)-4-氟苯基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯2c(450mg),产率:43%。
[0206]
ms m/z(esi):426.2[m 1]
[0207]
第三步
[0208]
(((3s)-1-(2-(1-(((r)-叔丁基亚磺酰基)氨基)乙基)-4-氟苯基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯
[0209]
将(((s)-1-(2-((e)-(((r)-叔丁基亚磺酰基)亚氨基)甲基)-4-氟苯基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯2c(450mg,1.06mmol)加入至3ml的四氢呋喃中,冷却至-65℃,滴加甲基溴化镁(4.22ml,4.22mmol,1mol/l),滴加完成后转移至室温反应,室温下反应2小时。 tlc监测反应结束,将反应液中加入20ml冰水中淬灭反应,以乙酸乙酯(20ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,过滤,减压浓缩,得到的残留物用硅胶柱层析法(洗脱剂:a体系)纯化,得到(((3s)-1-(2-(1-(((r)-叔丁基亚磺酰基)氨基)乙基)-4-氟苯基)吡咯烷
ꢀ-
3-基)甲基)氨基甲酸叔丁酯2d(440mg),产率:94.4%。
[0210]
ms m/z(esi):442.2[m 1]
[0211]
第四步
[0212]
(((3s)-1-(2-(1-氨基乙基)-4-氟苯基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯
[0213]
将(((3s)-1-(2-(1-(((r)-叔丁基亚磺酰基)氨基)乙基)-4-氟苯基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯2d(340mg,0.78mmol)溶于3.5ml四氢呋喃和水(v/v=6:1)的混合溶剂中,加入碘单质(38mg,0.17mmol),50℃下反应3小时,lc-ms监测反应完毕,硫代硫酸钠溶液淬灭,加水20ml,以乙酸乙酯(20ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,过滤,减压浓缩,得到的残留物用硅胶柱层析法(洗脱剂:a体系)纯化,得到(((3s)-1-(2-(1-氨基乙基)-4-氟苯基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯2e(336mg),产率:100%。
[0214]
ms m/z(esi):338.2[m 1]
[0215]
第五步
[0216]
5-((1-(2-((s)-3-(((叔丁氧基羰基)氨基)甲基)吡咯烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]] 嘧啶-3-甲酸乙酯
[0217]
将(((3s)-1-(2-(1-氨基乙基)-4-氟苯基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯2e(260mg, 0.78mmol)、5-氯吡唑并[1,5-a]嘧啶-3-羧酸乙酯1h(174mg,0.77mmol)和n,n-二异丙基乙胺(606mg,4.63mmol)溶于4ml的正丁醇中,120℃下反应5小时。lc-ms监测反应完毕,冷却至室温,减压浓缩,得到的残留物用硅胶柱层析法(洗脱剂:a体系)纯化,得到 5-((1-(2-((s)-3-(((叔丁氧基羰基)氨基)甲基)吡咯烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]] 嘧啶-3-甲酸乙酯2f(340mg),产率:66%。
[0218]
ms m/z(esi):527.3[m 1]
[0219]
第六步
[0220]
5-((1-(2-((s)-3-(((叔丁氧基羰基)氨基)甲基)吡咯烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]] 嘧啶-3-羧酸
[0221]
将5-((1-(2-((s)-3-(((叔丁氧基羰基)氨基)甲基)吡咯烷-1-基)-5-氟苯基)乙基)氨基)吡唑并 [1,5-a]]嘧啶-3-甲酸乙酯2f(340mg,0.65mmol)溶于4ml甲醇、四氢呋喃和水(v:v:v=6:1:1) 的混合溶剂中,加入一水合氢氧化锂(163mg,3.87mmol),70℃下搅拌
过夜。lc-ms监测反应完毕,冷却,缓慢滴加稀盐酸调至酸性,加水20ml,以乙酸乙酯(20ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,减压浓缩,得到5-((1-(2-((s)-3-(((叔丁氧基羰基)氨基)甲基)吡咯烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]]嘧啶-3-羧酸2g的粗品,产物不经纯化进行下一步反应。
[0222]
第七步
[0223]
5-((1-(2-((s)-3-(氨基甲基)吡咯烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]]嘧啶-3-羧酸
[0224]
将上一步得到的5-((1-(2-((s)-3-(((叔丁氧基羰基)氨基)甲基)吡咯烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]]嘧啶-3-羧酸2g粗品溶于5ml的盐酸二氧六环溶液中,室温下反应 2小时。lc-ms监测反应完毕,反应液减压浓缩,得到5-((1-(2-((s)-3-(氨基甲基)吡咯烷-1
-ꢀ
基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]]嘧啶-3-羧酸2h的粗品,产物不经纯化进行下一步反应。
[0225]
第八步
[0226]
(13s)-6-氟-3-甲基-2,10,15,19,20,23-六氮杂五环[15.5.2.1
10,13
.0
4,9
.0
20,24
]二十五烷
ꢀ-
1(23),4(9),5,7,17(24),18,21-庚烯-16-酮
[0227]
将上一步得到的5-((1-(2-((s)-3-(氨基甲基)吡咯烷-1-基)-5-氟苯基)乙基)氨基)吡唑并 [1,5-a]]嘧啶-3-羧酸2h粗品、五氟苯基二苯基磷酸酯(297mg,0.77mmol)和n,n-二异丙基乙胺(840mg,6.5mmol)溶于5ml二氯甲烷和n,n-二甲基甲酰胺(v:v=1.5:1)的混合溶剂中,室温下反应过夜。lc-ms监测反应完毕,加水20ml,以二氯甲烷(20ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,减压浓缩,通过制备液相得到(13s)-6-氟-3-甲基
ꢀ-
2,10,15,19,20,23-六氮杂五环[15.5.2.1
10,13
.0
4,9
.0
20,24
]二十五烷-1(23),4(9),5,7,17(24),18,21-庚烯-16-酮2(110mg),产率:48.6%。
[0228]
ms m/z(esi):381.4[m 1]
[0229]1h nmr(400mhz,dmso-d6)δ8.68(d,j=8.3hz,1h),8.51(d,j=7.6hz,1h),8.45(s,1h), 8.05(s,1h),7.24(d,j=10.0hz,1h),6.98(dd,j=6.8,1.7hz,2h),6.26(d,j=7.6hz,1h), 5.74-5.77(m,2h),3.60(dt,j=13.4,4.2hz,1h),3.52(t,j=8.5hz,1h),3.22(d,j=9.8hz, 2h),2.86(d,j=9.2hz,1h),2.76(s,1h),2.15-2.31(m,1h),1.96-1.97(m,1h),1.55(d,j= 7.0hz,3h).
[0230]
实施例3
[0231]
(13r)-6-fluoro-3-methyl-2,10,15,19,20,23
-ꢀ
hexaazapentacyclo[15.5.2.1
10,13
.0
4,9
.0
20,24
]pentacosa-1(23),4(9),5,7,17(24),18,21-heptaen-16-one (13r)-6-氟-3-甲基-2,10,15,19,20,23-六氮杂五环[15.5.2.1
10,13
.0
4,9
.0
20,24
]二十五烷
ꢀ-
1(23),4(9),5,7,17(24),18,21-庚烯-16-酮
基)甲基)氨基甲酸叔丁酯3b(430mg,0.99mmol)溶于3.5ml四氢呋喃和水(v/v=6:1)的混合溶剂中,加入碘单质(48mg,0.22mmol),50℃下反应3小时,lc-ms监测反应完毕,硫代硫酸钠溶液淬灭,加水20ml,以乙酸乙酯(20ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,过滤,减压浓缩,得到的残留物用硅胶柱层析法(洗脱剂:a体系)纯化,得到(((3r)-1-(2-(1
-ꢀ
氨基乙基)-4-氟苯基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯3c(330mg),产率:100%。
[0244]
ms m/z(esi):338.2[m 1]
[0245]
第四步
[0246]
5-((1-(2-((r)-3-(((叔丁氧基羰基)氨基)甲基)吡咯烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]] 嘧啶-3-甲酸乙酯
[0247]
将(((3r)-1-(2-(1-氨基乙基)-4-氟苯基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯3c(310mg, 0.93mmol)、5-氯吡唑并[1,5-a]嘧啶-3-羧酸乙酯1h(207mg,0.92mmol)和n,n-二异丙基乙胺(722mg,5.60mmol)溶于4ml的正丁醇中,120℃下反应5小时。lc-ms监测反应完毕,冷却至室温,减压浓缩,得到的残留物用硅胶柱层析法(洗脱剂:a体系)纯化,得到 5-((1-(2-((r)-3-(((叔丁氧基羰基)氨基)甲基)吡咯烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]] 嘧啶-3-甲酸乙酯3d(270mg),产率:56%。
[0248]
ms m/z(esi):527.3[m 1]
[0249]
第五步
[0250]
5-((1-(2-((r)-3-(((叔丁氧基羰基)氨基)甲基)吡咯烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]] 嘧啶-3-羧酸
[0251]
将5-((1-(2-((r)-3-(((叔丁氧基羰基)氨基)甲基)吡咯烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]]嘧啶-3-甲酸乙酯3d(270mg,0.52mmol)溶于4ml的混合溶液中(ch3oh: thf:h2o=6:1:1),加入一水合氢氧化锂(129mg,3.06mmol),70℃下搅拌过夜。lc-ms监测反应完毕,冷却,缓慢滴加稀盐酸调至酸性,加水20ml,以乙酸乙酯(20ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,减压浓缩,得到5-((1-(2-((r)-3-(((叔丁氧基羰基)氨基) 甲基)吡咯烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]]嘧啶-3-羧酸3e的粗品,产物不经纯化进行下一步反应。
[0252]
第六步
[0253]
5-((1-(2-((r)-3-(氨基甲基)吡咯烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]]嘧啶-3-羧酸
[0254]
将5-((1-(2-((r)-3-(((叔丁氧基羰基)氨基)甲基)吡咯烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]]嘧啶-3-羧酸3e溶于5ml的盐酸二氧六环溶液中,室温下反应2小时。lc-ms 监测反应完毕,反应液减压浓缩,得到5-((1-(2-((r)-3-(氨基甲基)吡咯烷-1-基)-5-氟苯基) 乙基)氨基)吡唑并[1,5-a]]嘧啶-3-羧酸3f的粗品,产物不经纯化进行下一步反应。
[0255]
第七步
[0256]
(13r)-6-氟-3-甲基-2,10,15,19,20,23-六氮杂五环[15.5.2.1
10,13
.0
4,9
.0
20,24
]二十五烷
ꢀ-
1(23),4(9),5,7,17(24),18,21-庚烯-16-酮
[0257]
将5-((1-(2-((r)-3-(氨基甲基)吡咯烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]]嘧啶-3-羧酸3f、五氟苯基二苯基磷酸酯(236mg,0.61mmol)和n,n-二异丙基乙胺
(662mg,5.12 mmol)溶于5ml二氯甲烷和n,n-二甲基甲酰胺(v:v=1.5:1)的混合溶剂中,室温下反应过夜。lc-ms监测反应完毕,加水20ml,以二氯甲烷(20ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,减压浓缩,通过制备液相得到(13r)-6-氟-3-甲基-2,10,15,19,20,23-六氮杂五环[15.5.2.1
10,13
.0
4,9
.0
20,24
]二十五烷-1(23),4(9),5,7,17(24),18,21-庚烯-16-酮3(90mg),产率: 46%。
[0258]
ms m/z(esi):381.4[m 1]
[0259]1h nmr(400mhz,dmso-d6)δ8.68(d,j=8.3hz,1h),8.51(d,j=7.6hz,1h),8.46(s,1h), 8.05(s,1h),7.24(d,j=9.8hz,1h),6.90-7.02(m,2h),6.26(d,j=7.6hz,1h),5.74-5.78(m, 2h),3.60(d,j=13.1hz,1h),3.52(t,j=8.5hz,1h),3.22(d,j=10.1hz,2h),2.85(d,j= 9.2hz,1h),2.73-2.77(m,1h),2.23(q,j=10.4,9.0hz,1h),1.92-2.03(m,1h),1.55(d,j= 7.0hz,3h).
[0260]
实施例4
[0261]
(13s)-6-fluoro-3-methyl-2,10,15,19,20,23
-ꢀ
hexaazapentacyclo[15.5.2.1
10,13
.0
4,9
.0
20,24
]pentacosa-1(23),4,6,8,17(24),18,21-heptaene-11,16-dio ne
[0262]
(13s)-6-氟-3-甲基-2,10,15,19,20,23-六氮杂五环[15.5.2.1
10,13
.0
4,9
.0
20,24
]二十五烷
ꢀ-
1(23),4,6,8,17(24),18,21-庚烯-11,16-二酮
[0263][0264]
第一步
[0265]
(13s)-6-氟-3-甲基-2,10,15,19,20,23-六氮杂五环[15.5.2.1
10,13
.0
4,9
.0
20,24
]二十五烷
ꢀ-
1(23),4,6,8,17(24),18,21-庚烯-11,16-二酮
[0266]
将(13s)-6-氟-3-甲基-2,10,15,19,20,23-六氮杂五环[15.5.2.1
10,13
.0
4,9
.0
20,24
]二十五烷
ꢀ-
1(23),4(9),5,7,17(24),18,21-庚烯-16-酮2(43mg,0.11mmol)、碘单质(429mg,1.7mmol)和碳酸氢钠(185mg,2.2mmol)溶于4.5ml四氢呋喃和水(v/v=2.5:1)的混合溶剂中,室温下搅拌5天。lc-ms监测反应完毕,加入硫代硫酸钠溶液20ml淬灭反应,以乙酸乙酯(20 ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,减压浓缩,通过制备液相得到
(13s)-6-氟-3
-ꢀ
甲基-2,10,15,19,20,23-六氮杂五环[15.5.2.1
10,13
.0
4,9
.0
20,24
]二十五烷-1(23),4,6,8,17(24),18,21
-ꢀ
庚烯-11,16-二酮4(4.6mg),产率:10%。
[0267]
ms m/z(esi):395.2[m 1]
[0268]1h nmr(400mhz,dmso-d6)δ8.70(d,j=8.7hz,1h),8.53(d,j=7.7hz,1h),8.07(s,1h), 7.77(s,1h),7.39(d,j=9.3hz,2h),7.16(s,1h),6.28(d,j=7.5hz,1h),5.10-5.20(m,1h), 3.64-3.68(m,1h),3.46(d,j=10.8hz,1h),3.29(d,j=9.3hz,1h),3.05(s,2h),2.56-2.74(m, 2h),1.56(d,j=6.7hz,3h).
[0269]
实施例5
[0270]
(3r)-6-fluoro-3-methyl-2,8,10,15,19,20,23
-ꢀ
heptaazapentacyclo[15.5.2.1
10,13
.0
4,9
.0
20,24
]pentacosa-1(23),4(9),5,7,17(24),18,21-heptaen-16-one (3r)-6-氟-3-甲基-2,8,10,15,19,20,23-五氮杂五环[15.5.2.1
10,13
.0
4,9
.0
20,24
]二十五烷
ꢀ-
1(23),4(9),5,7,17(24),18,21-庚烯-16-酮
[0271][0272]
第一步
[0273]
2-氯-5-氟-n-甲氧基-n-甲基烟酰胺
[0274]
将2-氯-5-氟烟酸5a(20g,113.93mmol)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐 (32.8g,170.90mmol)、1-羟基苯并三唑(23.1g,170.90mmol)和n,o-二甲基羟胺5b(20g, 113.93mmol)溶于300ml的二氯甲烷中,使其全部溶解,再加入n,n-二异丙基乙胺(37.7 ml,227.86mmol),室温下搅拌过夜。lc-ms监测反应完毕,加水200ml,以二氯甲烷(100 ml
×
3)萃取,合并有机相,以饱和氯化钠溶液洗涤,无水硫酸钠干燥,减压浓缩,得到
的残留物通过硅胶柱层析进一步分析纯化(洗脱剂:a体系),得到2-氯-5-氟-n-甲氧基-n-甲基烟酰胺5c(23g),产率:92.6%。
[0275]
ms m/z(esi):219.0[m 1]
[0276]
第二步
[0277]
1-(2-氯-5-氟吡啶-3-基)乙-1-酮
[0278]
将2-氯-5-氟-n-甲氧基-n-甲基烟酰胺5c(23g,105.21mmol)溶于250ml无水四氢呋喃中,氩气保护,低温冷却至-78℃,滴加甲基溴化镁(45.6ml,136.77mmol,3mol/l inthf),滴加过程中,保持温度在-78℃
--
60℃之间,滴加完毕自然升温至室温过夜。lc-ms 监测反应完毕,冷却后加入饱和氯化铵溶液淬灭。加水200ml,以乙酸乙酯(100ml
×
3)萃取,合并有机相,以饱和氯化钠溶液洗涤,无水硫酸钠干燥,减压浓缩,得到的残留物通过硅胶柱层析进一步分析纯化(洗脱剂:a体系),得到1-(2-氯-5-氟吡啶-3-基)乙-1-酮5d (15.6g),产率:85.7%。
[0279]
ms m/z(esi):174.0[m 1]
[0280]
第三步
[0281]
(r,z)-n-(1-(2-氯-5-氟吡啶-3-基)亚乙基)-2-甲基丙烷-2-亚磺酰胺
[0282]
将1-(2-氯-5-氟吡啶-3-基)乙-1-酮5d(200mg,1.15mmol),(r)-2-甲基丙烷-2-亚磺酰胺 1d(210mg,1.73mmol),钛酸四乙酯(1.05g,4.60mmol)溶于四氢呋喃中,80℃下反应过夜。lc-ms监测反应完毕,反应液加水20ml,固体析出,过滤得滤液,以乙酸乙酯(20 ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,过滤,减压浓缩,得到的残留物通过硅胶柱层析进一步分析纯化(洗脱剂:a体系),得到(r,z)-n-(1-(2-氯-5-氟吡啶-3-基)亚乙基)-2
-ꢀ
甲基丙烷-2-亚磺酰胺5e(250mg),产率:78%。
[0283]
ms m/z(esi):277.1[m 1]
[0284]
第四步
[0285]
((1-(3-((z)-1-(((r)-叔丁基亚磺酰基)亚氨基)乙基)-5-氟吡啶-2-基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯
[0286]
将(r,z)-n-(1-(2-氯-5-氟吡啶-3-基)亚乙基)-2-甲基丙烷-2-亚磺酰胺5e(250mg,0.90 mmol),(吡咯烷-3-基甲基)氨基甲酸叔丁酯5f(198.3mg,0.99mmol),碳酸氢钠(226.8mg, 2.70mmol)溶于正丁醇中,100℃下反应过夜。lc-ms监测原料反应完毕,冷却加水20ml,以乙酸乙酯(20ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,过滤,减压浓缩,得到的残留物通过硅胶柱层析进一步分析纯化(洗脱剂:a体系),得到((1-(3-((z)-1-(((r)-叔丁基亚磺酰基)亚氨基)乙基)-5-氟吡啶-2-基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯5g(120mg),产率30%。
[0287]
ms m/z(esi):441.2[m 1]
[0288]
第五步
[0289]
((1-(3-(1-(((r)-叔丁基亚磺酰基)氨基)乙基)-5-氟吡啶-2-基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯
[0290]
将((1-(3-((z)-1-(((r)-叔丁基亚磺酰基)亚氨基)乙基)-5-氟吡啶-2-基)吡咯烷-3-基)甲基) 氨基甲酸叔丁酯5g(120mg,0.27mmol)溶于甲醇中,加入硼氢化钠(22.5mg,0.59mmol), 60℃下反应1小时,直到反应完毕。冷却加水20ml,以乙酸乙酯(20ml
×
3)萃取,
合并有机相,以无水硫酸钠干燥,过滤,减压浓缩,得到((1-(3-(1-(((r)-叔丁基亚磺酰基)氨基) 乙基)-5-氟吡啶-2-基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯5h(90mg)粗品。
[0291]
ms m/z(esi):443.2[m 1]
[0292]
第六步
[0293]
((1-(3-(1-氨基乙基)-5-氟吡啶-2-基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯
[0294]
将((1-(3-(1-(((r)-叔丁基亚磺酰基)氨基)乙基)-5-氟吡啶-2-基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯5h(90mg)粗品,溶于20ml四氢呋喃和水(v/v=4:1)的混合溶剂中,加入碘单质(5.08mg,0.02mmol),50℃下反应3小时,lc-ms监测反应完毕,硫代硫酸钠溶液淬灭,加水20ml,以乙酸乙酯(20ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,过滤,减压浓缩,得到((1-(3-(1-氨基乙基)-5-氟吡啶-2-基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯5i (50mg)粗品。
[0295]
ms m/z(esi):339.2[m 1]
[0296]
第七步
[0297]
5-((1-(2-(3-(((叔丁氧基羰基)氨基)甲基)吡咯烷-1-基)-5-氟吡啶-3-基)乙基)氨基)吡唑[1,5-a] 嘧啶-3-甲酸乙酯
[0298]
将((1-(3-(1-氨基乙基)-5-氟吡啶-2-基)吡咯烷-3-基)甲基)氨基甲酸叔丁酯5i(100mg)粗品、5-氯吡唑并[1,5-a]嘧啶-3-羧酸乙酯1h(81.23mg,0.36mmol)和n,n-二异丙基乙胺 (293.8mg,1.8mmol)溶于正丁醇中,120℃下反应5小时。lc-ms监测反应完毕,冷却至室温,加水20ml,以乙酸乙酯(20ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,减压浓缩,得到的残留物通过硅胶柱层析进一步分析纯化(洗脱剂:a体系),得到 5-((1-(2-(3-(((叔丁氧基羰基)氨基)甲基)吡咯烷-1-基)-5-氟吡啶-3-基)乙基)氨基)吡唑[1,5-a] 嘧啶-3-甲酸乙酯5j(40mg)。
[0299]
ms m/z(esi):528.2[m 1]
[0300]
第八步
[0301]
5-((1-(2-(3-(((叔丁氧基羰基)氨基)甲基)吡咯烷-1-基)-5-氟吡啶-3-基)乙基)氨基)吡唑[1,5-a] 嘧啶-3-羧酸
[0302]
将5-((1-(2-(3-(((叔丁氧基羰基)氨基)甲基)吡咯烷-1-基)-5-氟吡啶-3-基)乙基)氨基)吡唑 [1,5-a]嘧啶-3-甲酸乙酯5j(40mg,0.076mmol)溶于5ml四氢呋喃、甲醇和水(v:v:v=3:1:1) 的混合溶剂中,加入一水合氢氧化锂(10.93mg,0.26mmol),50℃下反应5小时。lc-ms 监测反应完毕,冷却,缓慢滴加稀盐酸调至酸性,加水10ml,以乙酸乙酯(10ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,减压浓缩,得到5-((1-(2-(3-(((叔丁氧基羰基)氨基) 甲基)吡咯烷-1-基)-5-氟吡啶-3-基)乙基)氨基)吡唑[1,5-a]嘧啶-3-羧酸5k的粗品,产物不经纯化进行下一步反应。
[0303]
ms m/z(esi):500.2[m 1]
[0304]
第九步
[0305]
5-((1-(2-(3-(氨基甲基)吡咯烷-1-基)-5-氟吡啶-3-基)乙基)氨基)吡唑[1,5-a]嘧啶-3-羧酸
[0306]
将上一步得到的5-((1-(2-(3-(((叔丁氧基羰基)氨基)甲基)吡咯烷-1-基)-5-氟吡啶-3-基)乙基)氨基)吡唑[1,5-a]嘧啶-3-羧酸5k溶于20ml的盐酸二氧六环溶液中,室温
下反应1小时。 lc-ms监测反应完毕,反应液减压浓缩,得到5-((1-(2-(3-(氨基甲基)吡咯烷-1-基)-5-氟吡啶-3-基)乙基)氨基)吡唑[1,5-a]嘧啶-3-羧酸5l的粗品,产物不经纯化进行下一步反应。
[0307]
ms m/z(esi):400.2[m 1]
[0308]
第十步
[0309]
(3r)-6-氟-3-甲基-2,8,10,15,19,20,23-五氮杂五环[15.5.2.1
10,13
.0
4,9
.0
20,24
]二十五烷
ꢀ-
1(23),4(9),5,7,17(24),18,21-庚烯-16-酮
[0310]
将5-((1-(2-(3-(氨基甲基)吡咯烷-1-基)-5-氟吡啶-3-基)乙基)氨基)吡唑[1,5-a]嘧啶-3-羧酸 5l、五氟苯基二苯基磷酸酯(35mg,0.09mmol)和n,n-二异丙基乙胺(99.6mg,0.61mmol) 溶于20ml二氯甲烷和n,n-二甲基甲酰胺(v:v=1:2)的混合溶剂中,室温下反应过夜。 lc-ms监测反应完毕,加入饱和氯化铵20ml,加水20ml,以乙酸乙酯(20ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,减压浓缩,通过制备液相分离得到(3r)-6-氟-3-甲基
ꢀ-
2,8,10,15,19,20,23-五氮杂五环[15.5.2.1
10,13
.0
4,9
.0
20,24
]二十五烷-1(23),4(9),5,7,17(24),18,21
-ꢀ
庚烯-16-酮5(11mg)。
[0311]
ms m/z(esi):382.1[m 1]
[0312]
1h nmr(400mhz,dmso-d6)δ8.72(d,j=8.1hz,1h),8.52(d,j=7.6hz,1h),8.35(s, 1h),8.10(m,1h),8.05(s,1h),7.66(d,j=9.7hz,1h),6.27(d,j=7.6hz,1h),5.32(m,1h), 3.82(m,1h),3.59(m,2h),3.07(m,2h),1.95-2.04(m,1h),1.59(d,j=7.0hz,3h),0.85(m, 2h).
[0313]
实施例6
[0314]
(3r)-6-fluoro-3-methyl-2,10,15,19,20,23
-ꢀ
hexaazapentacyclo[15.5.2.0
4,9
.0
10,13
.0
20,24
]tetracosa-1(23),4(9),5,7,17(24),18,21-heptaen-16-one (3r)-6-氟-3-甲基-2,10,15,19,20,23-六氮杂五环[15.5.2.0
4,9
.0
10,13
.0
20,24
]二十四烷
ꢀ-
1(23),4(9),5,7,17(24),18,21-庚烯-16-酮
[0315][0316][0317]
第一步
[0318]
((1-(4-氟-2-甲酰基苯基)氮杂环丁烷-2-基)甲基)氨基甲酸叔丁酯
[0319]
将(氮杂环丁烷-2-基甲基)氨基甲酸叔丁酯6a(900mg,4.83mmol)溶于5ml的n,n
-ꢀ
二甲基甲酰胺中,加入2,5-二氟苯甲醛1b(1.03g,7.25mmol)和碳酸钾(2.34g,16.9mmol), 120℃搅拌6小时。lc-ms监测原料反应完毕,加水20ml,以乙酸乙酯(20ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,过滤,减压浓缩,得到的残留物通过硅胶柱层析进一步分析纯化(洗脱剂:a体系),得到((1-(4-氟-2-甲酰基苯基)氮杂环丁烷-2-基)甲基)氨基甲酸叔丁酯6b(420mg),产率:28%。
[0320]
ms m/z(esi):309.1[m 1]
[0321]
第二步
[0322]
((1-(2-((e)-(((r)-叔丁基亚磺酰基)亚氨基)甲基)-4-氟苯基)氮杂环丁烷-2-基)甲基)氨基甲酸叔丁酯
[0323]
将((1-(4-氟-2-甲酰基苯基)氮杂环丁烷-2-基)甲基)氨基甲酸叔丁酯6b(420mg,1.36 mmol)、(r)-2-甲基丙烷-2-亚磺酰胺1d(250mg,2.06mmol)、钛酸四乙酯(621mg,2.72mmol) 溶于20ml的四氢呋喃中,75℃下反应过夜。反应液减压浓缩,得到的残留物通过硅胶柱层析进一步分析纯化(洗脱剂:a体系),得到((1-(2-((e)-(((r)-叔丁基亚磺酰基)
亚氨基)甲基)-4-氟苯基)氮杂环丁烷-2-基)甲基)氨基甲酸叔丁酯6c(560mg),产率:100%。
[0324]
ms m/z(esi):412.2[m 1]
[0325]
第三步
[0326]
((1-(2-((r)-1-(((r)-叔丁基亚磺酰基)氨基)乙基)-4-氟苯基)氮杂环丁烷-2-基)甲基)氨基甲酸叔丁酯
[0327]
将((1-(2-((e)-(((r)-叔丁基亚磺酰基)亚氨基)甲基)-4-氟苯基)氮杂环丁烷-2-基)甲基)氨基甲酸叔丁酯6c(560mg,1.36mmol)加入至8ml的四氢呋喃中,冷却至-65℃,滴加甲基溴化镁(5.44ml,5.44mmol,1mol/l),滴加完成后,转移至室温反应,室温下反应过夜。tlc监测反应结束,将反应液中加入30ml冰水中淬灭,以乙酸乙酯(20ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,过滤,减压浓缩,得到的残留物通过硅胶柱层析进一步分析纯化(洗脱剂:a体系),得到((1-(2-((r)-1-(((r)-叔丁基亚磺酰基)氨基)乙基)-4-氟苯基) 氮杂环丁烷-2-基)甲基)氨基甲酸叔丁酯6d(90mg),产率:15.5%。
[0328]
ms m/z(esi):428.2[m 1]
[0329]
第四步
[0330]
((1-(2-((r)-1-氨基乙基)-4-氟苯基)氮杂环丁烷-2-基)甲基)氨基甲酸叔丁酯
[0331]
将((1-(2-((r)-1-(((r)-叔丁基亚磺酰基)氨基)乙基)-4-氟苯基)氮杂环丁烷-2-基)甲基)氨基甲酸叔丁酯6d(90mg,0.21mmol)溶于5ml四氢呋喃和水(v/v=4:1)的混合溶剂中,加入碘单质(11mg,0.042mmol),50℃下反应3小时,lc-ms监测反应完毕,硫代硫酸钠溶液淬灭,加水15ml,以乙酸乙酯(20ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,过滤,减压浓缩,得到((1-(2-((r)-1-氨基乙基)-4-氟苯基)氮杂环丁烷-2-基)甲基)氨基甲酸叔丁酯6e的粗品,产物不经纯化进行下一步反应。
[0332]
第五步
[0333]
5-(((1r)-1-(2-(2-(((叔丁氧基羰基)氨基)甲基)氮杂环丁烷-1-基)-5-氟苯基)乙基)氨基)吡唑并 [1,5-a]]嘧啶-3-甲酸乙酯
[0334]
将上一步得到的((1-(2-((r)-1-氨基乙基)-4-氟苯基)氮杂环丁烷-2-基)甲基)氨基甲酸叔丁酯6e粗品、5-氯吡唑并[1,5-a]嘧啶-3-羧酸乙酯1h(52mg,0.23mmol)和n,n-二异丙基乙胺(218mg,1.69mmol)溶于3ml的正丁醇中,120℃下反应6小时。lc-ms监测反应完毕,减压浓缩,得到的残留物通过硅胶柱层析进一步分析纯化(洗脱剂:a体系),得到 5-(((1r)-1-(2-(2-(((叔丁氧基羰基)氨基)甲基)氮杂环丁烷-1-基)-5-氟苯基)乙基)氨基)吡唑并 [1,5-a]]嘧啶-3-甲酸乙酯6f(65mg),产率:60.2%。
[0335]
ms m/z(esi):513.2[m 1]
[0336]
第六步
[0337]
5-(((1r)-1-(2-(2-(((叔丁氧基羰基)氨基)甲基)氮杂环丁烷-1-基)-5-氟苯基)乙基)氨基)吡唑并 [1,5-a]嘧啶-3-羧酸
[0338]
将5-(((1r)-1-(2-(2-(((叔丁氧基羰基)氨基)甲基)氮杂环丁烷-1-基)-5-氟苯基)乙基)氨基) 吡唑并[1,5-a]]嘧啶-3-甲酸乙酯6f(65mg,0.13mmol)溶于3ml四氢呋喃、甲醇和水 (v:v:v=1:4:1)的混合溶剂中,加入一水合氢氧化锂(54mg,1.27mmol),70℃下搅拌过夜。lc-ms监测反应完毕,冷却,缓慢滴加稀盐酸调至酸性,加水10ml,以乙酸乙酯
(20ml
×
3) 萃取,合并有机相,以无水硫酸钠干燥,减压浓缩,得到5-(((1r)-1-(2-(2-(((叔丁氧基羰基) 氨基)甲基)氮杂环丁烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶-3-羧酸6g的粗品,产物不经纯化进行下一步反应。
[0339]
第七步
[0340]
5-(((1r)-1-(2-(2-(氨基甲基)氮杂环丁烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶-3-羧酸
[0341]
将上一步得到的5-(((1r)-1-(2-(2-(((叔丁氧基羰基)氨基)甲基)氮杂环丁烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶-3-羧酸6g粗品溶于2ml的二氯甲烷溶液中,再加入3ml 的盐酸二氧六环溶液,室温下反应2小时。lc-ms监测反应完毕,反应液减压浓缩,得到 5-(((1r)-1-(2-(2-(氨基甲基)氮杂环丁烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶-3-羧酸 6h的粗品,产物不经纯化进行下一步反应。
[0342]
第八步
[0343]
(3r)-6-氟-3-甲基-2,10,15,19,20,23-六氮杂五环[15.5.2.0
4,9
.0
10,13
.0
20,24
]二十四烷
ꢀ-
1(23),4(9),5,7,17(24),18,21-庚烯-16-酮
[0344]
将上一步得到的5-(((1r)-1-(2-(2-(氨基甲基)氮杂环丁烷-1-基)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶-3-羧酸6h(50mg)、五氟苯基二苯基磷酸酯(60mg,0.16mmol)和n,n-二异丙基乙胺(135mg,1.04mmol)溶于5ml二氯甲烷和n,n-二甲基甲酰胺(v:v=1.5:1)的混合溶剂中,室温下反应过夜。lc-ms监测反应完毕,加水20ml,以二氯甲烷(20ml
×
3) 萃取,合并有机相,以无水硫酸钠干燥,减压浓缩,通过制备液相得到(3r)-6-氟-3-甲基
ꢀ-
2,10,15,19,20,23-六氮杂五环[15.5.2.0
4,9
.0
10,13
.0
20,24
]二十四烷-1(23),4(9),5,7,17(24),18,21-庚烯-16-酮6(30mg),产率:73.7%。
[0345]
ms m/z(esi):367.4[m 1]
[0346]1h nmr(400mhz,dmso-d6)δ8.57(d,j=7.6hz,1h),8.22(d,j=7.0hz,2h),8.12(s,1h), 7.22(d,j=10.3hz,1h),6.92-7.11(m,2h),6.44(d,j=7.7hz,1h),5.37(s,1h),4.63(s,1h), 3.55(d,j=15.4hz,1h),3.14(s,1h),3.03(d,j=9.8hz,1h),2.24(s,1h),1.66(s,1h),1.20 (d,j=6.6hz,3h).
[0347]
实施例7
[0348]
(3r,14s)-6-fluoro-3-methyl-13-oxa-2,10,16,20,21,24-hexaazapentacyclo[16.5.2.1
10,14
.0
4,9
.0
21,25
]h exacosa-1(24),4(9),5,7,18(25),19,22-heptaen-17-one
[0349]
(3r,14s)-6-氟-3-甲基-13-氧杂-2,10,16,20,21,24-六氮杂五环[16.5.2.1
10,14
.0
4,9
.0
21,25
]二十六烷-1(24),4(9),5,7,18(25),19,22-庚烯-17-酮
[0350][0351]
第一步
[0352]
(r)-1-(5-氟-2-(2-(羟甲基)吗啉代)苯基)乙烷-1-酮
[0353]
将1-(2,5-二氟苯基)乙烷-1-酮7a(12.9g,82.6mmol)、(r)-吗啉-2-基甲醇7b(4.86g,41.4 mmol)和碳酸钾(22.9g,165.7mmol)溶于50ml的n,n-二甲基甲酰胺中,加热至120℃,反应6小时。反应结束后冷却至室温,加水100ml,以乙酸乙酯(50ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,过滤,减压浓缩,得到的残留物通过硅胶柱层析进一步分析纯化(洗脱剂:a体系),得到(r)-1-(5-氟-2-(2-(羟甲基)吗啉代)苯基)乙烷-1-酮7c(2.1g),产率:20%。
[0354]
ms m/z(esi):254.1[m 1]
[0355]
第二步
[0356]
(r)-(4-(2-乙酰基-4-氟苯基)吗啉-2-基)甲基甲磺酸盐
[0357]
将(r)-1-(5-氟-2-(2-(羟甲基)吗啉代)苯基)乙烷-1-酮7c(6g,23.68mmol)和三乙胺(9.9 ml,70.92mmol)溶于60ml的二氯甲烷中,0℃时缓慢滴加甲磺酰氯(5.42g,47.32mmol),转移至室温反应过夜。反应结束后,加饱和氯化铵溶液30ml淬灭反应,以二氯甲烷(20 ml
×
3)萃取,合并有机相,并以无水硫酸钠干燥,减压浓缩,得到(r)-(4-(2-乙酰基-4-氟苯基)吗啉-2-基)甲基甲磺酸盐7d(510mg)的粗品,产物不经纯化进行下一步反应。
[0358]
第三步
[0359]
(r)-1-(2-(2-(叠氮基甲基)吗啉代)-5-氟苯基)乙-1-酮
[0360]
将(r)-(4-(2-乙酰基-4-氟苯基)吗啉-2-基)甲基甲磺酸盐7d(510mg)溶于3ml的n,n
-ꢀ
二甲基甲酰胺溶液中,再加入叠氮化钠(200mg,3.08mmol),室温反应过夜。反应结束后,加水30ml,以乙酸乙酯(20ml
×
3)萃取,合并有机相,并以无水硫酸钠干燥,减压浓缩,得到(r)-1-(2-(2-(叠氮基甲基)吗啉代)-5-氟苯基)乙-1-酮7e(428mg)的粗品,产物不经纯化进行下一步反应。
[0361]
ms m/z(esi):279.1[m 1]
[0362]
第四步
[0363]
(r)-n-((e)-1-(2-((r)-2-(叠氮基甲基)吗啉代)-5-氟苯基)亚乙基)-2-甲基丙基-2-亚磺酰胺
[0364]
将(r)-1-(2-(2-(叠氮基甲基)吗啉代)-5-氟苯基)乙-1-酮7e(428mg,1.54mmol)、(r)-2-甲基丙烷-2-亚磺酰胺1d(373mg,3.08mmol)、钛酸四乙酯(1.41mg,6.18mmol)溶于5ml 的四氢呋喃中,70℃下反应过夜。反应结束后,减压浓缩,得到的残留物通过硅胶柱层析进一步分析纯化(洗脱剂:a体系),得到(r)-n-((e)-1-(2-((r)-2-(叠氮基甲基)吗啉代)-5-氟苯基)亚乙基)-2-甲基丙基-2-亚磺酰胺7f(280mg),产率:47.7%。
[0365]
ms m/z(esi):382.2[m 1]
[0366]
第五步
[0367]
(r)-n-((r)-1-(2-((r)-2-(叠氮基甲基)吗啉代)-5-氟苯基)乙基)-2-甲基丙烷-2-亚磺酰胺
[0368]
将(r)-n-((e)-1-(2-((r)-2-(叠氮基甲基)吗啉代)-5-氟苯基)亚乙基)-2-甲基丙基-2-亚磺酰胺7f(280mg,0.73mmol)溶于5ml的四氢呋喃中,再加入9-硼双环[3,3,1]-壬烷(3ml,1.5 mmol,0.5mol/l),室温反应过夜。反应结束后,加10ml水淬灭,以乙酸乙酯(20ml
×
3) 萃取,合并有机相,并以无水硫酸钠干燥,减压浓缩,得到的残留物通过硅胶柱层析进一步分析纯化(洗脱剂:a体系),得到(r)-n-((r)-1-(2-((r)-2-(叠氮基甲基)吗啉代)-5-氟苯基) 乙基)-2-甲基丙烷-2-亚磺酰胺7g(160mg),产率:57%。
[0369]
ms m/z(esi):384.2[m 1]
[0370]
第六步
[0371]
(r)-1-(2-((r)-2-(叠氮基甲基)吗啉代)-5-氟苯基)乙-1-胺
[0372]
将(r)-n-((r)-1-(2-((r)-2-(叠氮基甲基)吗啉代)-5-氟苯基)乙基)-2-甲基丙烷-2-亚磺酰胺 7g(160mg,0.42mmol)溶于3ml的二氯甲烷溶液中,再加入3ml的盐酸二氧六环溶液,室温下反应1小时。lc-ms监测反应完毕,反应液减压浓缩,得到(r)-1-(2-((r)-2-(叠氮基甲基)吗啉代)-5-氟苯基)乙-1-胺7h的粗品,产物不经纯化进行下一步反应。
[0373]
第七步
[0374]
5-(((r)-1-(2-((r)-2-(叠氮基甲基)吗啉代)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶-3-甲酸乙酯
[0375]
将(r)-1-(2-((r)-2-(叠氮基甲基)吗啉代)-5-氟苯基)乙-1-胺7h的粗品(116mg)、5-氯吡唑并[1,5-a]嘧啶-3-羧酸乙酯1h(115mg,0.51mmol)和n,n-二异丙基乙胺(434mg,3.36 mmol)溶于3ml的正丁醇中,120℃下反应6小时。lc-ms监测反应完毕,减压浓缩,得到的残留物通过硅胶柱层析进一步分析纯化(洗脱剂:a体系),得到5-(((r)-1-(2-((r)-2-(叠氮基甲基)吗啉代)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶-3-甲酸乙酯7i
(80mg),产率: 40.6%。
[0376]
第八步
[0377]
5-(((r)-1-(2-((s)-2-(((叔丁氧基羰基)氨基)甲基)吗啉代)-5-氟苯基)乙基)氨基)吡唑并[1,5-a] 嘧啶-3-甲酸乙酯
[0378]
将5-(((r)-1-(2-((r)-2-(叠氮基甲基)吗啉代)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶-3
-ꢀ
甲酸乙酯7i(80mg,0.17mmol)溶于5ml的甲醇中,再加入二叔丁基焦碳酸酯(45mg, 0.21mmol)和30mg的湿钯碳,氢气保护下,室温反应5小时。反应结束后,过滤,滤液减压浓缩,得到5-(((r)-1-(2-((s)-2-(((叔丁氧基羰基)氨基)甲基)吗啉代)-5-氟苯基)乙基)氨基) 吡唑并[1,5-a]嘧啶-3-甲酸乙酯7j(93mg)的粗品,产物不经纯化进行下一步反应。
[0379]
第九步
[0380]
5-(((r)-1-(2-((s)-2-(((叔丁氧基羰基)氨基)甲基)吗啉代)-5-氟苯基)乙基)氨基)吡唑并[1,5-a] 嘧啶-3-羧酸
[0381]
将5-(((r)-1-(2-((s)-2-(((叔丁氧基羰基)氨基)甲基)吗啉代)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶-3-甲酸乙酯7j(93mg)溶于3ml的四氢呋喃、甲醇和水(v:v:v=1:4:1)的混合溶剂中,加入一水合氢氧化锂(72mg,1.71mmol),75℃下搅拌过夜。lc-ms监测反应完毕,冷却,缓慢滴加稀盐酸调至酸性,加水10ml,以乙酸乙酯(20ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,减压浓缩,得到5-(((r)-1-(2-((s)-2-(((叔丁氧基羰基)氨基)甲基)吗啉代)
ꢀ-
5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶-3-羧酸7k的粗品,产物不经纯化进行下一步反应。
[0382]
第十步
[0383]
5-(((r)-1-(2-((s)-2-(氨基甲基)吗啉代)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶-3-羧酸
[0384]
将5-(((r)-1-(2-((s)-2-(((叔丁氧基羰基)氨基)甲基)吗啉代)-5-氟苯基)乙基)氨基)吡唑并 [1,5-a]嘧啶-3-羧酸7k(87mg)溶于2ml的二氯甲烷溶液中,再加入3ml的盐酸二氧六环溶液,室温下反应1小时。lc-ms监测反应完毕,反应液减压浓缩,得到5-(((r)-1-(2-((s)-2-(氨基甲基)吗啉代)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶-3-羧酸7l的粗品,产物不经纯化进行下一步反应。
[0385]
第十一步
[0386]
(3r,14s)-6-氟-3-甲基-13-氧杂-2,10,16,20,21,24-六氮杂五环[16.5.2.1
10,14
.0
4,9
.0
21,25
]二十六烷
ꢀ-
1(24),4(9),5,7,18(25),19,22-庚烯-17-酮
[0387]
将5-(((r)-1-(2-((s)-2-(氨基甲基)吗啉代)-5-氟苯基)乙基)氨基)吡唑并[1,5-a]嘧啶-3-羧酸 7l(70mg)、五氟苯基二苯基磷酸酯(78mg,0.20mmol)和n,n-二异丙基乙胺(176mg, 1.36mmol)溶于3ml二氯甲烷和n,n-二甲基甲酰胺(v:v=2:1)的混合溶剂中,室温下反应过夜。lc-ms监测反应完毕,加入饱和氯化铵溶液20ml,以二氯甲烷(20ml
×
3)萃取,合并有机相,以无水硫酸钠干燥,减压浓缩,通过制备液相得到(3r,14s)-6-氟-3-甲基-13
-ꢀ
氧杂-2,10,16,20,21,24-六氮杂五环[16.5.2.1
10,14
.0
4,9
.0
21,25
]二十六烷
ꢀ-
1(24),4(9),5,7,18(25),19,22-庚烯-17-酮7(8mg),产率:12%。
[0388]
ms m/z(esi):397.4[m 1]
[0389]
生物学评价
[0390]
测试例1、本发明化合物对trka,trkb,trkc,trka(g595r),trka(g667c) 和trkc(g623r)激酶活性测定
[0391]
以下方法用于测定本发明化合物在体外条件下对重组人源ntrk家族激酶活性的抑制程度。本方法使用cisbio公司的kinease-tk酪氨酸激酶试剂盒(货号62tk0peb),该试剂盒原理基于时间分辨荧光能量共振转移(tf-fret),通过测定ntrk激酶介导的生物素化的多肽底物的磷酸化程度来反映化合物对ntrk激酶活性的抑制强弱。详细实验操作可参考试剂盒说明书。重组人源野生型ntrk蛋白购于carna bioscience(货号分别为 trka#08-186,trkb#08-187,trkc#08-197),重组人源突变型ntrk蛋白购于signalchem(货号分别为trka g595r#n16-12bg-10,trkc g623r#n18-12ch-10)
[0392]
将实验流程简述如下:受试化合物首先溶解于dmso中制备为贮存液,随后以试剂盒中提供的缓冲液进行梯度稀释,受试化合物在反应体系中的终浓度范围为1000nm~0.004 nm。使用梯度稀释的atp溶液(生工生物工程(上海)股份有限公司,a600311)的测定每个ntrk蛋白的atp km值浓度,依据获得的km值,设定反应体系中atp的浓度分别为 trka100μm,trkb 10μm,trkc 50μm,trka(g595r)7μm,trka(g667c)1μm和 trkc(g623r)100μm。反应在384孔微孔板中进行,首先向孔中加入化合物和一定量的对应ntrk蛋白,并在室温下孵育5-10分钟,随后向反应液中加入atp溶液和生物素化的多肽底物溶液,并在室温下振荡孵育60分钟。随后向反应中加入偶联有铕系元素化合物的抗磷酸化酪氨酸抗体和偶联有修饰化的别藻蓝蛋白xl665的链酶亲和素,并在室温下继续振荡孵育1小时。孵育结束后,在酶标仪以tf-fret模式上测定各孔在激发波长为304nm,发射波长为620nm和665nm的荧光强度值。通过与对照组(0.1%dmso)的荧光强度比值进行比较,计算化合物在各浓度下的百分比抑制率,并通过graphpad prism 5软件以化合物浓度对数值-抑制率进行非线性回归分析,或得化合物的ic
50
值,见表1。
[0393]
表1本发明化合物对ntrk酶活性抑制的ic
50
数据
[0394][0395]
结论:本发明的化合物对野生型和突变型的trka、trkb和trkc激酶均有较好的抑制作用。
[0396]
备注:nd代表未测定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

