不透射线的医疗组件和装置
1.相关申请的交叉引用
2.本技术是要求2019年3月1日提交的美国临时申请62/812468、2019年4月12日提交的美国临时申请62/833102和2019年5月3日提交的欧洲专利申请ep19172531.6的优先权的国际申请,这些申请中的每个申请的全部内容在此全文以引用方式并入。
技术领域
3.所公开的发明涉及可为不透射线并且可用于医疗领域的材料、方法和装置。
背景技术:
4.医学领域中的射线不透性是指抑制在医学成像中使用的x射线或类似辐射的品质。医疗装置通常包含射线不透剂(radiopacifier)以在各种医疗程序期间增强可视化。可包含射线不透剂的装置的示例是导管、导丝、支架和植入的医疗装置。在此类装置中包括射线不透剂充当视觉识别器,使得医生能够准确地放置装置或监测永久植入的装置的位置。
5.射线不透剂的示例是铂、钛、钨、硫酸钡和氧化锆。
6.射线不透剂可以以多种不同的方式结合到医疗装置中。在金属装置中,不透射线的材料,例如铂,可以卷曲或焊接至装置上以增加射线不透性。在聚合物装置中,在使医疗装置注射成型之前,可以将射线不透剂的颗粒与聚合物共混。
7.讨论赋予聚合物制品射线不透性的文件的示例有:us5300048、us8334524、us20060058867、us20080221670、us20110305881、wo2005/030284、wo2005/065725、和wo2006/132850。
技术实现要素:
8.在开发不透射线聚合物方面存在特定挑战。第一,使用射线不透剂将增加聚合物制剂的粘度。聚合物制剂的较高粘度可能负面地影响形成不透射线的部件或涂层的容易性。第二,添加射线不透剂可能会影响所形成的部件或涂层的最终机械特性。不透射线的部件或涂层的所需机械特性将取决于医疗装置的期望功能,并且因此不透射线的聚合物部件或涂层的所得机械特性是否足够将取决于医疗装置的预期应用。第三,应该适当地调谐射线不透性。取决于装置的给定用途,不透射线部分可能需要与装置的其他元件形成对比以允许装置的正确定位或可视化。
9.形成不透射线聚合物的最常见方式是通过配混射线不透剂和基础聚合物,然后应用基于热的部件制造方法,例如挤出或注射成型,以生产部件。然而,这些类型的材料通常是硬且脆的,这是由于通常是致密金属的射线不透剂本身的硬性质,以及聚合物的非弹性(刚性)性质。虽然热处理制造方法是所选定的最明显的方法,但是它们也可能引入聚合物降解,尤其是在存在大量吸湿的射线不透剂材料(例如,硫酸钡、三氧化二铋等)的情况下。经配混的、经热处理的不透射线聚合物的硬而脆的性质使得它们不适合用于许多要求在递送和功能期间对天然组织的顺应性或高卷曲性和弹性的医疗植入物应用。
10.不透射线的聚合物部件在某些情况下也可能不适合,因为它们可能太过刚性并影响医疗装置的柔韧性或可操纵性。此类柔韧性和可操纵性对于低轮廓医疗装置(例如心血管装置)的经皮递送可能是重要的。例如,在基于导管的程序中,装置的一定柔韧性和可压缩性对于将该装置卷曲成期望的轮廓以将其递送至目标解剖位置可能是必要的。此外,不透射线的聚合物部件可以通过熔融、热收缩或以其他方式结合至医疗装置的表面而紧固至医疗装置。此类基于热的工艺可将热应力引入装置部件,降低装置部件的疲劳寿命,并增加负载下应力断裂的机会。
11.现有技术中也已经公开了不透射线的聚合物涂层或粘合剂。涂层或粘合剂可能是优选的,因为它们可以形成为医疗装置的特定几何形状,而不会显著改变装置的尺寸。然而,对于内部使用,聚合物涂层或粘合剂呈现出增加的使涂层的一部分在体内从医疗装置分离的可能性。涂层的此类剥离可导致临床并发症,例如栓塞或卒中,具体取决于含有该涂层的医疗装置的位置和性质。通常,在装置将经历相当大的运动或者装置必须在循环负载下是柔韧的情况下,装置的这种可能性增加。
12.发明人试图通过以可相对于现有技术在机械特性、缝合线保持强度、柔软度、杨氏模量、极限强度、断裂伸长率、粘度、可加工性、可用性、组装、便利性、柔韧性、卷曲性、摩擦系数、对天然组织的顺应性、可视化和/或耐久性方面有所改进的组合物和形式提供不透射线材料来克服这些挑战。
13.在一个实施方案中,医疗组件包含基于医疗组件的总重量5重量%至50重量%的聚氨酯和50重量%至95重量%的射线不透剂,其中所述医疗组件的厚度是0.025mm至1mm。医疗组件是医疗装置的部件。例如,医疗组件可以连接或以其他方式结合到医疗装置中。
14.在一个实施方案中,医疗组件的长度是5mm至100mm并且宽度是1mm至6mm。在一个实施方案中,医疗组件的缝合线保持强度是3n至10n。在一个实施方案中,聚氨酯包含主链,所述主链包含二异氰酸酯、聚合脂肪族二醇和任选的扩链剂的反应产物。在一个实施方案中,包含射线不透性的医疗装置包括缝合至医疗装置的医疗组件。
15.在一个实施方案中,组合物包含基于组合物的总干重5重量%至50重量%的聚氨酯和50重量%至95重量%的射线不透剂,以及基于组合物的总重量80重量%至99重量%的溶剂。该组合物可用于形成医疗组件或涂层。
16.本发明的医疗组件的厚度通常不能通过注射成型或挤出工艺获得。在一个实施方案中,一种形成医疗组件的方法包括以下步骤:
17.a.形成组合物,所述组合物包含基于组合物的总干重5重量%至50重量%至的聚氨酯和50重量%至95重量%的射线不透剂,以及溶剂,
18.b.将所述组合物浇铸成膜,
19.c.蒸发所述溶剂,从而获得所述医疗组件,
20.其中所述医疗组件的厚度是0.025mm至1mm。
21.在一个实施方案中,一种形成包含射线不透性的医疗装置的方法包括以下步骤:
22.a.提供医疗组件,所述医疗组件包含基于医疗组件的总重量5重量%至50重量%的聚氨酯和50重量%至95重量%的射线不透剂,其中所述医疗组件的厚度是0.025mm至1mm,
23.b.将医疗组件连接至医疗装置。
24.本文所公开的组合物、医疗组件、医疗装置和/或方法可在成膜、再现性、机械特性(例如模量、拉伸强度、伸长率、耐久性或撕裂强度、缝合线保持强度)、机械特性的各向同性、防污性、可用于形成医疗组件的组合物的粘度、工艺再现性、工艺速度、可用性、组装、便利性、可视化、耐久性、表面品质、与多种溶剂一起使用和/或健康和安全考虑方面表现出益处,例如更容易或更方便地去除残留溶剂。
附图说明
25.图1是与实施例2相关联的极限拉伸强度(mpa)的图。
26.图2是与实施例2相关联的断裂伸长率(%)的图。
27.图3是从与实施例3相关联的荧光镜获得的图像。
具体实施方案
28.根据一个实施方案,医疗组件包含基于医疗组件的总重量5重量%至50重量%的聚氨酯和50重量%至95重量%的射线不透剂,其中所述医疗组件的厚度是0.025mm至1mm。医疗装置可包括一个或多个医疗组件。根据本发明的不透射线医疗组件可以由包含聚氨酯和射线不透剂的组合物形成。所述聚氨酯由制剂形成。
29.聚氨酯
30.在一个实施方案中,聚氨酯包含主链,所述主链包含二异氰酸酯、聚合脂肪族二醇和任选的扩链剂的反应产物。在一个实施方案中,聚氨酯由主链组成,所述主链包含二异氰酸酯、聚合脂肪族二醇和任选的扩链剂的反应产物。在一个实施方案中,聚氨酯还包含端基。在一个实施方案中,聚氨酯是热塑性的。在一个实施方案中,聚氨酯是热固性的。在一个实施方案中,聚氨酯是线性的。在一个实施方案中,聚氨酯是支化的。
31.反应产物是指二异氰酸酯和聚合脂肪族二醇以及任选的扩链剂参与同时或顺序的化学反应。例如,二异氰酸酯、聚合脂肪族二醇和扩链剂的反应产物是在:i)当二异氰酸酯、聚合脂肪族二醇和扩链剂全部一起同时反应时形成的,或者ii)当首先通过使二异氰酸酯和聚合脂肪族二醇反应形成预聚物,然后使该预聚物随后与扩链剂反应时形成的。
32.在一个实施方案中,聚氨酯不含亲水聚合物部分。亲水聚合物部分的示例是聚环氧乙烷或聚噁唑啉部分。
33.在一个实施方案中,聚氨酯的数均分子量(mn)是至少10,000g/mol、50,000g/mol、100,000g/mol、150,000g/mol、200,000g/mol、或250,000g/mol。在一个实施方案中,聚氨酯的mn是1,000,000g/mol或更少、800,000g/mol或更少、700,000g/mol或更少、600,000g/mol或更少、或500,000g/mol或更少。
34.在一个实施方案中,基于医疗组件的总重量,聚氨酯在所述医疗组件中以5重量%或更多、6重量%或更多、8重量%或更多、10重量%或更多、12重量%或更多、15重量%或更多、20重量%或更多、或25重量%或更多的量存在。在一个实施方案中,基于医疗组件的总重量,聚氨酯在所述医疗组件中以50重量%或更少、45重量%或更少、40重量%或更少、35重量%或更少、30重量%或更少、25重量%或更少、20重量%或更少、15重量%或更少、或10重量%或更少的量存在。
35.在一个实施方案中,基于组合物的总干重,聚氨酯在所述组合物中以1重量%或更
多、2重量%或更多、3重量%或更多、4重量%或更多、5重量%或更多、6重量%或更多、7重量%或更多、或8重量%或更多的量存在。干重是指不含任何溶剂的组合物的总重量。在一个实施方案中,基于组合物的总干重,聚氨酯在所述组合物中以20重量%或更少、15重量%或更少、12重量%或更少、10重量%或更少、8重量%或更少、7重量%或更少、6重量%或更少、或5重量%或更少的量存在。
36.聚氨酯的各种所需和任选组分将在以下章节中进一步详细描述。
37.二异氰酸酯
38.聚氨酯的主链包含二异氰酸酯残基。在一个实施方案中,二异氰酸酯每分子包含平均至少1.9个异氰酸酯基团和每分子平均少于2.7个异氰酸酯基团。
39.在一个实施方案中,二异氰酸酯包括脂肪族二异氰酸酯。在一个实施方案中,二异氰酸酯包括芳香族二异氰酸酯。在一个实施方案中,二异氰酸酯包括4,4'
‑
二苯基甲烷二异氰酸酯(mdi)、2,4
‑
甲苯二异氰酸酯、2,6
‑
甲苯二异氰酸酯、1,4
‑
亚苯基二异氰酸酯、六亚甲基二异氰酸酯(hdi)、四亚甲基
‑
1,4
‑
二异氰酸酯、环己烷
‑
1,4
‑
二异氰酸酯、二环己基甲烷
‑
4,4'
‑
二异氰酸酯(hmdi)、异佛尔酮二异氰酸酯(ipdi),或它们的混合物。在一个实施方案中,二异氰酸酯包括六亚甲基二异氰酸酯、二环己基甲烷4,4'
‑
二异氰酸酯、异佛尔酮二异氰酸酯,或它们的混合物。在一个实施方案中,二异氰酸酯由以下物质组成:六亚甲基二异氰酸酯、二环己基甲烷4,4'
‑
二异氰酸酯、异佛尔酮二异氰酸酯,或它们的混合物。在一个实施方案中,二异氰酸酯包括4,4'
‑
二苯基甲烷二异氰酸酯(mdi)、2,4
‑
甲苯二异氰酸酯、2,6
‑
甲苯二异氰酸酯、或1,4
‑
亚苯基二异氰酸酯。在一个实施方案中,二异氰酸酯由以下物质组成:4,4'
‑
二苯基甲烷二异氰酸酯(mdi)、2,4
‑
甲苯二异氰酸酯、2,6
‑
甲苯二异氰酸酯、或1,4
‑
亚苯基二异氰酸酯,或它们的混合物。
40.在一个实施方案中,二异氰酸酯的分子量是100g/mol至500g/mol。在一个实施方案中,二异氰酸酯的分子量是150g/mol至260g/mol。
41.在一个实施方案中,形成聚氨酯所的制剂包含基于所述制剂的总重量至少10重量%、至少20重量%、至少25重量%、至少30重量%、至少35重量%、或至少40重量%的二异氰酸酯。在一个实施方案中,形成聚氨酯所的制剂包含基于所述制剂的总重量至多50重量%、至多40重量%、至多35重量%、至多30重量%、至多25重量%、或至多20重量%的二异氰酸酯。在一个实施方案中,基于聚氨酯,聚氨酯包含至少10重量%、至少20重量%、至少25重量%、至少30重量%、至少35重量%、或至少40重量%的二异氰酸酯残基。在一个实施方案中,基于聚氨酯的总重量,聚氨酯包含至多50重量%、至多40重量%、至多35重量%、至多30重量%、至多25重量%、或至多20重量%的二异氰酸酯残基。
42.聚合脂肪族二醇
43.聚氨酯包含聚合脂肪族二醇残基。聚合脂肪族二醇包含两个oh基团和主链。oh基团可以直接连接至主链,或者可以由连接键分开。例如,羟烷基封端的聚二甲基硅氧烷(甲醇封端的)是聚合脂肪族二醇。
44.在一个实施方案中,聚合脂肪族二醇包括聚(环氧烷)、聚碳酸酯、聚硅氧烷、它们的无规或嵌段共聚物或它们的混合物。在一个实施方案中,聚合脂肪族二醇包括聚碳酸酯二醇、聚硅氧烷二醇、无规或嵌段的聚碳酸酯聚硅氧烷共聚物二醇或它们的混合物。在一个实施方案中,聚合脂肪族二醇包括聚碳酸酯二醇和聚硅氧烷二醇的混合物。在一个实施方
案中,聚合脂肪族二醇由聚碳酸酯二醇和聚硅氧烷二醇的混合物组成。在一个实施方案中,聚合脂肪族二醇包括聚(环氧烷)二醇、聚碳酸酯二醇或它们的混合物。
45.在一个实施方案中,聚合脂肪族二醇包括聚(环氧乙烷)二醇、聚(环氧丙烷)二醇、聚(四亚甲基氧化物)二醇、聚(异丁烯)二醇、聚酯二醇(例如由己二酸或间苯二酸和单体二醇形成的聚酯二醇)、烷烃二醇(例如氢化聚丁二烯二醇或聚乙烯二醇)、聚(六亚甲基碳酸酯)二醇、聚(聚四氢呋喃碳酸酯)二醇、聚硅氧烷二醇、聚(环氧乙烷)和聚(环氧丙烷)的无规或嵌段共聚物二醇、聚(环氧乙烷)和聚(四亚甲基氧化物)的无规或嵌段共聚物二醇、聚(环氧乙烷)和聚硅氧烷的无规或嵌段共聚物二醇、或它们的混合物。
46.在一个实施方案中,聚合脂肪族二醇包括聚(环氧乙烷)二醇、聚(环氧丙烷)二醇、聚(四亚甲基氧化物)二醇、聚(异丁烯)二醇、聚硅氧烷二醇、聚(环氧乙烷)和聚(环氧丙烷)的无规或嵌段共聚物二醇、聚(环氧乙烷)和聚(四亚甲基氧化物)的无规或嵌段共聚物二醇、聚(环氧乙烷)和聚硅氧烷的无规或嵌段共聚物二醇、包含聚硅氧烷的无规或嵌段共聚物二醇、或它们的混合物。
47.在一个实施方案中,聚合脂肪族二醇包括聚硅氧烷二醇与聚(环氧乙烷)二醇、聚(环氧丙烷)二醇、聚(四亚甲基氧化物)二醇、聚(环氧乙烷)和聚(环氧丙烷)的无规或嵌段共聚物二醇以及聚(环氧乙烷)和聚(四亚甲基氧化物)的无规或嵌段共聚物二醇中的一者或多者的混合物。在一个实施方案中,聚合脂肪族二醇包括聚碳酸酯二醇,该聚碳酸酯二醇包括聚(六亚甲基碳酸酯)二醇或聚(聚四氢呋喃碳酸酯)二醇。在一个实施方案中,聚合脂肪族二醇由聚碳酸酯二醇组成。在一个实施方案中,聚合脂肪族二醇由聚(六亚甲基碳酸酯)二醇、聚(聚四氢呋喃碳酸酯)二醇或它们的混合物组成。在一个实施方案中,聚合脂肪族二醇包括mn为至少500g/mol、至少750g/mol、至少1000g/mol、或至少1500g/mol的聚碳酸酯二醇。在一个实施方案中,聚合脂肪族二醇包括mn为至多10,000g/mol、至多7500g/mol、至多5000g/mol、至多4000g/mol、至多3000g/mol、或至多2500g/mol的聚碳酸酯二醇。
48.在一个实施方案中,聚合脂肪族二醇包括聚硅氧烷二醇、聚碳酸酯二醇、或聚(四亚甲基氧化物)二醇。在一个实施方案中,聚合脂肪族二醇由聚硅氧烷二醇、聚碳酸酯二醇、聚(四亚甲基氧化物)二醇或它们的混合物组成。在一个实施方案中,聚合脂肪族二醇包括聚硅氧烷二醇、聚碳酸酯二醇或聚(四亚甲基氧化物)二醇中的两者或更多者的混合物。在一个实施方案中,聚合脂肪族二醇由聚硅氧烷二醇、聚碳酸酯二醇或聚(四亚甲基氧化物)二醇中的两者或更多者的混合物组成。在一个实施方案中,聚合脂肪族二醇包括聚硅氧烷二醇以及聚碳酸酯二醇和聚(四亚甲基氧化物)二醇中的一者或多者。在一个实施方案中,聚合脂肪族二醇由聚硅氧烷二醇以及聚碳酸酯二醇和聚(四亚甲基氧化物)二醇中的一者或多者组成。
49.在一个实施方案中,聚合脂肪族二醇包含基于聚合脂肪族二醇的总重量15重量%或更少、10重量%或更少、5重量%或更少、2重量%或更少的疏水性聚(环氧烷),或者不含疏水性聚(环氧烷)。疏水性聚(环氧烷)是聚(环氧丙烷)和聚(四亚甲基氧化物)。
50.在一个实施方案中,聚合脂肪族二醇包括c2‑
c
16
氟烷基二醇或c2‑
c
16
氟烷基醚二醇。在一个实施方案中,聚氨酯主链包含1h,1h,4h,4h
‑
全氟
‑
1,4
‑
丁二醇、1h,1h,5h,5h
‑
全氟
‑
1,5
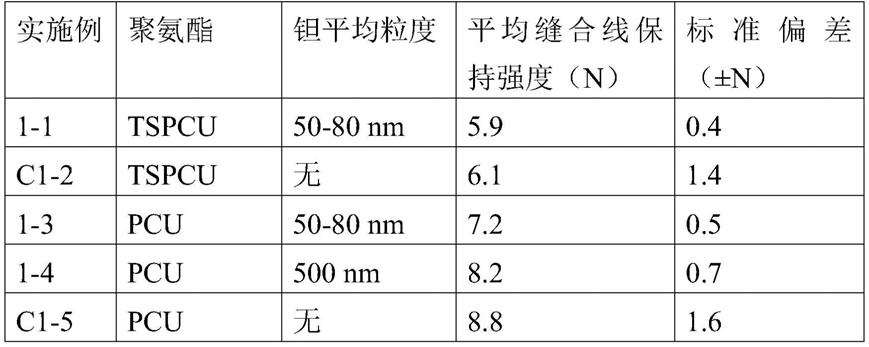
‑
戊二醇、1h,1h,6h,6h
‑
全氟
‑
1,6
‑
己二醇、1h,1h,8h,8h
‑
全氟
‑
1,8
‑
辛二醇、1h,1h,9h,9h
‑
全氟
‑
1,9
‑
壬二醇、1h,1h,10h,10h
‑
全氟
‑
1,10
‑
癸二醇、1h,1h,12h,12h
‑
全氟
‑
1,12
十二烷二醇、1h,1h,8h,8h
‑
全氟
‑
3,6
‑
二氧杂辛
‑
1,8
‑
二醇、1h,1h,11h,11h
‑
全氟
‑
3,6,9
‑
三氧杂十一烷
‑
1,11
‑
二醇、氟化三甘醇、或氟化四甘醇的残基。
51.在一个实施方案中,c2‑
c
16
氟烷基二醇或c2‑
c
16
氟烷基醚二醇的mn是至少150g/mol、至少250g/mol、或至少500g/mol。在一个实施方案中,氟烷基二醇或氟烷基醚二醇的mn是至多1500g/mol、至多1000g/mol、或至多850g/mol。在一个实施方案中,基于聚氨酯的总重量,c2‑
c
16
氟烷基二醇或c2‑
c
16
氟烷基醚二醇以至少1重量%、至少2重量%、或至少5重量%的量存在。在一个实施方案中,基于聚氨酯的总重量,c2‑
c
16
氟烷基二醇或c2‑
c
16
氟烷基醚二醇以至多15重量%、至多10重量%、或至多8重量%的量存在。
52.在一个实施方案中,聚合脂肪族二醇的mn是至少200g/mol、至少250g/mol、至少300g/mol、至少400g/mol、或至少500g/mol、至少600g/mol、至少700g/mol、至少800g/mol、至少900g/mol、或至少1000g/mol。在一个实施方案中,聚合脂肪族二醇的mn是至多10,000g/mol、至多8500g/mol、至多6000g/mol、至多5000g/mol、至多4000g/mol、至多3000g/mol、至多2000g/mol、或至多1500g/mol。
53.在一个实施方案中,聚氨酯由制剂形成,所述制剂包含基于制剂的总重量至少20重量%、至少30重量%、至少40重量%、至少50重量%、或至少60重量%的聚合脂肪族二醇。在一个实施方案中,聚氨酯由制剂形成,所述制剂包含基于制剂的总重量至多80重量%、至多70重量%、至多60重量%、或至多50重量%的聚合脂肪族二醇。在一个实施方案中,聚氨酯包含基于聚氨酯的总重量至少20重量%、至少30重量%、至少40重量%、至少50重量%、或至少60重量%的聚合脂肪族二醇残基。在一个实施方案中,聚氨酯包含基于聚氨酯的总重量至多80重量%、至多70重量%、至多60重量%、或至多50重量%的聚合脂肪族二醇残基。
54.扩链剂
55.聚氨酯可包含扩链剂残基。扩链剂是具有2个至20个碳原子的烷烃二醇,其中一个或多个碳原子可以被氧取代。在一个实施方案中,扩链剂的分子量是至少60g/mol、至少70g/mol、至少80g/mol、至少90g/mol、或至少100g/mol。在一个实施方案中,扩链剂的分子量是至多500g/mol、至多400g/mol、至多300g/mol、至多200g/mol、或至多150g/mol。在一个实施方案中,扩链剂包括乙二醇、二甘醇、丙二醇、二丙二醇、1,3
‑
丙二醇、1,4
‑
丁二醇、1,5
‑
戊二醇、1,6
‑
己二醇、或1,8
‑
辛二醇。
56.在一个实施方案中,聚氨酯由制剂形成,该制剂包含基于制剂的总重量至少1重量%、至少2重量%、至少5重量%、至少8重量%、或至少10重量%的扩链剂。在一个实施方案中,聚氨酯由制剂形成,该制剂包含基于制剂的总重量至多20重量%、至多15重量%、至多12重量%、至多10重量%、至多8重量%、或至多5重量%的扩链剂。在一个实施方案中,聚氨酯包含基于聚氨酯的总重量至少1重量%、至少2重量%、至少5重量%、至少8重量%、或至少10重量%的扩链剂残基。在一个实施方案中,聚氨酯包含基于聚氨酯的总重量至多20重量%、至多15重量%、至多12重量%、至多10重量%、至多8重量%、或至多5重量%的扩链剂残基。
57.端基
58.在一个实施方案中,聚氨酯包含一个或多个端基。端基是存在于分子的末端处的部分。在一个实施方案中,聚氨酯是线性的,并且在主链的每个末端处包含端基。在一个实
施方案中,端基是线性的。在一个实施方案中,端基是支化的。在一个实施方案中,聚氨酯包含平均至少0.1个端基、至少0.25个端基、至少0.5个端基、至少1个端基、至少1.5个端基、至少1.8个端基、约2个端基、或至少2个端基。在一个实施方案中,聚氨酯包含平均至多4个端基,平均至多2个端基、或平均至多2个端基。
59.端基可以通过使在形成聚合物主链后存在的末端异氰酸酯基团与单官能部分上的共反应性基团反应来形成。例如,末端异氰酸酯基团可以与1
‑
辛醇或辛胺反应形成c8烷基端基。端基也可能是由于在用于形成聚氨酯的制剂中包含链终止剂(例如单官能醇)而导致的。例如,用于形成聚氨酯的制剂可包含二异氰酸酯、聚合脂肪族二醇、扩链剂和单官能醇。
60.在一个实施方案中,端基包括疏水性聚(环氧烷)、亲水性聚(环氧烷)、包含亲水性聚(环氧烷)和疏水性聚(环氧烷)的共聚物、聚硅氧烷、c2‑
c
20
烷基、c2‑
c
16
氟烷基、c2‑
c
16
氟烷基醚、或它们的共聚物。在一个实施方案中,聚硅氧烷是聚(二甲基硅氧烷)。在一个实施方案中,亲水性聚(环氧烷)是聚(环氧乙烷)。在一个实施方案中,疏水性聚(环氧烷)是聚(环氧丙烷)或聚(四亚甲基氧化物)。在一个实施方案中,端基包括疏水性聚(环氧烷)、亲水性聚(环氧烷)、包含亲水性聚(环氧烷)和疏水性聚(环氧烷)的共聚物、c2‑
c
20
烷基、c2‑
c
16
氟烷基、c2‑
c
16
氟烷基醚、或它们的共聚物。此类端基可以用包括甲醇在内的单官能醇或前述胺形成。
61.在一个实施方案中,端基包括c2‑
c
16
氟烷基或c2‑
c
16
氟烷基醚。此类端基可以用包含c2‑
c
16
氟烷基或c2‑
c
16
氟烷基醚的单官能醇或胺形成。
62.在一个实施方案中,端基由包含c2‑
c
16
氟烷基或c2‑
c
16
氟烷基醚的单官能醇或胺形成。在一个实施方案中,端基由1h,1h
‑
全氟
‑
3,6
‑
二氧杂庚
‑1‑
醇、1h,1h
‑
九氟
‑1‑
戊醇、1h,1h
‑
全氟
‑1‑
己醇、1h,1h
‑
全氟
‑
3,6,9
‑
三氧杂癸
‑1‑
醇、1h,1h
‑
全氟
‑1‑
庚醇、1h,1h
‑
全氟
‑
3,6
‑
二氧杂癸
‑1‑
醇、1h,1h
‑
全氟
‑1‑
辛基醇、1h,1h
‑
全氟
‑1‑
壬醇、1h,1h
‑
全氟
‑
3,6,9
‑
三氧杂癸
‑1‑
醇、1h,1h
‑
全氟
‑1‑
癸醇、1h,1h
‑
全氟
‑1‑
十一烷基醇、1h,1h
‑
全氟
‑1‑
月桂基醇、1h,1h
‑
全氟
‑1‑
肉豆蔻醇、或1h,1h
‑
全氟
‑1‑
棕榈基醇形成。
63.在一个实施方案中,端基是单体的,并且分子量是200g/mol或更高、300g/mol或更高、或500g/mol或更高。在一个实施方案中,端基是单体的,并且分子量是1,000g/mol或更低或800g/mol或更低。在一个实施方案中,端基是聚合的,并的mn是10,000g/mol或更低、8,000g/mol或更低、6,000g/mol或更低、或4,000g/mol或更低。在一个实施方案中,端基是聚合的,并mn是500g/mol或更高、1,000g/mol或更高、或2,000g/mol或更高。
64.在一个实施方案中,基于形成聚氨酯的制剂的总重量,端基以至少0.1重量%、至少0.2重量%、至少0.3重量%、或至少0.5重量%的量存在。在一个实施方案中,基于形成聚氨酯的制剂的总重量,端基以至多3重量%、至多2重量%、或至多1重量%的量存在。在一个实施方案中,基于聚氨酯的总重量,端基以至少0.1重量%、至少0.2重量%、至少0.3重量%、或至少0.5重量%的量存在。在一个实施方案中,基于聚氨酯的总重量,端基以至多3重量%、至多2重量%、或至多1重量%的量存在。
65.射线不透剂
66.医疗组件包含射线不透剂。射线不透剂赋予医疗组件射线不透性。
67.在一个实施方案中,射线不透剂包含钽、金、铂、钨、铱、铂
‑
钨、铂
‑
铱、钯、铑、硫酸
钡、次碳酸铋、氯氧化铋、三氧化二铋、离子或非离子造影剂(例如泛影酸盐)、碘肥胺、碘海醇(iohexyl)、碘帕醇、碘酞酸盐(iothalamate)、碘佛醇、碘克酸盐(ioxaglate)和甲泛葡胺,或它们的组合。在一个实施方案中,射线不透剂包含钽、金、铂、钨,或它们的混合物或合金。
68.在一个实施方案中,射线不透剂作为颗粒存在。在一个实施方案中,射线不透剂颗粒的平均粒径是1nm或更大、5nm或更大、10nm或更大、25nm或更大、50nm或更大、100nm或更大、或200nm或更大。在一个实施方案中,射线不透剂颗粒的平均粒径是3μm或更小、2μm或更小、1000nm或更小、800nm或更小、700nm或更小、600nm或更小、500nm或更小、400nm或更小、300nm或更小、250nm或更小、200nm或更小、150nm或更小、100nm或更小、或75nm或更小。根据iso13321:1996使用光子关联光谱学(photon correlation spectroscopy,pcs)测量平均粒径。
69.在一个实施方案中,用粘合促进剂对射线不透剂进行表面处理以促进对聚氨酯的粘附。在一个实施方案中,用于形成医疗组件的组合物还包含粘合促进剂。在一个实施方案中,粘合促进剂包括甲基丙烯酸缩水甘油酯(glycidyl methacrylate,gma)改性的无规乙烯/丙烯酸酯共聚物,或gma和马来酸酐(maleic anhydride,ma)改性的无规乙烯/丙烯酸酯共聚物。这些的商业示例是由arkema生产的ax8840、ax8900和ax8930。
70.在一个实施方案中,基于医疗组件的总重量,射线不透剂在医疗组件中以50重量%或更多、55重量%或更多、60重量%或更多、65重量%或更多、70重量%或更多、75重量%或更多、80重量%或更多、85重量%或更多、86重量%或更多、87重量%或更多、88重量%或更多、89重量%或更多、或90重量%或更多的量存在。在一个实施方案中,基于医疗组件的总重量,射线不透剂在医疗组件中以95重量%或更少、92重量%或更少、90重量%或更少、88重量%或更少、86重量%或更少、84重量%或更少、82重量%或更少、80重量%或更少、或75重量%或更少的量存在。
71.在一个实施方案中,基于组合物的总干重,射线不透剂在组合物中以15重量%或更多、20重量%或更多、25重量%或更多、30重量%或更多、35重量%或更多、40重量%或更多、45重量%或更多、或50重量%或更多的量存在。在一个实施方案中,基于组合物的总干重,射线不透剂在组合物中以55重量%或更少、50重量%或更少、45重量%或更少、40重量%或更少、35重量%或更少、30重量%或更少、25重量%或更少、或20重量%或更少的量存在。
72.其他任选组分
73.在一个实施方案中,用于形成聚氨酯的制剂包含催化剂。在一个实施方案中,催化剂包括辛酸亚锡、二月桂酸二丁基锡、或胺催化剂。
74.医疗组件、组合物或制剂中可能存在的附加组分包括稳定剂,例如粘度稳定剂、表面活性剂、抗氧化剂、或润湿剂。
75.在一个实施方案中,医疗组件、组合物或制剂包含脱模剂。在一个实施方案中,脱模剂是乙烯双(硬脂酰胺)。
76.溶剂
77.用于形成医疗组件的组合物通常包含溶剂。医疗组件通常通过将包含聚氨酯、射线不透剂和溶剂的组合物浇铸成膜,以及蒸发溶剂而形成。通常,首先将聚氨酯溶于聚氨酯
中,然后将射线不透剂分散在聚氨酯中。
78.在一个实施方案中,溶剂包括四氢呋喃(thf)、甲基
‑
四氢呋喃(甲基
‑
thf)、二甲基乙酰胺(dmac)、二甲基甲酰胺(dmf)、二甲基亚砜(dmso)、二氯甲烷、氯仿、六氟异丙醇、或它们的混合物。在一个实施方案中,溶剂包括四氢呋喃(thf)、甲基
‑
四氢呋喃(甲基
‑
thf)、二甲基乙酰胺(dmac)、二甲基甲酰胺(dmf)、二甲基亚砜(dmso)、或它们的混合物。在一个实施方案中,溶剂包括四氢呋喃(thf)或甲基四氢呋喃(甲基thf)。
79.也可存在共溶剂。共溶剂构成了溶剂总量的小于50重量%。在一个实施方案中,共溶剂存在并且是甲醇、乙醇、异丁醇、丙醇、甲基乙基酮、或它们的混合物。
80.在一个实施方案中,溶剂包含40重量%或更多、50重量%或更多、或60重量%或更多的四氢呋喃(thf)、甲基
‑
四氢呋喃(甲基
‑
thf)、或它们的混合物。在一个实施方案中,基于组合物中溶剂的总量,溶剂包含40重量%或更多、50重量%或更多、或60重量%或更多的四氢呋喃(thf)、甲基
‑
四氢呋喃(甲基
‑
thf)或它们的混合物,以及1重量%至60重量%、1重量%至50重量%、或1重量%至40重量%的量的甲醇、乙醇、异丁醇、丙醇、甲基乙基酮或它们的混合物。
81.在一个实施方案中,基于组合物的总重量,溶剂在组合物中以至少60重量%、至少65重量%、至少70重量%、至少75重量%、至少80重量%、至少85重量%、至少88重量%、至少89重量%、至少90重量%、至少91重量%、至少92重量%、至少93重量%、至少94重量%、或至少95重量%的量存在。在一个实施方案中,基于组合物的总重量,溶剂在组合物中以至多99.5重量%、至多99重量%、至多98重量%、至多97重量%、至多96重量%、至多95重量%、或至多94重量%的量存在。
82.医疗组件的形成
83.聚氨酯可以如本领域中所通常已知的那样形成。可以采用催化剂。聚氨酯通常以颗粒形式提供,并且应该在使用前干燥。
84.在一个实施方案中,医疗组件由组合物形成。在一个实施方案中,组合物包含聚氨酯、射线不透剂和溶剂。
85.医疗组件可以由如下的此类组合物形成。首先,首先优选在搅拌下将聚氨酯加入至溶剂中。接下来,优选在搅拌下将射线不透剂加入至组合物中,并分散。继续搅拌,直至射线不透剂充分分散,注意避免气泡。
86.医疗组件可以通过以下方式由组合物形成:例如进行浸涂或溶剂浇铸,之后蒸发溶剂,并且如果需要的话,将涂层与基板分离以形成医疗组件。溶剂可以仅通过在环境温度下在空气中干燥来蒸发。也可以使用高温、真空和/或对流烘箱,任选地与空气干燥组合。典型的高温是40℃至90℃。在一个实施方案中,在氮气下干燥膜组分24小时之后在对流烘箱中在50℃下干燥1小时后,膜具有小于50ppm的残留溶剂含量。
87.医疗组件
88.医疗组件是独立的制品,而不是局限于基板的涂层。医疗组件可以通过将涂层与基板分离使得涂层不再局限于基板而形成。本文所公开的医疗组件可以以多种形式提供,例如长带状物、条带、圆盘或圆柱体,例如用于支架的带。在一个实施方案中,医疗组件的长度是其厚度的至少5倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍或50倍。在一个实施方案中,医疗组件的长度是其厚度的至多5000倍、2000倍、1000倍、500倍、400倍、300倍、200
倍、100倍、75倍、50倍、45倍、40倍、35倍、30倍、25倍或20倍。在一个实施方案中,医疗组件的长度是其宽度的至少1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍或10倍。在一个实施方案中,医疗组件的长度是其宽度的至多1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、11倍、12倍、13倍、14倍或15倍。
89.在一个实施方案中,医疗组件的厚度是0.025mm至1mm。在一个实施方案中,医疗组件的厚度是至少0.03mm、至少0.04mm、至少0.05mm、至少0.06mm、至少0.07mm、至少0.08mm、至少0.09mm、至少0.10mm、至少0.12mm、至少0.14mm、至少0.16mm、或至少0.18mm。在一个实施方案中,医疗组件的厚度是至多1.0mm、至多0.90mm、至多0.80mm、至多0.70mm、至多0.60mm、至多0.50mm、至多0.40mm、至多0.30mm、至多0.25mm、至多0.22mm、至多0.20mm、至多0.15mm、或至多0.10mm。
90.在一个实施方案中,医疗组件的长度是至少1mm、至少2mm、至少3mm、至少4mm、至少5mm、或至少10mm。在一个实施方案中,医疗组件的长度是至多100mm、至多75mm、至多50mm、至多30mm、至多20mm、至多15mm、至多10mm、至多9mm、至多8mm、至多7mm、至多6mm、或至多5mm。在一个实施方案中,医疗组件的宽度是至少1mm、至少2mm、至少3mm、至少4mm、或至少5mm。在一个实施方案中,医疗组件的宽度是至多10mm、至多8mm、至多7mm、至多6mm、至多5mm、或至多4mm。在一个实施方案中,医疗组件的长度是2mm至10mm并且宽度是1mm至6mm。
91.在一个实施方案中,医疗组件是带状物或条状物。这种形式允许针对最终用户的灵活性。最终用户可以将带状物修剪成合适的大小,并以提供所需射线不透性的形式将所述带状物连接至医疗装置。
92.在一个实施方案中,医疗组件被提供作为一系列可与下面的基板分离的突出部。单独的突出部可以由最终用户与下面的基板分离并连接至医疗装置。
93.医用部件的特性
94.在一个实施方案中,医疗组件的缝合线保持强度是至少3n、至少3.5n、至少4n、至少4.5n、至少5n、至少5.5n、至少6n、至少6.5n、至少7n、至少8n、至少9n、或至少10n,所述缝合线保持强度根据实施例中的过程在29
‑
37mm长度
×
2.7
‑
3.2mm宽度
×
0.17
‑
0.2mm厚度的条状物上测量。在一个实施方案中,医疗组件的缝合线保持强度是至多15n、至多14n、至多13n、至多12n、至多11n、至多10n、至多9n、至多8n、至多7n、或至多6n,所述缝合线保持强度根据实施例中的过程在29
‑
37mm长度
×
2.7
‑
3.2mm宽度
×
0.17
‑
0.2mm厚度的条状物上测量。
95.在一个实施方案中,医疗组件的缝合线保持强度是至少3n、至少3.5n at least 4n、至少4.5n、至少5n、至少5.5n、至少6n、至少6.5n、至少7n、至少8n、至少9n、或至少10n,所述缝合线保持强度根据实施例中的过程在29
‑
37mm长度
×
2.7
‑
3.2mm宽度
×
0.17
‑
0.21mm厚度的条状物上测量。在一个实施方案中,医疗组件的缝合线保持强度是至多15n、至多14n、至多13n、至多12n、至多11n、至多10n、至多9n、至多8n、至多7n、或至多6n,所述缝合线强度根据实施例中的过程在29
‑
37mm长度
×
2.7
‑
3.2mm宽度
×
0.17
‑
0.21mm厚度的条状物上测量。
96.在一个实施方案中,医疗组件的杨氏模量是至少40mpa、至少45mpa、至少50mpa、至少55mpa、至少56mpa、至少57mpa、至少58mpa、至少59mpa、至少60mpa、至少61mpa、至少62mpa、至少63mpa、至少64mpa、或至少65mpa,所述杨氏模量根据实施例中的过程测量。在一个实施方案中,医疗组件的杨氏模量是至多200mpa、至多175mpa、至多150mpa、至多125mpa、
至多100mpa、至多75mpa、至多70mpa、至多65mpa、至多64mpa、至多63mpa、至多62mpa、至多61mpa、或至多60mpa,所述杨氏模量根据实施例中的过程测量。
97.在一个实施方案中,医疗组件的杨氏模量是至少5mpa、至少6mpa、至少7mpa、至少8mpa、至少9mpa、至少10mpa、至少11mpa、至少12mpa、至少13mpa、至少14mpa、或至少15mpa,所述杨氏模量根据实施例中的过程在37℃的磷酸盐缓冲盐水中浸泡一周后测量。在一个实施方案中,医疗组件的杨氏模量是至多50mpa、至多45mpa、至多40mpa、至多35mpa、至多30mpa、至多25mpa、至多22.5mpa、至多20mpa、至多19mpa、至多18mpa、至多17mpa、至多16mpa、或至多15mpa,所述杨氏模量根据实施例中的过程在37℃的磷酸盐缓冲盐水中浸泡一周后测量。
98.在一个实施方案中,医疗组件的断裂伸长率是至少100%、至少150%、至少200%、至少250%、至少275%、至少300%、至少325%、至少350%、或至少375%,所述断裂伸长率根据实施例中的过程测量。在一个实施方案中,医疗组件的断裂伸长率是至多450%、至多425%、至多400%、至多375%、至多370%、至多365%、或至多360%,所述断裂伸长率根据实施例中的过程测量。
99.医疗装置
100.医疗组件可以附接或以其他方式结合到医疗装置中。在一个实施方案中,医疗组件在没有粘合剂帮助下紧固至医疗装置。在一个实施方案中,医疗组件用缝合线连接至医疗装置。在一个实施方案中,使用单根缝线将多个医疗组件紧固至医疗装置。
101.预期所公开的医疗组件可以为在使用前必须卷曲的医疗装置提供益处。在一个实施方案中,医疗装置包括支架、用于心脏瓣膜修复或置换的框架、或用于栓塞保护装置的框架。在一个实施方案中,医疗装置包括疝修补片。在一个实施方案中,医疗装置包括缝合至支架的多个医疗组件、用于心脏瓣膜修复或置换的框架、用于栓塞保护装置的框架、或疝修补片。
102.在一个实施方案中,医疗装置包括包含聚氨酯和射线不透剂的涂层。在一个实施方案中,用于形成医疗装置的方法包括以下步骤:在医疗装置的主体上涂覆包含聚氨酯、射线不透剂和溶剂的组合物,以及蒸发溶剂,从而形成涂层。可能需要重复涂覆和蒸发溶剂的步骤一次或多次,以形成实现所需射线不透性的足够厚的涂层。在一个实施方案中,医疗装置包括支架,其中涂层横跨支架的支柱。
103.下面的实施例进一步阐明了本发明的实施方案,但是当然不应解释为以任何方式限制权利要求的范围。
104.实施例
105.测试样品的制备
106.20
‑
80a tspcu的肖氏硬度是80sha,并且是可从dsm biomedical bv,sittard
‑
geleen nl获得的热塑性硅氧烷
‑
聚碳酸酯型聚氨酯。20
‑
80a tspcu包含约25重量%
‑
45重量%的二异氰酸酯残基、15重量%
‑
25重量%的硅氧烷二醇残基、30重量%
‑
50重量%的聚碳酸酯二醇残基、5重量%
‑
15重量%的扩链剂残基和0重量%
‑
3重量%的硅氧烷单醇残基。
107.80a pcu的肖氏硬度是80sha,并且是可从dsm biomedical bv,
sittard
‑
geleen nl获得的热塑性聚碳酸酯型聚氨酯。80a pcu包含约20重量%
‑
45重量%的二异氰酸酯残基、50重量%
‑
75重量%的聚碳酸酯二醇残基和5重量%
‑
15重量%的扩链剂残基。
108.实施例中使用的医疗组件是使用如下的80a tspcu或80a pcu颗粒形成的。聚氨酯通常具有0.5重量%
‑
2重量%的吸湿水平。重要的是将聚氨酯颗粒干燥然后将所述聚氨酯颗粒溶于溶剂中,以获得均匀溶液和改善的膜品质。目标是将聚合物干燥至小于0.05重量%的水分含量。通过首先在真空烘箱中在70℃干燥聚氨酯颗粒过夜,之后加入thf并在室温下搅拌过夜,来制备6.56质量%的tspcu在thf(lichrosolve)中的溶液或12质量%的pcu在thf中的溶液。一旦获得了均匀溶液,就在连续搅拌下以固定比率加入钽颗粒(美国纳米材料(us nanomaterials)ta纳米颗粒,高纯度,99.99%,平均粒度为50nm
‑
80nm或约500nm,金属),以获得由按干重测量计的86%w/w(30%v/v)钽/聚氨酯组成的制剂。
109.使用刮刀涂布机溶剂浇铸厚度为0.17mm
‑
0.21mm的薄膜。可能需要多遍刮刀涂布机来构建所需的厚度。将中间层风干30分钟,之后在40℃干燥1个小时,然后涂覆下一层。
110.测量方法
111.缝合线保持强度。使用超短脉冲激光(皮秒激光器800khz,18w,50mm/秒)从膜上切下呈10mm
×
30mm或3mm
×
30mm的条状物测试样品,以免材料热变形。使用低轮廓锥形针将由高强度uhmwpe纤维组成的usp 4
‑
0号市售缝线插入样品条状物的窄边的中间,距离样品边缘2mm。将缝线夹紧在专门设计用于保持缝线的气动夹具(细绳和纱线用instron part#2714
‑
040气动夹具(pneumatic action grips)且uhmwpe型细绳和纱线用instron part#2714
‑
044夹紧块)中,该气动夹具安装在通用机械测试机的上部位置上。将样品的自由端夹在安装在测试机的下部位置上的平夹具中。在每次测试开始时,将夹具至夹具的距离设定为200mm。施加0.05n的预负载,然后以50mm/min的速率拉紧缝线直至故障。记录屈服时的最大张力,并表示为缝合线保持强度。在n=4
‑
5个样品平行测定上进行测试。
112.拉伸性能。使用超短脉冲激光器(皮秒激光器800khz,18w,50mm//秒)按照iso527
‑
2:2012,part 1ba的尺寸建议,从膜上切下测试样品。在静止状态下在样品的中心测量样品的厚度。在为约20℃的环境温度和为50%相对湿度(rh)的湿度下进行测试。使用平夹具夹住测试样品的顶部和底部。在每次测试开始时,将夹具至夹具的距离设定为62mm。施加0.05n的预负载。以500mm/min的速度拉紧样品,直到失效。记录屈服时的最大张力,并计算极限拉伸强度。记录屈服前的最大伸长率,并表示为断裂伸长率。在n=3
‑
6个样品平行测定上重复测试。
113.实施例1
–
缝合线保持强度
114.根据上述过程测量缝合线保持强度。测试了10mm
×
30mm和3mm
×
30mm的条状物。10mm
×
30mm条状物的结果如下表1
‑
1中所示,并且3
×
30mm条带的结果如下表1
‑
2中所示。用c表示的实施例是不含射线不透剂的比较例。
115.表1
‑
1—实施例1的结果,10
×
30mm条状物
[0116][0117]
表1
‑
2—实施例2的结果,3
×
30mm条状物
[0118][0119]
这些实施例表明,相对于不含射线不透剂的条状物,具有射线不透剂的条状物仍然提供了可接受的缝合线保持强度。尤其是当将射线不透剂加入至聚氨酯中时,tspcu条状物显示出缝合线保持强度几乎没有降低。
[0120]
实施例2
–
拉伸性能
[0121]
根据上述程序测量拉伸性能。极限拉伸强度的结果在下表2
‑
1和图1中示出。
[0122]
表2
‑
1—极限拉伸强度
[0123][0124]
在负载射线不透剂时tspcu样品的极限拉伸强度的降低明显小于在负载射线不透剂时pcu样品的极限拉伸强度的降低。
[0125]
断裂伸长率的结果在下表2
‑
2和图2中示出。
[0126]
表2
‑
2—断裂伸长率
[0127][0128]
令人惊讶的是,在负载射线不透剂时tspcu样品的断裂伸长率的降低非常小,小于8%。因此,负载有射线不透剂的tspcu样品的断裂伸长率惊人地高。相比之下,在负载射线不透剂时pcu样品的断裂伸长率的降低要高得多(35%
‑
40%)。
[0129]
实施例3—射线不透性
[0130]
在尸体离体模型中研究了所公开的医疗组件的射线不透性。将直径为27mm并且支柱厚度为0.30mm的通用自膨胀镍钛诺支架用作模型心血管装置框架。将钽纳米颗粒(50
‑
80nm)机械分散在溶于四氢呋喃(10%w/w)中的20
‑
80a tspcu中,相当于复合物的最终固体含量中有86%w/w的钽。使用0.5cm/s的牵引速度将分散体浸涂到直径为24mm的心轴上,在环境温度下风干至少10分钟,然后在设定为40℃的烘箱中干燥至少10分钟。将该过程再重复四次,直到达到0.20mm的膜厚度。使用手术刀小心地从心轴上取下膜,并切成4mm宽并且0.20mm厚的环。通过稍微卷曲支架并使其恢复其全直径,从而使环膨胀,将所得环配合到支架的外表面上。在试验期间,将安装有复合环的支架放入聚乙烯管中以保护该支架。将含有支架和环的试管被放在已经出于其他伦理认可的研究目的被人道安乐死的50kg的羊的腹部下。将临床荧光镜(zkh7,philips)设定为血管腹部模式(70kv,6.42ma),并在尸体下方的支架和环的方向上从腹部的相对侧捕获图像。代表性的图像如图3所示。支架和不透射线的环连同羊的骨头一起在荧光镜上清晰可见。
[0131]
示例性实施方案的其他描述
[0132]
1.一种医疗组件,所述医疗组件包含基于所述医疗组件的总重量5重量%至50重量%的聚氨酯和50重量%至95重量%的射线不透剂,其中所述医疗组件的厚度是0.025mm至1mm。
[0133]
2.一种组合物,所述组合物包含基于所述组合物的总干重5重量%至50重量%的聚氨酯和50重量%至95重量%的射线不透剂,以及基于所述组合物的总重量80重量%至99重量%的溶剂。
[0134]
3.一种形成医疗组件的方法,所述方法包括以下步骤:
[0135]
a.在基板上形成组合物层,所述组合物包含基于所述组合物的总干重5重量%至50重量%的聚氨酯和50重量%至95重量%的射线不透剂,以及基于所述组合物的总重量80重量%至99重量%的溶剂,
[0136]
b.蒸发所述溶剂,从而获得干燥层,
[0137]
c.任选地通过在先前形成的层上重复步骤a和b来形成第二层或后续层,以及
[0138]
d.任选地分离所述医疗组件和所述基板。
[0139]
4.一种医疗装置,所述医疗装置包括涂层,其中所述涂层包含基于所述涂层的总重量5重量%至50重量%的聚氨酯和50重量%至95重量%的射线不透剂,其中所述涂层的厚度是0.025mm至1mm。
[0140]
5.一种医疗组件,所述医疗组件包含8重量%至20重量%的聚氨酯和80重量%至92重量%的射线不透剂,其中所述聚氨酯包含主链,所述主链包含二异氰酸酯、聚合脂肪族二醇和扩链剂的反应产物,其中所述聚合脂肪族二醇包括聚硅氧烷二醇和聚碳酸酯二醇。
[0141]
6.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯是热塑性聚氨酯。
[0142]
7.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯是线性的。
[0143]
8.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯不含亲水性聚合物部分。
[0144]
9.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯不含聚环氧乙烷和聚噁唑啉。
[0145]
10.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯不含聚环氧乙烷。
[0146]
11.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯的数均分子量(mn)是至少10,000g/mol、50,000g/mol、100,000g/mol、150,000g/mol、200,000g/mol、或250,000g/mol。
[0147]
12.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯的mn是1,000,000g/mol或更低、800,000g/mol或更低、700,000g/mol或更低、600,000g/mol或更低、或500,000g/mol或更低。
[0148]
13.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中基于所述医疗组件的总重量,所述聚氨酯在所述医疗组件中以5重量%或更多、6重量%或更多、8重量%或更多、10重量%或更多、12重量%或更多、15重量%或更多、20重量%或更多、或25重量%或更多的量存在。
[0149]
14.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中基于所述医疗组件的总重量,所述聚氨酯在所述医疗组件中以50重量%或更少、45重量%或更少、40重量%或更少、35重量%或更少、30重量%或更少、25重量%或更少、20重量%或更少、15重量%或更少、或10重量%或更少的量存在。
[0150]
15.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中基于所述组合物的总干重,所述聚氨酯在所述组合物中以1重量%或更多、2重量%或更多、3重量%或更多、4重量%或更多、5重量%或更多、6重量%或更多、7重量%或更多、或8重量%或更多的量存在。
[0151]
16.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中基于所述组合物的总干重,所述聚氨酯在所述组合物中以20重量%或更少、15重量%或更少、12重量%或更少、10重量%或更少、8重量%或更少、7重量%或更少、6重量%或更少、或5重
量%或更少的量存在。
[0152]
17.根据前述示例性实施方案中的任一实施方案所述的医疗装置,其中基于所述涂层的总重量,所述聚氨酯以5重量%或更多、6重量%或更多、8重量%或更多、10重量%或更多、12重量%或更多、15重量%或更多、20重量%或更多、或25重量%或更多的量存在。
[0153]
18.根据前述示例性实施方案中的任一实施方案所述的医疗装置,其中基于所述涂层的总重量,所述聚氨酯以50重量%或更少、45重量%或更少、40重量%或更少、35重量%或更少、30重量%或更少、25重量%或更少、20重量%或更少、15重量%或更少、或10重量%或更少的量存在。
[0154]
19.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯包含以下物质的反应产物:
[0155]
i.二异氰酸酯;
[0156]
ii.聚合脂肪族二醇;和
[0157]
iii.扩链剂。
[0158]
20.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯包含以下物质的反应产物:
[0159]
i.二异氰酸酯;
[0160]
ii.聚合脂肪族二醇;
[0161]
iii.扩链剂;和
[0162]
iv.单官能醇。
[0163]
21.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯由以下物质的反应产物组成:
[0164]
i.二异氰酸酯;
[0165]
ii.聚合脂肪族二醇;和
[0166]
iii.扩链剂。
[0167]
22.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯由以下物质的反应产物组成:
[0168]
i.二异氰酸酯;
[0169]
ii.聚合脂肪族二醇;
[0170]
iii.扩链剂;和
[0171]
iv.单官能醇。
[0172]
23.根据前述示例性实施方案中的任一实施方案所述的膜或组合物,其中所述二异氰酸酯包括脂肪族二异氰酸酯。
[0173]
24.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述二异氰酸酯包括4,4'
‑
二苯基甲烷二异氰酸酯(mdi)、2,4
‑
甲苯二异氰酸酯、2,6
‑
甲苯二异氰酸酯、1,4
‑
亚苯基二异氰酸酯、六亚甲基二异氰酸酯(hdi)、四亚甲基
‑
1,4
‑
二异氰酸酯、环己烷
‑
1,4
‑
二异氰酸酯、二环己基甲烷
‑
4,4'
‑
二异氰酸酯(hmdi)、异佛尔酮二异氰酸酯(ipdi),或它们的混合物。
[0174]
25.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述二异氰酸酯包括六亚甲基二异氰酸酯、二环己基甲烷4,4'
‑
二异氰酸
酯、异佛尔酮二异氰酸酯、或它们的混合物。
[0175]
26.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述二异氰酸酯由六亚甲基二异氰酸酯、二环己基甲烷4,4'
‑
二异氰酸酯、异佛尔酮二异氰酸酯、或它们的混合物组成。
[0176]
27.根据前述示例性实施方案中的任一实施方案所述的膜或组合物,其中所述二异氰酸酯包括芳族二异氰酸酯。
[0177]
28.根据前述示例性实施方案中的任一实施方案所述的膜或组合物,其中所述二异氰酸酯包括4,4'
‑
二苯基甲烷二异氰酸酯(mdi)、2,4
‑
甲苯二异氰酸酯、2,6
‑
甲苯二异氰酸酯、或1,4
‑
亚苯基二异氰酸酯。
[0178]
29.根据前述示例性实施方案中的任一实施方案所述的膜或组合物,其中所述二异氰酸酯由4,4'
‑
二苯基甲烷二异氰酸酯(mdi)、2,4
‑
甲苯二异氰酸酯、2,6
‑
甲苯二异氰酸酯、1,4
‑
亚苯基二异氰酸酯、或它们的混合物组成。
[0179]
30.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述二异氰酸酯每分子包含平均1.9个至2.7个异氰酸酯基团。
[0180]
31.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述二异氰酸酯的分子量是100g/mol至500g/mol、或150g/mol至260g/mol。
[0181]
32.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中形成聚氨酯的制剂包含基于形成聚氨酯的制剂的总重量至少10重量%、至少20重量%、至少25重量%、至少30重量%、至少35重量%、或至少40重量%的二异氰酸酯。
[0182]
33.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯由制剂形成,所述制剂包含基于所述制剂的总重量至多50重量%、至多40重量%、至多35重量%、至多30重量%、至多25重量%、或至多20重量%的二异氰酸酯。
[0183]
34.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯包含基于所述聚氨酯的总重量至少10重量%、至少20重量%、至少25重量%、至少30重量%、至少35重量%、或至少40重量%的二异氰酸酯残基。
[0184]
35.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯包含基于所述聚氨酯的总重量至多50重量%、至多40重量%、至多35重量%、至多30重量%、至多25重量%、或至多20重量%的二异氰酸酯残基。
[0185]
36.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中聚合脂肪族二醇包括聚(环氧烷)、聚碳酸酯、聚硅氧烷、它们的无规或嵌段共聚物或它们的混合物。
[0186]
37.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇包括聚碳酸酯二醇、聚硅氧烷二醇、无规或嵌段聚碳酸酯聚硅氧烷共聚物二醇、或它们的混合物。
[0187]
38.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇包括聚碳酸酯二醇和聚硅氧烷二醇的混合物。
[0188]
39.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇由聚碳酸酯二醇和聚硅氧烷二醇的混合物组成。
[0189]
40.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇包括聚(环氧烷)二醇、聚碳酸酯二醇、或它们的混合物。
[0190]
41.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇包括聚(环氧烷)、聚碳酸酯、它们的无规或嵌段共聚物或它们的混合物。
[0191]
42.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇包括聚(环氧乙烷)二醇、聚(环氧丙烷)二醇、聚(四亚甲基氧化物)二醇、聚(异丁烯)二醇、聚(六亚甲基碳酸酯)二醇、聚(聚四氢呋喃碳酸酯)二醇、聚硅氧烷二醇、聚(环氧乙烷)和聚(环氧丙烷)的无规或嵌段共聚物二醇、聚(环氧乙烷)和聚(四亚甲基氧化物)的无规或嵌段共聚物二醇、聚(环氧乙烷)和聚硅氧烷的无规或嵌段共聚物二醇、或它们的混合物。
[0192]
43.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇包括聚碳酸酯二醇,所述聚碳酸酯二醇包括聚(六亚甲基碳酸酯)二醇或聚(聚四氢呋喃碳酸酯)二醇。
[0193]
44.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇包括聚碳酸酯二醇。
[0194]
45.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇由聚碳酸酯二醇组成。
[0195]
46.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇由聚(六亚甲基碳酸酯)二醇、聚(聚四氢呋喃碳酸酯)二醇、或它们的混合物组成。
[0196]
47.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇包括聚硅氧烷二醇或包含聚硅氧烷的无规或嵌段共聚物二醇。
[0197]
48.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇包含c2‑
c
16
氟烷基或c2‑
c
16
氟烷基醚。
[0198]
49.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇包括1h,1h,4h,4h
‑
全氟
‑
1,4
‑
丁二醇、1h,1h,5h,5h
‑
全氟
‑
1,5
‑
戊二醇、1h,1h,6h,6h
‑
全氟
‑
1,6
‑
己二醇、1h,1h,8h,8h
‑
全氟
‑
1,8
‑
辛二醇、1h,1h,9h,9h
‑
全氟
‑
1,9
‑
壬二醇、1h,1h,10h,10h
‑
全氟
‑
1,10
‑
癸二醇、1h,1h,12h,12h
‑
全氟
‑
1,12十二烷二醇、1h,1h,8h,8h
‑
全氟
‑
3,6
‑
二氧杂辛
‑
1,8
‑
二醇、1h,1h,11h,11h
‑
全氟
‑
3,6,9
‑
三氧杂十一烷
‑
1,11
‑
二醇、氟化三甘醇、或氟化四甘醇。
[0199]
50.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯主链包含氟烷基或氟烷基醚二醇的残基。
[0200]
51.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯主链包含氟烷基或氟烷基醚二醇或二胺的残基。
[0201]
52.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中c2‑
c
16
氟烷基二醇或c2‑
c
16
氟烷基醚二醇的mn是至少150g/mol、至少250g/
mol、或至少500g/mol。
[0202]
53.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述氟烷基二醇或氟烷基醚二醇的mn是至多1500g/mol、至多1000g/mol、或至多850g/mol。
[0203]
54.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中基于所述聚氨酯的总重量,c2‑
c
16
氟烷基二醇或c2‑
c
16
氟烷基醚二醇以至少1重量%、至少2重量%、或至少5重量%的量存在。
[0204]
55.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中基于所述聚氨酯的总重量,c2‑
c
16
氟烷基二醇或c2‑
c
16
氟烷基醚二醇以至多15重量%、至多10重量%、或至多8重量%的量存在。
[0205]
56.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯主链包含1h,1h,4h,4h
‑
全氟
‑
1,4
‑
丁二醇、1h,1h,5h,5h
‑
全氟
‑
1,5
‑
戊二醇、1h,1h,6h,6h
‑
全氟
‑
1,6
‑
己二醇、1h,1h,8h,8h
‑
全氟
‑
1,8
‑
辛二醇、1h,1h,9h,9h
‑
全氟
‑
1,9
‑
壬二醇、1h,1h,10h,10h
‑
全氟
‑
1,10
‑
癸二醇、1h,1h,12h,12h
‑
全氟
‑
1,12十二烷二醇、1h,1h,8h,8h
‑
全氟
‑
3,6
‑
二氧杂辛
‑
1,8
‑
二醇、1h,1h,11h,11h
‑
全氟
‑
3,6,9
‑
三氧杂十一烷
‑
1,11
‑
二醇、氟化三甘醇、或氟化四甘醇的残基。
[0206]
57.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯主链包含嵌段,所述嵌段包含mn为至少150g/mol、至少250g/mol、或至少500g/mol的氟烷基或氟烷基醚。
[0207]
58.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中基于所述主链的总重量,所述聚氨酯的所述主链包含至少1重量%、至少2重量%、或至少5重量%的c2‑
c
16
氟烷基或c2‑
c
16
氟烷基醚。
[0208]
59.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中基于所述主链的总重量,所述聚氨酯的所述主链包含至多15重量%、至多10重量%、或至多8重量%的c2‑
c
16
氟烷基或c2‑
c
16
氟烷基醚。
[0209]
60.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇的mn是至少200g/mol、至少250g/mol、至少300g/mol、至少400g/mol、或至少500g/mol、至少600g/mol、至少700g/mol、至少800g/mol、至少900g/mol、或至少1000g/mol。
[0210]
61.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇的mn是至多10,000g/mol、至多8500g/mol、至多6000g/mol、至多5000g/mol、至多4000g/mol、至多3000g/mol、至多2000g/mol、或至多1500g/mol。
[0211]
62.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇包括mn为至少500g/mol、至少750g/mol、至少1000g/mol、或至少1500g/mol的聚碳酸酯二醇。
[0212]
63.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇包括mn为至多10,000g/mol、至多7500g/mol、至多5000g/mol、至多4000g/mol、至多3000g/mol、或至多2500g/mol的聚碳酸酯二醇。
[0213]
64.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或
医疗装置,其中所述聚合脂肪族二醇包括聚硅氧烷二醇、聚碳酸酯二醇、或聚(四亚甲基氧化物)二醇。
[0214]
65.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇由聚硅氧烷二醇、聚碳酸酯二醇、聚(四亚甲基氧化物)二醇、或它们的混合物组成。
[0215]
66.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇包括聚硅氧烷二醇、聚碳酸酯二醇或聚(四亚甲基氧化物)二醇中的两者或更多者的混合物。
[0216]
67.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇由聚硅氧烷二醇、聚碳酸酯二醇或聚(四亚甲基氧化物)二醇中的两者或更多者的混合物组成。
[0217]
68.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇包括聚硅氧烷二醇以及包括聚碳酸酯二醇和聚(四亚甲基氧化物)二醇中的一者或多者。
[0218]
69.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇由聚硅氧烷二醇以及由聚碳酸酯二醇和聚(四亚甲基氧化物)二醇中的一者或多者组成。
[0219]
70.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇不含亲水性聚合脂肪族二醇。
[0220]
71.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚合脂肪族二醇不含聚环氧乙烷。
[0221]
72.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯由制剂形成,所述制剂包含基于所述制剂的总重量至少20重量%、至少30重量%、至少40重量%、至少50重量%、或至少60重量%的聚合脂肪族二醇。
[0222]
73.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯由制剂形成,所述制剂包含基于所述制剂的总重量至多80重量%、至多70重量%、至多60重量%、或至多50重量%的聚合脂肪族二醇。
[0223]
74.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯包含基于所述聚氨酯的总重量至少20重量%、至少30重量%、至少40重量%、至少50重量%、或至少60重量%的聚合脂肪族二醇残基。
[0224]
75.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯包含基于所述聚氨酯的总重量至多80重量%、至多70重量%、至多60重量%、或至多50重量%的聚合脂肪族二醇残基。
[0225]
76.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述扩链剂的分子量是至少60g/mol、至少70g/mol、至少80g/mol、至少90g/mol、或至少100g/mol。
[0226]
77.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述扩链剂的分子量是至多500g/mol、至多400g/mol、至多300g/mol、至多200g/mol、或至多150g/mol。
[0227]
78.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述扩链剂包括乙二醇、二甘醇、丙二醇、二丙二醇、1,3
‑
丙二醇、1,4
‑
丁二醇、1,5
‑
戊二醇、1,6
‑
己二醇、或1,8
‑
辛二醇。
[0228]
79.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述扩链剂由乙二醇、二甘醇、丙二醇、二丙二醇、1,3
‑
丙二醇、1,4
‑
丁二醇、1,5
‑
戊二醇、1,6
‑
己二醇、或1,8
‑
辛二醇中的一者或多者组成。
[0229]
80.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯由制剂形成,所述制剂包含基于所述制剂的总重量至少1重量%、至少2重量%、至少5重量%、至少8重量%、或至少10重量%的扩链剂。
[0230]
81.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯由制剂形成,所述制剂包含基于所述制剂的总重量至多20重量%、至多15重量%、至多12重量%、至多10重量%、至多8重量%、或至多5重量%的扩链剂。
[0231]
82.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯包含基于所述聚氨酯的总重量至少1重量%、至少2重量%、至少5重量%、至少8重量%、或至少10重量%的扩链剂残基。
[0232]
83.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯包含基于所述聚氨酯的总重量至多20重量%、至多15重量%、至多12重量%、至多10重量%、至多8重量%、或至多5重量%的扩链剂残基。
[0233]
84.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯包含端基。
[0234]
85.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯包含线性端基。
[0235]
86.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯包含支化端基。
[0236]
87.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯包含平均至少0.1个端基、至少0.25个端基、至少0.5个端基、至少1个端基、至少1.5个端基、至少1.8个端基、或至少2个端基。
[0237]
88.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯是线性的并且在所述主链的每个末端处还包含端基。
[0238]
89.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述端基包括疏水性聚(环氧烷)、亲水性聚(环氧烷)、包含亲水性聚(环氧烷)和疏水性聚(环氧烷)的共聚物、聚硅氧烷、c2‑
c
20
烷基、c2‑
c
16
氟烷基、c2‑
c
16
氟烷基醚、或它们的共聚物。
[0239]
90.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚硅氧烷是聚(二甲基硅氧烷)。
[0240]
91.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述亲水性聚(环氧烷)是聚(环氧乙烷)。
[0241]
92.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或
医疗装置,其中所述疏水性聚(丙炔化氧)是聚(环氧丙烷)或聚(四亚甲基氧化物)。
[0242]
93.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述端基包括疏水性聚(环氧烷)、亲水性聚(环氧烷)、包含亲水性聚(环氧烷)和疏水性聚(环氧烷)的共聚物、c2‑
c
20
烷基、c2‑
c
16
氟烷基、c2‑
c
16
氟烷基醚、或它们的共聚物。
[0243]
94.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述端基由包含c2‑
c
16
氟烷基或c2‑
c
16
氟烷基醚的单官能醇或胺形成。
[0244]
95.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述端基由1h,1h
‑
全氟
‑
3,6
‑
二氧杂庚
‑1‑
醇、1h,1h
‑
九氟
‑1‑
戊醇、1h,1h
‑
全氟
‑1‑
己醇、1h,1h
‑
全氟
‑
3,6,9
‑
三氧杂癸
‑1‑
醇、1h,1h
‑
全氟
‑1‑
庚醇、1h,1h
‑
全氟
‑
3,6
‑
二氧杂癸
‑1‑
醇、1h,1h
‑
全氟
‑1‑
辛基醇、1h,1h
‑
全氟
‑1‑
壬醇、1h,1h
‑
全氟
‑
3,6,9
‑
三氧杂癸
‑1‑
醇、1h,1h
‑
全氟
‑1‑
癸醇、1h,1h
‑
全氟
‑1‑
十一烷基醇、1h,1h
‑
全氟
‑1‑
月桂基醇、1h,1h
‑
全氟
‑1‑
肉豆蔻醇、或1h,1h
‑
全氟
‑1‑
棕榈基醇形成。
[0245]
96.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述端基是单体的,并且分子量是200g/mol或更高、300g/mol或更高、或500g/mol或更高。
[0246]
97.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述端基是单体的,并且的分子量是1,000g/mol或更低或800g/mol或更低。
[0247]
98.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述端基是聚合的,并且mn是10,000g/mol或更低、8,000g/mol或更低、6,000g/mol或更低、或4,000g/mol或更低。
[0248]
99.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述端基是聚合的,并且mn是500g/mol或更高、1,000g/mol或更高、或2,000g/mol或更高。
[0249]
100.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中基于形成聚氨酯的制剂的总重量,所述端基以至少0.1重量%、至少0.2重量%、至少0.3重量%、或至少0.5重量%的量存在。
[0250]
101.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中基于形成聚氨酯的制剂的总重量,所述端基以至多3重量%、至多2重量%、或至多1重量%的量存在。
[0251]
102.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中基于所述聚氨酯的总重量,所述端基以至少0.1重量%、至少0.2重量%、至少0.3重量%、或至少0.5重量%的量存在。
[0252]
103.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中基于所述聚氨酯的总重量,所述端基以至多3重量%、至多2重量%、或至多1重量%的量存在。
[0253]
104.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述射线不透剂包含钽、金、铂、钨、铱、铂
‑
钨、铂
‑
铱、钯、铑、硫酸钡、次碳酸铋、氯氧化铋、三氧化二铋、离子或非离子造影剂如泛影酸盐、碘肥胺、碘海醇、碘帕醇、碘
酞酸盐、碘佛醇、碘克酸盐和甲泛葡胺,或它们的组合。
[0254]
105.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述射线不透剂包含钽、金、铂、钨,或它们的混合物或合金。
[0255]
106.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述射线不透剂作为颗粒存在。
[0256]
107.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述射线不透剂颗粒的平均粒径是1nm或更大、5nm或更大、10nm或更大、25nm或更大、50nm或更大、100nm或更大、或200nm或更大。
[0257]
108.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述射线不透剂颗粒的平均粒径是3μm或更小、2μm或更小、1000nm或更小、800nm或更小、700nm或更小、600nm或更小、500nm或更小、400nm或更小、300nm或更小、250nm或更小、200nm或更小、150nm或更小、100nm或更小、或75nm或更小。
[0258]
109.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述射线不透剂包括表面处理以促进至所述聚氨酯的粘附。
[0259]
110.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述组合物还包含粘合促进剂。
[0260]
111.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述粘合促进剂包括甲基丙烯酸缩水甘油酯(gma)改性的无规乙烯/丙烯酸酯共聚物、或gma和马来酸酐(ma)改性的无规乙烯/丙烯酸酯共聚物。
[0261]
112.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中基于所述医疗组件的总重量,所述射线不透剂在所述医疗组件中以50重量%或更多、55重量%或更多、60重量%或更多、65重量%或更多、70重量%或更多、75重量%或更多、80重量%或更多、85重量%或更多、86重量%或更多、87重量%或更多、88重量%或更多、89重量%或更多、或90重量%或更多的量存在。
[0262]
113.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中基于所述医疗组件的总重量,所述射线不透剂在所述医疗组件中以95重量%或更少、92重量%或更少、90重量%或更少、88重量%或更少、86重量%或更少、84重量%或更少、82重量%或更少、80重量%或更少、或75重量%或更少的量存在。
[0263]
114.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中基于所述组合物的总干重,所述射线不透剂在所述组合物中以15重量%或更多、20重量%或更多、25重量%或更多、30重量%或更多、35重量%或更多、40重量%或更多、45重量%或更多、或50重量%或更多的量存在。
[0264]
115.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中基于所述组合物的总干重,所述射线不透剂在所述组合物中以55重量%或更少、50重量%或更少、45重量%或更少、40重量%或更少、35重量%或更少、30重量%或更少、25重量%或更少、或20重量%或更少的量存在。
[0265]
116.根据前述示例性实施方案中的任一实施方案所述的医疗装置,其中基于所述涂层的总重量,所述射线不透剂以50重量%或更多、55重量%或更多、60重量%或更多、65重量%或更多、70重量%或更多、75重量%或更多、80重量%或更多、85重量%或更多、86重
量%或更多、87重量%或更多、88重量%或更多、89重量%或更多、或90重量%或更多的量存在。
[0266]
117.根据前述示例性实施方案中的任一实施方案所述的医疗装置,其中基于所述涂层的总重量,所述射线不透剂以95重量%或更少、92重量%或更少、90重量%或更少、88重量%或更少、86重量%或更少、84重量%或更少、82重量%或更少、80重量%或更少、或75重量%或更少的量存在。
[0267]
118.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中用于形成所述聚氨酯的所述制剂包含催化剂。
[0268]
119.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述催化剂包括辛酸亚锡、二月桂酸二丁基锡、或胺催化剂。
[0269]
120.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中用于形成所述聚氨酯或所述组合物的制剂包含稳定剂例如粘度稳定剂、表面活性剂、抗氧化剂、或润湿剂。
[0270]
121.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述医疗组件、所述组合物、或所述制剂包含脱模剂。
[0271]
122.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述医疗组件、所述组合物、或所述制剂包含乙烯双(硬脂酰胺)。
[0272]
123.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯包含主链,所述主链包含二异氰酸酯、聚合脂肪族二醇和任选的扩链剂的反应产物,并且其中所述聚合脂肪族二醇包含聚硅氧烷二醇和聚碳酸酯二醇。
[0273]
124.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯包含主链,所述主链由二异氰酸酯残基、聚硅氧烷二醇残基、聚碳酸酯二醇残基和扩链剂残基组成。
[0274]
125.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯由主链组成,所述主链由二异氰酸酯残基、聚硅氧烷二醇残基、聚碳酸酯二醇残基和扩链剂残基组成。
[0275]
126.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯包含主链,所述主链包含二异氰酸酯、聚合脂肪族二醇和扩链剂的反应产物,并且包含含有聚硅氧烷的端基,并且其中所述聚合脂肪族二醇包括聚硅氧烷二醇和聚碳酸酯二醇。
[0276]
127.根据前述示例性实施方案中的任一实施方案所述的医疗组件、组合物、方法或医疗装置,其中所述聚氨酯由主链和端基组成,所述主链由二异氰酸酯、聚合脂肪族二醇和扩链剂的反应产物组成,所述端基包含聚硅氧烷,并且其中所述聚合脂肪族二醇包括聚硅氧烷二醇和聚碳酸酯二醇。
[0277]
128.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中所述溶剂包括四氢呋喃(thf)、甲基
‑
四氢呋喃(甲基
‑
thf)、二甲基乙酰胺(dmac)、二甲基甲酰胺(dmf)、二甲基亚砜(dmso)、二氯甲烷、氯仿、六氟异丙醇、或它们的混合物。
[0278]
129.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中所述溶剂包括四氢呋喃(thf)、甲基
‑
四氢呋喃(甲基
‑
thf)、二甲基乙酰胺(dmac)、二甲基甲酰胺
(dmf)、或二甲基亚砜(dmso)。
[0279]
130.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中所述溶剂由四氢呋喃(thf)、甲基
‑
四氢呋喃(甲基
‑
thf)或它们的混合物组成。
[0280]
131.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中所述溶剂包含50重量%或更多或60重量%或更多的四氢呋喃(thf)、甲基
‑
四氢呋喃(甲基
‑
thf)或它们的混合物。
[0281]
132.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中所述溶剂包括四氢呋喃(thf)、甲基
‑
四氢呋喃(甲基
‑
thf)或它们的混合物,并且其中存在共溶剂,并且所述共溶剂是甲醇、乙醇、异丁醇、丙醇、甲基乙基酮、或它们的混合物。
[0282]
133.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中所述溶剂包含少于50重量%、少于40重量%、少于30重量%、少于20重量%、或少于10重量%的甲醇、乙醇、异丁醇、丙醇、甲基乙基酮、或它们的混合物。
[0283]
134.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中所述溶剂包含50重量%或更多的四氢呋喃(thf)、甲基
‑
四氢呋喃(甲基
‑
thf)或它们的混合物,以及少于50重量%的甲醇、乙醇、异丁醇、丙醇、甲基乙基酮或它们的混合物。
[0284]
135.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中基于所述组合物中溶剂的总量,所述溶剂包含40重量%或更多的四氢呋喃(thf)、甲基
‑
四氢呋喃(甲基
‑
thf)或它们的混合物,以及1重量%至60重量%的量的甲醇、乙醇、异丁醇、丙醇、甲基乙基酮或它们的混合物。
[0285]
136.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中基于所述组合物中溶剂的总量,所述溶剂包含至少40重量%的thf、甲基
‑
thf或它们的混合物,以及1重量%至60重量%的量的甲醇、乙醇或它们的混合物。
[0286]
137.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中基于所述组合物中溶剂的总量,所述溶剂包含至少40重量%的thf,以及1重量%至60重量%的量的甲醇、乙醇或它们的混合物。
[0287]
138.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中基于所述组合物中溶剂的总量,所述溶剂包含至少70重量%的thf,以及1重量%至30重量%的量的丙醇、异丁醇、甲基
‑
thf、或甲基乙基酮或它们的混合物。
[0288]
139.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中基于所述组合物中溶剂的总量,所述溶剂包含至少80重量%的thf,以及1重量%至20重量%的量的丙醇、异丁醇、甲基
‑
thf、或甲基乙基酮或它们的混合物。
[0289]
140.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中基于所述组合物中溶剂的总量,所述溶剂包含至少85重量%的thf,以及1重量%至15重量%的量的丙醇、异丁醇、甲基
‑
thf、或甲基乙基酮或它们的混合物。
[0290]
141.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中基于所述组合物中溶剂的总量,所述溶剂包含40重量%或更多、50重量%或更多、或60重量%或更多的四氢呋喃(thf)、甲基
‑
四氢呋喃(甲基
‑
thf)或它们的混合物,以及1重量%至60重量%、1重量%至50重量%、或1重量%至40重量%的量的甲醇、乙醇、异丁醇、丙醇、甲基乙基酮或它们的混合物。
[0291]
142.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中基于所述组合物的总重量,所述溶剂在所述组合物中以至少60重量%、至少65重量%、至少70重量%、至少75重量%、至少80重量%、至少85重量%、至少88重量%、至少89重量%、至少90重量%、至少91重量%、至少92重量%、至少93重量%、至少94重量%、或至少95重量%的量存在。
[0292]
143.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中基于所述组合物的总重量,所述溶剂在所述组合物中以至多99.5重量%、至多99重量%、至多98重量%、至多97重量%、至多96重量%、至多95重量%、或至多94重量%的量存在。
[0293]
144.根据前述示例性实施方案中的任一实施方案所述的组合物或方法,其中基于所述组合物的总重量,所述溶剂以85重量%至99.5重量%或90重量%至99重量%的量存在。
[0294]
145.一种医疗组件,所述医疗组件由根据前述示例性实施方案中的任一实施方案所述的组合物形成。
[0295]
146.一种形成医疗组件的方法,所述方法包括以下步骤:
[0296]
a.将所述组合物浇铸成膜,
[0297]
b.蒸发所述溶剂,从而获得所述医疗组件,
[0298]
其中所述医疗组件的厚度是0.025mm至1mm。
[0299]
147.一种医疗组件,所述医疗组件由根据前述示例性实施方案中的任一实施方案所述的方法形成。
[0300]
148.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件是长带状物、条带、圆盘或圆柱体形式。
[0301]
149.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件是带状物或条状物。
[0302]
150.一种医疗组件包装件,所述医疗组件包装件包括根据前述示例性实施方案中的任一实施方案所述的医疗组件,所述医疗组件被提供为一系列可与下面的基板分离的突出部(tab)。
[0303]
151.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的长度是其厚度的至少5倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍或50倍。
[0304]
152.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的长度是其厚度的至多5000倍、2000倍、1000倍、500倍、400倍、300倍、200倍、100倍、75倍、50倍、45倍、40倍、35倍、30倍、25倍或20倍。
[0305]
153.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的长度是其宽度的至少1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍或10倍。
[0306]
154.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的长度是其宽度的至多1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、11倍、12倍、13倍、14倍或15倍。
[0307]
155.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的厚度是0.025mm至1mm。
[0308]
156.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗
组件的厚度是至少0.3mm、至少0.4mm、至少0.05mm、至少0.06mm、至少0.07mm、至少0.08mm、至少0.09mm、至少0.10mm、至少0.12mm、至少0.14mm、至少0.16mm、或至少0.18mm。
[0309]
157.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的厚度是至多1.0mm、至多0.90mm、至多0.80mm、至多0.70mm、至多0.60mm、至多0.50mm、至多0.40mm、至多0.30mm、至多0.25mm、至多0.22mm、至多0.20mm、至多0.15mm、或至多0.10mm。
[0310]
158.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的长度是至少1mm、至少2mm、至少3mm、至少4mm、至少5mm、或至少10mm。
[0311]
159.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的长度是至多100mm、至多75mm、至多50mm、至多30mm、至多20mm、至多15mm、至多10mm、至多9mm、至多8mm、至多7mm、至多6mm、或至多5mm。
[0312]
160.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的宽度是至少1mm、至少2mm、至少3mm、至少4mm、或至少5mm。
[0313]
161.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中医疗组件的宽度是至多10mm、至多8mm、至多7mm、至多6mm、至多5mm、或至多4mm。
[0314]
162.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的长度是2mm至10mm并且宽度是1mm至6mm。
[0315]
163.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的缝合线保持强度是至少3n、至少3.5n、至少4n、至少4.5n、至少5n、至少5.5n、至少6n、至少6.5n、至少7n、至少8n、至少9n、或至少10n,所述缝合线保持强度根据实施例中的过程在30mm长度
×
3mm宽度
×
0.17
‑
0.2mm厚度的条状物上测量。
[0316]
164.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的缝合线保持强度是至多15n、至多14n、至多13n、至多12n、至多11n、至多10n、至多9n、至多8n、至多7n、或至多6n,所述缝合线保持强度根据实施例中的过程在30mm长度
×
3mm宽度
×
0.17
‑
0.2mm厚度的条状物上测量。
[0317]
165.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的缝合线保持强度是至少3n、至少3.5n、至少4n、至少4.5n、至少5n、至少5.5n、至少6n、至少6.5n、至少7n、至少8n、至少9n、或至少10n,所述缝合线保持强度根据实施例中的过程在30mm长度
×
3mm宽度
×
0.17
‑
0.21mm厚度的条状物上测量。
[0318]
166.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的如根据实施例中的程序在30mm长度
×
3mm宽度
×
0.17
‑
0.21mm厚度的条状物上测量的缝合线保持强度是至多15n、至多14n、至多13n、至多12n、至多11n、至多10n、至多9n、至多8n、至多7n、或至多6n,所述缝合线保持强度根据实施例中的过程在30mm长度
×
3mm宽度
×
0.17
‑
0.21mm厚度的条状物上测量。
[0319]
167.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的杨氏模量是至少40mpa、至少45mpa、至少50mpa、至少55mpa、至少56mpa、至少57mpa、至少58mpa、至少59mpa、至少60mpa、至少61mpa、至少62mpa、至少63mpa、至少64mpa、或至少65mpa,所述杨氏模量根据实施例中的过程测量。
[0320]
168.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗
组件的杨氏模量是至多200mpa、至多175mpa、至多150mpa、至多125mpa、至多100mpa、至多75mpa、至多70mpa、至多65mpa、至多64mpa、至多63mpa、至多62mpa、至多61mpa、或至多60mpa,所述杨氏模量根据实施例中的过程测量。
[0321]
169.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的杨氏模量是至少5mpa、至少6mpa、至少7mpa、至少8mpa、至少9mpa、至少10mpa、至少11mpa、至少12mpa、至少13mpa、至少14mpa、或至少15mpa,所述杨氏模量根据实施例中的过程在37℃的磷酸盐缓冲盐水中浸泡一周后测量。
[0322]
170.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的杨氏模量是至多50mpa、至多45mpa、至多40mpa、至多35mpa、至多30mpa、至多25mpa、至多22.5mpa、至多20mpa、至多19mpa、至多18mpa、至多17mpa、至多16mpa、或至多15mpa,所述杨氏模量根据实施例中的过程在37℃的磷酸盐缓冲盐水中浸泡一周后测量。
[0323]
171.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的断裂伸长率是至少100%、至少150%、至少200%、至少250%、至少275%、至少300%、至少325%、至少350%、或至少375%,所述断裂伸长率根据实施例中的过程测量。
[0324]
172.根据前述示例性实施方案中的任一实施方案所述的医疗组件,其中所述医疗组件的断裂伸长率是至多450%、至多425%、至多400%、至多375%、至多370%、至多365%、或至多360%,所述断裂伸长率根据实施例中的过程测量。
[0325]
173.一种医疗装置,所述医疗装置包括根据前述示例性实施方案中的任一实施方案所述的医疗组件或其一部分。
[0326]
174.一种医疗装置,所述医疗装置通过附接根据前述示例性实施方案中的任一实施方案所述的医疗组件或其一部分而形成。
[0327]
175.一种医疗装置,所述医疗装置包括根据前述示例性实施方案中的任一实施方案所述的医疗组件或其一部分,所述医疗组件或其一部分在没有粘合剂帮助下连接至所述医疗装置的主体。
[0328]
176.一种医疗装置,所述医疗装置包括根据前述示例性实施方案中的任一实施方案所述的医疗组件或其一部分,所述医疗组件或其一部分通过缝线连接至所述医疗装置的主体。
[0329]
177.一种医疗装置,所述医疗装置包括根据前述示例性实施方案中的任一实施方案所述的多个医疗组件或其多个部分,所述多个医疗组件或其多个部分通过缝线连接至所述医疗装置的主体。
[0330]
178.一种医疗装置,所述医疗装置包括根据前述示例性实施方案中的任一实施方案所述的多个医疗组件或其多个部分,所述多个医疗组件或其多个部分通过单根缝线连接至所述医疗装置的主体。
[0331]
179.一种医疗装置,所述医疗装置包括支架、用于心脏瓣膜修复或置换的框架、或用于栓塞保护装置的框架,以及根据前述示例性实施方案中的任一实施方案所述的医疗组件或其一部分。
[0332]
180.一种医疗装置,所述医疗装置包括疝修补片和根据前述示例性实施方案中的任一实施方案所述的医疗组件或其一部分。
[0333]
181.一种医疗装置,所述医疗装置包括根据前述示例性实施方案中的任一实施方
案所述的多个医疗组件或其多个部分,所述多个医疗组件或其多个部分缝合至支架、用于心脏瓣膜修复或置换的框架、用于栓塞保护装置的框架、或疝修补片。
[0334]
182.根据前述示例性实施方案中的任一实施方案所述的医疗装置,其中所述医疗装置包括支架、用于心脏瓣膜修复或置换的框架、用于栓塞保护装置的框架、或疝修补片。
[0335]
183.一种医疗装置,所述医疗装置包括由根据前述示例性实施方案中的任一实施方案所述的组合物形成的涂层。
[0336]
184.一种形成医疗装置的方法,所述方法包括将根据前述示例性实施方案中的任一实施方案所述的医疗组件或其一部分连接至所述医疗装置的主体的步骤。
[0337]
185.一种形成医疗装置的方法,所述方法包括通过缝线将根据前述示例性实施方案中的任一实施方案所述的医疗组件或其一部分连接至所述医疗装置的主体的步骤。
[0338]
186.一种形成医疗装置的方法,所述方法包括将根据前述示例性实施方案中的任一实施方案所述的医疗组件或其一部分缝合至所述医疗装置的主体的步骤。
[0339]
187.一种形成医疗装置的方法,所述方法包括以下步骤
[0340]
a.将根据前述示例性实施方案中的任一实施方案所述的组合物涂覆至医疗装置的主体,以及
[0341]
b.蒸发所述溶剂。
[0342]
188.根据前述示例性实施方案所述的方法,其中所述涂层通过喷涂或浸涂形成。
[0343]
189.一种涂层,所述涂层由根据前述示例性实施方案中的任一实施方案所述的组合物形成。
[0344]
190.一种涂层,所述涂层由根据前述示例性实施方案中的任一实施方案所述的组合物形成,其中所述涂层的厚度是0.025mm至1mm。
[0345]
191.一种医疗装置,所述医疗装置包括涂层,所述涂层由根据前述示例性实施方案中的任一实施方案所述的组合物形成。
[0346]
192.一种医疗装置,所述医疗装置包括涂层,所述涂层由根据前述示例性实施方案中的任一实施方案所述的组合物形成,其中所述涂层的厚度是0.025mm至1mm。
[0347]
193.一种医疗装置,所述医疗装置包括支架和根据前述示例性实施方案中的任一实施方案所述的涂层,其中所述涂层横跨所述支架的支柱。
[0348]
除非在此另外指明或者明显与上下文相矛盾,否则在描述本发明的上下文中(尤其是在以下权利要求的上下文中)术语“一”和“一个”和“该”以及类似的指示词的使用应被解释为涵盖单数和复数两者。除非另有说明,否则术语“包含”、“具有”、“包括”和“含有”应被解释为开放式术语(即,意思是“包括但不限于”)。除非本文另有指示,否则本文中对值范围的描述仅旨在用作引用落入该范围的每个单独值的速记方法,并且每个单独值并入本说明书中,如同其在本文中被单独引用一样。除非以其他方式要求保护,否则本文提供的任何和所有示例、或例示性语言(例如“例如”)的使用仅旨在更好地说明本发明,而不是对本发明的范围构成限制。说明书中的任何语言都不应被解释为表示任何不要求保护的要素对于本发明的实践为必不可少的。
[0349]
本文描述了本发明的优选实施方案,包括本发明人已知的用于实现本发明的最佳方式。通过阅读前述说明,那些优选实施方案的变型对于本领域普通技术人员而言将变得显而易见。本发明人希望技术人员适当地采用此类变型,并且本发明人希望以不同于本文
具体描述的方式实践本发明。因此,本发明包括适用法律所允许的本文所附权利要求中所述主题的所有修改和等同物。尽管某些任选特征被描述为本发明的实施方案,但是该描述意在包括并具体公开这些实施方案的所有组合,除非另外明确指出或物理上不可能。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

