1.要求保护的主题整体涉及组织部位的治疗,并且更具体地但不限于涉及用于施加到组织部位诸如伤口的组合物和装置,包括敷料和敷料部件,并且涉及与其相关的方法。
背景技术:
2.通常表征为“敷料”的多种材料和装置通常是本领域已知的,用于治疗伤口或其他组织破坏。此类伤口可以是创伤、外科手术或疾病的结果,并且可能会影响皮肤或其他组织。一般来讲,敷料可控制出血、吸收伤口渗出物、缓解疼痛、有助于对伤口进行清创、保护伤口组织免受感染或换句话讲促进愈合并保护伤口免受进一步损伤。
3.一些敷料可保护组织免受与伤口相关的感染,或者甚至有助于治疗与伤口相关的感染。感染可延缓伤口愈合,并且如果不治疗,可导致组织损失、全身感染、感染性休克和死亡。包含抗微生物剂的多种敷料是本领域已知的。然而,仍然需要具有一种或多种特性的改进的组合物,所述特性诸如改善的抗微生物功效、改善的伤口愈合、改善的血液和伤口渗出物的吸收、改善的伤口保护、降低的成本以及更易于使用。
技术实现要素:
4.用于例如敷料部件中的组合物、包括此类部件的敷料以及与其相关的方法在所附权利要求书中示出。还提供了例示性实施方案以使得本领域的技术人员能够制造和使用要求保护的主题。
5.在一个方面,提供了一种敷料,该敷料包括吸收性抗微生物层和生物可吸收层。在本文的任何实施方案中,吸收性层可包含吸收性纤维和抗微生物纤维。在本文的任何实施方案中,生物可吸收层可包含细胞外聚合物物质(eps)活性剂。生物可吸收层可被构造成降解生物膜的至少一部分。
6.在一个相关方面,提供了一种用于向组织部位提供治疗的系统,该系统包括本文所公开的任何实施方案的敷料。在另一个相关方面,提供了一种用于向组织部位提供治疗的方法,其中该方法包括将本文所公开的任何实施方案的敷料定位成邻近组织部位。
附图说明
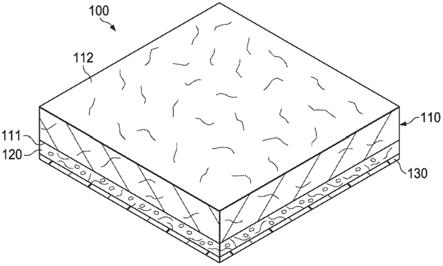
7.图1a是本技术的敷料的实施方案的剖面透视图的例示性表示。
8.图1b是本技术的敷料的实施方案的剖面透视图的例示性表示。
9.图1c是本技术的敷料的实施方案的剖面透视图的例示性表示。
10.图1d是本技术的敷料的实施方案的剖面透视图的例示性表示。
11.图2是图1c的敷料的剖面透视图的例示性表示,该敷料包括一个或多个附加部件。
12.图3是包括本技术的敷料的负压治疗系统的示例性实施方案的简化示意图。
13.图4是根据实施例的敷料对24小时铜绿假单胞菌生物膜的影响的图形表示。
14.应当指出的是,本文示出的附图中提供的代表性图示旨在示出示例性实施方案的
一般特征和/或特性,以帮助完整描述本技术。附图可能未精确地反映任何给定实施方案的特性,并且不一定旨在限定或限制要求保护的主题的范围。另外,本技术可包括或可不包括在任何一个或多个附图中提供的特性组的任何一个或多个特征,或者可结合或不结合在任何一个或多个附图中提供的特性组的任何一个或多个特征。
具体实施方式
15.以下描述提供了使得本领域的技术人员能够制造和使用所附权利要求中阐述的主题的信息,但可省略本领域中已熟知的某些细节。因此,以下具体实施方式应视为示例性的而非限制性的。
16.本文还可参考各种元件之间的空间关系或附图中描绘的各种元件的空间取向来描述示例性实施方案。一般来讲,此类关系或取向假设在待接受治疗的位置中与患者一致或相对于患者的参照系。然而,如本领域的技术人员应当认识到的,该参照系仅为描述性便利的而非严格的规定。
17.本技术提供了抗微生物敷料、其各个层和包括此类敷料和/或层的治疗系统,以及包括此类敷料、其各个层和/或治疗系统的本文所公开的任何实施方案的方法。一般来讲,并且如本文将公开,本技术的敷料可被构造成向组织部位提供治疗。
18.以下术语通篇使用,如下文所定义。
19.如本文和所附权利要求书中所用,除非本文另外指明或明确地与上下文矛盾,否则在描述要素的上下文中(尤其是在以下权利要求书的上下文中)的单数冠词“一个”、“一种”和“该”以及类似指代物应理解为涵盖单数和复数。除非本文另外指明,否则本文详述的值范围仅旨在充当单独指出落在该范围内的每个独立值的一种简便方法,并且每个独立值就像在本文中单独引用那样包括在说明书中。除非本文另外指明或明确地与上下文矛盾,否则本文所述的所有方法都可以按照任何合适的顺序进行。除非另外说明,否则本文提供的任何和全部实例或示例性语言(例如,“诸如”)的使用仅仅旨在更好地举例说明实施方案,而非用来限制权利要求的范围。本说明书中的任何语言都不应理解为表明任何不受权利要求书保护的要素是必需的。
20.如本文所用,“约”将为本领域的普通技术人员所理解,并且在某种程度上取决于其使用的上下文而变化。如果该术语的使用对于本领域的普通技术人员来说是不清楚的,则考虑到其使用的上下文,“约”将意味着多达具体项的
±
10%。
21.如本领域的技术人员将理解的那样,出于任何和所有目的,特别是在提供书面描述方面,本文所公开的所有范围还涵盖任何和所有可能的子范围及其子范围的组合。任何列出的范围可以容易地被识别为充分描述并使得相同的范围被分解成至少相等的一半、三分之一、四分之一、五分之一、十分之一等。作为非限制性示例,本文讨论的每个范围可以被容易地分解成下三分之一、中三分之一和上三分之一等。如本领域的技术人员还将理解的那样,所有语言如“多达”、“至少”、“大于”、“小于”等包括所述数字,并且是指随后可分解成如上所述的子范围的范围。最后,如本领域的技术人员将理解的那样,范围包括每个单独的成员。因此,例如,具有1
‑
3个原子的基团是指具有1个、2个或3个原子的基团。类似地,具有1
‑
5个原子的基团是指具有1个、2个、3个、4个或5个原子的基团,等等。
22.如本领域的普通技术人员所理解的那样,“分子量”(也称为“相对摩尔质量”)是无
量纲量,但通过乘以1克/摩尔转换为摩尔质量,例如,重均分子量为5000的胶原蛋白具有5000g/mol的重均摩尔质量。
23.如本文所用,术语“生物膜”是指可被包封或嵌入基质材料中的微生物(例如单个或多个菌种)的缔合,所述基质材料可由驻留微生物自我产生。生物膜可存在或附着到活的和/或无生命的表面,例如组织、伤口、医疗植入物,诸如但不限于矫形植入物、牙科植入物、导管、支架等。示例性微生物包括但不限于细菌,例如革兰氏阴性细菌,诸如铜绿假单胞菌(pseudomonas aeruginosa);革兰氏阳性细菌,诸如金黄色葡萄球菌(staphylococcus aureus)和变异链球菌(streptococcus mutans);以及真菌,诸如酵母,例如白色念珠菌(candida albicans)。术语“基质材料”旨在涵盖细胞外聚合物物质。示例性基质材料包括但不限于多糖、糖蛋白和/或核酸。术语“生物膜”还旨在包括在水性环境中的界面处发展并持续的生物膜。语言“生物膜发展”或“生物膜形成”旨在包括生物膜结构所包含的细菌菌落的形成、生长和修饰,以及生物膜结构的胞外多糖的合成和维持。“减少”或“破坏”生物膜包括减少构成生物膜的至少一部分的总活微生物的数量,例如,如通过微生物(例如,细菌、酵母)的总活菌计数(tvc)所测量。
24.如本文所用,“组织部位”是指位于组织上或组织内的伤口、缺损或其他治疗靶标,包括但不限于骨组织、脂肪组织、肌肉组织、神经组织、真皮组织、血管组织、结缔组织、软骨、肌腱或韧带。伤口可包括慢性伤口、急性伤口、创伤伤口、亚急性伤口和开裂伤口、部分皮层烧伤、溃疡(诸如糖尿病性溃疡、压迫性溃疡或静脉功能不全溃疡)、皮瓣、移植物或它们中的任何两种或更多种的组合物。术语“组织部位”还可指任何组织的区域,其不一定受伤或有缺陷,而是其中可能期望添加或促进附加组织生长的区域。
25.如本文所用,术语“有效量”是指足以实现期望治疗效果的量,例如导致本文所述的伤口或与本文所述的伤口相关的一种或多种迹象或症状减少的量。在治疗应用的上下文中,施用于受试者的组合物的量将根据组合物、伤口的程度、类型和严重性以及个体的特性而变化。该组合物还可与一种或多种附加的治疗化合物组合施用。在本文所述的方法中,可将治疗组合物施用于具有一个或多个伤口的受试者。
26.如本文所用,术语“个体”、“患者”或“受试者”可为生物个体、脊椎动物、哺乳动物或人。在一些实施方案中,个体、患者或受试者为人。
27.如本文所用,“治疗”包括:(i)抑制受试者的伤口,即,阻止其发展;(ii)缓解受试者的伤口,即,引起伤口的消退;(iii)减缓受试者的伤口的进展;和/或(iv)抑制、缓解和/或减缓受试者的伤口的一种或多种症状的进展。此类治疗意指与伤口相关的症状被例如缓和、减轻、治愈或置于缓解状态。
28.还应当理解,如本文所述的伤口的各种治疗模式旨在意指“实质的”,其包括全部治疗,但也包括少于全部治疗,并且其中实现了一些生物学或医学相关的结果。该治疗可以是对慢性伤口的连续长期治疗,或者是用于治疗急性伤口的单次或几次施用。
29.本技术的敷料
30.在一个方面,本技术提供了一种敷料,该敷料包括吸收性抗微生物层和生物可吸收层。生物可吸收层包含细胞外聚合物物质(eps)活性剂。图1a提供了敷料100的例示性图示,该敷料包括吸收性抗微生物层110和生物可吸收层120。在本文的任何实施方案中,敷料可包括各层,包括但不限于吸收性抗微生物层、生物可吸收层、非粘附层。例如,在本文的任
何实施方案中,敷料可包括吸收性抗微生物层、被构造成覆盖吸收性抗微生物层的一个或多个表面的生物可吸收层以及被构造成覆盖生物可吸收层的与吸收性抗微生物层相对的表面的非粘附层。在本文的任何实施方案中,生物可吸收层可位于吸收性抗微生物层与非粘附层之间。
31.吸收性抗微生物层
32.在本文的任何实施方案中,吸收性抗微生物层可为具有大致平坦的构型的片材,该片材包括彼此相对的两个大致平坦的表面以及大致正交于平坦表面的厚度。如本文所用,“平坦表面”是指通常被认为是平的或能够被平放的表面。例如,在本文的任何实施方案中,大致平坦的表面可包括微小的起伏和/或偏差。例如,图1a示出了吸收性抗微生物层110,该吸收性抗微生物层包括第一平坦表面111(例如,面向伤口的表面)和第二平坦表面112(例如,背部表面)。在本文的任何实施方案中,吸收性抗微生物层可包括表面积为约1cm2至约400cm2,诸如约2cm2至约200cm2或约4cm2至约100cm2的平坦表面;因此,本文的任何实施方案中所包括的吸收性抗微生物层的表面积可具有约1cm2、约2cm2、约3cm2、约4cm2、约5cm2、约6cm2、约7cm2、约8cm2、约9cm2、约10cm2、约11cm2、约12cm2、约13cm2、约14cm2、约15cm2、约16cm2、约17cm2、约18cm2、约19cm2、约20cm2、约25cm2、约30cm2、约40cm2、约50cm2、约55cm2、约60cm2、约65cm2、70cm2、约75cm2、约80cm2、约85cm2、约90cm2、约95cm2、约100cm2、约150cm2、约200cm2、约250cm2、约300cm2、约350cm2、约400cm2或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围的表面积。吸收性抗微生物层可被构造成具有多种形状,包括但不限于正方形、矩形、椭圆形、五边形、圆形或椭圆形。
33.在本文的任何实施方案中,吸收性抗微生物层可包括表现出和/或赋予一个或多个期望特性或参数的基底或基质。例如,在本文的任何实施方案中,吸收性抗微生物层可包含抗微生物材料。抗微生物材料可为允许将抗微生物材料结合到吸收性抗微生物层中的任何合适的形式,包括但不限于抗微生物纤维。例如,在本文的任何实施方案中,抗微生物纤维的平均长度可为约0.25英寸至约6英寸,诸如约0.5英寸至约4英寸或约0.75英寸至约3英寸;因此,本文的任何实施方案中所包括的抗微生物纤维的平均长度可为约0.25英寸、约0.5英寸、约0.75英寸、约1英寸、约1.25英寸、约1.50英寸、约1.75英寸、约2英寸、约2.25英寸、约2.50英寸、约2.75英寸、约3英寸、约3.25英寸、约3.50英寸、约3.75英寸、约4英寸、约4.25英寸、约4.50英寸、约4.75英寸、约5英寸、约5.25英寸、约5.50英寸、约5.75英寸、约6英寸或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。抗微生物纤维的旦尼尔/长丝(dpf)可为约0.5dpf至约40dpf,诸如约0.75dpf至约30dpf或约1dpf至约10dpf;因此,本文的任何实施方案中所包括的抗微生物纤维的旦尼尔可为约0.5dpf、约1dpf、约1.5dpf、约2dpf、约3dpf、约4dpf、约5dpf、约6dpf、约7dpf、约8dpf、约9dpf、约10dpf、约11dpf、约12dpf、约13dpf、约14dpf、约15dpf、约16dpf、约17dpf、约18dpf、约19dpf、约20dpf、约25dpf、约30dpf、约35dpf、约40dpf或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。
34.在本文的任何实施方案中,抗微生物材料可包括具有抗微生物涂层的基体纤维。基体纤维可包含合成材料。合适的合成材料可包括但不限于聚酰胺、聚烯烃、聚酯、聚丙烯、聚乙烯(例如,高分子量聚乙烯(hmwp))或它们中的两种或更多种的组合物。因此,在本文的任何实施方案中,基体纤维可包含聚酰胺,诸如尼龙。
35.在本文的任何实施方案中,抗微生物涂层可为金属涂层,例如银涂层。银涂层可包含金属形式、离子形式(例如,银盐,诸如乙酸银和/或柠檬酸银)或它们的组合物的银。在本文的任何实施方案中,金属涂层可包含与一种或多种附加金属组合的银,所述附加金属包括但不限于金、铂、铁锰、铜、锌或它们中的两种或更多种的组合物。
36.在本文的任何实施方案中,吸收性抗微生物层可包括安全有效量的抗微生物涂层。如本文所述,“安全有效量”是足以具有期望效果(例如,相对于银的抗微生物活性)而没有不当的不利副作用(诸如毒性、刺激性或过敏反应)的量,当以该技术的方式使用时,与合理的效/险比相称。银或另一种抗微生物涂层的具体安全有效量可根据诸如银的形式、基质中其他材料的类型和量、预期用途以及对其使用敷料的受试者的身体状况之类的因素而变化。
37.吸收性抗微生物层可包含至少约90%的具有银涂层的基体纤维,诸如至少约95%的具有银涂层的基体纤维或约100%的具有银涂层的基体纤维;因此,在本文的任何实施方案中,吸收性抗微生物层中的具有银涂层的基体纤维的量可为约90%、约91%、约92%、约93%、约94%、约95%、约98%、约99%、约100%或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。另外,基体纤维上的银涂层的量可为按抗微生物纤维的重量计约4%至约75%,诸如按抗微生物纤维的重量计约8%至约60%或按抗微生物纤维的重量计约12%至约30%;因此,基体纤维上的银涂层的量可为(按抗微生物纤维的重量计)约4%、约6%、约8%、约10%、约12%、约14%、约16%、约18%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。合适的抗微生物纤维(例如,具有银涂层的基体纤维)及其制备方法公开于美国专利7385101中,该专利全文以引用方式并入本文。
38.在本文的任何实施方案中,抗微生物涂层可包含聚己缩胍(也称为聚六亚甲基双胍或phmb)、氯己定、聚维酮碘、三氯生、硫糖铝、季铵盐或它们中的任何两种或更多种的组合物。
39.在本文的任何实施方案中,吸收性抗微生物层可包含吸收性材料。吸收性材料可包括能够吸收水性介质的材料,所述水性介质包括但不限于水、血液和/或伤口渗出物。当与足量的水性介质接触时,吸收性材料可形成凝胶。例如,在本文的任何实施方案中,吸收性材料可以至少约10克/克吸收性材料,诸如约15克、20克或25克/克吸收性材料的量吸收水性介质;因此,在本文的任何实施方案中,每克吸收性材料所吸收的水性介质的量可包括约10克、约11克、约12克、约13克、约14克、约15克、约16克、约17克、约18克、约19克、约20克、约21克、约22克、约23克、约24克、约25克或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。本文的任何实施方案的吸收性材料可为用于结合到吸收性抗微生物层内的任何合适的形式。例如,在本文的任何实施方案中,吸收性材料可包括凝胶、水凝胶、纤维、珠粒、颗粒或它们中的两种或更多种的组合物。因此,在本文的任何实施方案中,吸收性材料可包含吸收性纤维。
40.在本文的任何实施方案中,吸收性材料可包含相对于哺乳动物表现出合适的吸收特性并且不表现出毒性或免疫原性的材料,例如多糖。适合用作吸收性材料的多糖的示例包括水解胶体、纤维素材料、透明质酸、透明质酸盐或它们中两种或更多种的组合物。合适
的水解胶体包括但不限于藻酸和藻酸盐、瓜耳胶、刺槐豆胶、果胶、明胶、黄原胶、刺梧桐树胶、脱乙酰壳多糖或它们中的两种或更多种的组合物。因此,在本文的任何实施方案中,吸收性材料可包含藻酸盐。合适的藻酸盐包括但不限于藻酸钙、藻酸钠、藻酸钾或它们中的任何两种或更多种的组合物。合适的纤维素材料包括但不限于羧甲基纤维素(cmc)、cmc衍生物(例如,cmc钠、甲基纤维素、羟甲基纤维素或它们的组合物)、纤维素乙基磺酸盐(ces)或它们中的任何两种或更多种的组合物。在本文的任何实施方案中,吸收性材料可包含藻酸盐与cmc的组合物,例如藻酸钙纤维与cmc纤维的组合物。包含吸收性纤维的合适的吸收性材料的示例及其制备方法公开于美国专利7385101中,该专利全文以引用方式并入本文。
41.在本文的任何实施方案中,吸收性抗微生物层可包含如本文在任何实施方案中所述的抗微生物材料和吸收性材料两者。例如,吸收性抗微生物层可包含抗微生物材料和吸收性材料的共混物。共混物可以是抗微生物材料和吸收性材料的均一化共混物,使得吸收性抗微生物层通常表现出对水性介质的均匀或基本上均匀的吸收,并且表现出均匀或基本上均匀的抗微生物活性(例如,银离子的均匀或基本上均匀的释放)。例如,在本文的任何实施方案中,吸收性抗微生物层可包含涂覆有银涂层的尼龙纤维、藻酸钙纤维和cmc纤维的共混物。
42.在本文的任何实施方案中,存在于吸收性抗微生物层内的抗微生物纤维(例如,涂覆银的尼龙纤维)的量可为按吸收性抗微生物层的重量计约30%至约70%,诸如按吸收性抗微生物层的重量计约40%至约60%。例如,在本文的任何实施方案中,按吸收性抗微生物层的重量计,抗微生物纤维的量可为约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。
43.存在于吸收性抗微生物层内的吸收性纤维(例如,藻酸钙纤维和cmc纤维)的量可为按吸收性抗微生物层的重量计约30%至约70%、诸如按吸收性抗微生物层的重量计约40%至约60%的量。因此,在本文的任何实施方案中,吸收性抗微生物层中所包含的吸收性纤维的量可为(按吸收性抗微生物层的重量计)约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。在本文的任何实施方案中,吸收性纤维可包含藻酸钙纤维和cmc纤维。藻酸钙纤维和cmc纤维可以约1:12至约1:1、诸如约1:8至约1:2的重量比(藻酸钙纤维:cmc纤维)存在。例如,在本文的任何实施方案中,藻酸钙纤维和cmc纤维可以约1:1、约1:2、约1:3、约1:4、约1:5、约1:6、约1:7、约1:8、约1:9、约1:10、约1:11、约1:12或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围的重量比(藻酸钙纤维:cmc纤维)存在。
44.在本文的任何实施方案中,吸收性抗微生物层可包含抗微生物材料和吸收性材料的任何合适形式的共混物,例如非织造基质或织造基质。非织造基质或织造基质的厚度可为约1mm至约25mm,诸如约1.5mm至约15mm、约2mm至约12mm或约2.5mm至约10mm。因此,在本文的任何实施方案中,吸收性抗微生物层的非织造基质或织造基质的厚度可为约1mm、约2mm、约3mm、约4mm、约5mm、约6mm、约7mm、约8mm、约9mm、约10mm、约11mm、约12mm、约13mm、约14mm、约15mm、约16mm、约17mm、约18mm、约19mm、约20mm、约21mm、约22mm、约23mm、约24mm、约25mm或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。
45.吸收性抗微生物层还可包含一种或多种防腐剂、稳定剂、增塑剂、基质强化材料、抗氧化剂染料、活性材料或它们中的两种或更多种的组合物。
46.基质强化材料改善处理特性,例如,降低吸收性抗微生物层的易于撕裂性(例如,降低含cmc的吸收性抗微生物层的易于撕裂性)。非胶凝纤维素纤维是基质强化材料的示例,其中此类“非胶凝”纤维素纤维可为基本上水不溶性的,并且可由未被化学改性以增加水溶性的纤维素产生(与cmc或其他纤维素醚形成对比)。非胶凝纤维素纤维可商购获得(例如,由lenzing ag出售的纤维)。非胶凝纤维素纤维可由可商购获得的连续长度加工而成,诸如通过切割成长度为约0.5cm至约5cm的长度。因此,在本文的任何实施方案中,吸收性抗微生物层可包含长度为约0.5cm、约0.6cm、约0.7cm、约0.8cm、约0.9cm、约1cm、约1.2cm、约1.4cm、约1.6cm、约1.8cm、约2cm、约2.2cm、约2.4cm、约2.6cm、约2.8cm、约3cm、约3.2cm、约3.4cm、约3.6cm、约3.8cm、约4cm、约4.2cm、约4.4cm、约4.6cm、约4.8cm、约5cm或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围的非胶凝纤维。非胶凝纤维素纤维可以适于产生吸收性抗微生物层的期望物理特性的量存在于吸收性抗微生物层中。例如,在本文的任何实施方案中,非胶凝纤维素纤维可以按吸收性抗微生物层的重量计约5%至约50%、诸如按吸收性抗微生物层的重量计10%至约40%或约15%至约25%的含量存在。
47.如上所述,吸收性抗微生物层还可包含抗氧化剂染料,该抗氧化剂染料通常在可见光区域(即,400nm
‑
700nm)中具有吸光度,其中此类染料可用于以光化学方式捕集所生成的自由基,从而充当光化学脱敏剂,否则所述自由基可与吸收性抗微生物层中的银反应。在本文的任何实施方案中,抗氧化剂染料可包括苯胺染料、吖啶染料、硫堇染料、双萘染料、噻嗪染料、偶氮染料、蒽醌染料或它们中的任何两种或更多种的混合物。例如,在本文的任何实施方案中,抗氧化剂染料可为龙胆紫、苯胺蓝、亚甲蓝、结晶紫、吖啶黄、9
‑
氨基吖啶、吖啶黄、吖啶橙、原黄素、奎纳克林、亮绿、台盼蓝、台盼红、孔雀石绿、间氮丫啶、甲基紫、甲基橙、甲基黄、乙基紫、酸性橙、酸性黄、酸性蓝、酸性红、硫磺素、子种绿、靛蓝、亚甲基绿或它们中的任何两种或更多种的混合物。抗氧化剂染料可以按吸收性抗微生物层的重量计约0.05%至约5%、诸如按吸收性抗微生物层的重量计约0.2%至约2%的量包含在内。
48.同样如上所述,吸收性抗微生物层还可包含一种或多种活性材料。此类活性物质可例如有效地有助于伤口愈合。示例性活性物质包括但不限于非甾族抗炎药物(例如,对乙酰氨基酚)、类固醇、抗生素(例如,青霉素和/或链霉素)、除银之外的防腐剂(例如,氯己定)、生长因子(例如,成纤维细胞生长因子(fgf)、表皮生长因子(egf)、血小板衍生生长因子(pgdf))或它们中的任何两种或更多种的组合物。活性物质可以按吸收性抗微生物层的重量计约0.1%至约10%、诸如按吸收性抗微生物层的重量计约1%至约5%的量存在;因此,按吸收性抗微生物层的重量计,存在的活性物质的量可为约0.1%、约0.2%、约0.3%、约0.4%、约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。
49.本文的任何实施方案的吸收性抗微生物层可为表现出如本文在任何实施方案中所述的抗微生物活性、吸收性或它们的组合物的可商购获得的产品。示例性的可商购获得的产品为购自acelity,san antonio,texas的silvercel
tm
敷料。可适合用作吸收性抗微生
物层的另外的示例性材料及其制备方法公开于美国专利7385101中,该专利全文并入本文。
50.生物可吸收层
51.敷料的生物可吸收层可被构造成降解生物膜的至少一部分。如本文所用,“生物膜”是指被包封或嵌入基质材料内的微生物的缔合,所述基质材料可由驻留微生物(例如,细胞外dna;蛋白质)自我产生,并且还可包括在水性环境中的界面处发展并持续的生物膜。生物膜可附着到活的和/或无生命的表面,诸如组织、伤口、医疗植入物(例如,矫形植入物、牙科植入物、导管、支架等)。在本文的任何实施方案中,生物膜可包含细菌、非细菌微生物、基质材料或它们中的任何两种或更多种的组合物。在本文的任何实施方案中,合适的细菌可包括革兰氏阴性细菌(例如,铜绿假单胞菌)、革兰氏阳性细菌(例如,金黄色葡萄球菌和变异链球菌)或它们的组合物。合适的非细菌微生物可包括酵母,例如白色念珠菌。合适的基质材料可包括细胞外聚合物物质(eps)基质,诸如具有相对高分子量的聚合物(例如,生物聚合物)。合适的eps基质可包括但不限于多糖、糖蛋白(例如,脂质)、核酸(例如,dna或rna)或它们中两种或更多种的组合物。eps基质可有助于生物膜的各种特性。例如,eps基质可通过为那些抗微生物剂提供物理屏障来赋予对生物膜微生物的降低的抗微生物敏感性。
52.在本文的任何实施方案中,生物可吸收层可包含抗生物膜剂,该抗生物膜剂能够降解生物膜。例如,在本文的任何实施方案中,生物可吸收层可包含适用于降解eps基质的抗生物膜剂,在本文中称为eps活性剂。合适的eps活性剂可包括但不限于柠檬酸;抗坏血酸;羧酸(例如,乙酸、甲酸、葡萄糖酸、乳酸、草酸、酒石酸和过氧丙酮酸);或它们中的任何两种或更多种的组合物。因此,在本文的任何实施方案中,生物可吸收层可包含柠檬酸。eps活性剂可以按生物可吸收层的重量计约0.05%至约5.0%、诸如按生物可吸收层的重量计约0.5%至约2.5%或按生物可吸收层的重量计约1.0%至约2.0%的量存在于生物可吸收层内;因此,按任何实施方案的生物可吸收层的重量计,eps试剂的量可为约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1%、约1.1%、约1.2%、约1.3%、约1.4%、约1.5%、约1.6%、约1.7%、约1.8%、约1.9%、约2%、约2.1%、约2.2%、约2.3%、约2.4%、约2.5%、约2.6%、约2.7%、约2.8%、约2.9%、约3%、约3.1%、约3.2%、约3.3%、约3.4%、约3.5%、约3.6%、约3.7%、约3.8%、约3.9%、约4%、约4.1%、约4.2%、约4.3%、约4.4%、约4.5%、约4.6%、约4.7%、约4.8%、约4.9%、约5%或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。
53.生物可吸收层可包含作为生物可吸收材料的生物可吸收聚合物。如本文所用,“生物可吸收的”或“生物可吸收性”是指材料在暴露于生理流体或过程时至少部分地或完全地崩解、降解或溶解的特性。例如,在本文的任何实施方案中,生物可吸收层的至少一部分可在组织部位处或体内(例如,在哺乳动物体内)被吸收或同化。生物可吸收性可表现为化学过程或条件、物理过程或条件或它们的组合物的结果。生物可吸收层可被构造成在特定时间段内表现出特定比例的崩解、降解和/或溶解(下文称为“分解”)。在本文的任何实施方案中,生物可吸收层可被构造成使得约90重量%、约91重量%、约92重量%、约93重量%、约94重量%、约95重量%、约96重量%、约97重量%、约98重量%、约99重量%或约100重量%的生物可吸收层(或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围)可通过引入生理环境中或当用模拟生理流体在约37℃的温度处温育时在约24小时、约26小时、约28小时、约30小时、约32小时、约34小时、约36小时、约38小时、约40小时、约
42小时、约44小时、约46小时、约2天、约3天、约4天、约5天,约6天或约7天(或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围)的时间段内分解。
54.在本文的任何实施方案中,生物可吸收层可包含生物可吸收聚合物和eps活性剂,使得生物可吸收层在生物可吸收聚合物分解时释放eps活性剂。合适的生物可吸收聚合物可包括但不限于明胶、胶原蛋白、氧化再生纤维素(orc)、聚乳酸、聚乙醇酸、淀粉或它们中的任何两种或更多种的组合物。在本文的任何实施方案中,生物可吸收层可包含含有eps活性剂和生物可吸收聚合物的组合物,使得在生物可吸收聚合物重吸收时,eps活性剂可被释放。
55.生物可吸收层的胶原蛋白可为哺乳动物胶原蛋白。除此之外或另选地,在一些实施方案中,生物可吸收层的胶原蛋白可包括人胶原蛋白i型和人胶原蛋白iii型。除此之外或另选地,在一些实施方案中,生物可吸收层的胶原蛋白可包括牛胶原蛋白i型和牛胶原蛋白iii型。在本文所公开的任何实施方案中,生物可吸收层的哺乳动物重组胶原蛋白可通过本领域已知的任何合适的方法提供。除此之外或另选地,在一些实施方案中,生物可吸收层的人重组胶原蛋白可通过本领域已知的任何合适的方法提供。例如,提供人重组胶原蛋白的步骤可包括遵循美国专利5962648中所述的方案,该专利的全部内容以引用方式并入本文。其他重组方法描述于美国专利5593859和wo2004/078120中,所述专利也以引用方式并入本文。除此之外或另选地,在一些实施方案中,将通过培养已转染至少一种编码包含胶原蛋白的多肽的基因和编码氧化纤维素及翻译后酶脯氨酰4
‑
羟化酶的亚基的基因的细胞,并从其纯化所得的胶原蛋白单体,来重组制备胶原蛋白。随后可使人重组胶原蛋白溶液经受聚合或交联条件,以制备不溶性纤维胶原蛋白。
56.在本文所公开的任何实施方案中,生物可吸收层可包含按生物可吸收层的重量计约30重量%至约70重量%的胶原蛋白。胶原蛋白的重均分子量可为约5000至约100000。因此,生物可吸收层中的胶原蛋白可为(按生物可吸收层的重量计)约30%、约32%、约34%、约36%、约38%、约40%、约42%、约44%、约46%、约48%、约50%、约52%、约54%、约56%、约58%、约60%、约62%、约64%、约66%、约68%、约70%或包括这些值中的任意两个值和/或介于这些值中的任意两个值之间的任何范围。生物可吸收层中的胶原蛋白的重均分子量可为约5000、约6000、约7000、约8000、约9000、约10000、约12000、约14000、约16000、约18000、约20000、约22000、约24000、约26000、约28000、约30000、约32000、约34000、约36000、约38000、约40000、约45000、约50000、约55000、约60000、约65000、约70000、约75000、约80000、约85000、约90000、约95000、约100000或包括这些值中的任意两个值和/或介于这些值中的任意两个值之间的任何范围。
57.在本文所公开的任何实施方案中,生物可吸收层的胶原蛋白可包含约100:0、约90:10、约80:20、约70:30、约60:40、约50:50、约40:60、约30:70、约20:80、约10:90、约0:100或包括这些值中的任意两个值和/或介于这些值中的任意两个值之间的任何范围的人胶原蛋白i型与人胶原蛋白iii型的重量比。除此之外或另选地,在一些实施方案中,人胶原蛋白i型与人胶原蛋白iii型的重量比大于约50:50或大于约70:30。除此之外或另选地,在一些实施方案中,生物可吸收层的胶原蛋白可包含约85:15的i型牛胶原蛋白与iii型牛胶原蛋白的重量比。
58.在本文所公开的任何实施方案中,可通过例如用四氧化二氮氧化纤维素和/或如
美国专利3122479(以引用方式并入本文)中所述来制备orc。不受理论的束缚,据信该方法可将纤维素的糖残基上的伯醇基团转化成羧酸基团,例如,从而在纤维素链内形成糖醛酸残基。氧化可不以完全的选择性进行,因此糖残基的碳2和3上的羟基基团可转化成酮基形式。这些酮单元可引入碱不稳定的连接,其在ph7或更高ph处经由内酯的形成和糖环裂解而引发聚合物的分解。因此,氧化再生纤维素在生理条件下是生物可降解的且生物可吸收的。orc可具有多种氧化程度,从而具有多种降解速率。orc可包括颗粒、纤维或两者;在本文所公开的任何实施方案中,orc可为颗粒形式,诸如纤维颗粒或粉末颗粒。在包含orc纤维的实施方案中,orc纤维可具有一定体积分数,使得至少80%的纤维具有在约5μm至约1000μm或约250μm至约450μm范围内的长度。
59.在本文所公开的任何实施方案中,生物可吸收层可包含按生物可吸收层的重量计约30%至约70%的orc;因此,生物可吸收层可包含约30%、约32%、约34%、约36%、约38%、约40%、约42%、约44%、约46%、约48%、约50%、约52%、约54%、约56%、约58%、约60%、约62%、约64%、约66%、约68%、约70%或包括这些值中的任意两个值和/或介于这些值中的任意两个值之间的任何范围的量(按生物可吸收层的重量计)的orc。
60.在本文所公开的任何实施方案中,生物可吸收层可包含约30重量%至约90重量%的胶原蛋白和orc的混合物。因此,生物可吸收层中的胶原蛋白和orc混合物的量可为约30%、约32%、约34%、约36%、约38%、约40%、约42%、约44%、约46%、约48%、约50%、约52%、约54%、约56%、约58%、约60%、约62%、约64%、约66%、约68%、约70%、约72%、约74%、约76%、约78%、约80%、约82%、约84%、约86%、约88%、约90%或包括这些值中的任意两个值和/或介于这些值中的任意两个值之间的任何范围。
61.在本文所公开的任何实施方案中,生物可吸收层可包含(本文所公开的任何实施方案的)胶原蛋白和(本文所公开的任何实施方案的)orc,其中生物可吸收层中的胶原蛋白与orc的重量比为约60:40至约40:60;因此,生物可吸收层中的胶原蛋白与orc的重量比可为约60:40、约59:41、约58:42、约57:43、约56:44、约55:45、约54:46、约53:47、约52:48、约51:49、约50:50、约49:51、约48:52、约47:53、约46:54、约45:55、约44:56、约43:57、约42:58、约41:59、约40:60或包括这些值中的任意两个值和/或介于这些值中的任意两个值之间的任何范围。
62.生物可吸收层还可包含增塑剂,诸如甘油或其他多元醇。例如,在本文的任何实施方案中,增塑剂可以按生物可吸收层的重量计约0.1%至约2.0%、诸如约0.5%至约1.5%的量存在于生物可吸收层中。按生物可吸收层的重量计,合适的增塑剂量可包括但不限于约0.1%、约0.2%、约0.3%、约0.4%、约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1.0%、约1.1%、约1.2%、约1.3%、约1.4%、约1.5%、约1.6%、约1.7%、约1.8%、约1.9%、约2.0%或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。
63.生物可吸收层可为具有约100μm至约3000μm的合适厚度的膜;因此,在本文的任何实施方案中,膜的厚度可为约100μm、约200μm、约300μm、约400μm、约500μm、约600μm、约700μm、约800μm、约900μm、约1000μm、约1100μm、约1200μm、约1300μm、约1400μm、约1500μm、约1600μm、约1700μm、约1800μm、约1900μm、约2000μm或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。在本文的任何实施方案中,生物可吸收层可为表
征为流体不可渗透或流体基本上不可渗透的膜(例如,无孔膜)。在本文的任何实施方案中,生物可吸收层可为被构造成允许流体通过的膜。例如,生物可吸收层可包括延伸穿过其中的多个孔,以便允许通过生物可吸收层的流体连通。所述多个孔的平均孔尺寸可在约200μm至约3000μm的范围内;因此,本文的任何实施方案中的平均孔尺寸可为约200μm、约300μm、约400μm、约500μm、约600μm、约700μm、约800μm、约900μm、约1000μm、约1200μm、约1400μm、约1600μm、约1800μm、约2000μm、约2200μm、约2400μm、约2600μm、约2800μm、约3000μm或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。生物可吸收层可包括孔密度为约2个孔/cm2至约10个孔/cm2的多个孔;因此,本文的任何实施方案的生物可吸收层的孔密度可为约2个孔/cm2、约4个孔/cm2、约6个孔/cm2、约8个孔/cm2、约10个孔/cm2或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。
64.在本文的任何实施方案中,可将生物可吸收层施加到吸收性抗微生物层的一个或多个合适的表面,使得生物可吸收层覆盖吸收性抗微生物层的一个或多个表面。在一个示例性实施方案中,图1a示出了可将生物可吸收层120施加(例如,作为膜层合)到第一平坦表面111(例如,面向伤口的表面)。
65.非粘附层
66.在本文的任何实施方案中,敷料可包括非粘附层,该非粘附层被构造成相对于组织部位处的组织为基本上非粘附的。例如,在本文的任何实施方案中,非粘附层可被构造用于与组织部位接触。在本文的任何实施方案中,非粘附层可包含大体柔性的、基本上非粘附的材料。示例性非粘附材料包括但不限于热塑性材料、热塑性弹性体或它们的组合物。合适的热塑性材料包括但不限于丙烯酸类和/或丙烯酸酯类(例如,甲基丙烯酸乙酯(ema))。合适的热塑性弹性体可包括但不限于尼龙、苯乙烯乙烯丁烯苯乙烯(sebs)和其他嵌段共聚物(例如,聚醚嵌段聚酰胺(pebax))、有机硅弹性体、聚己内酰胺、聚乳酸和聚烯烃(例如,聚乙烯和聚丙烯)。
67.非粘附层可为织造材料或非织造材料(例如,膜)。非粘附层的厚度可为约10μm、约20μm、约30μm、约40μm、约50μm、约60μm、约70μm、约80μm、约90μm、100μm、约150μm、约200μm、约250μm、约300μm、约350μm、约400μm、约450μm、约500μm、约550μm、约600μm、约650μm、约700μm、约750μm、约800μm、约850μm、约900μm、约950μm、约1000μm或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。
68.非粘附层可被构造成使得非粘附层的至少一部分可渗透各种伤口流体(例如,水、血液或伤口渗出物)。例如,在本文的任何实施方案中,非粘附层可为多孔的、穿孔的或它们的组合物,使得非粘附层包括延伸穿过其中的多个孔以允许通过非粘附层的流体连通。所述多个孔的平均孔尺寸可为约200μm、约300μm、约400μm、约500μm、600μm、约700μm、约800μm、约900μm、约1000μm、约1200μm、约1400μm、约1600μm、约1800μm、约2000μm、约2200μm、约2400μm、约2600μm、约2800μm、约3000μm或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。在本文的任何实施方案中,非粘附层可包括孔密度为约2个孔/cm2至约10个孔/cm2的多个孔;因此,非粘附层的孔密度可为约2个孔/cm2、约4个孔/cm2、约6个孔/cm2、约8个孔/cm2、约10个孔/cm2或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。
69.在本文的任何实施方案中,非粘附层可被构造成覆盖生物可吸收层、吸收性抗微
生物层或它们的组合物的一个或多个表面。例如,如图1a所示,非粘附层130可覆盖或施加到生物可吸收层120的外表面。在本文的任何实施方案中,非粘附层可作为膜或片材层合到生物可吸收层的大致平坦的表面,该大致平坦的表面与生物可吸收层的面向吸收性抗微生物层的表面相对。
70.敷料构型
71.在本文的任何实施方案中,可将生物可吸收层施加到吸收性抗微生物层的第二平坦表面。例如,如图1b所示,可将第一生物可吸收层120a施加到第一平坦表面111,并且可将第二生物可吸收层120b施加(例如,作为膜层合)到吸收性抗微生物层110的第二平坦表面112。
72.可将非粘附层施加到生物可吸收层、吸收性抗微生物层或它们的组合物的各个表面。例如,参照图1b中的例示性实施方案,可将第一非粘附层130a施加(例如,作为膜层合)到第一生物可吸收层120a,并且可将第二非粘附层130b施加(例如,作为膜层合)到第二生物可吸收层120b。在图1c所示的另一个示例性实施方案中,可将第一非粘附层130a施加(例如,作为膜层合)到与吸收性抗微生物层110的第一平坦表面111相对的生物可吸收层120,并且可将第二非粘附层130b施加(例如,作为膜层合)到吸收性抗微生物层110的第二平坦表面112。
73.非粘附层可包括包层;例如,在本文的任何实施方案中,包层可以任何合适的形状包括袋子、囊袋、小袋、管、圆筒、盒或它们中的任何两种或更多种的组合物。例如,如图1d的示例性实施方案所示,第一非粘附层130a和第二非粘附层130b可一起形成包层135。包层可由膜或片材形式的一个或多个非粘附层形成,所述膜或片材可具有任何合适的尺寸或形状。例如,在本文的任何实施方案中,一个或多个非粘附层可为各自独立地为正方形、矩形、圆形、椭圆形或长方形的膜或片材的形式。在本文的任何实施方案中,包层形式的非粘附层可包封或涵盖吸收性抗微生物层,其中生物可吸收层可被施加到其一个或多个层。
74.在本文的任何实施方案中,敷料的吸收性抗微生物层、生物可吸收层、非粘附层或它们的组合物中的一者或多者可被构造成与组织部位接触。例如,在本文的任何实施方案中,吸收性抗微生物层、生物可吸收层、非粘附层或它们中的任何两者或更多者的组合可被构造成与组织部位的一部分、基本上所有组织部位或整个组织部位接触。在本文的任何实施方案中,组织部位可为伤口,并且敷料可部分地或完全地填充伤口,或者可置于伤口上(例如,上方)。在本文的任何实施方案中,敷料可被构造成具有适用于多种治疗因素的任何形式、尺寸、形状和/或厚度,诸如所实施的治疗的类型或组织部位的性质和尺寸。例如,在本文的任何实施方案中,敷料的尺寸和形状可适于较深和不规则形状的组织部位的轮廓并且/或者可被构造成适于给定形状或轮廓。在本文的任何实施方案中,吸收性抗微生物层、生物可吸收层、非粘附层或它们中的任何两者或更多者的组合中的一者或多者的任何或所有表面可包括凸起和/或不均匀的、粗糙的或锯齿状的外形,所述外形可在组织部位上引起应变和应力,这可有效促进组织部位处的肉芽形成。
75.任选的附加部件或层
76.在本文的任何实施方案中,敷料可包括一个或多个附加层。所述一个或多个附加层可被构造成执行多种功能中的任一种功能,包括例如使敷料粘附到伤口或周围组织、增加敷料的结构刚度、保护敷料免受外部环境中的水分或其他材料的影响、保护伤口表面、将
一种或多种活性材料或其他材料递送到伤口表面或它们中的两种或更多种的组合物。在本文的任何实施方案中,附加层可适形于伤口表面和/或周围组织。例如,在本文的任何实施方案中,一个或多个附加层可被构造成能够弯曲,使得敷料的面向伤口的表面与伤口和/或周围组织基本上接触。
77.在本文的任何实施方案中,敷料还可包括覆盖件。例如,如图2中的示例性实施方案所示,敷料100还可包括具有第一(例如,面向伤口的)表面221和第二(例如,背部)表面222的覆盖件220。覆盖件可支撑敷料的各个部件,诸如吸收性抗微生物层、生物可吸收层或非粘附层的表面(例如,背部表面)可与覆盖件的表面(例如,面向伤口的表面)接触并粘附到该表面。
78.在本文的任何实施方案中,覆盖件可为水蒸气可渗透的并且为液体不可渗透的或基本上不可渗透的。例如,在本文的任何实施方案中,覆盖件不可渗透液态水或伤口渗出物。覆盖件在37.5℃和50%相对湿度差下可具有约300g/m2/24小时至约5000g/m2/24小时、诸如约500g/m2/24小时至约2000g/m2/24小时的湿气透过率(mvtr),如astm e96
‑
00中所述;因此,mvtr可为约500g/m2/24小时、约750g/m2/24小时、约1000g/m2/24小时、约1500g/m2/24小时、约2000g/m2/24小时、约2500g/m2/24小时、约3000g/m2/24小时、约3500g/m2/24小时、约4000g/m2/24小时、约4500g/m2/24小时、约5000g/m2/24小时或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。在本文的任何实施方案中,覆盖件可为微生物不可渗透的或基本上不可渗透的。
79.覆盖件可由聚合物形成。用于形成覆盖件的合适聚合物可包括但不限于聚氨酯、聚烷氧基烷基丙烯酸酯、甲基丙烯酸酯或它们中的任何两种或更多种的组合物。例如,在本文的任何实施方案中,覆盖件可包括主要为闭孔的高密度封闭聚氨酯泡沫的连续层。合适的覆盖材料(例如,聚合物)公开于1972年2月29日公布的美国专利3645835中,该专利全文以引用方式并入本文。在本文的任何实施方案中,覆盖材料可为可以5714f商购获得的聚氨酯膜(由the lubrizol corporation出售)。
80.覆盖件的厚度可在约10μm至约1000μm、诸如约100μm至约500μm的范围内;因此,覆盖件的厚度可为约10μm、约20μm、约30μm、约40μm、约50μm、约60μm、约70μm、约80μm、约90μm、100μm、约150μm、约200μm、约250μm、约300μm、约350μm、约400μm、约450μm、约500μm、约550μm、约600μm、约650μm、约700μm、约750μm、约800μm、约850μm、约900μm、约950μm、约1000μm或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。覆盖件的表面的尺寸和构型可使得覆盖件延伸超过敷料并且限定延伸约0.5mm至约60mm、诸如约1mm至约50mm的边缘区域;因此,在本文的任何实施方案中,边缘区域可延伸约0.5mm、约1mm、约2mm、约3mm、约4mm、约5mm、约6mm、约7mm、约8mm、约9mm、约10mm、约15mm、约20mm、约25mm、约30mm、约35mm、约40mm、约45mm、约50mm、约55mm、约60mm或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。在本文的任何实施方案中,覆盖件可延伸超过覆盖件上的敷料的一个或多个边缘,该敷料包括吸收性抗微生物层、生物可吸收层、非粘附层或它们中的任何两者或更多者的组合。在本文的任何实施方案中,覆盖件可被构造成使得覆盖件的敷料周围的边缘区域的一部分可涂覆有粘合剂层,使得当施用到伤口组织时,边缘区域可用于将敷料粘附到伤口或其他组织部位周围的组织。
81.合适的粘合剂可包括但不限于压敏粘合剂。例如,在本文的任何实施方案中,压敏
粘合剂可包含丙烯酸酯共聚物、聚乙烯乙醚、聚氨酯或它们中的任何两种或更多种的组合物。合适的压敏粘合剂包括但不限于1972年2月29日公布的美国专利3645835中公开的那些压敏粘合剂,该专利全文以引用方式并入本文。粘合剂层的基重可为约20g/m2至约250g/m2。
82.在本文的任何实施方案中,敷料还可包括定位在敷料与覆盖件之间的辅助层。辅助层可包括互连以便改善流体的分配或收集的流体通路。例如,在本文的任何实施方案中,辅助层可为多孔泡沫材料,该多孔泡沫材料具有多个互连的泡孔、孔、边缘、壁或它们中的两种或更多种的组合物以形成互连的流体通路(例如,通道)。合适的多孔泡沫材料可包括但不限于多孔泡沫、开孔泡沫、网状泡沫、多孔组织收集物、其他多孔材料(例如,纱布或毡垫)或它们中的两种或更多种的组合物。在本文的任何实施方案中,辅助层可为具有以下孔尺寸的泡沫:约400微米、约420微米、约440微米、约460微米、约480微米、约500微米、约520微米、约540微米、约560微米、约580微米、约600微米或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围。因此,在本文的任何实施方案中,辅助层可为开孔网状聚氨酯泡沫。
83.辅助层可被表征为表现出吸收性。例如,在本文的任何实施方案中,辅助层可表现出至少约3g盐水/g、至少约4g盐水/g、至少约5g盐水/g、至少约6g盐水/g、至少约7g盐水/g、至少约8g盐水/g、至少约9g盐水/g、至少约10g盐水/g、至少约11g盐水/g、至少约12g盐水/g、至少约13g盐水/g、至少约14g盐水/g、至少约15g盐水/g、至少约16g盐水/g、至少约17g盐水/g、至少约18g盐水/g、至少约19g盐水/g、至少约20g盐水/g或包括前述值中的任意两个值和/或介于前述值中的任意两个值之间的任何范围的吸收性。辅助层可为亲水性的并且被构造成吸收(例如,芯吸)流体,使其远离敷料。例如,在本文的任何实施方案中,辅助层的芯吸特性可通过毛细流动或其他芯吸机制从敷料吸走流体。合适的亲水性泡沫包括但不限于聚乙烯醇、开孔泡沫、由聚醚制成的亲水性泡沫、已被处理或涂覆以提供亲水性的疏水性泡沫或它们中的任何两种或更多种的组合物。
84.负压治疗
85.本文所述的任何实施方案的敷料可用于其中用减压处理组织部位的治疗中。利用减压来治疗组织通常可称为“负压治疗”,但也可有其他名称,包括例如“负压伤口治疗”、“减压治疗”、“真空治疗”、“真空辅助闭合”和“局部负压”。负压治疗可提供许多益处,包括上皮组织和皮下组织的迁移、改善的血流和/或伤口部位处的组织的微变形。这些益处可一起增加肉芽组织的发育并减少愈合时间。
86.图3以简化示意图示出了用于负压治疗的示例性系统(300)。一般来讲,该系统可被构造成根据本说明书向组织部位提供负压。在本文的任何实施方案中,系统通常可包括负压供应,并且可包括或被构造成联接到分配部件。一般来讲,分配部件可指在负压供应和组织部位之间的流体路径中被配置为流体地联接到负压供应的任何补充或辅助部件。在图3所提供的图示中,敷料100是流体地联接到负压源304的分配部件的示例,使得负压可经由敷料100施加到组织部位。
87.在本文的任何实施方案中,敷料可被构造成分配负压。敷料可包括歧管或被构造为歧管。在该上下文中,“歧管”通常包括提供多个通路的任何组合物或结构,所述通路被构造成在压力下在组织部位上收集或分配流体。例如,歧管可被构造成从负压源接收负压并且通过多个孔口(例如,孔)分配负压,这可具有收集流体并将流体朝向负压源抽吸的效果。
更具体地,如图3所示,敷料(100)可被构造成从负压源(304)接收负压并通过敷料(100)分配负压,例如,这可具有通过从组织部位抽吸流体穿过敷料而从密封空间收集流体的效果。除此之外或另选地,流体路径可被反转或者可提供辅助流体路径以有利于流体在组织部位上的移动。除此之外或另选地,歧管的流体通路可互连以改善流体的分配或收集。除此之外或另选地,歧管可为具有多个互连孔或孔隙的多孔材料。例如,在本文的任何实施方案中,开孔泡沫诸如网状泡沫通常可包括可形成互连的流体通路(诸如通道)的孔、边缘和/或壁。
88.与使用负压源来减小另一个部件或位置中(诸如在密封的治疗环境内)的压力相关联的流体力学在数学上可以是复杂的。然而,适用于负压治疗的流体力学的基本原理是本领域的技术人员众所周知的。减小压力的方法可在本文中一般性地和例示性地描述为例如“递送”、“分配”或“产生”负压。
89.一般来讲,诸如伤口流体(例如,伤口渗出物和其他流体)的流体沿着流体路径流向较低压力。因此,术语“下游”通常意味着流体路径中的相对更靠近负压源或更远离正压源的某物。相反,术语“上游”意味着相对更远离负压源或更靠近正压源的某物。通常出于描述本文的各种特征部和部件的目的假设该取向。然而,在一些应用中,流体路径也可反转(诸如通过用正压源代替负压源),并且该描述约定不应理解为限制性约定。
[0090]“负压”通常可指小于局部环境压力的压力,诸如由敷料提供的密封治疗环境外部的局部环境中的环境压力。在许多情况下,局部环境压力也可以是组织部位附近或周围的大气压力。另选地或除此之外,压力可小于与组织部位处的组织相关联的液体静压。虽然施加到组织部位的负压的量和性质可根据治疗要求而变化,但压力通常为介于
‑
5mm hg(
‑
667pa)和
‑
500mm hg(
‑
66.7kpa)表压之间的低真空,通常也称为粗真空。常见的治疗范围介于
‑
50mm hg(
‑
6.7kpa)和
‑
300mm hg(
‑
39.9kpa)表压之间。
[0091]
除此之外或另选地,在本文的任何实施方案中,负压供应(诸如图3的负压源304)可为处于负压的空气的贮存器,或者可为可减小密封体积中的压力的手动或电动装置,诸如真空泵、抽吸泵、在许多医疗保健机构处可用的壁抽吸端口或微型泵。负压供应可以容纳在其他部件内或与其结合使用,诸如传感器、处理单元、警报指示器、存储器、数据库、软件、显示设备或进一步促进治疗的用户界面。负压源(例如,图3的负压源304)可与控制器和其他部件组合到治疗单元中。负压供应也可具有一个或多个供应端口,所述一个或多个供应端口被构造成有利于将负压供应与一个或多个分配部件联接和脱离联接。
[0092]
在本文的任何实施方案中,部件可彼此流体地联接以提供用于在部件之间传递流体(即,液体和/或气体)的路径。例如,部件可通过流体传导器(诸如管)来流体地联接。如本文所用,术语“流体传导器”可包括管、管道、软管、导管或具有适于在其两个端部之间传送流体的一个或多个管腔或开放路径的其他结构。通常,流体传导器可为具有一定柔性的细长圆柱形结构,但几何形状和刚度可变化。除此之外或另选地,在本文的任何实施方案中,负压源可经由敷料界面可操作地联接到敷料。例如,通过参考图3,敷料100可经由敷料界面联接到负压源304,使得敷料100从负压源304接收负压。
[0093]
方法
[0094]
本技术还提供了一种治疗方法,其中该治疗方法包括将本技术的本文任何实施方案的敷料邻近组织部位定位。例如,在本文的任何实施方案中,敷料可邻近伤口定位。敷料可用于多种伤口中的任一种伤口,诸如由创伤、外科手术或疾病引起的伤口。例如,可将敷
料放置在组织部位内、组织部位上方、组织部位上或以其他方式邻近组织部位。在其中敷料包括覆盖件的实施方案中,可将覆盖件放置在敷料的吸收性抗微生物层、生物可吸收层、非粘附层或它们中的任何两者或更多者的组合上方,并且覆盖件密封到靠近组织部位的附接表面。例如,可将敷料密封到组织部位周边的未受损表皮。在本文的任何实施方案中,可首先定位吸收性抗微生物层、生物可吸收层、非粘附层或它们中的任何两种或更多种的组合物,然后可邻近组织部位定位覆盖件。在本文的任何实施方案中,吸收性抗微生物层、生物可吸收层、非粘附层或它们的组合物以及覆盖件可为预组装的,例如使得吸收性抗微生物层、生物可吸收层、非粘附层、它们中的任何两者或更多者的组合物以及覆盖件可在邻近组织部位放置之前相对于彼此定位。因此,敷料可提供邻近组织部位的与外部环境基本上隔离的密封治疗环境。
[0095]
在本文的任何实施方案中,该方法可包括在负压治疗的上下文中采用敷料,其中负压治疗可包括将敷料邻近组织部位(例如,伤口)定位。例如,敷料的各个部件可相对于组织部位顺序地定位,或者另选地,可相对于彼此定位,然后相对于组织部位定位。负压治疗还可包括将覆盖件密封到组织部位周围的组织以形成密封空间。例如,可将覆盖件放置在吸收性抗微生物层、生物可吸收层、非粘附层或它们中的任何两者或更多者的组合上方,并且密封到靠近组织部位的附接表面,例如,密封到组织部位周边的未受损表皮。
[0096]
本文的任何实施方案中的负压治疗方法还可包括将负压源流体地联接到密封空间,并且操作负压源以在密封空间中产生负压。例如,负压源可联接到敷料,使得负压源可用于减小密封空间中的压力。例如,例如经由敷料施加在组织部位上的负压可有效地在组织部位处诱导宏观应变和微观应变,以及去除来自组织部位的渗出物和其他流体。
[0097]
优点
[0098]
本技术例如在用于伤口治疗方案中时提供了显著的优点。
[0099]
例如,在伤口愈合期间控制生物膜的常规尝试可通过产生eps基质而变得困难,所述eps基质可构成形成生物膜的基质的至少一部分,将生物膜锚定到各种伤口表面,物理保护细菌细胞或这些的组合。不受理论的束缚,据信本技术的敷料可例如通过破坏或降解eps基质来有效控制生物膜。因此,生物可吸收层可有效降低生物膜附近的ph并破坏eps基质,从而暴露eps基质内的细菌并使这些细菌易受吸收性抗微生物层的抗微生物活性的影响。例如,并非旨在受理论的束缚,与在不存在生物可吸收层的情况下使用时相比,通过破坏eps基质,生物可吸收层可相对更有效地改善吸收性抗微生物层的抗微生物活性。在本文的任何实施方案中,相对于在不存在eps活性剂的情况下包括吸收性抗微生物层的敷料,本技术的敷料可包括改进的敷料。例如,改进可包括包含eps活性剂的层,诸如生物可吸收层。在任何实施方案中,本文所述的敷料可用于降低生物膜的微生物浓度的方法中。该方法包括将敷料施加到伤口部位。在本文的任何实施方案中,与由单独的吸收性抗微生物层产生的微生物的浓度降低相比,微生物的浓度可降低至少约1log、约2log、约3log或包括这些值中的任意两个值和/或介于这些值中的任意两个值之间的任何范围。
[0100]
本文的示例被提供以说明本技术的优点和有益效果,并且进一步帮助本领域的普通技术人员制备或使用本技术的敷料。本文的示例还被呈现以便更全面地说明本技术的优选方面。这些示例绝不应理解为限制如所附权利要求限定的本技术的范围。示例可包括或结合上述本技术的任何变型、方面或实施方案。上述变型、方面或实施方案还可各自包括或
结合本技术的任何或所有其他变型、方面或实施方案的变型。
[0101]
实施例
[0102]
称取2克明胶粉末,将其添加到烧杯中的100ml去离子水中,并混合以形成溶液。向溶液中添加1克柠檬酸以制备1%柠檬酸溶液。使用2克柠檬酸重复该过程以制备2%柠檬酸溶液。将甘油作为增塑剂以25μl的浓度添加到1%柠檬酸溶液和2%柠檬酸溶液中的每一者。将每种溶液再混合5分钟。将1%柠檬酸溶液和2%柠檬酸溶液中的每一者取31克添加到10cm乘10cm正方形培养皿中,并且干燥过夜,获得具有不同柠檬酸浓度的膜。将所得膜施加到抗微生物基底(具体地,购自acelity的silvercel
tm
)以产生各种敷料,具体地包含silvercel
tm
1%柠檬酸的敷料和不含silvercel
tm
2%柠檬酸的敷料。使用抑菌圈测定来评估这些敷料对目标细菌的能力,在该抑菌圈测定中,敷料暴露于已存在细菌菌苔的培养皿。让细菌生长,并评估各个敷料的抗微生物活性。
[0103]
参见图4,示出了包含柠檬酸与抗微生物基底(具体地,购自acelity的silvercel
tm
敷料)的组合的膜对生物膜的影响。更具体地,图4示出了在暴露于各种试验之前存在109cfu/盘的生物膜群体(具体地,铜绿假单胞菌生物膜)。对于以下每种敷料,在24小时后评估生物膜群体,具体地(i)对照,(ii)单独的silvercel
tm
(0%柠檬酸),(iii)silvercel
tm
1%柠檬酸,(iv)silvercel
tm
2%柠檬酸,以及(v)prontosan凝胶,凝胶生物膜。
[0104]
如图所示,单独的silvercel
tm
(0%柠檬酸)提供大约3log的减少;然而,柠檬酸的添加导致生物膜群体的总活菌计数的显著改善的减少,更具体地,超过4log的减少至检出限。
[0105]
等同物
[0106]
虽然已举例说明和描述了某些实施方案,但本领域的普通技术人员在阅读上述说明书之后可对如本文所述的本技术的化合物或其盐、药物组合物、衍生物、前药、代谢物、互变异构体或外消旋混合物进行变化、等同物替换和其他类型的改变。上文所述的每个方面和实施方案也可包括或结合有如关于其他方面和实施方案中的任一个或全部所公开的此类变型或方面。
[0107]
本技术在本文所述的特定方面也不受限制,所述特定方面旨在作为本技术的各个方面的单个例示。如对于本领域技术人员而言将显而易见的那样,在不脱离本技术的实质和范围的情况下,可对本技术进行许多修改和变化。通过前面的描述,除了本文所枚举的那些之外,本技术的范围内的功能等同的方法对于本领域的技术人员而言将是显而易见的。此类修改和变化旨在落入所附权利要求的范围内。应当理解,本技术不限于当然可变化的特定方法、试剂、化合物、组合物、标记化合物或生物系统。还应当理解,本文所用的术语仅用于描述特定方面的目的,并非旨在进行限制。因此,本说明书旨在被认为是示例性的,其中本技术的广度、范围和实质仅由所附权利要求书、其中的定义及其任何等同物指示。
[0108]
本文例示性地描述的实施方案可在不存在本文未具体公开的任何一个或多个要素、一个或多个限制的情况下适当地实践。因此,例如,术语“包含”、“包括”、“含有”等应被广义地且非限制地理解。另外,本文所用的术语和表达已被用作描述而非限制的术语,并且在此类术语和表达的使用中无意排除所示出和描述的特征或其部分的任何等同物,但应当认识到,在受权利要求书保护的技术的范围内的各种修改是可能的。另外,短语“基本上由...组成”将被理解为包括具体列举的那些要素以及不会实质上影响受权利要求书保护
的技术的基本特征和新颖特征的那些附加要素。短语“由...组成”不包括未指定的任何要素。
[0109]
另外,在以马库什群组描述本公开的特征或方面的情况下,本领域的技术人员将认识到,本公开也由此以马库什群组的任何单个成员或成员子群组进行描述。落入一般公开内容内的较窄种类和亚属分组中的每一者也构成本发明的一部分。这包括本发明的一般性描述,前提条件或负限制是从属中去除任何主题,而不管本文是否具体叙述了切除的材料。
[0110]
如本领域的技术人员将理解的那样,出于任何和所有目的,特别是在提供书面描述方面,本文所公开的所有范围还涵盖任何和所有可能的子范围及其子范围的组合。任何列出的范围可以容易地被识别为充分描述并使得相同的范围被分解成至少相等的一半、三分之一、四分之一、五分之一、十分之一等。作为非限制性示例,本文讨论的每个范围可以被容易地分解成下三分之一、中三分之一和上三分之一等。如本领域的技术人员还将理解的那样,所有语言如“多达”、“至少”、“大于”、“小于”等包括所述数字,并且是指随后可分解成如上所述的子范围的范围。最后,如本领域的技术人员将理解的那样,范围包括每个单独的成员。
[0111]
本说明书中提及的所有出版物、专利申请、已公布专利和其他文献(例如,杂志、论文和/或教科书)均以引用方式并入本文,如同每个单独的出版物、专利申请、已公布专利或其他文献被具体且单独地指出全文将以引用方式并入。以引用方式并入的文本中包含的定义与本公开中的定义相矛盾时将被排除。
[0112]
本技术可包括但不限于以下带字母的段落中所述的特征和特征的组合,应当理解,以下段落不应被解释为限制所附权利要求书的范围或强制规定所有此类特征必须包括在此类权利要求书中:
[0113]
a.一种敷料,所述敷料包括:
[0114]
吸收性抗微生物层,所述吸收性抗微生物层包含非织造纤维;和
[0115]
生物可吸收层,所述生物可吸收层包含细胞外聚合物物质(eps)活性剂。
[0116]
b.根据段落a所述的敷料,其中所述吸收性抗微生物层包含藻酸盐。
[0117]
c.根据段落a或段落b所述的敷料,其中所述吸收性抗微生物层包含羧甲基纤维素。
[0118]
d.根据段落a至c中任一项所述的敷料,其中所述非织造纤维的至少一部分包含具有抗微生物涂层的尼龙纤维。
[0119]
e.根据段落d所述的敷料,其中所述抗微生物涂层包含银。
[0120]
f.根据段落a至e中任一项所述的敷料,其中所述非织造纤维的至少一部分包含吸收性纤维。
[0121]
g.根据段落f所述的敷料,其中所述吸收性纤维包含纤维素材料。
[0122]
h.根据段落f或段落g所述的敷料,其中所述吸收性纤维包含羧甲基纤维素纤维和藻酸盐纤维。
[0123]
i.根据段落f至h中任一项所述的敷料,其中所述吸收性纤维包含纤维素乙基磺酸盐纤维。
[0124]
j.根据段落a至i中任一项所述的敷料,其中所述eps活性剂包含柠檬酸。
[0125]
k.根据段落j所述的敷料,其中所述eps活性剂包含0.1%至5%的柠檬酸。
[0126]
l.根据段落j或段落k所述的敷料,其中所述eps活性剂包含0.5%至2.5%的柠檬酸。
[0127]
m.根据段落j至l中任一项所述的敷料,其中所述柠檬酸被掺入所述生物可吸收层内。
[0128]
n.根据段落a至m中任一项所述的敷料,其中所述生物可吸收层包含明胶、胶原蛋白、氧化再生纤维素(orc)或它们中的任何两种或更多种的组合物。
[0129]
o.根据段落a至n中任一项所述的敷料,其中所述生物可吸收层为膜。
[0130]
p.根据段落a至o中任一项所述的敷料,所述敷料还包括非粘附层,其中所述生物可吸收层定位在所述吸收性抗微生物层与所述非粘附伤口接触层之间。
[0131]
q.根据段落p所述的敷料,其中所述非粘附伤口接触层包含甲基丙烯酸乙酯。
[0132]
r.根据段落p或段落q所述的敷料,其中所述非粘附伤口接触层为膜。
[0133]
s.根据段落a至r中任一项所述的敷料,所述敷料还包括覆盖件,所述覆盖件定位在所述吸收性抗微生物层、所述生物可吸收层和所述非粘附伤口接触层上方并且被构造成密封到所述组织部位周围的组织。
[0134]
t.一种用于向组织部位提供治疗的系统,所述系统包括根据段落a至s中任一项所述的敷料。
[0135]
u.一种用于向组织部位提供治疗的方法,所述方法包括将根据段落a至s中任一项所述的敷料邻近所述组织部位定位。
[0136]
v.根据段落u所述的方法,所述方法还包括向所述组织部位提供负压。
[0137]
w.一种敷料,所述敷料包括:
[0138]
吸收性抗微生物层,所述吸收性抗微生物层由非织造纤维形成;
[0139]
生物可吸收层,所述生物可吸收层被构造成降解生物膜的至少一部分;和
[0140]
非粘附伤口接触层;
[0141]
其中所述生物可吸收层定位在所述吸收性抗微生物层与所述非粘附伤口接触层之间。
[0142]
x.根据段落w所述的敷料,其中所述生物可吸收层包含柠檬酸。
[0143]
y.根据段落x所述的敷料,其中所述生物可吸收层包含介于0.1%和5%之间的柠檬酸。
[0144]
z.根据段落x或段落y所述的敷料,其中所述生物可吸收层包含介于0.5%和2.5%之间的柠檬酸。
[0145]
aa.根据段落x至z中任一项所述的敷料,其中所述吸收性抗微生物层包含藻酸盐。
[0146]
ab.根据段落x至aa中任一项所述的敷料,其中所述吸收性抗微生物层包含羧甲基纤维素。
[0147]
ac.一种用于向组织部位提供治疗的系统,所述系统包括根据段落x至ab中任一项所述的敷料。
[0148]
ad.一种用于向组织部位提供治疗的方法,所述方法包括将根据段落x至ab中任一项所述的敷料邻近所述组织部位定位。
[0149]
ae.根据段落ad所述的方法,所述方法还包括向所述组织部位提供负压。
[0150]
af.一种敷料,所述敷料包括:
[0151]
第一层,所述第一层包含吸收性纤维和抗微生物纤维;和
[0152]
第二层,所述第二层包含生物可吸收材料和细胞外聚合物物质(eps)活性剂。
[0153]
ag.根据段落af所述的敷料,其中所述吸收性纤维包含藻酸盐纤维。
[0154]
ah.根据段落af或段落ag所述的敷料,其中所述吸收性纤维包含羧甲基纤维素。
[0155]
ai.根据段落af至ah中任一项所述的敷料,其中所述抗微生物纤维包含具有抗微生物涂层的尼龙纤维。
[0156]
aj.根据段落ai所述的敷料,其中所述抗微生物涂层包含银。
[0157]
ak.根据段落af至aj中任一项所述的敷料,其中所述吸收性纤维包含纤维素材料。
[0158]
al.根据段落af至ak中任一项所述的敷料,其中所述吸收性纤维包含羧甲基纤维素纤维和藻酸盐纤维。
[0159]
am.根据段落af至al中任一项所述的敷料,其中所述吸收性纤维包含纤维素乙基磺酸盐纤维。
[0160]
an.根据段落af至am中任一项所述的敷料,其中所述eps活性剂包含柠檬酸。
[0161]
ao.根据段落an所述的敷料,其中所述eps活性剂包含0.1%至5%的柠檬酸。
[0162]
ap.根据段落an或段落ao所述的敷料,其中所述eps活性剂包含0.5%至2.5%的柠檬酸。
[0163]
aq.根据段落af至ap中任一项所述的敷料,其中所述生物可吸收材料包括明胶、胶原蛋白、氧化再生纤维素(orc)或它们中的任何两种或更多种的组合物。
[0164]
ar.根据段落af至aq中任一项所述的敷料,其中所述第二层为膜。
[0165]
as.根据段落af至ar中任一项所述的敷料,所述敷料还包括非粘附层,其中所述第二层定位在所述第一层与所述非粘附层之间。
[0166]
at.根据段落as所述的敷料,其中所述非粘附层包含甲基丙烯酸乙酯。
[0167]
au.根据段落as或段落at所述的敷料,其中所述非粘附层为膜。
[0168]
av.一种用于向组织部位提供治疗的系统,所述系统包括根据段落af至au中任一项所述的敷料。
[0169]
aw.一种用于向组织部位提供治疗的方法,所述方法包括将根据段落af至au中任一项所述的敷料邻近所述组织部位定位。
[0170]
ax.根据段落aw所述的方法,所述方法还包括向所述组织部位提供负压。
[0171]
ay.一种敷料,所述敷料包括:
[0172]
吸收性抗微生物层,所述吸收性抗微生物层包含吸收性纤维和抗微生物纤维;和
[0173]
生物可吸收层,所述生物可吸收层包含生物可吸收材料和细胞外聚合物物质(eps)活性剂。
[0174]
az.根据段落ay所述的敷料,其中所述吸收性纤维包含藻酸盐纤维。
[0175]
ba.根据段落ay或段落az所述的敷料,其中所述吸收性纤维包含羧甲基纤维素。
[0176]
bb.根据段落ay至ba中任一项所述的敷料,其中所述抗微生物纤维包含具有抗微生物涂层的尼龙纤维。
[0177]
bc.根据段落bb所述的敷料,其中所述抗微生物涂层包含银。
[0178]
bd.根据段落ay至bc中任一项所述的敷料,其中所述吸收性纤维包含纤维素材料。
[0179]
be.根据段落ay至bd中任一项所述的敷料,其中所述吸收性纤维包含羧甲基纤维素纤维和藻酸盐纤维。
[0180]
bf.根据段落ay至be中任一项所述的敷料,其中所述吸收性纤维包含纤维素乙基磺酸盐纤维。
[0181]
bg.根据段落ay至bf中任一项所述的敷料,其中所述eps活性剂包含柠檬酸。
[0182]
bh.根据段落ay至bg中任一项所述的敷料,其中所述eps活性剂包含柠檬酸,并且其中所述生物可吸收层包含按所述生物可吸收层的重量计0.1%至5%的柠檬酸。
[0183]
bi.根据段落ay至bh中任一项所述的敷料,其中所述生物可吸收材料包括明胶、胶原蛋白、氧化再生纤维素(orc)或它们中的任何两种或更多种的组合物。
[0184]
bj.根据段落ay至bi中任一项所述的敷料,其中所述生物可吸收材料包含胶原蛋白和氧化再生纤维素(orc),其中所述生物可吸收层中的胶原蛋白与orc的重量比为约60:40至约40:60。
[0185]
bk.根据段落ay至bj中任一项所述的敷料,其中所述生物可吸收层为膜。
[0186]
bl.根据段落ay至bk中任一项所述的敷料,其中所述敷料还包括非粘附层。
[0187]
bm.根据段落bl所述的敷料,其中所述生物可吸收层定位在所述吸收性抗微生物层与所述非粘附层之间。
[0188]
bn.根据段落bl或段落bm所述的敷料,其中所述非粘附层包含甲基丙烯酸乙酯。
[0189]
bo.根据段落bl至bn中任一项所述的敷料,其中所述非粘附层为膜。
[0190]
bp.根据段落bl至bo中任一项所述的敷料,所述敷料还包括覆盖件,所述覆盖件定位在所述吸收性抗微生物层、所述生物可吸收层和所述非粘附层上方,其中所述覆盖件被构造成密封到组织部位周围的组织。
[0191]
bq.根据段落ay至bp中任一项所述的敷料,其中所述吸收性纤维和抗微生物纤维在所述吸收性抗微生物层中为非织造的。
[0192]
br.一种用于向组织部位提供治疗的方法,所述方法包括将根据段落ay至bq中任一项所述的敷料邻近所述组织部位定位。
[0193]
bs.根据段落br所述的方法,所述方法还包括向所述组织部位提供负压。
[0194]
其他实施方案在以下权利要求中连同赋予此类权利要求的等同物的全部范围一起阐述。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

