1.本发明属于酸枣提取物技术领域,涉及一种酸枣果抗菌增敏活性精制物,还涉及上述精制物的制备方法、应用。
背景技术:
2.近年来,在治疗细菌感染时,由于抗生素的不当使用导致出现广泛的耐药性细菌,导致现有的抗生素对耐药菌的疗效较差。鉴于细菌耐药性的不断出现,寻找新的有效解决耐药性问题的方法刻不容缓。其中,植物天然化合物是开发新型抗菌药物的重要潜在来源,许多植物已经被研究并可以作为抗菌增敏类药物发挥作用。该类药物的特点是,其本身并不具有或仅具有弱的抗菌作用,但可以改变或者修饰细菌的表型,提高或恢复现有抗菌药物的抗菌活性。由于该类药物对细菌不会产生直接的选择压力,因此不会诱导针对该类药物的耐药菌株的产生。最近,有研究表明植物源药物可作为抗生素的协同增强剂,使用药用植物进行协同治疗具有许多潜在的重要优势,如提高效率,减少不良影响和提高稳定性。如今已报道了的植物抗菌增敏剂有生物碱、含硫化合物、萜类化合物、酚类以及单宁等化合物。因此,开发与传统抗生素具有协同作用的植物提取物将是解决抗生素耐药的方法之一。
技术实现要素:
3.本发明的第一种目的是提供一种酸枣果抗菌增敏活性精制物,解决了现有抗生素对耐药菌疗效较差的问题。
4.本发明所采用的第一种技术方案是,一种酸枣果抗菌增敏活性精制物,按照质量百分比包括以下组分:
5.28.57~31.57%反油酸、23.45~25.91%油酸、10.96~12.12%顺
‑
10
‑
十六碳烯醇、10.01~11.07%棕榈酸、3.77~4.17%1
‑
二十四烯、2.75~3.03%岩芹酸、2.01~2.23%顺
‑
11
‑
十八碳烯酸、1.98~2.18%反
‑
13
‑
十八碳烯酸、1.96~2.16%顺,顺
‑
13,16二十二碳二烯酸、1.86~2.06%二十五烷、1.37~1.51%亚油酸、1.03~1.13%亚油酸甲酯、1.02~1.12%顺
‑
11
‑
二十碳烯酸、1.00~1.10%芥酸、0.93~1.03%顺
‑
13
‑
十八碳烯醛、0.81~0.89%反
‑9‑
十八碳烯酸甲酯、0.61~0.67%顺
‑
11二十烯酸、0.30~0.34%顺
‑9‑
十四碳烯
‑1‑
醇乙酸酯、0.31~0.35%顺,顺
‑
9,12
‑
十六碳二烯酸、0.11~0.13%1
‑
棕榈酸单甘油酯、0.06~0.08%1
‑
十三烯、0.04~0.06%13
‑
甲基十四烷酸甲酯、0.04~0.06%己酸、0.02~0.04%2
‑
氨基丁酸和0.01~0.03%庚酸,以上组分之和为100%。
6.本发明的第二种目的是提供一种酸枣果抗菌增敏活性精制物的制备方法。
7.本发明所采用的第二种技术方案是,一种酸枣果抗菌增敏活性精制物的制备方法,包括以下步骤:
8.步骤1、将酸枣果制成酸枣粉,采用氯仿对酸枣粉进行提取,得到氯仿提取物;
9.步骤2、对氯仿提取物进行硅胶柱色谱分离;
10.将所述氯仿提取物溶解于氯仿并充分混匀,然后将硅胶搅入其中混合均匀,蒸干
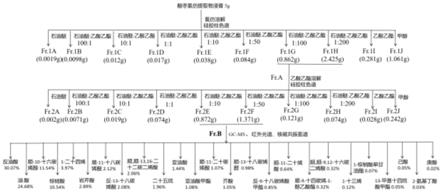
氯仿后湿法装柱,采用洗脱剂进行洗脱提纯,其中洗脱过程具体为:采用石油醚、石油醚:乙酸乙酯=100:1、石油醚:乙酸乙酯=10:1、石油醚:乙酸乙酯=1:1、石油醚:乙酸乙酯=1:50、石油醚:乙酸乙酯=1:100、石油醚:乙酸乙酯=1:200、乙酸乙酯、甲醇依次进行洗脱,并分别收集洗脱相,对洗脱相依次命名为fr.1a、fr.1b、fr.1c、fr.1d、fr.1e、fr.1f、fr.1g、fr.1h、fr.1i、fr.1j,将fr.1g和fr.1h合并,并命名为fr.a;对fr.a进行蒸馏浓缩、真空干燥,然后低温保存;
11.步骤3、对fr.a进行硅胶柱色谱分离;
12.将步骤2处理后的fr.a溶解于乙酸乙酯并充分混匀,然后将硅胶搅入其中混合均匀,蒸干乙酸乙酯后湿法装柱,采用洗脱剂进行洗脱提纯,其中洗脱过程具体为:采用石油醚:乙酸乙酯=100:1、石油醚:乙酸乙酯=10:1、石油醚:乙酸乙酯=1:1、石油醚:乙酸乙酯=1:10、石油醚:乙酸乙酯=1:50、石油醚:乙酸乙酯=1:100、石油醚:乙酸乙酯=1:200、乙酸乙酯、甲醇依次进行洗脱,并分别收集洗脱相,对洗脱相依次命名为fr.2a、fr.2b、fr.2c、fr.2d、fr.2e、fr.2f、fr.2g、fr.2h、fr.2i、fr.2j,将fr.2d和fr.2e合并,并命名为fr.b,对fr.b进行蒸馏浓缩、真空干燥,得到酸枣果抗菌增敏活性精制物fr.b。
13.本发明的第三种目的是提供一种酸枣果抗菌增敏活性精制物可用于制备抗菌药物。
14.本发明所采用的第三种技术方案是,一种酸枣果抗菌增敏活性精制物可用于制备抗菌药物。
15.本发明的第四种目的是提供一种酸枣果抗菌增敏活性精制物可用于制备抗菌增敏剂。
16.本发明所采用的第四种技术方案是,一种酸枣果抗菌增敏活性精制物可用于制备抗菌增敏剂。
17.本发明的第五种目的是提供一种酸枣果抗菌增敏活性精制物可用于制备治疗皮肤耐药菌感染的抗菌软膏。
18.本发明所采用的第五种技术方案是,一种酸枣果抗菌增敏活性精制物可用于制备治疗皮肤耐药菌感染的抗菌软膏。
19.本发明的第六种目的是提供一种用于制备治疗皮肤耐药菌感染的抗菌软膏。
20.本发明所采用的第六种技术方案是,一种用于制备治疗皮肤耐药菌感染的抗菌软膏,按照质量百分比包括以下组分:
21.酸枣果抗菌增敏活性精制物0.5%~3%、软膏基质90%~97%、抗生素0.5%~5%,余量为有机溶剂,以上组分的和为100%。
22.软膏基质包括凡士林、液体石蜡、聚乙二醇、二甲基硅油、蜂蜡、羊毛脂、硬脂酸中的一种或多种的混合物。
23.本发明的第七种目的是提供一种用于制备治疗皮肤耐药菌感染的抗菌软膏的制备方法。
24.本发明所采用的第七种技术方案是,一种用于制备治疗皮肤耐药菌感染的抗菌软膏的制备方法,包括以下步骤:
25.步骤1、按照上述的比例称取软膏基质、抗生素、酸枣果抗菌增敏活性精制物和有机溶剂,并对软膏基质进行水浴加热使其融化,得到基质液体;
26.步骤2、将抗生素溶于有机溶剂中,得到抗生素溶液;
27.步骤3、将酸枣果抗菌增敏活性精制物溶于无水乙醇中,得到fr.b溶液;
28.步骤4、使基质液体温度降至50~55℃时,在搅拌下向基质液体中加入抗生素溶液、fr.b溶液,得到抗菌软膏。
29.本发明的第八种目的是提供一种用于制备治疗皮肤耐药菌感染的抗菌软膏。
30.本发明所采用的第八种技术方案是,一种用于制备治疗皮肤耐药菌感染的抗菌软膏,包括fr.b软膏和抗生素软膏,所述fr.b软膏和抗生素软膏的质量比为1:1~5,所述fr.b软膏按照质量百分比包括以下组分:
31.酸枣果抗菌增敏活性精制物1%~6%、软膏基质92%~97%,余量为有机溶剂,以上组分的和为100%。
32.本发明的第九种目的是提供一种用于制备治疗皮肤耐药菌感染的抗菌软膏的制备方法。
33.本发明所采用的第九种技术方案是,一种用于制备治疗皮肤耐药菌感染的抗菌软膏的制备方法,包括以下步骤:
34.步骤1、按照上述的比例称取软膏基质、酸枣果抗菌增敏活性精制物和有机溶剂,并对软膏基质进行水浴加热使其融化,得到基质液体;
35.步骤2、将酸枣果抗菌增敏活性精制物溶于无水乙醇中,得到fr.b溶液;
36.步骤3、使基质液体温度降至50~55℃时,在搅拌下向基质液体中加入fr.b溶液,得到fr.b软膏;
37.步骤4、将fr.b软膏与抗生素软膏按1:1~5比例混匀,得到抗菌软膏。
38.本发明的有益效果是:
39.本发明的一种酸枣果抗菌增敏活性精制物,主要成分为脂肪酸,通过改变细胞的通透性从而增强抗生素对耐药菌的杀菌效果,具有广谱的抗菌增敏活性,能起到消炎以及促伤口愈合作用。
40.本发明的一种酸枣果抗菌增敏活性精制物的制备方法,产率高,成本低。
41.本发明的一种酸枣果抗菌增敏活性精制物fr.b可用于制备抗菌药物,将酸枣果活性精制物fr.b用于制备抗菌药物,具有消炎以及促伤口愈合作用。
42.本发明的一种用于制备治疗皮肤耐药菌感染的抗菌软膏,将酸枣果抗菌增敏活性精制物fr.b用于制备治疗皮肤耐药菌感染的抗菌软膏,该抗菌软膏粘稠度适中、涂展性良好,便于皮肤涂抹用药,临床使用较方便;酸枣果抗菌增敏活性精制物fr.b能显著增强抗生素的抗菌作用。
43.本发明的一种用于制备治疗皮肤耐药菌感染的抗菌软膏的制备方法,操作简单、条件温和、无环境污染;将fr.b和抗生素软膏联合使用,能提高抗生素软膏的治疗效果。
附图说明
44.图1是本发明一种酸枣果抗菌增敏活性精制物的制备方法的流程图;
45.图2为本发明一种酸枣果抗菌增敏活性精制物fr.b的红外光谱谱图;
46.图3为本发明一种酸枣果抗菌增敏活性精制物fr.b的核磁共振氢谱谱图;
47.图4为本发明一种酸枣果抗菌增敏活性精制物fr.b与抗生素联用对耐甲氧西林金
黄色葡萄球菌(mrsa)和白色念珠菌生长的影响;
48.图5为本发明一种酸枣果抗菌增敏活性精制物fr.b对mrsa细胞壁通透性的影响;
49.图6为本发明一种酸枣果抗菌增敏活性精制物fr.b对mrsa细胞膜通透性和完整性的影响;
50.图7为本发明一种用于制备治疗皮肤耐药菌感染的抗菌软膏中红霉素和fr.b的最佳配比的筛选;
51.图8为本发明一种用于制备治疗皮肤耐药菌感染的抗菌软膏的试验中小鼠感染模型建立图;
52.图9为本发明一种用于制备治疗皮肤耐药菌感染的抗菌软膏的试验中不同时间间隔的小鼠伤口愈合情况;
53.图10为本发明一种用于制备治疗皮肤耐药菌感染的抗菌软膏的试验中不同处理下小鼠创面菌落计数;
54.图11为本发明一种用于制备治疗皮肤耐药菌感染的抗菌软膏的试验中不同时间间隔的小鼠伤口愈合情况;
55.图12为本发明一种用于制备治疗皮肤耐药菌感染的抗菌软膏的试验中不同处理下小鼠创面菌落计数。
具体实施方式
56.下面结合附图和具体实施方式对本发明进行详细说明。
57.一种酸枣果抗菌增敏活性精制物,按照质量百分比包括以下组分:
58.28.57~31.57%反油酸、23.45~25.91%油酸、10.96~12.12%顺
‑
10
‑
十六碳烯醇、10.01~11.07%棕榈酸、3.77~4.17%1
‑
二十四烯、2.75~3.03%岩芹酸、2.01~2.23%顺
‑
11
‑
十八碳烯酸、1.98~2.18%反
‑
13
‑
十八碳烯酸、1.96~2.16%顺,顺
‑
13,16二十二碳二烯酸、1.86~2.06%二十五烷、1.37~1.51%亚油酸、1.03~1.13%亚油酸甲酯、1.02~1.12%顺
‑
11
‑
二十碳烯酸、1.00~1.10%芥酸、0.93~1.03%顺
‑
13
‑
十八碳烯醛、0.81~0.89%反
‑9‑
十八碳烯酸甲酯、0.61~0.67%顺
‑
11二十烯酸、0.30~0.34%顺
‑9‑
十四碳烯
‑1‑
醇乙酸酯、0.31~0.35%顺,顺
‑
9,12
‑
十六碳二烯酸、0.11~0.13%1
‑
棕榈酸单甘油酯、0.06~0.08%1
‑
十三烯、0.04~0.06%13
‑
甲基十四烷酸甲酯、0.04~0.06%己酸、0.02~0.04%2
‑
氨基丁酸和0.01~0.03%庚酸,以上组分之和为100%。
59.一种酸枣果抗菌增敏活性精制物的制备方法,包括以下步骤:
60.步骤1、将酸枣果制成酸枣粉,采用氯仿对酸枣粉进行提取,得到氯仿提取物;
61.具体的,步骤1.1、取成熟的野生酸枣果,选取无机械损伤、大小颜色均匀、无病虫害的果实,洗去表面污物,放入烘箱45℃烘干,粉粹,过80目筛,得酸枣粉,共10kg,放入自封袋中冰箱保存备用。
62.步骤1.2、先将酸枣粉用石油醚脱脂处理,再与氯仿按料液体积比1:3的比例混合,然后置于超声波清洗仪中,超声功率800w,超声温度15
‑
20℃,超声50min,过滤,滤渣自然风干,滤液放入旋转蒸发仪,水浴温度40℃,转速120rpm,冷凝温度4℃,压强0.09mpa,待溶剂挥发尽,得到氯仿提取物。
63.步骤2、对氯仿提取物进行硅胶柱色谱分离;
64.步骤2.1、样品处理将5g氯仿提取物溶解于氯仿并充分混匀,;
65.步骤2.2、湿法装柱称取260g 200
‑
300目硅胶,浸泡于石油醚洗脱液中,充分搅拌;待硅胶中没有气泡时,添加至规格为95mm
×
55cm的玻璃色谱柱中,添加过程中不能产生气泡;待洗脱液流滴一段时间后,封口,静置过夜;
66.步骤2.3、湿法上样称取95g 100
‑
200目硅胶与步骤1处理后的氯仿提取物搅拌混匀,蒸干氯仿,然后通过湿法装柱的方法装入柱内;
67.步骤2.4、采用洗脱剂进行洗脱提纯,其中洗脱过程具体为:采用石油醚、石油醚:乙酸乙酯=100:1、石油醚:乙酸乙酯=10:1、石油醚:乙酸乙酯=1:1、石油醚:乙酸乙酯=1:50、石油醚:乙酸乙酯=1:100、石油醚:乙酸乙酯=1:200、乙酸乙酯、甲醇依次进行洗脱,并分别收集洗脱相,对洗脱相依次命名为fr.1a、fr.1b、fr.1c、fr.1d、fr.1e、fr.1f、fr.1g、fr.1h、fr.1i、fr.1j,将fr.1g和fr.1h合并,并命名为fr.a;
68.步骤2.5、在旋转蒸发仪上对fr.a进行真空蒸馏浓缩,在45℃下真空干燥,然后低温保存。
69.步骤3、对fr.a进行硅胶柱色谱分离;
70.步骤3.1、样品处理将步骤2处理后的fr.a用乙酸乙酯充分溶解备用;
71.步骤3.2、湿法装柱称取90g的200
‑
300目硅胶采用湿法装柱的方式装入规格为45mm
×
52cm的玻璃色谱柱内,静置过夜;
72.步骤3.3、湿法上样称取20g的100
‑
200目硅胶与步骤1处理后的fr.a搅拌混匀,蒸干乙酸乙酯,然后通过湿法装柱的方法装入柱内;
73.步骤3.4、采用洗脱剂进行洗脱提纯,其中洗脱过程具体为:采用石油醚:乙酸乙酯=100:1、石油醚:乙酸乙酯=10:1、石油醚:乙酸乙酯=1:1、石油醚:乙酸乙酯=1:10、石油醚:乙酸乙酯=1:50、石油醚:乙酸乙酯=1:100、石油醚:乙酸乙酯=1:200、乙酸乙酯、甲醇依次进行洗脱,并分别收集洗脱相,对洗脱相依次命名为fr.2a、fr.2b、fr.2c、fr.2d、fr.2e、fr.2f、fr.2g、fr.2h、fr.2i、fr.2j,将fr.2d和fr.2e合并,并命名为fr.b;
74.步骤3.5、在旋转蒸发仪上对fr.b进行真空蒸馏浓缩,并在45℃下真空干燥,得到酸枣果抗菌增敏活性精制物fr.b。
75.一种酸枣果抗菌增敏活性精制物fr.b可用于制备抗菌药物。
76.一种酸枣果抗菌增敏活性精制物fr.b可用于制备治疗皮肤耐药菌感染的抗菌增敏剂,可用于人或动物皮肤耐药菌感染的辅助治疗。
77.一种酸枣果抗菌增敏活性精制物fr.b可用于制备治疗皮肤耐药菌感染的抗菌软膏。
78.一种用于制备治疗皮肤耐药菌感染的抗菌软膏,按照质量百分比包括以下组分:
79.酸枣果抗菌增敏活性精制物fr.b 0.5%~3%、软膏基质90%~97%、抗生素0.5%~5%,余量为有机溶剂,以上组分的和为100%。
80.软膏基质包括凡士林、液体石蜡、聚乙二醇、二甲基硅油、蜂蜡、羊毛脂、硬脂酸中的一种或多种的混合物。
81.软膏基质包括凡士林、液体石蜡,所述凡士林、液体石蜡的质量比为2~3∶1。
82.抗生素为红霉素、夫西地酸、莫匹罗星、庆大霉素、氯霉素、新霉素、四环素、金霉素、氧氟沙星、克林霉素、环丙沙星、林可霉素、多粘菌素、酮康唑、两性霉素b、制霉菌素、灰
黄霉素、克念菌素、克霉唑、咪康唑、益康唑、联苯苄唑、特比萘芬、氟胞嘧啶、球红霉素、甲帕霉素、氟康唑、伊曲康唑等已在临床上使用的外用抗菌药物中的一种。
83.机溶剂为无水乙醇、二甲基亚砜、甘油中的一种或多种的混合物。
84.一种用于制备治疗皮肤耐药菌感染的抗菌软膏的制备方法,包括以下步骤:
85.步骤1、按照上述比例称取软膏基质、抗生素、酸枣果抗菌增敏活性精制物fr.b和有机溶剂,并对软膏基质进行水浴加热约至60℃,使其完全融化,得到基质液体;
86.步骤2、将抗生素溶于有机溶剂中,得到抗生素溶液;
87.步骤3、将fr.b精制物溶于无水乙醇中,得到fr.b溶液;
88.步骤4、使基质液体温度降至50℃
‑
55℃时,在搅拌下向基质液体中加入抗生素溶液、fr.b溶液,得到抗菌软膏。
89.一种用于制备治疗皮肤耐药菌感染的抗菌软膏,包括fr.b软膏和抗生素软膏,所述fr.b软膏和抗生素软膏的质量比为1:1~5,所述fr.b软膏按照质量百分比包括以下组分:
90.酸枣果抗菌增敏活性精制物fr.b 1%~6%、软膏基质92%~97%,余量为有机溶剂,以上组分的和为100%。
91.一种用于制备治疗皮肤耐药菌感染的抗菌软膏的制备方法,包括以下步骤:
92.步骤1、按照前述的比例称取软膏基质、酸枣果抗菌增敏活性精制物fr.b和有机溶剂,并对软膏基质进行水浴加热约至60℃,使其完全融化,得到基质液体;
93.步骤2、将fr.b精制物溶于无水乙醇中,得到fr.b溶液;
94.步骤3、使基质液体温度降至50℃
‑
55℃时,在搅拌下向基质液体中加入fr.b溶液,得到fr.b软膏。
95.步骤4、将fr.b软膏与抗生素软膏按1:1~5比例混匀,得到抗菌软膏。fr.b软膏可以与任何市场上的抗生素软膏配合使用,作为抗生素软膏的辅助药物,无需提前制成fr.b 特定抗生素的混合软膏,应用范围更广。
96.实施例1
97.将洗脱物fr.1a、fr.1b、fr.1c、fr.1d、fr.1e、fr.1f、fr.1g、fr.1h、fr.1i、fr.1j分别与氨苄青霉素(amp)联合使用对铜绿假单胞菌做联合抑菌试验,对上述洗脱物进行活性检测;
98.(1)菌液的制备:37℃、220rpm将供试菌株振摇培养过夜,待菌液od600=1.0时,将其稀释至1
×
106cfu/ml;
99.(2)各分离组分的配制:将各洗脱物经准确称量后,使用无水乙醇溶解并分别配制成浓度为2560mg/ml、1280mg/ml、640mg/ml、400mg/ml、320mg/ml、200mg/ml、160mg/ml、100mg/ml、80mg/ml、50mg/ml、40mg/ml、20mg/ml、1mg/ml、0.5mg/ml和0.25mg/ml的母液;
100.(3)抗生素的配制:将溶于无菌水中的amp使用培养基稀释至浓度为4096μg/ml的母液,过滤除菌后备用;
101.(4)加样:对于单独药敏实验,先向96孔板中每孔加入100μl lb培养基,在第一个孔内加入100μl浓度为4096μg/ml的amp,再从中吸出100μl到第二个孔内,依次类推,使抗生素浓度依次稀释2倍,再向每孔中加入100μl浓度为1
×
106cfu/ml菌液(由于各分离组分的水溶性较差,单独药敏实验时先向96孔板中每孔加入100μl lb培养基,再向每孔中加入100
μl浓度为1
×
106cfu/ml菌液,然后直接向每孔中加入10μl各分离组分的不同浓度母液)。对于联合药敏实验,在单独药敏实验的基础之上再在每孔中加入处理好的对应分离组分10μl。设立阳性对照为100μl菌液加100μl培养基(实验中加入的无水乙醇不影响细菌的生长及抗生素对细菌的抑制作用),阴性对照为200μl lb培养基。
102.(5)mic的读取:将96孔板放置于37℃的培养箱中培养24小时,观察结果。用
“‑”
表示阴性,孔清亮,用“ ”表示阳性,孔混浊。mic为能够抑制细菌生长、繁殖的最低药物浓度,即用肉眼观察,无细菌生长孔为药物最低浓度孔。
103.(6)fic的计算:fic是指在2种或多种药物同时使用的情况下,各种药物的联合用药时的最小抑菌浓度(mic)与单独用药时的mic的比值之和。fic≤0.5时认为药物之间具有协同作用;fic在0.5~4.0之间则认为药物之间无相关作用;fic>4.0时则认为药物之间具有拮抗作用。
[0104][0105]
结果与分析
[0106]
为了深入挖掘酸枣果氯仿提取物中的抗菌增敏活性成分,本实施例采取硅胶柱色谱对氯仿提取物进行进一步的分离纯化。按照图1方法依次洗脱得到了fr.1a、fr.1b、fr.1c,fr.1d,fr.1e,fr.1f,fr.1g,fr.1h,fr.1i与fr.1j10个洗脱液,分别对它们进行联合抗菌增敏活性评价。其中结果如表1~表2所示,其中仅有5mg/ml的fr.1g、fr.1h可使amp对铜绿假单胞菌的mic降低512倍,而其他组分均不能增强amp的抑菌作用。由于单独使用时,fr.1g、fr.1h对铜绿假单胞菌的mic为128mg/ml,amp对铜绿假单胞菌的mic大于1024μg/ml,由表1和2可以得到两者的fic=0.04<0.5(5/128 2/1024),从而得出fr.1g、fr.1h分别与amp联合使用增强amp对铜绿假单胞菌的抑制作用,因此将有活性的fr.1g和fr.1h合并,并命名为fr.a。
[0107]
表1 fr.1g与amp联合使用对铜绿假单胞菌的抑制作用
[0108]
tab.1 combined antibacterial effects of fr.1g and ampicillin on pseudomonas aeruginosa
[0109]
[0110]
阴性孔显示清亮,以
“‑”
表示;阳性孔显示混浊,以“ ”表示。
[0111]
表2 fr.1h与amp联合使用对铜绿假单胞菌的抑制作用
[0112]
tab.2 combined antibacterial effects of fr.1h and ampicillin on pseudomonas aeruginosa
[0113][0114][0115]
阴性孔显示清亮,以
“‑”
表示;阳性孔显示混浊,以“ ”表示。
[0116]
对有活性的fr.a再一次进行硅胶柱色谱柱分离提纯,按照fr.a洗脱顺序依次洗脱,分别得到组分fr.2a、fr.2b、fr.2c、fr.2d、fr.2e、fr.2f、fr.2g、fr.2h、fr.2i与fr.2j,对这些组分依次进行体外抗菌增敏活性评价。结果如表3~4所示,仅有fr.2d、fr.2e组分能显著增强amp对铜绿假单胞菌的抑制作用,10mg/ml的fr.2d可使amp对铜绿假单胞菌的mic由1024μg/ml下降至4μg/ml。由于单独使用时,fr.2d对铜绿假单胞菌的mic为64mg/ml,而amp对铜绿假单胞菌的mic大于1024μg/ml,由此可得到fic=0.16<0.5(10/64 4/1024);10mg/ml的fr.2e可使amp对铜绿假单胞菌的mic由1024μg/ml下降至1μg/ml,由于单独使用时,fr.2e对铜绿假单胞菌的mic为64mg/ml,而amp对铜绿假单胞菌的mic大于1024μg/ml,由此可得到fic=0.16<0.5(10/64 1/1024)。说明fr.2d和fr.2e均具有较好的抗菌增敏活性,因此将有活性的fr.2d和fr.2e合并,并命名为fr.b。由于继续对fr.b进行分离纯化后得到的分离组分均无活性,因此无法对fr.b继续进行柱色谱分离,故确定fr.b组分为抗菌增敏活性精制物。
[0117]
表3 fr.2d与amp联合使用对铜绿假单胞菌的抑制作用
[0118]
tab.3 combined antibacterial effects of fr.2d and ampicillin on pseudomonas aeruginosa
[0119][0120]
阴性孔显示清亮,用(
‑
)表示,阳性孔显示混浊,以( )表示。
[0121]
表4 fr.2e与amp联合使用对铜绿假单胞菌的抑制作用
[0122]
tab.4 combined antibacterial effects of fr.2e and ampicillin on pseudomonas aeruginosa
[0123][0124]
(2)fr.b组分的gc
‑
ms、核磁、红外光谱分析
[0125]
酸枣果氯仿提取物分离纯化得到的fr.b具有较好的抗菌增敏活性,本实施例对fr.b进行gc
‑
ms组分成分分析。如图1,gc
‑
ms图谱分析到fr.b样品中主要含有30.07%反油酸、24.68%油酸、11.54%顺
‑
10
‑
十六碳烯醇、10.54%棕榈酸、3.97%1
‑
二十四烯、2.89%岩芹酸、2.12%顺
‑
11
‑
十八碳烯酸、2.08%反
‑
13
‑
十八碳烯酸、2.06%顺,顺
‑
13,16二十二碳二烯酸、1.96%二十五烷、1.44%亚油酸、1.08%亚油酸甲酯、1.07%顺
‑
11
‑
二十碳烯酸、1.05%芥酸、0.98%顺
‑
13
‑
十八碳烯醛、0.85%反
‑9‑
十八碳烯酸甲酯、0.64%顺
‑
11二十烯酸、0.32%顺
‑9‑
十四碳烯
‑1‑
醇乙酸酯、0.32%顺,顺
‑
9,12
‑
十六碳二烯酸、0.12%1
‑
棕榈酸单甘油酯、0.07%1
‑
十三烯、0.05%13
‑
甲基十四烷酸甲酯、0.05%己酸、0.03%2
‑
氨基丁
酸和0.02%庚酸。
[0126]
为了验证gc
‑
ms分析的结果,我们对fr.b进行红外光谱分析。如图2,显示3453cm
‑1为羟基吸收振动吸收峰,2923,2853cm
‑1为饱和亚甲基、甲基吸收峰。1843cm
‑1为酯基
‑
coo
‑
吸收峰。1376
‑
1456cm
‑1为ch(面内)弯曲振动吸收峰,1688cm
‑1为羰基伸缩振动吸收峰,1158cm
‑1为和羧基相连的
‑
cr不对称伸缩振动。红外分析的结果说明fr.b主要由脂肪酸类化合物构成,这与gc
‑
ms分析的结果一致。
[0127]
为了验证gc
‑
ms分析的结果,我们也对fr.b进行核磁共振氢谱分析。如图3的核磁谱图,显示化学位移0.5
‑
2.8ppm为典型的脂肪链甲基亚甲基上的氢,3.6ppm、4.0
‑
4.2ppm为脂肪酸上和羧基相连的亚甲基上的氢,以及和羟基相连的亚甲基上的氢,5.3ppm为碳碳双键上的氢,7.1ppm为氘代试剂的峰。核磁分析的结果说明fr.b主要由脂肪酸类化合物构成,这与gc
‑
ms分析的结果一致。结合红外和核磁分析结果显示,gc
‑
ms分析鉴定出的fr.b的化学组成成分的结果是可靠的。
[0128]
试验1酸枣果抗菌增敏精制物fr.b活性评价
[0129]
(一)酸枣提取物的广谱抗菌增敏活性研究
[0130]
试验方法
[0131]
(1)菌液的制备:37℃、200rpm将供试菌株振摇培养过夜,待菌液od
600
=1.0时,将其稀释至1
×
106cfu/ml。
[0132]
(2)fr.b的配制:将fr.b经准确称量后,使用无水乙醇溶解并分别配制成浓度为2560mg/ml、1280mg/ml、640mg/ml、400mg/ml、320mg/ml、200mg/ml、160mg/ml、100mg/ml、80mg/ml、50mg/ml、40mg/ml、20mg/ml、1mg/ml、0.5mg/ml和0.25mg/ml的母液;
[0133]
(3)抗生素的配制:配制庆大霉素(gm)、妥布霉素(tob)、amp、氯霉素(cm),红霉素(em),夫西地酸(fa),制霉菌素(ns),酮康唑(kcz),两性霉素b(am b)溶液,其中em、cm、kcz用无水乙醇配制,fa、am b用dmso配制,其它抗生素用无菌水配制。采用培养基分别将不同抗生素均稀释至浓度为4096μg/ml的母液,过滤除菌备用。
[0134]
(4)加样:对于单独药敏实验,先向每孔加入100μl lb培养基,在第一个孔内加入100μl浓度为4096μg/ml的抗生素,再从中吸出100μl到第二个孔内,依次类推,使抗生素终浓度依次稀释2倍,再向每孔中加入100μl浓度为1
×
106cfu/ml菌液(由于各分离组分的水溶性较差,单独药敏实验时先向96孔板中每孔加入100μl lb培养基,再向每孔中加入100μl浓度为1
×
106cfu/ml菌液,然后直接向每孔中加入10μl各分离组分的不同浓度母液)。对于联合药敏实验,在单独药敏实验的基础之上再在每孔中加入处理好的组分10μl。设立阳性对照为100μl菌液加100μl培养基(实验中加入的无水乙醇不影响细菌的生长及抗生素对细菌的抑制作用),阴性对照为200μl lb培养基。
[0135]
(5)mic的读取:将96孔板放置于37℃的培养箱中培养24小时,观察结果。用
“‑”
表示阴性,孔清亮,用“ ”表示阳性,孔混浊。mic为能够抑制细菌生长、繁殖的最低药物浓度,即用肉眼观察,无细菌生长孔为药物最低浓度孔。
[0136]
(6)fic的计算:fic是指在2种或多种药物同时使用的情况下,各种药物的联合用药时的最小抑菌浓度(mic)与单独用药时的mic的比值之和。fic≤0.5时认为药物之间具有协同作用;fic在0.5~4.0之间则认为药物之间无相关作用;fic>4.0时则认为药物之间具有拮抗作用。
[0137][0138]
结果与分析
[0139]
前面研究表明fr.b能增强amp对铜绿假单胞菌的抗菌作用。为验证fr.b是否也能增强其它抗生素对细菌、真菌的抗菌作用。本试验将fr.b与其它抗生素联合使用对多种供试细菌或真菌的体外抗菌增敏活性进行评价试验,结果如表5和表6所示。10mg/ml fr.b与庆大霉素(gm)、妥布霉素(tob)、氨苄青霉素(amp)和红霉素(em)等四种抗生素分别联合使用时,对铜绿假单胞菌和粪肠杆菌的fic<0.5,显示出明显的协同抗菌作用;对于大肠杆菌,10mg/ml fr.b与tob和em分别联用时显示出协同抗菌作用;对于耐甲氧西林金黄色葡萄球菌(mrsa),5mg/ml fr.b与gm、tob、amp、em、夫西地酸(fa)和氯霉素(cm)分别联用时显示出协同抗菌作用;对于白色念球菌,5mg/ml fr.b与酮康唑(kcz)和两性霉素b(am b)分别联用时显示出协同抗菌作用。这些结果表明fr.b显示出广谱抗菌增敏活性。
[0140]
表5 fr.b与抗生素联合使用时对细菌的联合抑菌指数(fic)
#
[0141][0142][0143]
#
注:括号里的数值代表抗生素抗菌活性增强的倍数。
[0144]
表6 f
r
.b与抗生素联合使用时对真菌的联合抑菌指数(fic)
#
[0145][0146]
#
注:括号里的数值代表抗生素抗菌活性增强的倍数。
[0147]
试验2 fr.b对病原菌生理特性的影响
[0148]
试验方法
[0149]
(1)fr.b与抗生素联用对病原菌生长的影响
[0150]
将细菌培养至对数中期,分别加入适当浓度的抗生素溶液和fr.b,使得抗生素终浓度为tob=64μg/ml、amp=256μg/ml、em=256μg/ml、cm=8μg/ml、gm=64μg/ml和fa=
0.125μg/ml;或者加入含有相同浓度的抗生素与终浓度5mg/ml的fr.b混合溶液,并使菌液的最终浓度为2.0
×
105cfu/ml,37℃,200r/min摇床中培养。每隔1h取样100μl,依次稀释至100、10
‑1、10
‑2、10
‑3、10
‑4、10
‑5,无菌涂布于lb平板上,三个重复,进行菌落计数。绘制时间杀伤曲线:y轴为细菌菌数cfu/ml,x轴为间隔1h的时间。
[0151]
结果与分析
[0152]
通过联合抑菌试验发现(表5和表6),5mg/ml的fr.b能够增强tob、amp、em、cm、gm、fa等这六种抗生素对mrsa菌株的抑制作用,其fic均<0.5。对于白色念珠菌来说,5mg/ml的fr.b与kcz、am b联用使白色念珠菌的mic分别降低了1024倍、512倍,说明fr.b对kcz、am b有较好的协同作用。为了进一步探究fr.b的抗菌增敏活性,我们通过时间杀伤生长曲线来观察fr.b与抗生素联用对mrsa菌株和白色念珠菌的协同杀菌活性。
[0153]
结果如图4所示,图4a为fr.b与六种抗生素联合使用对mrsa生长的影响;图4b为fr.b与三种抗生素联合使用对白色念珠菌生长的影响。图4a所示,fr.b与抗生素联用可以对mrsa菌株产生明显的协同杀菌作用,其中对tob、fa的协同杀菌较明显,而与gm联用对mrsa菌株生长的影响相对较小,这与前面联合抑菌实验结果一致。fr.b与kcz或者am b联合使用对白色念珠菌也产生明显的协同杀菌活性(图4b)。结果表明fr.b能协同抗生素增强其对mrsa菌株与白色念珠菌的杀菌作用。
[0154]
(2)fr.b对mrsa菌株细胞壁通透性的影响
[0155]
试验方法
[0156]
将细菌培养至对数期,待od
600
=0.6时分别加入终浓度为5mg/ml fr.b、1%红霉素(em)和5mg/ml fr.b 1%em,加入无水乙醇为空白对照组。每组实验做3个平行。37℃,120rpm摇床中培养,每隔2h取样,4500rpm离心10min,取上清,即为待测液。接着按照南京建成生物工程研究所的碱性磷酸酶试剂盒操作步骤进行活性测定。
[0157]
结果与分析
[0158]
先前的结果显示,fr.b主要由脂肪酸类化合物构成,因此推断fr.b可能是通过影响细菌细胞壁与细胞膜的完整性从而起抗菌增敏作用。碱性磷酸酶(akp)正常情况下存在于细胞壁和细胞膜之间,当细胞壁通透性增大时,会通过细胞壁流出到培养液中,因此培养液中akp的活性可以反映细胞壁的通透性。我们通过在细菌培养过程中分别加入不同试剂,以无水乙醇为空白对照,测定不同时间段培养液中akp的活性,来判断fr.b对mrsa菌株细胞壁通透性的影响。结果如图5所示,与对照组和em组相比,fr.b组和fr.b em组中akp的活性随着时间的延长而逐步增强,并且与fr.b组相比,fr.b em组akp活性得到进一步的提高。说明fr.b可以改变mrsa菌株细胞壁的通透性。
[0159]
(3)fr.b对mrsa细胞膜通透性和完整性的影响
[0160]
试验方法
[0161]
将细菌培养至对数期,待od
600
=0.8时,4500rpm离心10min收集细胞。将收集的细胞用pbs缓冲液洗涤2次,最终悬浮pbs中并使菌液的浓度为1.0
×
107cfu/ml,加入终浓度为5mg/ml fr.b、1%红霉素(em)和5mg/ml fr.b 1%em,无水乙醇为空白对照组。37℃,120rpm摇床中培养,每隔2h取样,4000rpm离心10min,取上清,即为待测液。用5%葡萄糖将上清液稀释20倍后,测定其电导率,实验重复3次,取平均值。用酶标仪于260nm下测定上清液中核酸大分子的吸光值,实验重复3次,取平均值。
[0162]
结果与分析
[0163]
培养液中电导率的大小可以反映细胞膜通透性的变化,而培养液中核酸等大分子物质含量可以反映细胞膜的破损情况。培养液电导率越大,说明细胞膜的通透性越好。培养液中核酸等大分子物质含量越高,说明细胞膜损害越严重。通过向培养液中加入分别加入不同试剂,以无水乙醇为空白对照,测定培养液中电导率和核酸分子含量。实验结果如图6所示,图6a为fr.b对细胞膜通透性的影响;图6b为fr.b对细胞膜完整性的影响。如图6a所示,与对照组和em组相比,fr.b组和fr.b em组中的导电率明显上升,并且fr.b em的导电率高于fr.b组说明fr.b可以增强了细胞膜的通透性。此外,通过测定培养液中的核酸等大分子物质含量,结果如图6b所示,相比对照组和em组,当加入fr.b以及fr.b em时,培养液中核酸大分子含量显著增大。因此可说明fr.b可能破坏了细胞膜的完整性,导致细胞内大分子物质外流,培养液中核酸分子量增多。
[0164]
试验3em fr.b最佳配比的筛选
[0165]
试验方法
[0166]
em fr.b最佳配比的筛选:将终浓度1%、0.1%、0.01%、0.05%、0.04%、0.03%、0.02%与0.01%em与终浓度5mg/ml的fr.b单独或者联合使用,对mrsa菌株进行时间杀伤生长曲线的测定,从中筛选出fr.b与红霉素最合适的配比。时间杀伤生长曲线方法见试验2。
[0167]
结果分析
[0168]
在不影响治疗效果的前提下我们尽量选取少量的em与适量的fr.b混合。为了找到两种组分配制的最佳比例,我们进行时间杀伤生长曲线试验,筛选出em与fr.b的最佳配比。结果如图7所示,5mg/ml fr.b、对照组以及单独使用不同浓度的em组,对mrsa菌株的生长并未产生影响。而1%、0.1%、0.05%、0.04%、0.03%的em与fr.b联用,菌株生长明显受限,其他浓度的配比组合抑菌效果明显减弱。因此,从减少耐药性的角度考虑,选定浓度为0.03%以上的红霉素与5mg/ml的fr.b联用时均可以达到较好的联合抑菌效果。
[0169]
实施例2红霉素 fr.b软膏的制备及其体内活性检测
[0170]
试验方法
[0171]
(1)红霉素 fr.b抗菌软膏的制备
[0172]
基质调配:称21g取白凡士林、8g液体石蜡,水浴加热约至60℃,使基质完全熔化、并搅拌均匀;
[0173]
抗生素溶液配制:称取1g红霉素溶于1ml的无水乙醇中,准备2份,备用;
[0174]
fr.b溶液配制:称取0.5g fr.b溶于1ml的无水乙醇中,准备2份,备用;
[0175]
软膏调制:撤去调配好基质的水浴加热装置,温度降至50℃左右时,向基质中分别加入配制好的红霉素溶液、fr.b溶液或两者的混合溶液,使其红霉素所占比例为1%,fr.b所占比例为0.5%,顺时针搅拌至均匀,同时将混合体系温度降至室温,得到抗菌软膏。其中仅含有基质的处理命为空白对照,基质中加入红霉素溶液的命名为红霉素软膏,基质中加入fr.b溶液的命名为fr.b软膏,基质中加入红霉素 fr.b混合物溶液的命名为抗霸软膏。
[0176]
分装:将配制好的软膏分装。
[0177]
(2)软膏的体内活性检测:体内动物研究获得延安大学实验动物科技中心批准,所有动物程序均按照中国国家卫生研究院实验室动物护理原则的指南进行。
[0178]
1)伤口感染模型建立
[0179]
用昆明小鼠(km)作为试验动物,选取体重为25
‑
27g的小鼠并分为8组,分别为无伤口组,伤口无感染组,伤口感染组(空白对照组),红霉素软膏组(含终浓度为1%的em),抗霸组(含终浓度为0.5%的fr.b 1%的em),fr.b软膏组(含终浓度为0.5%的fr.b),夫西地酸软膏组(含终浓度为2%的fa),莫匹罗星软膏组(含终浓度为2%的mu)(每个实验每组6只),每天给予食物和水,饲养2周,让小鼠适应环境。
[0180]
制备mrsa菌悬液:将培养至od
600
=0.6时mrsa菌液进行稀释至1.0
×
106cfu/ml个细胞,4000rpm/min,离心10min收集细胞,在pbs中洗涤两次,然后悬浮在100μl的pbs中,备用。
[0181]
小鼠感染模型建立:使用乙醚轻微麻醉小鼠,皮下注射5%的水合氯醛(250μl/20g),待小鼠完全昏迷后,对背部进行剃毛,再使用6%的硫化钠彻底脱毛。使用镊子夹取少量皮肤,用剪刀剪出伤口(10
×
10mm)。皮下注射0.8ml的葡萄糖,以维持小鼠生命体征。将制备好的细胞悬浮液淋洒至小鼠伤口处,接触感染2h,建立感染模型。对小鼠伤口进行拍照记录。
[0182]
2)动物局部治疗
[0183]
细菌接触小鼠伤口感染2h后,感染模型建立成功。接下来对小鼠进行初步治疗,除无伤口组,伤口无感染组不给予任何治疗外,给其他每组小鼠伤口涂抹0.1g相应的药物(基质软膏(空白对照组)、红霉素软膏、抗霸软膏(红霉素 fr.b)、fr.b软膏、夫西地酸软膏、莫匹罗星软膏),涂抹后,观察小鼠生命体征。接下来每天将相应药物涂抹至小鼠伤口处2次,共5d。
[0184]
3)实验指标的测定
[0185]
小鼠体重监测:观察并对小鼠体重进行称重。每天记录,用于评价建立的小鼠模型。
[0186]
伤口组织菌落计数:小鼠连续给药4d后18h,对部分小鼠安乐死,用剪刀剪取伤口处皮肤,将其悬浮在400μl pbs,将剪下的皮肤组织搞碎成匀浆,采用十倍稀释法稀释匀浆,涂布至高盐甘露糖培养基(金黄色葡萄球菌的选择性培养基),37℃培养箱培养48h,计数。
[0187]
评估伤口愈合和收缩:监测小鼠伤口愈合情况,分别在第0、2、4、6d拍摄小鼠伤口的照片,并用imagej软件测量小鼠伤口面积的大小,直到伤口闭合。第0d的伤口面积被认为是100%,每组动物的伤口被测量、记录并计算伤口面积占第0d的伤口面积的百分比。
[0188]
结果分析
[0189]
首先以昆明km小鼠为模型,进行伤口感染,通过对小鼠体重变化的监测,来判断小鼠伤口感染模型是否建立。结果如图8所示,伤口无感染组小鼠与伤口感染小鼠体重差异较明显,这样就说明,小鼠伤口感染模型建立成功,保证了后续实验的可靠性。
[0190]
其次评估抗菌软膏对伤口创面的影响。结果如图9所示,其中,a不同时间点小鼠伤口的图片,b为不同时间点小鼠伤口愈合情况的定量分析结果;
①
空白对照
②
抗霸软膏
③
红霉素软膏
④
fr.b软膏
⑤
夫西地酸软膏
⑥
莫匹罗星软膏。通过观察发现,对照组相比较其他组,伤口有明显的肿胀的迹象,但伤口大小并未发生明显的变化。通过数据显示,在第2d,对照组伤口大小从100%变化至87.78
±
26.16%,同时红霉素软膏组与夫西地酸软膏组伤口也观察到轻微的肿胀,使用红霉素软膏的伤口分别减少到71.59
±
13.96%;而夫西地酸软膏对伤口愈合能力相对较好,第2d已经降低到35.56
±
12.72%,抗霸软膏组能够达到与夫
西地酸软膏一样的效果,其伤口大小也降低至36.51
±
11.90%,但是更明显的是,抗霸软膏组的伤口并未发现有肿胀的迹象。与此同时,我们观察到,fr.b软膏组伤口变化不大,仅减少至72.11
±
14.11%,同时伤口表面并未发现肿胀的迹象,因此我们推测fr.b有消炎作用。我们还观察到莫匹罗星软膏使用2d后,伤口面积有明显的减少以及未出现肿胀的现象,其伤口大小降低至37.81
±
12.52%。通过对比空白对照组与抗霸软膏组,小鼠伤口在第2d变化最大,均发生明显的愈合。小鼠伤口在第6d时继续发生明显的变化,比较空白对照组,红霉素软膏组伤口肿胀得到了轻微的缓解,但伤口大小并未发生大的变化。而使用夫西地酸软膏治疗的小鼠的伤口的肿胀和伤口大小发生了明显的变化,其伤口大小在第6d减少至17.86
±
3.30%,伤口肿胀也得到了进一步缓解。与此同时,抗霸软膏组、莫匹罗星软膏组伤口大小也发生明显的变化,分别减少至11.90
±
5.56%、14.84
±
0.96%。通过观察fr.b软膏组伤口,发现伤口未发生肿胀,伤口大小变化也很小,其伤口大小降低至58.16
±
12.87%。在小鼠治疗的第10d,抗霸软膏小组伤口已经完全愈合,而其他组还存在不同大小的伤口。同时明显看出,空白对照组伤口还存在轻微肿胀,其伤口大小仍为32.04
±
5.93%,涂抹了红霉素软膏的伤口大小为27.01
±
7.56%,夫西地酸软膏和莫匹罗星软膏治疗组伤口也趋于愈合,仅剩9.20
±
3.79%和1.05
±
0.48%。可以看出这两种软膏对伤口的愈合能力强于红霉素软膏但弱于抗霸软膏。这一结果表明,抗霸软膏的治疗效果要显著优于红霉素软膏,与夫西地酸软膏和莫匹罗星软膏相比也有一定的优势。
[0191]
最后,我们对小鼠创面上的菌落进行计数。结果如图10所示,在第4d,空白对照组小鼠每克伤口组织的菌落数为4.38
×
106个,红霉素软膏组伤口显示出肿胀,其每克伤口组织的菌落数相比空白对照组减少幅度不大,为2.60
×
105个。fr.b对mrsa菌株本身没有杀菌的作用,每克伤口组织的菌落数(为1.78
×
106个)与空白对照相似;而夫西地酸软膏在伤口前期杀菌效果与莫匹罗星软膏类似,表现为夫西地酸软膏组每克伤口组织的菌落数为1.35
×
104个,莫匹罗星软膏组菌落计数为1.04
×
104个,均优于空白对照组。与夫西地酸软膏和莫匹罗星软膏相比,抗霸软膏组显示出更优秀的杀菌效果,每克伤口组织的菌落数仅为4.08
×
103个,显著低于其他处理组。表明fr.b能显著增强红霉素的抗菌作用,使之获得比夫西地酸和莫匹罗星更好的疗效。
[0192]
实施例3抗霸软膏的优化及其对皮肤创伤模型小鼠的治疗效果
[0193]
试验方法
[0194]
(1)抗菌软膏的制备
[0195]
①
fr.b溶液配制称取0.5g精制物溶于1ml的无水乙醇中,备用。
[0196]
②
基质调配称21g取白凡士林、8g液体石蜡,水浴加热约至60℃,使基质完全熔化、并搅拌均匀。撤去调配好基质的水浴加热装置,待基质凝固。
[0197]
③
软膏配制撤去调配好基质的水浴加热装置,温度降至50℃左右时,向基质中加入配制好的fr.b溶液,使得fr.b所占比例为1%,顺时针搅拌至均匀,同时将混合体系温度降至室温,得到fr.b软膏;
[0198]
④
将fr.b软膏与0.1%红霉素软膏按照1:1混匀,得到抗菌软膏。
[0199]
本实施例中0.1%红霉素软膏配制方法为:称21g取白凡士林、8g液体石蜡,水浴加热约至60℃,使基质完全熔化、并搅拌均匀,将市场销售的1%红霉素软膏与基质1:9混合,撤去调配好基质的水浴加热装置,待基质凝固,得到0.1%红霉素软膏。将0.1%红霉素软膏
与fr.b软膏混合得到的抗菌软膏涂抹至小鼠伤口处。
[0200]
抗生素软膏也可以按照下述配方组合以1:1混匀方式获得:基质 1%红霉素软膏、基质 0.1%红霉素软膏、fr.b软膏 1%红霉素软膏,其中1%红霉素软膏从市场上购买。
[0201]
(2)伤口感染模型建立
[0202]
同实施例2
[0203]
(3)动物局部治疗
[0204]
同实施例2
[0205]
(4)实验指标的测定
[0206]
同实施例2
[0207]
结果与分析
[0208]
前面研究表明抗霸软膏对小鼠伤口模型的治疗效果非常显著,为了确定抗霸软膏中的组成成分在哪种比例关系下,其治疗效果最佳,因此我们通过以下试验评估抗霸软膏各成分的不同配比对小鼠伤口模型的治疗效果。
[0209]
(1)对小鼠伤口面积的评估
[0210]
将实验小鼠分为七组,分别是为基质组,1%红霉素软膏组(含终浓度为1%的em),基质 1%红霉素软膏组(含终浓度为0.5%的em),基质 0.1%红霉素软膏组(含终浓度为0.05%的em),fr.b软膏组(含终浓度为0.5%的fr.b),fr.b软膏 1%红霉素软膏组(含终浓度为0.5%的fr.b 0.5%的em),fr.b软膏 0.1%红霉素软膏组(含终浓度为0.5%的fr.b 0.05%的em)(每个实验每组6只)。对不同组小鼠进行不同的治疗处理,每只小鼠每天涂抹两次,涂抹5d。监测不同处理对伤口创面的影响,通过相机对小鼠伤口进行拍照,并用imagej软件对小鼠伤口大小进行分析。
[0211]
如图11所示,其中,a不同时间点小鼠伤口的图片,b不同时间点小鼠伤口愈合情况的定量分析结果;
①
基质
②
1%红霉素软膏
③
基质 1%红霉素软膏
④
基质 0.1%红霉素软膏
⑤
fr.b软膏
⑥
fr.b软膏 1%红霉素软膏
⑦
fr.b软膏 0.1%红霉素软膏。图中显示了小鼠在第0、2、6、和10d用不同软膏治疗的伤口组的照片。通过数据显示,在2d后,基质组伤口面积从100%变化至93.75
±
10.64%,使用基质 1%红霉素软膏与基质 0.1%红霉素软膏的伤口面积分别减少到84.82
±
10.10%和88.68
±
8.24%,而1%红霉素软膏组的伤口面积减少到66.59
±
16.10%;与1%红霉素软膏组类似,含有fr.b的三组伤口愈合情况相对较好,我们可以看到fr.b软膏组伤口面积降低到68.50
±
5.10%,fr.b软膏 1%红霉素软膏组与fr.b软膏 0.1%红霉素软膏组的伤口面积分别减少到65.29
±
9.94%和66.64
±
8.87%。由此可以看出,fr.b具有一定的促伤口愈合作用,这与先前的研究结果一致。随着继续使用不同软膏治疗,在第6d可以观察到,基质组伤口面积减少到58.40%
±
7.13%,1%红霉素软膏组、基质 1%红霉素软膏组和基质 0.1%红霉素软膏组的伤口面积相差不大,分别减少到49.95
±
15.97%、43.11
±
4.62%、48.66%
±
4.72%,与它们相比,含有fr.b的三组伤口愈合情况较好,可以看到fr.b软膏组、fr.b软膏 1%红霉素软膏组与fr.b软膏 0.1%红霉素软膏组的伤口面积分别减少到35.12
±
3.42%、26.20
±
7.88%和30.32
±
3.77%,其中fr.b软膏 1%红霉素软膏组的疗效最优;在第10d,基质组、1%红霉素软膏组、基质 1%红霉素软膏组、基质 0.1%红霉素软膏组和fr.b软膏组的伤口面积分别减少到33.69
±
2.87%、28.41
±
13.54%、20.04%
±
3.15%、29.35%
±
1.35%和20.50%
±
1.25%,与它们相比,
fr.b软膏 1%红霉素软膏组与fr.b软膏 0.1%红霉素软膏组的伤口愈合情况更好,伤口面积分别减少到5.42
±
4.49%和11.43
±
1.61%,其中fr.b软膏 1%红霉素软膏组的疗效依然最优。
[0212]
综上所述,含有fr.b的治疗效果比含有基质组的治疗效果好,fr.b软膏 1%红霉素软膏比其他含有fr.b软膏组治疗效果好,fr.b软膏 红霉素软膏比单独的红霉素软膏治疗效果好。由此说明即使浓度减半,fr.b和红霉素的联合使用也比市场销售的红霉素软膏有更好的治疗效果。
[0213]
对小鼠伤口菌落数的评估:
[0214]
小鼠连续给药4d后18h,对部分小鼠安乐死,用剪刀剪取伤口处皮肤,捣至匀浆,稀释100、10
‑1、10
‑2、10
‑3、10
‑4涂布至高盐甘露糖培养基,37℃培养24h,计数。结果如图12所示,在第4d,基质组、fr.b软膏组、基质 0.1%红霉素软膏组和基质 1%红霉素软膏组小鼠每克伤口的菌落数分别为7.46
×
107个、3.82
×
107个、2.45
×
107个和1.04
×
107个,多于1%红霉素软膏组每克伤口组织的菌落数1.15
×
106个和fr.b软膏 0.1%红霉素软膏组每克伤口组织的菌落数1.19
×
106个,而fr.b软膏与1%红霉素软膏联合使用对小鼠伤口的治疗效果最佳,每克伤口组织的菌落数仅为2.80
×
104个。由此表明即使浓度减半,fr.b也能够显著增强红霉素对mrsa菌株的杀菌能力且其联合治疗的效果显著优于原浓度的红霉素。综上,说明单独制备的fr.b软膏与市场销售的红霉素软膏按一定比例混合使用时也能获得良好的治疗效果且其疗效显著优于市场销售的红霉素软膏。
[0215]
通过以上方式,本发明的一种酸枣果抗菌增敏活性精制物,具有广谱的抗菌增敏活性;主要成分为脂肪酸,通过改变细胞的通透性从而增强抗生素对耐药菌的杀菌效果,具有消炎以及促伤口愈合作用。本发明的一种酸枣果抗菌增敏活性精制物的制备方法,产率高,成本低。本发明一种酸枣果抗菌增敏活性精制物fr.b可用于制备抗菌药物,酸枣果活性精制物fr.b具有消炎以及促伤口愈合作用。一种酸枣果抗菌增敏活性精制物fr.b可用于制备治疗皮肤耐药菌感染的抗菌软膏,抗菌软膏粘稠度适中、涂展性良好,便于皮肤涂抹用药,临床使用较方便。一种酸枣果抗菌增敏活性精制物fr.b可用于制备治疗皮肤耐药菌感染的抗菌增敏剂。一种用于制备治疗皮肤耐药菌感染的抗菌软膏,能显著增强抗生素的抗菌作用。一种用于制备治疗皮肤耐药菌感染的抗菌软膏的制备方法,操作简单、条件温和、无环境污染;将fr.b和红霉素的联合使用,能提高抗生素软膏的治疗效果。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

