1.本发明涉及当存在于哺乳动物细胞内时能够诱导细胞内效应的效应子部分,所述效应子部分与至少一个皂苷缀合。本发明涉及当存在于哺乳动物细胞内时能够诱导细胞内效应的效应子部分,所述效应子部分包含与至少一个皂苷缀合的有效载荷。本发明还涉及包含根据本发明的效应子部分的抗体
‑
药物缀合物,或者包含本发明的效应子部分的配体
‑
药物缀合物,所述效应子部分包含共价偶联的皂苷。本发明还涉及一种治疗性组合,其包含:(a)本发明的效应子部分,所述效应子部分包含至少一个皂苷和任选的药学上可接受的赋形剂;以及(b)抗体
ꢀ‑
药物缀合物或配体
‑
药物缀合物,以及任选的药学上可接受的赋形剂。此外,本发明涉及药物组合物,其包含本发明的效应子部分或本发明的抗体
‑
药物缀合物或本发明的配体
‑
药物缀合物(其包含与效应分子共价连接的至少一个皂苷)和任选的药学上可接受的赋形剂。本发明还涉及本发明的效应子部分或本发明的抗体
‑
药物缀合物或本发明的治疗性组合或本发明的配体
‑
药物缀合物或本发明的药物组合物,其用作药物。最后,本发明还涉及本发明的效应子部分或本发明的抗体
‑
药物缀合物或本发明的治疗性组合或本发明的配体
‑
药物缀合物或本发明的药物组合物,其用于治疗或预防癌症或自身免疫疾病。
2.背景
3.在理论上,具有治疗性生物活性的分子在许多情况下适合应用为有效治疗药物以用于治疗有需要的人类患者中的疾病,如癌症。一个典型的实例是小分子生物活性部分。然而,目前临床中使用的许多(如果不是全部)潜在的类药(drug
‑
like)分子和治疗剂至少存在众多缺点和缺陷之一。当施用至人体时,除了针对待治疗疾病或健康问题的潜在方面的生物学活性之外,治疗活性分子还可发挥脱靶效应。此类脱靶效应是不希望的,并且存在所施用分子诱发健康或甚至危及生命的副作用的风险。正是此类不良事件的发生导致许多类药化合物和治疗性部分未能通过iii期临床试验或甚至iv期临床试验(进入市场后随访)。因此,强烈希望提供药物分子,如小分子治疗剂,其中药物分子的治疗性效应应该,如,(1)对驱动疾病的生物因素或生物过程具有高度特异性,(2)足够安全,(3)足够有效,(4)充分针对患病细胞且对非患病细胞几乎没有脱靶活性,(5)具有足够及时的作用模式(如施用的药物分子应在一定的时间范围内到达人类患者中的靶向部位,并应在靶向部位处保持一定的时间范围),和/或(6)在患者体内具有足够长的持续治疗活性,等等。不幸的是,迄今为止,尽管已经进行了长期和深入的研究并且尽管在个别遇到困难和缺陷的几个领域取得的令人印象深刻的进展,但具有许多或甚至所有上述有益特征的
‘
理想’治疗剂对于患者来说仍是不可用的。
4.化疗是癌症治疗中最重要的治疗选项之一。然而,它通常与低治疗窗有关,因为与健康组织中的分裂细胞相比,它对癌细胞没有特异性。单克隆抗体的发明提供了利用其特异性结合特性作为将细胞毒性剂靶向递送至癌细胞同时保留正常细胞的机制的可能性。这可以通过细胞毒性效应子(也称为有效载荷或弹头)化学缀合至抗体以产生抗体
‑ꢀ
药物缀合物(adc)来实现。通常,使用非常有效的有效载荷(如美坦新 (dm1)),它们的未缀合形式
vedotin)、英妥珠单抗奥佐米星(inotuzumab ozogamicin)、 moxetumomab pasudotox和泊洛妥珠单抗维多汀(polatuzumab vedotin),它们被评价为针对淋巴恶性肿瘤和多发性骨髓瘤的治疗选项。结合(恶性)b细胞上的cd79b的泊洛妥珠单抗维多汀和结合cd22的匹那妥珠单抗维多汀(pinatuzumab vedotin)在临床试验中进行测试,其中adc 各自与共施用的利妥昔单抗(一种结合cd20但不提供有效载荷的单克隆抗体)组合[b.yu和d.liu,antibody
‑
drug conjugates in clinical trialsfor lymphoid malignancies and multiple myeloma;journal of hematology &oncology(2019)12:94]。单克隆抗体的组合(如这些实例)是进一步的方法,并试图获得
‘
魔弹(magic bullet)’,其组合adc的许多或甚至所有上述所需特征。
[0008]
与此同时,在过去的几十年里,基于核酸的治疗剂正在开发中。治疗性核酸可基于脱氧核糖核酸(dna)或核糖核酸(rna)、反义寡核苷酸(aso,aon)和短干扰rna(sirna)、微小rna以及dna和rna 适配体,用于诸如基因疗法、rna干扰(rnai)的方法中。它们中的许多通过抑制dna或rna表达而共有相同的基本作用基础,从而防止疾病相关的异常蛋白质的表达。基因疗法领域中正在进行最大数量的临床试验,全球有近2600项正在进行或已完成的临床试验,但只有约 4%进入3期。随后是aso的临床试验。与adc类似,尽管探索了大量技术,但治疗性核酸在临床开发过程中共有两个主要问题:递送到细胞中和脱靶效应。例如,正在研究aso,如肽核酸(pna)、氨基磷酸酯吗啉代寡聚物(pmo)、锁核酸(lna)和桥接核酸(bna)作为特异性抑制靶基因,尤其是那些难以用小分子抑制剂或中和抗体靶向的基因的有吸引力的策略。目前,正在研究不同aso在许多神经退行性疾病 (如亨廷顿氏病(huntington’s disease)、帕金森氏病(parkinson’s disease)、阿尔茨海默氏病(alzheimer’s disease)和肌萎缩侧索硬化症)以及还有几个癌症阶段中的功效。aso作为潜在治疗剂的应用需要安全且有效的方法将其递送至靶细胞和组织的细胞质和/或细胞核。尽管已经证明了 aso的临床相关性,但体外和体内低效的细胞摄取限制了aso的功效,并且已经成为治疗剂开发的障碍。细胞摄取可小于剂量的2%,导致活性位点处的aso浓度过低,无法获得有效和持续的结果。因此,这需要增加施用剂量,这会诱导脱靶效应。最常见的副作用是补体级联的激活、凝血级联的抑制和toll样受体介导的免疫系统的刺激。
[0009]
化疗剂是最常见的小分子,然而,它们的功效受到严重的脱靶副毒性以及差的溶解性、快速清除和有限的肿瘤暴露的阻碍。支架
‑
小分子药物缀合物如聚合物
‑
药物缀合物(pdc)是具有药理学活性的大分子构建体,其包含结合载体支架(如聚乙二醇(peg))的一个或多个分子的小分子药物。
[0010]
此类缀合物原理引起了广泛的关注,并且已经被研究了几十年。处于临床前或临床开发中的大多数小分子药物的缀合物用于肿瘤适应症。然而,最近仅一种与癌症无关的药物(movantik,一种阿片类药物拮抗剂纳洛酮的peg寡聚物缀合物,astrazeneca)被批准用于2014年慢性疼痛患者中阿片类药物引起的便秘,这是一种非肿瘤学适应症。到目前为止,将药物
‑
支架缀合物的应用转化为人类对象的治疗几乎没有取得临床成功。例如,pk1(n
‑
(2
‑
羟丙基)甲基丙烯酰胺(hpma)共聚物多柔比星;由pharmacia,pfizer开发)在鼠模型的实体瘤和白血病中均显示出极大的抗癌活性,并且处于肿瘤适应症的临床研究中。尽管它在人体中证明了非特异性毒性的显著降低和改善的药代动力学,但在患者中抗癌功效的改善却是微不足道的,并且因此停止了对pk1的进一步开发。
[0011]
支架
‑
小分子药物缀合物的失败至少部分归因于其在肿瘤部位处的不良累积。例如,虽然在鼠模型中,pk1显示了在肿瘤中的累积比健康组织(肝、肾、肺、脾和心脏)中高45
‑
250倍,但在临床试验中仅在一小亚组的患者中观察到肿瘤中的累积。
[0012]
上述问题的一个潜在解决方案是将纳米颗粒系统应用于药物递送,如脂质体。脂质体是由一个或多个磷脂双层组成的球形囊泡,其当磷脂分散在水中时自发形成。磷脂的两亲性特征为其提供了自组装特性、乳化和润湿特征,并且这些特性可用于新药和新药递送系统的设计。与直接施用药物相比,封装在脂质体递送系统中的药物可具有多种优势,如改善和控制药代动力学和药效学、组织靶向特性、降低的毒性和增强的药物活性。此类成功的一个实例是脂质体封装形式的小分子化疗剂多柔比星(doxil:一种聚乙二醇化脂质体封装形式的多柔比星; myocet:一种非聚乙二醇化脂质体多柔比星),其已被批准用于临床使用。
[0013]
因此,仍然需要找到一种解决方案,其允许药物疗法,如抗肿瘤疗法,在需要时适用于非全身性使用,其中药物具有例如可接受的安全性特性、几乎没有脱靶活性、足够的功效,从患者体内清除率足够低等。
[0014]
概述
[0015]
对于本发明的一个实施方案,第一目标是提供改善的生物活性化合物或包含此类改善的生物活性化合物的组合物。
[0016]
本发明的实施方案的几个目标之一是提供在向有需要的人类患者施用小分子治疗活性化合物时遇到的非特异性问题的解决方案。本发明的实施方案的几个目标之一是提供对驱动疾病的生物因素或生物过程具有非最佳特异性的药物的问题的解决方案。本发明的实施方案的几个目标之一是提供当施用至有需要的人类患者时当前药物的安全特性不足的问题的解决方案。本发明的实施方案的几个目标之一是提供当施用至有需要的人类患者时当前药物不如所需有效的问题的解决方案。本发明的实施方案的几个目标之一是提供当施用至有需要的人类患者时当前药物未充分针对患病细胞且对非患病细胞几乎没有脱靶活性的问题的解决方案。本发明的实施方案的几个目标之一是提供当施用至有需要的人类患者时当前药物没有足够及时的作用模式的问题 (如,施用的药物分子应在一定的时间范围内到达人类患者的靶向部位,并应在靶向部位处保持一定的时间范围)的解决方案。本发明的实施方案的几个目标之一是提供当施用至有需要的人类患者时当前药物在患者体内没有足够长的持久治疗活性的问题的解决方案。
[0017]
本发明的实施方案的至少一个上述目的是通过提供当存在于哺乳动物细胞内时能够诱导细胞内效应的效应子部分来实现的,所述效应子部分与至少一个皂苷缀合,其中所述至少一个皂苷经由至少一个接头共价结合效应子部分,或者直接共价结合所述效应子部分。
[0018]
将关于特定实施方案描述本发明,但本发明不限于此而仅由权利要求书限制。除非另有说明,否则本文描述的本发明的实施方案可以组合和协作操作。
[0019]
本发明的一个方面涉及当存在于哺乳动物细胞内时能够诱导细胞内效应的效应子部分,所述效应子部分与至少一个皂苷缀合,其中所述至少一个皂苷经由至少一个接头共价结合所述效应子部分,或者直接共价结合所述效应子部分。
[0020]
本发明的一个方面涉及包含根据本发明的效应子部分的抗体
‑
药物缀合物,或者
包含本发明的效应子部分的配体
‑
药物缀合物,所述效应子部分包含共价偶联的皂苷。本发明的效应子部分是包含直接或经由至少一个接头,任选地包含可裂解接头,并且任选地经由寡聚支架或多聚支架彼此共价偶联的至少一个皂苷和至少一个效应分子的缀合物,所述至少一个皂苷和/或所述至少一个效应子部分共价结合至所述寡聚支架或多聚支架。
[0021]
本发明的一个方面涉及治疗性组合,其包含:(a)本发明的效应子部分,其包含至少一个皂苷和任选的药学上可接受的赋形剂;以及(b)抗体
ꢀ‑
药物缀合物或配体
‑
药物缀合物和任选的药学上可接受的赋形剂。
[0022]
本发明的一个方面涉及药物组合物,其包含本发明的效应子部分或本发明的抗体
‑
药物缀合物或本发明的配体
‑
药物缀合物(其包含与效应分子共价连接的至少一个皂苷)和任选的药学上可接受的赋形剂。
[0023]
本发明的一个方面涉及本发明的效应子部分或本发明的抗体
‑
药物缀合物或本发明的治疗性组合或本发明的配体
‑
药物缀合物或本发明的药物组合物,其用作药物。
[0024]
本发明的一个方面涉及本发明的效应子部分或本发明的抗体
‑
药物缀合物或本发明的治疗性组合或本发明的配体
‑
药物缀合物或本发明的药物组合物,其用于治疗或预防癌症或自身免疫疾病。
[0025]
定义
[0026]
术语“接头”具有其常规的科学含义,并且在本文是指通过肽键复合的氨基酸残基的化学部分或线性区段,其将分子或原子连接至另一个分子,如连接至配体或效应分子或支架。通常,接头包含通过化学键连接的原子链。本领域已知的任何接头分子或接头技术均可用于本公开内容中。在指示的情况下,接头是用于通过适合与接头形成共价连键或共价键的此类分子上的化学基团共价结合分子的接头。接头可以是不可裂解接头,如,接头在生理条件下是稳定的。接头可以是可裂解接头,如在酶的存在下或在特定的ph范围或值下或在生理条件下(如在内体(如晚期内体)和哺乳动物细胞(如人类细胞)的溶酶体中的胞内条件)可裂解的接头。可用于本公开内容上下文中的示例性接头包括但不限于n
‑
ε
‑
马来酰亚胺基己酸酰肼(emch)、3
‑
(2
‑
吡啶基二硫代) 丙酸琥珀酰亚胺酯或3
‑
(2
‑
吡啶基二硫代)丙酸n
‑
羟基琥珀酰亚胺酯 (spdp)和1
‑
[双(二甲基氨基)亚甲基]
‑
1h
‑
1,2,3
‑
三唑并[4,5
‑
b]吡啶鎓3
‑ꢀ
氧化物六氟磷酸盐(hatu)。
[0027]
术语“三官能接头”具有其常规的科学含义,并且在本文是指经由三个分子中的每一个上的化学基团连接三个分子的接头。技术人员能够基于本公开内容和公知常识设计此类三官能接头。此类三官能接头可以表现出例如马来酰亚胺基基团,马来酰亚胺基基团可用于缀合至表现出硫醇基团的靶向配体以进行硫醇
‑
烯反应。此外,三官能接头可以表现出二苯并环辛炔(dbco)基团,以与具有叠氮基的皂苷进行所谓的应变促进的炔烃
‑
叠氮化物环加成(spaac,点击化学)。最后,三官能接头可以获得第三个官能团,如反式环辛烯(tco)基团,以与具有四嗪(tz)的效应分子进行所谓的逆电子需求狄尔斯
‑
阿尔德(inverseelectron demand diels
‑
alder,iedda)反应。技术人员将理解,三官能接头的化学基团可以是所有三个相同或不同的,或者接头可以包含用于将分子连接到三官能接头的两个相同的化学基团。三官能接头之间形成的键可以是共价的或非共价的,并且优选共价键。三官能接头与一个或两个或三个结合的分子之间经由各自的化学基团形成的键,可以是可裂解的(不稳定的)键,如在酸性条件下在细胞内(如哺乳动物细胞(如人类细胞)的内体和溶酶体)
裂解,或者可以是不可裂解的。当然,三官能接头可以涵盖一个或两个用于形成共价键的化学基团,而另外的两个或一个化学基团分别用于形成非共价键。当然,三官能接头可以涵盖一个或两个用于形成可裂解键的化学基团,而另外的两个或一个化学基团分别用于形成不可裂解的键。
[0028]
诸如在术语“可裂解接头”或“可裂解键”中使用的术语“可裂解的”具有其常规的科学含义,并且在本文是指在酸性条件、还原条件、酶促条件或光诱导条件下进行裂解。例如,可裂解接头可以在酸性条件下进行裂解,优选地所述可裂解接头在如存在于哺乳动物细胞,优选人类细胞的内体和/或溶酶体的酸性条件下,优选在ph 4.0
‑
6.5下,并且更优选在ph≤5.5下在体内进行裂解。作为另一个实例,可裂解接头可以通过酶,如通过组织蛋白酶进行裂解。此外,在还原条件下可裂解的共价键的一个实例是二硫键。
[0029]
在寡聚支架或多聚支架的上下文中的术语“寡聚物”和“多聚物”具有其常规的科学含义。本文的多聚物是指分子结构主要或完全由大量相同或相似的单元键合在一起构成的物质;本文的寡聚物是指其分子由相对较少的重复单元组成的聚合物。例如,包含5
‑
10个或更少相同或相似单元的结构可以被称为寡聚结构,而包含10
‑
50个单体单元或更多的结构可以被称为多聚结构,而10个单体单元的结构可以被称为寡聚的或多聚的。
[0030]
术语“结合位点”具有其常规的科学含义,并且在本文是指分子(如,蛋白质、dna或rna)上的另一分子能够结合的区域或表位。
[0031]
术语“支架”具有其常规的科学含义,并且在本文是指一个或多个分子(如配体分子、本发明的皂苷、糖苷、效应分子)可以直接或经由接头(如可裂解接头)共价结合的寡聚或多聚模板或者载体或者基础 (base)(基础分子或基础结构)。支架可具有结构上有序的形成,如多聚物、寡聚物、树状物、树枝化基元化多聚物或树枝化基元化寡聚物或者具有组装的聚合结构,如水凝胶、微凝胶、纳米凝胶、稳定的聚合胶束或脂质体,但不包括由单体的非共价组装体(如胆固醇/磷脂混合物)组成的结构。支架可包含多聚结构或寡聚结构,如聚
‑
或寡聚(胺),如聚乙烯亚胺和聚(酰氨基胺);或者结构,如聚乙二醇,聚或寡聚(酯),如聚(丙交酯)、聚(内酰胺)、聚丙交酯
‑
共
‑
乙交酯共聚物;或聚(糊精)、聚糖或寡糖,如环糊精或聚葡萄糖;或者结构,如天然和/或人工聚氨基酸或寡氨基酸,如聚赖氨酸或肽或蛋白质、dna寡聚物或多聚物、稳定的rna聚合物或pna(肽核酸)聚合物。优选地,多聚结构或寡聚结构是生物相容的,其中生物相容意指多聚结构或寡聚结构在有机体内不显示出显著的急性或慢性毒性,并且可以原样排泄或通过身体的代谢完全降解为可排泄的化合物和/或生理化合物。
[0032]
术语“配体”具有其常规的科学含义,并且在本文是指可以选择性地结合靶细胞(如靶标癌细胞或靶标自身免疫细胞)处表达的靶细胞表面分子或靶细胞表面受体的任何一种或多种分子。配体可以结合靶细胞上的受体或其它抗原所包含的表位。优选地,细胞结合配体是抗体。
[0033]
如本文所用的术语“抗体”以最广泛的含义使用,可以指被定义为属于igg类、igm类、ige类、iga类或igd类(或其任何亚类)的蛋白质的免疫球蛋白(ig)或者免疫球蛋白的功能结合片段或结合结构域。在本发明的上下文中,免疫球蛋白的“结合片段”或“结合结构域”被定义为亲本免疫球蛋白的抗原结合片段或抗原结合结构域或其它衍生物,其基本上保持了此类亲本免疫球蛋白的抗原结合活性。功能片段和功能结构域是本发明意义上的抗
(如il
‑
2、il
‑
3、il
‑
4和il
‑
6)、集落刺激因子(csf,如g
‑
csf、m
‑
csf 和gm
‑
csf)、蛙皮素、胃泌素、arg
‑
gly
‑
asp或rgd、适配体(如as
‑ꢀ
1411、gbi
‑
10、针对hiv糖蛋白的rna适配体)、小分子(如叶酸、茴香酰胺苯基硼酸)、维生素(如维生素d)、碳水化合物(如透明质酸、半乳糖)。
[0038]“效应分子”或“效应子部分”或“有效载荷”具有其常规的科学含义,并且在本发明的上下文中是通过与胞内效应分子靶标相互作用而影响细胞代谢的任何物质,其中该效应分子靶标是除了内吞和循环途径的区室和囊泡的腔之外但包括这些区室和囊泡的膜的细胞内的任何分子或结构。因此,细胞内的所述结构包括细胞核、线粒体、叶绿体、内质网、高尔基体、其它转运囊泡、质膜的内部和胞质。
[0039]
效应分子或效应子部分是药学活性物质,如毒素,如蛋白质毒素、药物、多肽或多核苷酸。本发明中的药学活性物质是用于在有机体内,优选脊椎动物,更优选哺乳动物,如非人类对象或人类/对象中实现有益结果的效应分子或效应子部分。益处包括疾病和/或症状和/或健康问题的诊断、预后、治疗、治愈和防止(预防)。药学活性物质也可能导致不希望的并且有时甚至是有害的副作用(如临床试验期间观察到的不良事件)。在这种情况下,必须权衡利弊,以决定药学活性物质是否适用于特定情况。如果药学活性物质在细胞内的效应主要对整个有机体有益,则该细胞被称为靶细胞。如果细胞内的效应主要对整个有机体有害,则该细胞被称为脱靶细胞。在人工系统如细胞培养和生物反应器中,靶细胞和脱靶细胞取决于目的并由用户定义。效应分子和效应子部分的实例是药物、毒素、多肽(如酶)、多核苷酸(包括包含非天然氨基酸或核酸的多肽和多核苷酸)及其任何组合。
[0040]
作为药物的效应分子或效应子部分可以包括但不限于抗癌剂、抗炎剂和抗感染(如,抗真菌、抗细菌、抗寄生虫、抗病毒)剂。优选地,本发明的药物分子是抗癌剂或抗自身免疫剂。适合的抗癌剂包括但不限于烷化剂、抗代谢物、纺锤体毒植物生物碱、细胞毒性/抗肿瘤抗生素、拓扑异构酶抑制剂、光敏剂和激酶抑制剂。“抗癌剂”的定义中还包括:如,(i)抗激素剂,其用于调控或抑制激素对肿瘤的作用,如抗雌激素和选择性雌激素受体调节剂;(ii)抑制芳香酶的芳香酶抑制剂,其调控肾上腺中的雌激素产生;(iii)抗雄激素;(iv)蛋白激酶抑制剂; (v)脂质激酶抑制剂;(vi)反义寡核苷酸,特别是抑制参与异常细胞增殖的信号传导途径中的基因表达的那些;(vii)核酶,如vegf表达抑制剂和her2表达抑制剂;(viii)疫苗,如基因疗法疫苗;拓扑异构酶1 抑制剂;(ix)抗血管生成剂;以及上述中任一种的药学上可接受的盐、酸、溶剂化物和衍生物。
[0041]
作为毒素的效应分子或效应子部分可以包括但不限于:蛋白质毒性(如细菌源性毒素和植物源性毒素)、靶向微管蛋白丝的毒素、靶向 dna的毒素、靶向rna的毒素。蛋白质毒素的实例是皂草素、石竹素、蓖麻毒素、蒴莲根毒素、相思子毒素、蒴莲毒素、槲寄生素、志贺毒素、志贺样毒素、假单胞菌外毒素(pe,也称为外毒素a)、白喉毒素(dt)和霍乱毒素。靶向微管蛋白细丝的毒素的实例是美登素(如dm1 和dm4)、澳瑞他汀(如单甲基澳瑞他汀e(mmae)和单甲基澳瑞他汀 f(mmaf))、类毒素、微管菌素、念珠藻素、根瘤菌素。dna靶向毒素的实例是卡奇霉素:n
‑
乙酰基
‑
γ
‑
卡奇霉素、cc
‑
1065类似物、倍癌霉素、多柔比星、甲氨蝶呤、苯并二氮杂喜树碱类似物和蒽环类药物。dna靶向毒性的实例是鹅膏蕈碱、斯考他汀(spliceostatins)和泰兰斯他汀(thailanstatins)。如本发明中使用的毒素被定义为能够杀伤或灭活细胞的药学活性物质。优选地,靶向毒素是仅或至少主要对靶细胞有毒但对脱靶细胞无毒的毒素。靶向毒素的净效应优选对整个有机体是有益的。
[0042]
作为多肽的效应分子或效应子部分可以是如恢复失去的功能、诸如例如酶替代、基因调控功能的多肽,或毒素。作为效应分子的多肽的实例是如cas9;毒素(如皂草素、石竹素、白树毒素、(去)三角梅核糖体失活蛋白((de)bouganin)、麦仙翁毒素(agrostin)、蓖麻毒素(毒素a 链);商陆抗病毒蛋白、凋亡蛋白、白喉毒素、假单胞菌外毒素);代谢酶(如精氨基琥珀酸裂解酶、精氨基琥珀酸合成酶)、凝血级联酶、修复酶;用于细胞信号传导的酶;细胞周期调控因子;基因调控因子(转录因子如nf
‑
κb或基因阻遏子如甲硫氨酸阻遏子)。
[0043]
作为多核苷酸的效应分子或效应子部分可以是如包含编码信息如编码蛋白质的基因或开放阅读框的多核苷酸。它还可以包含调控信息,如启动子或调控元件结合区,或编码微小rna的序列。此类多核苷酸可以包括天然和人工核酸。人工核酸包括如肽核酸(pna)、吗啉代和锁核酸(lna)以及二醇核酸(gna)和苏糖核酸(tna)。这些中的每一个都通过分子主链的变化与天然存在的dna或rna区分开来。作为效应分子的核苷酸的实例是但不限于,如,dna:单链dna(如,腺嘌呤磷酸核糖转移酶的dna);线性双链dna(如凝血因子ix基因);环状双链dna(如质粒);rna:mrna(如tal效应分子核酸酶)、trna、 rrna、sirna、mirna、反义rna;反义寡核苷酸(aso、aon,如 pna、pmo、lna和bna)。
[0044]
在如“蛋白质分子”和“蛋白质毒素”中使用的术语“蛋白质”是包含至少一串氨基酸残基的分子和毒素,其可以作为表达产物从单一 mrna获得。此类分子或毒素还可包含任何翻译后修饰、碳水化合物如n
‑
或o
‑
连接的碳水化合物、二硫键、磷酸化、硫酸化等作为任何翻译后修饰的结果,和/或还可包含任何其它修饰如由化学修饰产生的那些(如,连接效应子部分、皂苷、支架、配体等,直接连接至如氨基酸侧链,或经由至少一个接头(共价)结合用于化学修饰蛋白质分子的分子以及化学结合(共价)蛋白质分子)。术语“蛋白质”还涵盖并包括此类分子的组装体,如同源二聚体、异源三聚体、异源六聚体或复杂的组装体如核糖体。
[0045]
在例如“特异性结合”和“特异性地存在或表达于肿瘤细胞表面上的受体或分子靶标”等的上下文中的术语“特异性的(specific)”和“特异性地(specifically)”具有本领域已知的其正常的科学含义,并且在本文是指如相对于第一分子与不同于第二分子的另一分子的任何推定结合以更高的亲和力发生的第一分子与第二分子的结合相互作用,或者是指如当例如考虑受体或分子靶标的数量时,相对于在第二类型细胞(如健康细胞等)处相同受体或分子靶标的表达程度,第一类型细胞(如肿瘤细胞、自身免疫细胞、患病细胞、异常细胞)的表面上细胞表面受体或分子靶标的表达或表达至更高程度,其中在第二类型细胞处的表达相对于肿瘤细胞等上的任何表达程度可完全不存在或非常低。此外,例如在“特异性结合”中的术语“特异性(specificity)”具有本领域已知的其正常科学含义,并且在本文具有表示可以具有以比分子之间的本底相互作用更高的结合亲和力与另一分子相互作用的分子的含义。类似地,术语“特异性(specificity)”是指,例如,两个分子之间或细胞与分子之间的相互作用,其具有比分子之间的本底相互作用更高的结合亲和力。结合分子如免疫球蛋白经由其结合位点(如免疫球蛋白的免疫球蛋白可变区)以比分子之间的本底相互作用更高的结合亲和力结合分子上的结合位点,如表位、细胞表面受体等。在本发明的上下文中,本底相互作用通常是具有低于10e
‑
4m的k
d
的亲和力的相互作用。类似地,“特异性结合结构域”是以比分子之间的本底相互作用更高的结合亲和力优先结合分子上的结合位点,如表位、细胞表面受体等的结构域。在本发明的上下文中,“本底相互作用”通常是具有低于
doi:10.3390/molecules24010171]。所述的结构是qs
‑
7的api
‑
变体 qs1862。分子质量是1862道尔顿,因为该质量是包括葡糖醛酸处的质子在内的正式质量。在中性ph下,分子被去质子化。当以负离子模式在质谱法中测量时,测量的质量是1861道尔顿。
[0056]
说明书和权利要求中的术语第一、第二、第三等用于区分相似的要素,并不一定用于描述依序或时间顺序。在适当的情况下,术语可以互换。本发明的实施方案可以以不同于本文描述或例示的其它顺序操作。
[0057]
此外,各个实施方案,虽然被称为“优选的”或“如”或“例如”或“特别地”,但应被解释为可以实施本发明的示例性方式而不是限制本发明的范围。
[0058]
权利要求中使用的术语“包括/包含”不应被解释为限于其后列出的要素或步骤;它不排除其它要素或步骤。需要将其解释为指定所提及的所述特征、整数、步骤或组分的存在,但不排除一个或多个其它特征、整数、步骤或组分或其群组的存在或添加。因此,表述“包含a 和b的药物组合物”的范围不应限于仅由组分a和b组成的药物组合物,而是就本发明而言,药物组合物的唯一列举的组分是a和b,而且权利要求应被解释为包括那些组分的等效物。类似地,表述“包括步骤a和步骤b的方法”的范围不应限于仅由步骤a和b组成的方法,而就本发明而言,该方法仅列举的步骤为a和b,而且权利要求应被解释为包括那些步骤的等效物。
[0059]
此外,不定冠词“一个/一种(a)”或“一个/一种(an)”对特征的提及不排除存在多于一个特征(如例如组分、赋形剂、皂苷等)的可能性,除非上下文清楚地要求有一个且只有一个特征。因此,不定冠词“一个/ 一种(a)”或“一个/一种(an)”通常意指“至少一个/种”。
[0060]
附图简述
[0061]
图1:hsp27bna、hsp27bna
‑
so1861和hsp27bna
‑
树枝化基元
‑ꢀ
(so1861)4在a431癌细胞系中的hsp27bna基因沉默活性。
[0062]
图2:a.bsa
‑
so1861的maldi
‑
tof
‑
ms光谱。b.bsa的maldi
‑
tof
‑ꢀ
ms光谱。
[0063]
图3:a.so1861的h
‑
nmr光谱。b.so1861
‑
emch((emch=n
‑
ε
‑
马来酰亚胺基己酸酰肼)缀合物的h
‑
nmr光谱。
[0064]
图4:a.so1861
‑
emch缀合物的maldi
‑
tof
‑
ms光谱。b.so1861
‑ꢀ
emch
‑
巯基乙醇缀合物的maldi
‑
tof
‑
ms光谱。
[0065]
图5:a.so1861
‑
emch的合成方案。b.so1861在负反射器模式(negative reflector mode)下的maldi
‑
tof
‑
ms光谱。tfa:三氟乙酸,r.t:室温, h:小时,以及mw:分子量。c:so1861
‑
emch在负反射器模式的maldi
‑ꢀ
tof
‑
ms光谱。tfa:三氟乙酸,r.t:室温,h:小时,以及mw:分子量。
[0066]
图6:树枝化基元(
‑
l
‑
so1861)4合成的反应方案。
[0067]
图7:树枝化基元(
‑
l
‑
so1861)8合成的反应方案。
[0068]
图8:a.cy3
‑
pamam的maldi
‑
tof
‑
ms光谱。b.cy3
‑
pamam
‑
so1861 的maldi
‑
tof
‑
ms光谱,其中每个pamam连接5个so1861。c.cy3
‑ꢀ
pamam
‑
so1861的maldi
‑
tof
‑
ms光谱,其中每个pamam连接13 个so1861。d.cy3
‑
pamam
‑
so1861的maldi
‑
tof
‑
ms光谱,每个 pamam连接51个so1861。
[0069]
图9:a.具有5当量进料so1861
‑
emch的cy3
‑
pamam
‑
so1861的 maldi
‑
tof
‑
ms光谱。b.具有30当量进料so1861
‑
emch的cy3
‑ꢀ
pamam
‑
so1861的maldi
‑
tof
‑
ms光谱。
[0070]
图10:cy3
‑
pamam
‑
nc
‑
so1861(nc=稳定键(“不可裂解的”))的maldi
‑ꢀ
tof
‑
ms光谱。
[0071]
图11:a.使用硫醇化试剂2
‑
亚氨基硫烷(iminothiolane)对pamam进行硫醇化的反应方案。b.天然pamam的maldi
‑
tof
‑
ms光谱。c.硫醇化 pamam
‑
(sh)
16
的maldi
‑
tof
‑
ms光谱。d.硫醇化pamam
‑
(sh)
65
的 maldi
‑
tof
‑
ms光谱。e.硫醇化pamam
‑
(sh)
108
的maldi
‑
tof
‑
ms光谱。
[0072]
图12:a.使用聚乙二醇化试剂mpeg
2k
‑
nhs对pamam进行聚乙二醇化的反应方案。b.天然pamam的maldi
‑
tof
‑
ms光谱。c.聚乙二醇化 pamam
‑
(mpeg
2k
)3的maldi
‑
tof
‑
ms光谱。d.聚乙二醇化pamam
‑ꢀ
(mpeg
2k
)8的maldi
‑
tof
‑
ms光谱。e.聚乙二醇化pamam
‑
(mpeg
2k
)
18
的maldi
‑
tof
‑
ms光谱。
[0073]
图13:cy3
‑
pamam
‑
nc
‑
so1861
‑
二苯并环辛炔(dbco)的反应方案。 b.cy3
‑
pamam
‑
nc
‑
so1861
‑
二苯并环辛炔(dbco)的maldi
‑
tof ms光谱。c.cy3
‑
pamam
‑
(so1861)5‑
dbco的maldi
‑
tof
‑
ms光谱。d.cy3
‑ꢀ
pamam
‑
(so1861)
27
‑
dbco的maldi
‑
tof
‑
ms光谱。
[0074]
图14:a.石竹素
‑
egf
‑
alexa488的反应方案。b.石竹素
‑
egf
‑
alexa488
‑
ss
‑ꢀ
peg
‑
n3的反应方案。c.石竹素
‑
egf的maldi
‑
tof
‑
ms光谱。d.石竹素
‑
egf
‑
alexa488的maldi
‑
tof
‑
ms光谱。e.石竹素
‑
egf
‑
alexa488
‑
ss
‑ꢀ
peg
‑
n3的maldi
‑
tof
‑
ms光谱。
[0075]
图15:a.石竹素
‑
alexa488的反应方案。b.石竹素
‑
alexa488
‑
ss
‑
peg
‑
n3的反应方案。c.石竹素的maldi
‑
tof
‑
ms光谱。d.石竹素
‑
alexa488的 maldi
‑
tof
‑
ms光谱。e.石竹素
‑
alexa488
‑
ss
‑
peg
‑
n3的maldi
‑
tof
‑ꢀ
ms光谱。
[0076]
图16:在versadoc成像系统上进行的sds
‑
page凝胶的荧光图像。m=标志物,p=cy3
‑
pamam
‑
(so1861)27
‑
dbco,d=石竹素egf
‑
alexa488
‑ꢀ
ss
‑
peg
‑
n3,c1=cy3
‑
pamam
‑
(so1861)5
‑
石竹素
‑
egf
‑
alexa488, c2=cy3
‑
pamam
‑
nc
‑
so1861
‑
石竹素
‑
egf
‑
alexa488,以及c3=cy3
‑ꢀ
pamam
‑
(so1861)27
‑
石竹素
‑
egf
‑
alexa488。
[0077]
图17:a.cy3
‑
pamam
‑
nc
‑
so1861经由还原胺化的合成方案。b.经由还原胺化合成的cy3
‑
pamam
‑
nc
‑
so1861的maldi
‑
tof
‑
ms光谱,其中每个pamam具有10个so1861。c.经由还原胺化合成的cy3
‑
pamam
‑ꢀ
nc
‑
so1861的maldi
‑
tof
‑
ms光谱,其中每个pamam具有30个 so1861。
[0078]
图18:a.天然肽的maldi
‑
tof
‑
ms光谱。b.肽
‑
so1861缀合物的maldi
‑ꢀ
tof
‑
ms光谱。
[0079]
图19:用于将增强内体逃逸的皂苷缀合到聚合结构的具有突出显示的化学基团的so1861结构。突出显示的基团是醛(黑色圆圈)、羧酸(虚线圈圈)、烯烃(虚线五边形)和醇(虚线框)。
[0080]
图20:a.产生稳定的
‘
即用型缀合物(ready
‑
to conjugate)’内体逃逸增强剂皂苷的示意图。b.产生可裂解的“即用型缀合物”内体逃逸增强剂皂苷的示意图。
[0081]
图21:图26:在酸性条件下so1861
‑
emch的腙键的水解。
[0082]
图22:a.so
‑
1861
‑
emch缀合物的标准分子结构。马来酰亚胺基团用圆圈标记。b.so1861
‑
emch缀合物的3d模型。马来酰亚胺基团用圆圈标记。
[0083]
图23:a.so1861
‑
emch在ph 3的hcl溶液中水解之前的maldi
‑
tof
‑ꢀ
ms光谱。b.so1861
‑
emch在ph 3的hcl溶液中水解之后的maldi
‑ꢀ
tof
‑
ms光谱。
[0084]
图24:so1861
‑
emch缀合至任何含胺的聚合结构的反应方案。
[0085]
图25:a.so1861
‑
emch缀合至花青3染料标记的聚酰胺胺(pamam)g5 树状物的反应方案。b.so1861
‑
hatu(hatu=1
‑
[双(二甲基氨基)亚甲基]
‑
1h
‑
1,2,3
‑
三唑并[4,5
‑
b]吡啶鎓3
‑
氧化物六氟磷酸盐)缀合至花青3 染料标记的聚酰胺胺(pamam)g5树状物的反应方案。
[0086]
图26:具有保护的氨基的g4
‑
树枝化基元的分子结构。
[0087]
图27:生成基于树枝化基元的支架的合成方案。
[0088]
图28:a.g4
‑
树枝化基元的部分染料标记和去保护的反应方案。b.去保护的和部分染料标记的g4
‑
树枝化基元的maldi
‑
tof
‑
ms光谱。
[0089]
图29:a.具有22进料当量的so1861
‑
emch的g4
‑
树枝化基元
‑
so1861 支架的maldi
‑
tof
‑
ms光谱。b.具有10进料当量的so1861
‑
emch的 g4
‑
树枝化基元
‑
so1861支架的maldi
‑
tof
‑
ms光谱。c.具有3进料当量的so1861
‑
emch的g4
‑
树枝化基元
‑
so1861支架的maldi
‑
tof
‑
ms 光谱。
[0090]
图30:a.如通过hela细胞的facs分析测定的egfr细胞表面表达。 b.用so1861 石竹素
‑
egf(dia
‑
egf)、so1861 石竹素
‑
egf 500nm氯喹, so1861 石竹素
‑
egf 500nm pamam,so1861 石竹素
‑
egf 667nm树枝化基元处理的hela细胞的细胞活力。c.用so1861 石竹素
‑
egf、 so1861 石竹素
‑
egf 500nm氯喹、so1861 石竹素
‑
egf 500nmpamam、so1861 石竹素
‑
egf 500nm pamam
‑
(sh)
16
、so1861 石竹素
ꢀ‑
egf 500nm pamam
‑
(sh)
65
、so1861 石竹素
‑
egf 500nm pamam
‑ꢀ
(sh)
108
处理的hela细胞的细胞活力。d.用so1861 石竹素
‑
egf、 so1861 石竹素
‑
egf 500nm氯喹、so1861 石竹素
‑
egf 500nmpamam、so1861 石竹素
‑
egf 500nm pamam
‑
(mpeg)3、so1861 石竹素
‑
egf 500nm pamam
‑
(mpeg)8、so1861 石竹素
‑
egf 500nmpamam
‑
(mpeg)
18
处理的hela细胞的细胞活力。
[0091]
详述
[0092]
为了使生物活性分子发挥作用,该分子必须能够与其如在血清中、在细胞表面的外部或者细胞或细胞器的内部的靶标结合。例如,几乎所有基于蛋白质的靶向毒素的活性部分都必须进入靶细胞的胞质以介导其靶标调节作用。在许多配合(constellation)中,毒素保持无效,因为 (1)靶向部分内化较差并保持与细胞外部结合,(2)内化后循环回到细胞表面或(3)运输到内溶酶体中,在那,其被降解。尽管这些基本问题几十年来已为人所知并且在过去几十年中已经研究了500多种靶向毒素,但所述问题仍未得到解决,并且迄今为止只有一种抗体靶向蛋白质毒素moxetumomab pasudotox
‑
tdfk(astrazenecapharmaceuticals lp)已被fda批准用于复发性或难治性毛细胞白血病。进一步批准的adc是elzonris,ontak。
[0093]
为了克服这些问题,已经描述了许多策略,包括将毒素重定向到内质网中的生物合成途径的内源性细胞膜转运复合物的方法,以及破坏或削弱内体(即细胞中内吞途径的区室)的膜完整性,从而促进内体逃逸的技术。这包括使用亲溶酶体胺,羧酸离子载体,钙通道拮抗剂,病毒、细菌、植物、动物、人类和合成来源的各种细胞穿透肽,其它有机分子和光诱导技术。尽管靶向毒素的功效通常在细胞培养中增强了数百或数千倍,在特殊情况下超过百万倍,但需要将内体逃逸增强剂与其它物质共施用会带来新的问题,包括另外的副作用、损失靶标特异性、难以确定治疗窗和细胞类型依赖性变化。
[0094]
所有策略(包括物理化学技术)都需要增强剂分子,其或多或少直接与膜相互作用,并且基本上包括小化学分子、次级代谢物、肽和蛋白质。所有这些物质的一个共同特征
是它们本身不是靶细胞特异性的,并且以不同于靶向毒素的其它动力学分布。这是当前方法的一个主要缺点。
[0095]
将关于特定实施方案描述本发明,但本发明不限于此而仅由权利要求书限制。除非另有说明,否则本文描述的本发明的实施方案可以组合和协作操作。
[0096]
虽然本发明已经根据几个实施方案进行了描述,但预期在阅读说明书和研究附图和图表后,本领域的普通技术人员将明白其替代、修改、置换和等价物。本发明不以任何方式限于例示的实施方案。在不脱离由所附权利要求限定的范围的情况下可以进行改变。
[0097]
本发明的一个方面涉及当存在于哺乳动物细胞内时能够诱导细胞内效应的效应子部分,所述效应子部分与至少一个皂苷缀合,其中所述至少一个皂苷经由至少一个接头共价结合所述效应子部分,或者直接共价结合所述效应子部分。
[0098]
发明人确定,当将皂苷和效应子部分的缀合物施用至荷瘤哺乳动物 (小鼠)(向其施用缀合物)时,所述缀合物的治疗窗增加,其中所述缀合物包含至少一个共价结合的皂苷。本发明的缀合物具有与其结合,优选共价结合,更优选经由可裂解接头结合的至少一种糖苷,如皂苷。皂苷可能通过增强效应子部分内体逃逸到需要效应子部分活性的溶胶中而增加了与皂苷结合的效应子部分的治疗功效。这样,已经在比效应子部分的常规剂量更低的剂量下,当缀合物如adc或aoc的一部分在本发明缀合物所包含的皂苷的存在的影响下确定治疗效果,从而使皂苷和效应子部分一起在靶细胞附近、在靶细胞处和/或在靶细胞内。靶细胞例如是患病细胞,如肿瘤细胞或自身免疫细胞或b细胞疾病相关的b细胞等。根据本发明,效应子部分例如是毒素,如是adc的一部分的毒素;或寡核苷酸,如是 aoc的一部分的反义bna。
[0099]
实施方案是本发明的效应子部分,其包含至少一种寡核苷酸、核酸、异源核酸或者由其组成,所述寡核苷酸、核酸、异源核酸优选选自以下中的任何一种或多种:载体、基因、诱导细胞自杀的转基因、脱氧核糖核酸(dna)、核糖核酸(rna)、反义寡核苷酸(aso,aon)、短干扰rna(sirna)、微小rna(mirna)、dna适配体、rna适配体、 mrna、微环dna、肽核酸(pna)、氨基磷酸酯吗啉代寡聚物(pmo)、锁核酸(lna)、桥接核酸(bna)、2
’‑
脱氧
‑2’‑
氟阿拉伯糖核酸(fana)、 2
’‑
o
‑
甲氧基乙基
‑
rna(moe)、2
’‑
o,4
’‑
氨基亚乙基桥接核酸、3
’‑
氟己糖醇核酸(fhna)、质粒、二醇核酸(gna)和苏糖核酸(tna)、或它们的衍生物,更优选bna,例如用于沉默hsp27蛋白表达的bna。
[0100]
令发明人惊讶的是,与对照相比,共价连接在一起的反义bna(如用于沉默hsp27基因表达)和皂苷(如so1861)的缀合物在快速生长/分裂的肿瘤细胞(如小鼠a431癌细胞系细胞)中有效地沉默hsp27表达。与在皂苷不存在下暴露于相同浓度的游离未缀合的bna的细胞中的hsp27表达相比,bna
‑
皂苷缀合物导致细胞中的hsp27表达降低约三倍。还参见实施例的图1。因此,使肿瘤细胞与反义寡核苷酸如反义bna接触导致基因沉默,当皂苷如so1861与寡核苷酸共价连接时,基因沉默得到改善或增强。因此,关于寡核苷酸的治疗窗扩大,因为当应用根据本发明的 bna和皂苷的缀合物时,现在可以用低三倍剂量的反义bna在肿瘤细胞中获得相同的基因沉默效果。
[0101]
一个实施方案是本发明的效应子部分,其包含至少一种蛋白质分子,所述蛋白质分子优选选自以下中的任何一种或多种:肽、蛋白质、酶如脲酶和cre重组酶、核糖体失活蛋白、蛋白质毒素如选自表a5的蛋白质毒素中的任何一种或多种和/或细菌毒素、植物毒素,
更优选选自以下中的任何一种或多种:病毒毒素,如凋亡蛋白;细菌毒素,如志贺毒素、志贺样毒素、铜绿假单胞菌外毒素(pe)或pe的外毒素a、全长或截短的白喉毒素(dt)、霍乱毒素;真菌毒素,如α
‑
帚曲菌素;植物毒素,包括核糖体失活蛋白和2型核糖体失活蛋白的a链,如石竹素例如石竹素
‑
30或石竹素
‑
32、皂草素例如皂草素
‑
s3或皂草素
‑
s6、三角梅核糖体失活蛋白或三角梅核糖体失活蛋白(bouganin)的去免疫化衍生物去三角梅核糖体失活蛋白(debouganin)、志贺样毒素a、商陆抗病毒蛋白、蓖麻毒素、蓖麻毒素a链、蒴莲根毒素、蒴莲根毒素a 链、相思子毒素、相思子毒素a链、蒴莲毒素、蒴莲毒素a链、槲寄生素、槲寄生素a链;或者动物或人类毒素,如蛙rna酶或者来自人类的颗粒酶b或血管生长素,或者它们的任何片段或衍生物;优选地,所述蛋白质毒素是石竹素和/或皂草素。
[0102]
一个实施方案是本发明的效应子部分,其包含至少一种有效载荷,所述有效载荷优选选自以下中的任何一种或多种:靶向核糖体的毒素、靶向延长因子的毒素、靶向微管蛋白的毒素、靶向dna的毒素和靶向 rna的毒素,更优选选自以下中的任何一种或多种:美坦新、pasudotox、美登素衍生物dm1、美登素衍生物dm4、单甲基澳瑞他汀e(mmae,维多汀)、单甲基澳瑞他汀f(mmaf,莫福汀)、卡奇霉素、n
‑
乙酰基
‑ꢀ
γ
‑
卡奇霉素、吡咯并苯并二氮杂(pbd)二聚体、苯并二氮杂cc
‑ꢀ
1065类似物、倍癌霉素、多柔比星、紫杉醇、多西他赛、顺铂、环磷酰胺、依托泊苷、多西他赛、5
‑
氟尿嘧啶(5
‑
fu)、米托蒽醌、微管菌素、吲哚啉苯并二氮杂az13599185、念珠藻素、根瘤菌素、甲氨蝶呤、蒽环类药物、喜树碱类似物、sn
‑
38、dx
‑
8951f、甲磺酸依喜替康、截短形式的铜绿假单胞菌外毒素(pe38)、倍癌霉素衍生物、鹅膏蕈碱、α
‑
鹅膏蕈碱、斯考他汀、泰兰斯他汀、奥佐米星、特司林、amberstatin269 和soravtansine或它们的衍生物。
[0103]
一个实施方案是本发明的效应子部分,其中所述至少一个皂苷是属于在c
‑
23位具有醛官能团的12,13
‑
脱氢齐墩果烷类型并且任选地在所述皂苷的c
‑
3β
‑
oh基团处的碳水化合物取代基中包含葡糖醛酸官能团的三萜皂苷和/或双糖链三萜皂苷,和/或是从石头花属物种和/或肥皂草属物种和/或麦仙翁属物种和/或皂皮树属物种如皂皮树分离的皂苷。
[0104]
一个实施方案是本发明的效应子部分,其中所述至少一个皂苷是单一特异性皂苷或者是两个或更多个不同皂苷的混合物。
[0105]
一个实施方案是本发明的效应子部分,其中所述皂苷是表a1或方案i中的皂苷中的一种或多种、so1861、sa1657、ge1741、sa1641、 qs
‑
21、qs
‑
21a、qs
‑
21a
‑
api、qs
‑
21a
‑
xyl、qs
‑
21b、qs
‑
21b
‑
api、 qs
‑
21b
‑
xyl、qs
‑7‑
xyl、qs
‑7‑
api、qs
‑
17
‑
api、qs
‑
17
‑
xyl、qs1861、 qs1862、皂皮树皂苷、saponinum album、qs
‑
18、quil
‑
a、gyp1、丝石竹皂苷a、ag1、ag2、so1542、so1584、so1658、so1674、so1832,或者它们的立体异构体中的任一种和/或它们的任何组合,优选地,所述皂苷是so1861和/或ge1741和/或sa1641和/或qs
‑
21和/或具有皂皮酸苷元核心、在c
‑
3β
‑
oh基团处具有gal
‑
(1
→
2)
‑
[xyl
‑
(1
→
3)]
‑
glca 碳水化合物取代基以及在c
‑
28
‑
oh基团处具有glc
‑
(1
→
3)
‑
xyl
‑
(1
→
4)
‑ꢀ
rha
‑
(1
→
2)
‑
[xyl
‑
(1
→
3)
‑4‑
oac
‑
qui
‑
(1
→
4)]
‑
fuc碳水化合物取代基的皂苷,和/或是3
‑
o
‑
β
‑
d
‑
半乳吡喃糖基
‑
(1
→
2)
‑
[β
‑
d
‑
木吡喃糖基
‑
(1
→
3)]
‑
β
‑ꢀ
d
‑
葡糖醛酸吡喃糖基皂皮酸28
‑
o
‑
β
‑
d
‑
葡吡喃糖基
‑
(1
→
3)
‑
β
‑
d
‑
木吡喃糖基
‑
(1
→
4)
‑
α
‑
l
‑
鼠李吡喃糖基
‑
(1
→
2)
‑
[β
‑
d
‑
木吡喃糖基
‑
(1
→
3)
‑4‑
oac
‑ꢀ
β
‑
d
‑
奎诺吡喃糖基
‑
(1
→
4)]
‑
β
‑
d
‑
岩藻吡喃糖苷,更优选地,所述皂苷是 so1861和/或qs
‑
21。
[0106]
令人惊讶的是,发明人现在证明了来自皂皮树的水溶性皂苷级分 (包括qs
‑
21及其家族成员qs
‑
21a、qs
‑
21a
‑
api、qs
‑
21a
‑
xyl、qs
‑ꢀ
21b、qs
‑
21b
‑
api、qs
‑
21b
‑
xyl、qs
‑7‑
xyl、qs
‑7‑
api、qs
‑
17
‑
api、qs
‑ꢀ
17
‑
xyl、qs1861、qs1862、qs
‑
18和quil
‑
a)当以包含单克隆抗体和至少一种糖苷(如由此类qs
‑
21制剂(如,皂皮树的水溶性级分)涵盖的 qs
‑
21及其家族成员皂苷)的共价缀合物的形式施用至哺乳动物物种 (人类)的肿瘤细胞时,也表现出增强如与单克隆抗体结合的核酸或与单克隆抗体结合的蛋白质毒素的体外生物效应的能力,在本文中效应分子和糖苷(如皂皮树的皂苷级分、qs
‑
21、so1861、sa1641、ge1741) 直接或经由接头或经由多聚支架或寡聚支架、直接或经由至少一个接头共价结合例如蛋白质分子。不希望受任何理论的束缚,在体外源自皂皮树的皂苷存在下,观察到的例如反义bna介导的肿瘤细胞hsp27 表达减少(hsp27基因沉默)的刺激或增强可能(也)与皂苷激活肿瘤细胞中的炎性体有关,例如导致肿瘤细胞焦亡。发明人确定缀合至例如反义bna或石竹素或皂草素的抗体当在生物基细胞测定中与细胞接触时,当在与靶向抗体偶联并且靶向相同(肿瘤)细胞的皂苷存在下,在体外完全发挥任何抗肿瘤细胞活性或改善抗肿瘤细胞活性,然而在皂苷的不存在下,未观察到对肿瘤细胞的此类活性。
[0107]
qs
‑
21,以及还有来自皂皮树的包含qs
‑
21的水溶性皂苷级分早已为人所知,并且先前因其增强免疫的能力而被广泛应用,如作为如亚单位疫苗中的佐剂。例如,qs
‑
21应用于人类患者的两种iii期临床试验中,所述患者疫苗接种了与包含qs
‑
21的佐剂混合的亚单位疫苗 (glaxo
‑
smith
‑
kline,magrit试验,derma研究),其中亚单位是由肿瘤细胞特异性表达并呈递的mage
‑
a3蛋白。qs
‑
21增强的抗肿瘤疫苗接种旨在延长癌症患者(黑色素瘤;非小细胞肺癌)的无病存活期。此外,qs
‑
21已在临床试验中作为佐剂进行测试,用于使用glaxo
‑ꢀ
smith
‑
kline的包含qs
‑
21的佐剂as01和as02,开发抗癌疫苗治疗、用于hiv
‑
1感染的疫苗、开发针对乙型肝炎的疫苗以及用于抗疟疾疫苗开发。先前的研究揭示了,在包含qs
‑
21皂苷的佐剂(as15;gsk)的影响下,针对在癌细胞表面呈递的mage
‑
a3肽引发的免疫应答。令发明人惊讶的是,皂皮树的皂苷级分以及因此可能是qs
‑
21(作为皂皮树的水溶性皂苷级分的一部分)增强了如结合至第二蛋白质分子(如配体egf)的有效载荷(如蛋白质毒素(石竹素))的抗肿瘤细胞活性。
[0108]
一个实施方案是本发明的效应子部分,其中所述皂苷是具有至少 1.500道尔顿的分子质量并且包含在c
‑
23位含有醛基团并且任选地在c
‑
16位含有羟基基团,以及在c
‑
3位具有第一支链碳水化合物侧链的齐墩果烷型三萜的双糖链皂苷,所述第一支链碳水化合物侧链任选地含有葡糖醛酸,其中所述皂苷含有在c
‑
28位具有第二支链碳水化合物侧链的酯基团,所述第二支链碳水化合物链优选包含至少四个碳水化合物单元,并且任选地含有至少一个乙酰基残基如两个乙酰基残基和 /或任选地包含一个或多个脱氧碳水化合物和/或奎诺糖和/或葡萄糖和 /或4
‑
甲氧基肉桂酸和/或任选地包含5
‑
o
‑
[5
‑
o
‑
ara/api
‑
3,5
‑
二羟基
‑6‑ꢀ
甲基
‑
辛酰基]
‑
3,5
‑
二羟基
‑6‑
甲基
‑
辛酸和/或任选地包含经由酯键与碳水化合物结合的5
‑
o
‑
[5
‑
o
‑
rha
‑
(1
→
2)
‑
ara/api
‑
3,5
‑
二羟基
‑6‑
甲基
‑
辛酰基]
‑
3,5
‑
二羟基
‑6‑
甲基
‑
辛酸,或者其中至少一个皂苷是qs
‑
21或者以下中的任何一种或多种:qs
‑
21a、qs
‑
21a
‑
api、qs
‑
21a
‑
xyl、qs
‑
21b、 qs
‑
21b
‑
api、qs
‑
21b
‑
xyl、qs
‑7‑
xyl、qs
‑7‑
api、qs
‑
17
‑
api、qs
‑
17
‑
xyl、 qs
‑
18、qs1861、质子化的qs1861(qs1862)、quil
‑
a。
[0109]
发明人显示,与对照相比以及与仅aoc(不存在具有偶联皂苷的抗体)相比,提供有
共价偶联的反义bna(如bna(hsp27))并且连同具有偶联的皂苷(如so1861、qs
‑
21)的抗体一起与肿瘤细胞接触的肿瘤细胞靶向单克隆抗体(bna和皂苷两者经由可裂解键偶联至相应抗体 (如西妥昔单抗)能够在肿瘤中在体内沉默hsp27。adc或抗体
‑
寡核苷酸缀合物(aoc)(如抗体
‑
bna缀合物)与具有连接的皂苷的抗体的共施用因此赋予adc或aoc抗肿瘤细胞活性,这在相同剂量下的仅adc 或仅aoc未观察到。值得注意的是,与对照组(仅施用媒介物)相比, aoc和具有共价偶联的皂苷的单克隆抗体在施用至分别在不同小鼠组中的荷瘤小鼠时增加了肿瘤细胞中的hsp27表达。当与对照相比时,仅包含效应子部分的aoc和具有共价偶联的皂苷的抗体的共施用表现出降低的hsp27表达。反义bna(hsp27)是根据zhang等人(2011) 的具有寡聚核酸序列5
’‑
ggcacagccagtggcg
‑3’
的bna[y zhang,z qu, s kim,v shi,b liao1,p kraft,r bandaru,y wu,lm greenberger and idhorak,down
‑
modulation of cancer targets using locked nucleicacid(lna)
‑
based antisense oligonucleotides without transfection,genetherapy(2011)18,326
‑
333]。值得注意的是,据发明人所知,bna被设计作为游离核酸应用。发明人现在是第一个证明反义bna可以通过 (不
‑
)可裂解接头与配体或抗体以一定方式共价偶联,使得在体外保留了基因沉默活性并且更重要的是在体内保留在荷瘤动物的肿瘤细胞中。这种提供基于bna的aoc的方法开辟了向有需要的人类(癌症)患者施用靶向bna的新方法。
[0110]
发明人在本文公开了,诸如经由三官能接头(如方案ii的三官能接头)或经由包含共价结合的皂苷的支架的寡聚结构或多聚结构将皂苷 (如皂皮树的水溶性级分中的皂苷、qs
‑
21、sa1641、so1861、表a1、方案i)共价偶联至例如反义寡核苷酸,如bna或者例如蛋白质分子,导致在本发明的效应子部分中共价偶联的皂苷的影响下由本发明的效应子部分所包含的效应子部分如毒素所发挥的细胞毒性得到改善。
[0111]
根据本发明,通常皂苷是表a1,方案i中列出的皂苷。已经证明皂苷的活性是有益的,如考虑当包含偶联的皂苷的本发明的效应子部分进入细胞并累积在胞质内时,当皂苷共价偶联至涉及腙键和/或酰肼键和/或二硫键的效应子部分(例如,bna)所包含的有效载荷时,细胞内的内体逃逸增强活性。此类键类型在哺乳动物细胞(如人类细胞)的 (晚期)内体和溶酶体内的酸性条件下和/或在还原条件下很容易裂解。可替代地,发明人还证明皂苷经由在细胞(如(晚期)内体、溶酶体、胞质)内的生理条件下不容易裂解的键共价偶联至本发明的效应子部分所包含的有效载荷还有益于皂苷对例如效应子部分如核酸(如bna沉默hsp27)和蛋白质毒素如皂草素的生物效应的增强活性。在包括权利要求书在内的整个申请中,术语
‘
可裂解接头’、
‘
可裂解键’等,也被称为
‘
不稳定接头’(
‘
l’)和
‘
不稳定键’,例如在(晚期)内体和/或溶酶体中此类键或接头的裂解的上下文中,当提及本发明的缀合物,如任选包含含有通过接头和/或经由支架经由腙键或二硫键偶联至有效载荷的皂苷的支架的效应子部分,如bna
‑
so1861,或者反义寡核苷酸
‑
皂苷缀合物(所述皂苷是表a1,方案i中的任何皂苷)。例如,发明人显示了在小鼠中的人类肿瘤内的体内hsp27基因沉默。用由单克隆抗体组成的抗体与经由根据本发明的不稳定接头(腙键)结合至其的皂苷处理荷瘤小鼠,然而包含用于沉默肿瘤细胞中的hsp27基因的结合的反义 bna的相同抗体的不同部分经由二硫键共价偶联至单克隆抗体(与第一单克隆抗体相同类型)。也就是说,不希望受任何理论的束缚,一旦本发明的治疗性组合通过例如内吞作用被内化,腙键和二硫键在靶向肿瘤细胞的(晚期)内体和/或溶酶体中被裂解,所述靶向肿瘤细胞在细胞表面的靶向细胞表面分子
(在本文是egfr)上表达表位。当考虑到 bna从内体和/或溶酶体进入胞质时,键的裂解可能有助于皂苷的内体逃逸增强活性,尽管此类裂解对于观察本发明的西妥昔单抗
‑ꢀ
so1861缀合物和西妥昔单抗
‑
bna缀合物的组合的基因沉默效果不是必需的。
[0112]
技术人员将理解三官能接头是适合于共价偶联一个、两个或三个皂苷部分的本发明的支架。对于三官能接头,一个或两个皂苷部分的共价偶联是优选的。第二和/或第三结合位点例如适合于共价偶联有效载荷,使得提供本发明的效应子部分。此外,三官能接头的第二或第三结合位点适合于免疫球蛋白如单克隆抗体,优选肿瘤细胞特异性分子,更优选在肿瘤细胞表面特异性(过
‑
)表达的肿瘤细胞受体的共价偶联。类似地,免疫球蛋白或涵盖免疫球蛋白结合特异性的其任何片段和/或结构域,适合于结合在自身免疫细胞的表面表达的细胞表面分子如受体。然后,三官能接头包含共价偶联的皂苷和共价偶联的有效载荷,由此提供本发明的效应子部分,以及另外,共价偶联的例如抗体,用于将效应子部分靶向所选细胞,如表达偶联抗体的肿瘤细胞特异性结合位点的肿瘤细胞,例如特异性肿瘤细胞受体。因此,在一个实施方案中,本发明的效应子部分包含三官能接头,所述接头包含以下或由以下组成:共价结合的皂苷和效应子部分,例如qs
‑
21、so1861和例如反义bna,蛋白质毒素以及用于(特异性)结合肿瘤细胞、自身免疫细胞、患病细胞、异常细胞、非健康细胞、b细胞疾病的共价结合的抗体。
[0113]
一个实施方案是本发明的效应子部分,其中所述至少一个皂苷是属于在c
‑
23位具有醛官能团的12,13
‑
脱氢齐墩果烷类型的双糖链三萜皂苷,其中所述至少一个皂苷经由所述皂苷中的醛官能团,优选在c
‑ꢀ
23位的所述醛官能团,优选经由至少一个接头,更优选经由至少一个可裂解接头共价偶联至存在时的所述效应子部分的氨基酸残基,其中所述氨基酸残基优选选自半胱氨酸和赖氨酸。
[0114]
一个实施方案是本发明的效应子部分,其中所述至少一个皂苷是属于在c
‑
23位具有醛官能团的12,13
‑
脱氢齐墩果烷类型并且在所述皂苷的c
‑
3β
‑
oh基团处的碳水化合物取代基中包含葡糖醛酸官能团的双糖链三萜皂苷,其中所述至少一个皂苷经由所述皂苷的c
‑
3β
‑
oh基团处碳水化合物取代基中的葡糖醛酸官能团,优选经由至少一个接头共价偶联至存在时的所述效应子部分的氨基酸残基,其中所述氨基酸残基优选选自半胱氨酸和赖氨酸。
[0115]
作为一个实例,根据本发明,将bna寡核苷酸,即靶向癌症靶标的 mrna转录物(在癌细胞中上调)的反义bna寡核苷酸热休克蛋白 27(hsp27bna)缀合至so1861
‑
emch(hsp27bna
‑
l
‑
so1861)或树枝化基元(
‑
l
‑
so1861)4(hsp27bna
‑
树枝化基元(
‑
l
‑
so1861)4),并共施用至 a431癌细胞系。如所述,令发明人惊讶的是,与对照相比,诸如用于沉默hsp27基因表达的反义bna和皂苷(如so1861)共价连接在一起的缀合物在快速生长/分裂的肿瘤细胞(如小鼠a431癌细胞系细胞)中有效地沉默hsp27表达。当与不存在缀合的皂苷和不存在游离皂苷的游离bna 相比时,将本发明的任何皂苷与寡核苷酸,如反义寡核苷酸,例如bna,如反义bna共价缀合导致在相同剂量的bna下增加的基因沉默效力。与在皂苷的不存在下暴露于相同浓度的游离未缀合的bna的细胞中的 hsp27表达相比,bna
‑
皂苷缀合物导致细胞中的hsp27表达降低约三倍。还参见实施例的图1。因此,使肿瘤细胞与反义寡核苷酸如反义bna 接触导致基因沉默,当皂苷如so1861与寡核苷酸共价连接时,基因沉默得到改善或增强。因此,关于寡核苷酸的治疗窗扩大,因为当应用根据本发明的bna和皂苷的缀合物
时,现在可以用低三倍剂量的反义bna在肿瘤细胞中获得相同的基因沉默效果。发明人确定,当考虑基因沉默时, bna与一个皂苷的缀合物比施用至细胞的游离bna可获得的基因沉默活性更有效。此外,发明人确定,当考虑基因沉默时,并且与施用至细胞的游离bna可获得的基因沉默活性相比,bna与四个皂苷的缀合物是日益有效的。也就是说,根据本发明,用bna(
‑
皂苷)4改善的基因沉默甚至高于用bna
‑
皂苷可获得的改善的基因沉默。接头是可裂解接头。
[0116]
一个实施方案是本发明的效应子部分,其中所述至少一个接头包含至少一个不可裂解接头和/或至少一个可裂解接头,其中任选地所述可裂解接头在酸性条件、还原条件、酶促条件或光诱导条件下进行裂解,并且优选地,所述可裂解接头包含选自以下的可裂解键:在酸性条件下进行裂解的腙键和酰肼键,和/或易于蛋白质水解的键,例如易于由组织蛋白酶b进行蛋白质水解的键,和/或易于在还原条件下裂解的键,如二硫键。
[0117]
一个实施方案是本发明的效应子部分,其中所述至少一个接头包含至少一个可裂解接头,其在如存在于哺乳动物细胞,优选人类细胞的内体和/或溶酶体的酸性条件下,优选在ph 4.0
‑
6.5下并且更优选在ph ≤5.5下在体内进行裂解。
[0118]
一个实施方案是本发明的效应子部分,其中所述至少一个皂苷共价结合赖氨酸侧链,形成酰胺键,和/或共价结合半胱氨酸侧链,形成硫醚连键或二硫键,其中所述赖氨酸和/或半胱氨酸由所述效应子部分所包含,并且其中所述皂苷直接结合所述效应子部分,或者经由至少一个接头结合所述效应子部分。
[0119]
一个实施方案是本发明的效应子部分,其中所述至少一个皂苷经由至少一个接头共价结合所述效应子部分,其中所述接头是或包含支架,所述支架包含多聚结构或寡聚结构以及用于将所述支架与所述效应子部分的共价偶联的化学基团。
[0120]
一个实施方案是本发明的效应子部分,其中所述至少一个皂苷经由可裂解键共价结合所述支架的多聚结构或寡聚结构。
[0121]
一个实施方案是本发明的效应子部分,其中所述可裂解键在酸性条件、还原条件、酶促条件和光诱导条件中的任一种下进行裂解,更优选地,所述可裂解键是在酸性条件下进行裂解的腙键或酰肼键和/或是易于蛋白质水解的键,例如由组织蛋白酶b进行蛋白质水解的键和/或是易于在还原条件下裂解的键,如二硫键。
[0122]
一个实施方案是本发明的效应子部分,其中所述可裂解键在如存在于哺乳动物细胞,优选人类细胞的内体和/或溶酶体的酸性条件下,优选在ph 4.0
‑
6.5下并且更优选在ph≤5.5下在体内进行裂解。
[0123]
一个实施方案是本发明的效应子部分,其中所述至少一个皂苷经由亚胺键、腙键、酰肼键、肟键、1,3
‑
二噁戊烷键、二硫键、硫醚键、酰胺键、肽键和/或酯键,优选经由至少一个接头,优选酰胺键、酰肼键、硫醚键和/或腙键共价结合所述支架的多聚结构或寡聚结构。
[0124]
一个实施方案是本发明的效应子部分,其中所述至少一个皂苷共价结合所述支架的多聚结构或寡聚结构,在所述共价键中涉及所述至少一个皂苷的c
‑
23位的醛官能团,当存在时,所述共价键优选为亚胺键或腙键或酰胺键或硫醚键或二硫键,和/或在所述共价键中涉及所述至少一个皂苷的c
‑
3β
‑
oh基团处的碳水化合物取代基中的葡糖醛酸官能团(当存在时),其中优选地,所述共价键是酰胺键或二硫键或硫醚键。
[0125]
一个实施方案是本发明的效应子部分,其中所述至少一个皂苷的c
‑ꢀ
23位的醛官
能团共价偶联至接头n
‑
ε
‑
马来酰亚胺基己酸酰肼,所述接头经由硫醚键共价偶联至所述支架的多聚结构或寡聚结构中的巯基基团,如半胱氨酸的巯基基团。
[0126]
一个实施方案是本发明的效应子部分,其中所述至少一个皂苷的c
‑ꢀ
3β
‑
oh基团处的碳水化合物取代基中的葡糖醛酸官能团共价偶联至接头1
‑
[双(二甲基氨基)亚甲基]
‑
1h
‑
1,2,3
‑
三唑并[4,5
‑
b]吡啶鎓3
‑
氧化物六氟磷酸盐,所述接头经由酰胺键共价偶联至所述支架的多聚结构或寡聚结构中的胺基团,如所述支架的多聚结构或寡聚结构的赖氨酸或 n
‑
末端的胺基团。
[0127]
一个实施方案是本发明的效应子部分,其中所述支架的用于将所述支架与所述效应子部分的共价偶联的所述化学基团是点击化学基团,其优选选自四嗪、叠氮化物、烯烃或炔烃或者这些基团的环状衍生物,更优选地,所述点击化学基团是叠氮化物。
[0128]
一个实施方案是本发明的效应子部分,其中所述支架的多聚结构或寡聚结构包括直链、支链和/或环状多聚物、寡聚物、树状物、树枝化基元、树枝化基元化多聚物、树枝化基元化寡聚物、dna、多肽、聚赖氨酸、聚乙二醇或者这些多聚结构或寡聚结构的组装体,所述组装体优选通过共价交联构建。
[0129]
一个实施方案是本发明的效应子部分,其中所述至少一个皂苷是限定数量的皂苷或限定范围的皂苷,优选1
‑
128个皂苷或者至少2、3、 4、5、6、8、10、16、32、64或128个皂苷,或者其间的任何数量的皂苷,如7、9、12个皂苷。
[0130]
一个实施方案是本发明的效应子部分,其中所述效应子部分包含多于一个的皂苷,优选2、3、4、5、6、8、10、16、32、64或1
‑
100 个皂苷或者其间任何数量的皂苷,如7、9、12个皂苷,所述皂苷直接共价结合至所述效应子部分的氨基酸残基,优选半胱氨酸和/或赖氨酸,和/或权利要求14
‑
23中任一项所述的经由至少一个接头和/或经由至少一个可裂解接头和/或经由至少一个多聚支架或寡聚支架,优选1
‑
8 个此类支架或2
‑
4个此类支架共价结合,其中1
‑
32个皂苷,优选2、 3、4、5、6、8、10、16或32个皂苷共价结合至少一个支架。
[0131]
发明人确定,当考虑(快速生长的)肿瘤细胞中的基因沉默时,向小鼠施用游离寡核苷酸如反义bna不是非常有效的。令人惊讶的是,发明人现在确定,在各种体外基于哺乳动物细胞的生物测定中的有益抗肿瘤活性可以通过用根据本发明的缀合物处理动物来实现,所述缀合物任选地包含根据本发明的支架,如g4
‑
树枝化基元。所述支架例如是具有至少一个经由可裂解或不可裂解连键共价结合的皂苷(例如so1861、qs
‑
21),和/或具有经由不可裂解键或可裂解键沉默bna(hsp27)的共价结合的效应子部分(例如反义寡核苷酸)的三官能接头,或者所述支架是树枝化基元,例如四个部分,如四个皂苷分子能够结合的树枝化基元,或者用于结合例如两个皂苷和两个效应分子的树枝化基元。参考实施例部分,举例说明了根据本发明的接头和支架,当考虑由例如反义bna(hsp27)施加的基因沉默时,因此当考虑肿瘤细胞中的基因沉默时,显示体外抗肿瘤细胞活性。
[0132]
术语“改善或增强效应子部分的效果”意指糖苷分子,优选本发明的皂苷,优选通过启用或改善其靶标接合(target engagement)来增加此效应子部分的功能功效(如,毒素或药物或寡核苷酸如bna的治疗指数;生物技术过程中修饰剂的代谢功效;细胞培养研究实验中基因的转染功效)。优选不包括抗原特异性免疫应答的加速、延长或增强。治疗功效包括但不限于更强的治疗效果,优选具有更低的剂量和/或更少的副作用。“改善效应子部分的效果”也可意指因为缺乏效果而不能使用(和如不被称为是效应子部分)的效应子部分当
与本发明组合使用时变得有效。如由本发明提供的有益的或期望的并且可以归因于效应子部分和第二或第三蛋白质分子的组合的任何其它效果都被认为是“改善的效果”。在一个实施方案中,包含结合的皂苷并由效应子部分包含的支架增强有效载荷/效应子部分的效果,该效果是预期的和/或期望的。
[0133]
许多优选的特征可以被配制用于效应子部分所包含的内体逃逸增强剂,即糖苷或皂苷,优选根据本发明的皂苷:(1)它们优选无毒且不引起免疫应答,(2)它们优选不介导效应子部分胞质摄取至脱靶细胞中, (3)它们在作用位点的存在优选与效应子部分的存在同步,(4)它们优选是可生物降解的或可排泄的,以及(5)它们优选基本上不干扰与内体逃逸增强剂所组合的效应分子的生物活性无关的有机体生物过程,如与激素相互作用。糖苷分子的实例如至少在一定程度上满足上述标准的本发明的皂苷是双糖链三萜,优选双糖链三萜皂苷,如so1861、 sa1641、qs
‑
21、ge1741以及表a1,方案i中的皂苷。
[0134]
为了更详细地解释本发明,描述了物质的细胞摄取过程(尽管发明人不希望受任何理论的束缚)和本发明中使用的术语。通过囊泡出芽将细胞外物质,如本发明的效应子部分摄入到细胞中被称为内吞作用。所述囊泡出芽的特征可以在于:(1)由胞质蛋白网格蛋白介导的受体依赖性配体摄取,(2)胆固醇结合蛋白小窝蛋白介导的脂筏摄取,(3)非特异性液体摄取(胞饮作用),或(4)非特异性颗粒摄取(吞噬作用)。所有类型的内吞作用都会进入以下称为内吞途径的囊泡运输和物质分选的细胞过程。内吞途径很复杂,并且尚未完全了解。不希望受任何理论的束缚,细胞器可以从头形成并沿着内吞途径成熟为下一个细胞器。然而,现在假设内吞途径涉及通过囊泡运输连接的稳定区室。区室是一种复杂的多功能膜细胞器,其专门用于细胞的一组特定基本功能。囊泡被认为是短暂的细胞器,组成更简单,并被定义为膜封闭的容器,其通过从预先存在的区室出芽而从头形成。与区室相比,囊泡可以经历成熟,这是一系列生理上不可逆的生化变化。早期内体和晚期内体代表内吞途径中的稳定区室,而初级内吞囊泡、吞噬体、多泡体(也称为内体载体囊泡)、分泌颗粒和甚至溶酶体代表囊泡。内吞囊泡出现在质膜处,最突出的是来自网格蛋白包被的小窝,首先与早期内体融合,早期内体是大约ph 6.5的主要分选区室。大部分内化的货物和膜通过再循环囊泡(再循环途径)循环回到质膜。应降解的组分经由多泡体运输到酸性晚期内体(ph低于6)。溶酶体是可以储存成熟的溶酶体酶并在需要时将它们递送至晚期内体区室的囊泡。所得细胞器称为杂合细胞器(hybrid organelle)或内溶酶体。溶酶体在称为溶酶体再生(lysosomereformation)的过程中从杂合细胞器中出芽。晚期内体、溶酶体和杂合细胞器是极其动态的细胞器,并且通常很难区分它们。内吞分子的降解发生在内溶酶体或溶酶体内。内体逃逸是物质从内吞途径,优选从网格蛋白介导的内吞作用,或再循环途径从任何种类的区室或囊泡的内腔主动或被动释放到溶质中。因此,内体逃逸包括但不限于从内体、内溶酶体或溶酶体(包括它们的中间和杂合细胞器)中释放。
[0135]
除非另有特别说明并且特别是在涉及糖苷分子(如本发明的皂苷) 的内体逃逸机制时,每当本文中使用措辞“内体”或“内体逃逸”时,其还包括内溶酶体和溶酶体,以及分别从内溶酶体和溶酶体中逃逸。进入胞质后,所述物质可能会移动到其它细胞单元如细胞核。
[0136]
在正式用语中,糖苷是其中经由糖苷键将糖基团通过其异头碳结合至另一个基团的任何分子。在本发明的上下文中,糖苷分子如皂苷是这样的分子,其能够进一步增强效应子部分的效果,不希望受任何理论的束缚,特别是通过促进效应子部分的内体逃逸。不希望
受任何理论的束缚,糖苷分子(皂苷,如表a1和方案i中列出的那些以及各种实施方案中例示的那些)与内吞和再循环途径的区室和囊泡的膜相互作用并使它们对于所述效应子部分渗漏,导致增加的内体逃逸。术语“支架能够增加效应子部分的内体逃逸”意指当两个分子在内体(如晚期内体)中时,任选地和优选地在至少一种糖苷如皂苷从效应子部分 (如从由所述效应分子所包含的接头或多聚结构或寡聚结构)中释放,如通过裂解至少一种糖苷(皂苷)与有效载荷(例如经由支架的多聚结构或寡聚结构和/或经由接头)之间的可裂解键之后,与支架的多聚结构或寡聚结构偶联的至少一个皂苷(糖苷分子)能够增强本发明的效应子部分所包含的有效载荷的内体逃逸。即使在至少一种糖苷如根据本发明的皂苷与本发明的效应子部分所包含的有效载荷之间的键(任选地经由接头或支架)可以是“稳定键”,这并不意味着此类键不能在内体中被例如酶裂解。例如,可以从剩余的接头片段或寡聚结构或多聚结构中裂解下来糖苷或皂苷,任选地连同接头或者支架的一部分寡聚结构或多聚结构。例如,可以是蛋白酶切割(蛋白质)接头或蛋白质聚合结构,如白蛋白,从而释放至少一种糖苷、皂苷。然而,优选的是糖苷分子 (优选皂苷)以活性形式释放,优选以其在(被制备为)任选地经由接头和 /或寡聚支架或多聚支架偶联至本发明的效应子部分所包含的有效载荷之前的原始形式释放;因此,糖苷(皂苷)在此类裂解后具有其天然结构或糖苷(皂苷)在此类裂解后具有结合至其的(部分)化学基团或接头,而糖苷生物活性(皂苷生物活性),如针对存在于相同内体或溶酶体中的有效载荷的内体/溶酶体逃逸增强活性在糖苷(皂苷)与例如有效载荷或载体分子(任选地包含本发明的接头和/或支架的本发明的效应分子所包含的)之间的键的所述裂解后得以维持或恢复。关于本发明,就如皂苷与有效载荷的氨基酸残基、接头、(支架的)多聚结构或寡聚结构、配体、(单克隆)免疫球蛋白或其结合结构域或结合片段和/或另外的效应子(效应子部分、效应分子)之间的键而言的术语“稳定的”意指该键不容易断裂或者至少并未被设计成容易被如ph差、盐浓度或紫外线、还原条件断裂。关于本发明,就如皂苷与本发明的效应子部分所包含的(蛋白质)有效载荷、接头、氨基酸残基、支架的多聚结构或寡聚结构、配体、抗体和/或另外的效应子之间的键而言的术语“可裂解的”意指该键被设计成容易被如ph差、盐浓度、在还原条件下等断裂。技术人员非常了解此类可裂解的键以及如何制备它们。
[0137]
在本发明之前,在市场上引入adc和aoc的主要障碍之一是小的治疗窗:治疗有效剂量的adc或aoc伴随着(不可接受的)副作用,阻碍了用adc治疗患者的发展和暗示。通过应用本发明的效应子部分作为用于制造adc
‑
皂苷缀合物或aoc
‑
皂苷缀合物的半成品,现在可以将一个或多个糖苷分子(皂苷)连同携带有效载荷的adc或连同与根据本发明的寡核苷酸如bna缀合的(单克隆)抗体一起引导至(靶)细胞,从而抗体提供有本发明的共价结合的效应子部分,其包含本发明的共价偶联的皂苷。特别地,先前不可能同时将本发明的效应子部分所包含的有效载荷的效应子部分和每有效载体(预定的、可控的)特定数量或范围的糖苷分子(皂苷)如经由细胞的内吞途径特异性引导至细胞胞质。现在,本发明的效应子部分可以共价偶联至单克隆抗体,用于结合异常细胞特异性表位,如特异性暴露于所述肿瘤细胞表面上的肿瘤细胞受体,使得本发明的效应子部分作为半成品应用于提供根据本发明的adc
‑
皂苷缀合物或aoc
‑
皂苷缀合物。
[0138]
本发明提供的解决方案包括至少一个皂苷共价结合有效载荷,从而提供本发明的效应子部分。本发明提供的另一种解决方案包括使用寡聚支架或多聚支架(首先)使糖苷分
子(皂苷)聚合,以及为本发明的效应子部分所包含的有效载荷提供一簇共价结合的皂苷,使得例如在内吞作用之后一个或多个皂苷能够在细胞内位点(在那需要皂苷的作用模式)处重新单体化。“聚合”在本上下文中意指皂苷分子与有效载荷分子经由接头或者直接或者经由多聚结构或寡聚结构以形成支架的可逆和/或不可逆的多重缀合,或者(修饰的)皂苷的可逆和/或不可逆的多重缀合从而形成多聚结构或寡聚结构以形成支架。“再单体化”在本上下文中意指例如在内吞作用之后皂苷从有效载荷分子(例如,蛋白质毒素、反义bna)、从将皂苷连接至本发明的效应子部分中的有效载荷分子的接头或者从支架裂解,并恢复未结合的皂苷的(天然)化学状态,所述未结合的皂苷可以包含或可以不包含另外的化学基团,如用于将皂苷连接至接头、有效载荷的氨基酸残基或支架的化学基团,和/或结合皂苷的化学基团(如醛基团或羧酸基团)的(化学)接头。由于皂苷的复杂化学性质,例如皂苷在支架或其它连接接头处的
‘
聚合’以及它们在期望位置处(如胞内,在内吞作用后)的
‘
再单体化’是一项具有挑战性的任务。特别地,用于提供接头和支架(包含用于共价结合有效载荷的共价连接的糖苷,如三萜皂苷(糖苷的聚合))的化学反应通常发生在无水有机溶剂中,但皂苷和例如应用为用于携带结合的皂苷的支架的生物相容性聚合物是水溶性分子。
[0139]
不希望受任何理论的束缚,优选使至少一个皂苷和效应子部分,优选毒素或寡核苷酸,在靶细胞,例如肿瘤细胞或自身免疫细胞的内吞途径的区室或囊泡中的同时存在。使用例如bna和游离皂苷,使分子在晚期内体中的存在同步,以便在体内获得不能有益获得的协同作用。在一个方面,本发明优选解决至少以下关于将本发明的缀合物所包含的效应子部分与本发明的缀合物所包含的皂苷组合的问题:不希望受任何理论的束缚,例如,可用于(共价),特别是单一和可裂解的可保留偶联的皂苷内的唯一合理的化学基团是内体逃逸活性所需的。已知的限制最可能是皂苷在除了皂苷在疫苗接种方案中的应用之外的临床研究中未曾与药学活性物质组合使用的原因,其中暗示了使用免疫增强佐剂物质,尽管例如列于表a1和方案i中的皂苷的显著的内体逃逸增强剂效应已知10多年了。例如,提供具有共价缀合的支架的本发明的缀合物至少部分地解决了这些困难。令人惊讶的是,先前在涉及皂苷作为佐剂组分的疫苗接种环境中应用其免疫增强活性的皂苷,现在也适用于(共价) 偶联至本发明的adc或aoc,用于体外和体内抗肿瘤活性。
[0140]
本发明的一个方面涉及包含根据本发明的效应子部分的抗体
‑
药物缀合物,或者包含本发明的效应子部分的配体
‑
药物缀合物,所述效应子部分包含共价偶联的皂苷。本发明的效应子部分是缀合物,其包含直接或经由至少一个接头,任选地包含可裂解接头,以及任选地经由寡聚支架或多聚支架彼此共价偶联的至少一个皂苷和至少一个效应分子,所述至少一个皂苷和/或所述至少一个效应子部分共价结合至所述寡聚支架或多聚支架上。
[0141]
一个实施方案是本发明的抗体
‑
药物缀合物或配体
‑
药物缀合物,其中所述抗体能够结合以下中的任一种:cd71、ca125、epcam(17
‑
1a)、 cd52、cea、cd44v6、fap、egf
‑
ir、整合素、多配体蛋白聚糖
‑
1、血管整合素α
‑
vβ
‑
3、her2、egfr、cd20、cd22、叶酸受体1、cd146、 cd56、cd19、cd138、cd27l受体、psma、canag、整合素
‑
αv、 ca6、cd33、间皮素、cripto、cd3、cd30、cd239、cd70、cd123、 cd352、dll3、cd25、肝配蛋白a4、muc1、trop2、ceacam5、 ceacam6、her3、cd74、ptk7、notch3、fgf2、c4.4a、flt3、 cd38、fgfr3、cd7、pd
‑
l1、ctla4、cd52、pdgfra、vegfr1、 vegfr2,优选cd71、her2、egfr,和/或其中所述抗体
‑
药物缀合物的抗体是或包含以下中的任一种:西妥昔单抗、达雷木单抗、吉妥珠单抗、曲妥珠单抗、帕尼单
抗、本妥昔单抗、英妥珠单抗、莫西莫单抗、泊洛妥珠单抗、奥滨尤妥珠单抗、igg型okt
‑
9抗cd71单克隆抗体、帕妥珠单抗、利妥昔单抗、奥法木单抗、赫塞汀、阿仑单抗、匹那妥珠单抗、okt
‑
10、抗cd38单克隆抗体、表a2或表a3或表 a4的抗体,优选西妥昔单抗或曲妥珠单抗或okt
‑
9或者其至少一个肿瘤细胞特异性受体结合片段和/或其至少一个肿瘤细胞特异性受体结合结构域,和/或其中抗体
‑
药物缀合物包含以下中的任一种:吉妥珠单抗奥佐米星、本妥昔单抗维多汀、曲妥珠单抗美坦新、英妥珠单抗奥佐米星、moxetumomab pasudotox和泊洛妥珠单抗维多汀以及表a2 和表a3的抗体
‑
药物缀合物,和/或其中所述配体
‑
药物缀合物包含用于结合细胞表面分子,如egf或细胞因子的至少一个非蛋白质配体和 /或至少一个蛋白质配体或者由其组成。
[0142]
本发明的一个方面涉及治疗性组合,其包含:(a)含有至少一个皂苷的本发明的效应子部分和任选的药学上可接受的赋形剂;以及(b)抗体
‑
药物缀合物或配体
‑
药物缀合物和任选的药学上可接受的赋形剂。
[0143]
一个实施方案是本发明的治疗性组合,其中所述抗体
‑
药物缀合物能够结合以下中的任一种:肿瘤细胞受体cd71、ca125、epcam(17
‑
1a)、 cd52、cea、cd44v6、fap、egf
‑
ir、整合素、多配体蛋白聚糖
‑
1、血管整合素α
‑
vβ
‑
3、her2、egfr、cd20、cd22、叶酸受体1、cd146、 cd56、cd19、cd138、cd27l受体、psma、canag、整合素
‑
αv、 ca6、cd33、间皮素、cripto、cd3、cd30、cd239、cd70、cd123、 cd352、dll3、cd25、肝配蛋白a4、muc1、trop2、ceacam5、ceacam6、her3、cd74、ptk7、notch3、fgf2、c4.4a、flt3、 cd38、fgfr3、cd7、pd
‑
l1、ctla4、cd52、pdgfra、vegfr1、 vegfr2,优选cd71、her2、egfr,和/或其中所述抗体
‑
药物缀合物的抗体是或包含以下中的任一种:西妥昔单抗、达雷木单抗、吉妥珠单抗、曲妥珠单抗、帕尼单抗、本妥昔单抗、英妥珠单抗、莫西莫单抗、泊洛妥珠单抗、奥滨尤妥珠单抗、igg型okt
‑
9抗cd71单克隆抗体、帕妥珠单抗、利妥昔单抗、奥法木单抗、赫塞汀、阿仑单抗、匹那妥珠单抗、okt
‑
10、抗cd38单克隆抗体、表a2或表a3或表 a4的抗体,优选西妥昔单抗或曲妥珠单抗或okt
‑
9或者其至少一个肿瘤细胞特异性受体结合片段和/或其至少一个肿瘤细胞特异性受体结合结构域,和/或其中抗体
‑
药物缀合物包含以下中的任一种:吉妥珠单抗奥佐米星、本妥昔单抗维多汀、曲妥珠单抗美坦新、英妥珠单抗奥佐米星、moxetumomab pasudotox和泊洛妥珠单抗维多汀以及表a2 和表a3的抗体
‑
药物缀合物,和/或其中所述配体
‑
药物缀合物包含用于结合细胞表面分子,如egf或细胞因子的至少一个非蛋白质配体和 /或至少一个蛋白质配体或者由其组成。
[0144]
可用于本发明中的效应子部分优选依赖于晚期内体逃逸以发挥其作用。一些效应子,诸如例如假单胞菌外毒素,在“晚期内体阶段”之前被改道到(rerouted)其它细胞器,因此通常不会受益于与根据本发明的第二蛋白质分子的偶联。然而,此类毒素可以适合与本发明一起使用,如通过缺失负责改道的信号肽。特别地,具有高度毒性并且仅需要一个分子即可逃逸出内体以杀伤细胞的毒素可能会被修饰为效力较低。如果至少2个、更优选至少5个、更优选至少10个、更优选至少 20个、更优选至少50个、最优选至少100个毒素分子逃逸出内体,则优选使用杀伤细胞的毒素。进一步优选的是,包含连接的效应子部分
‑
皂苷的本发明的缀合物包含共价缀合的官能化支架,即包含用于在靶细胞(如肿瘤细胞或自身免疫细胞)处递送包含结合的效应子部分的支架的共价结合的效应子部分的支架以及共价结合的皂苷。此外,为了降低脱靶毒性,细胞膜不可渗透性小分子毒素是优于细胞膜可渗透性毒
素的优选效应分子。
[0145]
如在本发明中使用的术语“配体”具有其普通含义,并且优选地意指能够结合靶细胞细胞表面上的另一分子或结构的分子或结构,其中细胞表面上的所述分子或结构可被内吞并且优选在脱靶细胞上不存在或不那么突出。优选地,细胞表面上的所述分子或结构被组成性内吞。更优选地,本发明中的配体在与所述分子或结构结合后诱导靶细胞的细胞表面上所述分子或结构的内吞作用。这是例如存在于多种癌细胞表面上的表皮生长因子受体(egfr)的情况。组成型内吞的靶细胞的细胞表面上的分子或结构的实例是例如密封蛋白
‑
1或主要组织相容性复合体ii类糖蛋白。配体可以是如抗体、生长因子或细胞因子。将本发明的效应子部分,例如,与皂苷偶联的毒素与配体组合到载体分子中是一种产生靶向毒素的可能性。只在靶细胞中有毒的毒素(因为它只干扰靶细胞中发生的过程),也可以被看作是靶向毒素(因为在脱靶细胞中它不能发挥其毒性作用,如凋亡蛋白)。优选地,靶向毒素是与配体或如单克隆抗体组合的毒素,以便在靶细胞中有活性而在脱靶细胞没有活性(因为它只与靶细胞结合并被靶细胞内吞)。在例如包含含有配体和本发明的效应子部分的载体分子的官能化支架中,配体或单克隆抗体将具有皂苷结合至其的效应子部分和支架引导至靶细胞。内化后,至少一种糖苷,优选本发明的效应子部分所包含的皂苷,介导效应子部分的内体逃逸。皂苷通常是表a1和方案i中列出的皂苷,并且优选地,所述皂苷是so1861和/或qs
‑
21,和/或sa1641和/或ge1741。
[0146]
本发明的有效载荷、效应分子或效应子部分在本发明的上下文中是通过与细胞内效应分子靶标相互作用影响细胞代谢的任何物质,其中该效应分子靶标是除了内吞和循环途径的区室和囊泡的腔之外但包括这些区室和囊泡的膜的细胞内的任何分子或结构。因此,细胞内的所述结构包括细胞核、线粒体、叶绿体、内质网、高尔基体、其它转运囊泡、质膜的内部和胞质。在本发明的上下文中,有效载荷或效应子部分的胞质递送优选意指有效载荷或效应子部分能够逃逸出内体 (和/或溶酶体),其如先前所定义的还包括逃逸出内体和溶酶体,并且优选地能够到达如本文所述的有效载荷或效应子部分靶标。本发明还涵盖了一种新型分子(被称为支架),当效应子部分包含有效载荷和皂苷时,其用于以预定的比率同时将有效载荷和至少一种糖苷分子(如本发明的皂苷)或本发明的效应子部分带入内体。在本发明的上下文中,支架的多聚结构或寡聚结构是结构有序的形成,如多聚物、寡聚物、树状物、树枝化基元化多聚物或树枝化基元化寡聚物,或者其是组装的聚合结构,如水凝胶、微凝胶、纳米凝胶、稳定的聚合物胶束或脂质体,但不包括由单体的非共价组装体(如胆固醇/磷脂混合物)组成的结构。术语“多聚物、寡聚物、树状物、树枝化基元化多聚物或树枝化基元化寡聚物”具有其普通含义。特别地,多聚物是分子结构主要或完全由大量相同或相似的键合在一起的单元构成的物质,寡聚物是分子由相对较少的重复单元组成的聚合物。对于多聚物和低聚物的上述定义中分别使用的“许多”和“几个”的一个具体截止值没有达成共识。然而,由于支架可包含多聚结构或寡聚结构或两者,因此键合在一起的相似单元的完整数量范围适合于此类结构,即2个单体单元至100个单体单元、1000个单体单元和更多。例如,包含5个或更少个的结构可以被称为寡聚结构,然而包含50个单体单元的结构可以被称为多聚结构。10个单体单元的结构可以被称为寡聚物或多聚物。如本文所定义的支架还包含至少一种糖苷分子,如本发明的皂苷。支架优选包含多聚结构或寡聚结构,如聚(胺)或寡聚(胺),如聚乙烯亚胺和聚(酰氨基胺),以及生物相容结构,如聚乙二醇,聚(酯)或寡聚
(酯),如聚(丙交酯)、聚(内酰胺)、聚丙交酯
‑
共
‑
乙交酯共聚物和聚(糊精),聚糖或寡糖,如环糊精或聚葡萄糖,和聚氨基酸或寡氨基酸,如聚赖氨酸或肽或蛋白质,或者dna寡聚物或多聚物。如本文所定义的组装聚合结构包括至少一个支架和任选的其它单独的多聚结构或寡聚结构。所述组装体的其它单独的多聚结构或寡聚结构可以是(a)支架(因此包含至少一种糖苷分子,如本发明的皂苷),(b)官能化支架(因此包含至少一种糖苷分子,如皂苷以及配体、抗体等,(c)不含糖苷分子(如本发明的皂苷(参见例如表a1)),不含配体、抗体等的多聚结构或寡聚结构。官能化组装的聚合结构是含有(a)至少一个官能化支架或(b)至少一个支架和至少一个聚合结构的组装聚合结构,其包含至少一个配体、抗体等。在组装的聚合结构中的不包含以上提及的分子(即,无糖苷如皂苷,无第一蛋白质分子如配体、抗体)中的任一种的多聚结构或寡聚结构特别作为组装结构的结构组分添加,所述组装结构有助于构建或稳定组装结构(“胶状”)。不希望受任何理论的束缚,酸性环境似乎是糖苷(皂苷)与效应子部分之间的协同作用的先决条件。
[0147]
本发明中的药学活性物质是用于在有机体内,优选脊椎动物,更优选人类如癌症患者或自身免疫患者中实现有益结果的效应子部分。益处包括疾病和/或症状的诊断、预后、治疗、治愈和/或预防。药学活性物质还可导致不期望的有害副作用。在这种情况下,必须权衡利弊,以决定药学活性物质是否适用于特定情况。如果细胞内的药学活性物质的效应主要是对整个有机体有益,则该细胞被称为靶细胞。如果细胞内的效应主要对整个有机体有害,则该细胞被称为脱靶细胞。在人工系统如细胞培养和生物反应器中,靶细胞和脱靶细胞取决于目的并且由用户定义。
[0148]
作为多肽的效应子部分可以是如恢复失去的功能,诸如例如酶替代、基因调控功能的多肽,或毒素。
[0149]
优选地,当内吞时,效应子部分与皂苷和/或例如抗体分离,所述效应子部分的作用通过与其结合的皂苷而增强。这可以通过例如在酸性条件、还原条件、酶促条件或光诱导条件下断裂可裂解键来实现。
[0150]
本发明的一个方面涉及药物组合物,其包含本发明的效应子部分或本发明的抗体
‑
药物缀合物或本发明的配体
‑
药物缀合物(包含与效应分子共价连接的至少一个皂苷)和任选的药学上可接受的赋形剂。
[0151]
本发明的一个方面涉及本发明的效应子部分或本发明的抗体
‑
药物缀合物或本发明的治疗性组合或本发明的配体
‑
药物缀合物或本发明的药物组合物,其用作药物。
[0152]
本发明的一个方面涉及本发明的效应子部分或本发明的抗体
‑
药物缀合物或本发明的治疗性组合或本发明的配体
‑
药物缀合物或本发明的药物组合物,其用于治疗或预防癌症或自身免疫疾病。
[0153]
发明人在本文公开了,诸如经由三官能接头(如方案ii的三官能接头)或经由包含共价结合的皂苷的支架的寡聚结构或多聚结构,如树枝化基元,例如g4
‑
树枝化基元,将皂苷(如皂皮树的水溶性级分中的皂苷、qs
‑
21、sa1641、so1861、表a1、方案i)共价偶联至效应分子,如寡核苷酸,例如反义bna,导致在缀合物中共价偶联的皂苷,即本发明的效应子部分的影响下缀合物所包含的效应子部分,如毒素,优选地反义寡核苷酸,如反义bna发挥的改善的细胞毒性。特别地,本发明的效应子部分是与树枝化基元共价缀合的反义寡核苷酸,所述树枝化基元具有与其共价结合的多个皂苷,如2、4、8、16个皂苷,优选4个皂苷。
[0154]
一个实施方案是本发明的缀合物,其包含效应子部分和含有方案 i中的结构a的皂苷的一个或几个或所有指定结构特征的皂苷,结构 a的皂苷被称为当内体逃逸增强活性针对存在于与本发明的缀合物接触的细胞的内体中的效应子部分时具有
‘
理想’结构的皂苷,和/或选自方案i的另外皂苷中的任何一种或多种的皂苷:
[0155]
方案i
[0156][0157]
方案i(续)
[0158][0159]
方案i(续)
[0160][0161]
方案i(续)
[0162][0163]
方案i(续)
[0164][0165]
根据本发明,具有用于增强本发明的缀合物所包含的效应分子的内体逃逸的目的的
‘
理想’结构的结合至本发明的缀合物所包含的效应子部分的糖苷(如根据本发明的皂苷)是具有至少1.500道尔顿的分子质量并且包含在c
‑
23位含有醛基团并且任选地在c
‑
16位含有羟基基团以及在c
‑
3位具有第一支链碳水化合物侧链的齐墩果烷型三萜的根据方案i的结构a的双糖链皂苷,所述第一支链碳水化合物侧链任选地含有葡糖醛酸,其中皂苷含有在c
‑
28位具有第二支链碳水化合物侧链的酯基团,所述第二支链碳水化合物链优选包含至少四个碳水化合物单元,任选地含有至少一个乙酰基残基如两个乙酰基残基和/或任选
地包含脱氧碳水化合物和/或任选地包含奎诺糖和/或任选地包含葡萄糖和/或任选地包含4
‑
甲氧基肉桂酸和/或任选地包含5
‑
o
‑
[5
‑
o
‑ꢀ
ara/api
‑
3,5
‑
二羟基
‑6‑
甲基
‑
辛酰基]
‑
3,5
‑
二羟基
‑6‑
甲基
‑
辛酸和/或任选地包含经由酯键与碳水化合物结合的5
‑
o
‑
[5
‑
o
‑
rha
‑
(1
→
2)
‑
ara/api
‑ꢀ
3,5
‑
二羟基
‑6‑
甲基
‑
辛酰基]
‑
3,5
‑
二羟基
‑6‑
甲基
‑
辛酸。
[0166]
so1861不同于方案i,结构a中显示的“理想结构”,仅在奎诺糖处具有仅一个乙酰基残基并且具有另外的木糖。用于增强效应分子或效应子部分,如反义寡核苷酸,如bna的内体逃逸的皂苷的“理想结构”是优选具有方案i中的结构a的皂苷,以及表现出内体逃逸增强活性的皂苷具有方案i的结构a中展现的一个或多个结构特征。不希望受任何理论的束缚,发明人相信方案i的结构a表示用于内体逃逸增强活性的“理想皂苷”(并且不是最低要求皂苷),这意味着并非所有的结构(化学基团)可以或必须存在于具有至少足够的内体逃逸增强活性以促进效应子部分在胞质中累积的每个皂苷中,并且意味着一些皂苷可具有其它结构元件如乙酰基链,和/或对于表现出内体逃逸增强活性的其它皂苷,糖可以不同于方案i中表现出的糖。例如,当考虑方案i中的结构a的理想结构:例如在qs
‑
21中存在乙酰基链时,qs
‑
21皂苷和皂皮树水溶性级分中的一些皂苷(皂皮树皂苷;quil
‑
a)在c
‑
28处的碳水化合物修饰方面不同。在皂皮树的水溶性级分中,皂苷,如qs
‑ꢀ
7、qs1862类似于理想结构a,并且类似于so1861。
[0167]
一个实施方案是本发明的效应子部分,其包含根据方案ii的寡聚三官能接头作为支架核心结构:
[0168][0169]
方案ii,
[0170]
其中至少一个皂苷经由不稳定的、可裂解的腙接头(酸敏感)和/或经由包含马来酰亚胺的键共价结合三官能接头支架,然而支架与效应子部分如寡核苷酸的结合是经由不稳定的、可裂解的腙接头(酸敏感) 和/或经由包含马来酰亚胺的键与结合位点中的半胱氨酸建立的,从而形成结构b:
[0171][0172]
结构b,
[0173]
如1、2、3或4个半胱氨酸,使得1
‑
4个支架共价结合单一效应子部分。
[0174]
[0175]
[0176]
[0177]
[0178]
[0179][0180]
表a2
‑
先前在人类临床环境中研究,随后从进一步临床研究中撤回的 adc
[0181]
[0182]
[0183]
[0184]
[0185]
[0186]
[0187]
[0188]
[0189]
[0190]
[0191]
[0192]
[0193]
[0194]
[0195][0196]
表a3
‑
达到iii期临床开发的adc
[0197]
[0198][0199]
[0200][0201]
表a5:来自植物的rip*
[0202]
[0203]
[0204]
[0205]
[0206]
[0207]
[0208]
[0209]
[0210]
[0211]
[0212]
[0213][0214]
如前所述,由根据本发明的效应子部分所包含的至少一个皂苷增加了本发明所定义的至少当前和新的效应子部分的功效。由于降低了与皂苷形成的缀合物所包含的效应子部分的剂量,将减少潜在的副作用,而不会降低功效。因此,本发明提供了根据本发明的效应子部分,其用于药物或用作药物。因此,本发明的一个方面涉及本发明的效应子部分,其用作药物。还提供了根据本发明的效应子部分用于制备药物的用途。尤其是癌症药物并且特别是经典的化疗药物,因其副作用而著名。由于效应子部分所包含的药物活性物质和效应子部分所包含的皂苷的时间和位置同步,因为有效载荷和皂苷共价连接,根据本发明的治疗性组合物对于用作药物,特别是用于治疗癌症的方法中尤其有价值。因此,本发明提供了包含根据本发明的效应子部分的治疗性组合物,其用于治疗癌症的方法中。本发明还提供了包含根据本发明的效应子部分的治疗性组合物,其用于治疗获得性或遗传性病症,特别是单基因缺陷病症的方法中。因此,治疗性组合物包含效应子部分,例如有效载荷,如反义寡核苷酸。因此,本发明的一个方面涉及包含用于治疗癌症或自身免疫疾病的方法中的根据本发明的效应子部分的治疗性组合物,其中有效载荷包含共价结合的皂苷。
[0215]
通过以下实施例来进一步说明本发明,这些实施例不应被理解为以任何方式限制本发明。
实施例
[0216]
实施例1
[0217]
材料和方法
[0218]
使用购买的以下化学品:甲醇(meoh,lichrosolv,merck),n
‑
ε
‑
马来酰亚胺基己酸酰肼(emch,95%,tci chemicals),三氟乙酸(tfa,99.8%, carl roth),2
‑
巯基乙醇
(98%,sigma
‑
aldrich),聚(酰氨基胺)(pamam树状物,乙二胺核心,第5.0代溶液,sigma
‑
aldrich),花青3羧酸(cy3
‑
cooh, 95%,lumiprobe),1
‑
[双(二甲基氨基)亚甲基]
‑
1h
‑
1,2,3
‑
三唑并[4,5
‑
b]吡啶鎓3
‑
氧化物六氟磷酸盐,n
‑
[(二甲基氨基)
‑
1h
‑
1,2,3
‑
三唑并
‑
[4,5
‑
b]吡啶
‑1‑ꢀ
基亚甲基]
‑
n
‑
甲基甲铵六氟磷酸盐n
‑
氧化物(hatu,97%,sigma
‑
aldrich),牛血清白蛋白级分v(bsa,carl roth),二甲亚砜(dmso,99%,carl roth), 2
‑
亚氨基硫烷盐酸盐(98%,sigma
‑
aldrich),罗丹明b(rhodb,95%,merck),杜尔贝科磷酸盐缓冲盐水(dulbecco’s phosphate buffered saline)(pbs, gibco),盐酸(hcl,37%,merck),nhs
‑
peg
13
‑
dbco(click chemistry tools), alexa fluor
tm
488 5
‑
tfp(thermo
‑
fischer),叠氮基
‑
peg3
‑
ss
‑
nhs(conju
‑ꢀ
probe),氰基硼氢化钠(nacnbh3,95%,sigma
‑
aldrich),过硫酸铵(aps, 98%,sigma
‑
aldrich),n,n,n',n'
‑
四甲基乙二胺(tmeda,99%,sigma
‑ꢀ
aldrich),定制的肽sesddamfcdamdesdsk(95%,peptidesynthetics),叠氮基dpeg
12
‑
nhs(95%,quanta biodesign),pfd
‑
g4
‑
叠氮化物
‑
nh
‑
boc 树枝化基元(g4
‑
树枝化基元,95%,polymer factory),花青素苷5
‑ꢀ
dbco(cy5
‑
dbco,95%,lumiprobe),氯仿(chcl3,99.5%,sigma),amiconultra 0.5ml离心过滤器(3kda mwco,sigma),mpeg
‑
scm(mpeg
2k
‑
nhs, 95.6%,creative peg works),amicon ultra 15ml离心过滤器(10kdamwco,sigma)。
[0219]
maldi
‑
tof
‑
ms
[0220]
在maldi
‑
质谱仪(bruker ultrafex iii)上记录maldi
‑
tof光谱。通常,经由干滴法(dried
‑
droplet
‑
method),使用super
‑
dhb(99%,fluka)或芥子酸(sa,99%,sigma
‑
aldrich)作为溶解在乙腈(测试的madli
‑
tof
‑
ms, sigma)/0.1%tfa(7:3v/v)中的基质,将溶解在纳摩尔至微摩尔范围的 milliq水中的样品点样在靶标(mtp 384靶板抛光钢tf,bruker dalton) 上。pepmix(肽校准标准,bruker dalton)或protemass(蛋白质校准标准, sigma
‑
aldrich)用作校准标准。rp模式是指反射器正模式。rn模式是指反射器负模式。lp模式是指线性正模式。
[0221]
h
‑
nmr
[0222]
使用bruker 400mhz nmr光谱仪进行1h nmr分析。在测量前24h 进行样品制备,其中将2mg样品溶解在0.8ml甲醇
‑
d4(99%,deutero) 中。
[0223]
尺寸排阻色谱法
[0224]
用来自ge healthcare的sephadex g 25superfin和预填充的pd10柱 (ge healthcare,sephadex g 25m)进行尺寸排阻色谱法(sec)。在进行色谱法之前,通过在相应的洗脱液中溶胀来活化材料。
[0225]
透析
[0226]
再生纤维素膜:mwco=1和2kda(spectra/por),以及mwco=12
–ꢀ
14kda(carl roth)用于进行透析。通常,用1l的溶剂进行24h的透析,所述溶剂在过程的前6小时后被更换。
[0227]
so1861
‑
emch合成
[0228]
将来自肥皂草的so1861(59mg,31.7μmol)和emch(301mg,888 μmol)置于带有搅拌器的圆烧瓶中,并溶解在13ml甲醇中。将tfa(400 μl,催化剂)加入到溶液中,并将反应混合物在rct b磁力搅拌器(ika labortechnik)上在800rpm和室温下搅拌3h。搅拌3h后,用milliq水或pbs稀释该混合物,并使用mwco为1kda的再生纤维素膜管 (spectra/por 7)用
milliq水或pbs充分透析24h。透析后,将溶液冻干以获得白色粉末。收率:62.4mg(95%)。将干燥的等分试样进一步用于经由1h nmr和maldi
‑
tof
‑
ms表征。
[0229]1h nmr(400mhz,甲醇
‑
d4)(图3a,so1861):δ=0.50
–
5.50(m,皂苷三萜和糖主链质子),9.43(1h,s,皂苷的醛质子,h
a
)。
[0230]1h nmr(400mhz,甲醇
‑
d4)(图3b.so1861
‑
emch,pbs后处理):δ=0.50
–
5.50(m,皂苷三萜和糖主链质子s),6.79(2h,s,马来酰亚胺质子, h
c
),7.62
‑
7.68(1h,m,腙质子,h
b
)。
[0231]
maldi
‑
tof
‑
ms(rp模式)(图4a):m/z 2124da([m k]
,皂苷
‑ꢀ
emch),m/z 2109da([m k]
,so1861
‑
emch),m/z 2094da([m na]
, so1861
‑
emch)。
[0232]
maldi
‑
tof
‑
ms(rn模式)(图5c):m/z 2275da([m
‑
h]
‑
,皂苷
‑ꢀ
emch缀合物),2244da([m
‑
h]
‑
,皂苷
‑
emch缀合物),2222da([m
‑
h]
‑
, 皂苷
‑
emch缀合物),2178da([m
‑
h]
‑
,皂苷
‑
emch缀合物),2144da([m
‑ꢀ
h]
‑
,皂苷
‑
emch缀合物),2122da([m
‑
h]
‑
,皂苷
‑
emch缀合物),2092 da([m
‑
h]
‑
,皂苷
‑
emch缀合物),2070da([m
‑
h]
‑
,so1861
‑
emch),2038 da([m
‑
h]
‑
,so1832
‑
emch),1936da([m
‑
h]
‑
,so1730
‑
emch),1861da ([m
‑
h]
‑
,so1861)。
[0233]
bsa
‑
so1861合成
[0234]
将溶解在47μl pbs中的2
‑
亚氨基硫烷(231μg,1.1μmol)加入到200 μl pbs中的bsa
‑
rhodb溶液(10mg,0.15μmol)中,并将混合物在thermomixer c(eppendorf)上在800rpm和室温下摇动40分钟。在摇动 40分钟后,将反应混合物立即通过sephadex g25超细尺寸排阻柱(16ml 柱体积),并将溶解在100μl pbs中的so1861
‑
emch(1mg,0.5μmol)加入到收集的bsa
‑
sh级分中。将反应混合物在thermomixer c(eppendorf) 上在800rpm和室温下摇动12h。在摇动12h后,经由mwco为3kda 的amicon ultra 15过滤器,使用在4,000rpm(15℃)下的离心过滤浓缩 bsa
‑
so1861。将缀合物作为溶液储存在冰箱中并取等分试样用于分析。收率:未测定。
[0235]
maldi
‑
tof
‑
ms(图2a)(lp模式):m/z 74.2kda([m h]
,连接了4 个so1861的bsa
‑
so1861),72.2kda([m h]
,连接了3个so1861的 bsa
‑
so1861),70.2kda([m h]
,连接了2个so1861的bsa
‑
so1861), 37.0kda([m h]
2
,连接了4个so1861的bsa
‑
so1861),35.9kda ([m h]
2
,连接了3个so1861的bsa
‑
so1861),34.7kda([m h]
2
,连接了2个so1861的bsa
‑
so1861)。
[0236]
结果
[0237]
通过使用牛血清白蛋白(bsa)的胺获得了so1861
‑
emch与蛋白质 (潜在蛋白质效应子的实例)缀合的第一个概念证明。缀合后,质谱获得 bsa
‑
so1861在m/z~70、~72和~74kda处的相应峰(图2a)。与具有m/z 66kda的bsa的检测质量相比(图2b),获得的bsa
‑
so1861的质量对应于每bsa由2个、3个和4个so1861分子组成的bsa
‑
so1861缀合物的混合物。这显示so1861分子能够有效地与潜在的蛋白质效应子缀合。
[0238]
实施例2
[0239]
材料和方法
[0240]
树枝化基元(
‑
l
‑
so1861)4合成(图6)
[0241]
中间体1:
[0242]
(((6
‑
叠氮基己酰基)氮烷二基)双(乙烷
‑
2,1
‑
二基))二氨基甲酸二叔丁酯
[0243]
将6
‑
叠氮基己酸(0.943g,6.00mmol)、edcl.hcl(1.21g,6.30mmol) 和oxyma pure
(0.938g,6.60mmol)溶解在dmf(10.0ml)中,并将混合物搅拌5分钟。然后加入(氮烷二基双(乙烷
‑
2,1
‑
二基))二氨基甲酸二叔丁酯(1.82g,6.00mmol)在dmf(5.00ml)中的溶液,并将反应混合物在室温下搅拌。5小时后,真空蒸发反应混合物,并将残余物溶解在乙酸乙酯(50 ml)中。将所得溶液用1n硫酸氢钾溶液(50ml),饱和碳酸氢钠溶液(2
×
50 ml)和盐水(50ml)洗涤,经na2so4干燥,过滤并真空蒸发。通过快速色谱法(乙酸乙酯
‑
庚烷梯度,10:90升至100:0)纯化残余物,得到呈白色固体的标题化合物(2.67g,100%)。基于lc
‑
ms的纯度:98%。
[0244]
lrms(m/z):287/343/465[m
‑
155/m
‑
99/m 23]
1
[0245]
lc
‑
ms r.t.(min):2.02
2a
[0246]
中间体2:
[0247]
n,n
‑
双(2
‑
氨基乙基)
‑6‑
叠氮基己酰胺二盐酸盐
[0248]
向(((6
‑
叠氮基己酰基)氮烷二基)双(乙烷
‑
2,1
‑
二基))二氨基甲酸二叔丁酯(2.66g,6.00mmol)中加入含hcl的异丙醇(5
‑
6n,20.0ml,110mmol),并将反应混合物在室温下搅拌。4小时后,真空蒸发反应混合物,并将所得粗产物与dcm(3
×
20ml)共蒸发,得到呈白色固体的粗制标题产物(1.49 g,79%)。
[0249]
lrms(m/z):243[m 1]
1
[0250]
中间体3:
[0251]
((5s,5's)
‑
((((6
‑
叠氮基己酰基)氮烷二基)双(乙烷
‑
2,1
‑
二基))双(氮烷二基))双(6
‑
氧代己烷
‑
6,1,5
‑
三基))四氨基甲酸四叔丁酯
[0252]
向n,n
‑
双(2
‑
氨基乙基)
‑6‑
叠氮基己酰胺二盐酸盐(1.19g,3.76mmol) 在dmf(30.0ml)和dipea(2.62ml,15.1mmol)中的溶液中加入boc
‑ꢀ
lys(boc)
‑
onp(3.69g,7.90mmol),并将混合物在室温下搅拌过夜。真空蒸发反应混合物并将残余物溶解在乙酸乙酯(100ml)中。将所得溶液用 1n硫酸氢钾溶液(100ml)和饱和碳酸氢钠溶液(5
×
100ml)洗涤,经 na2so4干燥,过滤并真空蒸发。通过快速色谱法(dcm
‑
甲醇/dcm(1/9,v/v) 梯度100:0升至0:100)纯化残余物,得到呈黄色固体的标题产物(3.07g, 91%)。基于lc
‑
ms的纯度:94%。
[0253]
lrms(m/z):800/900/922[m
‑
99/m 1/m 23]
1
[0254]
lc
‑
ms r.t.(min):2.17
2a
[0255]
中间体4:
[0256]4‑
硝基苯基3
‑
(乙酰基硫基)丙酸酯
[0257]
将4
‑
硝基苯基三氟乙酸酯(5.17g,22.0mmol)和3
‑
(乙酰基硫基)丙酸 (2.96g,20.0mmol)溶解在dcm(50.0ml)中。然后,加入dipea(6.97ml, 40.0mmol),并将反应混合物在室温下搅拌过夜。真空蒸发反应混合物并将残余物溶解在乙酸乙酯(50ml)中。将所得溶液用1n硫酸氢钾溶液(50 ml),饱和碳酸氢钠溶液(5
×
50ml)和盐水(50ml)洗涤,经na2so4干燥,过滤并真空蒸发。通过快速色谱法(dcm
‑
甲醇/dcm(1/9,v/v)梯度100:0 升至0:100)纯化残余物,得到呈微黄色固体的标题产物(4.90g,91%)。基于lc
‑
ms的纯度:99%。
[0258]
lrms(m/z):292[m 23]
1
[0259]
lc
‑
ms r.t.(min):1.94
2a
[0260]
中间体5:
[0261]
(s)
‑
2,6
‑
二氨基
‑
n
‑
(2
‑
(6
‑
叠氮基
‑
n
‑
(2
‑
((s)
‑
2,6
‑
二氨基己酰胺基)乙基) 己酰胺基)乙基)己酰胺四盐酸盐
[0262]
将((5s,5's)
‑
((((6
‑
叠氮基己酰基)氮烷二基)双(乙烷
‑
2,1
‑
二基))双(氮烷二基))双(6
‑
氧代己烷
‑
6,1,5
‑
三基))四氨基甲酸四叔丁酯(1.80g,2.00mmol) 溶解在含hcl的异丙醇(5
‑
6n,50.0ml,275mmol)中,并将反应混合物在室温下搅拌过夜。真空蒸发反应混合物,并将所得粗产物与dcm(3
×
20 ml)共蒸发,得到呈白色固体的粗制标题产物。
[0263]
lrms(m/z):250[m 2]
2
,500[m 1]
1
[0264]
中间体6:
[0265]
(2s)
‑
2,6
‑
双[3
‑
(乙酰基硫烷基)丙酰胺基]
‑
n
‑
[2
‑
(6
‑
叠氮基
‑
n
‑
{2
‑
[(2s)
‑ꢀ
2,6
‑
双[3
‑
(乙酰基硫烷基)丙酰胺基]己酰胺基]乙基}己酰胺基)乙基]己酰胺
[0266]
向(s)
‑
2,6
‑
二氨基
‑
n
‑
(2
‑
(6
‑
叠氮基
‑
n
‑
(2
‑
((s)
‑
2,6
‑
二氨基己酰胺基)乙基) 己酰胺基)乙基)己酰胺四盐酸盐(1.29g,2.00mmol)在dmf(30ml)和 dipea(3.48ml,20.0mmol)中的溶液中加入4
‑
硝基苯基3
‑
(乙酰基硫基)丙酸酯(2.26g,8.40mmol),并在周末期间,将反应混合物在室温下搅拌。真空蒸发反应混合物并将残余物溶解在dcm/甲醇(95:5,v/v,100ml)中。所得溶液用1n硫酸氢钾溶液(100ml)、1n氢氧化钠溶液(3
×
100ml)和盐水(100ml)洗涤,经na2so4干燥,过滤并真空蒸发。将残余物通过快速色谱法(dcm
‑
甲醇/dcm(1/9,v/v)梯度100∶0升至0∶100)纯化,得到呈白色固体的标题产物(1.33g,65%)。在lc
‑
ms上发现杂质(15%),其中 m/z值对应于具有一个去保护的硫代乙酸酯基团的产物。在后处理期间或之后形成杂质。基于lc
‑
ms的纯度:85%。
[0267]
lrms(m/z):510[m 2]
2
,1019/1041[m 1/m 23]
1
[0268]
lc
‑
ms r.t.(min):1.86
2b
[0269]
中间体7:
[0270]
n,n
’‑
((9s,19s)
‑
14
‑
(6
‑
氨基己酰基)
‑1‑
巯基
‑9‑
(3
‑
巯基丙酰胺基)
‑ꢀ
3,10,18
‑
三氧代
‑
4,11,14,17
‑
四氮杂二十三烷
‑
19,23
‑
二基)双(3
‑
巯基丙酰胺) 甲酸酯
[0271]
将支架2(102mg,0.100mmol)溶解在甲醇(1.00ml)中。然后,加入新鲜制备的1n氢氧化钠溶液(0.440ml,0.440mmol),并将反应混合物在室温下搅拌。30分钟后,加入含1.0m三甲基膦溶液的thf(0.500ml, 0.500mmol),并将所得混合物在室温下搅拌。30分钟后,真空蒸发反应混合物,并与甲醇(2
×
10ml)共蒸发。将残余物溶解在甲醇/水(9:1,v/v,1.00 ml)的混合物中,并将所得溶液进行制备型mp
‑
lc2。将对应于产物的级分立即汇集在一起,冷冻并冻干过夜,得到呈无色粘性油的标题化合物 (75.6mg,87%)。基于lc
‑
ms的纯度:96%。
[0272]
lrms(m/z):513[m 2]
2
,825[m 1]
1
[0273]
lc
‑
ms r.t.(min):1.42
2a
[0274]
中间体8:
[0275]
树枝化基元(
‑
l
‑
so1861)4‑
胺
[0276]
将n,n'
‑
((9s,19s)
‑
14
‑
(6
‑
氨基己酰基)
‑1‑
巯基
‑9‑
(3
‑
巯基丙酰胺基)
‑ꢀ
3,10,18
‑
三氧代
‑
4,11,14,17
‑
四氮杂二十三烷
‑
19,23
‑
二基)双(3
‑
巯基丙酰胺) 甲酸酯(2.73mg,3.13μmol)溶解在20mm nh4hco3与0.5mm tcep/乙腈(3:1v/v,3.00ml)的混合物中。然后,加入so1861
‑
emch(29.2mg,0.014 mmol),并将反应混合物在室温下搅拌。1.5小时后,
将反应混合物进行制备型lc
‑
ms
3b
。将对应于产物的级分立即汇集在一起,冷冻并冻干过夜,得到呈白色蓬松固体的标题化合物(12.3mg,43%)。基于lc
‑
ms的纯度:97%。
[0277]
lrms(m/z):1517[m
‑
6]6‑
,1821[m
‑
5]5‑
,2276[m
‑
4]4‑
[0278]
lc
‑
ms r.t.(min):4.39
5a
[0279]
中间体9:
[0280]
树枝化基元(
‑
l
‑
so1861)4‑
叠氮化物
[0281]
将树枝化基元(so1861)4‑
胺(6.81mg,0.748μmol)和2,5
‑
二氧代吡咯烷
‑1‑
基1
‑
叠氮基
‑
3,6,9,12
‑
四氧杂十五烷
‑
15
‑
酸酯(2.90mg,7.48μmol)溶解在dmf(1.00ml)中。然后,加入dipea(1.302μl,7.48μmol),将混合物摇动1分钟,并在室温下静置。2小时后,将反应混合物进行制备型lc
‑ꢀ
ms
3c
。将对应于产物的级分立即汇集在一起,冷冻并冻干过夜,得到呈白色蓬松固体的标题化合物(5.86mg,84%)。基于lc
‑
ms的纯度:90%。
[0282]
lrms(m/z):2344[m
‑
4]4‑
[0283]
lc
‑
ms r.t.(min):4.78
5b
[0284]
中间体10:
[0285]
树枝化基元(
‑
l
‑
so1861)4‑
马来酰亚胺1
[0286]
将树枝化基元(so1861)4‑
胺(8.12mg,0.891μmol)和2,5
‑
二氧代吡咯烷
ꢀ‑1‑
基1
‑
(2,5
‑
二氧代
‑
2,5
‑
二氢
‑
1h
‑
吡咯
‑1‑
基)
‑
3,6,9,12
‑
四氧杂十五烷
‑
15
‑
酸酯(3.94mg,8.91μmol)溶解在dmf(1.00ml)中。然后,加入dipea(1.55μl, 8.91μmol),将混合物摇动1分钟,并在室温下静置。3小时后,将反应混合物进行制备型lc
‑
ms
3c
。将对应于产物的级分立即汇集在一起,冷冻并冻干过夜,得到呈白色蓬松固体的标题化合物(6.76mg,80%)。基于 lc
‑
ms的纯度:66%。
[0287]
lrms(m/z):2358[m
‑
4]4‑
[0288]
lc
‑
ms r.t.(min):2.13
6c
[0289]
中间体11:
[0290]
树枝化基元(
‑
l
‑
so1861)4‑
马来酰亚胺2
[0291]
将支架2(5.10mg,5.00μmol)溶解在甲醇(100μl)中。然后,加入新鲜制备的1n氢氧化钠溶液(22.0μl,22.0μmol),将混合物摇动1分钟,并在室温下静置。30分钟后,加入含1.0m三甲基膦溶液的thf(25.0μl, 25.0μmol),将所得混合物摇动1分钟,在室温下静置。30分钟后,真空蒸发反应混合物,并与甲醇(2
×
5ml)共蒸发。将所得残余物溶解在20mmnh4hco3与0.5mm tcep/乙腈(3:1,v/v,3.242ml)的混合物中。从该溶液中,直接将1000μl加入到so1861
‑
emch(14.4mg,6.94μmol,4.5当量,与支架相比)中,将混合物摇动1分钟,并在室温下静置。10分钟后,将反应混合物冻干过夜。向所得残余物中加入2,5
‑
二氧代吡咯烷
‑1‑
基3
‑ꢀ
(2
‑
(2
‑
(3
‑
(2,5
‑
二氧代
‑
2h
‑
吡咯
‑
1(5h)
‑
基)丙酰胺基)乙氧基)乙氧基)丙酸酯 (5.84mg,0.014mmol)和dmf(1.00ml)。然后,加入dipea(2.39μl, 0.014mmol),将悬浮液摇动1分钟,并在室温下静置。2小时后,将反应混合物进行制备型lc
‑
ms
3c
。将对应于产物的级分立即汇集在一起,冷冻并冻干过夜,得到呈白色蓬松固体的标题化合物(10.9mg,85%)。基于 lc
‑
ms的纯度:80%。
[0292]
lrms(m/z):2354[m
‑
4]4‑
[0293]
lc
‑
ms r.t.(min):4.16
5b
[0294]
树枝化基元(
‑
l
‑
so1861)8合成(图7)
[0295]
中间体1:
[0296]
n
‑
[(1s)
‑1‑
{[(1s)
‑1‑
{[2
‑
(6
‑
叠氮基
‑
n
‑
{2
‑
[(2s)
‑
2,6
‑
双[(2s)
‑
2,6
‑
双({[(叔丁氧基
[0297]
)羰基]氨基})己酰胺基]己酰胺基]乙基}己酰胺基)乙基]氨基甲酰基}
‑5‑ꢀ
[(2s)
‑
2,6
‑
双({[(叔丁氧基)羰基]氨基})己酰胺基]戊基]氨基甲酰基}
‑5‑
{[(叔丁氧基)羰基]氨基}戊基]氨基甲酸叔丁酯
[0298]
将(s)
‑
2,6
‑
二氨基
‑
n
‑
(2
‑
(6
‑
叠氮基
‑
n
‑
(2
‑
((s)
‑
2,6
‑
二氨基己酰胺基)乙基) 己酰胺基)乙基)己酰胺四盐酸盐(964mg,1.50mmol)溶解在dmf(25.0ml) 和三乙胺(2.08ml,15.0mmol)中。然后,加入boc
‑
lys(boc)
‑
onp(3.36g, 7.18mmol),并将反应混合物在室温下搅拌过夜。真空蒸发反应混合物,并将残余物通过快速色谱法(dcm
‑
甲醇/dcm(1/9,v/v)梯度100∶0升至 0∶100)纯化,得到呈白色固体的标题产物(2.71g,100%)。基于lc
‑
ms的纯度:97%。
[0299]
lrms(m/z):807[m
‑
198]
2
[0300]
lc
‑
ms r.t.(min):2.35
2b
[0301]
中间体2:
[0302]
(2s,2's)
‑
n,n'
‑
((5s,15s,22s)
‑
22,26
‑
二氨基
‑
10
‑
(6
‑
叠氮基己酰基)
‑
15
‑ꢀ
((s)
‑
2,6
‑
二氨基己酰胺基)
‑
6,14,21
‑
三氧代
‑
7,10,13,20
‑
四氮杂二十六烷
‑
1,5
‑ꢀ
二基)双(2,6
‑
二氨基己酰胺)八盐酸盐
[0303]
将中间体1(2.71g,1.50mmol)溶解在含hcl的异丙醇(5
‑
6n,25.0ml, 138mmol)中,并将反应混合物在室温下搅拌过夜。然后,真空蒸发反应混合物,并将所得粗产物与dcm(3
×
20ml)共蒸发,得到呈白色固体的粗制标题产物。
[0304]
lrms(m/z):203/254[m
‑
200/m 4]
4
,338[m 3]
3
,507[m 2]
2
, 1012[m 1]
1
[0305]
中间体3:
[0306]
(2s)
‑
2,6
‑
双[3
‑
(乙酰基硫烷基)丙酰胺基]
‑
n
‑
[(1s)
‑1‑
{[2
‑
(6
‑
叠氮基
‑
n
‑ꢀ
{2
‑
[(2s)
‑
2,6
‑
双[(2s)
‑
2,6
‑
双[3
‑
(乙酰基硫烷基)丙酰胺基]己酰胺基]己酰胺基]乙基}己酰胺基)乙基]氨基甲酰基}
‑5‑
[(2s)
‑
2,6
‑
双[3
‑
(乙酰基硫烷基)丙酰胺基]己酰胺基]戊基]己酰胺
[0307]
向(2s,2's)
‑
n,n'
‑
((5s,15s,22s)
‑
22,26
‑
二氨基
‑
10
‑
(6
‑
叠氮基己酰基)
‑ꢀ
15
‑
((s)
‑
2,6
‑
二氨基己酰胺基)
‑
6,14,21
‑
三氧代
‑
7,10,13,20
‑
四氮杂二十六烷
‑ꢀ
1,5
‑
二基)双(2,6
‑
二氨基己酰胺)八盐酸盐(300mg,0.230mmol)中加入 dmf(20.0ml)、三乙胺(320μl,2.30mmol)和4
‑
硝基苯基3
‑
(乙酰基硫基) 丙酸酯(595mg,2.21mmol)。将所得悬浮液在60℃超声处理30分钟,并在室温搅拌过夜。真空蒸发反应混合物并将残余物通过首先进行快速色谱法(dcm
‑
甲醇/dcm(1/9,v/v)梯度100:0升至0:100),随后进行制备型 mp
‑
lc2来纯化,得到呈白色固体的标题产物(70mg,15%)。基于lc
‑
ms 的纯度:100%。
[0308]
lrms(m/z):685[m 3]
3
[0309]
lc
‑
ms r.t.(min):1.91
2a
[0310]
中间体4:
[0311]
(2s)
‑
n
‑
[(1s)
‑1‑
{[2
‑
(6
‑
氨基
‑
n
‑
{2
‑
[(2s)
‑
2,6
‑
双[(2s)
‑
2,6
‑
双(3
‑
硫烷基丙酰
胺基)己酰胺基]己酰胺基]乙基}己酰胺基)乙基]氨基甲酰基}
‑5‑
[(2s)
‑ꢀ
2,6
‑
双(3
‑
硫烷基丙酰胺基)己酰胺基]戊基]
‑
2,6
‑
双(3
‑
硫烷基丙酰胺基)己酰胺甲酸酯(盐)
[0312]
将支架4(10.0mg,4.87μmol)溶解在甲醇(200μl)中。然后,加入新鲜制备的1n氢氧化钠溶液(42.9μl,0.043mmol),将所得混合物摇动1分钟,并在室温下静置。30分钟后,加入含1.0m三甲基膦溶液的thf (24.4μl,0.024mmol),将所得混合物摇动1分钟,并在室温下静置。30 分钟后,将反应混合物用水(1ml)稀释并直接进行制备型mp
‑
lc2。将对应于产物的级分立即汇集在一起,冷冻并冻干过夜,得到呈白色蓬松固体的标题化合物(4.02mg,48%)。
[0313]
lrms(m/z):564[m 3]
3
,846[m 2]
2
[0314]
lc
‑
ms r.t.(min):1.54
2c
[0315]
中间体5:
[0316]
树枝化基元(
‑
l
‑
so1861)8‑
胺
[0317]
将支架5(0.52mg,0.299μmol)和so1861
‑
emch(29.2mg,0.014mmol) 溶解在20mm nh4hco3与0.5mm tcep/乙腈(3:1,v/v,1.00ml)的混合物中,将所得混合物摇动1分钟,并在室温下静置。30分钟后,加入 tcep(0.30mg,1.05μmol),并将反应混合物摇动1分钟。然后,将混合物直接进行制备型lc
‑
ms
3b
。将对应于产物的级分立即汇集在一起,冷冻并冻干过夜,得到呈白色蓬松固体的标题化合物(2.17mg,40%)。基于 lc
‑
ms的纯度:97%。
[0318]
lrms(m/z):2282[m
‑
8]8‑
,2607[m
‑
7]7‑
[0319]
lc
‑
ms r.t.(min):4.41
5a
[0320]
so1861
‑
bna寡核苷酸缀合
[0321]
将hsp27 bna寡核苷酸二硫化物(1.10mg,0.187μmol)溶解在具有1.0mm tcep的20mm nh4hco3(500μl)中,将混合物摇动1min 并在室温下静置。1小时后,通过使用截留分子量为3000da的离心过滤器(14000
×
g,持续30min)过滤反应混合物。将残余物溶液用具有 1.0mm tcep的20mm nh4hco3(500μl)稀释,并在上述相同条件下再次过滤所得混合物。将残余物溶液用20mm nh4hco3/乙腈(3:1, v/v,1.00ml)稀释,并将所得混合物加入到so1861
‑
emch(3.54mg, 0.375μmol)中。将反应混合物摇动1分钟并在室温下静置。10min后,将反应混合物进行制备型lc
‑
ms
4a
。将对应于产物的级分立即汇集在一起,冷冻并冻干过夜,得到呈白色蓬松固体的标题化合物(1.25 mg,85%)。基于lc
‑
ms的纯度:100%。
[0322]
lrms(m/z):1561[m
‑
5]5‑
,1951[m
‑
4]4‑
[0323]
lc
‑
ms r.t.(min):2.46
6b
[0324]
树枝化基元(so1861)4‑
bna寡核苷酸缀合
[0325]
将hsp27 bna寡核苷酸二硫化物(1.1mg,0.187μmol)溶解在具有 1.0mm tcep的20mm nh4hco3(500μl)中,将混合物摇动1min并在室温下静置。1小时后,通过使用截留分子量为3000da的离心过滤器(14000
×
g,持续30min)过滤反应混合物。将残余物溶液用具有1.0 mm tcep的20mm nh4hco3(500μl)稀释,并在上述相同条件下再次过滤所得混合物。将残余物溶液用20mm nh4hco3/乙腈(3:1, v/v,1.0ml)稀释,并将所得混合物加入到树枝化基元(so1861)4
‑
马来酰亚胺1(3.54mg,0.375μmol)中。将反应混合物摇动1分钟并在室温下静置。10min后,将反应混合物进行制备型lc
‑
ms
4a
。将对应于产物的级分立即汇集在一起,冷冻并冻干过夜,得到呈白色蓬松固体的标题化合物(1.25mg,85%)。基于lc
‑
ms的纯度:94%。
[0326]
lrms(m/z):1896[m
‑
8]8‑
,2167[m
‑
7]7‑
[0327]
lc
‑
ms r.t.(min):3.77
6b
[0328]
细胞培养
[0329]
将细胞以5,000c/w接种在96孔板中的补充有10%胎牛血清(pan
‑ꢀ
biotech gmbh)和1%青霉素/链霉素(pan
‑
biotech gmbh)的dmem(pan
‑
biotech gmbh)(100μl/孔)中,并在37℃和5%co2下孵育过夜。第二天,在dmem中制备样品并处理细胞。
[0330]
基因沉默
[0331]
根据标准程序和方案进行rna分离和qpcr分析。
[0332]
hsp27引物:f:r:
[0333]
hsp27bna寡核苷酸
[0334]
hsp27bna(
‑
硫醇)寡核苷酸(序列5
’‑
ggcacagccagtggcg
‑ꢀ3’
)(zhang等人,2011)在bio
‑
synthesis inc.(lewisville,texas)订购。
[0335]
结果
[0336]
将bna寡核苷酸,即靶向癌症靶标(在癌细胞中上调)的mrna转录物的反义bna寡核苷酸热休克蛋白27(hsp27bna)缀合至so1861
‑ꢀ
emch(hsp27bna
‑
l
‑
so1861)或树枝化基元(
‑
l
‑ꢀ
so1861)4(hsp27bna
‑
树枝化基元(
‑
l
‑
so1861)4),并共施用至根据本发明的a431癌细胞系。作为读出,测定a431细胞中hsp27 mrna的基因沉默。这揭示了与单独的hsp27bna相比,hsp27bna
‑
l
‑
so1861 处理导致hsp27基因沉默活性的改善,然而与单独的hsp27bna的基因沉默活性相比,hsp27bna
‑
树枝化基元(
‑
l
‑
so1861)4(4个so1861 分子/bna)的活性甚至更强(3倍)(图1)。这显示了由于so1861介导的内体逃逸和反义bna的细胞质递送的增强,一个或多个so1861分子的缀合改善了治疗性bna寡核苷酸的基因沉默活性。
[0337]
实施例3
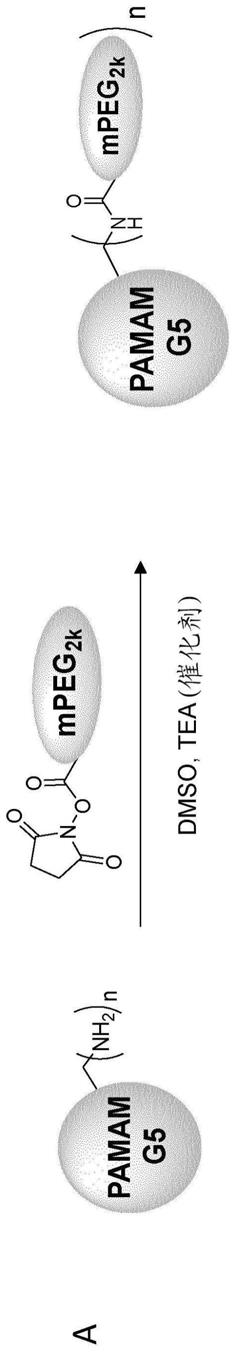
[0338]
材料
[0339]
使用购买的以下化学品:甲醇(meoh,lichrosolv,merck),n
‑
ε
‑
马来酰亚胺基己酸酰肼(emch,95%,tci chemicals),三氟乙酸(tfa,99.8%, carl roth),2
‑
巯基乙醇(98%,sigma
‑
aldrich),聚(酰氨基胺)(pamam树状物,乙二胺核心,第5.0代溶液,sigma
‑
aldrich),花青3羧酸(cy3
‑
cooh, 95%,lumiprobe),1
‑
[双(二甲基氨基)亚甲基]
‑
1h
‑
1,2,3
‑
三唑并[4,5
‑
b]吡啶鎓3
‑
氧化物六氟磷酸盐,n
‑
[(二甲基氨基)
‑
1h
‑
1,2,3
‑
三唑并
‑
[4,5
‑
b]吡啶
‑1‑ꢀ
基亚甲基]
‑
n
‑
甲基甲铵六氟磷酸盐n
‑
氧化物(hatu,97%,sigma
‑
aldrich),牛血清白蛋白级分v(bsa,carl roth),二甲亚砜(dmso,99%,carl roth), 2
‑
亚氨基硫烷盐酸盐(98%,sigma
‑
aldrich),罗丹明b(rhodb,95%,merck),杜尔贝科磷酸盐缓冲盐水(dulbecco’s phosphate buffered saline)(pbs, gibco),盐酸(hcl,37%,merck),nhs
‑
peg
13
‑
dbco(click chemistry tools), alexa fluor
tm
488 5
‑
tfp(thermo
‑
fischer),叠氮基
‑
peg3
‑
ss
‑
nhs(conju
‑ꢀ
probe),氰基硼氢化钠(nacnbh3,95%,sigma
‑
aldrich),过硫酸铵(aps, 98%,sigma
‑
aldrich),n,n,n',n'
‑
四甲基乙二胺(tmeda,99%,sigma
‑ꢀ
aldrich),定制的肽sesddamfcdamdesdsk(95%,peptidesynthetics),叠氮基dpeg
12
‑
nhs(95%,quanta biodesign),pfd
‑
g4
‑
叠氮化物
‑
nh
‑
boc 树枝化基元(g4
‑
树枝化基元,95%,polymer factory),花青素苷5
‑ꢀ
dbco(cy5
‑
dbco,95%,lumiprobe),氯仿(chcl3,99.5%,sigma),amiconultra 0.5ml离心过滤器(3kda mwco,sigma),mpeg
‑
scm(mpeg
2k
‑
nhs, 95.6%,creative peg works),amicon ultra 15ml离心过滤器(10kdamwco,sigma)。
[0340]
方法
[0341]
maldi
‑
tof
‑
ms
[0342]
在maldi
‑
质谱仪(bruker ultrafex iii)上记录maldi
‑
tof光谱。通常,经由干滴法(dried
‑
droplet
‑
method),使用super
‑
dhb(99%,fluka)或芥子酸(sa,99%,sigma
‑
aldrich)作为溶解在乙腈(测试的madli
‑
tof
‑
ms, sigma)/0.1%tfa(7:3v/v)中的基质,将溶解在纳摩尔至微摩尔范围的 milliq水中的样品点样在靶标(mtp 384靶板抛光钢tf,bruker dalton) 上。pepmix(肽校准标准,bruker dalton)或protemass(蛋白质校准标准, sigma
‑
aldrich)用作校准标准。rp模式是指反射器正模式。rn模式是指反射器负模式。lp模式是指线性正模式。
[0343]
h
‑
nmr
[0344]
使用bruker 400mhz nmr光谱仪进行1h nmr分析。在测量前24h 进行样品制备,其中将2mg样品溶解在0.8ml甲醇
‑
d4(99%,deutero) 中。
[0345]
uv
‑
vis
[0346]
在nanodrop nd
‑
1000分光光度计上在200
–
750nm的光谱范围中进行uv
‑
vis测量。
[0347]
尺寸排阻色谱法
[0348]
用来自ge healthcare的sephadex g 25superfin和预填充的pd10柱 (ge healthcare,sephadex g 25m)进行尺寸排阻色谱法(sec)。在进行色谱法之前,通过在相应的洗脱液中溶胀来活化材料。
[0349]
透析
[0350]
再生纤维素膜:mwco=1和2kda(spectra/por),以及mwco=12
–ꢀ
14kda(carl roth)用于进行透析。通常,用1l的溶剂进行24h的透析,所述溶剂在过程的前6小时后被更换。
[0351]
冻干
[0352]
在alpha 1
‑
2ld plus(martin christ gefriertrocknungsanlagen gmbh) 上进行冷冻干燥。通常,用液氮冷冻样品,并置于高真空的冷冻干燥器中。
[0353]
so1861
‑
emch合成
[0354]
将来自肥皂草的so1861(59mg,31.7μmol)和emch(301mg,888 μmol)置于带有搅拌器的圆烧瓶中,并溶解在13ml甲醇中。将tfa(400 μl,催化剂)加入到溶液中,并将反应混合物在rct b磁力搅拌器(ika labortechnik)上在800rpm和室温下搅拌3h。搅拌3h后,用milliq水或pbs稀释该混合物,并使用mwco为1kda的再生纤维素膜管 (spectra/por 7)用milliq水或pbs充分透析24h。透析后,将溶液冻干以获得白色粉末。收率:62.4mg(95%)。将干燥的等分试样进一步用于经由1h nmr和maldi
‑
tof
‑
ms表征。
[0355]1h nmr(400mhz,甲醇
‑
d4)(图3a,so1861):δ=0.50
–
5.50(m,皂苷三萜和糖主链质子),9.43(1h,s,皂苷的醛质子,h
a
)。
[0356]1h nmr(400mhz,甲醇
‑
d4)(图3b.so1861
‑
emch,pbs后处理):δ=0.50
–
5.50(m,皂苷三萜和糖主链质子s),6.79(2h,s,马来酰亚胺质子, h
c
),7.62
‑
7.68(1h,m,腙质子,h
b
)。
[0357]
maldi
‑
tof
‑
ms(rp模式)(图4a):m/z 2124da([m k]
,皂苷
‑ꢀ
emch),m/z 2109da([m k]
,so1861
‑
emch),m/z 2094da([m na]
, so1861
‑
emch)。
[0358]
maldi
‑
tof
‑
ms(rn模式)(图5c):m/z 2275da([m
‑
h]
‑
,皂苷
‑ꢀ
emch缀合物),2244da
([m
‑
h]
‑
,皂苷
‑
emch缀合物),2222da([m
‑
h]
‑
, 皂苷
‑
emch缀合物),2178da([m
‑
h]
‑
,皂苷
‑
emch缀合物),2144da([m
‑ꢀ
h]
‑
,皂苷
‑
emch缀合物),2122da([m
‑
h]
‑
,皂苷
‑
emch缀合物),2092 da([m
‑
h]
‑
,皂苷
‑
emch缀合物),2070da([m
‑
h]
‑
,so1861
‑
emch),2038 da([m
‑
h]
‑
,so1832
‑
emch),1936da([m
‑
h]
‑
,so1730
‑
emch),1861da ([m
‑
h]
‑
,so1861)。
[0359]
cy3
‑
pamam
[0360]
将溶解在甲醇(30mg,1.04μmol)中的720μl pamam置于250ml 圆烧瓶中,并经由旋转蒸发仪(20mbar,60℃)去除甲醇。将剩余的pamam 溶解在9ml dmso中。将溶解在0.5ml dmso中的hatu(7.6mg,20 μmol)加入到在dmso中的cy3
‑
coo h(0.6mg,1.2μmol)溶液中,并将混合物在t hermomixer c(eppendorf)上以800rpm在室温摇动1h。摇动 1h后,将hatu
‑
cy3溶液加入到搅拌的pamam溶液中,并将反应混合物在室温下搅拌12h。搅拌12h后,用milliq水稀释反应混合物,并使用mwco为2kda的再生纤维素膜管(spectra/por 6)对milliq水充分透析24h。在透析后,经由旋转蒸发仪(20mbar,60℃)减少缀合物溶液的体积,并使浓缩的缀合物溶液通过sep hadex g25超细尺寸排阻柱(16ml 柱体积)。收集第一级分并冻干以获得粘性粉红色pamam
‑
cy3缀合物。通过在薄层色谱法(甲醇/水,v/v 1:1)上的色谱和在sephadex g 25超细柱上出现较快的条带来确认pamam
‑
cy3缀合物的形成。收率:21.3 mg(63%)。通过uv
‑
vis分光光度法测定的染料/pamam摩尔比为0.43。
[0361]
maldi
‑
tof
‑
ms(图8a)(lp模式):m/z 28.0kda([m h]
,cy3
‑ꢀ
pamam)。
[0362]
cy3
‑
pamam
‑
so1861合成
[0363]
示例性地描述了针对cy3
‑
pamam
‑
(so1861)5的程序。将溶解在250 μl milliq水中的2
‑
亚氨基硫烷(1mg,6.7μmol)加入到125μl milliq水中的pamam
‑
cy3溶液(0.5mg,17nmol)中,并将混合物在thermomixerc(eppendorf)上在800rpm和室温下摇动40分钟。摇动40分钟后,将反应混合物立即通过sephadex g25超细尺寸排阻柱(16ml柱体积),并将溶解在40μl milliq水中的so1861
‑
emch(176μg,85nmol)加入到收集的cy3
‑
pamam
‑
sh级分中。将反应混合物在thermomixer c(eppendorf) 上在800rpm和室温下摇动12h。摇动12h后,用milliq水稀释反应混合物,并使用mwco为12
‑
14kda的再生纤维素膜管(zellutrans,carlroth)对milliq水充分透析24h。透析后,经由mwco为3kda的amiconultra 15过滤器,使用在4000rpm(15℃)下的离心过滤浓缩cy3
‑
pamam
‑ꢀ
so1861溶液。将缀合物作为溶液储存在冰箱中并取等分试样用于分析。收率:0.5mg(75%)。
[0364]
maldi
‑
tof
‑
ms光谱示于图8b
‑
d和图9中。cy3
‑
pamam
‑ꢀ
(so1861)6的maldi
‑
tof
‑
ms(图8b)(lp模式):m/z 38.4kda([m h]
, cy3
‑
pamam
‑
so1861),17.9kda([m h]
2
,cy3
‑
pamam
‑
so1861)。
[0365]
已经经由上述方法进行cy3
‑
pamam
‑
(so1861)5、cy3
‑
pamam
‑ꢀ
(so1861)
13
、cy3
‑
pamam
‑
(so1861)
51
和cy3
‑
pamam
‑
(so1861)
27
的合成,但起始材料2
‑
亚氨基硫烷和so1861
‑
emch的进料当量不同。表1中突出显示了起始材料的相应进料当量和缀合物的相应质量。
[0366]
表1:cy3
‑
pamam
‑
so1861合成的反应参数。
[0367][0368][0369]
cy3
‑
pamam
‑
nc
‑
so1861合成
[0370]
将cy3
‑
pamam(0.5mg,18nmol)、so1861(2.3mg,1.24μmol)和 hatu(64.6mg,170μmol)分别溶解在200μl dmso中。将so1861和 hatu溶液混合并在thermomixer c(eppendorf)上在800rpm和室温下摇动20分钟。摇动20分钟后,将cy3
‑
pamam溶液加入到摇动的so1861
‑ꢀ
hatu溶液中,并且使反应混合物在thermomixer c(eppendorf)上在800 rpm和室温下摇动12h。摇动12h后,用milliq水稀释反应混合物,并使用mwco为12
‑
14kda的再生纤维素膜管(zellutrans,carl roth)对 milliq水充分透析24h。透析后,经由mwco为3kda
的amicon ultra 15过滤器使用在4,000rpm(15℃)下离心过滤浓缩cy3
‑
pamam
‑
nc
‑ꢀ
so1861溶液。cy3
‑
pamam
‑
nc
‑
(so1861)
17
缀合物作为溶液储存在冰箱中并取等分试样用于分析。收率:0.77mg(69%)。
[0371]
maldi
‑
tof
‑
ms(图10)(lp模式):m/z 62.3kda([m h]
,cy3
‑ꢀ
pamam
‑
nc
‑
so1861),35.7kda([m h]
2
,cy3
‑
pamam
‑
nc
‑
so1861)。
[0372]
pamam硫醇化
[0373]
示例性地描述了针对最高的pamam与2
‑
亚氨基硫烷的比率的程序。向溶解在30μl甲醇中的pamam(333μg,12.8nmol)溶液中加入溶解在 128μl milliq水中的2
‑
亚氨基硫烷(0.53mg,3.84μmol)。将反应混合物在thermomixer c(eppendorf)上在800rpm和室温下摇动12h。摇动12 h后,经由使用amicon ultra离心过滤器(3kda mwco)在15℃和13500 rpm下的离心过滤,用milliq水洗涤反应混合物4次。洗涤后,将样品冻干以获得白色固体。未测定产率。
[0374]
maldi
‑
tof
‑
ms光谱示于图11中。pamam
‑
(sh)
108
的maldi
‑
tof
‑ꢀ
ms(图11c)(lp模式):m/z 41.5kda([m h]
,pamam
‑
[sh]
108
)。
[0375]
已经经由上述方法进行其它pamam
‑
亚氨基硫烷缀合物的合成,但起始材料2
‑
亚氨基硫烷的进料当量不同。对于最低的2
‑
亚氨基硫烷进料反应,已经使用了cy3
‑
pamam。
[0376]
表2中突出显示了起始材料的相应进料当量和缀合物的相应质量。
[0377]
表2:pamam
‑
sh合成的反应参数。
[0378][0379]
pamam聚乙二醇化
[0380]
示例性地描述了针对最低的pamam与mpeg
2k
比率的程序。向溶解在10μl dmso中的pamam(333μg,12.8nmol)溶液中加入溶解在13 μl dmso中的mpeg
2k
‑
nhs(0.268mg,128nmol)。将反应混合物在 thermomixer c(eppendorf)上在800rpm和室温下摇动12h。摇动12h 后,用milliq水稀释反应混合物,并使用mwco为2kda的再生纤维素膜管(spectra/por 6)对milliq水充分透析24小时。透析后,使用amiconultra 15ml离心过滤器((10kda mwco)经由离心过滤浓缩批料。将浓缩的批料通过pd10尺寸排阻柱,然后冻干,以获得白色蓬松粉末。未测定产率。
[0381]
maldi
‑
tof
‑
ms光谱示于图12中。pamam
‑
(mpeg
2k
)3的maldi
‑ꢀ
tof
‑
ms(图12c)(lp模式):m/z 33.46kda([m h]
,pamam
‑
[mpeg
2k
]3)。
[0382]
已经经由上述方法进行其它pamam
‑
mpeg
2k
缀合物的合成,但起始材料mpeg
2k
‑
nhs
的进料当量不同。表3中突出显示了起始材料的相应进料当量和缀合物的相应质量。
[0383]
表3:pamam
‑
mpeg
2k
合成的反应参数。
[0384][0385]
cy3
‑
pamam
‑
so1861
‑
dbco合成
[0386]
示例性地描述了针对cy3
‑
pamam
‑
(so1861)
27
‑
(dbco)
10
的程序。将 cy3
‑
pamam
‑
(so1861)
27
(0.41mg,4.71nmol)冷冻干燥并溶解在100μldmso中。将溶解在dmso中的dbco
‑
peg
13
‑
nhs酯(0.197mg,188 nmol)加入到cy3
‑
pamam
‑
so1861溶液中,并将混合物在thermomixerc(eppendorf)上在800rpm和室温下摇动。摇动3h后,用milliq水稀释反应混合物,并使用mwco为12
‑
14kda的再生纤维素膜管(zellutrans, carl roth)对milliq水充分透析24h。透析后,经由mwco为3kda的 amicon ultra 15过滤器使用在4,000rpm(15℃)下的离心过滤浓缩cy3
‑ꢀ
pamam
‑
so1861
‑
dbco溶液。将缀合物作为溶液储存在冰箱中并取等分试样用于分析。收率:0.1mg(22%)。
[0387]
maldi
‑
tof
‑
ms(图13d)(lp模式):m/z 92.5kda([m h]
,cy3
‑ꢀ
pamam
‑
so1861
‑
dbco),53.0kda([m h]
2
,cy3
‑
pamam
‑
so1861
‑ꢀ
dbco)。
[0388]
已经经由上述方法进行cy3
‑
pamam
‑
(so1861)5‑
(dbco)
38
和cy3
‑ꢀ
pamam
‑
(so1861)
27
‑
(dbco)
10
的合成。表4中突出显示了起始材料的相应进料当量和缀合物的相应质量。
[0389]
表4:cy3
‑
pamam
‑
so1861
‑
dbco合成的反应参数。
[0390][0391]
cy3
‑
pamam
‑
nc
‑
so1861
‑
dbco合成
[0392]
将cy3
‑
pamam
‑
nc
‑
(so1861)
17
(0.3mg,4.8nmol)冷冻干燥并溶解在 100μl dmso中。将溶解在dmso中的dbco
‑
peg
13
‑
nhs酯(0.202mg, 194nmol)加入到cy3
‑
pamam
‑
nc
‑
so1861溶液中,并将混合物在 thermomixer c(eppendorf)上在800rpm和室温下摇动。摇动3h后,用 milliq水稀释反应混合物,并使用mwco为12
‑
14kda的再生纤维素膜管(zellutrans,carl roth)对milliq水充分透析24h。透析后,经由mwco 为3kda的amicon ultra 15过滤器使用在4,000rpm(15℃)下的离心过滤浓缩cy3
‑
pamam
‑
so1861
‑
dbco溶液。将缀合物作为溶液储存在冰箱中并取等分试样用于分析。收率:0.1mg(22%)。质谱表明每pamam分子30个dbco部分的缀合。
[0393]
maldi
‑
tof
‑
ms(图13b)(lp模式):m/z 93.2kda([m h]
,cy3
‑ꢀ
pamam
‑
nc
‑
so1861
‑
dbco),49.6kda([m h]
2
,cy3
‑
pamam
‑
nc
‑ꢀ
so1861
‑
dbco)。
[0394]
egf石竹素和石竹素表达
[0395]
将质粒
‑
dna(his
‑
石竹素
‑
egf
‑
pet11d或his
‑
石竹素
‑
pet11d)[20]转化到化学感受态大肠杆菌nico21(de3)(new englandinc.)中,并在补充有50μg/ml氨苄青霉素的3ml溶原性肉汤中在37℃下以200 rpm生长5h。将这些细菌用于接种补充有50μg/ml氨苄青霉素的500 ml溶原性肉汤以在37℃过夜培养。随后,将培养物体积扩大至2l并使细菌生长直至光密度(a600)为0.9。通过加入终浓度为1mm的异丙基β
‑
d
‑1‑
硫代吡喃半乳糖苷(iptg)诱导蛋白质表达。将细胞在37℃和200 rpm下再生长3h。离心(5min,5,000g,4℃)后,将细胞沉淀重悬于20ml 磷酸盐缓冲盐水(含有ca
2
和mg
2
的杜尔贝科磷酸盐缓冲盐水(pbs), ph7.4)中,并储存在
‑
20℃。解冻后,通过超声装置(branson sonifier 250, g.heinemann)释放蛋白质。将溶液离心(15,800
×
g,30min,4℃)并调节至 20mm咪唑浓度。构建体含有n
‑
末端his
‑
标签,并通过镍次氮基三乙酸层析(ni
‑
nta琼脂糖,qiagen,hilden,germany)纯化。用咪唑(20
‑
250mm) 洗脱后,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳
(sds
‑
page)(12%)分析洗脱物。在4℃下,将含有石竹素
‑
egf或石竹素的级分用2l几丁质结合域缓冲液(20mm三(羟甲基)
‑
氨基甲烷/hcl,500mm nacl,1mmedta,0.1%吐温
‑
20,ph8.0)进行透析。通过几丁质柱亲和层析的进一步纯化用于去除对ni
‑
nta琼脂糖具有结合活性的细菌蛋白质。用几丁质结合结构域缓冲液洗脱后,通过sds
‑
page(12%)分析级分。在4℃下,将含有石竹素
‑
egf或石竹素的级分用5l pbs透析。通过amicon离心过滤装置(10kda,millipore,eschborn,germany)浓缩纯化的蛋白质。通过二辛可宁酸测定(pierce,rockford,usa)测定蛋白质浓度。
[0396]
石竹素
‑
egf
‑
alexa488合成
[0397]
将在pbs中的石竹素
‑
egf(240μg,6.7nmol)溶液置于mwco为3 kda的amicon ultra 15过滤器中,并在4,000rpm和4℃下离心30分钟三次。在每个循环之后,用0.1m碳酸钠缓冲液(ph9)再填充amicon过滤器。在第三次离心循环后,经由离心将体积减少至0.5ml。将石竹素
‑ꢀ
egf碳酸钠溶液置于2ml反应管中,并将溶解在10μl dmso中的alexafluor
tm
488 5
‑
tfp(50μg,56nmol)加入到蛋白质溶液中。将混合物在 thermomixer c(eppendorf)上在800rpm和室温下摇动80分钟。摇动后,将混合物通过sephadex g25 m尺寸排阻柱(ge healthcare,pd10柱)。将石竹素
‑
egf
‑
alexa488缀合物储存在冰箱中的0.1m碳酸钠缓冲液(ph9) 中并取等分试样用于分析。收率:210μg(85%)。
[0398]
maldi
‑
tof
‑
ms(图14d)(lp模式):m/z 36.8kda([m h]
,石竹素
ꢀ‑
egf
‑
alexa488),m/z 33.6kda([m h]
,石竹素
‑
egf
‑
alexa488),18.8kda ([m h]
2
,石竹素
‑
egf
‑
alexa488),16.6kda([m h]
2
,石竹素
‑
egf
‑ꢀ
alexa488)。
[0399]
石竹素
‑
alexa488合成
[0400]
将在pbs中的石竹素(184μg,6.2nmol)溶液置于mwco为3kda的 amicon ultra 15过滤器中,并在4,000rpm和4℃下离心30分钟三次。在每个循环之后,用0.1m碳酸钠缓冲液(ph9)再填充amicon过滤器。在第三次离心循环后,经由离心将体积减少至0.5ml。将石竹素碳酸钠溶液置于2ml反应管中,并将溶解在3.5μl dmso中的alexa fluor
tm 488 5
‑
tfp(16.7μg,19nmol)加入到蛋白质溶液中。将混合物在 thermomixer c(eppendorf)上在800rpm和室温下摇动80分钟。摇动后,将混合物通过sephadex g25 m尺寸排阻柱(ge healthcare,pd10柱)。将石竹素
‑
alexa488缀合物储存在冰箱中的0.1m碳酸钠缓冲液(ph9)中并取等分试样用于分析。收率:未测定
[0401]
maldi
‑
tof
‑
ms(图15d)(lp模式):m/z 30.7kda([m h]
,石竹素
‑ꢀ
alexa488)。
[0402]
石竹素
‑
egf
‑
alexa488
‑
s
‑
s
‑
peg
‑
n3和石竹素
‑
egf
‑
alexa488
‑
peg
12
‑ꢀ
n3合成
[0403]
示例性地描述了针对石竹素
‑
egf
‑
alexa488
‑
s
‑
s
‑
peg
‑
n3的程序。将石竹素
‑
egf
‑
alexa488(70μg,1.9nmol)碳酸钠溶液置于2ml反应管中,并将溶解在9μl dmso中的叠氮基
‑
peg3‑
s
‑
s
‑
nhs(120μg,272nmol)加入到蛋白质溶液中。将混合物在thermomixer c(eppendorf)上在800rpm 和15℃下摇动12h。摇动后,将反应混合物用pbs稀释,并使用mwco 为3kda的amicon ultra 15过滤器经由在4,000rpm和4℃下的离心过滤,用pbs洗涤。
[0404]
收率:54μg(70%)。
[0405]
maldi
‑
tof
‑
ms(图14e)(lp模式):m/z 40.8kda([m h]
,石竹素
ꢀ‑
egf
‑
alexa488
‑
s
‑
s
‑
peg
‑
n3),m/z 37.5kda([m h]
,石竹素
‑
egf
‑ꢀ
alexa488
‑
s
‑
s
‑
peg
‑
n3)。
[0406]
已经经由上述方法进行了石竹素
‑
egf
‑
alexa488
‑
s
‑
s
‑
peg
‑
n3和石竹素
‑
egf
‑
alexa488
‑
peg
12
‑
n3的合成,但使用的叠氮基
‑
peg接头不同。表 5中突出显示了相应的叠氮基
‑
peg接头、它们的进料当量和缀合物的相应质量。
[0407]
表5:石竹素
‑
egf
‑
alexa488
‑
peg
‑
n3合成的反应参数
[0408][0409]
石竹素
‑
alexa488
‑
s
‑
s
‑
peg
‑
n3[0410]
将石竹素
‑
alexa488(24.5μg,0.8nmol)碳酸钠溶液置于2ml反应管中,并将溶解在9μl dmso中的叠氮基
‑
peg3‑
s
‑
s
‑
nhs(34μg,78nmol) 加入到蛋白质溶液中。将混合物在thermomixer c(eppendorf)上在800 rpm和15℃下摇动12h。摇动后,将反应混合物用pbs稀释,并使用 mwco为3kda的amicon ultra 15过滤器经由在4,000rpm和4℃下的离心过滤,用pbs洗涤。
[0411]
收率:10.3μg(39%)。
[0412]
maldi
‑
tof
‑
ms(图15e)(lp模式):m/z 32.9kda([m h]
,石竹素
‑ꢀ
alexa488
‑
s
‑
s
‑
peg
‑
n3)。
[0413]
cy3
‑
pamam
‑
皂苷
‑
毒素缀合物合成
[0414]
示例性地描述了针对cy3
‑
pamam
‑
(so1861)
27
‑
dbco的程序。在1.5 ml反应管中,将在milliq水中的cy3
‑
pamam
‑
(so1861)
27
‑
dbco(17μg, 0.184nmol)溶液与在pbs中的石竹素
‑‑
egf
‑
alexa488
‑
ss
‑
peg3
‑
n3(3.6μg, 0.089nmol)溶液混合,并将反应混合物在thermomixer c(eppendorf)上在 800rpm和15℃下摇动2h。摇动后,取出少量等分试样用于在molecular versadoc
tm
mp 4000成像系统(bio
‑
rad)上经由sds
‑
page和荧光成像进行分析(图16)。
[0415]
已经经由上述方法进行了cy3
‑
pamam
‑
(so1861)5‑
s
‑
s
‑
石竹素
‑ꢀ
egf
‑
alexa488,cy3
‑
pamam
‑
(so1861)
27
‑
s
‑
s
‑
石竹素
‑
egf
‑
alexa488,cy3
‑ꢀ
pamam
‑
nc
‑
(so1861)
17
‑
s
‑
s
‑
石竹素
‑
egf
‑
alexa488,cy3
‑
pamam
‑
nc
‑ꢀ
(so1861)
17
‑
s
‑
s
‑
石竹素
‑
alexa488和cy3
‑
pamam
‑
nc
‑
(so1861)
17
‑
石竹素
ꢀ‑
egf
‑
alexa488的合成,但使用的pamam
‑
皂苷
‑
dbco批料、使用的叠氮基
‑
毒素批料及其进料当量不同。表6中突出显示了起始材料的相应进料当量。
[0416]
表6:cy3
‑
pamam
‑
皂苷
‑
毒素合成的反应参数。
[0417][0418][0419]
经由还原胺化合成cy3
‑
pamam
‑
nc
‑
so1861
[0420]
将cy3
‑
pamam(0.19mg,13nmol)和so1861(0.73mg,0.39μmol)分别溶解在200μl 0.1m乙酸盐缓冲液(ph 5)中。将so1861和cy3
‑
pamam 溶液混合并在thermomixer c(eppendorf)上在800rpm和室温下摇动20 分钟。摇动20分钟后,将nacnbh3(5mg,81μmol)加入摇动的反应溶液中,并使反应混合物在thermomixer c(eppendorf)上在800rpm和室温下摇动12h。摇动12h后,用milliq水稀释反应混合物,并使用mwco 为12
‑
14kda的再生纤维素膜管(zellutrans,carl roth)对milliq水充分透析24h。透析后,经由mwco为3kda的amicon ultra 15过滤器使用在4,000rpm(15℃)下的离心过滤浓缩cy3
‑
pamam
‑
nc
‑
so1861溶液。将缀合物作为溶液储存在冰箱中并取等分试样用于分析。收率:未测定
[0421]
maldi
‑
tof
‑
ms(图17b,c)(lp模式):m/z 88.7kda([m h]
,cy3
‑ꢀ
pamam
‑
nc
‑
so1861),49.2kda([m h]
2
,cy3
‑
pamam
‑
nc
‑
so1861)。
[0422]
已经经由上述方法进行cy3
‑
pamam
‑
nc
‑
(so1861)
30
和cy3
‑ꢀ
pamam
‑
nc
‑
(so1861)
10
的合成,但在将还原剂nacnbh3加入反应批料后的时间不同。在表7中突出显示了nacnbh3添加的相应时间和缀合物的相应质量。
[0423]
表7:经由还原胺化合成cy3
‑
pamam
‑
nc
‑
so1861的反应参数。
[0424][0425]
so1861
‑
emch肽偶联
[0426]
将具有序列sesddamfcdamdesdsk的定制肽(0.6mg,0.3μmol) 和so1861
‑
emch(0.8mg,0.39μmol)分别溶解在200μl pbs中。将 so1861
‑
emch和肽溶液混合,并在thermomixer c(eppendorf)上在800 rpm和室温下混合和摇动12h。摇动后取出少量等分试样用于分析。收率:未测定
[0427]
maldi
‑
tof
‑
ms(图18b)(rn模式):m/z 4.05kda([m h]
‑
,肽
‑ꢀ
so1861),3.92kda([m h]
‑
,肽
‑
so1730),1.98kda([m h]
‑
,肽),1.86kda ([m h]
‑
,so1861)。
[0428]
结果
[0429]
考虑到可用于与so1861分子发生缀合反应的化学基团,已经鉴定了四种化学基团。糖残基的醇和二醇、三萜主链上的醛基团、糖残基之一上的羧酸(葡糖醛酸)和三萜主链上的烯烃基团,如图19中突出显示。
[0430]
鉴于每种鉴定的化学基团的优点和缺点(表8),醛基团和醇基团最适合于可逆缀合反应,而烯烃和羧酸(葡糖醛酸)是最适合于不可逆/稳定缀合反应的基团。然而,与醇相比,so1861分子结构内的醛基团最适合于可逆缀合反应。一方面,因为结构中仅存在一种醛,其允许进行化学选择性反应。另一方面,因为醛可以与多种化学基团,如胺、酰肼和羟胺进行可逆缀合反应,形成酸可裂解的部分,像亚胺、腙和肟。该因素使得可以自由选择化学基团以进行期望的可逆缀合反应。相反,醇也是经由形成缩醛和缩酮进行可逆缀合反应的良好候选物,但缺乏化学选择性,因为它们大量存在于糖苷结构上。
[0431]
对于不可逆和稳定键的形成,羧酸是最适合的,因为它可以用肽化学中使用的常用工具形成酰胺和酯(如,经由碳二亚胺介导的酰胺形成与胺反应)。
[0432]
表8.可用于皂苷缀合反应的官能团
[0433][0434]
因此,为了开发增强内体逃逸的皂苷(如so1861),已经建立了一种方法,该方法允许使用so1861上存在的最合适的化学基团产生不可裂解的和可裂解的
‘
现成缀合(ready to conjugate)’皂苷(图20)。
[0435]
为了产生不可裂解的
‘
现成缀合’皂苷,so1861的羧基经由肽偶联化学中使用的试剂活化以产生活性酯(例如1
‑
[双(二甲基氨基)亚甲基]
‑
1h
‑ꢀ
1,2,3
‑
三唑并[4,5
‑
b]吡啶鎓3
‑
氧化物六氟磷酸盐,hatu)。所得so1861 的活性酯能够与胺反应形成稳定的酰胺键合的缀合物(图20a)。
[0436]
为了产生可裂解的
‘
现成缀合’皂苷,使so1861的醛基团与emch(ε
‑ꢀ
马来酰亚胺基己酸酰肼)接头反应。emch的酰肼基团与so1861的醛形成酸可裂解的腙键。同时,emch接头呈现了具有硫醇(巯基)反应性的马来酰亚胺基团,因此可以与硫醇缀合(图20b)。
[0437]
当在6.5
‑
7.5的ph范围内进行时,so1861
‑
emch的马来酰亚胺基团与硫醇和带有硫醇的聚合结构进行快速且特定的迈克尔加成反应(图 20b)。此外,so1861与emch之间的酸敏感腙连键可用于在酸性环境中进行从支架释放皂苷(图21)。因此,emch接头满足了对ph可裂解策略和对聚合结构的缀合策略的需要。
[0438]
关于用于与聚合结构缀合的理想emch间隔子长度,计算机模拟 (perkinelmer,chembio3d,ver.13.0.0.3015)显示so1861
‑
emch上的马来酰亚胺基团位于分子的外围,因此应可以接近带有硫醇的聚合结构 (图22)。
[0439]
为了合成so1861
‑
emch,已经开发了允许so1861上的醛基团转化成emch的策略(图
5a)。分离so1861
‑
emch缀合物,并经由核磁共振光谱(参见材料和方法部分,图3b)和基质辅助激光解吸/电离飞行时间质谱(maldi
‑
tof
‑
ms)对其成功地表征,如图5b和5c以及图4a所示。
[0440]
为了测试腙键的ph依赖性水解,将so1861
‑
emch溶解在ph为3 的hcl溶液中,并在两个不同的时间点记录maldi
‑
tof
‑
ms光谱(图23)。如图23a和23b所示,在m/z 2070da处对应于so1861
‑
emch的峰的明显降低趋势在图23b中可见。由于在水解过程中产生so1861,因此记录了在m/z 1861da处峰的增加,伴随在m/z 2070da处的降低趋势。这些结果显示,腙键对水解有响应,并且即使其连接在so1861上也会被裂解。
[0441]
为了使so1861
‑
emch与聚合结构缀合,聚合结构的可及胺借助于试剂2
‑
亚氨基硫烷转化成硫醇。然后,在聚合结构上产生的游离硫醇充当硫醇
‑
烯迈克尔型加成到so1861
‑
emch的马来酰亚胺基团上的亲核试剂(图24)。这种开发的方法适用于so1861
‑
emch与任何可获得的聚合结构的缀合,其获得可及的胺基团,并且此外,允许分别根据聚合结构控制缀合的so1861分子的数量。
[0442]
通过使用带有胺的第5代(g5)树状物聚(酰氨基胺)(具有共价偶联的红色荧光染料(cy3)的pamam),获得了将
‘
现成缀合皂苷’与聚合结构的缀合的概念证明。pamam
‑
cy3用作与so1861
‑
emch和so1861
‑ꢀ
hatu缀合的聚合结构,并用作so1861与聚合结构缀合的模型(图25)。
[0443]
使用3倍过量的2
‑
亚氨基硫烷/cy3
‑
pamam胺,将cy3
‑
pamam的所有可及的胺基团转化成硫醇,然后与so1861
‑
emch反应。将三个不同进料当量(5、20和57)的so1861
‑
emch用于三个反应批次。反应后,在maldi
‑
tof
‑
ms上记录的cy3
‑
pamam
‑
so1861缀合物的质量随着 so1861
‑
emch进料的增加而显示相应质量的增加(图8)。三种不同的进料对应于cy3
‑
pamam
‑
so1861缀合物的获得的m/z 38.4kda、m/z 53.9 kda和m/z 133.8kda的质量,所述cy3
‑
pamam
‑
so1861缀合物对应于如图8b
‑
d所示的每个pamam树状物连接的6、13和51个so1861分子。
[0444]
在另一个反应中,在与so1861
‑
emch反应之前,仅将一定数量的 pamam胺转化成硫醇。这里,分别使用了2
‑
亚氨基硫烷的两种不同的进料当量(8和32)和so1861
‑
emch两种不同的进料当量(5和30)。反应后,cy3
‑
pamam
‑
so1861缀合物在maldi
‑
tof
‑
ms的相应光谱显示在 m/z 37.7kda(5个进料当量的so1861
‑
emch)和m/z 87.0kda(30个进料当量的so1861
‑
emch)的峰,如图9所示。在m/z 37.7kda和m/z 87.0kda 处获得的质量对应于连接有5个和30个so1861分子的cy3
‑
pamam
‑ꢀ
so1861缀合物,并证明使用该方法几乎所有的so1861
‑
emch进料都是缀合的。
[0445]
为了产生非ph可裂解的皂苷缀合物,用hatu活化so1861的羧酸,然后与cy3
‑
pamam的胺反应,形成结合在cy3
‑
pamam与so1861 之间的ph稳定的酰胺。经由maldi
‑
tof
‑
ms检测所得缀合物的质量,质量为m/z 62.3kda,对应于cy3
‑
pamam
‑
nc
‑
so1861(nc=不可裂解的) 缀合物,每个pamam连接17.5个so1861分子(图25b,图10)。
[0446]
然后,将皂苷缀合的支架缀合至连接点,用于经由所谓的应变促进的炔烃
‑
叠氮化物环加成(spaac,点击化学)与靶向治疗剂(例如靶向毒素) 可能缀合,以获得官能化的支架。对于该反应,cy3
‑
pamam
‑
so1861(图 36c,d)和cy3
‑
pamam
‑
nc
‑
so1861(图13b)与异双官能性nhs
‑
peg
13
‑ꢀ
dbco接头缀合,所述异双官能性nhs
‑
peg
13
‑
dbco接头在缀合物的表面上产
生应变炔烃(图13a)。接头的nhs(n
‑
羟基琥珀酰亚胺)部分与 pamam
‑
皂苷缀合物的剩余胺反应,从而在支架与接头之间形成酰胺键。缀合物上的所得dbco(二苯并环辛炔)部分能够与靶向治疗剂上的相应叠氮化物一起进行spaac。
[0447]
石竹素
‑
egf用作模型靶向毒素,石竹素用作非靶向毒素。使用染料的四氟苯基酯(tfp)衍生物用alexa fluor
tm
488标记两种毒素。然后将染料标记的蛋白质缀合到异双官能化nhs
‑
ss
‑
peg3‑
叠氮化物接头上以获得spaac与pamam
‑
皂苷缀合物的相应化学部分。maldi
‑
tof
‑
ms测量显示每个石竹素
‑
egf分子上连接有一个alexa fluor
tm
488染料和9个 nhs
‑
ss
‑
peg3
‑
叠氮化物分子(图14,图15)。此外,alexa fluor
tm
488标记的石竹素
‑
egf缀合到杂双官能化nhs
‑
peg
12
‑
叠氮化物接头上,所述杂双官能化nhs
‑
peg
12
‑
叠氮化物接头缺少二硫键,因此将产生非毒素可裂解的构建体。
[0448]
cy3
‑
pamam
‑
nc
‑
so1861
‑
dbco和cy3
‑
pamam
‑
so1861
‑
dbco缀合物与alexa fluor
tm
488标记的叠氮基
‑
毒素反应以进行应变促进的炔烃
ꢀ‑
叠氮化物环加成。经由凝胶电泳和在凝胶电泳后仅连接在pamam聚合物上的cy3和仅连接毒素上的alexa fluor
tm
488的荧光信号在聚丙烯酰胺凝胶上的共定位来指示反应试剂之间的缀合(图16)。
[0449]
作为pamam树状物的替代聚合结构,具有16个官能化氨基端基和焦点处的叠氮基的g4
‑
树枝化基元(pfd
‑
g4
‑
叠氮化物
‑
nh
‑
boc,polymerfactory)用于与so1861缀合(图26)。与树状物相比,使用树枝化基元的优点是树枝化基元结构表现出的焦点。该焦点允许与靶向毒素的直接缀合,而不需要用正交点击功能对其进行后修饰(图27)。如图27所示,树枝化基元经历与针对pamam树状物所述相同的方法。简而言之,在部分染料标记和去保护后(图28),使用硫醇化试剂
‑2‑
亚氨基硫烷,将树枝化基元的氨基转化为硫醇,然后与so1861
‑
emch缀合。对于与so1861
‑ꢀ
emch的缀合,使用三种不同的进料当量的so1861
‑
emch。经由maldi
‑ꢀ
tof
‑
ms分析树枝化基元
‑
so1861缀合物。如所预期的,当使用3和10 的低so1861
‑
emch进料当量时,获得每个树枝化基元分子1个和2个 so1861分子的缀合物物质(图29b,c)。当使用每个树枝化基元分子22 进料当量的so1861
‑
emch分子时,获得了每个树枝化基元多达9个 so1861分子的较高树枝化基元
‑
so1861缀合物物质(图29a)。在进一步的实验中,皂苷官能化的树枝化基元将在其焦点上与目标毒素缀合以产生官能化的支架并将在生物学上进行评价。
[0450]
为了进一步测试so1861与聚合结构的其它缀合方法,使用还原胺化途径。为此,so1861的醛基团直接与pamam胺缀合,形成亚胺键。亚胺键形成之后通过添加还原剂氰基硼氢化钠进行还原胺化步骤,从而在 so1861与pamam之间形成ph稳定的胺键(图17a)。类似于emch和 hatu方法,该方法允许控制每个聚合物缀合的皂苷的数量,如图17b、 17c所示。这里,产生了pamam
‑
皂苷缀合物,其获得每个pamam的 10个(图17b)和30个(图17c)so1861分子。
[0451]
实施例4
[0452]
细胞活力测定
[0453]
将hela细胞以5,000c/w接种在含有补充有10%胎牛血清(pan
‑ꢀ
biotech gmbh)和1%青霉素/链霉素(pan
‑
biotech gmbh)的dmem(pan
‑ꢀ
biotech gmbh)的96孔板中(100μl/孔),并在37℃和5%co2下孵育过夜。第二天,在dmem中制备pamam、pamam
‑
缀合物、g4
‑
树枝化基元(在实施例3中制备)或氯喹(sigma aldrich)样品的20x浓缩储备液。将培养基从细
胞培养板中取出,并用160μl培养基替换,然后加入10μl 样品/孔(来自20x浓缩储备液),并在37℃下孵育45分钟。在此孵育期间,制备so1861浓度曲线。将so1861预储备液在50℃下加热10分钟,同时以1,250rpm摇动。然后进行15秒超声处理,并在50℃下短暂再加热1分钟,同时以1,250rpm摇动。随后在pbs中制备so1861的系列稀释液。so1861浓度曲线制备为10x浓缩储备液,每孔加入20μl。在37℃孵育15分钟后,每孔加入10μl在dmem中稀释至30pm的石竹素
‑ꢀ
egf(在实施例2中制备)或含有等量pbs的dmem,以获得1.5pm的最终石竹素
‑
egf浓度以及指定的so1861和不同的聚合结构或氯喹浓度,最终体积为200μl/孔。
[0454]
在处理后,将细胞在37℃下孵育72小时,然后通过根据制造商的说明书(celltiteraqueous one solution cell proliferation assay,promega) 进行的mts
‑
测定确定细胞活力。简而言之,将mts溶液在补充有10% fbs的不含酚红的dmem(pan
‑
biotech gmbh)中稀释20x。将细胞用200 μl/pbs孔洗涤一次,之后每孔加入100μl稀释的mts溶液。将板在 37℃下孵育约20
‑
30分钟。随后,在thermo scientific multiskan fc读板仪(thermo scientific)上测量492nm处的od。为了定量,从所有其它孔中减去“仅培养基”孔的本底信号,然后通过将处理孔的本底校正信号除以未处理孔的本底校正信号(x100),计算处理/未处理细胞的细胞活力百分比。
[0455]
facs分析
[0456]
将hela细胞以500,000c/板接种在含有补充有10%胎牛血清(pan
‑ꢀ
biotech gmbh)和1%青霉素/链霉素(pan
‑
biotech gmbh)的dmem(pan
‑ꢀ
biotech gmbh)的10cm培养皿中,并孵育48小时(5%co2,37℃),直至达到90%的汇合度。然后,将细胞用胰蛋白酶消化(tryple express,gibcothermo scientific)成单细胞。将0.75
×
106个细胞转移到15ml falcon管中并离心(1,400rpm,3分钟)。弃去上清液,同时使细胞沉淀浸没。通过在涡旋振荡器上轻轻敲击falcon管来分离沉淀,并用4ml冷pbs(不含mg
2
和ca
2
,2%fbs)洗涤细胞。洗涤后,将细胞重悬于3ml冷pbs(不含 mg
2
和ca
2
,2%fbs)中,并平均分配在3个圆底facs管(1ml/管)中。将细胞再次离心并重悬于200μl冷pbs(不含mg
2
和ca
2
,2%fbs)或 200μl抗体溶液中,所述抗体溶液含有在195μl冷pbs(含mg
2
和ca
2
, 2%fbs)的5μl抗体。apc小鼠igg1,κ同种型ctrl fc(#400122,biolegend) 用作同种型对照,apc抗人egfr#352906,biolegend)用于对egfr受体进行染色。将样品在4℃下在管辊混合器上孵育30分钟。然后,将细胞用冷pbs(不含mg
2
和ca
2
,2%fbs)洗涤3次,并使用在pbs中的2% pfa溶液在室温下固定20分钟。将细胞用冷pbs洗涤2次,并重悬于 250
‑
350μl冷pbs中用于facs分析。用bd facscanto ii流式细胞术系统(bd biosciences)和flowjo软件分析样品。
[0457]
结果
[0458]
先前已经描述了含胺的聚合结构如pamam和pei(聚乙烯亚胺)中的氨基能够经由其固有的h
缓冲能力阻断内体的酸化。由于so1861的内体逃逸增强特性仅在低内体ph(<ph5)下暴露,支架或官能化支架不应含有能够干扰内体酸化并因此阻断so1861活性的化学基团。
[0459]
测试g5 pamam(128个伯胺以及约126个叔胺)和g4
‑
树枝化基元 (16个伯胺)的含胺的聚合结构,以确定这些分子是否抑制so1861的内体逃逸增强能力。进行pamam(天然的或硫醇化的)或树枝化基元(天然的) 与石竹素
‑
egf和各种so1861浓度的组合在hela细胞上的共施用实验。使用氯喹作为抑制内体酸化的对照。
[0460]
hela细胞显示足够的egfr细胞表面水平(图30a)。观察到
‘
天然的’pamam和氯喹都抑制so1861介导的靶向毒素的内体逃逸和随后的细胞杀伤(hela细胞中)(图30b)。在500nm的pamam抑制甚至与内体酸化抑制剂氯喹相同的程度,而667nm树枝化基元根本没有影响。为了进一步解决
‘
天然’pamam的抑制活性是否是由于pamam中氨基的可利用性,pamam的伯氨基通过与2
‑
亚氨基硫烷反应而部分硫醇化(图 11),导致16/128(图11c)、65/128(图11d)和108/128(图11e)封闭的伯胺。观察到65个和108个伯胺的硫醇化克服了so1861介导的内体逃逸的抑制,而多达16个胺基团的硫醇化仍然显示出so1861介导的靶向毒素的内体逃逸的抑制作用(图30c)。pamam的伯氨基也通过与mpeg2k
‑
nhs 的反应部分地聚乙二醇化(图12),得到3/128(图12c)、8/128(图12d)和 18/128(图12e)封闭的伯胺。通过聚乙二醇化仅封闭3个伯胺已经足以逆转so1861介导的内体逃逸的抑制(图11d)。聚乙二醇化的屏蔽作用很可能延伸超过转化的少量胺,因为已知聚乙二醇化引入了能够屏蔽整个分子的水合层(如果达到足够的水平的话)。
[0461]
这些结果表明,在聚合结构如pamam上存在一定数量的游离氨基基团可以阻断内体酸化,从而抑制so1861或其它糖苷的内体逃逸活性。当氨基基团的数量较低时,如g4
‑
树枝化基元所示,或者如果氨基基团已经被屏蔽,如硫醇化或聚乙二醇化,则会逆转抑制作用。
[0462]
实施例a
‑
具有内体/溶酶体逃逸增强活性的包含qs
‑
21的皂皮树的皂苷混合物
[0463]
方案i展现了一系列qs
‑
21皂苷的常见分子结构(部分改编自: conrado pedebos,la
é
rcio pol
‑
fachin,ramon pons,cilaine v.teixeirahugo verli,atomic model and micelle dynamics of qs
‑
21saponin, molecules 2014,19,3744
‑
3760)。基于混合物中存在的至少一种单独皂苷(如qs
‑
21)的内体/溶酶体逃逸增强特性,或者基于混合物所包含的两个或更多个皂苷的组合(如qs
‑
21和qs
‑
7),从皂皮树获得的水溶性皂苷的混合物(sigma
‑
aldrich,产品号:s4521;roth,项号(item no.): 6857;invivogen,产品
‘
quil
‑
a’)可应用于根据本发明的包含至少一个皂苷的效应子部分或者应用于本发明的内体/溶酶体逃逸增强缀合物、组合物、组合。
[0464]
发明人证明,当在基于细胞的生物测定中用哺乳动物肿瘤细胞测试时,2.5微克/ml剂量的来自皂皮树的皂苷的混合物能够增强石竹素的内体逃逸。暴露至细胞的效应子部分是共价偶联至配体egf的石竹素:egf
‑
石竹素。测试的细胞为用于游离皂苷的肿瘤细胞系hela,以及用于测试当共价偶联至西妥昔单抗时皂皮树的皂苷的a431、mda
‑ꢀ
mb
‑
468、caski和a2058。
[0465]
参考文献
[0466]
weng,a.;thakur,m.;beceren
‑
braun,f.;bachran,d.;bachran,c.; riese,s.b.;jenett
‑
siems,k.;gilabert
‑
oriol,r.;melzig,m.f.;fuchs,h. the toxin component of targeted anti
‑
tumor toxins determines their efficacy increase by saponins.molecular oncology 2012,6,323
‑
332.
[0467]
saponinum album in a synergistic way.journal of immunotherapy 2009,32,713
‑
725.
[0468]
sama,s.;jerz,g.;schmieder,p.;joseph,j.f.;melzig,m.f.;weng,a. plant derived
[0469]
triterpenesfromgypsophilaelegansm.bieb.enablenon
‑
toxicdeliveryofgene
[0470]
loadednanoplexes.journalofbiotechnology2018,284,131
‑
139
[0471]
kolb,h.c.;finn,m.g.;sharpless,k.b.clickchemistry:diversechemicalfunctionfromafewgoodreactions.angewandtechemie2001,40,2004
‑
2021.
[0472]
bird,r.e.;hardmann,k.d.;jacobson,j.w.;johnson,s.;kaufman,b.m.;lee,s.m.;lee,t.;pope,s.h.;riordan,g.s.;whitlow,m.single
‑
chainantigen
‑
bindingproteins.science1988,242,423
‑
426.
[0473]
yzhang,zqu,skim,vshi,bliao1,pkraft,rbandaru,ywu,lmgreenbergerandidhorak,down
‑
modulationofcancertargetsusinglockednucleicacid(lna)
‑
basedantisenseoligonucleotideswithouttransfection,genetherapy(2011)18,326
–
333。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

