恢复对抗癌症的nkg2d通路功能的疫苗组合物和方法
1.本技术是申请日为2015年3月16日、申请人为达纳-法伯癌症研究所公司、发明名称为“恢复对抗癌症的nkg2d通路功能的疫苗组合物和方法”的中国专利申请201580013698.3的分案申请。
2.相关申请的交叉参考
3.本技术要求2014年3月14日提交的u.s.s.n.61/953,064的优先权和权益,其内容通过引用以其全部并入本文。
4.政府支持
5.采用由national institutes of health以批准号nci1r01ca173750
‑
01授予的政府支持完成本发明。政府在本发明中具有一定权利。
技术领域
6.本发明涉及在人类受试者中诱导抗癌免疫响应的方法与组合物。
背景技术:
7.mica是nkg2d(一种在大多数人类nk细胞、γδt细胞和cd8 t细胞上表达的c型凝集素样、ii型跨膜受体)的配体。在连接反应时,nkg2d通过衔接蛋白dap10发信号以唤起穿孔素依赖性细胞溶解并提供共同刺激。在人体内,nkg2d配体包括mhc i类链相关蛋白a(mica)、密切相关的micb、ul
‑
16结合蛋白(ulbp)1
‑
4和rae
‑
1g。
8.虽然nkg2d配体通常不在健康的组织上发现,各种形式的细胞应激(包括dna损伤)可能上调配体表达,导致它们在多种实体和血液恶性肿瘤(包括黑素瘤)中的频繁检测。通过配体阳性转化细胞的nkg2d活化有助于外源肿瘤免疫,因为nkg2d缺陷小鼠显示提高的肿瘤易感性。但是在许多癌症患者中,nkg2d介导的肿瘤免疫是无效的。部分地,通过nkg2d配体从肿瘤细胞中脱落,可以实现免疫逃逸,这引发了表面nkg2d的内在化和细胞毒性淋巴细胞的受损功能。参见例如wu等人,“prevalent expression of the immunostimulatory mhc class i chain
‑
related molecule is counteracted by shedding in prostate cancer”,j clin invest 114:560
‑
8(2004);groh等人,“tumour
‑
derived soluble mic ligands impair expression of nkg2d and t
‑
cell activation”,nature 419:734
‑
8(2002);doubrovina等人,“evasion from nk cell immunity by mhc class ichain
‑
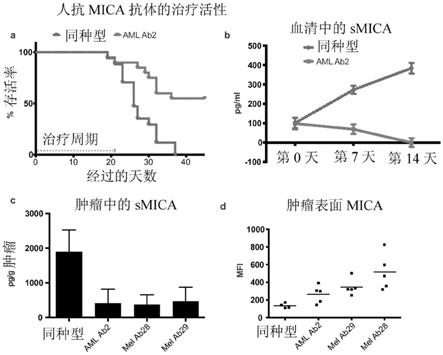
related molecules expressing colon adenocarcinoma”,j immunol 171:6891
‑
9(2003)。mic从肿瘤中脱落造成在肿瘤细胞表面上表达的mic的密度降低也是肿瘤逃避的机理之一。参见marten等人,“soluble mic is elevated in the serum of patients with pancreatic carcinoma diminishing gamma delta t cell cytotoxicity”,int j cancer 119:2359
‑
65(2006)。可溶性nkg2d配体也可以刺激调节性nkg2d cd4 foxp3
‑
t细胞(其可以通过fas配体、il
‑
10和tgf
‑
β拮抗抗肿瘤细胞毒性)的扩张。
9.mica是从肿瘤细胞中脱落的nkg2d配体,即从细胞表面释放到周围介质中,并且来自癌症患者亚群的血清含有提高水平的可溶形式(smica)。mic(术语“mic”是指mica和
micb)脱落部分通过与蛋白质二硫键异构酶erp5的相互作用来实现,所述蛋白质二硫键异构酶erp5裂解micα3结构域中的二硫键,使其易受通过adam
‑
10/17和mmp14进行的蛋白酶解(proteolysis)。已经描述了通过施用抗
‑
mic抗体或抗原结合肽片段来治疗癌症的方法。例如,us 8,182,809描述了此类方法,该方法利用特异性结合到位于mic多肽的α3胞外域中的氨基酸序列ngtyqt的纯化抗体或包含其抗原结合片段的多肽,以便抑制mic多肽与erp5的相互作用并抑制mic的脱落。并且us 7,959,916描述了使用抗
‑
micα3结构域抗体抑制mic多肽从癌细胞中脱落的方法。肿瘤衍生的可溶性mic多肽,mica或micb,或两者,已经也被建议作为癌症的诊断和预后的生物标记,并建议抗
‑
mica或抗
‑
micb抗体作为治疗癌症和自身免疫性疾病的治疗剂。例如,us 7,771,718描述了使用抗mic抗体以结合可溶性mic多肽来减轻淋巴细胞中mic诱导的nkg2d抑制方法。
10.在实践中,使用治疗性抗体治疗癌症或其它疾病的方法相对昂贵,因为需要制造大量具有足够纯度以便输注至患者的此类抗体。考虑到大规模抗体生产的复杂性和对抗体输注方案的专门要求,需要替代方法以便以更有效和成本有效的方式来靶向mic多肽。本发明通过提供用于在受试者中诱导抗mic抗体的疫苗提供了这一问题的解决方案。
11.肿瘤疫苗通常由共同作用以诱导识别和溶解肿瘤细胞的抗原特异性细胞毒性t细胞(ctl)的肿瘤抗原和免疫刺激分子(例如细胞因子或tlr配体)组成。此时,几乎所有疫苗均含有共享的肿瘤抗原或全肿瘤细胞制剂(gilboa,1999)。共享的肿瘤抗原是跨越多个个体在肿瘤中具有选择性表达的免疫原性蛋白,并通常以合成肽或重组蛋白形式递送至患者(boon等人,2006)。相反,全肿瘤细胞制剂以自体照射细胞、细胞裂解物、细胞融合、热休克蛋白制剂或总mrna形式递送至患者(parmiani等人,2007)。因为全肿瘤细胞由患者分离,该细胞表达患者特异性肿瘤抗原以及共享的肿瘤抗原。最后,存在第三类肿瘤抗原,该抗原由于识别它们的技术困难而极少用于疫苗(sensi等人,2006)。这一类由具有导致改变的氨基酸序列的肿瘤特异性突变的蛋白组成。此类突变蛋白具有以下潜力:(a)独特地标记肿瘤(相对于非肿瘤细胞)以便通过免疫系统识别和破坏(lennerz等人,2005);(b)避免中枢和有时的外周t细胞耐受,并由此被更有效的高亲和力t细胞受体识别(gotter等人,2004)。
技术实现要素:
12.本发明提供了通过引发针对mic多肽的免疫响应来治疗受试者的癌症的组合物与方法。本文中所用的术语“mic”指的是mica和/或micb。在一个实施方案中,本发明提供了用于治疗癌症的疫苗组合物,该组合物包含有效量的含有seq id no 1
‑
23的一种或更多种或由其组成的肽作为免疫原性组分,所述有效量是有效引发针对mic多肽或癌症的免疫响应的量。在另一实施方案中,该疫苗组合物包含有效量的含有seq id no 1
‑
4或2
‑
4的一种或更多种、seq id no 5
‑
7的一种或更多种、seq id no 8
‑
10的一种或更多种、或seq id no5
‑
13的一种或更多种或由其组成的肽作为免疫原性组分。在另一实施方案中,该疫苗组合物包含有效量的含有seq id no 14
‑
23的一种或更多种、seq id no 15
‑
23的一种或更多种、seq id no 18
‑
23的一种或更多种、或seq id no 21
‑
23的一种或更多种或由其组成的肽作为免疫原性组分。
13.在一个实施方案中,该疫苗组合物有效引发针对mic多肽的体外免疫响应。在另一实施方案中,该疫苗组合物有效引发针对mic多肽的体内免疫响应。
14.在一个实施方案中,该免疫响应针对未附着于细胞的mic多肽,也称为可溶性mic多肽。该可溶性mic可以为单体形式或多聚体形式。在另一实施方案中,该免疫响应针对表达mic多肽的癌细胞。该癌细胞可以是体外或体内的。在一个实施方案中,该疫苗组合物有效引发针对表达mic多肽的癌细胞的免疫响应。该癌细胞可以是体外或体内的。
15.在一个实施方案中,该mic多肽是mica或micb多肽,或含有mica和micb的α3结构域的融合蛋白。
16.任何表达mic的癌细胞可以使用本发明的组合物和方法来处理。在一个实施方案中,所述癌症选自前列腺癌、多发性骨髓瘤、多形性胶质母细胞瘤和黑素瘤。在一个实施方案中,该癌症是黑素瘤。
17.在一个实施方案中,该肽包含以下或由以下组成:一种或更多种的seq id no 8
‑
13,或与其任意一种具有90%或95%的氨基酸序列同一性的肽。在一个实施方案中,该肽包含以下或由以下组成:一种或更多种的seq id no 15
‑
23,或与其任意一种具有90%或95%的氨基酸序列同一性的肽。
18.在一个实施方案中,该疫苗组合物包含多种肽,所述肽选自两种或更多种的seq id no 5
‑
10,或与其任意一种具有95%的氨基酸序列同一性的肽;或选自两种或更多种的seq id no 8
‑
13,或与其任意一种具有90%的氨基酸序列同一性的肽。在一个实施方案中,该疫苗组合物包含多种肽,所述肽选自两种或更多种的seq id no 15
‑
20,或与其任意一种具有95%的氨基酸序列同一性的肽;或选自两种或更多种的seq id no 21
‑
23,或与其任意一种具有90%的氨基酸序列同一性的肽。
19.在一个实施方案中,该肽缀合到载体蛋白上。在一个实施方案中,该载体蛋白选自破伤风毒素和白喉毒素。
20.在一个实施方案中,该疫苗组合物包含病毒衣壳蛋白,所述病毒衣壳蛋白经改造以便在其表面上显示所述至少一种肽或多种肽。在一个实施方案中,该病毒衣壳蛋白是乙型肝炎衣壳蛋白。
21.在一个实施方案中,该疫苗组合物为包含所述至少一种肽或多种肽的聚合物支架的形式。在一个实施方案中,该聚合物支架是多孔的聚
‑
丙交酯
‑
共
‑
乙交酯(plg)聚合物支架。在一个实施方案中,该聚合物支架进一步包含gm
‑
csf蛋白和toll样受体激动剂的一者或两者。在一个实施方案中,该聚合物支架进一步包含要用该组合物治疗癌症的受试者的自体肿瘤细胞裂解物。
22.本发明还提供了通过向受试者施用本文中描述的疫苗组合物来治疗受试者的癌症的方法。在一个实施方案中,施用本发明的疫苗组合物作为治疗方案的一部分。在一个实施方案中,该治疗方案进一步包括放射疗法、免疫疗法、化学疗法或靶向疗法的一种或更多种。在一个实施方案中,该方法包括施用至少两种、优选三种独立的本发明的疫苗组合物作为初免
‑
加强(prime
‑
boost)策略的一部分,各种疫苗组合物具有彼此不同的免疫原。
23.本发明的其它特征和优点将由下列详述和附图以及由权利要求清楚可见。
附图说明
24.图1:在mica*100参考结构上的表位的作图。使用重叠肽阵列进行表位作图。各个肽为20个氨基酸线性序列,每个肽具有10个氨基酸偏移(offset)。
25.图2a和2b:在常见mica与micb等位基因中的表位保护。
26.图3包括图3a
‑
3c;其中:图3a和3b:具有适当放置的mic抗体的表位的嵌合蛋白设计。将mica abs 28和29的表位(以蓝色和红色突出显示)置入具有类似ig结构域结构的不相关的蛋白,人cmv蛋白ul18。比较mica a3(a)和嵌合蛋白(b)的结构显示了对mica抗体28和29的表位的保护。
27.图3c:嵌合蛋白的序列与mica和ul18序列(c)比对。结合到人lir的ul18的残基发生突变(以白色显示)。mica的残基206和210是多态的(分别为g/s和w/r)。
28.图4包括图4a
‑
4c;其中:图4a和4b:用于显示mica表位的二硫键稳定性最小
‑
mica的设计。最小
‑
mica蛋白设计为将b细胞响应集中于蛋白的关键部分。引入二硫键(绿色)以稳定mica ab29表位的构象。连接ab28和ab29表位的β链被删除(deleted)以降低蛋白柔性和改善溶解性。要注意的是,最小
‑
mica蛋白的n和c末端紧邻,这使得能够在乙型肝炎核衣壳的表面上显示。蓝色
–
ab28表位,红色
–
ab29表位。
29.图4c:最小
‑
mica的序列与mica比对。
30.图5包括图5a
‑
5d;其中:图5a
‑
5d是描述人抗mica抗体的治疗活性的一系列图表。图5a是描述用人u937肿瘤细胞(每周3
×
100微克ab)的scid植入小鼠的aml ab2改善的存活率。在x轴上显示经过的天数,并在y轴上显示百分比存活率。图5b是描述抗体治疗显著降低了通过elisa测得的获治小鼠血清中的smica浓度的图表。在x轴上显示治疗持续时间,并在y轴上显示血清中的smica浓度。图5c和5d显示在治疗一周后,mica抗体减少了肿瘤匀浆中的smica(归一化至肿瘤质量;参见图5c),并提高了肿瘤细胞表面上的mica表达,如通过流式细胞仪分析的那样(参见图5d)。图5c中的x轴显示实验条件,且y轴显示肿瘤匀浆中的smica浓度。图5d中的x轴显示实验条件,且y轴显示平均荧光强度(mfi)。
31.图6包括图6a
‑
6f;其中:图6a
‑
6f是描述人抗体在肿瘤中增强nk细胞聚积和功能的一系列图表。对于这些数据,带有u937肿瘤的scid小鼠用mica mabs(3
×
100微克)治疗一周,并评价nk细胞功能。图6a、6b和6c显示该抗体治疗提高了通过肿瘤浸润cd45
nk1.1
nk细胞的nkg2d(参见图6a)和nkp46(参见图6b)的表面水平,并在肿瘤中诱导nk细胞聚积(参见图6c,归一化至1
×
105个cd45
细胞)。图6d和6e显示治疗提高了通过肿瘤浸润cd45
nk.1
nk细胞的ifnγ(参见图6d)和穿孔素(参见图6e)表达。图6f描述了所有三种人mica抗体提高了通过脾细胞进行的
51
cr标记的yac
‑
1细胞的间接体内(ex vivo)杀灭。
具体实施方式
32.本发明提供了通过引发针对mic多肽的免疫响应治疗受试者的癌症的组合物和方法。术语“引发”、“刺激”和“诱导”可互换使用以表示在受试者中生成新生免疫响应或表示提高了现有免疫响应的强度或持久性。本发明的组合物含有至少一种mic肽作为免疫原性组分(在本文中也称为“免疫原”),其包含mica[seq id no:1]或micb[seq id no:14]的全长α3结构域[seq id no:1]或由其组成。在某些实施方案中,该mic肽是选自seq id no:2
‑
13或seq id no:15
‑
23的表位。
[0033]
在本发明的上下文中,表位是抗原分子的部分,其能够引发对该分子的免疫响应(优选细胞毒性t细胞响应或抗体分泌b细胞介导的响应)或可以被抗体结合。本发明人确定了作为cm33322 ab4、cm33322 ab28和cm33322 ab29的抗体结合表位的由seq id no:11
‑
13
和21
‑
23表示的最小表位,其描述在美国临时申请号61/792,034与61/913,198和美国申请号14/025,573中。从响应免疫疗法的癌症患者中分离这些抗体。这些抗体通过抑制mic蛋白从癌细胞上断裂增强了nk细胞与cd8 t细胞对抗癌细胞的活性。该抗体结合到mic蛋白的α3结构域上并在相关动物模型中具有强抗肿瘤活性。这些临床免疫学研究证明,针对mic蛋白α3结构域诱导抗体恢复了对抗癌症的抗肿瘤免疫功能。按照本发明,被这些抗体识别的表位可以用作癌症疫苗的免疫原性组分以刺激针对micα3结构域的抗体产生。本发明的一个重要要素在于,产生抗体对抗micα3结构域,但是不对抗mic的α1
‑
α2结构域,只要nk细胞和cd8 t细胞上的nkg2d受体结合到所述α1
‑
α2结构域。因此,本发明提供对人体中有效的抗mic免疫响应而言重要的mica和b蛋白的表位,以及涉及使用其作为癌症疫苗的免疫原性组分的方法和组合物。
[0034]
表1:抗体结合表位在mica*001参考序列(seq id no:1)的氨基酸序列中的位置。表位以粗体显示并加下划线。
[0035][0036]
表2:被来自响应癌症免疫疗法的患者的人抗体识别的mica表位(表位加下划线)
[0037][0038]
表3:具有短侧翼序列的mica表位
[0039][0040]
表4:最小mica表位
[0041][0042]
表5:在micb参考序列(seq id no:14)中被来自响应癌症免疫疗法的患者的人抗体识别的micb表位(表位加下划线)
[0043][0044]
表6:具有短侧翼序列的micb表位
[0045]
[0046][0047]
表7:最小micb表位
[0048][0049]
本发明提供了适于施用于人类的疫苗组合物,包含至少一种mic肽作为免疫原性组分。在一个实施方案中,所述至少一种mic肽包含mica或micb的全长α3结构域或由其组成,该结构域对应于参考序列,[seq id no:1]的氨基酸181至274。在另一实施方案中,所述至少一种肽包含选自seq id no:2
‑
13或seq id no:15
‑
23的任一种的mic肽的肽表位或由其组成。在一个实施方案中,所述至少一种肽由选自seq id no:11
‑
13或seq id no:21
‑
23的肽表位和一个或更多个侧翼氨基酸组成。在这方面,术语“侧翼氨基酸”指的是在全长参考序列[对mica为seq id no:1,或对micb为seq id no:14]中相邻于肽表位序列的氨基酸。在某些实施方案中,至少一个肽表位在其n末端或c末端、或两者上包含2、4、6、8或10个侧翼氨基酸。在一个实施方案中,所述至少一种肽由选自seq id no:11
‑
13或seq id no:21
‑
23的肽表位和一个或更多个侧翼氨基酸组成,使得所述肽由大约25至30个氨基酸组成,或适于有效诱导响应mic蛋白的抗体的长度。
[0050]
在一个实施方案中,该疫苗组合物包含选自seq id no:2
‑
13或seq id no:15
‑
23的mic肽的至少两种肽表位作为其免疫原性组分。在一个实施方案中,该疫苗组合物包含选自seq id no:2
‑
4或seq id no:15
‑
23的mic肽的至少两种肽表位作为其免疫原性组分。在一个实施方案中,该疫苗组合物包含选自seq id no:5
‑
10的mic肽的至少两种肽表位作为其免疫原性组分。在一个实施方案中,该疫苗组合物包含选自seq id no:11
‑
13或seq id no:21
‑
23的mic肽的至少两种肽表位作为其免疫原性组分。
[0051]
在一个实施方案中,该疫苗组合物包含选自seq id no:2
‑
13或seq id no:15
‑
23的mic肽的一种或更多种肽表位作为其免疫原性组分,其中所述肽表位为线性序列形式。在一个实施方案中,该肽表位为结构约束环形式。在一个实施方案中,所述肽保留其天然二级结构,例如为一种或更多种环的形式。在一个实施方案中,使用二硫键或化学接头产生该环。优选地,该环适于模拟人类蛋白上mic表位的三维构象。
[0052]
在另一实施方案中,该疫苗组合物包含编码seq id no:2
‑
13或seq id no:15
‑
23的肽的一种或更多种的核酸。该核酸可以为表达载体的形式,例如质粒或病毒载体,或者该核酸可以包装到纳米粒子中。在一个实施方案中,该核酸通过注射递送至受试者。在一个实
施方案中,该核酸作为纯化dna或以纳米粒子形式注射。在一个实施方案中,注射已经修饰以表达该核酸的修饰免疫细胞。在一个实施方案中,经由用包含该核酸的载体体外转染或感染来修饰该免疫细胞。
[0053]
在一个实施方案中,该疫苗组合物包含多种肽作为其免疫原性组分,所述多种肽包含选自seq id no:2
‑
13或seq id no:15
‑
23的两种或更多种肽或由其组成。在一个实施方案中,所述多种肽包含选自seq id no:2
‑
4或seq id no:15
‑
23的至少两种肽或由其组成。在一个实施方案中,所述多种肽包含选自seq id no:5
‑
10的至少两种或由其组成。在一个实施方案中,所述多种肽包含选自seq id no:11
‑
13或seq id no:21
‑
23的至少两种或由其组成。
[0054]
在一个实施方案中,所述至少一种肽或所述多种肽缀合至含有mhc
‑
ii表位的第二肽。优选地,该第二肽的氨基酸序列由25个氨基酸或更少、或15个氨基酸或更少组成。在特定实施方案中,该第二肽由9
‑
12个氨基酸、10
‑
18个氨基酸、或8
‑
18个氨基酸组成。优选地,该第二肽含有t细胞表位或b细胞表位。在一个实施方案中,该t细胞表位是有效增强b细胞分化成产生抗体的浆细胞的t辅助细胞表位,或细胞毒性t细胞表位。在一个实施方案中,该表位是不同的mhc等位基因的覆盖型表位,或通过许多mhc同种异型呈递的表位。在另一实施方案中,该表位是由不同的mhc等位基因呈递的肽。
[0055]
构成或混入本发明的疫苗组合物中的肽优选经纯化以除去污染的化学前体(如果化学合成的话),或基本不含来自它们所衍生自的细胞或组织来源的细胞材料。在特定实施方案中,该肽是60%,优选65%、70%、75%、80%、85%、90%、95%或99%不含污染的化学前体、蛋白、脂质或核酸。在优选实施方案中,该肽基本不含污染病毒。优选地,用于施用于受试者的各组合物是至少95%、至少97%、或至少99%不含污染病毒。
[0056]
在一个实施方案中,本发明的疫苗组合物的至少一种肽或多种肽包含一种或更多种至少90%、至少95%、至少98%、或至少99%与选自seq id no:2
‑
13、seq id no:5
‑
10、seq id no:11
‑
13、seq id no:15
‑
20和seq id no:21
‑
23的任一种的肽相同的肽或由其组成。
[0057]
在一个实施方案中,所述至少一种肽或多种肽包含一种或更多种至少90%、至少95%、至少98%、或至少99%与选自seq id no:2
‑
13或seq id no:15
‑
23的任一种的肽类似的肽或由其组成。在这方面,术语“类似”指的是根据相对于参考序列在查询序列中保守性和非保守性氨基酸变化的数量定义的氨基酸序列相似度。保守性和非保守性氨基酸变化在本领域是已知的。参见,例如w.r.taylor,the classification of amino acid conservation,j.theor.biol.1986 119:205
‑
218和d.bordo与p.argos,suggestions for"safe"residue substitutions in site
‑
directed mutagensis,1991 j.mol.biol.217:721
‑
729。通常,保守性氨基酸变化指的是一种氨基酸置换另一种具有基本类似的化学性质的氨基酸,特别是参照氨基酸侧链。非保守性变化指的是一种氨基酸置换另一种具有显著不同的化学性质的氨基酸。通常,保守性置换是本领域中被认为不太可能影响多肽的整体结构或生物功能的那些,而非保守性变化被认为更有可能影响结构和功能。
[0058]
保守性氨基酸变化的非限制性实例包括在下列组中的氨基酸的置换:脂族、芳族、极性、非极性、酸性、碱性、可磷酸化疏水性、亲水性、小非极性、小极性、大非极性和大极性。非保守性氨基酸变化的非限制性实例包括前述组之间的氨基酸置换。
[0059]
在一个实施方案中,保守性氨基酸变化是其中所述残基对的置换矩阵具有正值的置换。氨基酸置换矩阵的实例在本领域中是已知的,例如blosum50矩阵或pam250矩阵(参见w.a.pearson,rapid and sensitive sequence comparison with fastp and fasta,meth.enzymology,1990 183:63
‑
98,r.doolittle编辑,academic press,san diego)。打分矩阵(scoring matrices)的其它实例和它们之间的比较参见m.s.johnson和j.p.overington,1993,a structural basis for sequence comparisons:an evalution of scoring methodologies,j.mol.biol.233:716
‑
738。
[0060]
在优选实施方案中,保守性氨基酸变化是一个氨基酸置换相同化学组中的另一个氨基酸,其中所述组选自中性和极性的氨基酸(ser、thr、pro、ala、gly、asn、gln),带负电荷和极性的氨基酸(asp、glu),带正电荷和极性的氨基酸(his、arg、lys),缺乏环结构的非极性氨基酸(met、ile、leu、val),具有环结构的非极性氨基酸(phe、tyr、trp)和半胱氨酸。
[0061]
在一个实施方案中,本发明的疫苗组合物包含嵌合蛋白作为其免疫原性组分,所述嵌合蛋白由两个或更多个独立地选自seq id no2
‑
13或seq id no:15
‑
23的mic肽表位组成,其中所述表位是连接的。在一个实施方案中,所述两个或更多个mic肽表位是相同的表位。在另一实施方案中,所述两个或更多个mic肽表位包含至少两个不同的mic肽表位。在一个实施方案中,该疫苗组合物包含在病毒衣壳如乙型肝炎核衣壳的表面上显示的嵌合蛋白作为其免疫原性组分。
[0062]
在一个实施方案中,本发明的疫苗组合物包含嵌合蛋白作为其免疫原性组分,所述嵌合蛋白由置入具有与mica相比类似的整体免疫球蛋白折叠的免疫球蛋白(ig)结构域中的选自seq id no 2
‑
13或seq id no:15
‑
23的两个或更多个mic肽表位组成。在一个实施方案中,该ig结构域是选自以下之一的ig结构域:ul18(人cmv)、ifn
‑
α/β结合蛋白c12r的c端ig结构域(痘病毒诱骗受体,pdb id:3oq3)、来自t4样噬菌体的外衣壳蛋白的n端ig结构域(hoc,pdb id:3shs)和人cmv蛋白us2(pdb id:1im3)。
[0063]
在一个实施方案中,本发明的疫苗组合物包含适于单独施用的两种独立组分,第一组分包含由第一mic肽组成的免疫原,所述第一mic肽包含mica[seq id no:1]或micb的全长α3结构域或由其组成;第二组分包含由一个或更多个选自seq id no 2
‑
13或seq id no:15
‑
23的mic肽表位组成的免疫原。在一个实施方案中,该疫苗组合物包含含有由第一mic肽组成的免疫原的第一组分,所述第一mic肽包含mica[seq id no:1]的全长α3结构域或由其组成;以及一种或更多种附加组分,所述附加组分各自包含由一个或更多个选自seq id no 2
‑
13或seq id no:15
‑
23的mic肽表位组成的免疫原。优选地,第一组分以初免
‑
加强方式根据本领域中已知的方法在第二组分或附加组分之前施用。
[0064]
在与任意前述实施方案一致的一个实施方案中,本发明的疫苗组合物可以包含一个或更多个编码seq id no 1
‑
23的mic表位的多核苷酸序列。在进一步的实施方案中,编码一个或更多个mic表位的dna为包含该dna的纳米粒子的形式。
[0065]
肽变体
[0066]
在一些情况下,本文中公开的肽的氨基酸序列可以被修饰和改变以产生例如肽变体(例如对本文中公开的肽具有限定的序列同源性的肽),只要该肽变体的抗原结合性质相对于未修饰肽得以保持或改善(可以使用本文中描述的体外和/或体内测定和/或本领域中已知的技术来评估任何修饰肽的抗原结合性质)。
[0067]
虽然通常在氨基酸水平上观察和讨论肽变体,实际修饰通常在核酸水平上引入或进行。例如,通过使用本领域已知的技术(例如克隆技术)修饰编码肽或其部分/片段的核酸,可以生成与本发明的肽具有80%、85%、90%、95%、96%、97%、98或99%氨基酸序列同一性的变体。
[0068]
氨基酸序列修饰通常落入三类中的一类或更多类:置换性修饰、插入性修饰或缺失性修饰。插入包括氨基和/或端部融合以及单个或多个氨基酸残基的序列内插入。插入一般是将比氨基或羧基端部融合的那些更小的插入,例如大约一至四个残基。缺失的特征是从蛋白序列中除去一个或更多个氨基酸残基。通常,在蛋白分子中的任何一个位置处删除不超过大约2至6个残基。氨基酸置换通常为单一残基,但是可以一次性在多个不同位置处发生;插入通常将为近似约1至10个氨基酸残基;且缺失将为大约1至30个残基的范围。缺失或插入可以以相邻对进行,即缺失2个残基或插入2个残基。置换、缺失、插入或其任意组合可以组合以达成最终构建物(construct)。突变必须不将序列放置在阅读框之外,并优选将不生成能够产生二级mrna结构的互补区。置换性修饰是其中至少一个残基已经被除去并在其位置中插入不同残基的那些。在一些情况下,置换可以是保守性氨基酸置换。在一些情况下,本文中的肽相对于本发明的肽可以包括一个或更多个保守性氨基酸置换。例如,相对于表1中显示的肽,变体可以包括1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、20
‑
30、30
‑
40或40
‑
50个保守性氨基酸置换。或者,相对于表1中显示的肽,变体可以包括50个或更少、40个或更少、30个或更少、20个或更少、10个或更少、9个或更少、8个或更少、7个或更少、6个或更少、5个或更少、4个或更少、3个或更少、或者2个或更少保守性氨基酸置换。通常根据下表2进行此类置换,并将其称为保守性置换。预测对蛋白修饰的耐受性的方法在本领域中是已知的(参见,例如guo等人,proc.natl.acad.sci.,usa,101(25):9205
‑
9210(2004))。
[0069]
表2:保守性氨基酸置换
[0070][0071]
在一些情况下,置换并非保守性的。例如,表1中显示的肽中的氨基酸可以被可改变该肽的某些性质或方面的氨基酸替代。在一些情况下,可以进行非保守性氨基酸置换以例如改变肽的结构、改变肽的结合特性(例如提高或降低肽对抗原的结合亲和力和/或改变提高或降低肽对抗原的结合特异性)。
[0072]
在一些情况下,肽和/或肽变体可以包括或可以是表1中显示的肽的片段。此类片段可以包括比表1中所示的cdrs、frs和/或aas少例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36 37、38、39、40、41、42、43、44、45、46、47、48、49、50、50
‑
100、101
‑
150个的氨基酸,例如,只要该片段保留该全长肽的至少部分结合特性(例如该全长肽的至少50%、60%、70%、80%、90%或100%的结合特性)。可以在氨基末端、羧基末端和/或本文中的肽内进行截断。
[0073]
在一些情况下,肽变体的相互作用面可以与未修饰的肽相同(例如基本相同),以便例如相对于未修饰的肽改变(例如提高或降低)、保留或保持该肽变体的结合特性。识别肽的相互作用面的方法在本领域中是已知的(gong等人,bmc:bioinformatics,6:1471
‑
2105(2007);andrade和wei等人,pure and appl.chem.,64(11):1777
‑
1781(1992);choi等人,proteins:structure,function,and bioinformatics,77(1):14
‑
25(2009);park等人,bmc:and bioinformatics,10:1471
‑
2105(2009))。
[0074]
本领域技术人员容易理解如何确定两个多肽的同一性(例如未修饰的肽和肽变体)。例如可以在比对两个序列以使得同一性处于其最高水平之后计算该同一性。计算同一性的另一种方法可通过公布的算法来进行。用于比较的序列的最佳比对可以通过以下方法
来进行:smith和waterman,adv.appl.math,2:482(1981)的局部同一性算法、needleman和wunsch,j.mol.biol.48:443(1970)的同一性比对算法、pearson和lipman,proc.natl.acad.sci.usa 85:2444(1988)的搜索相似性方法、这些算法的计算机化实施(wisconsin遗传学软件包中的gap、bestfit、fasta和tfasta,遗传学计算机组,575science dr.,madison,wi)或通过检测(inspection)。
[0075]
通过例如zuker,science 244:48
‑
52(1989);jaeger等人,proc.natl.acad.sci.usa 86:7706
‑
10(1989);jaeger等人,methods enzymol.183:281
‑
306(1989)中公开的算法可以对核酸获得相同类型的同一性,对于至少涉及核酸比对的材料,所述文献通过引用并入本文。要理解的是,通常可以使用任何方法,并且在某些情况下,这些各种方法的结果可能不同,但是本领域技术人员理解如果采用这些方法的至少一种发现同一性,该序列将据说具有所述同一性且欲公开在本文中。
[0076]
在一些情况下,如在下文中方法段落中更详细描述的那样,本文中公开的治疗组合物可以使用从使用本文中公开的方法获得的免疫细胞(例如b细胞,包括记忆b细胞)中分离和/或纯化的遗传物质(例如dna和/或mrna)来制造。一旦获得此类遗传物质,使用其制造本文中公开的治疗组合物的方法在本领域中是已知的和/或总结在下文中。
[0077]
在一些情况下,肽可以包括可检测标记物。本文中所用的“标记物”指的是一个部分,其具有使得所述标记物连向的肽能够被检测的并入该部分中的至少一种元素、同位素或官能团。标记物可以直接连接(即经由键)或可以通过接头连接(如,诸如,例如环状或无环的、支化或非支化的、取代或未取代的亚烷基;环状或无环的、支化或非支化的、取代或未取代的亚烯基;环状或无环的、支化或非支化的、取代或未取代的亚炔基;环状或无环的、支化或非支化的、取代或未取代的亚杂烷基;环状或无环的、支化或非支化的、取代或未取代的亚杂烯基;环状或无环的、支化或非支化的、取代或未取代的亚杂炔基;取代或未取代的亚芳基;取代或未取代的亚杂芳基;或取代或未取代的亚酰基,或其任意组合,其可以组成接头)。标记物可以在不干扰被检测的本发明的多肽的生物活性或特性的任何位置处连接到肽上。
[0078]
标记物可以包括:含有同位素部分的标记物,所述同位素可以是放射性同位素或重同位素,包括但不限于2h、3h、
13
c、
14
c、
15
n、
31
p、
32
p、
35
s、
67
ga、
99m
tc(tc
‑
99m)、
111
in、
123
i、
125
i、
169
yb和
186
re;包括免疫或免疫反应性部分的标记物,其可以是抗体或抗原,其可以键合到酶(例如辣根过氧化物酶);彩色的、发光的、磷光的或包括荧光部分的标记物(例如荧光标记物fitc);具有一个或更多个光亲和部分的标记物;具有配体部分的标记物,所述配体部分具有一个或更多个已知的结合配偶体(binding partner)(如生物素
‑
抗生蛋白链菌素、fk506
‑
fkbp等等)。
[0079]
在一些情况下,标记物可以包含一个或更多个光亲和部分以便直接解析生物系统中的分子间相互作用。可以采用多种已知的发光团(photophores),大多数依靠重氮化合物、叠氮化物、或双吖丙啶(diazirine)向氮宾或卡宾的光转换(参见例如bayley,h.,photogenerated reagents in biochemistry and molecular biology(1983),elsevier,amsterdam,其全部内容通过引用并入本文)。在本发明的某些实施方案中,所用的光亲和标记物是被一个或更多个卤素部分取代的邻
‑
、间
‑
和对
‑
叠氮基苯甲酰,包括但不限于4
‑
叠氮基
‑
2,3,5,6
‑
四氟苯甲酸。
[0080]
标记物也可以是或可以充当显像剂。示例性显像剂包括但不限于用于正电子放射断层造影术(pet)、计算机辅助断层造影术(cat)、单光子发射计算机断层造影术、x射线、荧光镜透视检查和磁共振成像(mri)的那些;止吐剂;和对比剂。示例性诊断剂包括但不限于荧光部分、发光部分、磁性部分;钆螯合物(例如含有dtpa、dtpa
‑
bma、dota和hp
‑
do3a的钆螯合物)、铁螯合物、镁螯合物、锰螯合物、铜螯合物、铬螯合物、可用于cat和x射线成像的碘基材料、以及放射性核素。合适的放射性核素包括但不限于
123
i、
125
i、
130
i、
131
i、
133
i、
135
i、
47
sc、
72
as、
72
se、
90
y、
88
y、
97
ru、
100
pd、
101
mrh、
119
sb、
128
ba、
197
hg、
211
at、
212
bi、
212
pb、
109
pd、
111
in、
67
ga、
68
ga、
67
cu、
75
br、
77
br、
99
mtc、
14
c、
13
n、
15
o、
32
p、
33
p和
18
f。
[0081]
荧光和发光部分包括但不限于通常称为“染料”、“标记物”或“指示剂”的多种不同的有机或无机小分子。实例包括但不限于荧光素、罗丹明、吖啶染料、alexa染料、花青染料等等。荧光和发光部分可以包括多种天然存在的蛋白及其衍生物,例如基因工程变体。例如,荧光蛋白包括绿色荧光蛋白(gfp),增强的gfp,红色、蓝色、黄色、青色和蓝宝石荧光蛋白,造礁珊瑚荧光蛋白等等。发光蛋白包括荧光素酶、水母蛋白及其衍生物。许多荧光和发光染料和蛋白在本领域是已知的(参见例如美国专利公开2004/0067503;valeur,b.,“molecular fluorescence:principles and applications”,john wiley and sons,2002;以及handbook of fluorescent probes and research products,molecular probes,第9版,2002)。
[0082]
用于本发明的疫苗组合物的肽可以合成制造。在某些实施方案中,替换一个或更多个肽键以例如提高肽的生理稳定性,通过:反向
‑
翻转键(retro
‑
inverso bond)(c(o)
‑
nh);还原酰胺键(nh
‑
ch2);硫亚甲基键(s
‑
ch2或ch2‑
s);氧亚甲基键(o
‑
ch2或ch2‑
o);亚乙基键(ch2‑
ch2);硫代酰胺键(c(s)
‑
nh);反式烯烃键(ch=ch);氟取代的反式烯烃键(cf=ch);酮亚甲基键(c(o)
‑
chr或chr
‑
c(o),其中r为h或ch3);和氟
‑
酮亚甲基键(c(o)
‑
cfr或cfr
‑
c(o),其中r为h或f或ch3)。
[0083]
在某些实施方案中,所述肽通过乙酰化、酰胺化、生物素酰化、肉桂酰化、法尼基化、荧光素化(fluoresceination)、甲酰化、豆蔻酰化、棕榈酰化、磷酸化(ser、tyr或thr)、硬脂酰化、琥珀酰化和磺酰化的一种或更多种进行修饰。
[0084]
在一个实施方案中,所述至少一种肽或多种肽缀合到载体蛋白上。在一个实施方案中,该载体蛋白选自破伤风毒素和白喉毒素。在另一实施方案中,修饰肽以便通过针对肽酶活性加以防护来延长体内半衰期,例如us 2009/0175821中所述。在一个实施方案中,所述肽或修饰肽进一步缀合至聚乙二醇(peg)、烷基(例如c1
‑
c20直链或支链烷基)、脂肪酸基团及其组合。
[0085]
在一个实施方案中,所述多种肽保持天然二级结构,例如为短二硫键连接的环。在另一实施方案中,使用二硫键或通过将肽暴露于化学接头或交联剂生成环形式的二级结构。
[0086]
在一个实施方案中,该疫苗组合物包含病毒衣壳蛋白,所述病毒衣壳蛋白经改造以便在其表面上显示所述至少一种肽或多种肽。在一个实施方案中,该病毒衣壳蛋白是乙型肝炎衣壳蛋白,例如描述在proc natl acad sci u s a.1999mar 2;96(5):1915
‑
20中。
[0087]
在一个实施方案中,所述至少一种肽或多种肽包含在胶束或纳米粒子结构中。使用胶束可以有利地例如保持肽二级结构,如j.am.chem.soc.,1998,120(39),第9979
–
9987
页中所述。
[0088]
支架实施方案
[0089]
在一个实施方案中,该疫苗组合物包含蛋白支架或为蛋白支架形式,并且所述至少一种肽或多种肽包含在该支架内。特别优选的支架是多孔的聚
‑
丙交酯
‑
共
‑
乙交酯(plg)聚合物支架。在一个实施方案中,该支架进一步包含gm
‑
csf蛋白和toll样受体激动剂的一种或两种。在一个实施方案中,该toll样受体激动剂包含未甲基化cpg寡核苷酸(tlr9激动剂)或由其组成。该支架还可以含有自体肿瘤细胞裂解物,其中自体参照治疗的受试者(即受试者自己的肿瘤细胞的裂解物)。在一个实施方案中,该支架是us 2013/0202707、wo 2011/063336和us 2012/0100182中描述的wdvax支架。该支架还描述在2009年1月11日在线出版的nature materials,doi:10.1038/nmat2357和science translation medicine,sci transl med 1,8ra19(2009);doi:10.1126/scitranslmed.3000359中。
[0090]
添加剂和佐剂
[0091]
本发明的疫苗组合物可以进一步包含一种或更多种药学上可接受的添加剂或佐剂。在一个实施方案中,该疫苗组合物不包含佐剂。在一个实施方案中,所述一种或更多种佐剂选自油基佐剂、cpg dna佐剂、矿物盐佐剂、矿物盐凝胶佐剂、颗粒佐剂、微粒佐剂、粘膜佐剂和细胞因子。
[0092]
佐剂可以包含任意数量的递送系统,例如矿物盐、表面活性剂、合成微颗粒、水包油乳液、免疫刺激性复合物、脂质体、病毒体和病毒样颗粒。佐剂进一步包含一种或更多种免疫响应增效剂如微生物衍生物(例如细菌产物,毒素如霍乱毒素和来自大肠杆菌的不耐热毒素,脂质,脂蛋白,核酸,肽聚糖(peptidogylcans),碳水化合物,肽)、细胞、细胞因子(例如树突细胞、il
‑
12和gm
‑
csf)、激素和小分子。预期的佐剂包括但不限于油基佐剂(例如弗氏佐剂)、cpg寡核苷酸(参见klinman 2003 expert rev.vaccines 2:305
‑
15)、铝盐佐剂、钙盐佐剂、乳液和表面活性剂基制剂(例如mf59、aso2、montanide、isa
‑
51、isa
‑
720和qa21)。在疫苗佐剂方面的改进的回顾参见pashine等人.2005,nature med.11(4):s63
‑
s68。
[0093]
在一个实施方案中,该佐剂包含一种或更多种toll样受体(tlr)激动剂或由其组成。在一个实施方案中,该tlr激动剂是病原体相关激动剂,选自三酰脂肽(革兰氏阳性菌)、肽聚糖(革兰氏阳性菌)、细菌脂蛋白、脂磷壁酸、lps(牙龈卟啉单胞菌,问号钩端螺旋体)、gpi
‑
锚定蛋白(克氏锥虫)、奈瑟氏球菌孔蛋白(neisserial porins)、血凝素(mv)、磷脂甘露聚糖(phospholipomannan)(念珠菌属)、lam(分枝杆菌)、ssrna病毒(wnv)、dsrna病毒(rsv、mcmv)、lps(革兰氏阴性菌)、f
‑
蛋白(rsv)、甘露聚糖(念珠菌属)、糖肌醇磷酸磷脂(锥虫属)、包膜蛋白(rsv和mmtv)、鞭毛蛋白(鞭毛菌)、酚可溶性调控蛋白(表皮葡萄球菌)、双酰脂肽(支原体)、lta(链球菌)、酵母聚糖(酵母属)、病毒ssrna(流行性感冒、vsv、hiv、hcv)、来自rna病毒的ssrna、dsdna病毒(hsv、mcmv)、疟原虫色素(疟原虫属)和未甲基化cpg dna(细菌和病毒)。
[0094]
在一个实施方案中,该tlr激动剂是选自pam3cys、cfa、malp2、pam2cys、fsl
‑
1、hib
‑
ompc、poly i:c;poly a:u、agp、mpl a、rc
‑
529、mdf2β、cfa、鞭毛蛋白、malp
‑
2、pam2cys、fsl
‑
1、鸟苷类似物、咪唑并喹啉(例如咪喹莫德、r848、瑞喹莫德)、洛索立宾、咪唑并喹啉、洛索立宾、sspolyu、3m
‑
012和cpg
‑
寡核苷酸的合
成配体。
[0095]
制剂
[0096]
本发明的疫苗组合物可以使用一种或更多种生理上可接受的载体或赋形剂来配制。例如,当组合物配制为液体时,其可以包含无菌盐水、葡萄糖溶液或缓冲溶液,或其它药学上可接受的无菌流体。在一个实施方案中,该制剂用于皮内或皮下施用。在一个实施方案中,该制剂用于吸入或吹入(通过口或鼻)。在一个实施方案中,该制剂用于经口、含服、肠胃外、阴道或直肠施用。本文所用的术语肠胃外包括皮下、皮内、静脉内、肌肉内、关节内、动脉内、滑膜内、胸骨内、鞘内、病灶内和颅内注射或输注技术。
[0097]
优选地,配制该疫苗组合物以提供肽组分在储存和运输过程中提高的化学稳定性。例如,在一个实施方案中,该制剂防止或减少肽的寡聚反应。在另一实施例中,该制剂防止或减少该肽的氨基酸残基的氧化。该制剂可以被冻干,或者可以是液体制剂。
[0098]
在一个实施方案中,配制该组合物用于注射。在优选实施方案中,该组合物是无菌的冻干制剂,基本不含污染性细胞物质、化学品、病毒或毒素。在特定实施方案中,在无菌单剂量容器中提供用于注射的制剂。该制剂可以含有或可以不含有添加的防腐剂。液体制剂可以采取诸如在油性或水性媒介物中的混悬剂、溶液或乳剂的形式,并且可以含有配制剂(formulatory agent)如悬浮剂、稳定剂和/或分散剂。
[0099]
在一个实施方案中,该制剂包含脂质体。
[0100]
在一个实施方案中,用一种或更多种用于治疗癌症的其它治疗剂配制本发明的疫苗组合物。
[0101]
本发明的疫苗组合物是药物组合物,并可以包括一种或更多种药学上可接受的载体、添加剂或媒介物。在一个实施方案中,所述一种或更多种药学上可接受的载体、添加剂或媒介物选自离子交换剂、氧化铝、硬脂酸铝、卵磷脂、自乳化药物递送系统(sedds)如d
‑
i
‑
生育酚聚乙二醇1000琥珀酸酯、在药物剂型中使用的表面活性剂如吐温(tween)或其它类似聚合物递送基质、血清蛋白如人血清白蛋白、缓冲物质如磷酸盐、甘氨酸、山梨酸、山梨酸钾、饱和植物脂肪酸的偏甘油酯混合物、水、盐或电解质如硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐、胶体二氧化硅、三硅酸镁、聚乙烯基吡咯烷酮、纤维素基物质、聚乙二醇、羧甲基纤维素钠、聚丙烯酸酯、蜡、聚乙烯
‑
聚氧丙烯
‑
嵌段聚合物、聚乙二醇和羊毛脂。环糊精如i
‑
、θ
‑
和k
‑
环糊精,也可以有利地用于提高本文中所述配方的化合物的递送。
[0102]
本发明的疫苗组合物还可以包含药学上可接受的酸、碱或缓冲剂以提高配制化合物或其递送形式的稳定性。
[0103]
在一个实施方案中,本发明的疫苗组合物为用于吸入和/或经鼻给药的溶液或粉末形式。此类组合物可以根据本领域中已知的技术使用适当的分散剂或润湿剂(诸如,例如吐温80)和悬浮剂来配制。无菌可注射制剂还可以是在无毒的肠胃外可接受稀释剂或溶剂中的无菌可注射溶液或悬浮液,例如作为在1,3
‑
丁二醇中的溶液。可以使用的可接受的媒介物和溶剂尤其是甘露醇、水、林格氏溶液和等渗氯化钠溶液。此外,无菌的固定油常规用作溶剂或悬浮介质。为此,可以使用任何温和的固定油,包括合成的单甘油酯或二甘油酯。脂肪酸,如油酸及其甘油酯衍生物可用于制备注射剂,因为是天然的药学上可接受的油,如橄榄油或蓖麻油,尤其是它们的聚氧乙烯化版本。这些油溶液或悬浮液还可以含有长链醇稀释剂或分散剂,或羧甲基纤维素或通常用于配制药学上可接受的剂型如乳剂和/或混悬
剂的类似分散剂。其它常用表面活性剂如吐温和司盘(span)和/或通常用于制造药学上可接受的固体、液体或其它剂型的其它类似乳化剂或生物利用度增强剂也可用于配制目的。
[0104]
在一个实施方案中,本发明的疫苗组合物为口服可接受的剂型形式,包括但不限于胶囊剂、片剂、乳剂和水性混悬剂、分散剂和溶液。在用于口服的片剂的情况下,通常使用的载体包括乳糖和玉米淀粉。通常还加入润滑剂如硬脂酸镁。为了以胶囊形式口服,可用的稀释剂包括乳糖和干燥的玉米淀粉。当口服水性混悬剂和/或乳剂时,该活性成分可以悬浮或溶解在与乳化剂和/或悬浮剂组合的油相中。如果需要的话,可以加入某些甜味剂和/或调味剂和/或着色剂。
[0105]
治疗和给药的方法
[0106]
本发明的疫苗组合物可用于预防和治疗癌症。因此,本发明提供了在处于患癌症风险下的受试者中预防癌症的方法和在需要此类治疗的受试者中治疗癌症的方法。在一个实施方案中,所述癌症选自前列腺癌、多发性骨髓瘤、多形性胶质母细胞瘤和黑素瘤。在一个实施方案中,所述癌症是黑素瘤。
[0107]
在一个实施方案中,本发明的疫苗组合物施用于患有与mica过度表达相关的癌症的受试者。在一个实施方案中,所述癌症选自黑素瘤、肺癌、乳腺癌、肾癌、卵巢癌、前列腺癌、胰腺癌、胃癌和结肠癌、淋巴瘤或白血病。在一个实施方案中,所述癌症是黑素瘤。在一个实施方案中,所述癌症是浆细胞恶性肿瘤,例如,多发性骨髓瘤(mm)或浆细胞的癌前病症。在一些实施方案中,受试者已被诊断为患有癌症或易患癌症。
[0108]
本发明的疫苗组合物可以单独施用,或作为如下所述的治疗方案或组合治疗的一部分施用。本发明的疫苗组合物还可以单独施用,或多次施用,例如以初免
‑
加强策略施用。在这方面,术语“初免
‑
加强”指的是连续使用两种不同的免疫原。这两种不同的免疫原通常在一段时间后相继施用,如10至30天或10至60天。在一个实施方案中,该时间段为2至4周。由此,例如,在一个实施方案中,本发明的疫苗组合物在时间0施用,且本发明的第二疫苗组合物(包含不同的免疫原)在一段时间后施用,例如10至30天,10至60天,或2至4周。
[0109]
在一个实施方案中,一种或多种不同的本发明的疫苗组合物如us 8,110,196中所述在多个部位处施用于受试者。优选地,各部位引流至淋巴结或一组淋巴结。在一个实施方案中,本发明的疫苗组合物施用于引流至两个或更多个淋巴结的多个部位,所述淋巴结选自头颈部的淋巴结、腋淋巴结、气管支气管淋巴结、壁淋巴结、胃淋巴结、回结肠淋巴结以及腹股沟和腹股沟下(subinguinal)淋巴结。在另一实施方案中,该部位选自右臂、左臂、右大腿、左大腿、右肩、左肩、右乳房、左乳房、腹部、右臀和左臀。在一个实施方案中,该部位是或引流至未包膜的淋巴组织簇,其选自扁桃体、腺样增殖体、阑尾和派尔集合淋巴结。在一个实施方案中,本发明的疫苗组合物施用于引流至脾脏的部位。
[0110]
在一个实施方案中,各疫苗组合物通过独立地选自皮内、皮下、透皮、肌肉内、经口、直肠、阴道、通过吸入及其组合的途径施用。在一个实施方案中,至少一种组合物直接注射到不同解剖部位的淋巴结、淋巴结簇或未包膜的淋巴组织簇。
[0111]
本发明的方法包括任何合适的给药途径,例如皮内、皮下、静脉内、肌肉内或粘膜。粘膜给药途径包括但不限于口服、直肠、阴道和鼻内给药。在优选实施方案中,至少一种组合物透皮、皮内、皮下、经口、直肠、阴道或通过吸入来给药。美国食品与药品管理局(food and drug administration,fda)批准的任何途径可用于本发明的疫苗组合物。示例性给药
方法描述在fda的cder data standards manual,版本号004(其可以在fda.give/cder/dsm/drg/drg00301.htm处获得)。
[0112]
优选地,选择给药途径以便将组合物靶向特定部位,例如通过直接注射至淋巴结或淋巴结簇、通过口服以靶向胃淋巴结、通过肛门给药以靶向直肠淋巴结、通过吸入或气溶胶靶向肺淋巴结、或通过任何其它合适的给药途径。
[0113]
在本发明的方法包括向多个部位施用疫苗组合物的情况下,各组合物优选基本同时施用,例如,在一到八小时内或在相同的出诊期间。在一个实施方案中,各组合物在一至二小时内、在一至三小时内、在一至四小时内或在一至五小时内施用。
[0114]
当该疫苗组合物为支架形式时,为受试者接种的方法包括将支架组合物植入受试者体内,优选皮下植入。在某些实施方案中,为受试者接种的方法可以包括在受试者解剖结构的两个或更多个区域中植入或注射该支架疫苗组合物。
[0115]
在一个实施方案中,本发明的方法进一步包括向受试者施用抗原呈递细胞,该抗原呈递细胞已经用至少一种选自seq id no:2
‑
13的mic肽致敏。在优选实施方案中,该抗原呈递细胞是树突细胞。
[0116]
在一个实施方案中,该方法进一步包括向受试者施用一种或更多种佐剂。在一个实施方案中,所述一种或更多种佐剂选自油基佐剂、cpg dna佐剂、矿物盐佐剂、矿物盐凝胶佐剂、颗粒佐剂、微粒佐剂、粘膜佐剂和细胞因子。此类佐剂可以与本发明的组合物一起配制,或与该组合物分开施用,例如在向受试者施用该组合物之前、同时或之后施用。
[0117]
本文中公开的方法可应用于宽范围的物种,例如人类、非人灵长类动物(例如猴子)、马、牛、猪、绵羊、鹿、麋鹿、山羊、狗、猫、鼬、兔、豚鼠、仓鼠、大鼠和小鼠。
[0118]
本文中使用的术语“治疗”("treat"或"treating")指的是部分或完全减轻、抑制、改善和/或舒缓受试者所患有的疾病或病症。在一些情况下,治疗可以导致受试者所患有的疾病或病症的持续不存在。
[0119]
通常,方法包括选择易受或患有病症或疾病的风险的受试者。在一些情况下,可以用本文中公开的药物组合物治疗该受试者的病症或疾病。例如,在一些情况下,方法包括选择患有癌症的受试者,例如其中受试者的癌症可以通过靶向mica和/或血管生成素
‑
2(angiopoetin
‑
2)的一种或两种来治疗。
[0120]
在一些情况下,治疗方法可以包括根据预防或治疗受试者所患有的疾病或病症的需要单次施用、多次施用和重复施用。在一些情况下,治疗方法可以包括在治疗之前、在治疗过程中和/或在治疗之后评估受试者的疾病水平。在一些情况下,治疗可以持续进行,直到检测到受试者的疾病水平的降低。
[0121]
本文中所用的术语“施用(给药)”("administer,""administering,"或"administration")指的是植入、吸收、摄取、注射或吸入本发明的肽,无论何种形式。在一些情况下,一种或更多种本文中公开的肽可以局部(例如经鼻)和/或经口施用于受试者。例如,本文中的方法包括施用有效量的化合物或化合物组合物以实现所需的或所规定的效果。任何特定患者的具体剂量和治疗方案将取决于多个因素,包括所用具体化合物的活性、年龄、体重、一般健康状况、性别、饮食、给药时间、排泄率、药物组合、疾病的严重程度和病程、病症或症状、患者对疾病、病症或症状的处置、以及治疗医生的判断。
[0122]
在给药后,可以对受试者进行评估以检测、评价或确定他们的疾病水平。在一些情
况下,治疗可以持续进行,直到检测到受试者中疾病水平的变化(例如降低)。
[0123]
在患者病症改善时(例如受试者疾病水平的改变(例如降低)),可以在必要的情况下施用维持剂量的本发明的化合物、组合物或组合。随后,可以根据症状降低给药的剂量或频率或两者至保持改善的病症的水平。但是,当疾病症状出现任何复发时,患者可能长期需要间歇治疗。
[0124]
在一些情况下,本公开提供了检测来自人类受试者的免疫细胞,例如b细胞和/或记忆b细胞的方法。此类方法可以例如用于监控人类受试者中的免疫细胞,例如b细胞和/或记忆b细胞的水平,例如在一事件之后。示例性事件可以包括但不限于检测疾病、感染;施用本文中公开的治疗组合物、施用治疗剂或治疗方案、施用疫苗、诱导免疫响应。此类方法可以临床使用和/或用于研究。
[0125]
有效量和剂量
[0126]
在一个实施方案中,本发明的疫苗组合物的有效量是足以减轻患有癌症的受试者中癌症严重程度的量,或足以减轻或改善其一种或更多种症状的严重程度的量、足以防止癌症进展的量、足以防止癌症进一步转移的量、足以引起癌症的临床消退的量、或足以增强或改善在本发明的疫苗组合物的同时、之前或之后施用的另一种疗法或治疗剂的治疗效果的量。
[0127]
癌症的症状对本领域技术人员是熟知的,并包括但不限于不寻常的痣特征、痣的外观(包括不对称、边界、颜色和/或直径)的变化、新着色的皮肤区域、不正常的痣、指甲下的变黑区域、乳房肿块、乳头变化、乳腺囊肿、乳房疼痛、死亡、消瘦、乏力、过度疲劳、进食困难、食欲不振、慢性咳嗽、严重呼吸困难、咳血、血尿、便血、恶心、呕吐、肝脏转移、肺转移、骨转移、腹胀、胃气胀、腹腔液、阴道出血、便秘、腹部膨大、结肠穿孔、急性腹膜炎(感染、发烧、疼痛)、疼痛、吐血、大量出汗、发烧、高血压、贫血、腹泻、黄疸、头晕、发冷、肌肉痉挛、结肠转移、肺转移、膀胱转移、肝转移、骨转移、肾脏转移和胰腺转移,吞咽困难等等。
[0128]
在一个实施方案中,本发明的疫苗组合物的有效量是足以产生抗体分泌b细胞或细胞毒性t细胞介导的针对本发明的疫苗组合物的一种或更多种肽的免疫响应的量。在一个实施方案中,本发明的疫苗组合物的有效量是足以产生抗体分泌b细胞或细胞毒性t细胞介导的针对癌细胞的免疫响应的量。本发明的疫苗组合物引发免疫响应的能力可以使用本领域技术人员可用的任何常规方法来确定。在一个实施方案中,各组合物的有效量是足以在受试者中产生例如通过混合淋巴细胞t细胞测定法测得的细胞毒性t细胞响应的量。
[0129]
在一个实施方案中,施用于受试者或在受试者的特定部位处施用的疫苗组合物的有效量是递送1至1000微克的一种或更多种该组合物的肽的量。在一个实施方案中,肽的量为1至100微克、1至200微克、1至300微克、1至400微克、1至500微克、1至600微克、1至700微克、1至800微克或1至900微克。在另一实施方案中,肽的量为1至10微克、1至20微克、1至30微克、1至40微克、1至50微克、1至60微克、1至70微克、1至80微克或1至90微克。优选地,施用于受试者的肽的总量不超过5毫克,且最优选该总量不超过2毫克。
[0130]
组合治疗
[0131]
本发明还提供了用于治疗或预防癌症的方法,该方法包括向需要其的受试者施用本发明的疫苗组合物,以及一种或更多种附加治疗剂或治疗方案。在一个实施方案中,本发明的疫苗组合物作为包括手术、化学治疗剂、或放射疗法、免疫疗法、或前述的任意组合的
治疗方案的一部分施用。
[0132]
在一个实施方案中,该治疗方案包含或进一步包含一种或更多种免疫刺激剂。在一个实施方案中,所述一种或更多种免疫刺激剂选自抗
‑
ctla
‑
4抗体或肽、抗
‑
pd
‑
1抗体或肽、抗
‑
pdl
‑
1抗体或肽、抗
‑
ox40(也称为cd134、tnfrsf4、act35和/或txgp1l)抗体或肽、抗
‑
gitr(也称为tnfrsf18、aitr和/或cd357)抗体或肽、抗
‑
lag
‑
3抗体或肽和/或抗
‑
tim
‑
3抗体或肽。
[0133]
在一个实施方案中,所述一种或更多种免疫刺激剂选自wo 2013/049517或wo 2008/036981中描述的抗mica抗体。在一个实施方案中,所述一种或更多种免疫刺激剂选自cm33322 ab4、cm33322 ab28和cm33322 ab29,其描述在美国临时申请号61/792,034和61/913,198以及美国申请号14/025,573中。
[0134]
在一个实施方案中,该治疗方案包含或进一步包含一种或更多种细胞因子。在一个实施方案中,本发明的疫苗组合物包含一种或更多种细胞因子。在一个实施方案中,至少一种细胞因子是白介素或干扰素。在一个实施方案中,至少一种细胞因子是选自il
‑
1α、il
‑
1β、il
‑
2、il
‑
3、il
‑
4、il
‑
5、il
‑
6、il
‑
7、il
‑
8、il
‑
9、il
‑
11、il
‑
12、il
‑
13、il
‑
15和il
‑
18的白介素。在另一实施方案中,至少一种细胞因子是选自ifnα、ifnβ和ifnγ的干扰素。
[0135]
在一个实施方案中,本发明的疫苗组合物作为治疗方案的一部分施用,所述治疗方案包括向受试者施用至少一种选自组蛋白去乙酰化酶抑制剂(“hdac”)抑制剂、蛋白酶体抑制剂、烷基化剂和拓扑异构酶抑制剂的化学治疗剂。
[0136]
在一个实施方案中,该化学治疗剂是选自异羟肟酸、伏立诺他(zolinza)、辛二酰苯胺异羟肟酸(saha)(merck)、曲古抑菌素a(tsa)、laq824(novartis)、帕比司他(lbh589)(novartis)、贝利司他(pxd101)(curagen)、itf2357 italfarmaco spa(cinisello)、环四肽、酯肽(depsipeptide)(罗米地辛,fk228)(gloucester pharmaceuticals)、苯甲酰胺、恩替诺特(sndx
‑
275/ms
‑
275)(syndax pharmaceuticals)、mgcd0103(celgene)、短链脂族酸、丙戊酸、丁酸苯酯、an
‑
9、pivanex(titan pharmaceutical)、chr
‑
3996(chroma therapeutics)和chr
‑
2845(chroma therapeutics)的hdac抑制剂。
[0137]
在一个实施方案中,该化学治疗剂是选自硼替佐米(millennium pharmaceuticals)、npi
‑
0052(nereus pharmaceuticals)、卡非佐米(pr
‑
171)(onyx pharmaceuticals)、cep 18770和mln9708的蛋白酶体抑制剂。
[0138]
在一个实施方案中,该化学治疗剂是烷基化剂,如马法兰(mephalan)。
[0139]
在一个实施方案中,该化学治疗剂是拓扑异构酶抑制剂如阿霉素(多柔比星)。
[0140]
在一个实施方案中,该治疗方案包含或进一步包含化学疗法、放射疗法、细胞因子、趋化因子和其它生物信号分子、肿瘤特异性疫苗、细胞癌症疫苗(例如gm
‑
csf转导的癌细胞)、肿瘤特异性单克隆抗体、自体和同种异体干细胞解救(例如增加移植物抗肿瘤效果)、其它治疗抗体、分子靶向疗法、抗血管生成疗法、具有治疗目的的传染剂(如肿瘤定位细菌)和基因疗法的一种或更多种。
[0141]
试剂盒
[0142]
本发明提供了用于实施本发明的方法或治疗方案的药包或试剂盒。在一个实施方案中,该试剂盒包含冻干形式的本发明的疫苗组合物。在一个实施方案中,该试剂盒包含蛋白支架形式的本发明的疫苗组合物。
[0143]
在另一实施方案中,该试剂盒在一个或更多个附加容器中进一步包含细胞因子或佐剂。
[0144]
各容器中的组合物可以为药学上可接受的溶液的形式,例如与无菌盐水、葡萄糖溶液或缓冲溶液、或其它药学上可接受的无菌流体组合。或者,该组合物可以冻干或干燥;在这种情况下,该试剂盒任选在单独的容器中进一步包含优选无菌的药学上可接受的溶液(例如盐水、葡萄糖溶液等等)以便恢复该组合物以形成用于注射目的的溶液。
[0145]
在另一实施方案中,该试剂盒进一步包含一种或更多种可重复使用的或一次性的用于给药的装置(例如注射器、针头、分配笔),优选以无菌形式包装和/或包装的酒精片。任选包括使用说明以便由临床医师或由患者施用该组合物。该试剂盒还可以包含其它材料,例如金属或塑料箔,如泡罩包装。
[0146]
在一些实施方案中,本公开提供了在下列方法中使用本文中公开的疫苗组合物的任意一种或更多种(在下文中表示为“x”)的方法:
[0147]
物质x在一种或更多种本文中公开的疾病或病症(例如癌症,在下面的实施例中称为“y”)的治疗中用作药物。物质x用于制造用于治疗y的药物的用途;以及物质x用于治疗y。
[0148]
在一些情况下,本文中公开的治疗组合物可以配制用于在美国销售、进口到美国和/或由美国出口。
[0149]
除非另行定义,本文中使用的所有技术和科学术语具有与本发明所属领域普通技术人员通常理解的相同含义。在本文中描述了用于本发明的方法和材料;也可以使用本领域已知的其它合适的方法与材料。材料、方法和实施例仅仅是说明性的,且并非意在限制。所有出版物、专利申请、专利、序列、数据库条目和本文中提及的其它参考文献通过引用以其全部并入。在冲突的情况下,将以本说明书(包括定义)为准。
[0150]
实施例
[0151]
在下面的实施例中进一步描述本发明,该实施例不限制权利要求书中描述的本发明的范围。
[0152]
实施例1:具有适当放置的mica抗体的表位的嵌合蛋白的设计
[0153]
在图3和4中显示了两种设计。在第一设计(图3)中,将由人mica抗体识别的两个关键表位放入不相关的蛋白(来自人cmv的ul18)中,所述不相关蛋白具有类似的总免疫球蛋白折叠。在用人micaα3结构域的初次免疫后加强免疫的情况下,该蛋白应当尤其可用。
[0154]
在第二设计(图4)中,产生其中连接两个关键表位的最小蛋白。因为n端和c端紧邻,该蛋白可以在病毒衣壳如乙型肝炎核衣壳的表面上显示。
[0155]
实施例2:人mica抗体的治疗活性
[0156]
方法
[0157]
该研究设计得到了机构动物护理和使用委员会(institutional animal care and use committee)的批准(iacuc,方案id 08
‑
049)。六周龄雄性scid(icr
‑
prkdc
scid
)小鼠获自taconic(hudson,ny)。u937细胞获自美国模式培养物保藏所(american type culture collection,atcc,manassas,va)。为了进行生存实验,将2
×
106个细胞注入首次用于实验的小鼠的腹膜腔中。在将小鼠随机选择至双盲治疗组中之前令肿瘤生长十天。各治疗组含有十只小鼠,足以根据实验室先前的经验辨别生存益处。随机选择基于小鼠的体内成像,治疗组包含具有类似的整体平均信号强度的小鼠,显示类似的肿瘤负荷。通过未进
行生存实验的外部实验室成员将治疗双盲。研究者以标记为“a组”或“b组”的注射器给予治疗。在各生存实验结束时,研究并未混合。以100微克/剂静脉注射给予抗体治疗。动物接受每周三剂,共进行三周。每周将小鼠放血以便检测循环smica。所有小鼠均包括在分析内。
[0158]
对于短期治疗,皮下植入2
×
106个u937细胞并令肿瘤生长(establish)十天。具有可触知肿瘤的小鼠随后用全人源抗体(同种型aml ab2、mel ab28或mel ab29)治疗一周(3
×
100微克)。初次治疗后第八天,处死小鼠,并切除肿瘤和脾脏,记录肿瘤质量。在含有5毫升消化介质的皮氏培养皿(petri dish)中将肿瘤切成小块,所述消化介质含有具有2%fbs的rpmi介质、50u/毫升iv型胶原酶(invitrogen)和10u/毫升dna酶(roche)。组织在消化介质中在37℃下温育2小时。随后用温和macs dissociator(miltenyi biotech)进一步解离肿瘤。保存肿瘤细胞悬浮液的上清液用于测量局部smica浓度。细胞悬浮液经70微米过滤器过滤并用pbs洗涤三次。单一细胞悬浮液随后用zombie yellow(活性染料,biolegend)、nkg2d
‑
apc(cx5)、穿孔素
‑
pe(ebioomak
‑
d)、cd45
‑
pacblue(30
‑
f11)、nkp46
‑
percp/cy5.5(29a1.4)、ifnγ
‑
bv711(xmg1.2)、nk1.1
‑
bv510(pk136)、cd16
‑
apc/cy7(93)和cd49b
‑
fitc(dx5)染色以便进行nk细胞分析。除了穿孔素(ebiosciences)之外,所有抗体来自biolegend。细胞的附加单独等分试样使用抗mica
‑
pe(克隆6d4,biolegend)染色用于mica表达。
[0159]
要理解的是,虽然已经结合其详述描述了本发明,前面的描述意在说明而不限制本发明的范围,本发明的范围由所附权利要求的范围来限定。其它方面、优点和修改在下面的权利要求范围内。
[0160]
人mica/b抗体有效抑制肿瘤微环境中的mica脱落
[0161]
建立用于评估人mica抗体的治疗功效的小鼠模型。小鼠不具有mica或micb直向同源基因(orthologs),但是小鼠nkg2d受体识别人mica/b。参见liu等人.2013,jci 123(10):4410
‑
4422。我们在具有nk细胞但缺乏t细胞和b细胞的scid小鼠中植入了人u937细胞,一种aml细胞系。该模型使我们能够确定人mica抗体对nk细胞介导的针对人肿瘤细胞的免疫的影响,但是cd8 t细胞响应不能在该模型中进行评估。用鼠igg2a fc片段表达mica抗体aml ab2以使得能够与鼠fc受体适当地相互作用。患者抗体具有人igg1同种型,其在功能上类似于小鼠igg2a。用u937细胞植入小鼠并在十天后随机分配到双盲治疗组中。三周时间的治疗(3
×
100微克/周)提供了显著的存活益处,在治疗组(aml ab2)中在第45天的存活率为55%,相比之下,在对照组(同种型)中为0%。参见图5a。机理研究表明,在抗体治疗仅两周后,smica在血清中变得检测不到,而smica水平在对照组中上升。参见图5b。
[0162]
我们接下来研究了使用三种全人源mica/b抗体在早期时间点治疗的功能效果。在患有皮下肿瘤的scid小鼠治疗一周后,在aml ab2、mel ab28和mel ab29治疗组中在小鼠中的smica水平与同种型对照相比大大降低。参见图5c。肿瘤的流式细胞检测分析也显示了mica在肿瘤细胞表面上显著提高的表达,反映了体外结果。参见图5d。这些结果证实,人mica/b抗体有效抑制了肿瘤微环境中的mica脱落,并由此提高了被细胞毒性淋巴细胞识别的肿瘤细胞上mica的密度。
[0163]
人mica/b抗体由此改善了局部和全身两者nk细胞介导的针对肿瘤细胞的免疫
[0164]
我们在一周的治疗时间点处对肿瘤浸润nk细胞进行了进一步的机理研究。抑制肿瘤中mica脱落提高了在肿瘤浸润nk细胞上的nkg2d表面表达。参见图6a。抗体治疗还导致了
肿瘤浸润nk细胞的>40倍的扩大,以及提高的nkp46受体的表达。参见图6b和6c。扩大的肿瘤浸润nk细胞产生了更大量的ifnγ,一种对抗肿瘤免疫至关重要的细胞因子,并表达了更高水平的穿孔素,一种细胞毒性功能的关键分子。参见图6d和6e。为了确定mica/b抗体治疗的小鼠中nk细胞的细胞毒性潜力,我们评估了通过脾脏nk细胞间接体内杀灭yac
‑
1细胞。相对于同种型治疗的小鼠,跨越所有抗mica抗体治疗的小鼠均观察到增强的杀灭。参见图6f。人mica/b抗体由此改善了局部和全身两者nk细胞介导的对抗肿瘤细胞的免疫。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

