本申请要求2019年2月28日提交的美国临时申请号62/812,118以及2018年12月31日提交的美国临时申请号62/786,831的优先权和权益,其全部内容通过引用完全地并入本文中。本申请还涉及以下美国专利:美国专利号8,562,589、8,721,620、8,734,429、8,759,284、8,809,269、9,149,617,所述美国专利全部出于所有目的通过引用而完全地并入本文中。
技术领域:
本发明的实施方案涉及可吞服药物递送装置。更具体地,本发明的实施方案涉及用于将药物递送至小肠的可吞服药物递送装置。
背景技术:
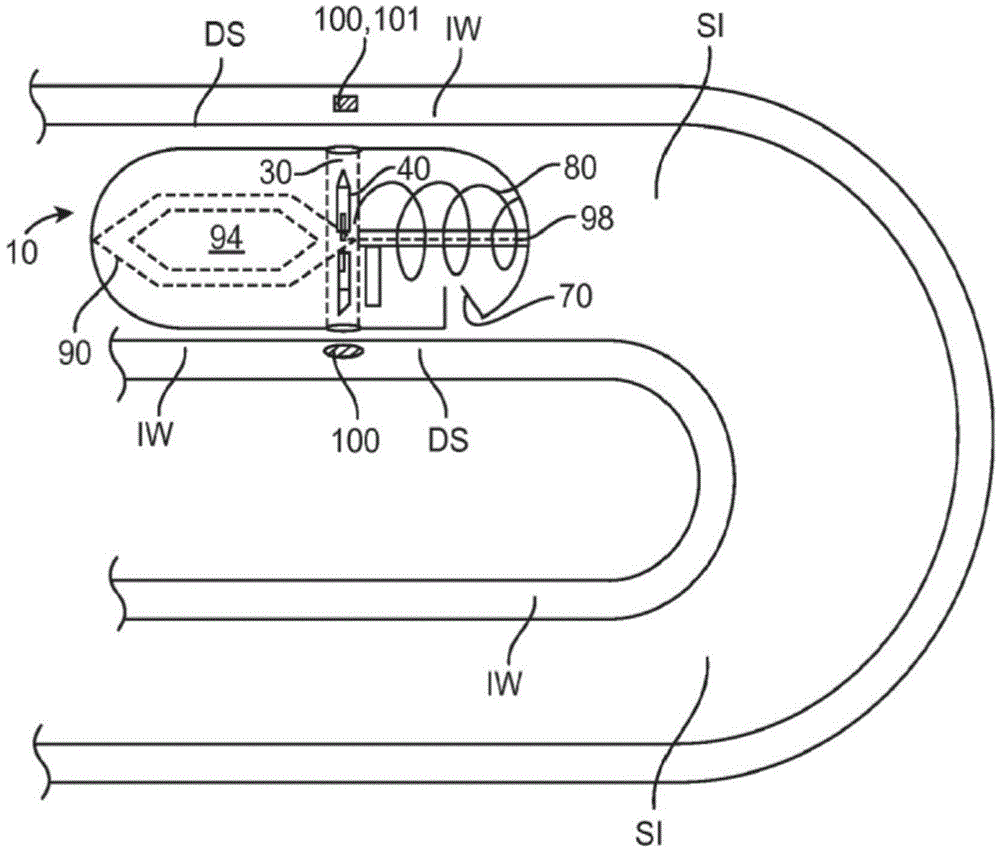
虽然近年来已经越来越多地研发了用于治疗多种疾病的新药,但许多新药因为其不能口服而在应用上受到限制。这是由于许多原因,包括:口服耐受性不良伴包括胃刺激和出血在内的并发症;药物化合物在胃里的分解/降解;以及药物的不良、缓慢或不稳定的吸收。诸如静脉内递送和肌肉内递送等常规替代药物递送方法具有许多缺点,包括:针刺引起的疼痛和感染风险,对使用无菌技术的需求,以及对将静脉注射(IV)管线长时期保持在患者体内的需求和相关风险。虽然已采用了诸如可植入式药物递送泵等其他药物递送方法,但这些方法需要装置半永久性地植入,并且可能仍然具有静脉注射递送的许多限制。因此,需要用于递送药物及其他治疗剂的改进的方法,包括需要对用于治疗糖尿病及其他血糖调节病症的胰岛素及其他治疗剂的改进递送。技术实现要素:本发明的实施方案提供了用于将药物和其他治疗剂递送到身体中各个位置的装置、系统、试剂盒和方法。许多实施方案提供了用于将药物及其他治疗剂递送在胃肠(GI)道内的可吞服装置。特定实施方案提供了用于将药物及其他治疗剂递送到小肠壁和/或周围组织或其他胃肠器官壁中的可吞服装置诸如胶囊。本发明的实施方案对于将吸收不良的、耐受不良的和/或降解不良的药物及其他治疗剂递送在胃肠道内特别有用。此外,本发明的实施方案可以用于递送先前仅能够或优选地通过静脉内或肠胃外施用的其他形式(包括各种非血管注射施用形式诸如肌肉内注射或皮下注射)递送的药物及其他治疗剂。在各种实施方案中,此类治疗剂可以包括生物治疗剂(也描述为生物制品)。本文中使用的术语“生物治疗剂”(也称为生物制品)是指由活生物产生的或包含活生物的组分的产品。它可以包括生物治疗分子诸如各种抗体,包括但不限于免疫球蛋白G(IgG)。它还可以包括细胞诸如各种免疫细胞(例如,白细胞、巨噬细胞、T-细胞等)或诸如血小板的细胞组分或碎片。在本发明的一方面,本发明提供了用于递送至胃肠道壁或周围组织中的治疗剂制剂,其中所述制剂包含治疗有效剂量的至少一种治疗剂诸如IgG或其他抗体。所述制剂具有形状和材料一致性以被包含在可吞服胶囊或其他可吞服装置中并且从该胶囊递送到肠壁中以将该剂量的治疗剂释放在胃肠壁或周围组织(例如,腹膜壁或腹膜腔)内。在许多实施方案中,制剂被配置成被包含在可吞服胶囊或其他可吞服包壳中并且可操作地耦合到致动器、可扩张性球囊或具有第一配置和第二配置的其他装置。在第一配置下,制剂被包含在胶囊(或其他可吞服包壳)中并且在第二配置下被推出该胶囊并且进入肠壁以将治疗剂递送到肠壁。在变型中,制剂可以被配置成被部分地包含在胶囊内或附接或以其他方式布置在胶囊表面上。在这些及相关实施方案中,制剂的释放可以通过使用在小肠中降解的可溶性pH敏感性包衣来实现。在其他实施方案中,本发明提供了用于将治疗剂递送到胃肠道壁中的方法,该方法包括吞服药物递送装置,该药物递送装置包括胶囊、致动器以及治疗剂制剂的实施方案。致动器响应于小肠中的诸如pH的条件,从而促动治疗剂制剂向小肠壁中递送。在具体实施方案中,致动器可包含位于胶囊上的释放元件或包衣,该释放元件或包衣由小肠中的选定pH所降解。一旦所述元件或包衣被降解,其即引发通过一种或多种递送工具,诸如通过一个或多个球囊的扩张,对治疗剂制剂的递送,所述一个或多个球囊可操作地耦合至组织穿透构件,所述组织穿透构件含有所述治疗剂制剂并被配置成在球囊扩张时穿透并被推进到肠壁中。一旦组织穿透构件位于肠壁或周围组织中,它们即降解,以将治疗剂释放到血流中。因为本发明的实施方案将治疗剂制剂直接递送到小肠壁或周围组织中,所以在血流或身体的其他位置中达到该治疗剂的最大浓度所需的时间段(本文描述为Tmax)短于在治疗剂被非血管地注射到体内(诸如通过肌肉内注射或皮下注射)时达到该最高浓度所需的相应时间段。在各个实施方案中,通过使用本发明的一个或多个实施方案(诸如可吞服装置的实施方案)将治疗制剂插入到肠壁中所实现的Tmax可以是通过使用治疗剂的非血管注射所实现的Tmax的80%、50%、30%、20%或者甚至10%。在相关实施方案中,本发明提供了治疗制剂以及用于递送到胃肠壁或周围组织中的相关方法,其中可以实现递送的一个或多个药代动力学参数。此类参数可以包括,例如,绝对生物利用度(bioavailability)、Tmax、T1/2、Cmax和曲线下面积中的一个或多个。绝对生物利用度是相对于静脉内(IV)剂量来自配方制品的到达体循环的药物量,其中IV剂量被假定为100%可生物利用。Tmax是治疗剂在血流中达到其最大浓度Cmax所需的时间段,T1/2是在血流(或体内其他位置)中治疗剂的浓度在已达到Cmax之后达到其初始Cmax值的一半所需的时间段。在特定实施方案中,包括,例如,其中治疗制剂包含抗体诸如IgG的那些实施方案,通过本发明的实施方案递送的治疗剂的绝对生物利用度可以在约50%至68.3%的范围,其中特定值为60.7%。还设想到其他值。另外,递送抗体例如IgG的Tmax可以是约24小时而T1/2可以在约40.7至128小时的范围,其中特定值为约87.7小时。另外,在相关实施方案中,治疗制剂以及用于将其递送到小肠壁或周围组织中的相关方法可以被配置成产生治疗剂的血浆/血浓度-时间谱图,该谱图以Cmax或Tmax作为参照点具有选定的形状。例如,血浆浓度-时间谱图可以具有上升部分和下降部分,其具有在该上升部分期间从治疗剂的递送前浓度变化到Cmax水平所耗时间(称为上升时间)与在下降部分期间从该Cmax水平变回到递送前浓度所耗时间(称为下降时间)的选定比率。在各种实施方案中,上升部分与下降部分的比率可以在约1至20、1至10以及1至5的范围中。在包含抗体诸如IgG的治疗制剂的具体实施方案中,在谱图中上升时间与下降时间的比率可以是约1比9。在另一方面,本发明提供了一种用于将药物或其他治疗剂制剂递送到小肠或大肠或者胃肠道其他器官的壁中的可吞服装置。所述装置包括:胶囊,其大小被设定为被吞服并通过胃肠道;可展开的对准器,其安设于胶囊内,用于将胶囊的纵轴线与小肠的纵轴线对准;递送机构,其用于将治疗剂递送到肠壁中;以及展开构件,其用于使对准器或递送机构中的至少一个展开。胶囊壁可通过与胃肠道中的液体接触而降解,但亦可包括外包衣或外层,该外包衣或外层仅在小肠中存在的较高pH下降解,并用来防止下面的胶囊壁在胶囊到达小肠之前在胃内降解,在胶囊到达小肠时通过包衣的降解而引发药物递送。在使用中,此类材料允许治疗剂在诸如小肠的肠道的选定部分中靶向递送。合适的外包衣可以包括各种肠溶衣,如甲基丙烯酸与丙烯酸乙酯的各种共聚物。胶囊的另一实施方案包括至少一个导管、安放于至少一个导管中的一个或多个组织穿透构件、递送构件和致动机构。组织穿透构件通常包含空心针或其他类似的结构,并且具有内腔和用于穿透到肠壁中的可选择深度的组织穿透端。在各个实施方案中,所述装置可包括第二组织穿透构件和第三组织穿透构件,并且还设想到额外数目的组织穿透构件。每个组织穿透构件可包含相同或不同的药物。在具有多个组织穿透构件的优选实施方案中,组织穿透构件可对称地分布在胶囊的周边周围,以便在药物递送期间将胶囊锚固到肠壁上。在一些实施方案中,整个组织穿透构件或其一部分(例如,组织穿透端)可由药物制剂本身制成。在这些实施方案及相关实施方案中,药物制剂可具有被配置用于穿透肠壁并被保留在肠壁中的针或飞镖状结构(具有或不具有倒钩)。组织穿透构件可由各种可生物降解性材料(例如,PLGA(聚乳酸-共-羟基乙酸共聚物)、麦芽糖或其他糖)制成,以便在小肠内降解并因此提供故障-安全机构,其用于使组织穿透构件从肠壁脱离(假如该部件被保留在肠壁中)。另外,在这些实施方案及相关实施方案中,胶囊的可选择部分可由此类可生物降解性材料制成,以便允许整个装置可控地降解成较小的片块。此类实施方案促进了装置通过胃肠道的穿过和排出。在特定实施方案中,胶囊可以包括可生物降解性材料的接缝,该接缝可控地降解,以使胶囊破裂成可选择的大小和形状的片块,以帮助穿过胃肠道。接缝可以是预加应力的、穿孔的或者以其他方式处理的以加速降解。使用可生物降解性接缝在胃肠道中产生可吞服装置的受控降解的构思还可应用于其他可吞服装置,如可吞服相机,以促进穿过胃肠道并减小装置卡在胃肠道中的可能性。递送构件被配置用于经组织穿透构件内腔将药物从胶囊推进到肠壁中。通常,递送构件的至少一部分可在组织穿透构件内腔中推进。递送构件可具有大小设定为装配在递送构件内腔之内的活塞结构或类似的结构。递送构件的远端(推进到组织中的端部)可具有柱塞元件,该柱塞元件推进组织穿透构件内腔中的药物并且还与内腔形成密封。柱塞元件可与递送构件成为一体或附接至递送构件。优选地,递送构件被配置成在针内腔中行进固定的距离,以便将固定剂量或计量剂量的药物递送到肠壁中。这可以通过选择递送构件直径(例如,该直径可以在远端逐渐缩小)、组织穿透构件直径(可在其远端缩小)、使用挡块和/或致动机构中的一种或多种来实现。对于具有由药物制成的组织穿透构件(例如,药物飞镖(drugdart))的装置的实施方案,递送构件被适配成将该飞镖推出胶囊并推入组织中。递送构件和组织穿透构件可以被配置用于递送液体、半液体或固体形式或者全部三种形式的药物。固体形式的药物可以包括粉剂或丸粒。半液体可以包括浆剂或糊剂。药物可以包含于胶囊的空腔内,或者在液体或半液体的情况下,包含于封闭的储器内。在一些实施方案中,胶囊可以包含第一药物、第二药物或第三药物(或者更多的药物)。此类药物可以包含于组织穿透构件内腔之内(在固体或粉剂的情况下)或者包含于胶囊主体内单独的储器中。致动机构可以耦合到组织穿透构件或者递送构件中的至少一个。该致动机构被配置用于将组织穿透构件向肠壁中推进可选择的距离,以及推进递送构件以递送药物,然后将组织穿透构件从肠壁撤回。在各个实施方案中,致动机构可以包括预载弹簧机构,该预载弹簧机构被配置成通过释放元件来释放。合适的弹簧可以包括盘簧(包括锥形弹簧)和板簧,其中还设想到其他弹簧结构。在特定实施方案中,弹簧可以是锥形的,以便减小弹簧在压缩状态下的长度,甚至使弹簧的压缩长度达到大约若干个线圈(例如,两个或三个线圈)或者仅一个线圈的厚度的程度。在特定实施方案中,致动机构包含弹簧、第一运动转换器和第二运动转换器以及轨道构件。释放元件耦合至弹簧以保持弹簧处于压缩状态,使得释放元件的降解将弹簧释放。第一运动转换器被配置用于将弹簧的运动转换成,用于将组织穿透元件推入组织及撤出组织。第二运动转换器被配置用于将弹簧的运动转换成,用于将递送构件推入组织穿透构件内腔中。运动转换器由弹簧推动,并沿着用于引导转换器路径的杆或者其他轨道构件而游走。它们(直接地或间接地)接合组织穿透构件和/或递送构件,以产生所需的运动。它们理想地被配置用于将弹簧沿着其纵轴线的运动转换成组织穿透构件和/或递送构件的正交运动,但还设想到在其他方向上的转换。运动转换器可以具有楔形、梯形或者弯曲的形状,且还设想到其他的形状。在特定实施方案中,第一运动转换器可具有梯形的形状并且包括槽沟,该槽沟接合游走于槽沟中的组织穿透构件上的销钉。该槽沟可具有如下的梯形形状:其映射或者以其他方式对应于转换器的整体形状,并且用来在梯形的上坡部分期间推动组织穿透构件,然后在下坡部分期间将其拉回。在一种变型中,所述运动转换器中的一者或二者可以包含凸轮或凸轮状器件,该器件由弹簧来转动,并且接合组织穿透构件和/或递送构件。在其他变型中,致动机构还可以包含诸如螺线管或压电器件的机电器件/机构。在一个实施方案中,压电器件可以包括具有非展开状态和展开状态的成形压电元件。该元件可被配置成在施加电压时进入展开状态,然后在移除电压时返回到非展开状态。该实施方案和相关的实施方案允许致动机构往复运动,以便既推进组织穿透构件,又在随后将其撤回。释放元件耦合到致动机构或与致动机构相耦合的弹簧之中的至少一个。在特定实施方案中,释放元件耦合到位于胶囊内的弹簧,以便保持弹簧处于压缩状态。释放元件的降解将弹簧释放,以促动致动机构。在许多实施方案中,释放元件包含被配置成在暴露于小肠或大肠中的化学条件如pH时会降解的材料。通常,将释放元件配置成在暴露于小肠内的例如7.0、7.1、7.2、7.3、7.4、8.0或更高的选定pH时降解。然而,还可以将其配置成响应于小肠内的其他条件而降解。在特定实施方案中,可以将释放元件配置成响应于小肠中的流体内的特定化学条件,诸如在摄食(例如,高脂肪或高蛋白膳食)之后出现的化学条件而发生降解。通过选择用于释放元件的材料、这些材料的交联量以及释放元件的厚度和其他尺寸,可以实现由小肠(或胃肠道中的其他位置)中的一种或多种条件而引起释放元件的生物降解。较少的交联量和/或较薄的尺寸可以增加降解速率,反之亦然。对于释放元件来说,合适的材料可以包括可生物降解性材料,诸如被配置成在暴露于小肠内较高pH或其他条件时降解的各种肠溶材料。肠溶材料可以与一种或多种聚合物共聚合或者以其他方式相混合,以便除生物降解之外,还获得许多特定的材料性质。此类性质可包括但不限于刚度、强度、柔性和硬度。在特定实施方案中,释放元件可以包括膜或插塞,该膜或插塞装配于导管之上或者以其他方式阻塞导管并将组织穿透构件保持在导管内部。在这些实施方案及相关实施方案中,组织穿透构件耦合到弹簧加载式致动机构,使得当释放元件充分降解时,其释放出组织穿透构件,而组织穿透构件随后弹出导管之外以穿透到肠壁中。在其他实施方案中,释放元件可以成形,以发挥将组织穿透构件保持就位的闩锁的功能。在这些实施方案及相关实施方案中,释放元件可以位于胶囊的外部或内部上。在内部实施方案中,胶囊和导管被配置成允许肠液进入胶囊内部以允许释放元件的降解。在一些实施方案中,可以借助于传感器来促动致动机构,该传感器例如是pH传感器或其他化学传感器,所述传感器检测胶囊在小肠中的存在,并且向致动机构发送信号(或者向耦合到致动机构的电子控制器发送信号以促动该机构)。pH传感器的实施方案可以包括基于电极的传感器,或者它可以是基于机械的传感器,诸如在暴露于小肠内的pH或其他化学条件时会萎缩或扩张的聚合物。在相关实施方案中,可扩张性/可收缩式传感器还可以通过使用源于传感器扩张或收缩的机械运动而构成致动机构本身。根据用于检测装置处于小肠(或胃肠道内其他位置)之中的另一实施方案,传感器可以包括应变计或其他压力/力传感器,用来检测胶囊在肠道中特定位置内正经历的蠕动收缩的数目。在这些实施方案中,胶囊的大小理想地设定为在蠕动收缩期间被小肠紧握。胃肠道内的不同位置具有不同数目的蠕动收缩。小肠具有介于每分钟12次至9次之间的收缩,其中该频率沿肠的长度下行而降低。因此,根据一个或多个实施方案,对蠕动收缩的数目的检测不仅可以用来确定胶囊是否处于小肠内,而且还可以确定胶囊在肠内的相对位置。在一些实施方案中,作为内部激活的药物递送的替代或补充,使用者可以借助于RF装置、磁装置或者本领域中公知的其他无线信号装置而外部地激活致动机构以递送药物。在这些实施方案及相关实施方案中,使用者可以使用手持式装置(例如,手持式RF装置),该手持式装置不仅包括信号发送装置,而且还包括用于当所述装置处于小肠内或胃肠道中其他位置时通知使用者的装置。通过在可吞服装置上包含RF发射器以在装置处于小肠中或其他位置时向使用者发出信号(例如,通过用信号发送来自传感器的输入),可以实现后一种实施方案。相同的手持式装置还可被配置成当已经激活致动机构并且已经递送选定的药物时提醒使用者。以此方式,向使用者提供药物已经被递送的确认。这允许使用者采用其他适当的药物/治疗剂,以及作出其他相关决定(例如,糖尿病患者是否进食和应当食用何种食物)。手持式装置还可以被配置用于向可吞服装置发送信号以超控(over-ride)致动机构,并以此来阻止、延迟或加速药物递送。在使用中,此类实施方案允许使用者基于其他症状和/或患者的行为(例如,进食、决定去睡觉、锻炼等)而进行干预,以阻止、延迟或加速药物递送。使用者还可以在吞服胶囊后的选定时间段外部地激活致动机构。该时间段可以与使食物移动经过使用者的胃肠道抵达胃肠道诸如小肠内特定位置的典型移行时间或移行时间范围相关。本发明的另一方面提供了通过使用本文所述的可吞服装置的实施方案而递送到小肠壁或周围组织中的治疗剂制剂。该制剂包含治疗有效的剂量的至少一种治疗剂例如IgG或另一种抗体。另外,它可以包含固体、液体或二者的组合,并且可以包含一种或多种药用赋形剂。所述制剂具有形状和材料一致性以被包含在可吞服胶囊(或其他可吞服包壳)的实施方案中,从胶囊递送到肠壁并且在肠壁或周围组织内降解而释放所述剂量的治疗剂。所述制剂还可以具有可选择的表面积与体积之比,从而增强或以其他方式控制该制剂在小肠壁中或其他体内腔中的降解速率。在各个实施方案中,制剂可被配置成耦合到诸如释放元件或致动机构的致动器,该致动器具有第一配置和第二配置,在第一配置下制剂被包含于胶囊中,在第二配置下制剂被推出胶囊并进入小肠壁中。制剂中的药物或其他治疗剂的剂量可以从常规口服递送方法所需的剂量向下滴定,从而可以降低来自药物的潜在副作用。通常,但不一定必须如此,制剂将被成形并以其他方式配置成包含于诸如空心针的组织穿透构件的内腔中,该组织穿透构件被配置成被推出胶囊并进入小肠壁。制剂本身可以包含组织穿透构件,该组织穿透构件配置成被推进到小肠壁中或肠道的其他内腔中。组织穿透构件的尖端可以具有各种形状,包括具有对称或不对称的锥形或斜形。后一类实施方案可以用于将组织穿透构件偏转或引导到特定组织层中诸如肠壁中。本发明的又一方面提供了使用可吞服药物递送装置的实施方案将药物和治疗剂递送到胃肠道的壁中的方法。此类方法可用于递送治疗有效量的多种药物和其他治疗剂。这些药物和治疗剂包括由于在胃中的化学分解而原本需要注射的许多大分子肽和蛋白质,例如,生长激素、甲状旁腺素、胰岛素、干扰素和其他类似的化合物。可以通过本发明实施方案递送的合适的药物和其他治疗剂包括各种化疗剂(例如,干扰素)、抗生素、抗病毒药、胰岛素及相关化合物、胰高血糖素样肽(例如,GLP-1、艾塞那肽)、甲状旁腺激素、生长激素(例如,IFG(胰岛素样生长因子)和其他生长因子)、抗癫痫剂、免疫抑制剂以及诸如各种抗疟疾剂之类的抗寄生虫剂。可以针对患者的体重、年龄、病况或其他参数来滴定特定药物的剂量。在各个方法实施方案中,可以使用可吞服药物递送装置的实施方案来递送多种药物以用于治疗多种病况或者用于治疗特定病况(例如,用于治疗HIVAIDS的蛋白酶抑制剂混合物)。在使用中,此类实施方案允许患者不必针对一种或多种特定病症而服用多种医药品。另外,此类实施方案提供了一种用于促使一种方案的两种或更多种药物大致同时被递送并吸收到小肠中并从而吸收到血流中的手段。由于化学成分、分子量等的差异,药物可通过肠壁以不同速率被吸收,因而导致不同的药代动力学分布曲线。本发明的实施方案通过大致同时注射所需的药物混合物来解决该问题。这继而改善药代动力学,并且因此改善所选的药物混合物的效能。本发明的这些及其他实施方案和方面的进一步细节在下文参考附图更充分地进行描述。附图说明图1a是示出可吞服药物递送装置的一个实施方案的侧视图。图1b是示出包括可吞服药物递送装置的系统的一个实施方案的侧视图。图1c是示出包括可吞服药物递送装置和一套使用说明书的试剂盒的一个实施方案的侧视图。图1d是示出包括药物储器的可吞服药物递送装置的一个实施方案的侧视图。图2是示出可吞服药物递送装置的一个实施方案的侧视图,该可吞服药物递送装置具有用于将组织穿透构件推入组织的弹簧加载式致动机构。图3是示出可吞服药物递送装置的一个实施方案的侧视图,该可吞服药物递送装置具有弹簧加载式致动机构,该致动机构具有第一运动转换器。图4是示出可吞服药物递送装置的一个实施方案的侧视图,该可吞服药物递送装置具有弹簧加载式致动机构,该致动机构具有第一运动转换器和第二运动转换器。图5是示出第一运动转换器和第二运动转换器与组织穿透构件和递送构件的接合的透视图。图6是示出可吞服药物递送装置的一个实施方案的横截面图,该可吞服药物递送装置具有单一组织穿透构件和用于推进该组织穿透构件的致动机构。图7a是示出可吞服药物递送装置的一个实施方案的横截面图,该可吞服药物递送装置具有多个组织穿透构件和用于推进所述组织穿透构件的致动机构。图7b是示出图7a的实施方案的组织穿透构件的展开的横截面图,该展开用于将医药品递送到递送部位以及在递送期间将该装置锚固在肠壁内。图8a-图8c是示出药物递送装置在小肠中的定位和组织穿透构件用以递送药物而展开的侧视图;图8a示出了在组织穿透构件展开之前处于小肠中的装置,其中释放元件保持完整;图8b示出了在释放元件已降解并且组织穿透元件已展开时处于小肠中的装置;图8c示出了在组织穿透元件已缩回并且药物已得到递送时处于小肠中的装置。图9a示出了包括胶囊的可吞服药物递送装置的一个实施方案,该胶囊具有可生物降解的接缝,该可生物降解的接缝被定位用于产生胶囊在胃肠道中的受控降解。图9b示出了已经在胃肠道中降解成更小片块后的图9a的实施方案。图10示出了具有包括用于加速胶囊生物降解的孔隙和/或孔眼的可生物降解接缝的胶囊的一个实施方案。图11是示出对可吞服药物递送装置的实施方案的使用的侧视图,包括装置在胃肠道中的移行和该装置用以递送药物的操作。图12a和图12b是示出用于可吞服药物递送装置的胶囊的一个实施方案的侧视图,该胶囊包括帽和涂覆有pH敏感性可生物降解包衣的主体,图12a示出了处于未组装状态的胶囊,而图12b示出了处于已组装状态的胶囊。图13a和图13b示出了未折叠的多球囊组装件的实施方案,所述多球囊组装件包括展开球囊、对准器球囊、递送球囊和各种连接管;图13a示出了单拱顶配置的展开球囊的组装件的一个实施方案;而图13b示出了双拱顶配置的展开球囊的组装件的一个实施方案;以及图13c是示出可用于包括对准器球囊在内的本文所述球囊的一个或多个实施方案的嵌套式球囊配置的实施方案的透视图。图14a-图14c是示出多隔室展开球囊的实施方案的侧视图;图14a示出了在分离阀关闭情况下处于未膨胀状态的球囊;图14b示出了在阀打开情况下的球囊和化学反应物的混合;而图14c示出了处于膨胀状态的球囊。图15a-图15g是示出用于折叠多球囊组装件的方法的侧视图,每幅图中的折叠配置都适用于单拱顶配置和双拱顶配置的展开球囊,不同之处在于:图15c涉及为双拱顶配置所特有的折叠步骤;而图15d涉及为双拱顶配置所特有的最终折叠步骤;图15e涉及为单拱顶配置所特有的折叠步骤;而图15f和图15g是涉及为单拱顶配置所特有的最终折叠步骤的正交视图。图16a和图16b是示出具有附接的递送组装件的最终折叠的多球囊组装件的实施方案的正交视图。图17a和图17b是示出插入胶囊中的最终折叠的多球囊组装件的实施方案的正交透明视图。图18a是组织穿透构件的一个实施方案的侧视图。图18b是示出组织保持特征的放置的组织穿透构件的一个实施方案的仰视图。图18c是具有套管针尖端和倒锥形轴杆的组织穿透构件的一个实施方案的侧视图。图18d是具有单独的含有药物的区段的组织穿透构件的一个实施方案的侧视图。图18e和图18f是示出具有成形的含有药物的区段的组织穿透构件的一个实施方案的组装的侧视图。图18e示出了组装之前的组织穿透构件和成形的药物区段;而图18f示出了组装之后的组织穿透构件和成形的药物区段。图19提供了用于组装递送组装件的一个实施方案的组件和步骤的各种视图。图20a-图20i提供了示出用于将医药品递送到肠壁的可吞服装置的操作方法的各种视图。图21是平均血浆浓度-时间图线,示出使用本文所述的可吞服装置(也称为RaniPill)的实施方案来递送IgG的药代动力学结果以及血浆浓度-时间曲线的形状。图22是与IgG的静脉内(IV组)和皮下注射(SC组)相比使用RaniPill(Rani组)递送IgG的平均血浆浓度-时间图线。图23是在图22中针对平均IV组图线的对狗的静脉内注射IgG的血浆浓度-时间图线。图24是在图22中针对平均SC组图线的对狗的皮下注射IgG的血浆浓度-时间图线。图25是在图22中针对平均Rani组图线的使用RaniPill对狗递送IgG的血浆浓度-时间图线。图26示出在实施例2的测试中所有组的药代动力学(PK)谱图。图27示出在实施例2的测试中OC组动物的药代动力学(PK)谱图。图28示出在实施例2的测试中SC组动物的药代动力学(PK)谱图。图29示出在实施例2的测试中IV组动物的药代动力学(PK)谱图。具体实施方式本发明的实施方案提供用于将医药品递送到体内的各种位置中的装置、系统和方法。如本文中使用的术语“医药品”是指呈任何形式的药用制剂,其可以包含药物或其他治疗剂以及一种或多种药用赋形剂。许多实施方案提供用于将医药品递送在胃肠道内的可吞服装置。特定实施方案提供用于将医药品诸如IgG或其他抗体递送到小肠壁或其他胃肠器官的可吞服装置诸如胶囊。如本文中使用的“胃肠道”是指食管、胃、小肠、大肠和肛门,而“肠道”是指小肠和大肠。本发明的各个实施方案可被配置和布置用于将医药品递送到肠道以及整个胃肠道中。在各种实施方案中,递送可以被如此配置,从而获得一种或多种可选择的药代动力学参数(例如,Tmax、绝对生物利用度等)以及所需的血浆药物浓度-时间谱图,如以下更详细地描述。如本文中使用的术语“约”意指在性质、特性、尺寸或其他参数的陈述值的10%内,更优选地在5%内,还更优选地在2%内。现参见图1-图11,用于将医药品100递送到诸如小肠壁或周围组织等肠道内的递送部位DS的装置10的实施方案包括胶囊或其他可吞服包壳20,其包括至少一个导管30、位于所述至少一个导管中或者以其他方式在所述至少一个导管内可推进的一个或多个组织穿透构件40、递送构件50、致动机构60和释放元件70。医药品100在本文中也称为制剂100,通常包含至少一种药物或其他治疗剂101,并且可包含本领域已知的一种或多种药用赋形剂。递送构件50和机构60中的一个或多个可共同构成用于将医药品100递送到肠道壁中的工具。本文设想到的其他递送工具包括一个或多个可扩张性球囊(例如,递送球囊172)或本文描述的其他可扩张性装置/构件。装置10可被配置用于递送液体、半液体或固体形式的医药品100或所有三种形式的医药品100。固体形式的医药品/制剂100可包括粉剂、丸粒或其他成形体中的一种或多种。半液体形式可包括浆剂或糊剂。无论何种形式,制剂100都理想地具有形状和材料一致性,从而允许医药品被推出该装置,进入肠壁(或胃肠道内的其他内腔壁),然后在肠壁内降解以释放药物或其他治疗剂101。材料一致性可以包括制剂的硬度、孔隙率和(在体液中)溶解性中的一种或多种。材料一致性可通过以下中的一项或多项来实现:i)用于制作该制剂的压实力;ii)本领域已知的一种或多种药用崩解剂的使用;iii)其他药用赋形剂的使用;iv)制剂的颗粒大小和分布(例如,微粉化颗粒);以及v)微粉化和本领域已知的其他颗粒成型方法的使用。制剂100的合适形状可包括圆柱形、立方形、矩形、锥形、球形、半球形及其组合。另外,还可以选择形状以便限定制剂100的特定表面积和体积,从而限定这两者之比。表面积与体积之比进而可用于实现在胃肠道内的肠壁或其他内腔壁中的选定降解速率。较大的比率(例如,每单位体积较大的表面积量)可用于实现更快的降解速率,反之亦然。在特定的实施方案中,表面积与体积之比可在约1:1至100:1的范围之内,具体实施方案为2:1、5:1、20:1、25:1、50:1和75:1。制剂/医药品100通常将会被预先装进组织穿透构件40的内腔44之内,但也可包含在胶囊20的内部24之中的另一位置处,或者在液体或半液体的情况下,包含在封闭的储器27内。该医药品可以经预成形以便装配于内腔之内或者例如以粉剂形式进行包装。通常,装置10将被配置用于递送作为医药品100的一部分的单一药物101。然而在一些实施方案中,装置10可以被配置用于多种药物101的递送,所述多种药物101包括第一药物、第二药物或第三药物,它们可混合成单一的或多种医药品100。对具有多种医药品/药物的实施方案来说,医药品可包含于单独的组织穿透构件40之中或者包含在胶囊20内的单独隔室或储器27内。在另一实施方案中,包含第一药物101的第一剂量102的医药品100可装入穿透构件40中,而第二剂量103的医药品100(包含相同的或不同的药物101)可如图1b的实施方案中所示那样涂覆到胶囊的表面25上。两种医药品剂量102和103中的药物101可以是相同的或不同的。以这种方式,可以实现相同或不同药物的双峰药代动力学释放。第二剂量103的医药品100可具有肠溶衣104,以便确保其在小肠中释放并且还实现医药品100的时间释放。肠溶衣104可包括本文描述的或本领域中已知的一种或多种肠溶衣。用于将医药品100递送到小肠壁或胃肠道内其他位置的系统11可包括装置10,装置10包含用于治疗一种或多种选定病症的一种或多种医药品100。在一些实施方案中,该系统可包括手持式装置13,本文将装置13描述为用于如图1b的实施方案中所示那样与装置10进行通信。系统11还可配置成试剂盒14,如图1c的实施方案中所示,试剂盒14包括封装在包装12中的系统11和一套使用说明书15。这些说明书可向患者指出相对于诸如摄食或者对诸如血糖、胆固醇等生理测量的一个或多个事件,应于何时采用该装置10。在这样的实施方案中,试剂盒14可包括多个装置10,它们包含用于选定的给药期(例如,根据所要治疗的病况为一天、一周或多周)的一个方案的医药品100。胶囊20的大小设定为被吞服并穿过肠道。还可以根据待递送的药物的量和患者体重以及成人与儿科应用来调整大小。胶囊20包括内部容积24和外表面25,外表面25具有一个或多个孔口26,孔口26的大小适合于导管30。除装置10的其他组件(例如,致动机构等)之外,内部容积可包括一个或多个隔室或储器27。胶囊20的一个或多个部分可由本领域已知的各种生物相容性聚合物来制造,所述生物相容性聚合物包括各种可生物降解性聚合物,其在优选实施方案中可包括PGLA(聚乳酸-共-羟基乙酸)。其他合适的可生物降解性材料包括本文描述的各种肠溶材料以及丙交酯、乙交酯、乳酸、羟基乙酸、对二噁烷酮、己内酯、三亚甲基碳酸酯、己内酯,及其掺合物和共聚物。如本文进一步详述的,在各个实施方案中,胶囊20可以包括可生物降解性材料的接缝22,以便可控地降解成更容易穿过肠道的较小片块23。此外,在各个实施方案中,胶囊可包含各种不透射线的材料或回声材料,用于使用荧光透视、超声或其他医学成像方式来对装置进行定位。在特定实施方案中,整个胶囊或者其一部分可如图1a和图1b的实施方案中所示包含不透射线/回声标记20m。在使用中,此类材料不仅允许装置10在胃肠道中的定位,而且还允许对该装置穿过胃肠道的通行时间的确定。在优选实施方案中,组织穿透构件40安放在导管30内,导管30用于引导和支持构件40向诸如小肠壁或胃肠道的其他部分等组织中的推进。组织穿透构件40通常将会包括空心针或其他类似结构,并且将会具有内腔44以及用于穿透到肠壁IW中可选择深度的组织穿透端45。构件40还可以包括销钉41,用于与本文所述的运动转换器90相接合。穿透深度可由构件40的长度、本文所述运动转换器90的配置以及挡块或凸缘40s在构件40上的放置来控制,挡块或凸缘40s在一个实施方案中可对应于本文所述的销钉41。医药品100通常将会穿过内腔44被递送到组织中。在许多实施方案中,内腔44预先装有所需的医药品100,医药品100使用递送构件50或其他推进手段(例如,借助于向构件40的可坍缩实施方案施加的力)而被推出内腔。作为备选,医药品100可从胶囊20中的另一位置/隔室推入内腔44中。在一些实施方案中,整个组织穿透构件40或其一部分可由医药品100本身制成。在这些实施方案及相关实施方案中,医药品可具有针状或飞镖状结构(有倒钩或无倒钩),其被配置用于穿透肠壁(例如,小肠壁)并保持于其中。飞镖的大小和形状可以依据医药品、剂量和向肠壁中的期望穿透深度而定。医药品100可使用制药领域中已知的各种模压成型法形成飞镖形状、丸粒形状或其他形状。在各个实施方案中,如图7a和图7b的实施方案中所示,装置10可包括第二42和第三43组织穿透构件40,且设想到额外的数目。每个组织穿透构件40可用于递送相同的或不同的医药品100。在优选实施方案中,组织穿透构件40可以基本上对称地围绕胶囊20的周边21分布,以便在医药品100的递送期间将胶囊锚固到肠壁IW上。以这种方式锚固胶囊20减小了胶囊被医药品递送期间发生的蠕动收缩所移位或移动的可能性。在特定实施方案中,可将锚固力的量调整成在小肠的蠕动收缩期间所施加的典型的力。通过将一些或所有组织穿透构件40配置成具有弯曲的形状或者弓形的形状,可进一步促进锚固。递送构件50被配置用于推进医药品100穿过组织穿透构件内腔44并进入肠壁IW中。因此,递送构件50的至少一部分可在组织穿透构件内腔44中推进,因此构件50具有配置成装配在递送构件内腔44内的大小和形状(例如,活塞状的形状)。在一些实施方案中,递送构件的远端50d(推进到组织中的一端)可具有柱塞元件51,柱塞元件51在组织穿透构件内腔44内推进医药品并且还与内腔形成密封。柱塞元件51可以与递送构件50成为一体或附接到递送构件50。优选地,递送构件50被配置用于在针内腔44内行进固定的距离,以便将固定剂量或计量剂量的药物递送到肠壁IW中。这可以通过选择递送构件的直径(例如,直径可以在远端逐渐变小)、选择组织穿透构件的直径(其可在其远端缩窄)、使用挡块和/或致动机构中的一项或多项来实现。然而在一些实施方案中,构件50的行程或行进距离可响应于诸如胃肠道中的一种或多种感测到的病况等各种因素来原位做出调整。原位调整可通过使用与致动机构60的机电实施方案相耦合的逻辑资源29(包括控制器29c)来实现。这样允许将可变剂量的医药品注入肠壁中以及/或者改变医药品注入肠壁中的距离。致动机构60可以耦合到组织穿透构件40或递送构件50中的至少一个。致动机构被配置用于将组织穿透构件40向肠壁IW中推进可选择的距离,以及推进递送构件以递送医药品100,然后从肠壁撤回组织穿透构件。在各个实施方案中,致动机构60可包括弹簧加载式机构,该弹簧加载式机构被配置成通过释放元件70来释放。合适的弹簧80可以包括盘簧(包括锥形弹簧)和板簧,还设想到其他弹簧结构。在特定实施方案中,弹簧80可以基本上是锥形,以便减小弹簧在压缩状态下的长度,甚至使弹簧的压缩长度达到约若干个线圈(例如,两个或三个线圈)或者仅一个线圈厚度的程度。在特定实施方案中,如图2、图4和图8a-图8c的实施方案中所示,致动机构60可包括弹簧80、第一运动转换器90以及第二运动转换器94和轨道构件98。释放元件70耦合到弹簧80以将弹簧保持在压缩状态,使得释放元件的降解将弹簧释放。弹簧80可以通过闩锁或其他连接元件81耦合到释放元件70。第一运动转换器90被配置用于转换弹簧80的运动,以便将组织穿透构件40推入和撤出肠壁或其他组织。第二运动转换器94被配置用于转换弹簧80的运动,以便将递送构件50推入组织穿透构件内腔44中。运动转换器90和94由弹簧推动,并且沿着装配到转换器90的轨道构件内腔99中的杆或其他轨道构件98游走。轨道构件98有助于引导转换器90的路径。转换器90和94(直接地或间接地)接合组织穿透构件40和/或递送构件50以产生期望的运动。它们具有如下的形状和其他特性:该形状和其他特性被配置用于将弹簧80沿其纵轴线的运动转换成组织穿透构件40和/或递送构件50的正交运动,但是还设想到在其他方向上的转换。运动转换器可具有楔形、梯形或弯曲的形状,并且还设想到其他形状。在特定实施方案中,如图2、图3和图4的实施方案中所示,第一运动转换器90可具有梯形形状90t且包括槽沟93,槽沟93接合游走于该槽沟中的组织穿透构件上的销钉41。槽沟93还可具有映射或以其他方式对应于转换器90的整体形状的梯形形状93t。槽沟93用于在梯形的上坡部分91期间推动组织穿透构件40,然后在下坡部分92期间将其拉回。在一种变型中,运动转换器90和94之一或全部二者可包含凸轮或凸轮状器件(未示出)。凸轮可由弹簧80来转动,以便接合组织穿透构件40和/或递送构件50。包括运动转换器90和94在内的机构60的一个或多个组件(以及装置10的其他组件)可使用本领域已知的各种基于MEMS的方法来制造,以便允许选定量的微型化从而装配在胶囊10内。此外,如本文所述,它们还可由本领域已知的各种可生物降解性材料形成。在其他变化形式中,致动机构60还可包括诸如螺线管或压电器件等机电器件/机构。在一个实施方案中,机构60中使用的压电器件可包括具有非展开状态和展开状态的成形的压电元件。该元件可被配置用于在施加电压时进入展开状态,然后在移除电压或电压发生其他变化时返回到非展开状态。这个实施方案和相关的实施方案允许致动机构60的往复运动,以便推进组织穿透构件,然后将其撤回。用于压电元件的电压可使用电池或基于压电的能量转换器来生成和获得,该能量转换器通过诸如由胶囊周围的小肠的蠕动收缩引起的胶囊20的压缩而发生的机械变形等机械变形来生成电压。关于基于压电的能量转换器的进一步描述可见于序号为12/556,524的美国专利申请,该申请出于所有目的而通过引用完全并入本文。在一个实施方案中,组织穿透构件40的展开实际上可由小肠的蠕动收缩来引发,小肠的蠕动收缩提供了用于生成压电元件的电压的机械能。释放元件70通常将会耦合到致动机构60和/或与致动机构相耦合的弹簧;然而,还设想到其他配置。在优选实施方案中,如图2的实施方案中所示,释放元件70耦合到安放在胶囊20内的弹簧80,以便将弹簧保持在压缩状态85。释放元件70的降解将弹簧80释放,以便促动致动机构60。相应地,释放元件70可因此发挥致动器70a的作用(致动器70还可包括弹簧80和机构60的其他元件)。如以下进一步说明的,释放元件70/致动器70a具有第一配置和第二配置,在第一配置下,治疗剂制剂100包含在胶囊20中,在第二配置下,治疗剂制剂从胶囊被推进到小肠壁或肠道内的其他内腔壁中。在许多实施方案中,释放元件70包含被配置成在暴露于小肠中或大肠中的诸如pH等化学条件时会降解的材料。通常,释放元件70被配置成在暴露于小肠中选定的pH(例如,7.0、7.1、7.2、7.3、7.4、7.5、7.6、8.0或更大)时降解。释放元件还可被配置成在特定的pH范围内降解,例如,该范围例如为7.0至7.5。在特定实施方案中,可以针对待递送的特定药物来选择使释放元件70降解的pH(本文定义为降解pH),以便在小肠中对应于选定pH的位置处释放药物。此外,对具有多种医药品100的装置10的实施方案来说,该装置可包括被配置成在第一pH下降解的第一释放元件70(耦合到用于递送第一药物的致动机构)和被配置成在第二pH下降解的第二释放元件70(耦合到用于递送第二药物的致动机构)(还设想到额外数目的释放元件用于不同数目的药物)。还可以将释放元件70配置成响应于小肠(或其他GI位置)中的其他病况而降解。在特定实施方案中,释放元件70可被配置成响应于小肠中的流体中的特定化学条件而降解,该化学条件例如是摄食(例如,含有脂肪、淀粉或蛋白质的一餐)后出现的化学条件。通过这种方式,医药品100的释放可以基本上与一餐的消化同步或者以其他方式定时。设想到多种方法用于释放元件70的生物降解。在特定实施方案中,由小肠(或胃肠道中的其他位置)中的一种或多种病况引起的释放元件70的生物降解可通过以下途径中的一项或多项来实现:i)用于释放元件的材料选择;ii)这些材料的交联量;以及iii)释放元件的厚度和其他尺寸。更少的交联量和/或较薄的尺寸可增加降解的速率,反之亦然。用于释放元件的合适材料可包括诸如各种肠溶材料等可生物降解性材料,此类材料被配置成在暴露于肠中的较高pH时降解。合适的肠溶材料包括但不限于以下材料:醋酸纤维素邻苯二甲酸酯、醋酸纤维素偏苯三酸酯、羟丙基甲基纤维素邻苯二甲酸酯、聚醋酸乙烯邻苯二甲酸酯、羧甲基乙基纤维素、共聚甲基丙烯酸/甲基丙烯酸甲酯以及本领域已知的其他肠溶材料。选定的肠溶材料可与一种或多种其他聚合物共聚合或以其他方式组合,以便除生物降解之外还获得许多其他特定材料性质。这样的性质可包括但不限于刚度、强度、柔性和硬度。在备选实施方案中,释放元件70可包括膜或插塞70p,该膜或插塞70p装配在导管30之上或者以其他方式阻塞导管30,并将组织穿透构件40保持在导管内部。在这些实施方案和相关实施方案中,组织穿透构件40耦合到弹簧加载式致动机构,以便当释放元件充分降解时,其使组织穿透构件释放,组织穿透构件然后弹出导管以穿透到肠壁中。在又一些其他实施方案中,释放元件70可成形以发挥将组织穿透构件40保持就位的闩锁的功能。在这些实施方案和相关实施方案中,释放元件可位于胶囊20的外部或内部上。在后一种情况下,胶囊20和/或导管30可被配置用于允许肠液进入胶囊内部,从而允许释放元件的降解。在一些实施方案中,可借助于传感器67,如pH传感器68或检测胶囊在小肠中的存在的其他化学传感器,来促动致动机构60。传感器67然后可以向致动机构60或与致动机构60相耦合的电子控制器29c发送信号,以促动该机构。pH传感器68的实施方案可包括基于电极的传感器,或者其可以是基于机械的传感器,诸如在暴露于小肠中选定的pH或其他化学条件时萎缩或扩张的聚合物。在相关实施方案中,可扩张性/可收缩性传感器67还可以通过使用由传感器的扩张或收缩产生的机械运动而构成致动机构60本身。根据用于检测装置位于小肠中(或胃肠道中的其他位置)的另一实施方案,传感器67可包括用于检测胶囊20在肠道中的特定位置内正经历的蠕动收缩的数目的压力/力传感器,如应变计(在这样的实施方案中,胶囊20的大小理想地设定成由小肠在蠕动收缩期间紧握)。胃肠道内的不同位置具有不同数目的蠕动收缩。小肠具有介于每分钟12次至9次的收缩,其中该频率沿着肠的长度下行而降低。因此,根据一个或多个实施方案,对蠕动收缩的数目的检测不仅可以用于确定胶囊20是否处于小肠之中,而且还可确定其在肠内的相对位置。在使用中,这些实施方案和相关的实施方案允许医药品100在小肠中特定位置处的释放。作为对内部激活的药物递送(例如,使用释放元件和/或传感器)的替代或补充,在一些实施方案中,使用者可以借助于RF装置、磁性装置或本领域已知的其他无线信号发送装置而外部地激活致动机构60以递送医药品100。在这些实施方案和相关实施方案中,使用者可使用如图1b的实施方案中所示的手持式通信装置13(例如,诸如手机等手持式RF装置)来从装置10发送接收信号17。在这样的实施方案中,可吞服装置可以包括诸如RF收发器芯片或其他类似的通信器件/电路等发射器28。手持式装置13不仅可以包括信号发送装置,而且还可以包括用于在装置10处于小肠中或胃肠道中的其他位置时通知使用者的装置。后一实施方案可通过使用逻辑资源29(例如,处理器29)来实现,逻辑资源29耦合到发射器28,以便发送信号以进行检测并且在装置位于小肠中或其他位置时发信号给使用者(例如,通过用信号发送来自传感器的输入)。逻辑资源29可包括控制器29c(在硬件或在软件中)以控制该过程的一个或多个方面。相同的手持式装置还可被配置用于在致动机构60已经激活并且选定的医药品100已得到递送时提醒使用者(例如,使用处理器29和发射器28)。通过这种方式,向使用者提供医药品100已被递送的确认。这允许使用者采用其他合适的药物/治疗剂以及做出其他的相关决定(例如,糖尿病患者是否进食和应当食用什么食物)。该手持式装置还可被配置用于向可吞服装置10发送信号以便超控致动机构60,从而阻止、延迟或加速医药品100的递送。在使用中,这样的实施方案允许使用者基于其他症状和/或患者的行为(例如,进食、决定去睡觉、锻炼等)而进行干预以阻止、延迟或加速医药品的递送。使用者还可以在吞服胶囊后的选定时间段外部地激活致动机构60。该时间段可以与让食物移动穿过使用者的胃肠道到达胃肠道内诸如小肠等特定位置的典型通行时间或通行时间范围相关。在特定实施方案中,如图10a和图10b的实施方案中所示,胶囊20可以包括可生物降解性材料的接缝22,接缝22可控地降解以使胶囊破裂成可选择大小和形状的胶囊片块23,从而促进穿过胃肠道。如图10的实施方案中所示,接缝22还可包含用于让流体进入该接缝中以加速生物降解的孔隙或其他开口22p。还如图10的实施方案中所示,用于加速接缝22的生物降解的其他手段可以包括对接缝预加应力和/或在接缝中包括孔眼22f。在又一些其他实施方案中,接缝22可由易于通过吸收超声(例如,高频率超声(HIFU))能量而降解的材料构建而成,以及/或者具有易于通过吸收超声(例如,高频率超声(HIFU))能量而降解的结构,从而允许使用通过外部或内镜(或其他微创方法)施用的超声使胶囊降解为更小的片块。用于接缝22的合适材料可包括本文所述的一种或多种可生物降解性材料,如PGLA和羟基乙酸等。可以使用诸如模塑、热熔接合等聚合物领域公知的各种连结方法将接缝22附接到胶囊主体20。除了也由可生物降解性材料制成的胶囊20的实施方案之外,可以通过以下中的一种或多种手段来实现接缝22的更快速的生物降解:i)由更快生物降解的材料制造接缝,ii)对接缝预加应力,或iii)对接缝穿孔。使用可生物降解性接缝22来产生可吞服装置在胃肠道中的受控降解的概念还可适用于诸如可吞服相机(或其他可吞服成像装置)等其他可吞服装置,以促进穿过胃肠道并降低这样的装置卡在胃肠道中的可能性。因此,可生物降解性接缝22的实施方案可以适合于可吞服成像装置和其他可吞服装置。本发明的另一方面提供了使用可吞服药物递送装置10的一个或多个实施方案将药物和其他治疗剂(以医药品100的形式)递送到胃肠道壁中的方法。现将对这样的方法的示例性实施方案进行描述。所描述的药物递送实施方案发生在小肠SI中。然而应当理解,这只是示例性的,并且本发明的实施方案可用于在包括胃和大肠在内的胃肠道中的许多位置中递送药物。为便于讨论,本文中有时会将可吞服药物递送装置10称为胶囊。如上所述,在各个实施方案中,装置10可包装成处于密封包装12内的试剂盒11,试剂盒11包括装置10和一套使用说明书15。如果患者正在使用手持式装置13,则患者可被指示要手动地或经由位于说明书15或包装12上的条形码18(或其他识别标记18)向装置13中输入数据。如果使用条形码,则患者将会使用装置13上的条形码读取器19来扫描该条形码。在打开包装12、阅读说明书15并输入任何所需的数据后,患者吞下可吞服药物递送装置10的实施方案。根据药物,患者可随餐(例如,餐前、用餐期间或餐后)或者生理测量一起服用装置10。如图11的实施方案中所示,胶囊20的大小被设定成穿过胃肠道并行进经过患者的胃S,并通过蠕动动作而进入小肠SI中(如在装置10中实施的)。根据本发明的一个或多个实施方案,一旦释放元件70处于小肠中,其就因小肠中的碱性pH(或小肠所特有的其他化学或物理条件)而降解,从而促动致动机构60,并将医药品100递送到小肠SI的壁中。对于包括空心针或其他中空组织穿透构件40的实施方案,通过使用致动机构60将针40向肠壁IW的粘膜中推进选定的距离,然后通过递送构件50的推进而经由针内腔40将医药品注入,来实现医药品递送。递送构件50撤回,然后针40撤回到从肠壁脱离的胶囊主体内(例如,通过弹簧的弹回)。对于具有多个针的装置10的实施方案,还可以使用第二针42或第三针43来递送额外剂量的相同药物或单独的药物101。针的推进可以基本上同时进行或依次进行。在使用多个针的优选实施方案中,针的推进可以基本上同时进行,以便在药物递送期间将装置10锚固在小肠中。在医药品递送后,装置10然后穿过包括大肠LI在内的肠道,并最终排出。对于具有可生物降解性接缝22或其他可生物降解性部分的胶囊20的实施方案,如图9a和图9b的实施方案中所示,胶囊在肠道中降解成更小的片块,从而促进穿过肠道并从其排出。在具有可生物降解的组织穿透针/构件40的特定实施方案中,如果针卡在肠壁中,则该针会生物降解,从而将胶囊20从该壁上释放下来。对于包括传感器67的装置10的实施方案,可以通过由传感器向致动机构60和/或与致动机构相耦合的处理器29或控制器29c发送信号来实现机构60的促动。对于包括外部致动能力的装置10的实施方案,使用者可在吞服胶囊后的选定时间段外部地激活致动机构60。该时期段可以与让食物移动通过使用者的胃肠道到达胃肠道内诸如小肠等特定位置的典型通行时间或通行时间范围相关。上文方法的一个或多个实施方案可用于递送包含治疗有效量的多种药物和其他治疗剂101的制剂100来治疗多种疾病和病况。这些药物和治疗剂101包括因在胃内的化学分解而原本需要注射的许多大分子肽和蛋白质。特定药物的剂量可针对患者的体重、年龄或其他参数来滴定。另外,用于在通过本发明的一个或多个实施方案递送时实现所需效果或治疗效果的药物101(例如,用于血糖调节的胰岛素)的剂量可低于该药物在通过常规口服递送(例如,在胃中消化并通过小肠壁吸收的可吞服丸剂)而递送的情况下所需的量。这是由于药物不被胃中的酸和其他消化液所降解,并且全部的而非仅一部分的药物递送到小肠壁(或肠道中的其他内腔,例如大肠、胃等)中。根据药物101,为了实现所需的治疗效果(例如,血糖调节、癫痫调节等),在制剂100中递送的剂量102的范围可以是通过常规口服递送(例如,丸剂)而递送的剂量的100%至5%,并且还设想甚至更低的量。特定的剂量减少可基于特定药物、待治疗的病况以及患者的体重、年龄和病况来滴定。对于一些药物(在肠道中的降解程度已知),可以采用标准的剂量减小(例如,10%-20%)。更大量的剂量减小可用于更易于降解且吸收性差的药物。通过这种方式,由于摄入的剂量降低,因此可以减小由装置10递送的一种或多种特定药物的潜在毒性和其他副作用(例如,胃痉挛、肠易激、出血等)。这进而由于患者在副作用的严重程度和发生率上均得到减小而提高了患者依从性。采用对药物101的剂量减小的实施方案的额外益处包括降低患者产生耐药性(需要更高剂量)的可能性,以及在抗生素的情况下,降低患者产生细菌的耐药菌株的可能性。另外,对于经受胃旁路手术以及其中小肠的区段已被移除或者其工作(例如消化)长度实际上被缩短的其他手术的患者,可以实现其他程度的剂量减小。除了递送单一药物之外,还可以使用可吞服药物递送装置10的实施方案及其使用方法来递送用于多种病况的治疗或用于特定病况的治疗的多种药物(例如,蛋白酶抑制剂,用于治疗HIVAIDS,I)。在使用中,这样的实施方案允许患者摒弃必须针对一种或多种特定病况服用多种医药品的必要性。另外,它们提供用于促使一个方案的两种或更多种药物被递送并吸收到小肠中,从而在大致相同时间递送并吸收到血流中的手段。由于化学组成和分子量等的差异,药物可能以不同的速率经肠壁吸收,从而导致不同的药代动力学分布曲线。本发明的实施方案通过基本上同时地注射期望的药物混合物而解决了这个问题。这进而改善了选定的药物混合物的药代动力学,并因此改善了其疗效。此外,消除服用多种药物的需要对患有一种或多种长期慢性病况的患者(包括认知能力或行动能力受损的患者)特别有益。在各种应用中,以上方法的实施方案可用于递送包含药物和治疗剂101的制剂100,以提供对许多医学病况和疾病的治疗。可利用本发明的实施方案进行治疗的医学病况和疾病可以包括但不限于:癌症、激素病况(例如,甲状腺机能减退/甲状腺机能亢进、生长激素病况)、骨质疏松、高血压、胆固醇及甘油三酯升高、糖尿病和其他血糖调节障碍、感染(局部感染或败血症)、癫痫和其他癫痫病症、骨质疏松、(房性和室性)冠心病心律不齐、冠状动脉缺血性贫血或其他类似的病况。还设想到其他病况和疾病,包括各种自身免疫疾病/病症,包括例如多发性硬化、银屑癣、银屑癣关节炎、强直性脊柱炎、多灶性运动神经病、慢性炎症性脱髓鞘性多发性神经病及诸如此类,其中之一可以由抗体诸如IgG治疗。在许多实施方案中,特定疾病或病况的治疗可以在不需要注射药物或其他治疗剂(或者诸如栓剂等其他非口服递送形式),而是仅仅依靠递送到小肠壁或者胃肠道的其他部分中的治疗剂的情况下来进行。类似地,患者不需要服用常规口服形式的药物或者其他治疗剂,而是可以再次仅仅依靠使用可吞服胶囊的实施方案向小肠壁中的递送。在其他实施方案中,递送到小肠壁中的治疗剂可以协同注射剂量的药剂一起递送。例如,患者可以使用可吞服胶囊的实施方案来服用每日剂量的治疗剂,但仅需每隔几天或者当患者的病况需要时(例如,高血糖症)施用注射剂量。对于传统上以口服形式递送的治疗剂同样如此(例如,患者可以服用可吞服胶囊或其他可吞服装置,并根据需要而服用常规口服形式的药剂)。这样的实施方案中递送的剂量(例如,吞服剂量和注射剂量)可根据需要来滴定(例如,使用标准剂量响应曲线,并且可以使用其他药代动力学方法来确定适当的剂量)。另外,对于使用可通过常规口服手段来递送的治疗剂的实施方案,可以将使用可吞服胶囊的实施方案递送的剂量滴定为低于一般针对药剂的口服递送而给定的剂量,这是因为药剂在胃或肠道的其他部分中存在很少的降解或者不存在降解(本文再次可以应用标准剂量响应曲线和其他药代动力学方法)。现将参考剂量来描述包含用于治疗各种疾病和病况的一种或多种药物或其他治疗剂101的制剂100的各组实施方案。应当认识到,这些实施方案,包括特定的治疗剂和相应剂量,都是示例性的,并且制剂100可以包含本文描述的(以及本领域已知的那些)被配置成使用装置10的各个实施方案向肠道中的内腔壁(例如,小肠壁)或周围组织(例如,腹膜腔)中递送的多种其他治疗剂。剂量可以大于或小于所描述的剂量,并且可以使用本文描述或者本领域已知的一种或多种方法来调整。在一组实施方案中,治疗剂制剂100可以包含治疗有效剂量的用于治疗糖尿病及其他葡萄糖调节障碍的胰岛素。胰岛素可以是人源的或合成来源的,如本领域已知的。在一个实施方案中,制剂100可以包含约1-10单位(一单位为约45.5μg的纯结晶胰岛素的生物当量)范围的治疗有效量的胰岛素,其中具体范围是2-4、3-9、4-9、5-8或6-7。还设想到较大范围诸如1至25单位或1-50单位。所述制剂中胰岛素的量可以基于以下因素(本文中,“葡萄糖控制滴定因素”)中的一种或多种进行滴定:i)患者的病况(例如,1型对比II型糖尿病;ii)患者先前血糖控制总体水平;iii)患者体重;iv)患者年龄;v)服药频率(例如,一天一次对比一天多次);vi)当天的时间(例如,早晨对比晚上);vii)特定餐(早餐对比晚餐);vii)特定餐的内容物/血糖指数(例如,高脂肪/脂质和糖含量(例如,造成血糖快速升高的食物)对比低脂肪和糖含量;以及viii)患者总体膳食的内容物(例如,每日摄取的糖及其他碳水化合物、脂质和蛋白质的量)。在使用中,包含用于治疗糖尿病或其他血糖病症的胰岛素或其他治疗剂的治疗制剂100的各种实施方案通过在无需患者自己注射的情况下递送更准确受控剂量的胰岛素而允许改善对血糖水平的控制。另外,患者可以在他们进食的同时吞服装置诸如可吞服装置10或110(包含用于治疗糖尿病的胰岛素和/或其他治疗剂),使得与食物中的葡萄糖或其他糖从小肠释放到血流中大约同时或接近同时,胰岛素或其他治疗剂从小肠释放到血流中。这种同时或者时间接近的释放使得胰岛素能够作用于各种受体(例如,胰岛素受体),从而正当由于糖从小肠吸收到血液中而血糖水平开始升高时增大肌肉及其他组织对葡萄糖的摄入。在另一组实施方案中,治疗剂制剂100可以包含治疗有效剂量的用于治疗糖尿病及其他葡萄糖调节障碍的一种或多种肠降血糖素。此类肠降血糖素可以包括胰高血糖素样肽1(GLP-1)及它们的类似物,以及抑胃肽(GIP)。合适的GLP-1类似物包括艾塞那肽、利拉鲁肽、阿必鲁肽和他司鲁肽(taspoglutide)以及它们的类似物、衍生物及其他功能等效物。在一个实施方案中,制剂100可以包含治疗有效量的艾塞那肽,其范围是约1-10μg,具体范围分别是2-4、4-6、4-8和8-10μg。在另一实施方案中,制剂100可以包含治疗有效量的利拉鲁肽,其范围是约1-2mg(毫克),具体范围分别是1.0至1.4、1.2至1.6,以及1.2至1.8mg。一种或多种葡萄糖控制滴定因素可以应用于滴定艾塞那肽、利拉鲁肽或其他GLP-1类似物或肠降血糖素的剂量范围。在又一组实施方案中,治疗剂制剂100可以包含用于治疗糖尿病及其他葡萄糖调节障碍的治疗剂的组合。此类组合的实施方案可以包含例如治疗有效剂量的肠降血糖素和双胍化合物。肠降血糖素可以包括本文所述的一种或多种GLP-1类似物,诸如艾塞那肽,并且双胍可以包括二甲双胍(例如,其可以MerckSantéS.A.S.生产的商标获得)及其类似物、衍生物及其他功能等效物。在一个实施方案中,制剂100可以包含约1-10μg范围的治疗有效量的艾塞那肽和约1至3克范围的治疗有效量的二甲双胍的组合。还设想到更小和更大的范围,其中一种或多种葡萄糖控制滴定因素用于滴定艾塞那肽(或其他肠降血糖素)和二甲双胍或其他双胍的相应剂量。此外,艾塞那肽或其他肠降血糖素和二甲双胍或其他双胍的剂量可以被匹配成在数小时(例如,12)至一天至多天的延长时间段范围内改善患者的葡萄糖控制水平(例如,使血糖维持在正常生理水平内和/或降低高血糖症和/或低血糖症病例的发病率和严重性),其中还设想到更长时间段。剂量的匹配还可以通过以下来实现:使用葡萄糖控制调节因素以及在延长时间段内利用糖基化的血红蛋白(称为血红蛋白A1c、HbA1c、A1C或Hb1c)以及与长期平均血糖水平相关的其他分析物和测量监测患者的血糖。可以采用并且/或者更改已知的药物递送系统的药物递送组合物和组分,以便用于本文所述发明的一些实施方案。例如,可以更改用于利用药物贴片通过皮肤表面来递送药物的微针及其他微结构,并将其包括在本文所述的胶囊内,并且替代地将其用于将药物制剂递送到诸如小肠壁等胃肠道内腔壁中。合适的聚合物微针结构可从美国加利福尼亚州的Corium购得,如MicroCorTM微递送系统技术。MicroCorTM贴片递送系统的其他组分,包括药物配方或组分,也可并入到本文所述的胶囊中。或者,可从市场获得多个提供商来配制出聚合物或其他药物递送基质与选定药物及其他药物制剂组分的组合,从而产生具有期望的药物释放特性的期望形状(诸如本文所述的可释放式组织穿透形状)。这样的提供商例如可包括Corium、明尼苏达州的SurModics、新加坡的BioSensorsInternational等。本文所述治疗组合物的各个实施方案的一个优点和特征在于,生物(治疗性肽或蛋白质例如IgG、胰岛素)药物有效负载得到保护而免于由胃肠(GI)道中肽酶和蛋白酶的作用造成的降解和/或水解。这些酶普遍存在于生命系统之中。胃肠道特别富含蛋白酶,其功能在于将人的饮食中的复杂的蛋白质和肽分解成较小的片段,并释放出随后从肠中被吸收的氨基酸。本文所述的组合物被设计用于保护治疗肽或蛋白质免受这些GI蛋白酶的作用,以及用于将肽或蛋白质有效负载直接递送至肠壁中。在本文所述组合物的各个实施方案中存在两个特征用于保护蛋白质或肽有效负载免受GI蛋白酶的作用。第一,在某些实施方案中,由于胶囊外表面上的防止其在胃里的低pH下溶解的pH敏感性包衣,容纳展开引擎和机具的胶囊壳直到抵达十二指肠段和下十二指肠段时才溶解。第二,在某些实施方案中,中空的麦芽糖(或其他适当的聚合物)微矛状体包含实际的治疗肽或蛋白质;麦芽糖(或其他聚合物)微矛状体被设计用于当外胶囊壳一溶解就穿透肠肌;并且所述微矛状体本身在肠肌壁中缓慢溶解以释放药物有效负载。因此,肽或蛋白质有效负载不暴露于GI蛋白酶的作用,因而不遭受经胃肠道中蛋白水解而降解。此特征继而促成治疗肽或蛋白质的高%生物利用度。如上论述,本文所述的实施方案包含治疗组合物,该治疗组合物包含用于治疗各种病症诸如糖尿病或其他葡萄糖调节障碍的胰岛素。此类组合物导致以期望的药代动力学性质递送胰岛素。在此方面,值得注意的药代动力学指标包括:Cmax,施用后胰岛素的峰值血浆浓度;Tmax,达到Cmax的时间;以及t1/2,胰岛素的血浆浓度在已达Cmax之后达到其Cmax值的一半所需的时间。这些指标可使用本领域中已知的标准药代动力学测量技术来测量。在一种方法中,可以从通过使用可吞服装置或通过非血管注射(例如,皮下注射)进行的治疗剂组合物施用时开始并在此之后按设定的时间间隔(例如,1分钟、5分钟、1/2小时、1小时等)采取血浆样品。然后可以使用可适合于特定药物的诸如GC-质谱法、LC-质谱法、HPLC(高效液相色谱法)或各种ELISA(酶联免疫吸附测定)等一种或多种适当的分析方法来测量血浆中的胰岛素浓度。然后可以使用来自血浆样品的测量值制作浓度-时间曲线(本文中亦称为浓度谱图)。浓度曲线的峰对应于Cmax,而Cmax出现的时间则对应于Tmax。该曲线中浓度在已达Cmax之后达到其最大值(即,Cmax)的一半所在的时间对应于T1/2,该值亦称为治疗剂的消除半衰期。用于确定Cmax的起始时间在非血管注射的情况下可基于进行注射时的时间,并可基于可吞服装置的实施方案将一个或多个组织穿透构件(含有药物)推进到小肠或胃肠道内其他位置(例如,大肠)中所在的时间点。在后一种情况下,该时间可以使用一种或多种手段来确定,该一种或多种手段包括响应于外部控制信号(例如,RF信号)而将组织穿透构件展开到肠壁和/或周围组织中的可吞服装置的遥控实施方案,或者当组织穿透构件已经展开时发送RF信号或其他可在体外检测到的信号的可吞服装置的实施方案。设想到用于检测组织穿透构件展开到小肠中的其他手段,诸如一种或多种医学成像方式,包括例如超声或荧光透视。在这些研究中的任一个中,可以使用适当的动物模型,例如狗、猪、大鼠等,从而模拟人的药代动力学响应。本文所述的实施方案包含治疗组合物,该治疗组合物包含用于治疗糖尿病或其他葡萄糖调节障碍的胰岛素。此类组合物导致以期望的药代动力学性质递送胰岛素。在此方面,值得注意的药代动力学指标包括:Cmax,施用后药物的峰值血浆浓度;Tmax,达到Cmax的时间;以及T1/2,药物的血浆浓度达到其初始值的一半所需的时间。因此,一个实施方案提供了包含胰岛素的治疗组合物,该组合物适配成在口服之后插入肠壁中,其中所述组合物一经插入就将胰岛素从肠壁释放到血流中,从而与经血管外注射的胰岛素剂量相比更快地达到Cmax。在各种实施方案中,治疗胰岛素组合物具有的Tmax是经血管外注射的胰岛素剂量的Tmax的约80%、或50%、或30%、或20%、或10%。此类经血管外注射的胰岛素剂量可以是例如皮下注射或肌内注射。在某些实施方案中,通过插入肠壁中来递送治疗胰岛素组合物所达到的Cmax,与在将该组合物口服递送而未插入肠壁中时达到的Cmax相比,显著更大,诸如为100倍、或50倍、或10倍、或5倍。在一些实施方案,治疗胰岛素组合物被配置用于产生胰岛素的长期释放,诸如具有可选择的t1/2的胰岛素长期释放。例如,可选择的T1/2可以是6、或9、或12、或15、或18、或24小时。本文所述的各种实施方案提供了包含胰岛素的治疗剂组合物(本文中也称为制剂或组合物)。该组合物被适配成在口服摄入之后插入肠壁中,其中所述组合物一经插入就将胰岛素从肠壁释放到血流中,从而与经血管外注射的治疗剂剂量相比更快地达到Cmax,即相比于经血管外注射的治疗剂剂量的情况,治疗剂的插入形式在较短的时间段(例如,较小Tmax)中达到Cmax。注意到,递送到肠壁中的组合物中的治疗剂的剂量与通过血管外注射递送的剂量可以但不需要是可比性地达到这些结果。在各种实施方案中,组合物被配置成达到的胰岛素的Tmax(例如,通过胰岛素从肠壁例如小肠壁释放到血流中)是经血管外注射的胰岛素剂量的Tmax的约80%、或50%、或30%、或20%、或10%。此类经血管外注射的胰岛素剂量可以是例如皮下注射或肌内注射。在某些实施方案中,通过插入肠壁中来递送治疗剂所达到的Cmax,与在将该治疗剂口服递送(例如通过治疗剂或相关化合物的丸剂其他常规口服形式)而未插入肠壁中时达到的Cmax相比,显著更大,例如为5、10、20、30、40、50、60、70、80或甚至100倍。在一些实施方案,治疗胰岛素组合物被配置用于产生胰岛素的长期释放。另外,组合物可以被配置成产生具有可选择的T1/2的胰岛素长期释放。例如,可选择的t1/2可以是6、或9、或12、或15、或18、或24小时。在一些实施方案中,治疗剂组合物还可以包含治疗有效剂量的用于治疗糖尿病或葡萄糖调节障碍的肠降血糖素。可使用的肠降血糖素包括胰高血糖素样肽-1(GLP-1)、GLP-1类似物或抑胃肽(GIP)。示例性GLP-1类似物包括艾塞那肽、利拉鲁肽、阿必鲁肽和他司鲁肽。可以使用任何适当剂量的肠降血糖素;例如,艾塞那肽可以在约1至10微克的剂量范围使用;或利拉鲁肽可以在约1至2mg的范围使用。各种实施方案还提供胰岛素组合物,其适配成在口服摄入之后插入肠壁中,其中所述组合物一经插入就将治疗剂从肠壁释放到血流中,从而达到的t1/2大于未插入肠壁中的口服的治疗剂剂量的t1/2。例如,插入肠壁中的剂量的T1/2可以是未插入肠壁中的剂量的T1/2的100或50或10或5倍。胰岛素组合物可以是固体形式,诸如配置成在肠壁中降解的固体形式组合物,并且固体形式组合物可以具有例如组织穿透特征诸如尖端。胰岛素组合物可以包含至少一种可生物降解性材料,并且/或者可以包含至少一种药用赋形剂,所述药用赋形剂包括可生物降解性聚合物诸如PLGA或糖诸如麦芽糖。胰岛素组合物可适合于以可吞服胶囊口服递送。在某些实施方案中,这样的可吞服胶囊可适合于可操作地耦合至具有第一配置和第二配置的机构,该治疗胰岛素组合物在第一配置下被容纳在胶囊内,并且在第二配置下被推出胶囊并推入到肠壁中。这样的可操作地耦合的机构可以包括可扩张性构件、可扩张性球囊、阀、组织穿透构件、耦合至可扩张性球囊的阀或者耦合至可扩张性球囊的组织穿透构件中的至少一个。在一些实施方案中,胰岛素组合物可以被配置成在组织穿透构件的内腔或其他空腔内被递送,和/或治疗组合物可以被成形为可推进到肠壁中的组织穿透构件。组织穿透构件的大小可以设定为被完全容纳在肠壁内,和/或它可以包括用于穿透肠壁的组织穿透特征,和/或它可以包括用于将组织穿透构件保持在肠壁内的保持特征。保持特征可以包括例如倒钩。在一些实施方案中,组织穿透构件被配置成通过向组织穿透构件的表面施加力而被推进肠壁中,并且任选地,组织穿透构件具有足够的刚度以完全被推进肠壁中,和/或穿透构件的表面被配置成可操作地耦合到可扩张性球囊,该可扩张性球囊在扩张时施加力,和/或组织穿透构件被配置成当力的方向变化时从施加力的结构脱离。除上文所述之外,本发明的各个方面还提供了用于递送医药品100的可吞服递送装置的其他实施方案。根据一个或多个此类实施方案,可吞服递送装置可以包括一个或多个可扩张性球囊或其他可扩张性装置,用于将包含医药品100的一个或多个组织穿透构件递送到肠如小肠的壁中。现参见图12-图20,用于将医药品100递送到胃肠(GI)道中的递送部位DS的装置110的另一实施方案可包括:胶囊120,其大小设定为被吞服并穿过肠道;展开构件130;含有医药品100的一个或多个组织穿透构件140;可展开的对准器160;和递送机构170。在一些实施方案中,医药品100(本文中亦称为制剂100)本身可构成组织穿透构件140。可展开的对准器160安放于胶囊内,并被配置用于将胶囊与肠如小肠对准。通常,这将会需要使胶囊的纵轴线与肠的纵轴线对准;然而,还设想到其他对准。递送机构170被配置用于将医药品100递送到肠壁中,并且通常将会包括递送构件172,如可扩张性构件。展开构件130被配置用于展开对准器160或递送机构170中的至少一个。如本文将进一步描述的,整个胶囊壁或其一部分可通过与胃肠道中的液体相接触而降解,以便允许这些液体触发由装置110对医药品100的递送。本文所用的,“胃肠道”是指食管、胃、小肠、大肠和肛门,而“肠道”是指小肠和大肠。本发明的各个实施方案可被配置和布置用于医药品100向肠道以及整个胃肠道中的递送。包括组织穿透构件140的装置110可被配置用于递送液体、半液体或固体形式的医药品100或者所有三种形式的组合。无论何种形式,医药品100都理想地具有材料一致性,从而允许将医药品推出装置110,推入肠壁(例如小肠或大肠)或胃肠道中的其他内腔壁中,然后在肠壁内降解,以释放药物或其他治疗剂101。医药品100的材料一致性可包括制剂的硬度、孔隙度和溶解度(在体液中)中的一个或多个。材料一致性可通过选择和使用以下中的一项或多项来实现:i)用于制作制剂的压实力;ii)使用本领域已知的一种或多种药用崩解剂;iii)使用其他药用赋形剂;iv)制剂(例如,微粉化颗粒)的颗粒大小和分布;以及v)使用本领域已知的微粉化和其他颗粒成型方法。胶囊120的大小设定为被吞服并穿过肠道。还可以根据待递送的药物的量和患者体重以及成人与儿科应用来调整尺寸。通常,胶囊将会具有管状形状或胶囊形状,该管状形状具有与维生素相似的弯曲端。在这些实施方案和相关实施方案中,胶囊长度120L可在0.5-2英寸的范围内,并且直径120D可在0.1-0.5英寸的范围内,并且设想到其他尺寸。胶囊120包括胶囊壁121w,胶囊壁121w具有外表面125和限定内部空间或容积124v的内表面124。在一些实施方案中,胶囊壁121w可包括大小设定为用于组织穿透构件140向外推进的一个或多个孔口126。除了装置110的其他组件(例如,可扩张性构件等)之外,内部容积可包括一个或多个隔室或储器127。胶囊可由制药领域中已知的各种可生物降解性明胶材料制成,但是还可包括各种肠溶衣120c,肠溶衣120c被配置用于保护帽以免在胃中(由于酸等原因)降解,然后后续在小肠或肠道其他区域中存在的较高pH下降解。在各个实施方案中,胶囊120可由多个部分形成,所述多个部分中的一个或多个可以是可生物降解的。在许多实施方案中,胶囊120可由两个部分120p-如主体部分120p”(在此为主体120p”)和帽部分120p’(在此为帽120p’)-形成,其中帽例如通过在主体之上或之下滑动(还设想到其他布置)而装配到主体上。一个部分,如帽120p’,可包括被配置成在高于第一pH(例如,pH5.5)下降解的第一包衣120c’,而第二部分,如主体120p”,可包括被配置成在高于第二较高pH(例如,6.5)下降解的第二包衣120c”。胶囊120的内表面124和外表面125两者涂覆有包衣120c’和120c”,使得胶囊的任一部分在其接触具有选定pH的流体之前将会基本上得到保存。对于主体120p”的情况而言,这允许维持主体120p”的结构完整性,以便保持球囊172处于主体部分内部并且不展开,直到球囊130已经扩张为止。包衣120c’和120c”可包括各种基于甲基丙烯酸酯和丙烯酸乙酯的包衣,诸如由EvonikIndustries以商品名EUDRAGIT生产的那些包衣。胶囊120的这些包衣和其他双包衣配置允许处于胶囊120的一个部分中的机构在处于胶囊的其他部分中的机构之前得到促动。这是因为肠液会首先进入较低pH包衣已经降解的那些部分,从而促动对这类流体起反应的触发器(例如,可降解性阀)。在使用中,胶囊120的此类双包衣实施方案提供了向小肠中的特定位置(或者胃肠道中的其他位置)靶向递送药物,以及改善递送过程中的可靠性。这是因为诸如对准器160等特定组件的展开可被配置成开始于小肠的上部区域(例如,十二指肠)中,从而允许胶囊在肠内对准以便最佳地递送药物(例如,递送到肠壁中),以及提供足够的时间来展开/促动其他组件,以实现在胶囊仍然处于小肠中或其他选定位置时向肠壁中递送药物。如以上所论述的,胶囊120的一个或多个部分可由本领域已知的各种生物相容性聚合物制成,所述生物相容性聚合物包括各种可生物降解性聚合物,在优选实施方案中可包括纤维素、明胶材料和PGLA(聚乳酸-共-羟基乙酸)。其他合适的可生物降解性材料包括本文所述的各种肠溶材料以及丙交酯、乙交酯、乳酸、羟基乙酸、对二噁烷酮、己内酯、三亚甲基碳酸酯、己内酯,及其掺合物和共聚物。在各个实施方案中,胶囊的壁120w可通过与胃肠道中的液体(例如,小肠中的液体)相接触而降解。在优选实施方案中,胶囊壁被配置成在穿过胃期间保持完好,但随后在小肠中降解。在一个或多个实施方案中,这可以通过在胶囊壁120w上使用外包衣或外层120c来实现,外包衣或外层120c仅在小肠中存在的较高pH下降解,并有助于保护下面的胶囊壁免于在胶囊到达小肠(此时如本文所述,药物递送过程由包衣的降解引发)之前在胃内降解。在使用中,这样的包衣允许治疗剂在诸如小肠的肠道选定部分中靶向递送。与胶囊20类似,在各个实施方案中,胶囊120可包括各种不透射线的材料、回声材料或其他材料,以用于使用诸如荧光透视、超声、MRI等一种或多种医学成像方式来对装置进行定位。如本文进一步论述的,在许多实施方案中,展开构件130、递送构件172或可展开的对准器160中的一个或多个可以对应于形状和大小被设定用于装配在胶囊120内的可扩张性球囊。因此,为了便于论述,现在将会把展开构件130、递送构件172和可展开的对准器160称为球囊130、160和172;然而应当理解,还设想到用于这些元件的、包括各种可扩张性装置在内的其他装置,并且这些装置可以例如包括具有与胶囊120的内部容积124v相对应的扩张形状和大小的各种形状记忆装置(例如,由形状记忆式可生物降解性聚合物脊状物或弹簧制成的可扩张性篮)或弹簧、可扩张性压电装置和/或可化学扩张性装置。球囊130、160和172中的一个或多个可包含医疗装置领域中已知的各种聚合物。在优选实施方案中,这样的聚合物可包括一种或多种类型的聚乙烯(PE),其可对应于低密度PE(LDPE)、线性低密度PE(LLDPE)、中密度PE(MDPE)和高密度PE(HDPE)以及本领域已知的其他形式的聚乙烯。在使用聚乙烯的一个或多个实施方案中,可使用本领域已知的聚合物辐照方法对材料进行交联。在特定实施方案中,可以使用基于辐射的交联来通过降低球囊材料的可塑性而控制球囊的膨胀直径和形状。可以选择辐射的量来实现特定量的交联,进而为给定的球囊产生特定量的可塑性,例如,可以使用增加的辐照来产生更硬的、更低可塑性的球囊材料。其他合适的聚合物可包括PET(聚对苯二甲酸乙二醇酯)、有机硅和聚氨酯。在各个实施方案中,球囊130、160和172还可包含诸如硫酸钡等本领域已知的各种不透射线材料,以允许医师确定球囊的位置和物理状态(例如,未膨胀、已膨胀或刺穿)。球囊130、160和172可使用球囊导管领域中已知的各种球囊吹制法(例如,模具吹制、无模吹制等)制成,以具有大致与胶囊120的内部容积124v相对应的形状和大小。在各个实施方案中,球囊130、160和172中的一个或多个以及各个连接特征(例如,连接管)可具有由单一模具形成的整体构造。采用这样的整体构造的实施方案由于在装置110的一个或多个组件之间所必须制出的接合处较少而提供了改善可制造性和可靠性的益处。球囊130、160和172的合适形状包括具有锥形或弯曲端部的各种圆柱形形状(这样的形状的示例包括热狗形)。在一些实施方案中,球囊130、160和172中的一个或多个的膨胀大小(例如,直径)可大于胶囊120,以便致使胶囊因膨胀力(例如,由于环向应力)而裂开。在其他相关的实施方案中,球囊130、160和172中的一个或多个的膨胀大小可以使得当膨胀时:i)胶囊120与小肠壁充分接触以便引起蠕动收缩,从而导致小肠围绕胶囊收缩;和/或ii)允许消除小肠的褶皱。这些结果都允许改善胶囊/球囊表面与肠壁之间的接触,从而在胶囊和/或递送球囊172的选定区域上递送组织穿透构件140。理想地,球囊130、160和172的壁将会是薄的,并且可以具有在0.005-0.0001”范围内,更优选地在0.005-0.0001范围内的壁厚,其中特定实施方案为0.004、0.003、0.002、0.001和0.0005。另外,在各个实施方案中,球囊130、160或172中的一个或多个可具有嵌套式球囊配置,该嵌套式球囊配置具有膨胀室160IC和延伸的指部160EF,如图13c的实施方案中所示。连接膨胀室160IC的连接管道163可以是狭窄的,以便仅允许气体168通过;而将球囊130的两个半部耦合起来的连接管道36可以更大,以便允许水通过。如上所述,对准器160通常将会包含可扩张性球囊,并且为了便于讨论,现在将其称为对准器球囊160或球囊160。球囊160可使用如上所述的材料和方法制造而成。该球囊具有未扩张状态和扩张状态(亦称为展开状态)。在其扩张状态或展开状态下,球囊160延长胶囊120的长度,使得由小肠SI的蠕动收缩而对胶囊120施加的力有助于将胶囊120的纵轴线120LA以平行的方式与小肠SI的纵轴线LAI对准。这进而有助于将组织穿透构件140的轴杆以垂直的方式与肠壁IW的表面对准,以增强和优化组织穿透构件140向肠壁IW中的穿透。除了有助于将胶囊120在小肠中对准之外,对准器160还被配置用于在递送球囊172膨胀之前将递送机构170推出胶囊120,使得递送球囊和/或机构不会受到胶囊的阻碍。在使用中,由于不必在能够发生药物递送之前等待胶囊的特定部分(例如,覆盖在递送机构上面的部分)降解,因此对准器160的这种推出功能改善了递送治疗剂的可靠性。球囊160可借助于聚合物管或其他流体耦合件162而流体耦合到包括球囊130和172在内的装置110的一个或多个组件,聚合物管或其他流体耦合件162可包括用于耦合球囊160和130的管163以及用于耦合球囊160和球囊172的管164。管163被配置用于允许球囊160由来自球囊130的压力(例如,球囊130内的化学反应物的混合物所生成的压力)而扩张/膨胀,并且/或者以其他方式允许液体在球囊130与160之间通过,以便引发用于使球囊130和160之一或全部二者膨胀的生成气体的化学反应。管164将球囊160连接到球囊172,以便允许球囊172通过球囊160而膨胀。在许多实施方案中,管164包括或者耦合至控制阀155,控制阀155被配置用于在选定的压强下打开,以便控制球囊172通过球囊160而膨胀。管164因此可包含连接至阀的近端部164p和从阀引出的远端部164d。通常,近端部164p和远端部164d将如下所述连接到阀罩158。阀155可包含放置在阀罩158的腔室158c内(或者,其可直接放置在管道164内)的材料157的三角形或其他形状的区段156。区段157被配置成在选定压强下机械降解(例如,撕裂、剪断、分层等),以便允许气体通过管164和/或阀室158c。用于阀155的合适材料157可包括蜂蜡或者医学领域中已知的、具有可选择密封力/爆破压强的其他形式的蜡和各种粘合剂。阀配件158通常将包含薄圆柱形隔室(由可生物降解性材料制成),在该隔室中放置材料157的区段156(如图13b的实施方案中所示),以便将腔室158c的壁密封在一起或者以其他方式阻碍流体穿过腔室。阀155的释放压强可通过对区段156的大小和形状中的一个或多个的选择以及对材料157(例如,针对诸如粘合强度、抗剪强度等性质)的选择而得到控制。在使用中,控制阀155允许球囊160和172顺序膨胀,使得球囊160在球囊172膨胀之前被完全膨胀或者基本上膨胀。这进而允许球囊160在球囊172膨胀之前将球囊172连同递送机构170的其余部分一起推出胶囊120(通常从主体部分120p’推出),使得组织穿透构件140的展开不受胶囊120的阻碍。在使用中,由于组织穿透构件140向肠壁IW中的推进不受胶囊壁120w的阻碍,因此这样的方法在实现期望的穿透深度和递送胶囊120中所包含的更多数目的穿透构件140方面均改善了组织穿透构件140向肠壁IW中的穿透的可靠性。如上文所述,对准器球囊160的膨胀长度160l足以使胶囊120由于肠的蠕动收缩而变得与小肠的横轴线对准。对准器160的合适的膨胀长度160l可以包括介于胶囊120在对准器160膨胀之前的长度120l的大约1/2至两倍之间的范围。对准器球囊160的合适的形状可以包括各种细长形状,诸如热狗状的形状。在特定实施方案中,球囊160可包括第一区段160’和第二区段160”,其中第一区段160’的扩张被配置用于将递送机构170从胶囊120中推出(通常从其中推出),而第二区段160”用于使递送球囊172膨胀。在这些实施方案和相关实施方案中,第一区段160’和第二区段160”可被配置成具有伸缩套筒(telescope)样式的膨胀,其中第一区段160’首先膨胀以将机构170推出胶囊(通常从主体部分120p’推出),然后第二区段160”膨胀以使递送构件172膨胀。这可以通过如下实现:将第一区段160’配置成具有比第二区段160”更小的直径和体积,以使得第一区段160’首先膨胀(由于其较小的体积),而第二区段160”在第一区段160’已基本上膨胀之前不膨胀。在一个实施方案中,这可以通过使用连接区段160’和160”的控制阀155(如上所述)而得到促进,控制阀155在区段160’中已达到最小压强之前不允许气体通入区段160”。在一些实施方案中,对准器球囊可含有化学反应物,该化学反应物在与来自展开球囊的水或其他液体相混合时发生反应。在许多实施方案中,展开构件130将会包含被称为展开球囊130的可扩张性球囊。在各个实施方案中,展开球囊130被配置用于通过使用气体(例如由化学品生成气体169)来促进对准器球囊160的展开/扩张。气体可通过随后与水或其他水性液体168相混合的诸如酸166(例如,柠檬酸)和碱166(例如,碳酸氢钾、碳酸氢钠等)等固态化学反应物165的反应而生成。反应物的量使用化学计量法来选择,以在球囊130、160和172中的一个或多个中产生选定的压强。反应物165和液体可以分开储存在球囊130和160中,然后响应于诸如小肠中的pH条件等触发事件而被汇集在一起。反应物165和液体168可储存在任一球囊中,然而在优选实施方案中,液体168储存在球囊130中,而反应物165储存在球囊160中。为了允许液体168通过以开始反应和/或产生气体169,球囊130可借助于连接管163耦合至对准器球囊160,连接管163通常还包括分离装置150,诸如下文所述的可降解性阀150。对于球囊130含有液体的实施方案,管163具有足够的直径来允许足够的水从球囊130流通到球囊60,以产生期望的气体量来使球囊160膨胀,也使球囊172膨胀。另外,当球囊130含有液体时,球囊130和管163中之一或二者被配置用于允许液体通过以下方式中的一个或多个而流通至球囊160:i)由小肠在暴露的球囊130上的蠕动收缩而施加到球囊130的压缩力;以及ii)通过毛细管作用经由管163对液体的芯吸。管163通常将会包括可降解的分离阀或其他分离装置150,该可降解的分离阀或其他分离装置150将球囊130的内容物(例如,水158)与球囊160的内容物(例如,反应物165)相分离直到阀降解为止。阀150可由诸如麦芽糖等材料制成,该材料可被液态水降解,使得阀在暴露于水以及消化道中的各种液体时打开。阀还可以由可响应于肠液中存在的较高pH而降解的材料制成,诸如基于甲基丙烯酸酯的包衣。阀理想地安放在管163上的突出至球囊130上方和/或以其他方式充分暴露的位置处,以使得在帽120p’降解时阀150暴露于进入胶囊的肠液。在各个实施方案中,阀150可安放成位于球囊130的表面上或者甚至突出至球囊130的上方(如图16a和图16b的实施方案中所示),使得一旦帽120p’降解,阀150就明显地暴露于肠液。本发明的各个实施方案提供了分离阀150的多种结构,例如,梁状结构(其中阀包含压在管163和/或连接区段136上的梁)或者套环式结构(其中阀包含位于管163和/或连接区段136之上的套环)。还设想到其他阀结构。球囊130具有展开状态和未展开状态。在展开状态下,展开球囊130可以具有与胶囊的端部形状相对应的拱顶形状130d。还设想到展开球囊130的其他形状130s,如球形、管形等。反应物165通常将会包括至少两种反应物166和167,例如,诸如柠檬酸的酸和诸如碳酸氢钠的碱。还设想到包括其他酸(例如,乙酸)和其他碱(例如,氢氧化钠)的其他反应物165。当阀或其他分离装置150打开时,反应物在液体中混合并产生诸如二氧化碳等气体,该气体使对准器球囊160或其他可扩张性构件扩张。在图13b中所示的替代实施方案中,展开球囊130可实际上包含通过管136或其他连接装置136(例如,连接区段)连接的第一球囊130’和第二球囊130”。连接管136通常将包括分离阀150,分离阀150可通过如上所述的液体和/或具有诸如小肠中存在的碱性pH等特定pH(例如5.5或6.5)的液体而降解。两个球囊130’和130”可各自具有半拱顶形状130hs,从而允许它们在处于扩张状态时装配到胶囊的端部中。一个球囊可含有(一种或多种)化学反应物165(例如,碳酸氢钠、柠檬酸等),而另一球囊含有液态水168,使得当阀降解时,两种组分混合以形成气体,该气体使球囊130’和130”之一或二者膨胀,进而使对准器球囊160膨胀。在另一替代实施方案中,球囊130可包含多隔室球囊130mc,多隔室球囊130mc形成为或以其他方式构造为具有多个隔室130c。通常,隔室130c将至少包括第一隔室134和第二隔室135,第一隔室134和第二隔室135由分离阀150或其他分离装置150所分离,如图14a的实施方案中所示。在许多实施方案中,隔室134和135将于其间至少具有小连接区段136,小连接区段136在通常放置分离阀150之处。如图14a的实施方案中所示,可以在第一隔室134内安设液体168(通常为水),而在第二隔室135中安设一种或多种反应物165(通常为固体,但亦可使用液体)。当阀150打开(例如,由于小肠内的流体所造成的降解)时,液体168进入隔室135(反之亦然,或者二者同时发生),反应物165与该液体混合并产生诸如二氧化碳等气体169,气体169使球囊130扩张,进而可用于使球囊160和172中的一个或多个扩张。反应物165通常将至少包括第一反应物166和第二反应物167,例如,诸如柠檬酸的酸和诸如碳酸氢钠或碳酸氢钾的碱。如本文所讨论的,在各个实施方案中,可将第一反应物和第二反应物放置在球囊130(包括隔室134和135或者半部130’和130”)和球囊160中的一个或多个中。还设想到另外的反应物,包括产生惰性气体副产物的酸和碱的其他组合。对于使用柠檬酸和碳酸氢钠或碳酸氢钾的实施方案,这两种反应物(例如,柠檬酸与碳酸氢钾)之间的比率可以在约1:1至约1:4的范围内,特定比率为约1:3。理想地,固体反应物165具有很少的吸收水或者没有吸收水。因此,诸如碳酸氢钠或碳酸氢钾的反应物中的一种或多种可以在放置于球囊130内之前被预先干燥(例如,通过真空干燥)。还设想到其他反应物165,包括其他酸(例如,乙酸)和碱。包括反应物组合在内的特定反应物165的量可以使用针对特定化学反应的已知的化学计量方程以及球囊的膨胀体积和理想气体定律(例如,PV=nRT)来选择,以便产生特定的压强。在特定的实施方案中,可以选择反应物的量来产生所选定的压强,使球囊130、160和172中的一个或多个:i)实现向肠壁中的特定穿透深度;以及产生球囊130、160和172中的一个或多个的特定直径;以及iii)对肠壁IW施加选定量的力。在特定实施方案中,可以选择反应物(例如,柠檬酸和碳酸氢钾)的量和比率,以在球囊130、160和172中的一个或多个中实现处于10-15psi的范围内的压强,还设想到更小或更大的压强。再一次地,可以使用已知的化学计量方程来确定用于实现这些压强的反应物的量和比率。在使用化学反应物165产生气体169的本发明各个实施方案中,化学反应物独自或与展开球囊130相结合可以构成展开引擎180,用于展开对准器球囊160和包括递送球囊172的递送机构170之一或二者。展开引擎180还可包括使用两个展开球囊130和130”(如图13b中所示的双拱顶配置)或如图14a中所示的多隔室球囊130mc的实施方案。本发明的各个实施方案还设想到展开引擎180的其他形式,诸如使用可扩张性压电材料(其通过施加电压而扩张)、弹簧和其他形状记忆材料以及各种可热膨胀性材料。可扩张性球囊130、160和172中的一个或多个还将通常包括排气阀159,排气阀159用于在球囊膨胀之后使球囊缩小。排气阀159可以包含可生物降解性材料,所述可生物降解性材料被配置成在暴露于小肠中的流体和/或球囊隔室之一内的液体时降解,以便产生用于特定球囊内的气体逸出的开口或通道。理想地,排气阀159被配置成以与阀150相比更缓慢的速率降解,以允许足够的时间用于球囊130、160和172在排气阀降解之前的膨胀。如图14a的实施方案中所示,在隔室化的球囊130的各个实施方案中,排气阀159可对应于安放于球囊端部131上的可降解性区段139。在该实施方案和相关的实施方案中,当可降解性区段139因暴露于所述液体而降解时,球囊壁132撕裂或以其他方式裂开,从而提供高准确性的快速缩小。可以将多个可降解性区段139放置在球囊壁132内的各个位置。如图13b的实施方案中所示,在球囊172的各个实施方案中,排气阀159可对应于附接至递送球囊172的端部172e(与耦合至对准器球囊的一端相对)的管阀173。管阀173包含具有内腔的中空管173t,该内腔在选定的位置173l处被诸如麦芽糖等材料173m所阻塞,材料173m在暴露于诸如小肠中的流体等流体时降解。阻塞材料173m在管173t中的位置173l被选择用于为递送球囊172提供足够的时间,以在阻塞材料溶解从而打开阀173之前膨胀,并将组织穿透构件140递送到肠壁IW中。通常,该位置将会靠近管173t的端部173e,但并不完全处于端部173e,以便允许用于液体在到达材料173m之前必须芯吸到管内腔中的时间。根据一个或多个实施方案,一旦排气阀173打开,其不仅用于使递送球囊172缩小,而且还用于使对准器球囊160和展开球囊130缩小,这是因为在许多实施方案中,所有三个球囊都是流体相连的(对准器球囊流体连接到递送球囊172,并且展开球囊130流体连接到对准器球囊160)。通过将排气阀173放置在因对准器球囊160的膨胀而被驱动到胶囊120之外的递送球囊172的端部172e上以使得排气阀良好地暴露于小肠中的液体,可以促进排气阀173的打开。类似的排气管阀173还可安放于对准器球囊162和展开球囊130之一或两者上。在这后两种情况中,管阀中的阻塞材料可被配置成在一段时间内降解,以便允许足够的时间用于递送球囊172的膨胀和组织穿透构件140向肠壁中的推进。另外,作为确保缩小的另一种备选,可将一个或多个穿刺元件182附接至胶囊的内表面124,使得当球囊(例如,球囊130、160、172)完全膨胀时,所述球囊接触穿刺元件182并被穿刺元件182刺穿。穿刺元件182可包含自表面124突出的具有尖头尖端的短突出物。在用于球囊缩小的装置的另一替代或附加实施方案中,组织穿透构件140中的一个或多个可直接耦合至球囊172的壁172w,并且被配置成在它们脱离时从球囊上撕掉,从而在该过程中撕裂球囊壁。现将对组织穿透构件140作出讨论。组织穿透构件140可由各种药物和其他治疗剂101、一种或多种药用赋形剂(例如,崩解剂、稳定剂等)以及一种或多种可生物降解性聚合物制造。后几种材料被选择用于向穿透构件赋予期望的结构和材料性质(例如,用于向肠壁中的插入的裂断强度,或者用于控制药物的释放的孔隙度和亲水性)。现在参见图18a-图18f,在许多实施方案中,如图18a的实施方案中所示,穿透构件140可以形成为具有轴杆144和针尖端145或者其他尖头尖端145,以便容易地穿透肠壁的组织。在优选实施方案中,尖端145具有如图18c的实施方案中所示的套管针形状。尖端145可包含(在尖端的主体内或者作为包衣的)各种可降解性材料,如蔗糖或者增加尖端的硬度和组织穿透性质的其他糖。一旦穿透构件140处于肠壁中就被壁组织内的间质流体降解,从而药物或其他治疗剂101溶解在所述流体中并被吸收到血流中。组织穿透构件140的大小、形状和化学组成中的一个或多个可以被选择成允许在几秒、几分钟或甚至几小时内溶解和吸收药物101。在特定实施方案中,溶解速率可以通过使用制药领域中已知的各种崩解剂来控制。崩解剂的示例包括但不限于各种淀粉诸如羟基乙酸淀粉钠以及各种交联的聚合物诸如羧甲基纤维素。崩解剂的选择可以具体地针对小肠壁内的环境来调整。组织穿透构件140通常还将包括诸如倒钩或挂钩等一个或多个组织保持特征143,用于在推进后将穿透构件保持在肠壁IW或周围组织(例如腹膜壁)的组织内。保持特征143可以布置成各种图案143p以增强组织保持,如围绕和沿着构件轴杆144对称地或以其他方式分布的两个或更多个倒钩,如图18a和图18b的实施方案中所示。另外,在许多实施方案中,穿透构件还将包括凹陷或其他配合特征146,用于附接至递送机构170上的耦合组件。组织穿透构件140理想地配置成可脱离地耦合至平台175(或递送机构170的其他组件),使得在组织穿透构件140向肠壁中推进之后,穿透构件从球囊上脱离。可脱离性可以通过多种方式实现,包括:i)平台175中的开口174与构件轴杆144之间的贴合或配合;ii)组织保持特征143在穿透构件140上的配置和放置;以及iii)轴杆144向肠壁中的穿透深度。利用这些因素中的一个或多个,可将穿透构件140配置成由于球囊缩小(其中在球囊缩小或者以其他方式被向回拉离肠壁时,保持特征143将穿透构件140保持在组织中)和/或小肠的蠕动收缩所施加于胶囊120上的力而脱离。在具体实施方案中,可以通过将组织穿透构件轴杆144配置成具有如图18c的实施方案中所示的倒锥形部144t来增强组织穿透构件140在肠壁IW或周围组织(例如,腹膜壁)中的可脱离性和保持。轴杆144上的锥形部144t被配置成使得来自肠壁的蠕动收缩力在轴杆上的施加会导致轴杆被向内推动(例如,向内挤压)。这是由于轴杆的锥形部144t将横向施加的蠕动力PF转换成作用于迫使轴杆向内进入肠壁中的正交力OF。在使用中,这样的倒锥形轴杆配置有助于将组织穿透构件140保持在肠壁内,以便在球囊172缩小时从平台175(或递送机构170的其他组件)脱离。在另外的实施方案中,具有倒锥形轴杆的组织穿透构件140还可包括一个或多个保持特征143,以便组织穿透构件一旦插入就进一步增强其在肠壁IW内的保持。如上所述,在各个实施方案中,组织穿透构件140可由许多药物和其他治疗剂101(包括各种抗体诸如IgG)制成。另外,根据一个或多个实施方案,组织穿透构件可完全由药物/治疗剂101制成,或者也可具有其他组成组分,例如,各种药用赋形剂(例如,粘结剂、防腐剂、崩解剂等)、赋予期望的机械性质的聚合物等。此外,在各个实施方案中,一个或多个组织穿透构件140可承载与其他组织穿透构件相同或不同的药物101(或其他治疗剂)。前一种配置允许递送较大量的特定药物101,而后一种配置允许大致同时将两种或更多种不同药物递送到肠壁中,以促进需要基本上并行递送多种药物的药物治疗方案。在具有多个递送组装件178(例如,两个递送组装件,在球囊172的每个面上各一个)的装置110的实施方案中,第一组装件178’可承载具有第一药物101的组织穿透构件,并且第二组装件178”可承载具有第二药物101的组织穿透构件。通常,由组织穿透构件140所承载的药物或其他治疗剂101将会与可生物降解性材料105相混合以形成组织穿透构件140。材料105可包括一种或多种可生物降解性聚合物,例如PGLA、纤维素,以及诸如麦芽糖的糖或者本文所述或本领域已知的其他可生物降解性材料。在这样的实施方案中,穿透构件140可包含药物101与可生物降解性材料105的基本上不均一的混合物。或者,如图18d的实施方案中所示,组织穿透构件140可包括基本上由可生物降解性材料105形成的部分141和由药物101形成或含有药物101的单独区段142。在一个或多个实施方案中,区段142可对应于药物101的丸状、块状、圆柱形或其他成形区段142s。如图18e和图18f的实施方案中所示,成形区段142s可以预先形成为单独区段,然后插入到组织穿透构件140中的空腔142c中。或者,区段142s可通过将药物制剂100添加到空腔142c而形成。在实施方案中,在将药物制剂100添加到空腔142c的情况下,制剂可作为浇注或注射到空腔142c中的粉末、液体或凝胶来添加。成形区段142s可由药物101本身所形成,或者由含有药物101和一种或多种粘结剂、防腐剂、崩解剂及其他赋形剂的药物制剂所形成。合适的粘结剂包括聚乙二醇(PEG)和本领域公知的其他粘结剂。在各个实施方案中,PEG或其他粘结剂可构成区段142s的约10%-90%的重量百分比,并且用于胰岛素制剂的优选实施方案为约25-90重量百分比。可用于粘结剂的其他赋形剂可以包括PLA、PLGA、环糊精、纤维素、甲基纤维素、麦芽糖、糊精、蔗糖和PGA。关于区段142中的赋形剂的重量百分比的更多信息可见表1。为便于讨论,在该表中将区段142称为丸粒,但表中的数据还可适用于本文所述的区段142的其他实施方案。在各个实施方案中,组织穿透构件140的重量范围可介于约10至15mg之间,并且设想到更大和更小的重量。对于由麦芽糖制成的组织穿透构件140的实施方案,重量的范围可介于约11至14mg之间。在各个实施方案中,根据药物101和期望的递送剂量,构件140中的药物的重量百分比的范围可介于约0.1%至约15%之间。在示例性实施方案中,这些重量百分比对应于由麦芽糖或PGLA制成的构件140的实施方案,然而,它们还可适用于在构件140的制造中所使用的任何可生物降解性材料105。可以根据期望的剂量,以及为了提供药物的结构和化学计量稳定性,并且还为了实现药物在血液或身体其他组织中的期望的浓度曲线,来调整构件140中的药物或其他治疗剂101的重量百分比。可以使用本领域已知的各种稳定性试验和模型(例如,使用阿伦尼乌斯方程)和/或已知的药物化学降解速率来在重量百分比范围内作出具体调整。表1列出了可通过组织穿透构件140递送的胰岛素和多种其他药物的剂量和重量百分比范围。在一些情况下,该表列出了剂量的范围以及单一值。应当理解,这些值是示例性的,并且还考虑到在本文中(包括权利要求书)所记载的其他值。此外,本发明的实施方案还考虑到在这些值周围的变动,包括例如±1、±5、±10、±25以及甚至更大的变动。这样的变动被认为落入宣称特定值或值的范围的实施方案的范围之内。该表还针对各种药物和其他治疗剂,列出了药物在区段142中的重量百分比,其中再次为了便于讨论,区段142被称为丸粒。另外,本发明的实施方案考虑到上述变动。表1组织穿透构件140可使用本领域已知的一种或多种聚合物和医药制造技术来制造。例如,药物101(具有或不具有可生物降解性材料105)可以是固体形式,然后使用模塑、压实或其他类似的方法,添加一种或多种粘结剂而形成为组织穿透构件140的形状。或者,药物101和/或药物制剂100可以是固体或液体形式,然后被添加到液体形式的可生物降解性材料105中,并且然后使用模塑或聚合物领域中已知的其他成型方法使该混合物形成穿透构件140。理想地,包含药物或其他治疗剂101和可降解性材料105的组织穿透构件140的实施方案在不产生包括诸如各种肽和蛋白质等药物在内的药物的任何显著热降解的温度下形成。这可以通过使用本领域已知的室温固化聚合物、室温模塑和溶剂蒸发技术来实现。在特定的实施方案中,组织穿透构件内的热降解的药物或其他治疗剂的量期望地按重量计小于约10%,且更优选地小于5%,且更加优选地小于1%。特定药物的热降解温度是已知的,或者可以使用本领域已知的方法来确定,然后可使用该温度来选择和调整特定的聚合物加工方法(例如,模塑、固化、溶剂蒸发方法等),以使温度和相关联的药物热降解程度最小化。将要提供对递送机构170的描述。通常,如图16a和图16b的实施方案中所示,该机构将包含附接至递送球囊172的递送组装件178(含有组织穿透构件140)。递送球囊的膨胀提供机械力,用于从胶囊向外接合递送组装件172并进入肠壁IW中,以便将组织穿透构件140插入到肠壁中。在各个实施方案中,递送球囊172可具有细长形状,该细长形状具有通过铰接式手风琴状主体172b连接的两个相对平坦的面172f。平坦面172f可配置成在球囊172扩张时压抵在肠壁(IW)上,以便将组织穿透构件(TPM)140插入肠壁中。TPM140(自身或者如下所述作为递送组装件178的一部分)可安放在球囊172的一个或全部两个面172f上,以允许含有药物的TPM140插入在肠壁IW的相对侧上。球囊172的面172f可具有足够的表面积,以允许多个含有药物的TPM140放置在每个面上。现在参见图19,将要提供对递送组装件178的组装的描述。在第一步骤300中,可将一个或多个组织穿透构件140可脱离地耦合至可生物降解的推进结构175,推进结构175可对应于支撑平台175(又称为平台175)。在优选实施方案中,平台175包括用于如步骤300所示插入构件140的一个或多个开口174。开口174的大小设定为允许构件140在球囊172扩张之前插入并保持在平台175中,同时允许所述构件在其穿透到肠壁中时从平台脱离。然后可如步骤301所示将支撑平台175安放在承载结构176内。承载结构176可对应于孔结构176,孔结构176具有限定了空腔或开口176c的侧壁176s和底壁176b。平台175理想地使用本领域已知的粘合剂或其他连结方法附接至底壁176b的内表面。孔结构176可包含各种聚合物材料,并且可使用聚合物加工领域中已知的真空成型技术而形成。如步骤302所示,在许多实施方案中,可使用保护膜177来覆盖开口176o。保护膜177具有被选择以发挥屏障作用的性质,以便如下文所述保护组织穿透构件140免受湿气和氧化的影响,同时仍然允许组织穿透构件140穿透所述膜。膜177可包含各种不透水和/或不透氧的聚合物,所述聚合物理想地被配置成可在小肠中生物降解和/或惰性地通过消化道。所述膜还可具有多层构造,该多层构造具有为了对于例如氧、水蒸气等给定物质的不透性而选择的特定层。在使用中,采用保护膜177的实施方案有助于增加组织穿透构件140中的治疗剂101的保存期限,进而增加装置110的保存期限。支撑平台175附接的组织穿透构件140、孔结构176和膜177可共同地构成递送组装件178。具有包含于组织穿透构件140或其他药物递送工具内的一种或多种药物或治疗剂101的递送组装件178可以被预先制造、储存,随后在以后的时间用于装置110的制造。组装件178的保存期限可通过用诸如氮气的惰性气体填充经密封的组装件178的空腔176c而进一步提高。回顾参见图16a和图16b,组装件178可安放在球囊172的一个或全部两个面172f上。在优选实施方案中,组装件178安放在全部两个面172f上(如图16a中所示),以便在球囊172扩张时提供对肠壁IW的相对侧的基本上相等的力分布。组装件178可使用聚合物领域中已知的粘合剂或其他连结方法附接至面172f。当球囊172扩张时,TPM140贯穿膜177,进入肠壁IW并由保持元件143和/或TPM140的其他保持特征(例如,倒锥形轴杆144t)保持在该处,使得TPM140在球囊172缩小时从平台175脱离。在各个实施方案中,可将球囊130、160和172中的一个或多个以折叠、收拢或其他期望的配置装在胶囊120内部,以节省胶囊的内部容积124v内的空间。可以使用预成形褶痕或者医用球囊领域中已知的其他折叠特征或方法来完成折叠。在特定的实施方案中,可以选定的取向折叠球囊130、160和172,以实现以下各项中的一个或多个:i)节省空间;ii)产生特定的膨胀球囊的期望取向;和iii)促进期望顺序的球囊膨胀。图15a-图15f中所示的实施方案示出了折叠方法和各种折叠布置的实施方案。然而应当认识到,这种折叠布置和由此产生的球囊取向是示例性的,还可以使用其他的布置和球囊取向。在该实施方案和相关的实施方案中,可以手动、通过自动化机器或者两者相结合来实现折叠。另外,在许多实施方案中,如图13a和图13b的实施方案中所示,通过使用包含球囊130、160、170;阀室158和各种连接管道162的单一多球囊组装件7(在此称为组装件7)可以使折叠变得容易。图13a示出了具有球囊130的单一拱顶构造的组装件7的实施方案,而图13b示出了具有球囊130的双球囊/拱顶配置的组装件7的实施方案。组装件7可使用聚合物膜制成,该聚合物膜使用聚合物加工领域中已知的各种真空成型和其他相关方法而真空成型为期望的形状。合适的聚合物膜包括聚乙烯膜,该聚乙烯膜的厚度在约0.003至约0.010”的范围内,其中一个具体实施方案为0.005”。在优选实施方案中,将组装件制造成具有整体构造,以便不再需要连结该组装件的一个或多个组件(例如,球囊130、160等)。然而,还设想到由随后使用聚合物/医疗装置领域中已知的各种连结方法连结的多个部分(例如,半部)或组件(例如,球囊)来制成组装件7。现在参见图15a-图15f、图16a-图16b和图17a-图17b,在第一折叠步骤210中,将球囊160折叠到阀配件158上,其中在此过程中球囊172被翻折到阀配件158的相对侧(参见图15a)。然后,在步骤211中,将球囊172折叠成与球囊160和阀158的折叠组合呈直角(参见图15b)。然后,在针对球囊130的双拱顶实施方案的步骤212中,将球囊130的两个半部130’和130”折叠到彼此之上,使阀150保持露出(参见图15c,对于球囊130的单拱顶实施方案,折叠到其自身之上,参见图15e)。最终的折叠步骤213可以通过将折叠的球囊130折叠180°至阀配件158和球囊160的相对侧来完成,以产生图15e中所示的双拱顶配置的最终折叠组装件8以及图15e和图15f中所示的单拱顶配置的最终折叠组装件8’。然后在步骤214中将一个或多个递送组装件178附接至组装件8(通常附接至球囊172的两个面172f),以产生最终组装件9(图16a和图16b的实施方案中所示),最终组装件9随后插入到胶囊120中。在插入步骤215后,具有插入的组装件9的装置110的最终组装形式在图17a和图17b中示出。现在参见图20a-图20i,将提供使用装置110将医药品101递送到胃肠道中的部位(如小肠或大肠壁)的方法的描述。应当认识到,步骤及其次序是示例性的,还设想到其他步骤和次序。如图20b中的步骤400所示,在装置110进入小肠SI后,帽包衣120c’被上部小肠中的碱性pH所降解,从而造成帽120p’的降解。如图20c中的步骤401所示,阀150随后暴露于小肠中的流体,从而造成阀开始降解。然后,如图20d中所示,在步骤402中,球囊130(由于气体169的生成)扩张。然后,如图20e中所示,在步骤403中,球囊160的区段160’开始扩张,从而开始将组装件178从胶囊主体中推出。然后,如图20f中所示,在步骤404中,球囊160的区段160’和160”变得完全膨胀,以将组装件178完全从胶囊主体中推出,从而使胶囊长度120l伸长,以便有助于将胶囊侧向轴线120AL与小肠的侧向轴线LAI对准。在此期间,阀155开始由于球囊60中增大的压强而停止作用(由于球囊已经完全膨胀,并且没有其他让气体169离开之处)。然后,如图20g中所示,在步骤405中,阀155已经完全打开,从而使球囊172膨胀,球囊172随后将现已完全暴露的组装件178(已经被完全推出主体120p”)径向向外推入肠壁IW中。然后,如图20h中所示,在步骤406中,球囊172继续扩张以此时将组织穿透构件推进到肠壁IW中。然后,在步骤407中,球囊172(连同球囊160和130)已经缩小从而拉回,并将组织穿透构件保持于肠壁IW中。另外,胶囊的主体部分120p”连同装置110的其他可生物降解的部分一起已经完全降解(由于包衣120c”的降解)。任何未降解的部分都通过消化引起的蠕动收缩而被经过小肠向远端运送,最终被排出。本发明的药代动力学特征和参数现参照图21-图25,将论述与本发明的方法及其他实施方案相关的各种药代动力学参数和特征。具体而言,本发明的各个实施方案提供了治疗制剂以及用于将治疗剂递送到胃肠壁或周围组织中的相关方法,其中可以实现递送的一种或多种药代动力学参数。此类参数可以包括而不限于药代动力学/药学领域已知的绝对生物利用度、Tmax、T1/2、Cmax和曲线下面积或AUC中的一种或多种。“绝对生物利用度”是相对于静脉内(IV)剂量来自配方制品的到达体循环的药物量,其中IV剂量被假定为100%可生物利用。Tmax是治疗剂在血流中达到其最大浓度Cmax所需的时间段,T1/2是在血流(或体内其他位置)中治疗剂的浓度在已达到Cmax之后达到其初始Cmax值的一半所需的时间段。实施例1,包括图21-图25,提供了药代动力学数据及其他结果,示出了利用本文所述的可吞服胶囊的实施方案向犬科动物递送包含抗体(包括免疫球蛋白G(IgG))的治疗制剂的实施方案而获得的上述参数中的一个或多个。如该实施例中所示,在其中治疗制剂包含抗体诸如IgG的各种实施方案中,通过本发明的实施方案递送的治疗剂的绝对生物利用度可以在约50%至68.3%的范围,其中特定值为60.7%。还设想到其他值。另外,递送抗体例如IgG的Tmax可以是约24小时而T1/2可以在约40.7至128小时的范围,其中特定值为约87.7小时。现参见图21,在各种实施方案中,治疗制剂以及用于将它们递送到小肠壁或周围组织中的相关方法可以被配置成产生治疗剂的具有选定的形状203的血浆/血浓度-时间谱图200,其中以Cmax205或Tmax206或其他药代动力学值作为参照点207。例如,如图21中所示,血浆浓度-时间谱图200可以具有上升部分210和下降部分220,具有上升部分210与下降部分220的时长的选定比率。在具体实施方案中,这是在上升部分期间从治疗剂的递送前浓度204变化到Cmax水平205所耗时间208(此时间对应于Tmax时间206)(也称为上升时间208)与在下降部分210期间从Cmax水平205变回到递送前浓度204所耗时间209(也称为下降时间209)的比率。在各种实施方案中,上升时间208与下降时间209的比率可以在约1至20、1至10和1至5的范围。在包含抗体诸如IgG的治疗制剂的具体实施方案中,在谱图200中上升时间与下降时间的比率可以是约1至9,如图21和图22中所示。还设想到其他比率。对于包含具有较短半衰期的治疗制剂诸如胰岛素的治疗制剂的实施方案,因为治疗剂将从身体更快地清除,所以将预期到上升时间与下降时间的比率较小。本发明的递送IgG或其他类似抗体而获得上述药代动力学参数中的一个或多个的实施方案可以用于治疗一种或多种IgG响应性病况,包括各种自身免疫病和病况以及各种免疫缺陷病和病况。可通过本发明的递送IgG或其他抗体的实施方案治疗的自身免疫病和病况包括但不限于多发性硬化、银屑癣、银屑癣关节炎、强直性脊柱炎、格林-巴利综合征(guillain-barrésyndrome)、多灶性运动神经病、慢性炎症性脱髓鞘性多发性神经病。可通过本发明的递送IgG或其他抗体的实施方案治疗的免疫缺陷病和病况包括但不限于原发性免疫缺陷病诸如X-连锁无丙种球蛋白血症(XLA)和常见变异型免疫缺陷(CVID)等,并且以缺乏和/或受损的抗体功能为特征。结论为了说明和描述,已经介绍了本发明的各个实施方案的前文描述。这并非旨在将本发明限于所公开的确切形式。许多修改、改变和改进对本领域技术人员将是显而易见的。例如,可以将装置的实施方案的大小设定成且以其他方式使其适于各种儿科和新生儿应用以及各种兽医应用。另外,本领域技术人员将会认识到,或者仅使用常规实验就能确定本文所述具体装置和方法的许多等同方案。此类等同方案被视为落入本发明的范围内,并由所附权利要求书涵盖。来自一个实施方案的元件、特性或行动可以容易地与来自其他实施方案的一个或多个元件、特性或行动重新组合或由其取代,以在本发明的范围内形成众多另外的实施方案。此外,所示或所述的与其他元件组合的元件可在各个实施方案中作为独立的元件存在。更进一步地,本发明的实施方案还考虑到排除或负面列举元件、特征、化学品、治疗剂、特性、值或步骤,无论所述元件、特征、化学品、治疗剂、特性、值、步骤等在何处被正面列举。因此,本发明的保护范围不限于所描述的实施方案的具体细节,而是仅由所附权利要求书所限定。实施例参考以下实施例进一步说明本发明的各个实施方案。应理解,仅仅出于说明的目的而呈现这些实施例,并且本发明不应限于其中的信息或细节。实施例1使用可吞服胶囊的实施方案递送IgG的体内动物研究目的:研究目的是展示在清醒的狗中通过本文所述的可吞服胶囊(也称为RaniPillTM或RANIPILL)的实施方案和/或变型口服递送生物治疗分子并且评估其绝对生物利用度。人免疫球蛋白G(IgG)用作此类分子的代表。材料纯化的人IgG从美国德克萨斯州的AlphaDiagnosticInternationalInc.(ADIInc.)(目录号20007-1-100)获得,并且用于此研究中的测试品的制剂。IgG微型片剂由包含90%(w/w)纯化的人IgG和10%(w/w)赋形剂的干粉剂配方批次进行制备。将IgG批次基于物理特性以及由ELISA评估的蛋白回收的验收标准进行分析和合格性检验。将RaniPillTM胶囊通过对有效负载腔室的多性能测试以评估针以怎样的压强和速度展开而进行生产和合格性检验。此外,进行测试以确定峰值化学反应压强来形成足够的气体压强以确保针递送。这些测试验证所述装置的展开可靠性。在本研究中使用的胶囊批次通过了所有的合格性测试。本研究中使用的所有测试品及它们对应的ID号列于表2中。表2.测试品信息研究方案初始地用测试组(即Rani组)进行研究,其中动物接受通过RaniPill的实施方案递送的IgG,在10天期间采集血液样品。基于此初始经验,在方案持续时间延长的情况下,随后增加另外两组IV(静脉内施用IgG)和SC(皮下施用IgG)。每组的具体方案在下文更详细地描述。Rani组:口服施用一个RaniPillTM胶囊(2.4mgIgG/微型片剂);N=3。这是在10天期间被给药并且采集血样的初始组。后续药物水平分析表明该研究持续时间可能太短,以至在所有动物中血清IgG浓度尚未完全恢复至基线水平。因此,对于下两组,将采集血样的方案延长至14天。SC组:将一个IgG微型片剂(2.4mgIgG/微型片剂)溶解于1mL无菌水中以供注射和皮下给药(SC);N=2。IV组:将纯人IgG冻干粉剂(2.4mgIgG)溶解于1mL无菌水以供注射、静脉内给药(IV);N=3。用于每组的受试者和测试材料的细节总结于表3-表5中。在SC组和Rani组中向每只动物施用的IgG总剂量基于微型片剂重量以及微型片剂中的IgG百分比进行计算。在给药之前,将纯人IgG和微型片剂溶解大约30分钟。Rani组口服接受一个胶囊并且被荧光透视监测以确认成功移行到小肠中以及装置展开的时间。表3.用于Rani组的动物和测试材料数据动物ID#动物体重(kg)IgG施用剂量(mg)31075678.12.3331124047.82.3032811338.92.38平均±SD8.1±0.042.34±0.04表4.用于SC组的动物和测试材料数据动物ID#动物体重(kg)IgG施用剂量(mg)30482428.42.3932836328.42.34平均±SD8.4±0.02.37±0.04表5.用于IV组的动物和测试材料数据动物ID#动物体重(kg)IgG施用剂量(mg)25071548.72.3929289749.62.4031332238.42.39平均±SD8.3±0.62.40±0.003结果将对照(IV和SC)组和实验(Rani)组的动物中的血清IgG浓度水平相对于时间作图并且示于图22-25中,图23示出IV递送的结果,图24示出SC递送的结果,图25示出使用RaniPill实施方案递送的结果,并且图22示出所有三组的平均浓度-时间图。根据这些PK(药代动力学)谱图,计算药代动力学参数来确定每个剂量组的IgG的最大浓度(Cmax)、达到Cmax的时间(称为Tmax)、终末消除半衰期(T1/2),以及代表在所耗的时间内至最后时间点期间药物总暴露量的重量归一化的曲线下面积(AUClast),以及外推到无穷的重量归一化的曲线下面积(AUCinf),以及生物利用度(%F)。首先对实验(即Rani)组进行给药和采集样品直至第10天。然而,当分析数据时发现,在所有三只动物中可测量的IgG血清浓度仍然是可检测的。基于这些结果,对后续IV组和SC组进行样品采集直至第14天。为了比较给药群组,通过非隔室方法从血清样品估算PK参数。自给药起标称耗用时间用于估算各个PK参数。IgG的血清浓度水平在IV给药之后直至3.3±1小时达到Cmax,其中平均浓度为5339±179ng/mL。直至第14天检测到可测量的水平,其中平均AUClast为500800±108000ng*h/mL。外推到无穷,AUCinf显示出相似的值513400±111700ng*h/mL,表明样品采集捕获到大部分暴露量。平均清除率(CL)相对低至0.009±0.002mL/min/kg,并且分布的体积(Vz)也是低至0.04±0.01L/kg。平均终末消除半衰期是51.5±3.3小时。在SC组中两只动物的IgG血清浓度具有在120小时1246ng/mL的Cmax,以及在72小时1510ng/mL的Cmax以及49.9小时的平均t1/2。测得平均AUClast和AUCinf分别为274200±21570和298300±46130ng*h/mL。皮下递送的IgG的平均生物利用度计算为50.9%。在实验(Rani)组中所有动物在整个10天研究过程中表现出可测量的IgG水平,如图25中所示。IgG的平均最大浓度(例如,Cmax)在口服施用胶囊10的实施方案之后在24±0小时达到2491±425ng/mL,24±0小时因此对应于Rani组的Tmax。平均AUClast和AUCinf计算为327400±38820和409700±101800ng*h/mL。Rani组的T1/2在40.7至128小时范围,其中平均值为87.7小时。t1/2的此大范围可以表明在该组中未达到实际终末消除半衰期。从外推的AUCinf值(AUCext),外推的百分比范围是4.55%至29.1%,并且3只动物中的2只超过20%。由于此可变性,生物利用度(%F)对于Rani组是使用AUClast进行估算,而对于IV施用则是使用AUCinf值进行估算。%F值(即绝对生物利用度)范围是50.0%至68.3%,平均为60.7%。实施例2:在清醒的狗中口服递送的抗体与皮下(SC)和静脉内(IV)递送的抗体的药代动力学(PK)的比较目的:为了比较在注射入清醒狗的小肠壁中时的人免疫球蛋白(人免疫球蛋白G(huIgG))与皮下和静脉内递送的huIgG的药代动力学。材料和方法表6:动物和测试品在此单剂量可行性研究中,将8只清醒的称重为7.8-9.6kg的接受2.3-2.4mg人免疫球蛋白G(huIgG)的禁食小猎犬如上表6中所示分成三组:1.口服递送OC(RaniPillTM口服胶囊)组(N=3):口服施用OC,其包含密封在中空可溶性针内部的固体形式的约2.3mg的huIgG;2.皮下(SC)组(N=2):以2ml的体积SC注射2.4mg的huIgG;和3.静脉内(IV)组(N=3)。OC的移行是经由荧光透视来跟踪通过胃肠道以确认成功通过并且在小肠中展开。在长达14天期间采集系列血样以通过ELISA测量huIgG的血清浓度。结果表7:药代动力学数据*注意:数据代表为平均±SD在三个研究组中huIgG的药代动力学(PK)谱图示于图26-图29中,PK参数示于上表7中。huIgG的平均绝对生物利用度,在OC中是60.7%,而在SC组中是50.9%。与SC组相比,在OC中观察到的Tmax更短并且Cmax更高。狗缺乏疼痛或行为反应确认了huIgG无痛递送在肠壁中。讨论和结论此研究表明经由OC(RaniPillTM)的实施方案成功地口服递送了大的抗体,其中绝对生物利用度与皮下途径相似。可摄取的OC表现出有效地用于口服递送目前通过频繁痛苦的肠胃外注射递送的治疗性肽和蛋白质。当前第1页12
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

