治疗和预防hiv和aids的方法
1.本技术是国际申请日为2017年2月10日的发明名称为“治疗和预防hiv和aids的方法”的pct/us2017/017283号发明专利申请的分案申请,原申请进入中国国家阶段获得的国家申请号为201780010879.x。
2.发明背景人类免疫缺陷病毒(hiv
‑
1)感染是一种严重的疾病状态,其如果不加治疗,最终会破坏宿主的免疫系统,导致获得性免疫缺陷综合征(aids)和过早死亡。尽管抗逆转录病毒疗法(art)取得了进展,但hiv仍然是全球流行病和全球公共卫生的优先事项。2012年,全球估计有3500万人感染(live with) hiv (全球报告:unaids关于2013年全球aids流行的报告。unaids / jc2502/1/e)。在美国,估计有120万人感染hiv,并且每年约有50,000人成为新感染者。hiv血清反应阳性的个体最初是无症状的,但通常发展aids相关综合征(arc),然后是aids。美国有超过650,000人死于aids,并且每年报告超过14,000例死亡增加。治疗可以帮助具有hiv的人过上更长寿、更健康的生活,但目前美国只有30%的具有hiv的人成功地使其病毒得到控制。(疾病控制和预防中心。今日hiv/aids流行。2015年7月)。
3.核苷类逆转录酶抑制剂(nrtis或nsrtis)抑制hiv逆转录酶并阻断hiv复制。它们是用作有效和持久的多药方案的组分的6类hiv抗逆转录病毒药物(arvs)之一,所述多药方案通常将两种nrti(或nrti与ntrti)与非核苷类逆转录酶抑制剂、整合酶链转移抑制剂或蛋白酶抑制剂组合。联合治疗使治疗反应最大化并使耐药性的出现最小化。
4.由于hiv复制是不同时的,所以抗逆转录病毒剂需要在患者中持续存在以有效抑制病毒血症。对于大多数药物类别,包括蛋白酶抑制剂、整合酶抑制剂和非核苷类逆转录酶抑制剂,由循环药物浓度决定功效,并且给药的目的在于在整个给药间隔提供超过抑制病毒复制所需的那些(即ic50或ic95)的循环药物浓度(即cmin)。相反,进入细胞后,nrtis和核苷酸类逆转录酶抑制剂(ntrtis,如替诺福韦)进入专性细胞内合成代谢途径(obligate intracellular anabolic pathway)以转化为活性磷酸化形式,正是它们的细胞内半衰期而非血浆浓度决定了它们的持续作用。所有目前批准的nrtis和ntrtis至少每日一次施用。
5.4'
‑
乙炔基
‑2‑
氟
‑
2'
‑
脱氧腺苷(efda)是一种核苷类逆转录酶抑制剂,其在体外(kawamoto, a., kodama, e., sarafianos s. f.等人, int. j. biochem. cell biol.; 40(11):2410
‑
20 [2008]; ohrui, h., kohgo, s., hayakawa, h.等人, nucleosides, nucleotides & nucleic acids, 26, 1543
‑
1546 [2007])和体内(hattori, s., ide, k., nakata, h.等人. antimicrobial. agents and chemotherapy, 53, 3887
‑
3893 [2009])阻断hiv
‑
1和siv病毒复制。
[0006]
美国专利号7339053描述了efda(在'053专利中称为2'
‑
脱氧
‑
4'
‑
c
‑
乙炔基
‑2‑
氟腺苷)和4'
‑
乙炔基
‑2‑
氯
‑
2'
‑
脱氧腺苷(在本文中称为ecda;在'053专利中称为2
‑
氯
‑
2'
‑
脱氧
‑
4'
‑
c
‑
乙炔基腺苷)。efda和ecda具有以下化学结构:
。
[0007]
两种化合物在细胞中代谢为其活性三磷酸合成代谢物,其抑制hiv逆转录酶。与目前可用于治疗hiv感染的nsrtis和ntrti (缺乏3'
‑
oh基团来阻断进入的核苷酸的掺入)相反,efda和ecda保留3'oh基团并通过阻止逆转录酶(rt)活性位点中的引物:模板的易位,和阻止进入的三磷酸脱氧核糖核苷酸(dntps)的结合而起到链终止剂的作用。此外,认为efda和ecda的修饰的核糖环的折叠通过将3'oh置于载体中而有助于抑制逆转录酶,其中来自进入的核苷酸的磷酸转移是无效的。(michailidis e,等人., 4'
‑
乙炔基
‑2‑
氟
‑
2'
‑
脱氧腺苷三磷酸抑制hiv
‑
1逆转录酶的机制,j biol chem 284:35681
–
35691 [2009]; michailidis e,等人, 4'
‑
乙炔基
‑2‑
氟
‑
2'
‑
脱氧腺苷(efda)以多种机制抑制hiv
‑
1逆转录酶, j biol chem 289:24533
–
24548 [2014])。
[0008]
在体外hiv复制测定中,efda是一种有效的抗逆转录病毒药物,并且对已经评估的所有亚型中的临床分离株表现出相当的抗病毒活性。它在体外在淋巴来源的细胞系和外周血单核细胞中均迅速合成代谢为活性三磷酸,并且efda三磷酸(efda
‑
tp)的细胞内半衰期超过72小时。(stoddart, c. a., galkina,等人., 口服施用核苷efda (4'
‑
乙炔基
‑2‑
氟
‑
2'
‑
脱氧腺苷)提供人源化小鼠的hiv病毒血症的快速抑制,以及有利的小鼠和恒河猴的药代动力学特性, antimicrob agents chemother, 2015 jul; 59(7): 4190
–
4198, 在线公开于2015年5月4日)。
[0009]
已显示efda在hiv感染的动物模型中具有功效,包括人源化小鼠模型和siv感染的恒河猴模型。在小鼠和猕猴中口服施用的efda的药代动力学研究证明了核苷在外周血单核细胞(pbmcs)中快速吸收和稳健转化为活性三磷酸。当分别向hiv和siv感染的动物施用时,在人源化小鼠和恒河猴中都实现的药物浓度在抑制病毒血症方面是有效的。在药物施用后24小时从未感染的猴中分离的pbmcs是抗siv感染的(同上)。
[0010]
目前可用于hiv感染的药物治疗联合起作用以抑制病毒血症,使病毒得到控制。hiv药物疗法是终生的,严格遵守治疗方案对于维持病毒抑制,降低耐药性风险和最小化传播风险至关重要。容易以低给药频率服用的有效且安全的、耐受良好的药物有可能提高患者的依从性和长期治疗成功率。对于预防hiv感染,美国食品和药物管理局批准的目前唯一可用的暴露前预防(prep)治疗是truvada
®
(恩曲他滨/替诺福韦df),用于预防未感染者的hiv感染。
[0011]
目前可用的口服施用的抗逆转录病毒药物是每日一次给药的。较低频率的给药可能有助于减轻每日服用hiv药物的实际挑战和累积心理影响。长效arts可能有助于患者恢复更大的正常感,并提供灵活性,这可能影响他们生活、工作、旅行、与他人交往以及看待自己的方式。此外,需要终生治疗的其他慢性病如骨质疏松症和2型糖尿病的教训表明,一些患者适应并且可能更喜欢每周一次,相对于每日一次的给药方案,这可以导致改善的药物依从性。
[0012]
通过施用单一活性剂或活性剂的组合,期望处于hiv感染风险中的人有额外的预防性疗法选择。另外,期望hiv疗法(治疗和预防hiv感染二者)有口服给药选择,其施用频率可以低于每日给药,以为患者提供进一步的替代方案。
[0013]
发明概述本发明涉及使用4'
‑
乙炔基
‑2‑
氟
‑
2'
‑
脱氧腺苷(efda)或4'
‑
乙炔基
‑2‑
氯
‑
2'
‑
脱氧腺苷(ecda)进行暴露前预防(prep)治疗,即,efda或ecda,或任一活性剂的药学上可接受的盐或共晶体,用于预防未感染hiv的个体的hiv感染的用途,所述个体处于所述感染的风险中。预防性治疗可以通过任何施用途径或方法,包括但不限于口服、肠胃外或使用可植入的组合物或装置施用来进行。
[0014]
本发明还包括通过肠胃外施用efda或ecda,或任一活性剂的药学上可接受的盐或共晶体,使用每周一次或更低频率的给药方案来治疗感染hiv的个体。它还包括通过使用可植入组合物或装置施用efda或ecda来治疗感染hiv的个体,每周一次或以更低频率将所述可植入组合物或装置植入个体中以在从一次植入到下一次植入的时间间隔期间递送活性剂。
[0015]
本发明进一步涉及使用用于hiv疗法的口服给药方案向个体口服施用efda或ecda,或任一活性剂的药学上可接受的盐或共晶体,其中以低于每日一次的频率施用efda或ecda。例如,可以以每周两次给药、每周一次给药、每两周一次给药、每月两次给药或每月一次给药的剂量方案口服施用efda或ecda,以用于抑制hiv逆转录酶,治疗hiv感染,预防hiv感染,以及预防、治疗和/或延迟aids和/或arc的发作或进展。
[0016]
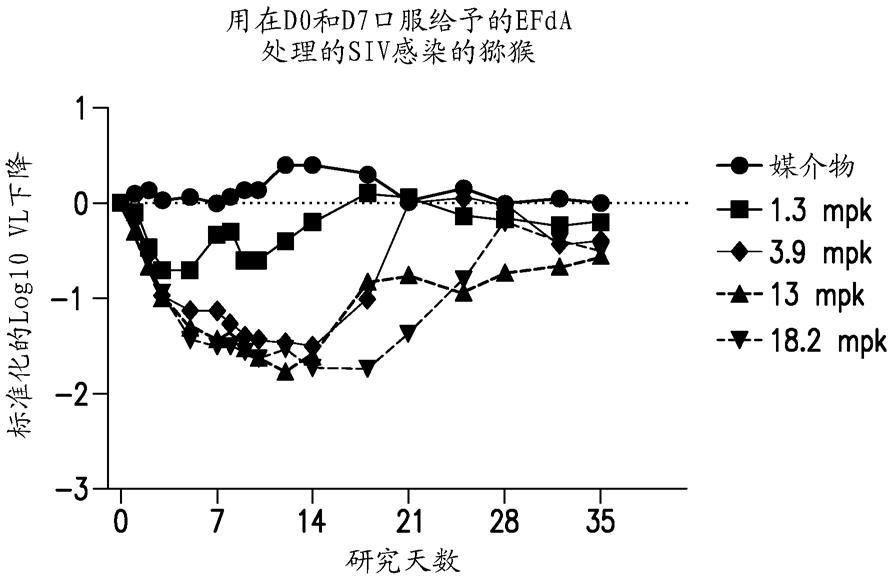
附图描述图1是来自实施例1中描述的“在hiv感染的siv感染的猕猴模型中的每周一次功效”研究中siv感染的猴中病毒载量变化的图。
[0017]
图2是向健康禁食个体施用每周一次口服剂量的efda 3周后efda三磷酸(tp)的平均pbmc浓度对时间曲线的图(线性标度)(下部,半对数图)。
[0018]
图3是向健康禁食个体施用每周一次口服剂量的efda 3周后平均efda血浆浓度对时间曲线的图(线性标度,给药后第一个24小时)(下部,半对数图) (n=6, loq= 3.41 nm)。
[0019]
发明详述本发明的一个实施方案,在本文中称为实施方案a,涉及预防hiv感染的方法,包括向未感染hiv的个体施用有效量的结构式i的化合物或其药学上可接受的盐或共晶体,其中x为
–
f或
–
cl。可以每日一次、每周两次、每周一次、每两周一次、每月两次或每月一次或以更低频率的间隔例如每季度一次、每年两次或每年一次向个体施用有效量的所述化合物,以用于预防hiv感染。在该实施方案的一个方
面,可以使用给药方案向个体施用有效量的所述化合物,在所述给药方案中以低于每日一次的频率向个体施用式i化合物或其药学上可接受的盐或共晶体。
[0020]
对于在未感染的个体中抗hiv感染的预防性用途,可以通过任何引起活性剂与药剂作用位点接触的方式施用式i化合物或其盐或共晶体。它们可以通过可用于与药物一起使用的常规方式,作为单独的预防剂或预防剂的组合施用。它们可以单独施用,但通常与基于所选施用途径和标准药学实践选择的药物载体一起施用。可以例如口服(例如,通过片剂或胶囊)、肠胃外(包括皮下注射,静脉内、肌内或胸骨内注射,或其他输注技术),或通过吸入喷雾,以一个或多个单位剂量的药物组合物的形式施用式i化合物,所述药物组合物含有单独或组合的有效量的化合物和常规无毒的药学上可接受的载体、佐剂和媒介物,以用于预防hiv感染。还可以通过适于在延长的时间段内提供有效量的化合物的可植入的药物递送组合物或装置肠胃外施用式i化合物。
[0021]
适于口服施用的固体制剂(例如粉剂、丸剂、胶囊和片剂)可根据本领域已知的技术制备,并可使用固体赋形剂,例如淀粉、糖、高岭土、润滑剂、粘合剂、崩解剂等。适于口服施用的液体制剂(例如悬浮液、糖浆、酏剂等)可根据本领域已知的技术制备,并可使用任何常用的介质,例如水、二醇、油、醇等。对于口服施用,优选固体剂型,特别是片剂。
[0022]
式i化合物的肠胃外组合物可根据本领域已知的技术制备,并且通常使用无菌水作为载体和任选的其他成分,例如稳定剂和/或溶解助剂。可注射溶液或可注射悬浮液可根据本领域已知的方法制备,例如,其中载体包含盐水溶液、葡萄糖溶液或含有盐水和葡萄糖的混合物的溶液。可植入组合物还可以根据本领域已知的方法制备,例如,其中载体包含活性化学成分和合适的赋形剂(例如聚合物),或利用用于药物递送的可植入装置。
[0023]
适用于制备具有式i化合物的药物组合物的方法和适用于所述组合物的成分的进一步描述提供在雷明登氏药学全书(remington's pharmaceutical sciences), 第18版, 由a. r. gennaro编辑, mack publishing co., 1990和雷明登:药学科学与实践(remington
ꢀ‑ꢀ
the science and practice of pharmacy), 第22版, 由pharmaceutical press和philadelphia college of pharmacy at university of the sciences出版, 2012, isbn 978 0 85711
‑
062
‑
6和以前版本中。肠胃外制剂的描述可以例如见于wright, jeremy c.和burgess, diane j. (编辑) 长效注射剂和植入物(递送科学系列进展) (long acting injections and implants (advances in delivery science series)), springer new york
‑
dordrecht
‑
heidelberg
‑
london, 2012, print中。
[0024]
在实施方案a的一个方面,可以使用任何合适的给药方案施用式i化合物以用于预防hiv感染,所述给药方案例如但不限于,每日一次、每周两次、每周一次、每两周一次、每月两次、每月一次、每季度一次、每年两次或每年一次施用式i化合物。在另一方面,可以每周两次、每周一次、每两周一次、每月两次、每月一次、每季度一次、每年两次或每年一次施用单位剂量的式i化合物以用于预防hiv感染。在实施方案a的另一方面,可以每周一次、每两周一次、每月两次、每月一次、每季度一次(即每3个月一次)、每年两次(即每6个月一次)或每年一次施用式i化合物。
[0025]
在实施方案a的另一方面,其中除了上述给药方案之外,可以使用更低频率的剂量方案肠胃外施用式i化合物,例如但不限于,每18个月一次或每两年一次(bi
‑
annually或once every two years)。
[0026]
通常,在每个时间间隔每次施用时的剂量将随着每次施用之间的时间间隔的增加而增加。
[0027]
优选的施用方法或途径也可以根据给药方案中剂量之间的时间间隔而变化。例如,可以在例如但不限于每日一次、每周两次、每周一次、每两周一次、每月两次或每月一次的间隔口服施用用于预防用途的有效量的式i化合物。虽然在每个给药间隔优选口服施用一个单位剂量,但是可以根据需要在每个给药间隔施用一个或多个口服单位剂量以递送适当量的活性剂。
[0028]
或者,可以在例如但不限于每周一次、每两周一次、每月两次、每月一次、每季度一次、每年两次、每年一次,或更长的间隔例如但不限于,每18个月一次或每两年一次肠胃外施用用于预防用途的有效量的式i化合物。每次施用活性剂之间的间隔越长,每次施用时需要的活性剂量可能越大。因此,可以根据需要在每个给药间隔施用一个或多个单位剂量以递送适当量的活性剂,例如,一个或多个式i化合物的注射剂或输注物,或一个或多个植入物组合物或装置。
[0029]
用于预防性用途的任何给药方案可以是连续给药方案或间歇给药方案。
[0030]
对于预防性治疗,单位剂量的efda或ecda的量可以为0.1 mg至500 mg;或者0.1至400 mg或更大,以用于较长间隔剂量方案。每个单位剂量的剂量将根据给药方案中剂量之间的时间间隔而变化。
[0031]
本发明的另一个实施方案,在本文中称为实施方案b,涉及在需要其的个体中抑制hiv逆转录酶,治疗或预防hiv感染,其包括治疗或预防病毒血症,以及治疗、预防和/或延迟aids或arc的发作或进展的方法,该方法采用其中以低于每日一次的频率向所述个体口服施用式i化合物或其药学上可接受的盐或共晶体的给药方案。通常,在每个时间间隔每次施用时的剂量将随着每次施用之间的时间间隔的增加而增加。
[0032]
可以通过任何引起活性剂与药剂作用位点接触的方式口服施用任选地为盐或共晶体形式的efda或ecda。该化合物可以通过可用于与药物一起使用的常规方式,作为单独的治疗剂或治疗剂的组合口服施用。它可以单独施用,但通常与口服施用选择的药物载体一起施用,含有有效量的化合物和一种或多种常规无毒的药学上可接受的载体、佐剂和/或媒介物。适合于口服施用的固体制剂,例如但不限于片剂、胶囊、粉剂、丸剂,可以根据本领域已知的技术制备,并且可以使用固体赋形剂,例如淀粉、糖、高岭土、润滑剂、粘合剂、崩解剂等。适合于口服施用的液体制剂(例如悬浮液、糖浆、酏剂等)可根据本领域已知的技术制备,并可使用任何常用的介质,例如水、二醇、油、醇等。对于口服施用,优选固体剂型,特别是片剂。
[0033]
实施方案b的一个方面是在hiv感染个体中抑制hiv逆转录酶,治疗hiv感染,其包括治疗或预防hiv病毒血症,以及治疗、预防和/或延迟aids或arc的发作或进展的方法,其包括向所述个体口服施用作为单位剂量的有效量的efda或ecda,其中给药方案的给药间隔范围为约每3天一次至约每30天一次(即,每月一次(once
‑
monthly或once per month))。可用于该方法的口服施用efda或ecda的给药方案的实例包括每周两次给药、每周一次给药、每两周一次给药、每月两次给药和每月一次给药。所选择的给药方案将使用适合于在每次施用至下一次的时间间隔期间提供hiv感染、aids或arc的治疗,aids或arc的预防,和/或aids或arc的发作或进展的延迟的每次施用时的剂量。
mg、13 mg、14 mg、15 mg、16 mg、17 mg、18 mg、19 mg或20 mg;21mg、22 mg、23 mg、24 mg、25 mg、26 mg、27 mg、28 mg、29 mg或30 mg,31mg、32 mg、33 mg、34 mg、35 mg、36 mg、37 mg、38 mg、39 mg或40 mg。
[0045]
ecda的剂量可以比efda的剂量高约2
‑
4倍。
[0046]
当以盐或共晶体形式施用efda或ecda时,提及以毫克或克计的化合物的量是基于化合物的游离形式的efda或ecda(即非盐或非共晶体形式)的重量。
[0047]
efda或ecda的最小剂量将随给药方案而变化,并且无论预期用途是用于治疗和/或预防感染hiv的个体,还是用于预防未感染hiv的个体。对于感染hiv的个体的每周一次口服给药的非限制性实例是包含约10 mg efda或ecda的单位剂量,用于治疗和/或预防如上所述的疾病状态。用于阻止未感染个体中hiv感染的每周一次口服给药的非限制性实例是包含约2 mg efda或ecda的单位剂量。
[0048]
本发明的另一个实施方案,在本文中称为实施方案c,涉及抑制hiv逆转录酶,治疗hiv感染,其包括治疗病毒血症,以及治疗、预防和/或延迟aids或arc的发作或进展的方法,所述方法采用给药方案通过向感染hiv的个体肠胃外施用有效量的式i化合物或其药学上可接受的盐或共晶体进行,在所述给药方案中所述化合物的肠胃外施用频率低于每日一次。
[0049]
可以以单位剂量的药物组合物的形式肠胃外,包括皮下注射,静脉内、肌内或胸骨内注射,或其他输注技术(可根据需要在每个给药间隔施用一个或多个注射剂或输注物以递送适当量的活性剂)或者通过吸入喷雾施用式i化合物,所述药物组合物含有有效量的化合物和常规无毒的药学上可接受的载体、佐剂和媒介物,以用于治疗感染hiv的个体。还可以通过适于在延长的时间段内提供有效量的化合物的可植入的药物递送组合物或装置肠胃外施用式i化合物。如上所述用于未感染hiv的个体的肠胃外组合物的制备(参见实施方案a)同样适用于制备用于治疗感染hiv的个体的肠胃外组合物。应使用连续给药方案治疗hiv感染的个体。
[0050]
在实施方案c的一个方面,可以在例如但不限于每周一次、每两周一次、每月两次、每月一次、每季度一次、每年两次或每年一次的间隔,或更长间隔例如但不限于每18个月一次或每两年一次肠胃外施用单位剂量的有效量的式i化合物。
[0051]
在实施方案c的另一方面,可以在每月一次、每季度一次、每年两次或每年一次的间隔肠胃外施用该化合物。
[0052]
每次施用活性剂之间的间隔越长,每次施用时需要的活性剂量可能越大。因此,可以根据需要在每个给药间隔施用一个或多个单位剂量以递送适当量的活性剂,例如,包含式i化合物的一个或多个注射剂或输注物或一个或多个植入组合物或装置。
[0053]
包括本文所记载的所有实施方案、方面和描述的本发明还涉及efda或ecda以如上所述的给药方案与一种或多种抗hiv药剂一起施用的用途。“抗hiv药剂”是直接或间接有效抑制hiv,治疗或预防hiv感染,和/或治疗、预防或延迟aids或arc的发作或进展的任何药剂。应当理解,抗hiv药剂有效治疗、预防或延迟hiv感染或aids的发作或进展和/或由此引起或与之相关的疾病或疾病状态。例如,无论是在暴露前和/或暴露后的时段,可以与有效量的一种或多种选自hiv抗病毒剂、免疫调节剂、抗感染剂或可用于治疗hiv感染或aids的疫苗的其它抗hiv药剂组合有效施用式i化合物。
[0054]
本发明包括包含有效量efda或ecda和药学上可接受的载体的药物组合物。所述组合物可包含efda或ecda作为唯一的活性成分或可包含一种或多种另外的活性成分。因此,本发明还包括包含有效量的efda或ecda和药学上可接受的载体的药物组合物,所述药物组合物还包含有效量的一种或多种选自hiv抗病毒剂、免疫调节剂和抗感染剂中的一种或多种的其他抗hiv药剂。在该实施方案中,抗hiv药剂是选自hiv蛋白酶抑制剂、hiv逆转录酶抑制剂、hiv整合酶抑制剂、hiv融合抑制剂、hiv进入抑制剂和hiv成熟抑制剂中的一种或多种的抗病毒剂。
[0055]
与本发明化合物组合使用的合适的hiv抗病毒剂包括但不限于,例如,表a中列出的那些。
[0056]
表a:用于治疗hiv感染或aids的抗病毒剂名称类型阿巴卡韦,abc,ziagen
®
nrti阿巴卡韦 拉米夫定,epzicom
®
nrti阿巴卡韦 拉米夫定 齐多夫定,trizivir
®
nrti安普那韦,agenerase
®
pi阿扎那韦,reyataz
®
piazt,齐多夫定,叠氮胸苷,retrovir
®
nrti卡普韦林nnrti地瑞那韦,prezista
®
piddc,扎西他滨,双脱氧胞苷,hivid
®
nrtiddi,地达诺新,双脱氧肌苷,videx
®
nrtiddi(肠溶包衣),videxec
®
nrti地拉夫定,dlv,rescriptor
®
nnrti度鲁特韦,tivicay
®
inidoravirine,mk
‑
1439nnrti依法韦仑,efv,sustiva
®
,stocrin
®
nnrti依法韦仑 恩曲他滨 替诺福韦df,atripla
®
nnrti nrti埃替格韦ini恩曲他滨,ftc,emtriva
®
nrti恩曲他滨 替诺福韦df,truvada
®
nrtiemvirine,coactinon
®
nnrti恩夫韦地,fuzeon
®
fi肠溶包衣的地达诺新,videxec
®
nrti依曲韦林,tmc
‑
125nnrti福沙那伟钙,lexiva
®
pi茚地那韦,crixivan
®
pi拉米夫定,3tc,epivir
®
nrti拉米夫定 齐多夫定,combivir
®
nrti洛匹那韦pi
洛匹那韦 利托那韦,kaletra
®
pi马拉韦罗,selzentry
®
ei奈非那韦,viracept
®
pi奈韦拉平,nvp,viramune
®
nnrtippl
‑
100(还称为pl
‑
462)(ambrilia)pi雷特格韦,mk
‑
0518,isentress
tm
ini利匹韦林nnrti利托那韦,norvir
®
pi沙奎那韦,invirase
®
,fortovase
®
pi司他夫定,d4t,二脱氢脱氧胸苷,zerit
®
nrti替诺福韦df(df=富马酸二吡呋酯),tdf,viread
®
nrti替诺福韦艾拉酚胺富马酸盐,tafnrti替拉那韦,aptivus
®
pivicriviroceiei =进入抑制剂;fi =融合抑制剂;ini =整合酶抑制剂;pi =蛋白酶抑制剂;nrti =核苷类逆转录酶抑制剂;nnrti =非核苷类逆转录酶抑制剂。以盐的形式使用表a中列出的一些药物;例如,阿巴卡韦硫酸盐、地拉夫定甲磺酸盐、茚地那韦硫酸盐、阿扎那韦硫酸盐、奈非那韦甲磺酸盐、沙奎那韦甲磺酸盐。
[0057]
应理解,式i化合物与抗hiv药剂的组合范围不限于表a中列出的hiv抗病毒剂,但原则上包括与可用于治疗和/或预防hiv和aids的任何药物组合物的任何组合。hiv抗病毒剂和其它药剂通常以其常规剂量范围和方案用于这些组合中,常规剂量范围和方案如本领域所报道的,包括例如医生案头参考(physicians' desk reference), thomson pdr, thomson pdr, 第57版(2003)、第58版(2004)或第59版(2005)和医生案头参考(physicians' desk reference) (第68版). (2014), montvale, nj: pdr network中描述的剂量。在这些组合中,本发明化合物的剂量范围可与上面所列的那些相同。
[0058]
本发明还包括efda或ecda,其用于制备可用于在需要其的个体中抑制hiv逆转录酶,治疗hiv感染,预防hiv感染,或治疗、预防和延迟aids或arc的发作或进展中的任何一种或多种的药物。它还包括施用efda或ecda与一种或多种选自hiv抗病毒剂、免疫调节剂和抗感染剂中的一种或多种的其它抗hiv药剂的组合,以用于制备用于在需要其的个体中抑制hiv逆转录酶,治疗hiv感染,预防hiv感染,治疗aids,或预防或延迟aids的发作或进展中的任何一种或多种的药物。在本发明的该实施方案中,抗hiv药剂是选自hiv蛋白酶抑制剂、hiv逆转录酶抑制剂、hiv整合酶抑制剂、hiv融合抑制剂、hiv进入抑制剂和hiv成熟抑制剂中的一种或多种的抗病毒剂。
[0059]
本发明的另一个实施方案包括本文所列的方法、药物组合物、药物、用途和组合,其中感兴趣的hiv是hiv
‑
1。因此,例如,在使用本文所列的所述剂量方案的任何方法、药物组合物、药物、用途和组合中,以有效抗hiv
‑
1的量使用efda或ecda;当与一种或多种抗hiv药剂组合使用时,每种另外的抗hiv药剂是选自hiv
‑
1蛋白酶抑制剂、hiv
‑
1逆转录酶抑制剂、hiv
‑
1整合酶抑制剂、hiv
‑
1融合抑制剂、hiv
‑
1进入抑制剂或hiv
‑
1成熟抑制剂中的一种或多种的hiv
‑
1抗病毒剂。
[0060]
当以本文所述的剂量方案每周两次、每周一次或更低频率施用时,efda和/或ecda还可以表现出抗hiv
‑
2的活性。efda或ecda还可以表现出抗hiv的耐药性形式(例如nrti相关突变株m184v、m184i、k65r)的活性。
[0061]
任何特定患者的具体剂量水平和剂量频率可以变化,并且取决于多种因素,包括所用具体化合物的活性,该化合物的代谢稳定性和作用时间,年龄,体重,一般健康,性别,饮食,施用方式和时间,排泄率,药物组合,特定疾病状态的严重程度和经历治疗的个体。在一些情况下,根据化合物的效力或个体反应,可能需要从给定剂量向上或向下偏离。可以根据考虑这些因素的主治临床医生的判断来调节施用的量和频率。
[0062]
在本发明的另一个实施方案中,在本文描述和/或要求保护的每种方法、药物组合物、药物、用途、组合、方面和其他实施方案中,式i化合物是efda或其药学上可接受的盐或共晶体(即其中x是
‑
f)。
[0063]
在本发明的另一个实施方案中,在本文描述和/或要求保护的每种方法、药物组合物、药物、用途、组合、方面和其他实施方案中,式i化合物是ecda或其药学上可接受的盐或共晶体(即其中x是cl)。
[0064]
为简洁起见,在本文中术语“式i化合物”、“efda”或“ecda”之后并不总是记载短语“或其药学上可接受的盐或共晶体”。然而,在本文描述和/或要求保护的方法、药物组合物、药物、用途、组合、方面和其他实施方案中提及使用式i化合物、efda或ecda旨在包括使用式i化合物、efda或ecda(每个术语出现时)或其药学上可接受的盐或共晶体。
[0065]
如本文所用的术语“个体”或“患者”是指已经或将要成为治疗对象的动物,优选哺乳动物,最优选人,所述治疗包括预防性治疗、观察或实验。人类个体或患者包括(1) 感染hiv且患有或未患有aids的那些,他们正在寻求治疗hiv感染、arc或aids,和/或预防和/或延迟arc或aids的发作或进展,以及(2) 未感染hiv的那些,他们正在寻求或接受预防性治疗以阻止或降低hiv传播风险。在本发明的一个实施方案中,在本文描述和/或要求保护的每种方法、药物组合物、药物、用途、组合、方面和其他实施方案中,所述个体是人类个体。
[0066]
如本文所用的术语“有效量”是指在施用后足以抑制hiv逆转录酶,抑制hiv复制,发挥预防作用和/或发挥治疗作用的化合物的量。“有效量”的一个实施方案是“治疗有效量”,其是在患者中有效抑制hiv逆转录酶,抑制hiv复制(前述的任一种,其在本文中也可称为“抑制有效量”),治疗hiv感染,治疗aids或arc,和/或减缓aids或arc的进展的化合物的量。“有效量”的另一个实施方案是“预防有效量”,其是在患者中有效预防hiv感染,延迟aids或arc发作,或预防aids或arc的化合物的量。应当理解,在hiv感染个体中,有效量可以同时是治疗有效量,例如用于治疗hiv感染,和预防有效量二者,例如用于阻止或降低发展aids或arc的风险或延迟aids或arc的发作或进展。
[0067]
在未感染的个体中预防(或阻止)hiv感染旨在表示阻止或降低个体中hiv感染的可能性。在感染hiv的个体中,预防(或阻止)aids或arc旨在表示阻止或降低个体中发展aids或arc的可能性。
[0068]“有效量”的另一个实施方案包括efda或ecda的量,其降低hiv感染个体中的病毒血症或阻止暴露于病毒的未感染者的hiv感染。
[0069]
在本发明的组合疗法中,有效量可以指每种单独的药剂或作为整体的组合,其中组合施用的所有药剂的量一起有效,但是其中组合的组分药剂可以有效量单独存在或可以
不以有效量单独存在,该有效量是单独施用时认为对该组分药剂有效的量。关于本文的方法的术语“施用”及其变体(例如,“施用”化合物)是指将化合物提供给需要治疗或预防的个体,并且包括自我施用和由另一人向患者施用。当efda或ecda与一种或多种其他活性剂(例如,可用于治疗或预防hiv感染或aids的抗病毒剂)组合提供时,“施用”及其变体各自被理解为包括向个体同时(即,所有均在相同的给药方案时间表上)或不同时(如果一种或多种其他药剂不能在与efda或ecda相同的剂量方案时间表上给药时)提供efda或ecda和一种或多种其他药剂。当同时施用组合的药剂时,它们可以在单一组合物中一起施用,或者它们可以分开施用。
[0070]
siv =猿猴免疫缺陷病毒;vl =病毒载量;llq =定量下限。
[0071]
以上描述了本发明的给药方案,其采用efda或ecda的给药频率低于每日一次。本文还可以记载关于给药的“间隔”来描述给药方案。如本文所用的术语“连续给药方案”是指只要临床医生或患者需要所需治疗效果或预防效果或认为所需治疗效果或预防效果是合适的,就重复而不中断的给药方案。如本文所用的术语“间歇给药方案”是指用于一个或多个有限时间段的给药方案,以用于定期预防来阻止或降低hiv传播风险,其中在一个时段之后或在采用给药方案的时段之间停止给药方案。
[0072]
本发明提供给药方案,其中根据选自每周一次给药、每周两次给药、每两周一次给药、每月两次给药和每月一次给药的给药间隔定期施用单位剂量的efda或ecda。如本文所用的短语“每周一次”给药是指每周施用一次单位剂量的efda或ecda,即在七天时段内施用一次,优选在每周的同一天施用。在每周一次的给药方案中,通常约每七天施用剂量。每周一次给药方案的非限制性实例将需要每周日施用单位剂量的efda或ecda。优选每7天施用一次单位剂量,但每周一次的给药方案包括给药方案,其中每5至10天施用单位剂量,只要两个连续剂量落入两个不同的每周时段内。
[0073]
如本文所用的短语“每周两次”给药是指每周两次施用单位剂量的efda或ecda,即在七天时段内施用两次,在每个每周时段的两个不同天施用,其中优选该2天每周相同。在每周两次的给药方案中,通常大约每三至四天施用每个单位剂量。每周两次方案的非限制性实例将需要每周日和周三施用单位剂量的efda或ecda。优选每3至4天施用单位剂量,但每周两次给药方案包括给药方案,其中每2至5天施用单位剂量,只要在每个每周时段内施用两个剂量。
[0074]
如本文所用的短语“每两周一次”给药是指在两周时段内施用一次单位剂量的efda或ecda,即在十四天时段内施用一次,优选在每两周时段内的同一天施用。在每两周一次的给药方案中,通常每十四天施用一次每个单位剂量。每两周一次给药方案的非限制性实例将需要每隔一个周日施用单位剂量的efda或ecda。优选地,每14天施用一次单位剂量,但每两周一次给药方案包括给药方案,其中每12至16天施用单位剂量,只要两个连续剂量落入两个不同的每两周时段内。
[0075]
如本文所用的短语“每月两次”给药是指在每日历月时段内施用两次(twice或two times)单位剂量的efda或ecda。使用每月两次的方案,剂量优选在每月的两个相同日期给予。在每月两次的给药方案中,通常约每十四至十六天施用每个单位剂量。每月两次给药方案的非限制性实例将需要在该月的第一天或大约第一天和在该月的第十五天或大约第十五天,即该月的中间点给药。优选每14至16天施用单位剂量,但每月两次给药方案包括给药
方案,其中每13至18天施用单位剂量,只要在每月时段内施用两个剂量。每月两次的方案在本文中定义为不同于并且不包括每两周一次的给药方案,因为两种方案具有不同的周期性并导致在长时间段内施用不同数量的剂量。例如,在一年的时段内,根据每月两次的方案将施用总计大约二十四个剂量(因为一年中有十二个日历月),而根据每两周一次的给药方案将施用总计大约二十六个剂量(因为一年大约有五十二周)。
[0076]
如本文所用的短语“每月一次(once
‑
monthly或once per month)”给药是指在一个月时段内施用一次单位剂量的efda或ecda,即在每日历月时段内施用一次,优选在每个一个月时段内的同一天施用。在每月一次的给药方案中,通常每28
‑
31天施用一次每个单位剂量。每月一次给药方案的非限制性实例将需要在每月的第一天或大约第一天施用单位剂量的efda或ecda。优选每28
‑
31天施用一次单位剂量,但每月一次的给药方案包括给药方案,其中每27至33天施用单位剂量,只要两个连续剂量落入两个不同的每月时段内。
[0077]
如本文所用的短语“每季度一次”给药是指在3个月时段内施用一次单位剂量的efda或ecda,即在每日历季度时段内施用一次,优选在每个每季度时段内的同一日期施用。在每季度一次的给药方案中,通常每84
‑
93天施用一次每个单位剂量。该给药方案的非限制性实例将需要在每个每季度时段的第一个月的第一天或大约第一天施用单位剂量的efda或ecda。优选每84
‑
93天施用一次单位剂量,但每季度一次的给药方案包括给药方案,其中每81至99天施用单位剂量,只要两个连续剂量落入两个不同的3个月时段内。
[0078]
如本文所用的短语“每年两次”给药是指在6个月时段内施用一次单位剂量的efda或ecda,即在6个日历月时段内施用一次,优选在每个每年两次时段内的同一日期施用。在每年两次的给药方案中,通常每168
‑
186天施用一次每个单位剂量。该给药方案的非限制性实例将需要在每个每年两次时段的第一个月的第一天或大约第一天施用单位剂量的efda或ecda。优选每168
‑
186天施用一次单位剂量,但每年两次给药方案包括给药方案,其中每162
‑
198天施用单位剂量,只要两个连续剂量落入两个不同的6个月时段内。
[0079]
如本文所用的短语“每年一次”给药是指在12个月时段内施用一次单位剂量的efda或ecda,即在12个日历月时段内施用一次,优选在每个每年一次时段内的同一日期施用。在每年一次的给药方案中,通常每336
‑
372天施用一次每个单位剂量。该给药方案的非限制性实例将需要在每个每年一次时段的第一个月的第一天或大约第一天施用单位剂量的efda或ecda。优选每336
‑
372天施用一次单位剂量,但每年一次的给药方案包括给药方案,其中每324
‑
396天施用单位剂量,只要两个连续剂量落入两个不同的12个月时段内。
[0080]
可以以药学上可接受的盐或药学上可接受的共晶体形式施用efda或ecda。术语“药学上可接受的盐”和“药学上可接受的共晶体”是指盐或共晶体,其在生物学上或其他方面不是不合需要的(例如,既不是有毒的也不以其他方式对其接受者有害)。由于efda或ecda在氟腺嘌呤碱基上含有至少一个碱性基团,因此本发明包括相应的药学上可接受的盐。由于efda或ecda在腺嘌呤碱基上含有至少一个碱性基团,即可被质子化的基团,因此其可根据本发明以其与无机或有机酸的酸加成盐的形式使用,例如但不限于与氢氯酸、氢溴酸、磷酸、硫酸、硝酸、苯磺酸、甲磺酸、对甲苯磺酸、萘二磺酸、三氟乙酸、酒石酸、乳酸、水杨酸、苯甲酸、甲酸、丙酸、特戊酸、琥珀酸等的盐。efda或ecda可根据本发明以其与无机或有机酸的酸共晶体形式使用,例如但不限于与苯磺酸、甲磺酸、对甲苯磺酸、萘二磺酸、三氟乙酸、酒石酸、乳酸、水杨酸、苯甲酸、甲酸、丙酸、特戊酸、琥珀酸等的盐。可以通过本领域技术
人员已知的常规方法,例如通过在溶剂或分散剂中与有机或无机酸或碱组合,或者通过与其他盐的离子交换,从efda或ecda获得盐和共晶体。
[0081]
如本文所用,术语“组合物”旨在涵盖包含具体成分的产品,以及由组合具体成分产生的任何产品。适合包含在药物组合物中的成分是药学上可接受的成分,这意味着该成分必须彼此相容并且对其接受者无害。
[0082]
实施例1在hiv感染的siv感染猕猴模型中的每周一次功效在路易斯安那州拉斐特的新伊比利亚研究中心(new iberia research center,nirc)进行口服功效研究。用baytril
®ꢀ
(5 mg/kg, im, sid)处理5天后,用sivmac251对20只猴进行静脉内接种。3天后,每2
‑
5天(每周2次)收集静脉血用于病毒载量测试并监测至稳定的病毒血症(其中3个连续样品在急性病毒血症峰值后在彼此的3倍以内)。在加利福尼亚州伯克利市的siemens diagnostics使用分支dna技术测定血浆siv病毒rna水平。
[0083]
在确定稳定的病毒血症后,通过年龄、体重和病毒载量使siv感染的猴随机化(每组n = 3)。采用双臂自适应设计,其中第1组的结果告知第2组的剂量。在第1组中,动物接受通过口服灌胃施用的两个每周一次剂量的媒介物、1.3 mg/kg efda或13 mg/kg efda。在第2组中,动物接受每周一次的3.9 mg/kg或18.2 mg/kg efda或每日一次的0.19 mg/kg efda达两周。在处理时段内的第
‑
2天,第0天(给药日),第1、2、3、5、7天(给药日),第8、9、10、12和14天,然后在洗脱时段内每周两次达3周抽取血液(4ml)用于病毒载量测定。另外,在第0天(给药后2小时),第1天(给药后24小时),第7天(给药后2小时)和第8天(给药后24小时)抽取血液(1ml)用于efda药代动力学评估。
[0084]
使用qiaamp病毒rna迷你试剂盒(cat# 52904/52906)从140 μl血浆中分离用于基因分型的siv rna。使用superscript iii rt/platinum聚合酶,引物s251rtf1 (ggcaaaaggattaaagggac [2732
‑
2751])和s251rtr1 (ttttactttgtctttgcccc [4206
‑
4225])以及8 μl模板rna在20 μl反应中逆转录和扩增sivmac251的逆转录酶区域。使用来自第一次反应的3.5 μl产物与takara la taq以及引物s251rtf2 (acaatcatgacaggggacac [2750
‑
2769])和s251rtr2 (gctttcccttcttttgactg [4169
‑
4188])在50 μl反应中进行巢式pcr反应。在通过凝胶电泳验证~1.5 kb的大小后,使用exosap
‑
it (affymetrix; cat #78201)纯化pcr产物并调节至15 ng/ml。将pcr产物(10 μl)与5 μl 5 μm测序引物s251rts5 (caggggacactccgattaac [2760
‑
2779])、s251rts6 (aaggttctgcctcagggatg [3266
‑
3285])或s251rts7 (ctcagtcaggaacaagaagg [3755
‑
3774])混合。在genewiz (115 corporate blvd, 南普莱恩菲尔德, nj 07080)进行dna测序。
[0085]
猴在个体中的反应表现出高度的变异性。具有高vl(超过10)的那些的反应不和具有低vl的那些一样,这导致了很大的标准偏差(图1)。然而,这些组在vl方面是平衡的,并且平均数据显示了关于vl降低和停止给药后(洗脱)vl返回的剂量反应曲线。从3.9到18.2 mg/kg qw,vl下降似乎接近最大值,甚至在3.9 mg/kg时,vl抑制从第7天到第14天维持了7天。因为临床症状不佳,在第19天左右将媒介物组中的一只猴安乐死。在洗脱时段内存在剂量依赖性vl反弹。
[0086]
这些实验证明,efda可以像每日一次处理一样以每周一次口服施用来控制病毒血症。
[0087]
实施例2在健康人类中施用口服剂量后efda的药代动力学在i期单次和多次上升剂量研究中评估efda的药代动力学。在单剂量研究中,向8名健康成人个体的三个交替组施用单次口服剂量的efda口服混悬剂(5至400 mg)。在每个组中,在多达3个处理期内,以不知情的方式向个体施用单剂量的efda (n = 6)或匹配的安慰剂(n = 2)。a组接受15 mg和200 mg。b组接受30 mg、400 mg以及30 mg和食物。c组接受100 mg和5 mg。在多次上升剂量研究中,向8名健康成人个体的三个组施用多剂量的efda口服胶囊。在每个组中,在第1、8和15天向个体施用三个每周一次剂量的efda(n = 6)或匹配的安慰剂(n = 2)。a组接受10 mg。b组接受30 mg,和c组接受100 mg。
[0088]
在单剂量研究中,efda
‑
tp达到细胞内c
max
,中值t
max
为6
‑
24小时,pbmc中的浓度下降,表观终末半衰期为~120
‑
210小时。细胞内efda药代动力学在很大程度上不受高脂肪膳食的影响。efda迅速被吸收,中值t
max
为0.5小时。血浆浓度以双相方式降低,其中初始相快速(c
max
在前6
‑
12小时内降低约10倍)和终末相缓慢,表观终末半衰期为~50
‑
60小时。efda血浆暴露似乎在5至400 mg之间大致以与剂量成比例的方式增加。
[0089]
来自多剂量研究的细胞内efda
‑
三磷酸(tp)药代动力学显示在图2和表1中。来自多剂量研究的血浆efda药代动力学显示在图3和表2中。来自多剂量研究的结果概括了来自单剂量研究的结果。
[0090]
在多剂量30 mg和100 mg后,似乎efda
‑
tp auc0‑
168hr
和cmax适度累积,而efda
‑
tp c
168hr
几乎没有累积。如较短半衰期所预期的,efda在血浆中几乎没有累积。在10 mg剂量下,所有个体在给药后48小时和之后第1周以及在给药后96小时或之后第3周具有低于llq (3.41 nm)的血浆浓度。血浆中的efda和pbmc中的efda
‑
tp的暴露似乎一般以与剂量成比例的方式增加。
[0091]
表1. 向健康禁食个体施用每周一次口服剂量的efda达3周后pbmc中的细胞内efda
‑
tp药代动力学参数值的总结
[0092]
表2:向健康禁食个体施用每周一次口服剂量的efda达3周后efda血浆药代动力学参数值的总结
[0093]
实施例3efda的单剂量单一疗法功效目前正在未用过抗逆转录病毒治疗的hiv
‑
1患者中进行评估。在该研究中,单次10 mg剂量的efda与vl的快速且稳健的降低相关。在给药后168小时,观察到平均(95%ci)安慰剂调整的vl降低为1.67 log10 (1.47, 1.87)。平均vl到第10天继续下降,平均降低1.78 log10 (1.59,
ꢀ‑
1.98)并且没有复发迹象。10 mg剂量通常耐受良好,报告了有限数量的轻度/中度不良体验。efda血浆和efda
‑
tp pbmc pk与先前报道的健康个体的数据相似。在下表3中提供了10 mg剂量的病毒载量相对于基线的安慰剂校正变化的总结。
[0094]
表3:10 mg剂量efda的病毒载量相对于基线的安慰剂校正变化
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

