1.本发明涉及生物工程技术领域,具体涉及一种酶和微生态制剂复合组剂在断奶仔猪饲料中的应用及其方法。
背景技术:
2.科学研究和临床实践表明,微生态制剂可以替代抗生素,实现无抗养殖。微生态制剂作为一种绿色的免疫调节剂,可以调节和维持动物肠道微生态平衡,达到防治疾病、促进动物生长和提高饲料利用率的目的。但是微生态制剂也存在一定的问题,如存在活菌含量低、水分含量偏高、不耐抗生素、对胃酸和胆盐不稳定等问题影响其在畜禽上的应用效果,限制了微生态制剂的应用。
3.饲用酶制剂按其特性及作用主要分为两大类:一类是外源性消化酶,包括蛋白酶、脂肪酶和淀粉酶等,这类酶畜禽消化道能够合成与分泌,但因种种原因需要补充和强化。其应用的主要功能是补充幼年动物如仔猪、犊牛、雏禽、幼鱼等体内消化酶分泌不足,以强化生化代谢反应,促进饲料中营养物质的消化与吸收。另一类是外源性降解酶,包括纤维素酶、半纤维素酶、β—葡聚糖酶、木聚糖酶和植酸酶等。这些酶,动物组织细胞不能合成与分泌,但饲料中又存在相应的底物(多数为抗营养因子)。近年来,利用微生物能合成这类酶的特性,采用微生物发酵技术或转基因生物技术,已有这类酶制剂生产并应用于畜牧生产。这类酶的主要功能是降解动物难以消化或完全不能消化的物质或抗营养物质,提高饲料营养物质的利用率,同时可为开发新的饲料资源开辟新途径。由于饲用酶制剂无毒害、无残留、可降解,使用酶制剂不但可提高畜禽的生产性能,充分挖掘现有饲料资源的利用率,而且还可降低畜禽粪便中有机物、氮和磷等的排放量,缓解发展畜牧业与保护生态环境间的矛盾,开发应用前景广阔。并且本课题组已开发出一种能调节动物肠道生态平衡,预防疾病的同时促进消化、提高饲料营养物质利用率的酶与微生态制剂复合组剂及其制备方法,并申请了发明专利,申请号为:202110748790.1。
4.仔猪断奶是猪生长发育阶段的既艰难又关键的重要时期,由于仔猪在断奶时面临生理、免疫、环境和饲料等因素的改变,极易造成应激,进而导致腹泻,生长缓慢,甚至死亡。抗生素因在预防仔猪应激方面具有显著效果而在养猪业广泛应用,但大量使用抗生素极易引起细菌耐药性增强、微生态失衡以及药物残留,严重威胁着人类的安全健康。随着国家禁抗制度的实施,寻找一种高效、副作用小、无残留且不易导致细菌耐药性的抗生素替代品迫在眉睫。
技术实现要素:
5.本发明的目的在于提供一种酶和微生态制剂复合组剂在断奶仔猪饲料中的应用,提高仔猪肠道中有益菌所占比例,改善和增加肠道菌群的丰富度和多样性,减少仔猪断奶期中肠道疾病的发生率。
6.本发明的另一目的在于提供一种酶和微生态制剂复合组剂在断奶仔猪饲料中应
用的方法,保持断奶期仔猪的健康,有效促进断奶仔猪生长。
7.本发明公开了酶和微生态制剂复合组剂在断奶仔猪饲料中的应用,所述复合组剂是由枯草芽孢杆菌混合液、啤酒酵母菌混合液、嗜酸乳杆菌混合液混合后,再与保护剂混合而制成的。
8.所述酶和微生态制剂复合组剂的制备方法为:向培养基中加入枯草芽孢杆菌、中性蛋白酶和纤维素酶,培养成枯草芽孢杆菌混合液;向培养基中加入啤酒酵母菌、中性蛋白酶和纤维素酶,培养成啤酒酵母菌混合液;向培养基中加入嗜酸乳杆菌、中性蛋白酶和纤维素酶,培养成嗜酸乳杆菌混合液;将甘油、脱脂奶粉和明胶混合制成保护剂;以菌酶混合液与保护剂混合均匀得到液体复合组剂。
9.其中,所述制备方法还包括将所述液体复合组剂冷冻干燥制成冻干粉。
10.所述保护剂中脱脂奶粉:甘油:明胶的质量比为25:6:8。
11.优选地,向培养基中加入枯草芽孢杆菌、中性蛋白酶和纤维素酶时,使中性蛋白酶的浓度为1g/l,纤维素酶的浓度为3g/l;向培养基中加入啤酒酵母菌、中性蛋白酶和纤维素酶时,使中性蛋白酶的浓度为2g/l,纤维素酶的浓度为3g/l;向培养基中加入嗜酸乳杆菌、中性蛋白酶和纤维素酶时,使中性蛋白酶的浓度为2g/l,纤维素酶的浓度为4g/l。
12.具体地,所述的冷冻干燥是先将液体复合组剂于
‑
80℃冷冻8
‑
12h,再于温度
‑
40℃、压强50
‑
80pa的真空冷冻干燥机中冷冻干燥24h,冷冻干燥效果最佳。
13.优选地,所述菌酶混合液是由枯草芽孢杆菌混合液、啤酒酵母菌混合液和嗜酸乳杆菌混合液等体积混合制成,菌酶混合液中枯草芽孢杆菌、啤酒酵母菌、嗜酸乳杆菌的菌浓度都不小于3
×
10
11
cfu/ml。
14.优选地,为了保证菌液浓度和菌体与保护剂充分结合,所述枯草芽孢杆菌混合液的培养时间不小于14h,所述啤酒酵母菌混合液的培养时间不小于14h,所述嗜酸乳杆菌混合液的培养时间不小于18h。
15.进一步地,所述复合组剂的应用方式为添加至仔猪饲料,混匀后饲喂断奶期仔猪。
16.所述复合组剂与饲料的添加比例为质量比= 1:1000~3:1000。
17.优选地,所述添加比例为质量比=2:1000。
18.所述的复合组剂在断奶仔猪饲料中应用的方法为:以质量比为1:1000~3:1000的复合组剂与饲料均匀混合, 并根据仔猪采食情况进行同质量比的补充,以保证仔猪每日的自由采食饲粮充足。
19.一般情况下,仔猪断奶时会出现不进食的情况,而在开始食用饲料后会有腹泻、体重增加减缓甚至下降的现象,严重影响仔猪健康和生命安全。酶和微生态制剂复合组剂在添加至断奶仔猪饲料后,能调节断奶仔猪在食源转换过程中产生的不适应,帮助消化在转换期难以消化或不能消化的物质,提高营养物质利用率,促进其生长,使其在断奶后适应饲料并维持体重。
20.酶和微生态制剂复合组剂可以全面代替抗生素,减少养猪业中抗生素的使用。在对肠黏膜影响、zo
‑
1蛋白表达、细菌多样性等多方面几乎都优于抗生素。利用酶和微生态制剂复合组剂代替抗生素,一方面可以减少使用抗生素对仔猪胃口、健康产生的影响,另一方
面大幅减少了仔猪因长期使用抗生素,仔猪及其体内细菌产生抗性,导致患病时治疗困难的情况。
21.酶和微生态制剂复合组剂添加至断奶仔猪饲料中,能维持仔猪肠道微生态的平衡,增加肠道菌群的丰富度和多样性,并提高有益菌所占比例,减少断奶仔猪肠道疾病的发生。此外,添加了酶和微生态制剂复合组剂的饲料还能改善仔猪肠道黏膜形态和黏膜屏障,增加其对营养物质的吸收,被消化的营养物质又为肠道中的益生菌提供了能量来源,增强益生菌的活菌数目。
附图说明
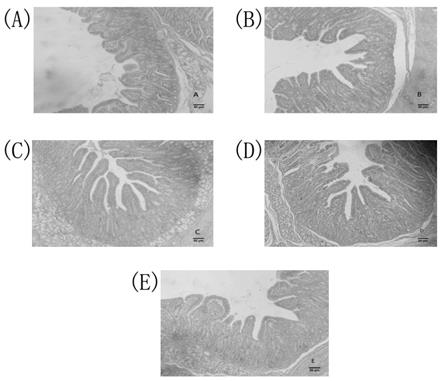
22.图1是施用复合组剂后断奶仔猪十二指肠黏膜形态结构,其中a是空白对照组,b是低剂量组,c是中剂量组,d是高剂量组,e是抗生素组。
23.图2是施用复合组剂后断奶仔猪空肠黏膜形态结构,其中a是空白对照组,b是低剂量组,c是中剂量组,d是高剂量组,e是抗生素组。
24.图3是施用复合组剂后断奶仔猪回肠黏膜形态结构,其中a是空白对照组,b是低剂量组,c是中剂量组,d是高剂量组,e是抗生素组。
25.图4为复合组剂对断奶仔猪十二指肠中zo
‑
1蛋白表达的影响,其中a是空白对照组,b是低剂量组,c是中剂量组,d是高剂量组,e是抗生素组。
26.图5为复合组剂对断奶仔猪空肠中zo
‑
1蛋白表达的影响,其中a是空白对照组,b是低剂量组,c是中剂量组,d是高剂量组,e是抗生素组。
27.图6为复合组剂对断奶仔猪回肠中zo
‑
1蛋白表达的影响,其中a是空白对照组,b是低剂量组,c是中剂量组,d是高剂量组,e是抗生素组。
28.图7为小肠各段ihc zo
‑
1蛋白表达对比情况,其中a是十二指肠中的表达情况,b是空肠中的表达情况,c是回肠中的表达情况,各图中的ck代表空白对照组,d代表低剂量组,z代表中剂量组,g代表高剂量组,k代表抗生素组。
29.图8小肠各段荧光定量pcr zo
‑
1蛋白表达情况,其中a是十二指肠中的表达情况,b是空肠中的表达情况,c是回肠中的表达情况。
30.图9为仔猪盲肠菌群层次聚类分析图,其中a是jaccard系数,b是bray
‑
curtis相异度,c是unweighted unifrac分析,d是weighted unifrac分析。
31.图10和图11为仔猪盲肠内容物unweighted
‑
unifracpcoa分析,其中a组是pc1和pc2对样品差异的贡献值分别为21.14%、10.72%的三维图和二维图;b组是pc1和pc2对样品差异的贡献值分别为30.25%、18.13%的三维图和二维图,c组是pc1和pc2对样品差异的贡献值分别为27.28%、20.17%的三维图和二维图,d组是pc1和pc2对样品差异的贡献值分别为23.86%、10.02%的三维图和二维图,e组是pc1和pc2对样品差异的贡献值分别为37.23%、23.68%的三维图和二维图。
32.图12为门水平差异物种heatmap图。
33.图13为属水平差异物种丰度top10boxplot图。
34.图7
‑
13中,ck代表空白对照组,d代表低剂量组,z代表中剂量组,g代表高剂量组,k代表抗生素组。
具体实施方式
35.下面结合附图和实施例以及比较例,对本发明的具体实施方式作进一步详细描述。以下实施例和比较例仅用于更加清楚地说明本发明的技术方案,从而使本领域技术人员能很好地理解和利用本发明,而不是限制本发明的保护范围。
36.本发明实施例和比较例中涉及到的实验方法、生产工艺、仪器以及设备,其名称和简称均属于本领域内常规的名称,在相关用途领域内均非常清楚明确,本领域内技术人员能够根据该名称理解常规工艺步骤并应用相应的设备,按照常规条件或制造商建议的条件进行实施。
37.本发明实施例和比较例中使用的各种原料或试剂,并没有来源上的特殊限制,均为可以通过市售购买获得的常规产品。其中,仔猪来源于山西省某农牧集团有限公司,试验中使用的抗生素为金霉素,购自齐鲁制药有限公司。实施例中使用的酶酶和微生态制剂复合组剂按下述方法制备而成:向100ml lb液体培养基中接种枯草芽孢杆菌,培养至菌液浓度达到107cfu/ml,向100ml pdb培养基中接种啤酒酵母菌,培养至菌液浓度达到107cfu/ml,向100ml mrs液体培养基中接种嗜酸乳杆菌,培养至菌液浓度达到107cfu/ml。
38.取5ml培养好的枯草芽孢杆菌菌液加入发酵培养基中,并加入0.1g中性蛋白酶和0.3g纤维素酶,在厌氧条件下,放置于转速为200rpm、温度为36℃的摇床中培养14h,制成枯草芽孢杆菌混合液;取5ml培养好的啤酒酵母菌菌液加入发酵培养基中,并加入0.2g中性蛋白酶和0.3g纤维素酶,在有氧条件下,放置于转速为200rpm、温度为37℃的摇床中培养14h,制成啤酒酵母菌混合液;取5ml培养好的嗜酸乳杆菌菌液加入发酵培养基中,并加入0.2g中性蛋白酶和0.4g纤维素酶,在有氧条件下,放置于转速为200rpm、温度为30℃的摇床中培养18h,制成嗜酸乳杆菌混合液,再将三种混合液全部均匀混合,制成菌酶混合液。
39.取25g脱脂奶粉溶于75g超纯水,用94g超纯水稀释6g甘油,8g明胶溶于29g超纯水,将上述100g脱脂奶粉和100g稀释后的甘油及100g明胶全部混匀,制成复合保护剂。
40.将菌酶混合液与复合保护剂全部混合,在磁力搅拌器中以500rpm的速度均匀搅拌6min,使保护剂与菌体、蛋白酶和纤维素酶充分接触,覆盖于其表面,成为酶与微生态制剂复合组剂。混匀的复合组剂置于
‑
80℃中冷冻8h,再将真空冷冻干燥机设置为
‑
40℃、50
‑
80pa,冷冻干燥24h,分装并密封后制成酶与微生态制剂的复合组剂。
41.实施例1 复合组剂对断奶仔猪生长情况的影响。
42.以饲料中添加复合组剂的仔猪作为实验组,将实验组分为低剂量组(复合组剂在饲料中的添加比例为1:1000)、中剂量组(复合组剂在饲料中的添加比例为2:1000)、高剂量组(复合组剂在饲料中的添加比例为3:1000),并增加喂食纯饲料的空白对照组和饲料中添加抗生素的阳性对照组。在实验28日期间提供相同的饲喂环境,喂食不同饲料,记录仔猪体重,结果如表1所示,按下述公式计算每组仔猪的平均日采食量、平均日增重及料重比。
43.平均日采食量(adfi)=饲料总消耗量/总天数平均日增重(adg)=(平均末重
‑
平均始重)/总天数料重比(f/g)=平均日采食量(adfi)/平均日增重(adg)
注:同行数据标记大写字母表示与空白对照组对比差异,同行数据上标有小写字母代表与抗生素组对比差异,相同字母代表差异性不显著(p>0.05),不同字母代表差异性显著(p<0.05),下同。
44.表1表明,连续28d食用复合组剂后,与空白对照组相比,饲喂添加有不同剂量复合组剂的仔猪平均日采食量均升高,低剂量组、高剂量组和抗生素组的平均日采食量增加,且差异性显著(p<0.05),中剂量组的平均日采食量增加,但无明显差异(p>0.05)。与抗生素组相比,低剂量组的平均日采食量显著增加(p<0.05),中剂量组平均日采食量显著降低(p<0.05),高剂量组平均日采食量增加,但无明显差异(p>0.05),说明食用复合组剂后,仔猪的食欲得到提高,采食情况得到改善。
45.在平均日增重的对比中,复合组剂添加组和抗生素组平均日增重较空白对照组均增加,但无明显差异(p>0.05)。与抗生素组对比,中剂量组和高剂量组平均日增重略有降低(p>0.05),低剂量组略有增加,无显著性差异(p>0.05),说明食用复合组剂后,仔猪的体重得到较快的提高,生长速度加快。
46.料重比是平均日采食量和平均日增重的比值,体现了饲料转化效果。在料重比的对比中,复合组剂添加组和抗生素组较空白对照组均降低,且差异性显著(p<0.05)。与抗生素组相比,低剂量组和高剂量组料重比显著增高(p<0.05),中剂量略微降低,但差异性不显著(p>0.05),说明食用复合组剂后,仔猪的饲料转化率提高,食用同等质量饲料的情况下,仔猪的体重可以得到更多的增加,经济效益提高,其中中剂量组效果最好。上述数据中,复合组剂添加组的料重比均低于空白对照组,说明复合组剂可以提高仔猪的生长性能。其中,中剂量组的料重比和抗生素组无显著差异,说明中剂量的复合组剂可以增加仔猪的生长性能,且可以达到替抗效果。
47.实施例2复合组剂对断奶仔猪腹泻率的影响。
48.在实施例1所述的实验期间,记录如表2所示的仔猪腹泻情况,28d后按下述公式计算各组仔猪的腹泻率。
49.腹泻率(%)=[实验期每组腹泻总次数/(实验期每组仔猪总数目
×
试验期总天数)]
×
100%从表2中可以看出,中剂量组、高剂量组和抗生素组较空白对照组均有降低,且差异性显著(p<0.05),低剂量组腹泻率降低,但无明显差异(p>0.05)。与抗生素组相比,中剂量组和高剂量组的腹泻率明显低于抗生素组(p<0.05),低剂量组腹泻率明显高于抗生素组(p<0.05),说明食用复合组剂后,仔猪的肠道功能得到了较好的改善,腹泻发病率降
低,且中剂量组效果最显著。
[0050]
复合组剂添加组的腹泻率均低于空白对照组,说明复合组剂可以降低仔猪腹泻率。其中,中剂量组和高剂量组的腹泻率显著低于抗生素组,说明中剂量和高剂量组的复合组剂可以降低仔猪的腹泻率,且效果优于抗生素。
[0051]
实施例3复合组剂对断奶仔猪生化指标的影响。
[0052]
实施例1所述的实验结束后,采集仔猪血液并使用全自动分析仪进行血清生化指标的检测,结果如表3所示,将试验所得结果用spss
‑
25.0进行anova单因素方差分析和显著性检验。
[0053]
如表3所示,连续28d食用复合组剂后,复合组剂添加组的glu、tp、alb、hdl、alp与空白对照组相比均升高,其中,低剂量组和中剂量组均与抗生素组有显著性差异(p<0.05)。复合组剂组tg、cho、ldl、alt、ast和ldh均降低,其中,中剂量组除ldl与空白对照组无显著性差异(p>0.05)外,其余指标均显著降低(p<0.05),且除glu、tp、alb外,其余指标均显著优于抗生素组,说明食用复合组剂后,仔猪对饲粮中糖类、蛋白质等营养物质的消化率和利用率提高。说明酶和微生态制剂复合组剂对仔猪血糖、血脂及肝功能、肾功能有较好的改善作用,并且中剂量组在多个方面优于抗生素组效果。
[0054]
实施例4复合组剂对断奶仔猪肠道黏膜形态的影响。
[0055]
实施例1所述的实验结束后,采集仔猪的十二指肠、空肠和回肠组织,he染色后在显微镜下观察肠道黏膜形态结构并拍照,结果如图1、2、3所示,使用imagej
‑
1.48v图像分析系统测量绒毛长度和隐窝深度,结果如表4所示,并按下方公式计算其绒腺比:绒腺比=绒毛长度/隐窝深度
表4显示,复合组剂添加组和抗生素组的十二指肠绒毛长度均显著增加(p<0.05),且复合组剂添加组仔猪的绒毛长度均显著长于抗生素组(p<0.05);复合组剂添加组和抗生素组的隐窝深度均显著大于空白对照组(p<0.05),中剂量组和低剂量组与抗生素组之间无显著差异(p>0.05),高剂量组显著低于抗生素组(p<0.05)。复合组剂添加组绒腺比显著高于空白对照组和抗生素组(p<0.05),说明食用复合组剂后,仔猪十二指肠对食物的吸收面积增加。
[0056]
对空肠黏膜形态结构观察发现,复合组剂添加组和抗生素组的绒毛长度均显著长于空白对照组(p<0.05),高剂量组略长于抗生素组,但不具有显著性(p>0.05),中剂量组绒毛显著长于抗生素组(p>0.05),低剂量组低于抗生素组,且有显著性差异(p<0.05);复合组剂添加组的隐窝深度显著低于空白对照组(p<0.05),复合组剂添加组的绒腺比均显著大于空白对照组和抗生素组(p<0.05),说明食用复合组剂后,仔猪空肠对食物的吸收面积增加。
[0057]
对回肠黏膜形态结构观察发现,复合组剂添加组和抗生素组的绒毛长度均显著长于空白对照组(p<0.05),高剂量组和中剂量组长于抗生素组,且具有显著性(p<0.05),低剂量组略低于抗生素组,但不具有显著性(p>0.05)。高剂量组和中剂量组的隐窝深度显著低于空白对照组(p<0.05),低剂量组略有升高,但不具有显著性(p>0.05),高剂量组和中剂量组显著低于抗生素组(p<0.05),低剂量组高于抗生素组,且具有显著性(p<0.05);复合组剂添加组和抗生素组的绒腺比均高于空白对照组,高剂量组和中剂量组显著高于空白对照组和抗生素组(p<0.05),低剂量组与空白对照组和抗生素组差异均不显著(p>0.05),说明食用复合组剂后,仔猪回肠对食物的吸收面积增加。
[0058]
总的来说,酶和微生态制剂复合组剂可以改善仔猪肠道黏膜形态,增加绒毛长度,降低绒腺比,提高小肠对食物的吸收面积,其中,中剂量组的效果最好,并优于抗生素组。
[0059]
实施例5复合组剂对断奶仔猪肠道zo
‑
1蛋白的影响。
[0060]
肠道机械屏障是肠道黏膜屏障的重要组成部分,主要由单层肠上皮细胞和细胞之间的连接构成,在保护肠道黏膜免受病原菌、毒素等入侵的同时,还可以作为选择过滤器,将蛋白质、水、维生素等营养物质滤过吸收,保障机体对营养物质的吸收。紧密连接位于上皮细胞间的顶端,是维持黏膜通透性的重要组成部分之一,紧密连接蛋白zo
‑
1蛋白(zonula occludens
‑
1,闭锁小带蛋白1)是紧密连接的一个重要成分,在维持上皮细胞极性、调节物质转运等方面发挥重要作用,其结构和功能与构成紧密连接的其他组分紧密相关,因此,
zo
‑
1蛋白通常被用作判断机体紧密连接屏障功能和选择性滤过功能的重要指标。
[0061]
实施例1所述的实验结束后,采集仔猪的十二指肠、空肠和回肠组织,进行荧光定量pcr实验、免疫组化(ihc),并在显微镜下观察并拍照,得到图4、5、6,用imagejv1.8.0计算平均光密度值(aod),用graphprism8v8.3.1对所得结果进行单因素方差分析并作图,得到图7所示的小肠各段ihc zo
‑
1蛋白表达情况,以及图8所示的小肠各段荧光定量pcr zo
‑
1蛋白表达情况,图中ck是空白对照组、d是低剂量组、z是中剂量组、g是高剂量组、k是抗生素组。
[0062]
aod=iod/area;(iod为累计光密度值)如图7、图8所示,zo
‑
1蛋白在小肠各段黏膜上皮间均有表达,但表达水平不同。十二指肠中,复合组剂添加组和抗生素组的zo
‑
1蛋白表达均显著高于空白对照组(p<0.05),低剂量组zo
‑
1蛋白表达显著高于空白对照组(p<0.05),同时显著低于抗生素组(p<0.05),中剂量组、高剂量组和抗生素组zo
‑
1蛋白表达均极显著高于空白对照组(p<0.0001)。其中,中剂量组zo
‑
1蛋白表达极显著高于抗生素组(p<0.0001),高剂量组zo
‑
1蛋白表达略高于抗生素组,差异不显著(p>0.05),说明食用中剂量的复合组剂后,仔猪十二指肠的肠道机械屏障增强,对有害菌的抵抗力提高,且效果最好;空肠中,复合组剂添加组和抗生素组的zo
‑
1蛋白表达均显著高于空白对照组(p<0.05),其中,低剂量组zo
‑
1蛋白表达显著高于抗生素组(p<0.05),中剂量组和高剂量组极显著高于空白对照组和抗生素组(p<0.0001),中剂量组的zo
‑
1蛋白表达最高,说明食用中剂量的复合组剂后,仔猪空肠的肠道机械屏障增强,对有害菌的抵抗力提高,且效果最好;回肠中,低剂量组zo
‑
1蛋白的表达显著高于空白对照组和抗生素组(p<0.05),中剂量组zo
‑
1蛋白的表达高于空白对照组和抗生素组,且差异性极显著(p<0.0001),高剂量组显著高于空白对照组(p<0.05),极显著高于抗生素组(p<0.0001),其中,中剂量组zo
‑
1蛋白表达最强,说明食用中剂量的复合组剂后,仔猪回肠的肠道机械屏障增强,对有害菌的抵抗力提高,且效果最好。
[0063]
综上可知酶和微生态制剂复合组剂可以提高仔猪肠道zo
‑
1蛋白的表达量,增强肠道的机械屏障,其中,中剂量组效果最好,并且优于抗生素组。
[0064]
实施例6复合组剂对断奶仔猪肠道菌群的影响。
[0065]
实施例1所述的实验结束后,采集仔猪的盲肠内容物,利用16srdna高通量测序对肠道菌群进行检测,测序流程为:从样品中提取全部微生物的基因组dna,pcr扩增16srdna的可变区,随后构建质粒文库进行测序,再对测序出来的数据进行去噪处理(如去除接头、序列标签、引物序列、低质量的序列及嵌合序列等),最后对去噪序列进行聚类分析,生成分类单元(operational taxonomic units, otu),并用fast tree等生物分析软件进一步进行生物信息学分析。
[0066]
选择α多样性作为空间尺度对肠道菌群的生物多样性进行研究,选取的评估指数包括chao1,goods coverage,shannon,simpson,observed_species ,pd_whole_tree,实验时各样品的指数曲线均趋于平缓,说明测序量和深度足够,可以覆盖样品中绝大多数的微生物信息,基本可以反映样品中的种类和组成,检测结果如表5所示。
[0067]
表5中,中剂量组chao1指数、goods
‑
coverage指数、observed
‑
species指数等显著高于空白对照组(p<0.05),shannon指数显著低于空白对照组(p<0.05),同时与抗生素组alpha多样性存在显著性差异(p<0.05)。
[0068]
进行beta多样性分析,结果如图9、10、11所示,从图9中可以看出,在以不同的计算方式得到的不同的聚类图中,中剂量组聚集程度最高,其仔猪盲肠内容物的菌群组成是相似度最高的,表明中剂量组的分组效果最好,其次是抗生素组,另外三个组的仔猪盲肠内容物的菌群结构均有不同程度的离散。
[0069]
从图10、11中可以看出,在五个分组中,中剂量组的点分布可以较明显的与其他组分隔开,其次是抗生素组,其他三个组均有不同程度的离散,说明中剂量组的β多样性与其他组有较明显的差异,分组效果最好。
[0070]
中剂量组的alpha多样性、beta多样性及有益菌的相对丰度等方面均优于抗生素组,说明中剂量组的酶和微生态制剂复合组剂较抗生素可以更好的提高仔猪肠道微生态菌群的丰富度和均匀度,增加有益菌在肠道菌群中的比例。
[0071]
再制作如图12所示的的门水平差异物种heatmap图和图13所示的属水平差异物种丰度top10boxplot图。图12显示,与空白对照组相比,中剂量组的firmicutes(厚壁菌门)、bacteroides(拟杆菌门)等有益菌的相对丰度均有提高,proteobacteria(变形菌门)相对丰度降低,图13显示,中剂量组的lactobacillus(乳杆菌属)相对丰度高于空白对照组和抗生素组,escherichia
‑
shigella(埃希
‑
志贺菌属)相对丰度低于空白对照组和抗生素组。表明中剂量组的酶和微生态制剂复合组剂较抗生素可以更好的提高仔猪肠道微生态菌群的丰富度和均匀度,增加有益菌在肠道菌群中的比例,减少有害菌,调节肠道菌群的成分和组成。
[0072]
综合上述数据,可以得出在饲粮中添加中剂量的复合组剂可以增加仔猪肠道微生物菌群的丰富度和多样性,降低微生物区系的紊乱性。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。