一种c
(sp3)
‑
c
(sp2)
键的构建方法与
β
‑
芳基氨基酸的制备方法
技术领域
1.本发明涉及化学键的构建及应用,尤其涉及一种c
(sp3)
‑
c
(sp2)
键的构建方法及β
‑
芳基氨基酸的合成方法,属于化学物质合成技术领域。
背景技术:
2.理论上,氨基酸β
‑
c
(sp3)
‑
h活化芳基化反应是构建c
(sp3)
‑
c
(sp2)
键的一种直接高效的方法,从而可用于合成各种各样的β
‑
芳基氨基酸,包括非天然β
‑
芳基氨基酸。目前氨基酸β
‑
c
(sp3)
‑
h芳基化反应所用的芳基化试剂仅限于高活性的芳基碘。对于酚类化合物,由于c
(sp2)
‑
o键的键能较高,反应活性低,尚未见有酚作为芳基化试剂构建c
(sp3)
‑
c
(sp2)
键的报道。此外,已报道的氨基酸β
‑
c
(sp3)
‑
h活化芳基化反应体系复杂,步骤繁琐,例如需要引入导向基、加入过量的贵金属银,并对氨基酸实施保护等。从而限制了氨基酸β
‑
c
(sp3)
‑
h活化芳基化反应的广泛应用。
3.酚类化合物广泛存在于具有生物活性的天然产物和药物中,如黄酮类化合物、甾体类化合物、香豆素等。氨基酸和肽是构成生物体蛋白质的基本单元结构,具有信号传导的功能,在生物体内发挥着极为重要的生理功能。在新药研发领域,将活性分子与氨基酸和肽通过拼合原理设计新的化合物,可以提高其生物活性、生物相容性,增强对靶点的选择性,改善药物吸收分布,是新药设计的一种重要途径。传统的拼接方法是将氨基酸或肽与酚类化合物通过酯键形成新的化合物。通过氨基酸β
‑
c
(sp3)
‑
h活化芳基化将酚类化合物与氨基酸形成稳定的c
‑
c键进行拼合,减缓在体内降解,将为酚类活性分子的氨基酸化或肽化提供一种全新的方法,为新药的设计合成提供一种新的途径和选择。
4.鉴于c
(sp3)
‑
h较难活化,而c
(sp2)
‑
o键又异常稳定,企图以酚为芳基化试剂在氨基酸β
‑
c
(sp3)
上直接发生芳基化反应构建c
(sp3)
‑
c
(sp2)
键具有非常大的挑战。本发明提供了一种有效的方法实现该化学转化过程。
技术实现要素:
5.针对上述问题,本发明提供一种c
(sp3)
‑
c
(sp2)
键的构建方法用于β
‑
芳基氨基酸的制备,以酚的磺酸酯为芳基化试剂,于双金属催化剂催化条件下在不活泼的氨基酸β
‑
c
(sp3)
实现芳基化反应,在构建c
(sp3)
‑
c
(sp2)
键的同时,选择性地手性合成β
‑
芳基氨基酸,为新药的设计合成提供一种新的途径和选择。
6.为实现上述目的,本发明的技术方案为:
7.一种c
(sp3)
‑
c
(sp2)
键的构建方法,所述构建方法是将氨基酸β
‑
c
(sp3)
与酚羟基所在的环碳c
(sp2)
直接偶联构建c
‑
c键。
8.进一步的,所述氨基酸为l构型或d构型中的任一种或两种的消旋体混合物,所述酚羟基对应的酚包括苯酚、取代苯酚、萘酚、取代萘酚、多稠环酚类、黄酮类或甾体类中的任一种。
9.进一步的,构建方法包括如下步骤,氨基酸与配体l1、二价镍盐先反应形成镍(ⅱ)
氨基酸络合物,镍(ⅱ)氨基酸络合物再在钯催化剂催化下与酚的磺酸酯于非质子极性溶剂中完成氨基酸β
‑
c
(sp3)
‑
h芳基化反应,即完成c
(sp3)
‑
c
(sp2)
键的构建,反应式如下:
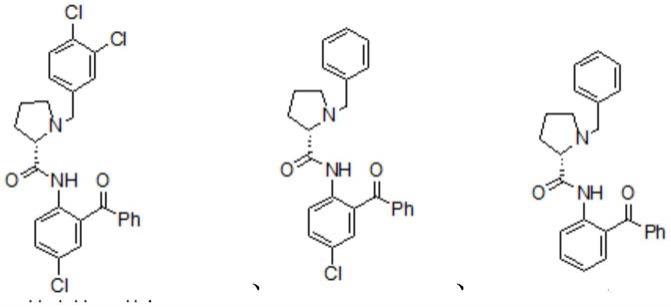
[0010][0011]
进一步的,所述镍(ⅱ)氨基酸络合物是通过如下步骤得到的,取氨基酸、配体l1、二价镍盐和碱ⅰ以摩尔比为1:1
‑
1.5:1
‑
1.3:4
‑
5.8,在溶剂中升温反应1.5
‑
5小时,经重结晶得到镍(ⅱ)氨基酸络合物,反应式如下:
[0012][0013]
所述二价镍盐包括氯化镍、硫酸镍、溴化镍中的任一种;所述碱ⅰ包括磷酸钾、碳酸铯、叔丁醇钾、叔丁醇钠、氢化钠中的任一种;所述溶剂包括二甲亚砜、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、1,3
‑
二甲基
‑2‑
咪唑啉酮、n
‑
甲基吡咯烷酮、乙醇、四氢呋喃;
[0014]
所述配体l1包括如下任意一种:
[0015][0016]
进一步的,反应式中取代基r1包括三氟甲基、2
‑
三氟甲基苯基、3
‑
三氟甲基苯基、4
‑
三氟甲基苯基、3,5
‑
二三氟甲基苯基、邻硝基苯基、对硝基苯基中的任一种。
[0017]
进一步的,所述氨基酸β
‑
c
(sp3)
‑
h芳基化反应包括如下步骤:将镍(ⅱ)氨基酸络合物、碱ⅱ和酚的磺酸酯加入到非质子极性溶剂中,在钯/配体l2催化下,升温反应,反应后的反应液冷却至室温,加入预定量的水、有机溶剂,经萃取、干燥、浓缩得到粗品,柱层析得到β
‑
芳基化产物;
[0018]
所述钯催化剂包括二价钯和零价钯,其中二价钯盐包括:pdcl2、pd(oac)2、pdbr2中的任一种,零价钯包括纳米pd、pd/c、pd/rgo、pd2(dba)3、pd2(dba)3chcl3、pd(ch3cn)2cl2、pd(pph3)4中的任一种;所述碱ⅱ包括磷酸钾、碳酸钾、碳酸铯、叔丁醇钾中的任一种;所述非质子极性溶剂包括二甲亚砜、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、1,3
‑
二甲基
‑2‑
咪唑啉酮、n
‑
甲基吡咯烷酮中的任一种;所述配体l2包括如下任一种:
[0019][0020]
所述酚的磺酸酯的加入量为1.5
‑
3eq,二价钯盐的加入量为5
‑
20mol%,零价钯/配体l2的加入量为5
‑
10mol%/10
‑
20mol%;反应温度为100
‑
150℃;反应式中取代基r2包括h、芳基或烷基中的任一种。
[0021]
进一步的采用“一锅法”的方法进行构建c
(sp3)
‑
c
(sp2)
键,包括如下步骤,将氨基酸、配体l1、二价镍盐、碱ⅲ和分子筛加入非质子极性溶剂中,升温至50
‑
65℃反应2
‑
3小时,然后加入酚的磺酸酯,在二价钯盐、或者零价钯/配体l2催化下,升温至100
‑
150℃反应20
‑
36小时,反应完成后冷却至室温,在冷却后的反应液中加入预定量的水,有机溶剂萃取、干燥、浓缩得到粗品,柱层析纯化得到氨基酸β
‑
芳基化后的产物,其中,所述的分子筛为分子筛或分子筛,反应式如下:
[0022][0023]
进一步的,反应式中取代基r2包括h、芳基或烷基中的任一种;所述配体l1包括如下任意一种:
[0024]
所述二价镍盐包括氯化镍、醋酸镍、硫酸镍、溴化镍中的任一种;所述碱ⅲ包括磷酸钾、碳酸钾、碳酸铯、叔丁醇钾、叔丁醇钠、氢化钠中的任一种;所述二价钯盐包括pdcl2、pd(oac)2、pdbr2中的任一种,零价钯包括纳米pd、pd/c、pd/rgo、pd2(dba)3、pd2(dba)3chcl3、pd(ch3cn)2cl2、pd(pph3)4中的任一种;所述配体2包括如下任一种:
[0025][0026]
进一步的,所述酚的磺酸酯的加入量为1.5
‑
3eq,二价钯盐的加入量为5
‑
20mol%,
配体l2的加入量为5
‑
20mol%;
[0027]
反应式中取代基r1包括三氟甲基、2
‑
三氟甲基苯基、3
‑
三氟甲基苯基、4
‑
三氟甲基苯基、3,5
‑
二三氟甲基苯基、邻硝基苯基、对硝基苯基中的任一种。
[0028]
一种根据上述c
(sp3)
‑
c
(sp2)
键的构建方法制备得到β
‑
芳基氨基酸的方法,包括如下步骤,将纯化所得氨基酸β
‑
芳基化后的产物溶于0.5
‑
2n的矿物酸水溶液,在25w的微波辅助下进行水解,然后用氢氧化钠水溶液中和,乙酸乙酯萃取回收配体l1,水相经浓缩,残余物经重结晶得β
‑
芳基氨基酸;其中,矿物酸包括盐酸、硫酸、硝酸、硫酸氢钾中的任一种,或其任何比例的混合酸;反应式如下:
[0029][0030]
本发明上述技术方案中用到的酚的磺酸酯可通过购买成品得到,也可通过如下方法合成得到:将酚类化合物与磺酸酐或磺酰氯在缚酸剂的条件下进行反应,形成酚的磺酸酯,反应式如下:
[0031][0032]
所述酚类化合物包括苯酚、取代苯酚、萘酚、取代萘酚、多稠环酚类、黄酮类或甾体类中的任一种;反应式中取代基r1包括三氟甲基、2
‑
三氟甲基苯基、3
‑
三氟甲基苯基、4
‑
三氟甲基苯基、3,5
‑
二三氟甲基苯基、邻硝基苯基、对硝基苯基中的任一种;所述缚酸剂为吡啶或三级胺。
[0033]
由于采用了上述技术方案,本发明的有益效果如下:
[0034]
本发明提供的用磺酸酚酯(即酚的磺酸酯)为芳基化剂在双金属催化下直接与氨基酸β
‑
c(sp3)
‑
h发生取代反应以构建c(sp3)
‑
c(sp2)键的新方法,并实现β
‑
芳基氨基酸不对称合成。本发明将含有不活泼的β
‑
c
(sp3)
‑
h的氨基酸和特定结构的配体l1与二价镍络合生成四配位的螯合物,而后于碱性条件下进一步与磺酸酚酯在钯催化下完成氨基酸不活泼β
‑
c
(sp3)
‑
h的芳基取代和质子转移等反应,立体选择性地获得单一中间产物,实现c(sp3)
‑
c(sp2)键的构建,最后经微波辅助酸解释放出β
‑
c芳基化氨基酸和配体l1,后者经简单处理后可回收再用。
[0035]
本发明的c(sp3)
‑
c(sp2)键构建方法反应体系简单,成本低,反应通用性强,同时反应的立体选择性高;该合成方法为具有生物活性的酚类化合物的氨基酸化/肽化修饰提供一种新的方法,为新药的设计合成提供一种新的途径和选择。
具体实施方式
[0036]
下面对本发明实施例中的技术方案进行清楚、完整地描述。在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
[0037]
实施例1(s)
‑
对
‑
甲氧基苯丙氨酸的合成
[0038]
步骤s1:将对甲氧基苯酚(124mg,1mmol)、吡啶(159mg,2mmol)溶于二氯甲烷(5ml),冷却至0℃,滴加三氟甲磺酸酐(564mg,2mmol),升至室温反应过夜,反应完毕后加入30ml冰水,二氯甲烷(20ml
×
3)萃取,冰的2%稀盐酸、饱和盐水依次洗涤,无水硫酸钠干燥,浓缩后得到粗品,柱层析(石油醚/乙酸乙酯=20:1)得到三氟甲基磺酸4
‑
甲氧苯酯,产率91%。
[0039]
步骤s2:将消旋的丙氨酸(45mg,0.5mmol)、nicl2(65mg,0.5mmol)、配体l1(244mg,0.5mmol)、磷酸钾(530mg,2.5mmol)加入二甲亚砜(3ml),60℃反应2
‑
3小时,加入5%硫酸氢钾水溶液中和,二氯甲烷萃取,干燥,浓缩得到粗品,经二氯甲烷/正己烷重结晶得到络合物纯品,产率92%。
[0040]
步骤s3:氩气保护下,将络合物(308mg,0.5mmol)、磷酸钾(318mg)、醋酸钯(11mg)或者三(二亚苄基丙酮)二钯(45mg)/xantphos(57mg),步骤s1制备得到的三氟甲基磺酸4
‑
甲氧苯酯(384mg,3eq)溶于无水二甲亚砜(10ml),升温至110℃,反应24小时。反应完毕后,冷却至室温,加入50ml水,乙酸乙酯(20ml
×
3)萃取,饱和盐水洗涤,无水硫酸钠干燥,浓缩得到粗品,经柱层析(二氯甲烷/丙酮=8:1)得到产品,醋酸钯催化反应产率86%,dr>99:1;三(二亚苄基丙酮)二钯/xantphos催化反应产率82%,dr>99:1。
[0041]1h nmr(500mhz,chloroform
‑
d)δ8.92(d,j=2.1hz,1h),8.15(d,j=9.3hz,1h),7.65(dd,j=8.1,2.2hz,1h),7.62
–
7.54(m,2h),7.48
–
7.39(m,2h),7.35
–
7.29(m,2h),7.13
–
7.06(m,3h),6.95(d,j=8.6hz,2h),6.80(d,j=7.7hz,1h),6.60(d,j=2.6hz,1h),4.24(t,j=4.9hz,1h),4.18(d,j=12.6hz,1h),3.83(s,3h),3.23
–
3.14(m,2h),3.08(d,j=12.5hz,1h),3.04(dd,j=14.0,4.5hz,1h),2.74(dd,j=14.0,5.5hz,1h),2.44
–
2.29(m,3h),2.01(d,j=6.2hz,1h),1.94(d,j=8.1hz,1h),1.76(d,j=7.0hz,1h).
[0042]
13
c nmr(126mhz,chloroform
‑
d)δ180.0,178.4,135.0,133.8,132.6,132.5,131.7,131.1,130.4,129.9,129.6,129.3,127.7,127.6,127.3,125.8,123.9,114.4,72.0,71.6,63.5,58.7,55.5,38.9,30.1,23.1.hrms(esi)m/z:calcd for c
35
h
31
cl3n3nio
4
[m h]
:720.0734,found:720.0742.
[0043]
步骤s4:所得纯化后产物溶于1n盐酸(10ml),在微波25w,25℃下反应5分钟。用氢氧化钠水溶液中和,乙酸乙酯萃取回收配体l1。水相浓缩后经结晶得到产物。;[α]
d25
=
‑
6.7(c=2,1n hcl),1h nmr(d2o):δ7.11(d,j=8.3hz,2h),6.86(d,j=8.3hz,2h),3.80(m,1h)3.08(dd,j=14.6,5.0hz,1h),3.68(s,3h),2.93(dd,j=14.6,7.8hz,1h).
[0044]
13
c nmr(d2o):δ173.9,158.2,130.5,127.4,114.4,55.9,55.3,35.3.
[0045]
上述步骤的反应式如下:
[0046][0047]
实施例2(s)
‑
对
‑
甲氧基苯丙氨酸的“一锅法”合成
[0048]
利用实施例1步骤s1制备得到的三氟甲基磺酸4
‑
甲氧苯酯采用“一锅法”构建c
(sp3)
‑
c
(sp2)
键及制备β
‑
芳基氨基酸,步骤如下:氩气保护下,将消旋的丙氨酸(45mg,0.5mmol)、nicl2(65mg,0.5mmol)、配体l1(244mg,0.5mmol),碳酸钾(530mg,2.5mmol),干燥的分子筛加入反应管中,加入无水dmso(10ml)。65℃下反应3h,加入醋酸钯(11mg)或者三(二亚苄基丙酮)二钯(45mg)/xantphos(57mg),三氟甲基磺酸4
‑
甲氧苯酯(384mg,3eq),升温至110℃,反应36h。反应完毕后,冷却至室温,加入50ml水,乙酸乙酯(20ml
×
3)萃取,饱和盐水洗涤,无水硫酸钠干燥,浓缩得到粗品,经柱层析(二氯甲烷/丙酮=8:1)得到产品,醋酸钯催化反应产率71%,dr>99:1;三(二亚苄基丙酮)二钯/xantphos催化反应产率69%,dr>99:1。反应式如下:
[0049][0050]
利用该产物,采用实施例1步骤s4的方法制备得到β
‑
芳基氨基酸。
[0051]
实施例3(s)
‑
邻
‑
苯基苯丙氨酸的合成
[0052]
步骤s1:将对邻苯基苯酚(170mg,1mmol)、吡啶(159mg,2mmol)溶于二氯甲烷(5ml),冷却至0℃,滴加三氟甲磺酸酐(564mg,2mmol),升至室温反应过夜,反应完毕后加入30ml冰水,二氯甲烷(20ml
×
3)萃取,冰2%稀盐酸洗涤,饱和盐水洗涤,无水硫酸钠干燥,浓缩后得到粗品,柱层析(石油醚/乙酸乙酯=20:1)得到三氟甲基磺酸邻苯基苯酯,产率89%。
[0053]
步骤s2:将消旋的丙氨酸(45mg,0.5mmol)、nicl2(65mg,0.5mmol)、配体1(244mg,0.5mmol)、磷酸钾(530mg,2.5mmol)加入二甲亚砜(3ml),60℃反应2
‑
3小时,加入5%硫酸氢钾水溶液中和,二氯甲烷萃取,干燥,浓缩得到粗品,经二氯甲烷/正己烷重结晶得到络合物纯品,产率92%。
[0054]
步骤s3:氩气保护下,将络合物(308mg,0.5mmol)、磷酸钾(318mg)、醋酸钯(11mg)或者三(二亚苄基丙酮)二钯(45mg)/xantphos(57mg),步骤s1中的三氟甲基磺酸邻苯基苯酯(453mg,3eq)溶于无水dmso(10ml),升温至110℃,反应24小时。反应完毕后,冷却至室温,加入50ml水,乙酸乙酯(20ml
×
3)萃取,饱和盐水洗涤,无水硫酸钠干燥,浓缩得到粗品,经柱层析(二氯甲烷/丙酮=8:1)得到产品,醋酸钯催化反应产率82%,dr>99:1;三(二亚苄基丙酮)二钯/xantphos催化反应产率85%,dr>99:1。
[0055]1h nmr(500mhz,chloroform
‑
d)δ8.90(d,j=2.1hz,1h),8.31(d,j=9.3hz,1h),7.59(dd,j=8.2,2.1hz,1h),7.48(t,j=7.4hz,1h),7.43(t,j=7.5hz,1h),7.41
–
7.36(m,1h),7.35
–
7.30(m,1h),7.28(d,j=8.0hz,2h),7.25(s,1h),7.20
–
7.14(m,3h),7.11(dd,j=9.3,2.6hz,1h),7.01(t,j=7.2hz,2h),6.95(d,j=7.1hz,2h),6.38(d,j=2.6hz,1h),5.41(d,j=7.7hz,1h),4.16(d,j=12.5hz,1h),4.06(t,j=5.2hz,1h),3.29
–
3.16(m,2h),3.14
–
3.03(m,3h),2.55
–
2.30(m,3h),1.99(ddd,j=11.1,9.7,6.6hz,1h),1.79(dd,j=8.2,4.2hz,1h).
[0056]
13
c nmr(126mhz,chloroform
‑
d)δ178.3,140.9,135.0,133.8,133.5,133.4,133.3,132.5,132.4,131.1,131.0,130.8,129.9,129.8,129.5,129.2,129.0,128.2,128.1,127.5,127.2,127.1,127.0,127.1,123.7,72.7,71.7,63.3,58.7,36.7,31.2,23.6.hrms(esi)m/z:calcd for c
40
h
33
cl3n3nio
3
[m h]
:766.0941,found:766.0946.
[0057]
步骤s4:所得纯化后产物溶于1n盐酸(10ml),在微波25w,25℃下反应5分钟。用氢氧化钠水溶液中和,乙酸乙酯萃取回收配体l1。水相浓缩后经结晶得到产物。
[0058]1h nmr(500mhz,d2o):δ7.30
‑
7.60(m,9h),3.69(dd,j=7.2,3.9hz,1h),3.62(dd,j
=10.9,3.9hz,1h),2.9(1h,dd,j=10.9,7.2hz).;
[0059]
13
c nmr(d2o):δ173.8,144.1,142.5,134.7,131.7,130.8,130.3,129.7,129.6,128.3,128.0,56.4,36.0.
[0060]
反应式如下:
[0061][0062]
实施例4(s)
‑
邻
‑
苯基苯丙氨酸的“一锅法”合成
[0063]
利用实施例3步骤s1制备得到的三氟甲基磺酸邻苯基苯酯采用“一锅法”构建c
(sp3)
‑
c
(sp2)
键及制备β
‑
芳基氨基酸,步骤如下:氩气保护下,将消旋的丙氨酸(45mg,0.5mmol)、nicl2(65mg,0.5mmol)、配体l1(244mg,0.5mmol),碳酸钾(346mg,2.5mmol),干燥的分子筛加入反应管中,加入无水dmso(10ml)。65℃下反应3h,加入醋酸钯(11mg)或者三(二亚苄基丙酮)二钯(45mg)/xantphos(57mg),三氟甲基磺酸邻苯基苯酯(453mg,3eq),升温至110℃,反应36h。反应完毕后,冷却至室温,加入50ml水,乙酸乙酯(20ml
×
3)萃取,饱
和盐水洗涤,无水硫酸钠干燥,浓缩得到粗品,经柱层析(二氯甲烷/丙酮=8:1)得到产品,醋酸钯催化反应产率72%,dr>99:1;三(二亚苄基丙酮)二钯/xantphos催化反应产率67%,dr>99:1。反应式如下:
[0064][0065]
利用该产物,采用实施例3步骤s4的方法制备得到β
‑
芳基氨基酸。
[0066]
以不同酚的磺酸酯为芳基化剂在氨基酸β
‑
碳上发生的芳基化取代反应,应用实例如下:
[0067]
实施例5苯酚磺酸酯为芳基化剂的取代反应
[0068]
反应步骤同实例1,结果见表1。
[0069]1h nmr(500mhz,chloroform
‑
d)δ8.90(d,j=2.1hz,1h),8.16(d,j=9.3hz,1h),7.75
–
7.62(m,1h),7.62
–
7.49(m,2h),7.40(d,j=3.2hz,4h),7.35
–
7.24(m,2h),7.22
–
7.12(m,2h),7.10(dd,j=9.3,2.6hz,1h),6.77(d,j=7.6hz,1h),6.61(d,j=2.6hz,1h),4.28(t,j=5.0hz,1h),4.16(d,j=12.5hz,1h),3.22(dd,j=10.0,6.4hz,1h),3.10(t,j=10.2hz,3h),2.81(dd,j=13.8,5.5hz,1h),1.91(dt,j=10.5,5.1hz,1h),1.73(dt,j=10.0,2.7hz,1h).
[0070]
13
c nmr(126mhz,chloroform
‑
d)δ179.99,178.30,141.18,135.73,135.01,133.83,133.39,132.61,132.49,131.06,130.76,130.35,129.87,129.55,129.31,129.07,127.75,127.72,127.34,127.24,125.78,123.93,71.86,71.60,63.40,58.62,39.85,31.01,23.15.hrms(esi)m/z:calcd for c
34
h
29
cl3n3nio
3
[m h]
:690.0628,found:690.0624.
[0071]
产物结构如下:
[0072][0073]
实施例6间甲苯酚磺酸酯为芳基化剂的取代反应
[0074]
反应步骤同实例1,结果见表1。
[0075]1h nmr(500mhz,methanol
‑
d4)δ8.85(d,j=2.0hz,1h),8.18(dd,j=8.3,2.1hz,1h),8.07(d,j=9.3hz,1h),7.65(dt,j=25.7,7.5hz,2h),7.53
–
7.41(m,3h),7.24(dd,j=15.4,7.5hz,2h),7.18
–
7.10(m,2h),7.05(d,j=7.5hz,1h),6.60
–
6.44(m,2h),4.24(t,j=6.1hz,1h),4.14(d,j=12.5hz,1h),3.55(dd,j=10.8,6.4hz,1h),3.44(dd,j=13.8,6.6hz,1h),3.35(m,2h),3.27(dd,j=14.1,5.6hz,1h),3.18
–
3.10(m,1h),3.03
–
2.86(m,1h),2.58(dq,j=12.2,8.9hz,1h),2.45(dd,j=6.6,3.4hz,1h),2.16(td,j=10.9,6.3hz,1h),2.07(s,3h).
[0076]
13
c nmr(126mhz,methanol
‑
d4)δ182.58,181.11,142.14,138.03,135.22,134.76,134.32,134.19,134.10,133.66,133.39,132.71,132.56,132.29,132.05,131.59,130.61,130.53,129.22,129.04,128.86,127.50,127.06,125.34,72.94,72.87,64.07,59.82,39.64,32.14,24.70,19.81.hrms(esi)m/z:calcd for c
35
h
31
cl3n3nio
3
[m h]
:704.0784,found:704.0794.
[0077]
产物结构如下:
[0078][0079]
实施例7 3,4
‑
二甲基苯酚磺酸酯为芳基化剂的取代反应
[0080]
反应步骤同实例1,结果见表1。
[0081]1h nmr(500mhz,chloroform
‑
d)δ8.94(d,j=2.1hz,1h),8.17(d,j=9.3hz,1h),7.69(dd,j=8.1,2.1hz,1h),7.53
–
7.46(m,2h),7.31(d,j=8.2hz,1h),7.25(d,j=1.9hz,1h),7.09(dd,j=9.3,2.6hz,1h),6.99
–
6.87(m,4h),6.52(d,j=2.7hz,1h),6.28(d,j=7.6hz,1h),4.29
–
4.17(m,2h),3.45(dd,j=14.1,6.9hz,1h),3.29(q,j=10.7,8.8hz,2h),3.17(dd,j=14.1,5.1hz,1h),3.11(d,j=12.6hz,1h),2.94(d,j=13.6hz,1h),2.53(td,j=8.3,5.3hz,2h),2.31(s,3h),1.99(s,3h),2.03
–
1.99(m,2h).
[0082]
13
c nmr(126mhz,chloroform
‑
d)δ179.93,178.40,137.65,137.33,135.07,133.78,133.50,132.93,132.63,132.58,131.85,131.51,131.11,130.89,130.11,129.87,129.22,129.18,127.76,127.60,127.31,127.13,125.80,123.83,71.80,71.75,63.31,58.69,38.73,31.13,23.48,21.17,19.47.hrms(esi)m/z:calcd for c
36
h
33
cl3n3nio
3
[m h]
:718.0941,found:718.0935.
[0083]
产物结构如下:
[0084][0085]
实施例8对甲硫基苯酚磺酸酯为芳基化剂的取代反应
[0086]
反应步骤同实例1,结果见表1。
[0087]1h nmr(500mhz,chloroform
‑
d)δ8.93(d,j=2.0hz,1h),8.15(d,j=9.3hz,1h),7.63(dd,j=8.2,2.2hz,1h),7.59
–
7.53(m,2h),7.46(dd,j=7.5,1.8hz,2h),7.33
–
7.28(m,3h),7.14
–
7.05(m,3h),6.89
–
6.80(m,1h),6.61(d,j=2.6hz,1h),4.27(t,j=4.8hz,1h),4.16(d,j=12.6hz,1h),3.19(dd,j=10.1,6.5hz,1h),3.16
–
3.10(m,1h),3.07(d,j=12.6hz,1h),3.01(dd,j=13.9,4.3hz,1h),2.71(dd,j=13.9,5.5hz,1h),2.49(s,3h),2.44
–
2.37(m,1h),2.34
–
2.22(m,2h),1.97
–
1.88(m,1h),1.79
–
1.71(m,1h).
[0088]
13
c nmr(126mhz,chloroform
‑
d)δ180.04,170.93,141.20,135.04,133.86,133.39,132.65,132.47,132.17,131.21,131.06,130.42,129.86,129.63,129.35,127.70,127.34,127.21,126.68,123.94,71.75,71.61,63.50,58.77,39.06,31.11,23.08,15.65.hrms(esi)m/z:calcd for c
35
h
31
cl3n3nio3s
[m h]
:736.0505,found:736.0509.
[0089]
产物结构如下:
[0090][0091]
实施例9 2
‑
甲基
‑5‑
异丙基苯酚磺酸酯为芳基化剂的取代反应
[0092]
反应步骤同实例1,结果见表1。
[0093]1h nmr(500mhz,chloroform
‑
d)δ8.94(d,j=2.0hz,1h),8.23(d,j=9.3hz,1h),7.70(dd,j=8.2,2.1hz,1h),7.46(dd,j=9.4,7.2hz,2h),7.31(d,j=8.1hz,1h),7.23(d,j=7.3hz,1h),7.18(s,1h),7.09
–
7.06(m,1h),7.03(s,2h),6.99(s,1h),6.48(d,j=2.6hz,1h),5.87(d,j=7.6hz,1h),4.25(d,j=12.6hz,1h),4.18(dd,j=8.2,4.7hz,1h),3.67(dd,j=13.9,8.2hz,1h),3.41
–
3.28(m,3h),3.14(d,j=12.6hz,1h),2.71
–
2.58(m,
3h),2.14
–
1.98(m,3h),1.93(s,3h),1.00(d,j=6.9hz,3h),0.95(d,j=6.9hz,3h).
[0094]
13
c nmr(126mhz,chloroform
‑
d)δ178.42,146.88,141.05,135.12,135.08,133.75,133.52,132.61,132.58,131.15,130.89,130.07,129.87,129.61,129.07,129.00,127.95,127.65,127.21,126.03,123.86,71.93,71.65,63.21,58.62,40.20,33.47,31.29,23.95,23.81,18.87.hrms(esi)m/z:calcd for c
38
h
37
cl3n3nio
3
[m h]
:746.1254,found:746.1250.
[0095]
产物结构如下:
[0096][0097]
实施例10对氰基苯酚磺酸酯为芳基化剂的取代反应
[0098]
反应步骤同实例1,结果见表1。
[0099]1h nmr(500mhz,chloroform
‑
d)δ8.91(d,j=2.1hz,1h),8.15(d,j=9.3hz,1h),7.68(d,j=8.2hz,2h),7.65
–
7.56(m,3h),7.50(td,j=7.5,1.5hz,1h),7.35(d,j=7.0hz,1h),7.32(d,j=8.1hz,1h),7.20(d,j=8.2hz,2h),7.13(dd,j=9.3,2.6hz,1h),6.86(d,j=7.7hz,1h),6.62(d,j=2.6hz,1h),4.29(dd,j=6.2,4.4hz,1h),4.19(d,j=12.6hz,1h),3.25(dd,j=10.4,6.3hz,1h),3.21
–
3.15(m,1h),3.12(d,j=12.6hz,1h),3.08(dd,j=13.7,4.4hz,1h),2.95
–
2.85(m,1h),2.56
–
2.37(m,2h),2.36
–
2.26(m,1h),1.98
–
1.84(m,2h).
[0100]
13
c nmr(126mhz,chloroform
‑
d)δ179.98,177.59,134.93,133.81,133.64,133.21,133.02,132.63,132.51,131.35,131.20,130.66,129.88,129.84,129.51,127.52,127.41,124.08,111.79,71.41,71.13,63.48,58.57,40.06,31.04,23.25.hrms(esi)m/z:calcd for c
35
h
28
cl3n4nio
3
[m h]
:715.0580,found:715.0592.
[0101]
产物结构如下:
[0102][0103]
实施例11 1
‑
萘酚磺酸酯为芳基化剂的取代反应
[0104]
反应步骤同实例1,结果见表1。
[0105]1h nmr(500mhz,chloroform
‑
d)δ8.90(d,j=2.1hz,1h),8.15(d,j=9.2hz,1h),7.81(t,j=7.5hz,2h),7.69(dd,j=8.2,2.1hz,1h),7.63(d,j=8.6hz,1h),7.44
–
7.29(m,5h),7.24
–
7.14(m,3h),7.07(dd,j=9.3,2.6hz,1h),6.81(t,j=7.6hz,1h),6.45(d,j=2.6hz,1h),5.83(d,j=7.6hz,1h),4.44(dd,j=7.8,4.6hz,1h),4.20(d,j=12.6hz,1h),4.06(dd,j=14.2,7.9hz,1h),3.76(dd,j=14.2,4.6hz,1h),3.29
–
3.19(m,2h),3.09(d,j=12.5hz,1h),2.98
–
2.87(m,1h),2.54
–
2.45(m,1h),2.41(d,j=13.9hz,1h),1.95(m,2h).
[0106]
13
c nmr(126mhz,chloroform
‑
d)δ179.65,178.31,170.51,134.91,133.58,133.37,132.56,132.46,132.31,131.67,131.01,129.73,129.61,128.84,128.75,128.59,128.55,128.39,127.32,127.29,126.37,125.98,125.62,125.53,123.64,123.42,71.72,71.67,63.07,58.43,39.80,31.02,23.59.hrms(esi)m/z:calcd for c
38
h
31
cl3n3nio
3
[m h]
:740.0784,found:740.0789.
[0107]
产物结构如下:
[0108][0109]
实施例12 6
‑
羟基黄酮磺酸酯为芳基化剂的取代反应
[0110]
反应步骤同实例1,结果见表1。
[0111]1h nmr(500mhz,chloroform
‑
d)δ8.90(d,j=2.1hz,1h),8.16(d,j=9.3hz,1h),7.96
–
7.90(m,2h),7.83(d,j=2.2hz,1h),7.69(d,j=2.1hz,1h),7.62(d,j=4.4hz,2h),7.57
–
7.48(m,5h),7.35(s,3h),7.13(dd,j=9.3,2.6hz,1h),6.91(d,j=7.9hz,1h),6.82(s,1h),6.64(d,j=2.6hz,1h),4.28
–
4.20(m,2h),3.36
–
3.30(m,1h),3.26
–
3.22(m,1h),
3.20(d,j=4.2hz,2h),3.13(d,j=12.6hz,1h),2.85
–
2.74(m,1h),2.40(m,2h),2.05
–
1.95(m,2h).
[0112]
13
c nmr(126mhz,chloroform
‑
d)δ179.98,177.91,177.72,171.05,155.85,141.17,135.59,134.95,133.81,133.48,132.83,132.47,131.87,131.79,131.15,130.72,129.96,129.78,129.52,129.27,127.53,127.46,126.89,126.43,125.93,124.20,118.55,107.77,71.57,71.47,63.29,58.63,40.54,30.95,23.54.hrms(esi)m/z:calcd for c
43
h
33
cl3n3nio
5
[m h]
:834.0839,found:834.0831.
[0113]
产物结构如下:
[0114][0115]
实施例13雌酚酮磺酸酯为芳基化剂的取代反应
[0116]
反应步骤同实例1,结果见表1。
[0117]1h nmr(500mhz,chloroform
‑
d)δ8.92(d,j=2.1hz,1h),8.17(d,j=9.3hz,1h),7.63
–
7.50(m,3h),7.43(td,j=7.5,1.5hz,1h),7.36
–
7.28(m,3h),7.10(dd,j=9.3,2.6hz,1h),6.94(dd,j=7.9,1.9hz,1h),6.84
–
6.77(m,2h),6.61(d,j=2.6hz,1h),4.24(dd,j=5.6,4.3hz,1h),4.17(d,j=12.5hz,1h),3.22
–
3.13(m,2h),3.10(d,j=12.6hz,1h),3.00(dd,j=13.9,4.3hz,1h),2.85
–
2.76(m,2h),2.76
–
2.69(m,1h),2.55
–
2.43(m,2h),2.39
–
2.24(m,4h),2.19
–
2.12(m,1h),2.09
–
1.96(m,3h),1.87(dt,j=10.3,5.2hz,1h),1.74(s,2h),1.66
–
1.57(m,2h),1.55
–
1.50(m,2h),1.47
–
1.42(m,1h),0.91(s,3h).
[0118]
13
c nmr(126mhz,chloroform
‑
d)δ220.66,179.77,170.71,137.06,134.99,133.80,133.34,133.03,132.58,132.45,131.33,131.04,130.31,129.76,129.52,129.17,128.15,127.75,127.35,125.94,125.73,123.82,71.83,71.43,63.29,58.36,50.60,48.01,44.62,39.24,38.36,35.95,31.68,30.92,29.79,29.50,26.69,25.90,22.80,21.69,13.93.hrms(esi)m/z:calcd for c
46
h
45
cl3n3nio
4
[m h]
:866.1829,found:866.1835.
[0119]
产物结构如下:
[0120][0121]
实施例14苯酚磺酸酯为芳基化剂与苯丙氨酸的镍络合物进行的取代反应
[0122]
反应步骤同实例1,结果见表1。
[0123]1h nmr(500mhz,chloroform
‑
d)δ8.96(d,j=2.1hz,1h),8.21(d,j=9.4hz,1h),
7.73
–
7.63(m,2h),7.49
–
7.41(m,6h),7.39
–
7.34(m,2h),7.29(dd,j=8.0,2.0hz,2h),7.23
–
7.17(m,1h),7.10(dd,j=9.3,2.6hz,1h),7.07(s,4h),6.58(d,j=2.6hz,1h),6.47
–
6.35(m,1h),4.73(d,j=4.4hz,1h),4.59(d,j=4.5hz,1h),4.21(d,j=12.5hz,1h),3.26(dd,j=9.3,7.1hz,1h),3.13
–
3.04(m,2h),2.55
–
2.46(m,2h),2.01(q,j=7.5,6.1hz,2h),1.83(dt,j=6.9,4.5hz,1h).
[0124]
13
c nmr(126mhz,chloroform
‑
d)δ179.98,141.24,140.19,139.18,134.99,133.88,132.71,132.68,132.27,131.03,130.31,130.04,129.88,129.36,129.33,128.96,128.67,128.57,128.30,128.00,127.82,127.38,126.77,123.67,72.02,63.60,58.92,58.74,31.37,23.52.hrms(esi)m/z:calcd for c
40
h
33
cl3n3nio
3
[m h]
:766.0941,found:766.0947.
[0125]
产物结构如下:
[0126][0127]
实施例15苯酚磺酸酯为芳基化剂的“一锅法”取代反应
[0128]
反应步骤同实例实例2,结果见表2
[0129]
实施例16对氰基苯酚磺酸酯为芳基化剂的“一锅法”取代反应
[0130]
反应步骤同实例实例2,结果见表2
[0131]
实施例17雌酚酮磺酸酯为芳基化剂的“一锅法”取代反应
[0132]
反应步骤同实例实例2,结果见表2
[0133]
表1实施例5
‑
14构建c
(sp3)
‑
c
(sp2)
的实验结果
[0134][0135]
[0136][0137]
表2“一锅法”构建c
(sp3)
‑
c
(sp2)
的实验结果
[0138][0139][0140]
本发明表征数据的检测采用氢核磁共振、碳核磁共振和高分辨质谱,按仪器的使用方法对产物进行分析鉴定,1h nmr和
13
c nmr核磁检测:核磁共振波谱仪,瑞士avance500mhz。高分辨质谱,ltq(velos pro)/orbitrap elite/etd仪器型号及参数条件
[0141]
显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

