一种共提取不同样本的dna和rna的方法
技术领域
1.本发明涉及分子生物学领域,特别是一种共提取不同样本的dna和rna的方法。
背景技术:
2.临床样本的检验传统检测方法为培养法,但该方法时间长,且阳性率低,无法满足现在的需求。以核酸物质为基础的分子生物学技术克服了培养技术的限制,为临床病原微生物的检测提供了强有力的手段。随着分子生物学技术的深入发展,在基因水平上对疾病进行诊断已经成为临床诊断技术的一项基本技术手段。
3.但对于临床样本的检测来说,针对一种样品要做到多种病原微生物的检测,不仅包括dna也包括rna,因此设计一种适用于不同样本dna/rna共提取技术很重要。
4.目前核酸提取的方法有以下几种:(1)无酚氯仿法、苯酚
‑
氯仿法这两种方法也称为“有机溶剂法”,是纯液相方法中最经典的方法。主要是利用酚
‑
氯仿使蛋白质变性,通过离心从而来去除蛋白质。该方法虽然耗时短,但步骤比较多,易使核酸断裂。
5.(2)尿素法尿素对氨基酸具有增溶作用,能形成氢键,他能够使蛋白质的疏水残基伸展和溶解性加强,高浓度的尿素可使蛋白质变性并抑制核酸酶活性。该方法虽然过程较温和,操作步骤少但该方法容易造成dna变性降解。
6.(3)磁珠法在反应体系中,核酸分子中的负电基团会特异性吸附在磁珠表面。但当反应溶液吸出,加入水性分子时会使核酸分子水化,使吸附到磁珠上的核酸分子被纯化出来,磁珠法提纯核酸不需要使用有机溶剂,操作安全简单,非常有利于核酸的自动化和高通量提取,符合核酸自动化提取要求,是核酸纯化方法发展的重要方向。
7.目前市场有很多关于分别提取dna、rna的方法,但无法将dna和rna共同提取。市场需要一种适用于不同样本的dna/rna共提取方法。该方法不仅能够完成dna/rna的共提取,又不会使提取率降低;本发明解决这样的问题。
技术实现要素:
8.为解决现有技术的不足,本发明的目的在于提供一种共提取不同样本的dna和rna的方法,本发明能够同时提取dna/rna ,实现较全面地获取病原微生物,快速检测出感染源,增加病原识别的准确性。
9.为了达到上述目的,本发明采用如下技术方案:一种共提取不同样本的dna和rna的方法,包括如下步骤:步骤一,将临床样本加入到离心管中作为样本,向离心管中加naoh溶液液化样本;步骤二,在液化的样本中加入酶并研磨,离心,取上清液;
步骤三,取离心管加入裂解液,离心后加入步骤二的上清液,振荡、离心、孵育、离心;裂解液包括:二硫苏糖醇和异硫酸氰胍;步骤四,在离心管中加入无水乙醇,混匀,加入磁珠,静置;步骤五,将离心管放置于磁力架上,待磁珠完全吸附至管壁后吸弃上清液;步骤六,将离心管中加入洗涤液,振荡,置于磁力架上,待磁珠完全吸附至管壁后吸弃上清液;步骤七,在离心管中加入80%乙醇,混匀后置于磁力架,待磁珠完全吸附至管壁后吸弃上清液,打开ep管,晾干;步骤八,在离心管中加入洗脱液,混匀后孵育,置于磁力架上,待磁珠完全吸附至管壁后吸取上清液于新的离心管中,即得到dna/rna混合液。
10.进一步的,临床样本包括:血浆、肺泡灌洗液、脑脊液、脓肿抽液、痰液或拭子。
11.进一步的,步骤二中的酶为蛋白酶k和溶菌酶;微生物样本与蛋白酶k的体积比为400:5,蛋白酶k的浓度≥30 units/mg proteinn。
12.进一步的,步骤二中的研磨采用灭菌过的氧化锆研磨珠研磨。
13.进一步的,裂解液为:10mg/ml糖原、0.025
‑
0.055m 二水合柠檬酸三钠、0.05
‑
0.08m二硫苏糖醇、0.01
‑
0.03m tris
‑
hcl、10% tritonx
‑
100、0.05m edta、10% n
‑
月桂酰基肌氨酸钠、2m 异硫酸氰胍和2%非离子表面活性剂。
14.进一步的,磁珠为磁性纳米磁珠。
15.进一步的,洗涤液为1
×
wb洗涤液,成分为:3
‑
4m 异硫酸氰胍、0.01m tris
‑
hcl(ph=8.0)、0.2m 氯化钠和0.04m edta。
16.进一步的,洗脱液为去核酸酶水。
17.采用上述技术方案后,本发明的有益之处在于:本发明能够同时提取dna和rna ,实现较全面地获取病原微生物;该方法能更快的检测出感染源,增加病原识别的准确性;本发明通过加入的异硫氰酸胍以及二硫苏糖醇(dtt),避免rnase降解在一般dna提取过程中,避免了rna的降解,实现dna/rna的共提取,以便于后期病原菌的检出。
18.本发明基于纳米磁珠,同时利用物理机械破碎以及酶法破壁相结合的提取方法,不会使用苯酚、氯仿、β
‑
巯基乙醇等有毒试剂,提高实验安全性的同时环保。
附图说明
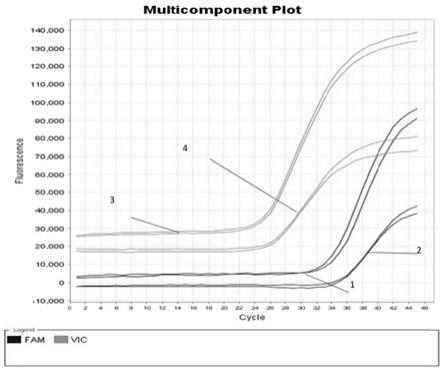
19.图1是本发明实验二中以样本p2按照不同的提取方法获得的dna为模板,实时荧光定量pcr(qpcr)扩增图,1为本发明的提取方法所提取dna的目标靶点扩增曲线,2为按照苯酚
‑
氯仿法(对照组1)提取dna的目标靶点扩增曲线,3为本发明的提取方法获得的dna为模板的内参扩增曲线,4为苯酚
‑
氯仿法(对照组1)提取dna为模板的内参扩增曲线;图2是本发明实验二中以样本p3按照不同的提取方法获得的rna为模板,实时逆转录
‑
荧光定量pcr(rt
‑
qpcr)扩增图,5为本发明的提取方法所提取rna的目标靶点扩增曲线,6为按照trizol法(对照组2)提取rna的目标靶点扩增曲线,7为本发明的提取方法获得的rna为模板的内参扩增曲线,8为trizol法(对照组2)提取rna为模板的内参扩增曲线。
具体实施方式
20.以下结合附图和具体实施例对本发明作具体的介绍。
21.根据如下的一种共提取不同样本的dna和rna的方法验证本发明的技术效果,包括如下步骤:步骤一,试剂的准备与配制:1.裂解液分别将500mg/ml糖原200μl;1m 二水合柠檬酸三钠550μl;1m二硫苏糖醇(dtt) 550μl;1m tris
‑
hcl(ph=8.0) 300μl;10% tritonx
‑
100 1ml ;0.5m edta 1ml;10% n
‑
lanroyl sarcdsine 5ml;5m 异硫酸氰胍 400μl混合,搅拌混匀后定容至10ml。需要说明的是:这只是一种优选实施例,只要是具有异硫氰酸胍以及二硫苏糖醇(dtt)的裂解液都在本发明的 保护范围之内。
22.2.wb母液将5m 异硫酸氰胍6ml;1m tris
‑
hcl(ph=8.0)100μl;5m 氯化钠 400μl;0.5m edta 800μl,混合,搅拌混匀后定容至10ml。
23.3.1
×
wb洗涤液将wb母液与无水乙醇按照体积一比一混合,混匀。
24.步骤二,核酸共提取:(1)以痰液样本为例,将样本加入到离心管中,并向离心管中加dtt溶液液化样本,并向管内加入6μl的蛋白酶k,5μl的溶菌酶,使得微生物样本与蛋白酶k的体积比为400:5,蛋白酶k的浓度≥30 units/mg protein;同时加入0.05mm氧化锆研磨珠,使用研磨机进行研磨,60s为一循环,研磨3循环。
25.(2)吸取处理过的样本400μl于新的离心管中,加入400μl裂解液,涡旋振荡器充分振荡10
‑
15s后瞬时离心,然后放入到 60℃水孵育5min。
26.(3)孵育后瞬离,取400μl的无水乙醇于ep管中,在涡旋振荡器充分振荡10
‑
15s后瞬时离心放回到 ep 管架。
27.(4)将室温平衡过的磁珠涡旋振荡混匀,取20μl磁珠于上述ep 管中,盖好管盖涡旋振荡10
‑
15s 后室温静置 2min。
28.(5)将上述样本瞬时离心后放入到磁力架上,静置 1min 或磁珠完全吸附到 ep 管壁后,打开盖子匀速吸弃上清,吸弃过程中枪尖保持在液面以下直至ep管底部,上清吸完后立即将管盖盖上。
29.(6)吸取500μl 1
×
wb洗涤液,靠着ep管壁有磁珠部分匀速释放,然后涡旋震荡混匀。
30.(7)瞬离后再放入到磁力架上,静置1min或磁珠完全吸附到 ep 管壁后,用1000μl移液器吸弃上清液体。
31.(8)保持ep 管于磁力架上,加入500μl现配的80%乙醇,盖上管涡旋震荡30s,瞬离后吸弃上清液,将ep管取下瞬离后置于磁力架上,小心将 ep 管底部的液体吸出。
32.(9)打开ep管盖,静置晾干,待磁珠基本干燥时立即盖上ep管盖,取 80μl 洗脱液,左手取下ep管,涡旋震荡混匀后,室温孵育2min。
33.(10)将上述 ep 管瞬离后放置到磁力架上,静置 1min 或磁珠完全吸附到 ep管
壁后,吸取上清液转移至新的ep管中,
‑
20℃保存备用。
34.实验一,添加异硫氰酸胍以及二硫苏糖醇(dtt)的dna/rna共提取效果测试:1.dna/rna提取(1)使用本发明中提取方法共提取肺泡灌洗液样本p的dna/rna(2)去异硫氰酸胍的dna/rna共提取将本发明中提取方法中的裂解液配方调整为:10mg/ml糖原、0.025
‑
0.055m 二水合柠檬酸三钠、0.05
‑
0.08m二硫苏糖醇(dtt)、0.01
‑
0.03m tris
‑
hcl(ph=8.0)、10% tritonx
‑
100、0.05m edta、10% n
‑
月桂酰基肌氨酸钠、2%非离子表面活性剂。wb洗脱液配方:0.01m tris
‑
hcl(ph=8.0)、0.2m 氯化钠、0.04m edta。对样本p进行dna/rna的共提取。
35.(3)去二硫苏糖醇(dtt)的dna/rna共提取将本发明中提取方法中的裂解液配方调整为:10mg/ml糖原、0.025
‑
0.055m 二水合柠檬酸三钠、0.01
‑
0.03m tris
‑
hcl(ph=8.0)、10% tritonx
‑
100、0.05m edta、10% n
‑
月桂酰基肌氨酸钠、2m 异硫酸氰胍、2%非离子表面活性剂。对样本p进行dna/rna的共提取。
36.2.dna/rna共提取效果对比结果如表1所示。
37.表13.实验结果分析从表1的提取效果对比可看出,通过在裂解液及洗脱液中添加异硫氰酸胍以及二硫苏糖醇(dtt),明显提高了dna/rna的提取效率。
38.实验二,常用的单独提取dna和rna方法与本发明的共提取技术提取效果比较实验:1. 验证方法(1)dna/rna的提取以本发明的提取方法和苯酚
‑
氯仿法分别提取痰液样本p1、p2的dna,以本发明的提取方法和trizol法分别提取痰液样本p3、p4 的rna。
39.(2)提取效果的检验以本发明的提取方法为试验组,苯酚
‑
氯仿法为对照组1,trizol法为对照组2,三种方法提取效果对比如表2。
40.(3)本发明适用于不同样本dna/rna共提取技术实际应用的验证分别以p2不同提取方法所提取的核酸为模板,相同体系和扩增程序下进行qpcr扩增验证,扩增结果得到的ct值进行统计如表3,扩增曲线图如图1。以p3不同提取方法所提取的核酸为模板,相同体系和扩增程序下进行rt
‑
qpcr扩增验证,扩增结果得到的ct值进行统
计如表3,扩增曲线如图2。
41.2.实验结果(1)不同方法提取dna、rna的效果对比结果如表2所示。
42.表2不同方法提取dna、rna的效果对比结果分析:从表2的提取效果对比可看出,本发明的dna/rna共提取技术的核酸浓度高于常用的dna和rna提取方法的核酸浓度,且纯度相当。因此说明本发明的适用于不同样本dna/rna共提取技术提高了提取率,提取效果十分理想。
43.(2)实际应用的验证结果如表3、4所示。
44.表3qpcr扩增结果统计表4rt
‑
qpcr扩增结果统计从表3、表4、图1、图2可知,本发明适用于不同样本dna/rna共提取技术所提取的dna/rna均可用于实际样本核酸的提取,且扩增结果显示本发明技术与常用的dna和rna的提取技术相比,更易于临床样本的检测。
45.除上述优选实施例外,本发明还有其他的实施方式,本领域技术人员可以根据本发明作出各种改变和变形,只要不脱离本发明的精神,均应属于本发明权利要求书中所定义的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

