1.本发明涉及药食用真菌领域,具体是一种假芝提取物及其制备方法和应用。
背景技术:
2.假芝(amauroderma rugosum)是一种营养价值丰富,药效活性显著的药食用真菌,被认为是古代六芝中的“黑芝”,在中国应用历史悠久。假芝在真菌系统分类学隶属于灵芝科假芝属,因其幼嫩子实体白色的菌盖边缘及菌盖背面被轻轻触碰便会出现血样分泌物而俗称“血芝”。古籍、现代文献《戴玉成,图力古尔,崔宝凯,等.中国药用真菌图志[m].黑龙江哈尔滨:东北林业大学出版社,2013:38
‑
41.》中均记载,假芝具有抗肿瘤、抗炎及利尿作用。
[0003]
胃溃疡是消化系统中的临床常见病、多发病,是指由于各种致病因子导致的黏膜发生炎症反应或缺损坏死病变,常常有上消化道出血、梗阻、穿孔、癌变等并发症发生,严重影响了患者的生活质量和身心健康。根据调查,全球胃溃疡的发病率可达10%~12%,且随着现代社会节奏的加快,工作、家庭、精神压力的增大,胃溃疡的发病率仍在逐年上升。胃溃疡的病因病机目前尚不够明确,现代的医学者普遍认为,胃溃疡的发病机制主要与其自身损伤因素和防御因素之间失去平衡有关,损伤因素主要包括:胃酸分泌异常、幽门螺杆菌的感染、非甾体抗炎药的滥用及吸烟、饮酒、暴饮暴食等不良生活习惯等,当表皮生长因子、黏膜屏障、黏膜
‑
碳酸氢盐屏障、内源性前列腺素等防御因素力量降低时,以上损伤因素对胃黏膜造成损害,致使溃疡形成。
[0004]
临床上常用h2受体拮抗剂和质子泵抑制剂,通过抑制胃酸分泌治疗胃溃疡,虽治愈率较高,但具有易复发的缺点。近年来,很多研究表明炎症反应是急性胃溃疡的重要发病机制,因此抑制胃部炎症反应是一种有效的抗胃溃疡作用机制。已有研究表明假芝具有较好的体外抗炎、抗氧化作用,但未有关于其用于抗胃溃疡方面的药理研究报道。
技术实现要素:
[0005]
针对现有技术的不足,本发明拟解决的技术问题是,提供一种假芝提取物及其制备方法和应用。
[0006]
本发明解决所述制备方法技术问题的技术方案是,提供一种假芝提取物的制备方法,其特征在于,该方法包括假芝水提取物的制备和假芝乙醇提取物的制备;
[0007]
所述假芝水提取物的制备,具体是:取假芝子实体粉末,加水后,90℃~100℃加热回流提取至少1次,每次提取至少30min,每次提取后进行过滤,得到滤液;所有提取完成后,合并得到的所有滤液;再将合并后的滤液减压浓缩,制成1ml相当于生药1g标准的流浸膏,流浸膏即为假芝水提取物;
[0008]
所述假芝乙醇提取物的制备,具体是:取假芝子实体粉末,加入乙醇后,在提取温度下加热回流提取至少1次,每次提取至少30min,每次提取后进行过滤,得到滤液;所有提取完成后,合并得到的所有滤液;再将合并后的滤液减压浓缩,制成1ml相当于生药1g标准的流浸膏,流浸膏即为假芝乙醇提取物;所述提取温度为低于乙醇的沸点5℃至乙醇的沸点
之间。
[0009]
本发明解决所述假芝提取物技术问题的技术方案是,提供一种所述假芝提取物的制备方法得到的假芝提取物,其特征在于,该假芝提取物包括假芝水提取物和假芝乙醇提取物。
[0010]
本发明解决所述应用技术问题的技术方案是,提供一种所述假芝提取物在制备抗胃溃疡的药物和食品中的应用。
[0011]
与现有技术相比,本发明有益效果在于:本发明公开了一种假芝提取物,并通过药理试验证明该提取物在抗胃溃疡中的有效性,揭示了假芝提取物的抗胃溃疡作用机制为:假芝提取物通过抑制nf
‑
κb p65(核因子
‑
κb p65)核迁移,从而抑制炎症通路nf
‑
κb/nlrp3,使胃黏膜组织促炎因子下调,从而抑制炎症反应,实现抗胃溃疡作用。
附图说明
[0012]
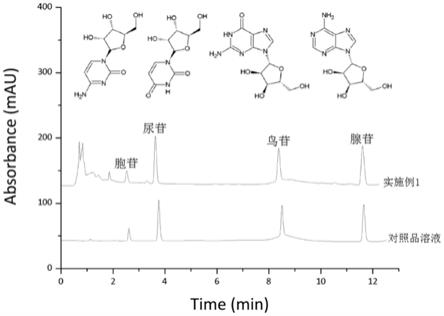
图1为本发明实施例1制得的假芝水提取物的核苷类物质含量测定hplc色谱图;
[0013]
图2为本发明实施例2制得的假芝乙醇提取物的麦角甾醇含量测定hplc色谱图;
[0014]
图3为本发明实施例6的各个组的大鼠胃黏膜照片;图中,a为正常组;b为模型组;c为阳性药组;d为实施例1的假芝水提取物高剂量组;e为实施例1的假芝水提取物中剂量组;f为实施例1的假芝水提取物低剂量组;
[0015]
图4为本发明实施例6的各个组的大鼠胃溃疡面积数据图;
[0016]
图5为本发明实施例6的各个组对胃黏膜组织促炎因子含量影响的测试结果图;图中,a为tnf
‑
α;b为il
‑
1β;c为il
‑
6;
[0017]
图6为本发明实施例6的各个组对胃中促炎相关基因表达量影响的测试结果图;图中,a为nlrp3;b为asc;c为caspase 1;
[0018]
图7为本发明实施例6的各个组对nf
‑
κb p65核迁移的影响表达量影响的测试结果图;图中,a为nf
‑
κb p65在细胞质的水平;b为nf
‑
κb p65在细胞核的水平。
[0019]
图8为本发明实施例7的各个组的大鼠胃黏膜照片;图中,a为正常组;b为模型组;c为阳性药组;d为实施例1的假芝水提取物高剂量组;e为实施例1的假芝水提取物中剂量组;f为实施例1的假芝水提取物低剂量组;
[0020]
图9为本发明实施例7的各个组的大鼠胃溃疡面积数据图;
[0021]
图10为本发明实施例7的各个组对胃黏膜防御及修复基因cox
‑
2表达量影响的测试结果图;
[0022]
图11为本发明实施例8的各个组的大鼠胃黏膜照片;图中,a为正常组;b为模型组;c为阳性药组;d为实施例2的假芝乙醇提取物高剂量组;e为实施例2的假芝乙醇提取物中剂量组;f为实施例2的假芝乙醇提取物低剂量组;
[0023]
图12为本发明实施例8的各个组的大鼠胃溃疡面积数据图。
具体实施方式
[0024]
下面给出本发明的具体实施例。具体实施例仅用于进一步详细说明本发明,不限制本技术权利要求的保护范围。
[0025]
本发明提供了一种假芝提取物的制备方法(简称方法),其特征在于,该方法包括
假芝水提取物的制备和假芝乙醇提取物的制备;
[0026]
所述假芝水提取物的制备,具体是:取假芝子实体粉末,精密称定,加水后,90℃~100℃加热回流提取至少1次(优选3次),每次提取至少30min(优选1h),每次提取后进行过滤,得到滤液;所有提取完成后,合并得到的所有滤液;再将合并后的滤液减压浓缩,制成1ml相当于生药1g标准的流浸膏,流浸膏即为假芝水提取物;
[0027]
所述假芝乙醇提取物的制备,具体是:取假芝子实体粉末,精密称定,加入乙醇后,在提取温度下加热回流提取至少1次(优选3次),每次提取至少30min(优选1h),每次提取后进行过滤,得到滤液;所有提取完成后,合并得到的所有滤液;再将合并后的滤液减压浓缩,制成1ml相当于生药1g标准的流浸膏,流浸膏即为假芝乙醇提取物;所述提取温度为低于乙醇的沸点5℃至乙醇的沸点之间。
[0028]
优选地,每次加水的体积与假芝子实体粉末的质量之比为10~40:1,本实施例中,第1次加水的体积与假芝子实体粉末的质量之比为20:1,第2次加水的体积与假芝子实体粉末的质量之比为16:1,第3次加水的体积与假芝子实体粉末的质量之比为16:1;
[0029]
优选地,每次加入乙醇的体积与假芝子实体粉末的质量之比为10~40:1,本实施例中,第1次加入乙醇的体积与假芝子实体粉末的质量之比为20:1,第2次加入乙醇的体积与假芝子实体粉末的质量之比为16:1,第3次加入乙醇的体积与假芝子实体粉末的质量之比为16:1;
[0030]
优选地,假芝乙醇提取物的制备中,加入的乙醇浓度为75~95%(优选75%)。
[0031]
优选地,所述假芝为人工栽培假芝或野生假芝。
[0032]
本发明同时提供了一种所述假芝提取物的制备方法得到的假芝提取物(extract of amauroderma rugosum,ea),其特征在于,该假芝提取物包括假芝水提取物和假芝乙醇提取物。
[0033]
所述假芝水提取物包括多糖类物质和核苷类物质等;
[0034]
所述假芝乙醇提取物包括三萜及甾醇类物质和麦角甾醇等;
[0035]
所述多糖类物质的含量及检测方法如下:精密量取假芝水提取物2ml,边搅边缓慢滴加乙醇30ml,摇匀,4℃放置12h,取出,离心(3500r/min),倾去上清液,沉淀加热水溶解,转移至50ml量瓶中,放冷,加水至刻度,摇匀,取溶液适量,离心(3500r/min),精密量取上清液3ml,置25ml量瓶中,加水至刻度,摇匀,即得供试品溶液。用纯化水溶解葡萄糖对照品,配制成0.1mg/ml的对照品溶液。采用硫酸蒽酮法,利用紫外可见分光光度计测定样品中多糖含量,检测波长625nm。
[0036]
所述核苷类物质的含量及检测方法如下:精密量取假芝水提取物0.6ml,置于20ml量瓶中,加水至刻度,摇匀,即得供试品溶液。采用快速hplc法测定样品中胞苷、尿苷、鸟苷及腺苷含量,如图1所示,色谱条件为gl sciences inertsustain aq
‑
c
18
色谱柱(2.1
×
100mm,1.9μm),以甲醇(a)
‑
水(b)为流动相,梯度洗脱(0~2min,0%a;2~2.5min,0%~2%a;2.5~4min,2%a;4~4.5min,2%~10%a;4.5~8.5min,10%a;8.5~9.0min,10%~30%a;9.0~10.5min,30%~90%a);流速0.3ml
·
min
‑1;柱温40℃;进样体积1μl;检测波长259nm。
[0037]
所述三萜及甾醇类物质的含量及检测方法如下:精密量取假芝乙醇提取物0.5ml,置于25ml量瓶中,加乙醇至刻度,摇匀,即得供试品溶液。用乙醇溶解齐墩果酸对照品,配制
成0.2mg/ml的对照品溶液。采用香草醛
‑
高氯酸显色反应,利用紫外可见分光光度计测定样品中三萜及甾醇含量,检测波长546nm。
[0038]
所述麦角甾醇的含量及检测方法如下:精密量取假芝乙醇提取物1ml,置于20ml量瓶中,加乙醇至刻度,摇匀,即得供试品溶液。采用hplc法测定样品中麦角甾醇含量,如图2所示,色谱条件为wondasil
tm c
18
色谱柱(4.6
×
250mm,5μm),以乙腈
‑
水(98:2)等度洗脱;流速1.0ml
·
min
‑1;柱温30℃;进样体积20μl;检测波长282nm。
[0039]
本发明同时提供了一种所述假芝提取物在制备抗胃溃疡的药物和食品中的应用。
[0040]
所述药物包括有效量的假芝提取物和药学上可接受的载体。
[0041]
实施例1
[0042]
取假芝子实体粉末800g,精密称定,98~100℃加热回流提取3次,每次1h,第1次加水16l,第2次加水12.8l,第3次加水12.8l,每次提取后进行过滤,得到滤液;所有提取完成后,合并得到的所有滤液;再将合并后的滤液减压浓缩至800ml,制成1ml相当于生药1g标准的流浸膏,流浸膏即为假芝水提取物。
[0043]
经测试,实施例1的核苷类物质的理化指标如表1;多糖类物质含量7.20mg/ml,rsd值2.92%。
[0044]
表1
[0045]
核苷种类胞苷尿苷鸟苷腺苷合计样品含量(mg/ml)0.24650.63010.40640.49891.7819rsd(%)3.873.004.403.991.53
[0046]
实施例2
[0047]
取假芝子实体粉末800g,精密称定,75℃加热回流提取3次,每次1h,第1次加75%乙醇16l,第2次加75%乙醇12.8l,第3次加75%乙醇12.8l,每次提取后进行过滤,得到滤液;所有提取完成后,合并得到的所有滤液;再将合并后的滤液减压浓缩至800ml,制成1ml相当于生药1g标准的流浸膏,流浸膏即为假芝乙醇提取物。
[0048]
经测试,实施例2的三萜及甾醇类物质含量3.60mg/ml,rsd值2.51%;麦角甾醇含量0.387mg/ml,rsd值2.99%。
[0049]
实施例3
[0050]
取假芝子实体粉末800g,精密称定,80℃加热回流提取3次,每次1h,第1次加50%乙醇16l,第2次加50%乙醇12.8l,第3次加50%乙醇12.8l,每次提取后进行过滤,得到滤液;所有提取完成后,合并得到的所有滤液;再将合并后的滤液减压浓缩至800ml,制成1ml相当于生药1g标准的流浸膏,流浸膏即为假芝乙醇提取物。
[0051]
实施例4
[0052]
取假芝子实体粉末800g,精密称定,70℃加热回流提取3次,每次1h,第1次加80%乙醇16l,第2次加80%乙醇12.8l,第3次加80%乙醇12.8l,每次提取后进行过滤,得到滤液;所有提取完成后,合并得到的所有滤液;再将合并后的滤液减压浓缩至800ml,制成1ml相当于生药1g标准的流浸膏,流浸膏即为假芝乙醇提取物。
[0053]
实施例5
[0054]
取假芝子实体粉末800g,精密称定,70℃加热回流提取3次,每次1h,第1次加90%乙醇16l,第2次加90%乙醇12.8l,第3次加90%乙醇12.8l,每次提取后进行过滤,得到滤
液;所有提取完成后,合并得到的所有滤液;再将合并后的滤液减压浓缩至800ml,制成1ml相当于生药1g标准的流浸膏,流浸膏即为假芝乙醇提取物。
[0055]
实施例6
[0056]
(一)药理试验方案:无水乙醇致大鼠胃溃疡模型中假芝水提取物对胃黏膜的作用;
[0057]
1、药物与动物:
[0058]
1)假芝提取物选用实施例1制备的假芝水提取物。阳性药选用兰索拉唑(lansoprazole)。
[0059]
2)动物:spf级雄性sd大鼠(6
‑
7周龄,200
‑
250g)。
[0060]
2、分组与给药:
[0061]
将大鼠随机分为6组,分别为正常组(control)、模型组(model)和给药组,其中给药组为阳性药组、高剂量假芝提取物(h
‑
ea)组、中剂量假芝提取物组(m
‑
ea)和低剂量假芝提取组(l
‑
ea)。模型组中的大鼠只数n=8,其他组n=6。
[0062]
正常组:连续7天灌服生理盐水,7天中的最后一天禁食24h且可自由饮水。
[0063]
模型组:连续7天灌服生理盐水,7天中的最后一天禁食24h且可自由饮水;最后一次灌服1h后,灌胃给予1ml无水乙醇。
[0064]
阳性药组:按30mg/kg的剂量连续灌服7天兰索拉唑,7天中的最后一天禁食24h且可自由饮水;最后一次灌服1h后,灌胃给予1ml无水乙醇。
[0065]
h
‑
ea组:按200mg/kg的剂量连续灌服7天实施例1的假芝水提取物,7天中的最后一天禁食24h且可自由饮水;最后一次灌服1h后,灌胃给予1ml无水乙醇。
[0066]
m
‑
ea组:按100mg/kg的剂量连续灌服7天实施例1的假芝水提取物,7天中的最后一天禁食24h且可自由饮水;最后一次灌服1h后,灌胃给予1ml无水乙醇。
[0067]
l
‑
ea组:按50mg/kg的剂量连续灌服7天实施例1的假芝水提取物,7天中的最后一天禁食24h且可自由饮水;最后一次灌服1h后,灌胃给予1ml无水乙醇。
[0068]
(二)检测结果:
[0069]
1、数据分析:所有检测结果均为平均值
±
标准误差。
[0070]
图4、图5、图6、图7、图9、图10和图12中,模型组与正常组的比较采用配对样品t检验。给药组与模型组的比较,采用单因素方差分析,probability(p)表示概率。模型组与正常组相比,当p<0.05时,表示两组数据具有显著性差异,图中用“#”表示;当p<0.01时,表示两组数据间具有极显著性差异,图中用“##”表示。给药组与模型组相比,当p<0.05时,表示两组数据具有显著性差异,图中用“*”表示;当p<0.01时,表示两组数据间具有极显著性差异,图中用“**”表示。分析软件为spss 20.0。
[0071]
2、性状观察:
[0072]
(1)灌胃给予1ml无水乙醇的1h后,腹腔注射10%水合氯醛4ml/kg麻醉大鼠,解剖大鼠,沿胃大弯剪开胃部,用冰冷生理盐水冲洗,展开胃部并用器具压平拍照,image j软件(national insti)测定溃疡面积(mm2)。由图3可以看出,胃黏膜内壁颜色较深处为发生溃疡部位,正常组没有发生溃疡,模型组溃疡面积分布广泛,给药组的胃溃疡程度均比模型组轻。
[0073]
(2)由图4可以看出,模型组与正常组相比,胃黏膜溃疡面积显著升高,表明造模成
功。给药组与模型组相比,溃疡面积均显著降低,说明假芝水提取物具有抗溃疡效果。
[0074]
3、胃黏膜组织促炎因子的测定:取各个组的大鼠胃壁组织匀浆,照试剂盒说明书操作,分别测定肿瘤坏死因子(tumor necrosis factor
‑
alpha,tnf
‑
α)、白细胞介素(interleukins factors,il)
‑
1β(il
‑
1β)、白细胞介素
‑
6(il
‑
6)的含量。由图5可以看出,tnf
‑
α、il
‑
1β、il
‑
6三个胃黏膜组织促炎因子,在模型组中显著升高,在给药组中均有不同程度的降低,h
‑
ea组、m
‑
ea组和l
‑
ea组对il
‑
1β下调的效果最为显著,说明假芝水提取物具有抗炎作用。
[0075]
4、实时定量聚合酶链式反应(q
‑
pcr):从匀浆组织样品中提取总rna,设计相应引物按q
‑
pcr流程进行测定。无水乙醇致大鼠胃溃疡模型测定的基因包括促炎相关基因nlrp3、caspase
‑
1和asc。由图6可以看出,nlrp3、asc、caspase 1三个促炎相关基因在无水乙醇致大鼠胃溃疡模型中,模型组表达量升高,给药组的表达量降低,说明假芝水提取物具有通过调控促炎基因表达从而抑制胃黏膜组织促炎因子生成的作用。
[0076]
5、蛋白质印迹法(western blot,wb):每组选择4只大鼠,按wb试验操作流程,检测炎症通路nf
‑
κb/nlrp3的重要调控因子nf
‑
κb p65在细胞质和细胞核的水平。由图7可以看出,炎症通路nf
‑
κb/nlrp3的重要调控因子p65在模型组中,细胞质含量显著降低,细胞核含量显著升高,即在模型组中p65发生显著的核迁移,激活炎症通路nf
‑
κb/nlrp3,从而促进炎症基因表达,提高促炎因子的生成;与之相反,在给药组中,p65核迁移显著减弱,从而通过抑制nf
‑
κb/nlrp3通路减弱炎症反应,最终实现抗胃溃疡作用。
[0077]
实施例7
[0078]
(一)药理试验方案:吲哚美辛致大鼠胃溃疡模型中假芝水提取物对胃黏膜的作用;
[0079]
1、药物与动物:
[0080]
1)假芝提取物选用实施例1制备的假芝水提取物。阳性药选用兰索拉唑。
[0081]
2)动物:spf级雄性sd大鼠(6
‑
7周龄,200
‑
250g)。
[0082]
2、分组与给药:
[0083]
将大鼠随机分为6组,分别为正常组、模型组和给药组,其中给药组为阳性药组、高剂量假芝提取物(h
‑
ea)组、中剂量假芝提取物组(m
‑
ea)和低剂量假芝提取组(l
‑
ea)。模型组中的大鼠只数n=8,其他组n=6。
[0084]
正常组:连续7天灌服生理盐水,7天中的最后一天禁食24h且可自由饮水。
[0085]
模型组:连续7天灌服生理盐水,7天中的最后一天禁食24h且可自由饮水;最后一次灌胃30min后,灌胃给予100mg/kg剂量的吲哚美辛。
[0086]
阳性药组:按30mg/kg的剂量连续灌服7天兰索拉唑,7天中的最后一天禁食24h且可自由饮水;最后一次灌胃30min后,灌胃给予100mg/kg剂量的吲哚美辛。
[0087]
h
‑
ea组:按200mg/kg的剂量连续灌服7天实施例1的假芝水提取物,7天中的最后一天禁食24h且可自由饮水;最后一次灌胃30min后,灌胃给予100mg/kg剂量的吲哚美辛。
[0088]
m
‑
ea组:按100mg/kg的剂量连续灌服7天实施例1的假芝水提取物,7天中的最后一天禁食24h且可自由饮水;最后一次灌胃30min后,灌胃给予100mg/kg剂量的吲哚美辛。
[0089]
l
‑
ea组:按50mg/kg的剂量连续灌服7天实施例1的假芝水提取物,7天中的最后一天禁食24h且可自由饮水;最后一次灌胃30min后,灌胃给予100mg/kg剂量的吲哚美辛。
[0090]
(二)检测结果:
[0091]
1、性状观察:
[0092]
(1)灌胃给予100mg/kg剂量的吲哚美辛的5h后,腹腔注射10%水合氯醛4ml/kg麻醉大鼠,解剖大鼠,沿胃大弯剪开胃部,用冰冷生理盐水冲洗,展开胃部并用器具压平拍照,image j软件(national insti)测定溃疡面积(mm2)。由图8可以看出,胃黏膜内壁颜色较深处为发生溃疡部位,正常组没有发生溃疡,模型组溃疡面积分布较广泛,给药组的胃溃疡程度均比模型组轻。
[0093]
(2)由图9可以看出,模型组与正常组相比,胃黏膜溃疡面积显著升高,表明造模成功。m
‑
ea组与模型组相比,溃疡面积减小;阳性药组、h
‑
ea组、l
‑
ea组与模型组相比,溃疡面积均显著降低,说明假芝水提取物具有抗溃疡效果。
[0094]
2、实时定量聚合酶链式反应(q
‑
pcr):每组选择5只大鼠,从匀浆组织样品中的提取总rna,设计相应引物按q
‑
pcr流程进行测定。吲哚美辛致大鼠胃溃疡模型测定的基因为胃黏膜防御及修复基因cox
‑
2。由图10可以看出,在吲哚美辛致大鼠胃溃疡模型中,胃黏膜防御及修复基因cox
‑
2在模型组中表达量降低,给药组升高,说明假芝水提取物具有增强胃保护作用。
[0095]
实施例8
[0096]
(一)药理试验方案:无水乙醇致大鼠胃溃疡模型中假芝乙醇提取物对胃黏膜的作用;
[0097]
1、药物与动物:
[0098]
1)假芝提取物选用实施例2制备的假芝乙醇提取物。阳性药选用兰索拉唑。
[0099]
2)动物:spf级雄性sd大鼠(6
‑
7周龄,200
‑
250g)。
[0100]
2、分组与给药:
[0101]
将大鼠随机分为6组,分别为正常组、模型组和给药组,其中给药组为阳性药组、高剂量假芝提取物(h
‑
ea)组、中剂量假芝提取物组(m
‑
ea)和低剂量假芝提取组(l
‑
ea)。每组中大鼠只数均为n=7。
[0102]
正常组:连续7天灌服生理盐水,7天中的最后一天禁食24h且可自由饮水。
[0103]
模型组:连续7天灌服生理盐水,7天中的最后一天禁食24h且可自由饮水;最后一次灌服1h后,灌胃给予1ml无水乙醇。
[0104]
阳性药组:按30mg/kg的剂量连续灌服7天兰索拉唑,7天中的最后一天禁食24h且可自由饮水;最后一次灌服1h后,灌胃给予1ml无水乙醇。
[0105]
h
‑
ea组:按200mg/kg的剂量连续灌服7天实施例2的假芝乙醇提取物,7天中的最后一天禁食24h且可自由饮水;最后一次灌服1h后,灌胃给予1ml无水乙醇。
[0106]
m
‑
ea组:按100mg/kg的剂量连续灌服7天实施例2的假芝乙醇提取物,7天中的最后一天禁食24h且可自由饮水;最后一次灌服1h后,灌胃给予1ml无水乙醇。
[0107]
l
‑
ea组:按50mg/kg的剂量连续灌服7天实施例2的假芝乙醇提取物,7天中的最后一天禁食24h且可自由饮水;最后一次灌服1h后,灌胃给予1ml无水乙醇。
[0108]
(二)检测结果:
[0109]
1、性状观察:
[0110]
(1)灌胃给予1ml无水乙醇的1h后,腹腔注射10%水合氯醛4ml/kg麻醉大鼠,解剖
大鼠,沿胃大弯剪开胃部,用冰冷生理盐水冲洗,展开胃部并用器具压平拍照,image j软件(national insti)测定溃疡面积(mm2)。由图11可以看出,胃黏膜内壁颜色较深处为发生溃疡部位,正常组没有发生溃疡,模型组溃疡面积分布广泛,给药组的胃溃疡程度均比模型组轻。
[0111]
(2)由图12可以看出,模型组与正常组相比,胃黏膜溃疡面积显著升高,表明造模成功。阳性药及假芝水提取物与模型组相比,溃疡面积均显著降低,说明假芝乙醇提取物具有抗溃疡效果。
[0112]
本发明未述及之处适用于现有技术。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

