research),2016,41(9):1143
‑
9)。
技术实现要素:
7.在一些实施例中,本发明提供了一种滴眼液,其包括瑞普洛莎或其药学上可接受的盐以及药学上可接受的赋形剂,其中瑞普洛莎或其药学上可接受的盐的浓度小于或等于0.5%w/v且大于或等于约0.1%w/v。在一些实施例中,所述滴眼液包括约0.15到0.45%w/v瑞普洛莎或其药学上可接受的盐以及药学上可接受的赋形剂。在一些实施例中,所述滴眼液包括约0.2到0.3%w/v瑞普洛莎或其药学上可接受的盐以及药学上可接受的赋形剂。
8.在一些实施例中,所述滴眼液包括约0.25%w/v瑞普洛莎和药学上可接受的赋形剂。
9.在一些实施例中,所述药学上可接受的赋形剂包括环糊精,特别是磺丁基醚
‑
β
‑
环糊精或羟丙基
‑
β
‑
环糊精。
10.在一些实施例中,本发明提供了一种用于治疗受试者中的干眼病的方法,其包括向患有干眼病的受试者的眼睛局部施用治疗有效量的本发明的滴眼液。在一些实施例中,本发明的方法包括向患有干眼病的受试者的眼睛局部施用本发明的滴眼液,每天四次(qid)。在一些实施例中,本发明的方法包括向患有干眼病的受试者的眼睛局部施用本发明的滴眼液,每天三次(tid)。在一些实施例中,本发明的方法包括向患有干眼病的受试者的眼睛局部施用本发明的滴眼液,每天两次(bid)或每天一次。在一些实施例中,本发明的方法包括向患有干眼病的受试者的眼睛局部施用本发明的滴眼液,根据需要(prn)。
11.在一些实施例中,本发明的方法包括在初始阶段局部施用本发明的滴眼液,每天四次(qid),然后是维持阶段,其中施用本发明的滴眼液,每天少于四次,例如每天一次、两次或三次。
附图说明
12.图1描绘了od和4
‑
症状调查表:干涩(仅具有观察数据的itt人群)。
13.图2描绘了od和4
‑
症状调查表:总眼部不适(仅具有观察数据的itt人群)。
14.图3描绘了荧光素染色:结膜总评分(鼻部和颞部)(仅具有观察数据的itt人群)。
15.图4描绘了荧光素染色:鼻部(仅具有观察数据的itt人群)。
16.图5描绘了泪液数量和质量改善:泪液膜破裂时间、席尔梅尔氏(schirmer)测试和泪液渗透压支持宽活动谱(终点特异性最坏眼睛:仅具有观察数据的itt人群)。
17.图6描绘了第12周基线丽丝胺绿染色:下部的明显功效混淆了cae终点(仅具有观察数据的itt人群)。
18.图7描绘了荧光素染色:下部总人群(n=100/100/100)相对于高中位亚组(n=68/69/66)(仅具有观察数据的itt人群)。
19.图8描绘了荧光素染色:鼻部总人群(n=100/100/100)相对于高中位亚组(n=59/56/62)(仅具有观察数据的itt人群)。
20.图9描绘了荧光素染色:结膜总评分(鼻部和颞部)总人群(n=100/100/100)相对于高中位亚组(n=55/56/60)(仅具有观察数据的itt人群)。
具体实施方式
21.1.本发明的某些实施例的概述
22.正在开发瑞普洛莎局部滴眼液以用于治疗眼部炎症。所述药物产品以各种强度完成了过敏性结膜炎的1期临床试验以及对照双盲2a期临床试验;过敏性结膜炎的对照双盲2b期临床试验;非传染性前葡萄膜炎的对照双盲2期临床试验;干眼病的2a期临床试验;和干眼病的对照双盲2b期临床试验。在这些完成的临床试验中,瑞普洛莎的最大暴露为以0.5%w/v瑞普洛莎给药,持续六周,用于治疗患有非感染性前葡萄膜炎的患者。
23.干眼病的2a期临床试验的目的是针对以三种不同的调配物中的一种qid给药28天,评估瑞普洛莎滴眼液在患有干眼病(ded)的受试者中的安全性、耐受性和药效学活性。所使用的调配物是0.1%w/v瑞普洛莎滴眼液、0.5%w/v瑞普洛莎滴眼液和0.5%w/v眼科脂质液。在使用三种瑞普洛莎调配物进行的28天治疗期间,未观察到重度不良事件(sae),并且未观察到视力(va)、眼内压(iop)、裂隙灯生物显微镜发现或未扩张眼底镜发现的临床上显著的变化。与0.1%w/v瑞普洛莎滴眼液相比,0.5%w/v瑞普洛莎滴眼液和眼科脂质液的对滴落舒适性的耐受性较差。在被评估为探索性药效学终点的各种ded征兆和症状中,观察到了受试者内改善的统计学显著功效。
24.在2b期临床试验中,在患有干眼病的患者中评价瑞普洛莎滴眼液(0.25%和0.1%)的功效(参见实例1的详细信息)。施用瑞普洛莎滴眼液12周导致多种征兆和症状的在统计学显著改善。瑞普洛莎滴眼液的功效概况早在治疗开始后两周就很明显。瑞普洛莎滴眼液在各种征兆上均表现出宽活性,包含泪液数量(席尔梅尔氏测试)、泪液质量(泪液膜破裂时间(tbut)和泪液渗透压)和眼表染色。另外,在2b期临床试验中证明了0.1%和0.25%瑞普洛莎剂量强度之间的剂量反应。在为期12周的研究中,发现瑞普洛莎滴眼液是安全且耐受性良好的,仅出现轻度至中度不良事件,包含滴注后的短暂眼部刺痛。
25.因此,在一些实施例中,本发明提供了一种滴眼液,其包括瑞普洛莎或其药学上可接受的盐以及药学上可接受的赋形剂,其中瑞普洛莎或其药学上可接受的盐的浓度小于或等于0.5%w/v且大于或等于约0.1%w/v。在一些实施例中,本发明提供了一种用于治疗受试者中的干眼病的方法,其向患有干眼病的受试者的眼睛局部施用所述滴眼液。
26.2.定义
27.除非另有明确说明,否则本文使用的通用术语用以下含义定义。
28.除非另有说明,否则术语“包括”和“包含”在本文中以其开放式和非限制性含义使用。应当进一步理解,在各个实施例的描述使用术语“包括”或“包含”的情况下,本领域技术人员将理解,在一些特定情况下,可以可替代地使用语言“基本上由
……
组成”或“由
……
组成”来描述一个实施例。
29.在描述本发明的上下文中(尤其是在以下权利要求的上下文中),术语“一个/一种”和“所述”以及相似的指代应被解释为覆盖单数和复数,除非本文另有指示或与上下文明显矛盾。当复数形式用于化合物、盐等时,这也被认为是指单一化合物、盐等。
30.本文定义的术语“药学上可接受的”是指在合理的医学判断范围内适合于与受试者(例如,哺乳动物和人类)的组织接触而没有过度的毒性、刺激过敏反应和其他问题并发症并与合理的收益/风险比相称的那些化合物、生物剂、材料、组合物和/或剂型。
31.如本文使用,术语“治疗(treating/treatment)”包括缓解、减少或减轻受试者中
的至少一种症状或实现疾病、病状和/或病症的发展的延迟的治疗。例如,治疗可以是减少病症的一种或征兆或症状或完全根除病症。在本发明的含义内,术语“治疗”还表示阻止疾病发展或恶化、延迟其发作(例如,疾病的临床表现之前的时期)和/或降低其风险。
32.如本文使用,术语“受试者”或“患者”包含动物,例如哺乳动物,例如人类、狗、牛、马、猪、绵羊、山羊、猫、小鼠、兔、大鼠和转基因非人类动物。在一些实施例中,受试者是人类。
33.术语“约”或“大约”应具有给定值或范围的10%以内的含义。在一些实施例中,术语“约”是指在给定值的10%、9%、8%、7%、6%、5%、4%、3%、2%或1%之内。
34.如本文使用,术语“w/v”是指“克/ml”(重量/体积),其是浓度单位。例如,7%w/v相当于70mg/ml。
35.瑞普洛莎具有下式
[0036][0037]
不希望受到任何特定理论的束缚,瑞普洛莎充当醛螯合剂或“捕获剂”,其快速结合到醛并形成环状产物。
[0038]
3.滴眼液
[0039]
本发明的滴眼液包括瑞普洛莎或其药学上可接受的盐,其浓度适合于有效治疗干眼病,特别是不会引起严重或无法忍受的不良作用。在一些实施例中,本发明提供了一种滴眼液,其包括约0.1%到0.5%w/v瑞普洛莎或其药学上可接受的盐以及药学上可接受的赋形剂。在一些实施例中,赋形剂包括环糊精,例如磺丁基醚β
‑
环糊精(sbecd)或羟丙基β
‑
环糊精。
[0040]
在一些实施例中,滴眼液包括摩尔:摩尔比为小于1:2.1的瑞波沙普和环糊精赋形剂。在一些实施例中,瑞普洛莎和环糊精的摩尔:摩尔比为约1:2.1到约1:25。在一些实施例中,所述摩尔:摩尔比为约1:2.2到1:20、1:2.5到1:20、1:2.5到1:10、1:2.75到1:10、1:3到1:8、1:3.5到1:7、1:4到1:6或1:4到1:5。在一些实施例中,所述摩尔:摩尔比为约1:2.1、1:2.2、1:2.3、1:2.4、1:2.5、1:2.6、1:2.7、1:2.8、1:2.9、1:3、1:3.1、1:3.2、1:3.3、1:3.4、1:3.5、1:3.6、1:3.7、1:3.8、1:3.9、1:4.0、1:4.1、1:4.2、1:4.3、1:4.4、1:4.5、1:4.6、1:4.7、1:4.8、1:4.9、1:5.0、1:5.1、1:5.2、1:5.3、1:5.4、1:5.5、1:6、1:7、1:8、1:9、1:10、1:12、1:15、1:20或1:25。
[0041]
在一些实施例中,环糊精赋形剂是本文所述的那些中的一种,例如磺丁基醚β
‑
环糊精(sbecd)。sbecd的平均取代度为约6.5。
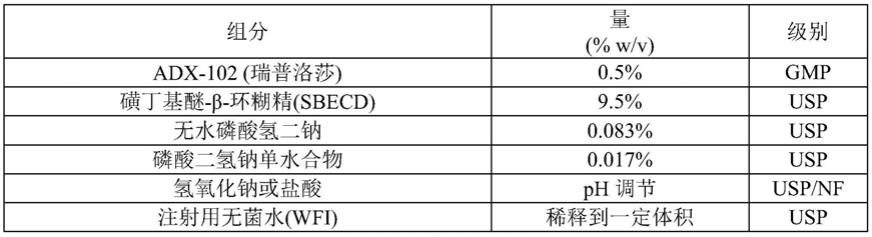
[0042]
在一些实施例中,瑞普洛莎与赋形剂的摩尔:摩尔比为约1:2.1或更小。
[0043]
在一些实施例中,赋形剂是环糊精,并且瑞普洛莎与赋形剂的摩尔:摩尔比为约1:2.1到约1:25。
[0044]
在一些实施例中,赋形剂是环糊精,并且瑞普洛莎与赋形剂的摩尔:摩尔比为约1:2到约1:5。
[0045]
在一些实施例中,本发明提供了一种滴眼液,其包括瑞普洛莎或其药学上可接受
的盐以及药学上可接受的赋形剂,其中瑞普洛莎或其药学上可接受的盐的浓度小于或等于0.5%w/v且大于或等于约0.1%w/v。在一些实施例中,滴眼液包括约0.15到约0.45%w/v瑞普洛莎或其药学上可接受的盐以及药学上可接受的赋形剂。在一些实施例中,滴眼液包括约0.2到约0.4%w/v瑞普洛莎或其药学上可接受的盐以及药学上可接受的赋形剂。在一些实施例中,滴眼液包括约0.21到约0.35%w/v瑞普洛莎或其药学上可接受的盐以及药学上可接受的赋形剂。在一些实施例中,滴眼液包括约0.22到约0.3%w/v瑞普洛莎或其药学上可接受的盐以及药学上可接受的赋形剂。在一些实施例中,滴眼液包括约0.22到约0.29%w/v瑞普洛莎或其药学上可接受的盐以及药学上可接受的赋形剂。在一些实施例中,滴眼液包括约0.25%w/v瑞普洛莎或其药学上可接受的盐以及药学上可接受的赋形剂。在一些实施例中,滴眼液包括约0.25%w/v瑞普洛莎和选自环糊精的药学上可接受的赋形剂。在一些实施例中,滴眼液包括约0.5%w/v瑞普洛莎和选自环糊精的药学上可接受的赋形剂。
[0046]
在一些实施例中,本发明提供了一种滴眼液,其包括小于0.5%w/v瑞普洛莎或其药学上可接受的盐以及药学上可接受的赋形剂。在一些实施例中,本发明提供了一种滴眼液,其包括至少0.1%w/v瑞普洛莎或其药学上可接受的盐以及药学上可接受的赋形剂。在一些实施例中,本发明提供了一种滴眼液,其包括瑞普洛莎或其药学上可接受的盐以及药学上可接受的赋形剂,其中瑞普洛莎或其药学上可接受的盐的浓度小于0.5%w/v且大于或等于0.1%w/v。
[0047]
在一些实施例中,本发明的滴眼液中的瑞普洛莎或其药学上可接受的盐的浓度小于0.45%w/v且至少为0.1%w/v。在一些实施例中,本发明的滴眼液中的瑞普洛莎或其药学上可接受的盐的浓度小于0.4%w/v且至少为0.1%w/v。在一些实施例中,本发明的滴眼液中的瑞普洛莎或其药学上可接受的盐的浓度小于0.35%w/v且至少为0.1%w/v。在一些实施例中,本发明的滴眼液中的瑞普洛莎或其药学上可接受的盐的浓度小于0.3%w/v且至少为0.1%w/v。在一些实施例中,本发明的滴眼液中的瑞普洛莎或其药学上可接受的盐的浓度小于0.25%w/v且大于0.1%w/v。在一些实施例中,本发明的滴眼液中的瑞普洛莎或其药学上可接受的盐的浓度小于0.2%w/v且至少为0.1%w/v。在一些实施例中,本发明的滴眼液中的瑞普洛莎或其药学上可接受的盐的浓度小于0.15%w/v且至少为0.1%w/v。
[0048]
在一些实施例中,本发明的滴眼液中的瑞普洛莎或其药学上可接受的盐的浓度小于或等于0.5%w/v且至少为0.15%w/v。在一些实施例中,本发明的滴眼液中的瑞普洛莎或其药学上可接受的盐的浓度小于或等于0.5%w/v且至少为0.2%w/v。在一些实施例中,本发明的滴眼液中的瑞普洛莎或其药学上可接受的盐的浓度小于或等于0.5%w/v且至少为0.25%w/v。在一些实施例中,本发明的滴眼液中的瑞普洛莎或其药学上可接受的盐的浓度小于或等于0.5%w/v且至少为0.3%w/v。在一些实施例中,本发明的滴眼液中的瑞普洛莎或其药学上可接受的盐的浓度小于或等于0.5%w/v且至少为0.35%w/v。在一些实施例中,本发明的滴眼液中的瑞普洛莎或其药学上可接受的盐的浓度小于或等于0.5%w/v且至少为0.4%w/v。在一些实施例中,本发明的滴眼液中的瑞普洛莎或其药学上可接受的盐的浓度小于或等于0.5%w/v且至少为0.45%w/v。
[0049]
在一些实施例中,本发明的滴眼液中的瑞普洛莎或其药学上可接受的盐的浓度为约0.1%到0.5%、0.15%到0.45%w/v、0.15%到0.4%w/v、0.15%到0.35%w/v、0.15%到0.3%w/v、0.15%到0.25%w/v或0.15%到0.2%w/v。在一些实施例中,本发明的滴眼液中
的瑞普洛莎或其药学上可接受的盐的浓度为0.2%到0.45%w/v、0.2%到0.4%w/v、0.2%到0.35%w/v、0.2%到0.3%w/v或0.2%到0.25%w/v。在一些实施例中,本发明的滴眼液中的瑞普洛莎或其药学上可接受的盐的浓度为0.25%到0.45%w/v、0.25%到0.4%w/v、0.25%到0.35%w/v或0.25%到0.3%w/v。在一些实施例中,本发明的滴眼液中的瑞普洛莎或其药学上可接受的盐的浓度为0.3%到0.45%w/v或0.3%到0.4%w/v。
[0050]
在一些实施例中,本发明的滴眼液中的瑞普洛莎或其药学上可接受的盐的浓度为约0.1%w/v、0.15%w/v、约0.2%w/v、约0.25%、约0.3%w/v、约0.35%w/v、约0.4%w/v、约0.45%w/v或约0.5%w/v。
[0051]
在一些实施例中,如本文进一步所述,可以选择前述浓度的瑞普洛莎并将其应用于包含初始阶段、加重阶段和/或维持阶段的治疗方案。
[0052]
在一些实施例中,本发明的滴眼液中的药学上可接受的赋形剂是环糊精。在一些实施例中,环糊精为α
‑
、β
‑
和γ
‑
环糊精。在一些实施例中,环糊精是环糊精的药学上可接受的衍生物,包含但不限于α
‑
、β
‑
和γ
‑
环糊精的羟烷基衍生物(尤其是β
‑
环糊精和γ
‑
环糊精的羟乙基和羟丙基衍生物)、无规甲基化的β
‑
环糊精、磺丁基醚β
‑
环糊精、磺丁基醚γ
‑
环糊精和所谓的支链β
‑
和γ
‑
环糊精衍生物(例如,葡萄糖基
‑
β
‑
环糊精和葡萄糖基
‑
γ
‑
环糊精)。天然环糊精可单独使用或以两种或两种以上环糊精的混合物形式(作为非限制性实例,γ
‑
环糊精和水溶性更强的羟丙基γ
‑
环糊精、或γ
‑
环糊精和磺丁基醚γ
‑
环糊精、或β
‑
环糊精和羟丙基
‑
β
‑
环糊精、或β
‑
环糊精和磺丁基醚β
‑
环糊精的混合物)使用。
[0053]
在一些实施例中,本发明的滴眼液中的环糊精的浓度为0到20%w/v。在一些实施例中,本发明的滴眼液中的环糊精的浓度为1到18%w/v、1到16%w/v、1到14%w/v、2到12%w/v、4到10%w/v、5到9%w/v或6到8%w/v。在一些实施例中,本发明的滴眼液中的环糊精的浓度为7%到11%w/v。在一些实施例中,本发明的滴眼液中的环糊精的浓度为约1%w/v、2%w/v、3%w/v、4%w/v、5%w/v、6%w/v、7%w/v、8%w/v、9%w/v、10%w/v、11%w/v、12%w/v、13%w/v、14%w/v、15%w/v、16%w/v、17%w/v、18%w/v、19%w/v或20%w/v。
[0054]
在一些实施例中,本发明的滴眼液中的药学上可接受的赋形剂是磺丁基醚
‑
β
‑
环糊精,特别是为任何指定浓度和在以上浓度范围内,例如约7%w/v。在一些实施例中,本发明的滴眼液中的药学上可接受的赋形剂是羟丙基
‑
β
‑
环糊精,特别是为任何指定浓度和在以上指定浓度范围内,例如约7%w/v。
[0055]
在一些实施例中,滴眼液包括约0.2%到0.4%w/v瑞普洛莎和约7%到25%w/v环糊精赋形剂(例如,sbecd)。在一些实施例中,滴眼液包括约0.2%、0.25%、0.3%、0.35%或0.4%w/v瑞普洛莎和约7%到25%w/v环糊精赋形剂(例如,sbecd)。
[0056]
在一些实施例中,滴眼液包括约0.25%w/v瑞普洛莎和约4.7%到约25%w/v环糊精赋形剂(例如,sbecd)。
[0057]
在一些实施例中,滴眼液包括约0.25%w/v瑞普洛莎和约7%到25%w/v环糊精赋形剂(例如,sbecd)。
[0058]
在一些实施例中,滴眼液包括约0.25%w/v瑞普洛莎和约4.75%到约11%w/v环糊精赋形剂(例如,sbecd)。
[0059]
在一些实施例中,滴眼液包括约0.5%w/v瑞普洛莎和约9.5%到约11%w/v环糊精赋形剂(例如,sbecd)。在一些实施例中,api与sbecd的比率为每2摩尔sbecd约一摩尔api。
[0060]
在一些实施例中,滴眼液包括约0.25%w/v瑞普洛莎和约7%w/v环糊精赋形剂(例如,sbecd)。在一些实施例中,api与sbecd的比率为每3摩尔sbecd约一摩尔api。
[0061]
在一些实施例中,滴眼液包括约0.25%w/v瑞普洛莎和约11%w/v环糊精赋形剂(例如,sbecd)。在一些实施例中,api与sbecd的比率为每5摩尔sbecd约一摩尔api。
[0062]
在一些实施例中,本发明的滴眼液包括药学上可接受的缓冲剂。在一些实施例中,药学上可接受的缓冲剂是磷酸盐缓冲液、柠檬酸盐缓冲液、tris缓冲液、组氨酸缓冲液或乙酸盐缓冲液。
[0063]
在一些实施例中,药学上可接受的缓冲剂是磷酸氢二钠。在一些实施例中,药学上可接受的缓冲剂是磷酸二氢钠。在一些实施例中,药学上可接受的缓冲剂是磷酸氢二钠和磷酸二氢钠的混合物。在一些实施例中,本发明的滴眼液包括约0.083%w/v磷酸氢二钠和约0.017%w/v磷酸二氢钠。
[0064]
在一些实施例中,本发明的滴眼液为近似中性的ph。在一些实施例中,本发明的滴眼液的ph为6.5到8。在一些实施例中,本发明的滴眼液的ph为6.9到7.7。在一些实施例中,本发明的滴眼液的ph为7.1到7.5。在一些实施例中,本发明的滴眼液的ph为约7.3。
[0065]
可以在滴眼液中使用药学上可接受的酸和/或碱以调节ph。在一些实施例中,本发明的滴眼液包括药学上可接受的酸。在一些实施例中,本发明的滴眼液包括药学上可接受的碱。在一些实施例中,本发明的滴眼液包括药学上可接受的酸和碱。在一些实施例中,药学上可接受的酸是盐酸。在一些实施例中,药学上可接受的碱是氢氧化钠。
[0066]
在一些实施例中,本发明的滴眼液包括张度剂。在一些实施例中,张度剂选自由以下组成的群组:右旋糖、氯化钾、丙二醇和氯化钠。在一些实施例中,本发明的滴眼液包括浓度小于约0.5%w/v的张度剂。在一些实施例中,本发明的滴眼液包括浓度为约0.45%、0.4%、0.35%、0.3%、0.25%、0.2%、0.15%或0.1%w/v的张度剂。在一些实施例中,张度剂是氯化钠。
[0067]
在一些实施例中,滴眼液包括指定浓度的瑞普洛莎、环糊精、磷酸盐和氯化钠。在一些实施例中,滴眼液包括本文指定浓度(例如,0.1%w/v、0.25%w/v、0.5%w/v等)的瑞普洛莎、5到9%w/v环糊精(例如,磺丁基醚
‑
β
‑
环糊精或羟丙基
‑
β
‑
环糊精);0.07%到0.09%w/v磷酸(氢二)钠、0.015%到0.19%w/v磷酸(二氢)钠和0.2到0.3%w/v氯化钠。在一些实施例中,滴眼液包括本文指定浓度(例如,0.1%w/v、0.25%w/v、0.5%w/v等)的瑞普洛莎、约7%w/v环糊精(例如,磺丁基醚
‑
β
‑
环糊精或羟丙基
‑
β
‑
环糊精);0.07%到0.09%w/v磷酸(氢二)钠、0.015%到0.019%w/v磷酸(二氢)钠和0.2到0.3%w/v氯化钠。在一些实施例中,用氢氧化钠或hcl将滴眼液调节至适当的ph。
[0068]
在一些实施例中,滴眼液包括以下(0.5%瑞普洛莎滴眼液a):
[0069]
[0070]
在一些实施例中,滴眼液包括以下(0.5%瑞普洛莎滴眼液b)
[0071][0072]
在一些实施例中,滴眼液包括以下(0.25%瑞普洛莎滴眼液a)
[0073][0074]
在一些实施例中,滴眼液包括以下(0.25%瑞普洛莎滴眼液b)
[0075][0076]
应当理解,考虑到本文提供的指导,可以制备在本公开的范围内的滴眼液的变形。
[0077]
4.治疗方法
[0078]
一方面,本发明提供了一种用于治疗受试者的干眼病的方法,其包括向有需要的受试者的眼睛局部施用治疗有效量的本发明的滴眼液。在一些实施例中,在所述方法中使用的滴眼液中的瑞普洛莎的浓度如上所述。
[0079]
在一些实施例中,本发明的滴眼液可以以适合于有效治疗干眼病的不同频率施用,例如不会引起严重或无法忍受的不良作用。
[0080]
在一些实施例中,本发明的滴眼液可以局部施用,每天一到六次。在一些实施例中,本发明的方法包括局部施用本发明的滴眼液,每天六次。在一些实施例中,本发明的方法包括局部施用本发明的滴眼液,每天五次。在一些实施例中,本发明的方法包括局部施用本发明的滴眼液,每天四次(qid)。在一些实施例中,本发明的方法包括局部施用本发明的滴眼液,每天三次(tid)。在一些实施例中,本发明的方法包括局部施用本发明的滴眼液,每天两次(bid)。在一些实施例中,本发明的方法包括局部施用本发明的滴眼液,每天一次(qd)。在一些实施例中,本发明的方法包括局部施用本发明的滴眼液,根据需要(prn)。
[0081]
在一些实施例中,本发明的方法包括向患有干眼病的受试者的眼睛局部施用治疗有效量的本发明的滴眼液,每天六次,每天五次,每天四次(qid),每天三次(tid),每天两次(bid),每天一次(qd),然后根据需要(prn)进行施用。
[0082]
在一些实施例中,本发明的方法包括以各种强度(例如,以本文所述的不同的瑞普洛莎浓度和不同的施用频率)局部施用本发明的滴眼液。
[0083]
在一些实施例中,本发明的方法包括局部施用包括约0.25%w/v瑞普洛莎或其药学上可接受的盐的滴眼液,每天四次,每天三次或每天两次。
[0084]
在一些实施例中,本发明的方法包括局部施用包括约0.30%w/v瑞普洛莎或其药学上可接受的盐的滴眼液,每天四次,每天三次或每天两次。
[0085]
在一些实施例中,本发明的方法包括局部施用包括约0.35%w/v瑞普洛莎或其药学上可接受的盐的滴眼液,每天四次,每天三次或每天两次。
[0086]
在一些实施例中,本发明的方法包括局部施用包括约0.4%w/v瑞普洛莎或其药学上可接受的盐的滴眼液,每天四次,每天三次或每天两次。
[0087]
在一些实施例中,本发明的方法包括局部施用包括约0.45%w/v瑞普洛莎或其药学上可接受的盐的滴眼液,每天四次,每天三次或每天两次。
[0088]
在一些实施例中,本发明的方法包括局部施用包括约0.5%w/v瑞普洛莎或其药学上可接受的盐的滴眼液,每天四次,每天三次或每天两次。
[0089]
在一些实施例中,本发明的方法包括局部施用包括约0.3%到0.4%w/v瑞普洛莎或其药学上可接受的盐的滴眼液,每天四次,每天三次或每天两次。
[0090]
在一些实施例中,本发明的方法包括局部施用包括约0.2%到0.3%w/v瑞普洛莎或其药学上可接受的盐的滴眼液,每天四次,每天三次或每天两次。
[0091]
在一些实施例中,本发明的方法包括局部施用包括约0.2%到0.4%w/v瑞普洛莎或其药学上可接受的盐的滴眼液,每天四次,每天三次或每天两次。
[0092]
在一些实施例中,本发明的方法包括两个或两个以上阶段,其中本发明的滴眼液在不同阶段以不同强度局部施用。在一些实施例中,本发明的方法包括初始阶段和维持阶段,其中滴眼液在初始阶段以比维持阶段更高的强度局部施用。在一些实施例中,本发明的方法的治疗周期包括多个阶段,包含征兆和/或症状恶化的加重阶段。
[0093]
在一些实施例中,本发明的方法包括两个或两个以上阶段,其中本发明的滴眼液在不同阶段以不同强度局部施用。在一些实施例中,本发明的方法包括初始阶段,其中滴眼液在初始阶段以高强度局部施用,在维持阶段以低强度局部施用,并且在疾病征兆和/或症状加重期间以高强度局部施用。
[0094]
在一些实施例中,与在维持阶段施用的滴眼液相比,在初始阶段施用的滴眼液包括更高浓度的瑞普洛莎或其药学上可接受的盐。在一些实施例中,在初始阶段或加重阶段施用的滴眼液以及在维持阶段施用的滴眼液包括瑞罗沙普或其药学上可接受的盐,其浓度选自由以下组成的群组:约0.5%w/v、0.45%w/v、0.4%w/v、0.35%w/v、0.3%w/v、0.25%w/v、0.2%w/v、0.15%w/v和0.1%w/v。
[0095]
在一些实施例中,在初始阶段或加重阶段施用约0.5%w/v瑞普洛莎的滴眼液,而在维持阶段施用小于0.5%w/v瑞普洛莎的滴眼液。在一些实施例中,在维持阶段施用约0.4%w/v、0.35%w/v、0.3%w/v、0.25%w/v、0.2%w/v、0.15%w/v或0.1%w/v瑞普洛莎的滴眼液。
[0096]
在一些实施例中,在初始阶段或加重阶段施用约0.5%w/v到约0.4%瑞普洛莎的滴眼液,而在维持阶段施用小于0.4%w/v瑞普洛莎的滴眼液。在一些实施例中,在维持阶段
施用约0.35%w/v、0.3%w/v、0.25%w/v、0.2%w/v、0.15%w/v或0.1%w/v瑞普洛莎的滴眼液。
[0097]
在一些实施例中,在初始阶段或加重阶段施用约0.5%w/v到约0.3%瑞普洛莎的滴眼液,而在维持阶段施用小于0.3%w/v瑞普洛莎的滴眼液。在一些实施例中,在维持阶段施用约0.25%w/v、0.2%w/v、0.15%w/v或0.1%w/v瑞普洛莎的滴眼液。
[0098]
在一些实施例中,在初始阶段或加重阶段施用约0.4%w/v到约0.3%瑞普洛莎的滴眼液,而在维持阶段施用小于0.3%w/v瑞普洛莎的滴眼液。在一些实施例中,在维持阶段施用约0.25%w/v、0.2%w/v、0.15%w/v或0.1%w/v瑞普洛莎的滴眼液。
[0099]
在一些实施例中,在初始阶段或加重阶段施用约0.3%w/v到约0.2%瑞普洛莎(例如,0.3%、0.25%或0.2%w/v)的滴眼液,而在维持阶段施用0.25%w/v或更小的瑞普洛莎的滴眼液。在一些实施例中,在维持阶段施用约0.25%w/v、0.2%w/v、0.15%w/v或0.1%w/v瑞普洛莎的滴眼液。
[0100]
在一些实施例中,与维持阶段相比,本发明的滴眼液在初始阶段和加重阶段每天更频繁地局部施用。在一些实施例中,本发明的滴眼液在初始阶段每天五次局部施用,然后在维持阶段每天四次、三次、两次或一次局部施用。在一些实施例中,本发明的滴眼液在初始阶段每天四次局部施用,然后在维持阶段每天三次、两次或一次局部施用。在一些实施例中,本发明的滴眼液在初始阶段每天三次局部施用,然后在维持阶段每天两次或一次局部施用。在一些实施例中,本发明的滴眼液在初始阶段每天两次局部施用,然后在维持阶段每天一次局部施用。
[0101]
在一些实施例中,与在维持阶段施用的滴眼剂相比,在初始阶段或加重阶段施用的滴眼剂溶液具有更高的瑞普洛莎浓度和更高的施用频率。
[0102]
在一些实施例中,本发明提供了一种用于治疗受试者中的干眼病的方法,其包括向受试者局部施用包括约0.4%w/v瑞普洛莎或其药学上可接受的盐以及药学上可接受的赋形剂的滴眼液,其中滴眼液在初始阶段或加重阶段以较高的强度施用,然后在维持阶段以较低的强度施用,其中初始阶段、加重阶段和维持阶段中的每一个如本文所述。
[0103]
在一些实施例中,多阶段治疗周期可以包含长达12周的初始阶段或加重阶段,其中滴眼液包括约0.5%、0.4%或0.35%w/v(例如,0.5%到0.35%w/v)瑞普洛莎或其药学上可接受的盐,长达12周,然后是维持阶段。在一些实施例中,包括约0.5%、0.4%或0.35%w/v(例如,0.5%到0.35%w/v)瑞普洛莎或其药学上可接受的盐的滴眼液在初始阶段或加重阶段每天四次施用,然后在维持阶段每天三次、两次或一次施用。在一些实施例中,包括约0.5%、0.4%或0.35%w/v(例如,0.5%到0.35%w/v)瑞普洛莎或其药学上可接受的盐的滴眼液在初始阶段或加重阶段每天三次施用,然后在维持阶段每天两次或一次施用。
[0104]
在一些实施例中,包括约0.4%、0.35%或0.3%w/v(例如,0.4%到0.3%w/v)瑞普洛莎或其药学上可接受的盐的滴眼液在初始阶段或加重阶段每天四次施用,然后在维持阶段每天三次、两次或一次施用。在一些实施例中,包括约0.4%、0.35%或0.3%w/v(例如,0.4%到0.3%w/v)瑞普洛莎或其药学上可接受的盐的滴眼液在初始阶段或加重阶段每天三次施用,然后在维持阶段每天两次或一次施用。
[0105]
在一些实施例中,包括约0.3%、0.25%或0.2%w/v(例如,0.3%到0.2%w/v)瑞普洛莎或其药学上可接受的盐的滴眼液在初始阶段或加重阶段每天四次施用,然后在维持阶
段每天三次、两次或一次施用。在一些实施例中,包括约0.3%、0.25%或0.2%w/v(例如,0.3%到0.2%w/v)瑞普洛莎或其药学上可接受的盐的滴眼液在初始阶段或加重阶段每天三次施用,然后在维持阶段每天两次或一次施用。
[0106]
在一些实施例中,本发明提供了一种用于治疗受试者中的干眼病的方法,其包括向受试者局部施用包括0.35%到0.45%w/v瑞普洛莎或其药学上可接受的盐以及药学上可接受的赋形剂的滴眼液,其中滴眼液在初始阶段或加重阶段以较高的强度施用,然后在维持阶段以较低的强度施用,其中初始阶段、加重阶段和维持阶段中的每一个如本文所述。在一些实施例中,包括0.35%到0.45%w/v瑞普洛莎或其药学上可接受的盐的滴眼液的多阶段治疗周期长达12周。在一些实施例中,包括0.35%到0.45%w/v瑞普洛莎或其药学上可接受的盐的滴眼液在初始阶段或加重阶段每天四次施用,然后在维持阶段每天三次、两次或一次施用。在一些实施例中,包括0.35%到0.45%w/v瑞普洛莎或其药学上可接受的盐的滴眼液在初始阶段或加重阶段每天三次施用,然后在维持阶段每天两次或一次施用。
[0107]
在一些实施例中,滴眼液qid施用约10到14周,优选约12周。在一些实施例中,滴眼液qid施用约2到6周,优选约4周,然后bid施用约6到10周,优选约8周。在一些实施例中,用于前述治疗方案的滴眼液是0.25%w/v瑞普洛莎或其药学上可接受的盐以及约7%w/v sbecd。
[0108]
在一些实施例中,滴眼液qid施用约2到6周,优选约4周,然后bid施用约6到10周,优选约8周。在一些实施例中,用于前述治疗方案的滴眼液是0.25%w/v瑞普洛莎或其药学上可接受的盐以及约11%w/v sbecd。
[0109]
在一些实施例中,本发明提供了一种用于治疗患有干眼病的某些受试者的方法。在一些实施例中,患有干眼病的受试者为18岁或更大。在一些实施例中,患有干眼病的受试者在接受本发明的治疗之前有至少六个月的干眼病史。在一些实施例中,患有干眼病的受试者在接受本发明的治疗之前的六个月内有使用或期望使用滴眼剂治疗干眼症状的历史。
[0110]
在一些实施例中,本发明提供了一种用于治疗患有干眼病(特别是中度至重度干眼病)的受试者的方法,其包括在接受本发明的治疗之前,对至少一只眼睛满足以下一或多个以下标准的受试者进行标识(例如,在接受治疗之前约一和/或两周进行筛查):
[0111]
席尔梅尔氏测试评分≤10mm且≥1mm;
[0112]
泪液膜破裂时间(tfbut)≤5秒;
[0113]
至少一个区域(例如,下部、上部或中部)中的角膜荧光素染色评分≥2;
[0114]
基于下部、上部、中部区域的总和的总角膜荧光素染色评分≥4;和
[0115]
基于颞部和鼻部区域的总和的总丽丝胺绿结膜评分≥2。
[0116]
在一些实施例中,患有干眼病的受试者不是怀孕、哺乳或计划怀孕的女性患者。在一些实施例中,患有干眼病的受试者先前未使用过瑞普洛莎滴眼液。
[0117]
在一些实施例中,本发明提供了一种用于治疗患有干眼病的受试者的方法,其包括在接受本发明的治疗之前,筛查以排除至少一只眼睛患有以下一或多种病状的受试者:
[0118]
有任何临床上显著的裂隙灯发现,其可能包含活动性睑缘炎、睑板腺功能障碍(mgd)、睑缘炎症或可能需要治疗的活动性眼部过敏;
[0119]
正患有眼部感染(细菌性、病毒性或真菌性)或活动性眼部炎症;
[0120]
在过去的12个月内曾进行过激光辅助原位角膜磨削术(lasik);
[0121]
在研究期间有任何计划的眼部和/或眼睑手术,或在六个月内有任何眼部手术;和
[0122]
对本发明的滴眼液或其组分具有已知的过敏和/或敏感性。
[0123]
如本文所述,本发明的滴眼液可以在患有干眼病的受试者中实现早期起效。如本文使用,“早期起效作用”是指改善干眼病的症状的早期功效(例如,在治疗开始后1到2周内——在初始或加重阶段)。在一些实施例中,“早期起效作用”是针对在初始或加重阶段的相同的剂量和施用频率的。因此,在一些实施例中,本发明提供了一种用于治疗患有干眼病的受试者的方法,其包括向受试者局部施用本发明的滴眼液,其中滴眼液以可以实现早期起效概况的剂量强度施用。在一些实施例中,早期起效概况包括症状(例如,眼部不适,包含干涩、发痒、流泪、灼痛、刺痛、砂砾感、视力模糊、对环境的敏感性、眼部分泌物粘稠)的早期起效。在一些实施例中,早期起效概况包括征兆(例如,眼部活体染色、泪液膜破裂时间、泪液渗透压和泪液体积)的早期起效。
[0124]
在一些实施例中,可以实现早期起效的剂量强度包括以本文所述的浓度局部施用包括瑞普洛莎或其药学上可接受的盐的滴眼液。在一些实施例中,可以实现早期起效的剂量强度包括以本文所述的频率局部施用包括瑞普洛莎或其药学上可接受的盐的滴眼液。在一些实施例中,可以实现早期起效的剂量强度包括以本文所述的浓度和频率局部施用包括瑞普洛莎或其药学上可接受的盐的滴眼液。
[0125]
在一些实施例中,本发明的方法可以在约两周内实现早期起效。以不同的剂量强度(例如,不同的浓度和施用频率),本发明的方法可以在少于约两周内实现起效。例如,在一些实施例中,本发明的方法可以在约14、13、12、11、十、九或八天内实现起效。以某一剂量强度,本发明的方法可以在约一周或更短的时间内实现起效。在一些实施例中,本发明的方法可以在约七、六、五、四、三、二或一天内实现起效。
[0126]
在一些实施例中,本发明提供了一种用于治疗受试者中的干眼病的方法,其包括向受试者局部施用包括约0.5%w/v瑞普洛莎或其药学上可接受的盐以及药学上可接受的赋形剂的滴眼液,其中滴眼液每天三次、两次或一次施用。在一些实施例中,包括约0.5%w/v瑞普洛莎或其药学上可接受的盐的滴眼液每天三次施用。在一些实施例中,包括约0.5%w/v瑞普洛莎或其药学上可接受的盐的滴眼液每天两次施用。在一些实施例中,包括约0.5%w/v瑞普洛莎或其药学上可接受的盐的滴眼液每天一次施用。
[0127]
在一些实施例中,本发明提供了一种用于治疗受试者中的干眼病的方法,其包括向受试者局部施用包括约0.5%w/v瑞普洛莎或其药学上可接受的盐以及药学上可接受的赋形剂的滴眼液,其中滴眼液在初始阶段或加重阶段以较高的强度施用,然后在维持阶段以较低的强度施用,其中初始阶段、加重阶段和维持阶段中的每一个如本文所述。在一些实施例中,包括约0.5%w/v瑞普洛莎或其药学上可接受的盐的滴眼液在初始阶段或加重阶段每天四次施用,然后在维持阶段每天三次、两次或一次施用。在一些实施例中,包括约0.5%w/v瑞普洛莎或其药学上可接受的盐的滴眼液在初始阶段或加重阶段每天三次施用,然后在维持阶段每天两次或一次施用。在一些实施例中,包括约0.5%w/v瑞普洛莎或其药学上可接受的盐的滴眼液在初始阶段每天两次施用,然后在维持阶段每天一次施用。在一些实施例中,在初始阶段或加重阶段局部施用包括约0.5%w/v瑞普洛莎或其药学上可接受的盐的滴眼液,然后在维持阶段局部施用包括小于约0.5%w/v瑞普洛莎或其药学上可接受的盐的滴眼液,其中每种滴眼液的施用频率选自如上所述的那些。
[0128]
实例
[0129]
以下实例旨在说明本发明,并且不应被解释为对本发明的限制。瑞普洛莎可以如先前报道的那样合成,例如在wo 2006/127945中,其全部内容通过引用并入本文。
[0130]
缩略语
[0131]
cae:受控不利环境
[0132]
gmp:良好生产规范
[0133]
ich:人用药品技术要求国际协调会
[0134]
od:右眼
[0135]
os:左眼
[0136]
ou:双眼
[0137]
prn:根据需要
[0138]
qd:每天一次
[0139]
qid:每天四次
[0140]
qs:足量
[0141]
实例1.用于在患有干眼病的受试者中评估瑞普洛莎滴眼液(0.25%和0.1%)相较于媒剂的安全性和功效的多中心、2b期、随机、双盲、平行组、媒剂对照的临床研究
[0142]
目标:
[0143]
●
评价瑞普洛莎滴眼液(0.25%和0.1%)对干眼病的征兆和症状终点的基线到第2、4、8和12周变化评分的功效。
[0144]
●
评价瑞普洛莎滴眼液(0.25%和0.1%)相对于治疗干眼病的征兆和症状的媒剂的功效终点的效应量,以确认3期研究的终点选择和样本量。
[0145]
●
评价瑞普洛莎滴眼液(0.25%和0.1%)相对于治疗干眼病的征兆和症状的媒剂的安全性和耐受性。
[0146]
研究产品:
[0147]
1)瑞普洛莎滴眼液(0.25%)
[0148]
2)瑞普洛莎滴眼液(0.1%)
[0149]
3)媒剂滴眼液
[0150]
在2b期研究中,瑞普洛莎按照说明中所述被调配成滴眼液。
[0151]
持续时间:受试者的参与时间估计为大约14周(98天)。
[0152]
剂量/给药方案/滴注/应用/用途:筛查:在第1次和第2次访视之间,所有受试者的两只眼睛均接受连续14(
±
2)天的qid自施用流入(run
‑
in)(媒剂)滴眼剂。
[0153]
治疗:在12周(84
±
3天)治疗期期间,通过双侧局部眼部给药qid施用浓度为0.1%、0.25%的瑞普洛莎滴眼液或媒剂滴眼液。在第2次访视的后评估之后,将受试者随机分到三个治疗组(1:1:1)中的一个以接受研究药物。
[0154]
访视时间表总结:大约14周的期间内的六次访视
[0155]
●
第1次访视=第
‑
14
±
2天,筛查
[0156]
●
第2次访视=第1天,确认/基线
[0157]
●
第3次访视=第15
±
2天,2周随访
[0158]
●
第4次访视=第29
±
2天,4周随访
[0159]
●
第5次访视=第57
±
3天,8周随访
[0160]
●
第6次访视=第85
±
3天,12周随访和研究退出
[0161]
病状/疾病:干眼病(ded)
[0162]
纳入标准:治疗受试者基于以下标准:
[0163]
1.至少18岁,任意性别,任意种族;
[0164]
2.提供书面知情同意书并签署健康信息携带和责任法案(hipaa)表;
[0165]
3.在第1次访视之前,有至少六个月的报告干眼历史;
[0166]
4.在第1次访视的六个月内,有使用或期望使用滴眼剂治疗干眼症状的历史;
[0167]
5.在第1次访视和第2次访视前时,至少一种症状的ora眼部不适和4症状调查表上的报告评分≥2;
[0168]
6.在第1次访视和第2次访视时,席尔梅尔氏测试评分≤10mm且≥1mm;
[0169]
7.在第1次访视和第2次访视前时,泪液膜破裂时间(tfbut)≤5秒;
[0170]
8.在第1次访视和第2次访视前时,至少一个区域(例如,下部、上部、中部)中的角膜荧光素染色评分≥2;
[0171]
9.在第1次访视和第2次访视前时,基于下部、上部、中部区域的总和的总角膜荧光素染色评分≥4;
[0172]
10.在第1次访视和第2次访视前时,基于颞部和鼻部区域的总和的总丽丝胺绿结膜评分≥2;
[0173]
11.在第1次访视和第2次访视时,表现出的对的反应定义如下:
[0174]
a.在暴露后,至少一只眼睛的下部区域的荧光素染色增加至少≥1点;
[0175]
b.在暴露期间,报告了至少一只眼睛在两个或两个以上连续时间点的眼部不适评分≥3(如果受试者的某一只眼睛在时间=0时的眼部不适等级为3,则她/他必须报告所述眼睛的连续两次测量的眼部不适等级为4)。注意:受试者在时间=0时的眼部不适评分不能为4);
[0176]
12.至少一只眼睛,同一只眼睛,满足以上6、7、8、9、10和11的所有标准。
[0177]
排除标准:基于以下标准排除受试者:
[0178]
1.在第1次访视时,有任何临床上显著的裂隙灯发现,其可能包含活动性睑缘炎、睑板腺功能障碍(mgd)、睑缘炎症或需要治疗的活动性眼部过敏,和/或研究者认为其可能干扰了研究参数;
[0179]
2.在第1次访视时,被诊断为正患有眼部感染(细菌性、病毒性或真菌性)或活动性眼部炎症;
[0180]
3.在第1次访视的七天内佩戴过隐形眼镜,或在研究期间预期使用隐形眼镜;
[0181]
4.在第1次访视的2小时内使用任何滴眼剂;
[0182]
5.在最近12个月内进行过激光辅助原位角膜磨削术(lasik);
[0183]
6.在第1次访视的90天内使用0.05%环孢霉素或5.0%利非司特(lifitegrast)滴眼液;
[0184]
7.在研究期间有任何计划的眼部和/或眼睑手术,或在第1次访视的6个月内有任何眼部手术;
[0185]
8.在研究期间一直使用或预期使用临时泪点塞,但在第1次访视的30天内仍不稳
定;
[0186]
9.目前正在服用任何局部眼科处方(包含用于青光眼的药物)或非处方(otc)溶液、人工泪液、凝胶或洗涤液,并且在试验期间不能中止使用这些药物(不包含允许用于研究的进行的药物);
[0187]
10.在第1次访视时,双眼的矫正视力大于或等于最小分辨角的对数(logmar) 0.7,如糖尿病性视网膜病变早期治疗研究(etdrs)标度所评估;
[0188]
11.是怀孕、哺乳或计划怀孕的女性;
[0189]
12.如果有生育能力,不愿在第1次访视和第6次访视接受尿液妊娠测试(或提前终止访视)。无生育能力被定义为永久性绝育的女性(例如,已经进行子宫切除或输卵管结扎)或绝经后的女性(连续12个月没有月经);
[0190]
13.没有使用可接受的节育手段;可接受的避孕方法包含:激素——口服、可植入、可注射或经皮避孕药;机械性——杀精子剂与屏障(例如,避孕膜或避孕套)结合使用;子宫内避孕装置(iud);或伴侣进行手术绝育的有生育能力的男性或女性。对于没有性活动的男性或女性,禁欲被认为是适当的节育方法;然而,如果受试者在研究期间进行了性活动,则他/她必须同意在研究的其余时间中使用以上定义的适当节育措施;
[0191]
14.对测试物品或其组分具有已知的过敏和/或敏感性;
[0192]
15.研究者认为有可能使受试者处于重大风险,混淆研究结果或显著干扰受试者参与研究的状况或情形;
[0193]
16.目前参与了研究药物或装置研究,或在第1次访视的30天内使用了研究药物或装置;
[0194]
17.先前使用过瑞普洛莎滴眼液;
[0195]
18.目前正在使用任何已知会引起眼部干燥的药物,但在第1次访视之前的至少30天未依照稳定的给药方案使用;
[0196]
19.无法或不愿意遵循指示,包含参与所有研究评估和访视。
[0197]
在研究中使用了以下功效度量和终点:
[0198]
●
丽丝胺绿染色(ora标度);区域:下部、上部、中部、颞部、鼻部、角膜和、结膜和以及总眼睛评分)
[0199]
●
荧光素染色(ora标度);区域:中部、上部、下部、颞部、鼻部、角膜和、结膜和以及总眼睛评分)
[0200]
●
泪液膜破裂时间
[0201]
●
不麻醉的席尔梅尔氏测试
[0202]
●
ora眼部不适标度
[0203]
●
ora眼部不适和4症状调查表
[0204]
●
眼表疾病指数(osdi)
[0205]
●
sande调查表
[0206]
●
泪液渗透压
[0207]
安全措施:
[0208]
●
视力
[0209]
●
裂隙灯估计
[0210]
●
不良事件查询
[0211]
●
眼内压(iop)
[0212]
●
扩张眼底镜
[0213]
一般统计方法和分析类型
[0214]
样本量:使用ded hybrid cae研究设计和其它开发计划以及观察到的治疗四周后相较于基线的变化的瑞普洛莎的2a期中的效应量,基于之前的2期和3期临床试验结果,选择每组100的研究样本量。认为本样本量足以评估瑞普洛莎相对于媒剂的ded征兆和症状终点的效应量,以确认终点选择和瑞普洛莎的3期研究所需的样本量。每组样本量为100,在α=0.05时提供90%效能,以检测到下部丽丝胺绿染色的效应量为0.26(ora标度)(假设通用标准偏差为0.56),并且眼部不适的效应量为0.44(使用ora眼部不适标度进行评估,假设通用标准差为0.97)。
[0215]
功效分析
[0216]
●
评价ded征兆和症状终点(前cae和cae终点)的瑞普洛莎的基线到第2、4、8和12周的变化评分。每个终点以双侧α水平0.05进行分析,并且在本研究中未控制总体i型错误。
[0217]
●
评价ded征兆和症状终点(前cae和cae终点)的瑞普洛莎相对于媒剂的基线到第2、4、8和12周的变化评分,以确认主要结果参数的终点选择和瑞普洛莎的3期研究的样本量。
[0218]
●
对ded征兆和症状终点(前cae和cae终点)的瑞普洛莎相对于媒剂的基线到第2、4、8和12周的变化评分的效应量进行子组分析[统计分析计划(sap)中对子组进行了前瞻性详细说明]。
[0219]
表1.受试者处置总结
[0220][0221][0222]
表2. 2b期ae总结
[0223][0224]
*受试者在第12天中止
[0225]
**受试者在以下天数中止:2、3、5、5、5、12、14
[0226]
***受试者在以下天数中止:15、16
[0227]
2b期数据在图1至9及表1至3中示出。
[0228]
来自2b期临床试验的主要观察
[0229]
1.跨多种征兆和症状证明的从2b期开始的早期起效
[0230]
●
在0.25%组的第一研究终点(第2或4周),观察到相对于媒剂的大多数效果(>50
‑
100%):
[0231]
○
4个症状终点中有3个早期起效呈阳性:ods、od4sq、osdi
[0232]
■
sande呈阴性
[0233]
○
4个征兆终点中有3个早期起效呈阳性:丽丝胺绿总评分、荧光素总评分、泪液渗透压
[0234]
■
呈阴性(满足第4周的定义)
[0235]
■
在第12周仅席尔梅尔氏测试评估
[0236]
2.剂量反应显示在0.1%和0.25%剂量强度之间
[0237]
3.0.1%瑞普洛莎在较后的时间点匹配较高的剂量效应
[0238]
●
最明显的效应具有征兆(尤其是眼部染色)
[0239]
●
0.25%组的合规性最差(8%不合规,而0.1%组中3%不合规,媒剂组中1%不合规)
[0240]
4.媒剂效应随着研究持续而增加
[0241]
●
观察到的最明显的效应具有征兆(尤其是眼部染色)
[0242]
●
ded的正常模式,有大约两到三个月的平台期
[0243]
●
预计2b期中的qid媒剂会增强这种效应
[0244]
表3. 2b期临床试验结果热图:复制了广泛的2a期活性
[0245][0246]
尽管我们已经描述了本发明的多个实施例,但是显然可以改变我们的基本实例以提供利用本发明的化合物和方法的其他实施例。因此,将理解,本发明的范围将由所附权利要求书而不是由通过举例表示的具体实施例来限定。
[0247]
在本申请中引用的所有出版物、专利、专利申请和其他文件均由此出于所有目的通过引用整体并入,其程度就好像每个单独的出版物、专利、专利申请或其他文件均单独指出以出于所有目的通过引用并入一样。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。