制备混合型过敏原组合物的方法
1.相关申请的交叉引用
2.本技术要求享有2019年1月23日提交的美国临时专利申请no.62/795,877和2019年6月24日提交的美国临时专利申请no.62/865,473的权益和优先权,为所有目的通过引用将它们公开的内容并入本技术。
3.背景
4.过敏症是免疫系统的一种病症,其特征在于对通常无害的环境物质发生过敏反应。过敏症由过敏原引起,过敏原可能存在于广泛多种来源中,包括,但不限于花粉或其他植物成分、灰尘、霉菌或真菌、食物、添加剂、乳胶、输血、动物或禽类皮屑、昆虫毒液、放射性造影剂、药物或化学品。常见的过敏反应包括湿疹、荨麻疹、花粉热、哮喘和对毒液的反应。轻度过敏症,例如花粉热在人群中非常普遍,并且会引起例如过敏性结膜炎、瘙痒和流鼻水等症状。在某些人中,如果不治疗,则对环境过敏原、膳食过敏原或药物的严重过敏可能导致危及生命的过敏反应。
5.食物过敏是对食物过敏原,例如食物蛋白的不良免疫应答。常见的食物过敏原存在于贝类、花生、树本坚果、鱼、奶、蛋、大豆和新鲜水果例如草莓、芒果、香蕉和苹果中。免疫球蛋白e(ige)介导的食物过敏症被归类为i型速发型超敏反应。这些过敏反应急性发作(从几秒到一小时),且伴随的症状可能包括:血管性水肿(眼睑、面部、嘴唇、舌头、喉部和气管的软组织肿胀);荨麻疹;口腔、咽喉、眼睛和皮肤的瘙痒;胃肠道症状,例如恶心、呕吐、腹泻、胃痉挛和腹痛;流液溢或鼻充血;哮鸣;呼吸短促;吞咽困难;以及过敏反应(一种严重的全身过敏反应,其可导致死亡)。据估计,每12名21岁以下的儿童中就有1名被诊断出患有食物过敏,并且每年用于食物过敏反应的医疗保健费用超过240亿美元,其中大部分归因于单独在美国每年约90,000次因食物引起的过敏反应导致的急诊室就诊。此外,每年都发生由致命的食物过敏症导致的死亡事件。
6.因此,本领域中对可以预防和/或治疗过敏症的过敏原组合物以及制备用于预防和/或治疗过敏症的过敏原组合物的方法存在需求。
7.概述
8.本公开至少部分涉及制备基本上不含能生存复制的生物的混合型过敏原产品的方法。例如,在某些实施方案中,该方法包括:提供包含2至20种单独的完全食物过敏原的松散状混合型过敏原材料;通过干热灭菌对松散状混合型过敏原材料灭菌,由此得到混合型过敏原产品。
9.在某些实施方案中,所述方法进一步包括:提供2至20种单独的完全食物过敏原,并且将该2至20种单独的完全食物过敏原掺混在一起,得到松散状混合型过敏原材料。
10.在其它实施方案中,本公开提供一种方法,其中所述2至20种单独的完全食物过敏原选自杏仁、腰果、鳕鱼、蛋、榛子、奶、燕麦、花生、美洲山核桃、开心果、鲑鱼、芝麻、虾、大豆、核桃和小麦。
11.在另一个实施方案中,本公开提供一种方法,其中所述掺混进一步包括将所述2至20种单独的完全食物过敏原与一种或多种填充剂掺混。
12.在本公开的某些实施方案中,掺混包括将2至20种单独的完全食物过敏原装入设置在约10hz至约50hz的螺带式掺混机中约10分钟至约50分钟。在其它实施方案中,掺混后使松散状混合型过敏原材料排入衬里大桶。
13.在某些实施方案中,本公开的方法进一步包括过滤混合型过敏原产品。在一些实施方案中,过滤包括使混合型过敏原产品通过振荡器上#5目(us)筛至#10目(us)筛的筛约1分钟至约10分钟。
14.在一些实施方案中,本公开的方法进一步包括使混合型过敏原产品通过稀土磁铁、金属检测器和金属分离器。
15.在某些实施方案中,所述本公开的方法提供应用干热灭菌,其中干热灭菌是在约65℃至约175℃的温度下进行约18小时至约72小时。在一些实施方案中,干热灭菌包括使用具有加热炉和加热室的灭菌系统,其中加热炉向加热室提供约250,000btu至约750,000btu的热。在某些实施方案中,首先将松散状混合型过敏原材料包装到耐热包装中,然后干热灭菌。在某些实施方案中,在灭菌过程中将温度探头与松散状混合型过敏原材料一起放置,以便监测干热灭菌的温度。
16.在本公开的某些实施方案中,与相应未灭菌的松散状混合型过敏原材料相比,混合型过敏原产品需氧细菌生物平板计数具有至少约1log减少到至少约4log减少。在一些实施方案中,所述混合型过敏原产品具有小于约10,000cfu/g的需氧菌生物。在其它实施方案中,所述混合型过敏原产品具有小于约10cfu/g的大肠菌群,大肠杆菌(escherichia coli),肠杆菌(enterobacteriaceae),霉菌,金黄色葡萄球菌(staphylococcus aureus)和酵母。在某些实施方案中,所述混合型过敏原产品具有小于约10cfu/g的沙门菌(salmonella)。在某些实施方案中,所述混合型过敏原产品具有小于约10cfu/g的克罗诺杆菌(cronobacter)。在其它实施方案中,每25克的混合型过敏原产品、25克的混合型过敏原产品和375克的混合型过敏原产品,所述混合型过敏原产品在基于pcr的检测法中利斯特菌属(listeria)种类、克罗诺杆菌种类和沙门菌种类分别为阴性。
17.在本公开的一些实施方案中,所述混合型过敏原产品具有约10%至约20%重量的脂肪含量。
18.在其它实施方案中,所述混合型过敏原产品的蛋白质完整性基本上类似于相应未被灭菌的松散状混合型过敏原材料的蛋白质完整性。在一些实施方案中,通过sds
‑
page测定所述混合型过敏原产品的蛋白质完整性。
19.在某些实施方案中,所述混合型过敏原产品具有约40%至约50%重量的蛋白质含量。
20.在某些实施方案中,所述混合型过敏原产品具有约1%至约10%重量水分。在其它实施方案中,所述混合型过敏原产品具有约0.1至约0.6的水分活度。
21.在本公开的某些实施方案中,所述混合型过敏原产品包含小于约10%重量的具有大于500微米直径的颗粒。
22.在一些实施方案中,与未经灭菌的相应松散状混合型过敏原材料相比,混合型过敏原产品颜色更深。在其它实施方案中,与未经灭菌的相应松散状混合型过敏原材料相比,混合型过敏原产品具有基本相似的味道特性。
23.在某些实施方案中,本公开所述的方法包括一次或多次进一步应用干热灭菌。
a 1、cor a 2、cor a 6、cor a 8、cor a 9、cor a 10、cor a 11、cor a 12、cor a 13和cor a 14)、腰果蛋白(例如,ana o 1、ana o 2和ana o 3)、开心果蛋白(例如,pis v 1、pis v 2、pis v 3、pis v 4和pis v 5)、核桃蛋白(例如,jug r 1、jug r 2、jug r 3、jug r 4、jug r 5、jug r 6、jug r 7和jug r 8、jug n1、jug n 2和jug n 4)、美洲山核桃蛋白(例如,car i 1,car i 2和car i 4)、杏仁蛋白(例如,pru du 3、pru du 4、pru du 5、pru du 6和pru du 8)、花生蛋白(例如,ara h 1、ara h 2、ara h 3、ara h 4、ara h 5、ara h 6、ara h 7、ara h 8、ara h 9、ara h 10、ara h 11、ara h 12、ara h 13、ara h 14、ara h 15、ara h 16和ara h 17)和巴西坚果蛋白(例如,ber e 1和ber e 2)。致敏性蛋白还可以包括,但不限于动物蛋白,例如卵蛋白(例如,gal d 1、gal d 2、gal d 3、gal d 4、gal d 5、gal d 6、gal d 7、gal d 8、gal d 9、gal d 10)、乳蛋白(例如,bos d 2、bos d 3、bos d 4、bos d 5,bos d,6、bos d 7、bos d 8、bos d 9、bos d 10、bos d 11和bos d 12)、鲑鱼蛋白(例如,onc k 5,sal s 1,sal s 2和sal s 3)、鳕鱼蛋白(例如,pgad c 1、gad m 1、gad m 2和gad m 3)、虾蛋白(例如,cra c 1、cra c 2、cra c 4、cra c 5、cra c 6、cra c 8、lit v 1、lit v 2,lig v 3、lit v 4、met e 1、pan b 1、pen a 1、pen i 1、pen m 1、pen m 2、pen m 3、pen m 4和pen m 6)和蟹蛋白(例如,cha f 1、por p1、scy p 2、scy p 4和scy p 8)。致敏性蛋白还可以包括,但不限于非坚果植物蛋白,例如小麦蛋白(例如,tri a 12、tri a 14、tri a 15、tri a 17、tri a 18、tri a 19、tri a 20、tri a 21、tri a 25、tri a 26、tri a 27、tri a 28、tri a 29、tri a 30、tri a 31、tri a 32、tri a 33、tri a 34、tri a 35、tri a 36、tri a 37、tri a 39、tri a 40、tri a 41、tri a 42、tri a 43、tri a 44和tri a 45)、大豆蛋白(例如,gly m 1、gly m 1.0101、gly m 2、gly m 3、gly m 4、gly m 5、gly m 6、gly m 7和gly m 8)、鹰嘴豆蛋白、芝麻蛋白(例如,ses i 1、ses i 2、ses i 3、ses i 4、ses i 5、ses i 6和ses i 7)、猕猴桃蛋白(例如,act c 1、act c 5、act c 8、act c 10、act d 1、act d 2、act d 3、act d 4、act d 5、act d 6、act d 7、act d 8、act d 9、act d 10、act d 11、act d 12和act d 13)、胡萝卜蛋白(例如,dau c 1、dau c4和dau c5)、芹菜蛋白(例如,api q 1、api q 2、api q 3、api q 4、api q 5和api q 6)、核果蛋白(例如,pru ar 1,pru ar 3、pru av 1、pru av 2、pru av 3、pru av 4、pru p 1、pru p 2、pru p 3、pru p4、pru p 7和pru d 3)和燕麦蛋白。
38.本发明公开的,例如,为一种制备基本上不含能生存复制的生物的混合型过敏原产品的方法,它包括:提供包含2至20种单独的完全食物过敏原的松散状混合型过敏原材料;并且通过干热灭菌对该松散状混合型过敏原材料进行灭菌,由此得到混合型过敏原产品。
39.在某些实施方案中,所述的松散状混合型过敏原材料包含2至20种单独的完全食物过敏原,例如,4至20、6至20、8至20、10至20、12至20、14至20、16至20、18至20、2至18、4至18、6至18、8至18、10至18、12至18、14至18、16至18、2至16、4至16、6至16、8至16、10至16、12至16或14至16种单独的完全食物过敏原。例如,所述的松散状混合型过敏原材料可以包含2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20种单独的完全食物过敏原。在一个具体实施方案中,所述的松散状混合型过敏原材料包含15或16种单独的完全食物过敏原。
40.例如,在某些实施方案中,所述单独的完全食物过敏原选自坚果、种子、豆类、蛋、
乳制品、鱼和甲壳类动物。在具体实施方案中,所述单独的完全食物过敏原选自杏仁、腰果、榛子、花生、美洲山核桃、开心果、核桃、芝麻、大豆、蛋、奶、燕麦、小麦、鳕鱼、鲑鱼和虾。在某些实施方案中,所述单独的完全食物过敏原为杏仁、腰果、榛子、花生、美洲山核桃、开心果、核桃、芝麻、大豆、蛋、奶、燕麦、小麦、鳕鱼、鲑鱼和虾。关注单独的完全食物过敏原可以作为膳食、食物粉、粉末和/或蛋白质浓缩物提供。
41.在某些实施方案中,所述的方法进一步包括提供2至20种单独的完全食物过敏原,并且将该2至20种单独的完全食物过敏原掺混在一起,得到松散状混合型过敏原材料。应当理解,可以在掺混之前组合提供两种或更多种单独的完全食物过敏原。例如,可以在掺混之前组合提供2至20、4至20、6至20、8至20、10至20、12至20、14至20、16至20、18至20、2至18、4至18、6至18、8至18、10至18、12至18、14至18、16至18、2至16、4至16、6至16、8至16、10至16、12至16或14至16种单独的完全食物过敏原。在另一个实例中,可以在掺混之前组合提供2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20种单独的完全食物过敏原。
42.应当理解,掺混可以包括一个或多于一个掺混步骤,得到松散状混合型过敏原材料。例如,可以在1至19、1至17、1至15、1至13、1至11、1至9、1至7、1至5或1至3个掺混步骤中掺混单独的完全食物过敏原。在一个具体实施方案中,掺混包括在单一掺混步骤中混合单独的完全食物过敏原。
43.正如本公开中关注的,通过干热灭菌将松散状混合型过敏原材料灭菌。可以理解,灭菌可以进一步包括一次或多于一次额外应用干热灭菌,以使耐热孢子灭活。
44.在某些实施方案中,可以将干热应用到其中容纳或传送松散状混合型过敏原材料的灭菌系统的处理室,其中该处理室可以被加热至约65℃至约175℃的温度。例如,在某些实施方案中,处理室可以被加热至约65℃至约80℃、约65℃至约120℃、约100℃至约150℃或约125℃至约175℃。在具体实施方案中,处理室可以被加热至约65℃、约66℃、约67℃、约68℃、约69℃、约70℃、约71℃、约72℃、约73℃、约74℃、约75℃、约85℃、约95℃、约105℃、约115℃、约125℃、约135℃、约145℃、约155℃、约165℃或约175℃的温度。在其它实施方案中,可以将干热应用于松散状混合型过敏原材料约3分钟至约72小时。在某些实施方案中,例如,可以将干热应用约3分钟至约72小时、约30分钟至约72小时、约12小时至约72小时、约18小时至约72小时、约24小时至约72小时、约30小时至约72小时、约36小时至约72小时、约42小时至约72小时、约48小时至约72小时、约54小时至约72小时、约60小时至约72小时或约66小时至约72小时。例如,在具体的实例中,可以将干热应用于松散状混合型过敏原材料约30分钟、约45分钟、约60分钟、约75分钟、约90分钟、约105分钟、约120分钟、约12小时、约18小时、约24小时、约30小时、约36小时、约42小时、约48小时、约54小时、约60小时、约66小时或约72小时。
45.在某些实施方案中,例如,可以通过多个天然气燃烧炉向灭菌系统的处理室提供干热,所述天然气燃烧炉向处理室提供约250,000btus至约750,000btu的热。例如,可以向处理室提供约250,000btu、约300,000btu、约350,000btu、约400,000btu、约450,000btu、约500,000btu、约550,000btu、约600,000btu、约650,000btu、约700,000btu或约750,000btu的热。
46.在另一个实施方案中,可以将干热灭菌应用于包装在耐热包装中的松散状混合型过敏原材料。如本技术中所使用的,“耐热”应被理解意指对包装材料施加与同时施加到其
中包装的松散状混合型过敏原材料相同的温度和持续时间的热不会导致包装材料发生影响其作为化学或微生物污染的屏障的完整性和功能性的改变。此外,“耐热”应被理解意指对包装材料施加与同时施加到其中包装的松散状混合型过敏原材料相同的温度和持续时间的热不会改变包装以导致包装中的化学物质被添加到包装在其中的松散状混合型过敏原材料中。例如,耐热包装可以包括,但不限于散装袋、小袋或棒条状包装。在另一个实例中,耐热包装可以放置在盒中和/或放置在加热室内的托盘或架子上以进行干热灭菌。
47.正如本公开所述方法中所关注的,掺混可以包括将2至20种单独的物质食物过敏原(例如,4
‑
20、6
‑
20、8
‑
20、10
‑
20、12
‑
20、14
‑
20、16
‑
20、18
‑
20、2
‑
18、4
‑
18、6
‑
18、8
‑
18、10
‑
18、12
‑
18、14
‑
18、16
‑
18、2
‑
16、4
‑
16、6
‑
16、8
‑
16、10
‑
16、12
‑
16或14
‑
16种单独的完全食物过敏原)装载到机械搅拌器或混合器中。例如,机械搅拌器或混合器可以选自,但不限于:螺带式掺混机;桨式捣碎器;犁式搅拌机;流化搅拌器;强力混合器;真空混合器;锥形混合器;旋转间歇式搅拌机;以及双轴混合器。在一个具体实施方案中,将单独的完全食物过敏原装载到螺带式掺混机中。不希望受理论束缚,认为通过将单独的完全食物过敏原装载到机械搅拌器或混合器中进行掺混减少砂砾感、减少大颗粒的数量并增加均匀性。
48.将理解,可以将每个单独的完全食物过敏原以不同量装载到机械搅拌器或混合器中,例如,但不限于:约5千克至约100千克;约10千克至约90千克;约15千克至约80千克;约20千克至约70千克;约25千克至约60千克;以及约30千克至约50千克。还将进一步理解,机械搅拌器或混合器可以容纳不同合并总量的完全食物过敏原。在某些实施方案中,例如,机械搅拌器或混合器可以容纳约100千克至约2200千克或约500千克至约2000千克合并总量的完全食物过敏原。例如,在一些实施方案中,机械搅拌器或混合器可以容纳约500千克、约600千克、约700千克、约800千克、约900千克、约1000千克、约1100千克、约1200千克、约1500千克、约1600千克、约1700千克、约1800千克、约1900千克或约2000千克合并总量的完全食物过敏原。
49.还将理解,可以调节机械搅拌器或混合器的设置,以便实现单独的完全食物过敏原的最佳掺混和/或混合。例如,可以将机械搅拌器设置在约10hz至约50hz(例如,约15hz至约45hz、约20hz至约40hz或约25hz至约35hz)。也可以将机械搅拌器设置以运行不同的时间长度。例如,机械搅拌机可以将单独的食物过敏原掺混约5分钟至约30分钟、约7.5分钟至约25分钟或约10分钟至约20分钟。在一个具体实施方案中,机械搅拌器或混合器为1000千克容量的螺带式掺混机并且在30hz下掺混单独的完全食物过敏原15分钟。
50.在某些实施方案中,本公开的方法进一步包括将2至20种单独的完全食物过敏原与一种或多于一种填充剂掺混。所考虑的填充剂可以包括本技术中所述的任何填充剂。在某些实施方案中,填充剂包含糖,例如,蔗糖、麦芽糊精、海藻糖、海藻糖二水合物、异麦芽酮糖醇、甘露糖醇、乳糖、葡萄糖、果糖、棉子糖或它们的任意组合。在某些实施方案中,填充剂包含麦芽糊精或蔗糖或其组合。
51.在某些实施方案中,可以使松散状混合型过敏原材料从机械掺混机或混合器中排放到衬里大桶中,然后再装载进行灭菌。在其它实施方案中,可以将排入衬里大桶的松散状混合型过敏原材料包装入袋或包。
52.还关注的是制备混合型过敏原产品的方法,它还包括过滤混合型过敏原产品以去除团聚颗粒。例如,可以将混合型过敏原产品通过在振荡器上#5目(us)筛至#10目(us)筛范
围的筛网约1分钟至约10分钟。例如,所述筛网可以为#5目(us)筛、#6目(us)筛、#7目(us)筛、#8目(us)筛、#9目(us)筛或#10目(us)筛。在一个具体实施方案中,通过在振荡器上#5目(us)筛至#10目(us)筛范围的筛网将混合型过敏原产品过滤约3分钟。
53.在某些实施方案中,制备混合型过敏原产品的方法可以进一步包括磁性筛分混合型过敏原产品以去除金属颗粒。例如,磁性筛分可以包括使混合型过敏原产品通过稀土磁铁、金属检测器和/或金属分离器。在另一个实例中,金属检测器可以检测尺寸至少约2毫米至约2.5毫米的不锈钢颗粒、尺寸至少约1.5毫米至约2毫米的含铁颗粒和具有每百万份之约1.5至2份灵敏度的有色金属颗粒。
54.在其它实施方案中,制备混合型过敏原产品的方法可以为一个连续过程,其中该方法的总完成时间约为3分钟至约72小时、约30分钟至约72小时、约12小时至约72小时、约18小时至约72小时、约24小时至约72小时、约30小时至约72小时、约36小时至约72小时、约42小时至约72小时、约48小时至约72小时、约54小时至约72小时、约60小时至约72小时或约66小时至约72小时。例如,在特定的实例中,该方法的总完成时间约为30分钟、约45分钟、约60分钟、约75分钟、约90分钟、约105分钟、约120分钟、约12小时、约18小时、约24小时、约30小时、约36小时、约42小时、约48小时、约54小时、约60小时、约66小时或约72小时。
55.在本公开的方法中,通过干热灭菌对松散状混合型过敏原料进行灭菌产生混合型过敏原产品,该混合型过敏原产品基本上不含能生存复制的生物。
56.在某些实施方案中,本公开的混合型过敏原产品基本上不含能生存复制的细菌、酵母和/或霉菌。在一些实施方案中,与未经灭菌的相应松散状混合型过敏原材料相比,混合型过敏原产品可以具有:需氧菌生物平板计数至少约1log减少到至少约9log减少;至少约1log减少至约4log减少;至少约1log减少至约5log减少;至少约1log减少至约6log减少;至少约1log减少至约7log减少;至少约1log减少至约8log减少或至少约3log减少至约9log减少。例如,与未经灭菌的相应松散状混合型过敏原材料相比,混合型过敏原产品可以具有需氧菌生物平板计数至少约1log减少、至少约2log减少、至少约3log减少、至少约4log减少、至少约5log减少、至少约6log减少、至少约7log减少、至少约8log减少或至少约9log减少。在另一个实例中,所述的混合型过敏原产品具有小于约100,000cfu/g、10,000cfu/g、小于约1,000cfu/g、小于约100cfu/g或小于约10cfu/g的需氧菌生物。在另一个实例中,所述的混合型过敏原产品具有小于约100cfu/g、小于约10cfu/g或小于约1cfu/g的大肠菌群。在还另一个实例中,所述的混合型过敏原产品可以具有小于约10cfu/g的致病微生物菌株。例如,所述的混合型过敏原产品具有小于约100cfu/g、小于约10cfu/g或小于约1cfu/g的大肠杆菌。在另一个实例中,所述的混合型过敏原产品具有小于约100cfu/g、小于约10cfu/g或小于约1cfu/g的肠杆菌。在另一个实例中,所述的混合型过敏原产品具有小于约100cfu/g或小于约10cfu/g的沙门菌。在另一个实例中,所述的混合型过敏原产品具有小于约100cfu/g或小于约10cfu/g的克罗诺杆菌。在还另一个实例中,通过基于pcr的检测法所测定,所述的混合型过敏原产品每25克混合型过敏原产品样品的利斯特菌属种类或克罗诺杆菌属种类为阴性。在另一个实例中,所述的混合型过敏原产品具有小于约100cfu/g、小于约10cfu/g或小于约1cfu/g的霉菌。在还另一个实例中,通过基于pcr的检测法所测定,所述的混合型过敏原产品每375克混合型过敏原产品样品的沙门菌属种类为阴性。在另一个实例中,所述的混合型过敏原产品具有小于约100cfu/g、小于约10cfu/g或小于约1cfu/g的金黄
色葡萄球菌。在另一个实例中,所述的混合型过敏原产品具有小于约100cfu/g、小于约10cfu/g或小于约1cfu/g的酵母。
57.在某些实施方案中,本公开的混合型过敏原产品具有至少约5%重量的脂肪含量。例如,所述的混合型过敏原产品可以具有约10%至约20%重量的脂肪含量。在一些实施方案中,例如,所述的混合型过敏原产品可以具有约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%或约20%重量的脂肪含量。
58.关注到,将干热灭菌应用于松散状混合型过敏原材料基本上不会改变蛋白质完整性。例如,在某些实施方案中,经灭菌的混合型过敏原产品与未经灭菌的相应松散状混合型过敏原材料具有相同的蛋白质完整性。在另一个实例中,通过sds
‑
page测定蛋白质完整性,其中所述的混合型过敏原产品与未经灭菌的松散状混合型过敏原材料具有基本上相似的蛋白质带、蛋白质带分布和蛋白质带强度。
59.进一步关注到,将干热灭菌应用于松散状混合型过敏原材料在被个体消耗时不会实质影响松散状混合型过敏原材料引发过敏原效应的能力。如本技术中所使用的,“过敏原效应”应被理解意指指对一种或多于一种抗原成分的免疫反应,其特征在于,但不限于免疫细胞活化、细胞因子的产生和ige的产生。在某些实施方案中,所述混合型过敏原产品在被个体消耗时具有与消耗基本相似蛋白质量的未经灭菌的相应松散状混合型过敏原材料基本相似的过敏原效应。在某些实施方案中,通过ige或细胞因子的产生或者测定个体响应松散状混合型过敏原材料或混合型过敏原产品的消耗所产生的免疫细胞活化反应,确定过敏原效应。在其它实施方案中,通过体外免疫反应,例如,测定ige或细胞因子的产生,或测量用松散状混合型过敏原材料或混合型过敏原产品处理后免疫细胞培养物的活化,测定过敏原效应。
60.在某些实施方案中,本公开的混合型过敏原产品具有约40%至约50%重量的蛋白质含量。例如,所述的混合型过敏原产品可以具有约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%或约50%重量的蛋白质含量。
61.在某些实施方案中,本公开的混合型过敏原产品具有约1%至约10%重量水分。例如,所述的混合型过敏原产品可以具有约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%或约10%重量水分。
62.在某些实施方案中,本公开的混合型过敏原产品具有约0.1至约0.6的水分活度。“水分活度”应被理解为在相同条件下混合型过敏原产品的蒸汽压与蒸馏水蒸汽压之比。将理解,水分活度是不与混合型过敏原产品的分子结合并因此能够支持细菌、酵母和霉菌生长的水的量度。此外,将理解,可以使用适合的电子仪器例如湿度计、水分
‑
湿度计、湿度表和相对湿度系统来测量水分活度。
63.在某些实施方案中,本公开的混合型过敏原产品具有小于约10%重量的具有大于500微米的直径的颗粒。
64.在还另一个实施方案中,本公开的混合型过敏原产品与未经灭菌的相应松散状混合型过敏原材料相比具有基本上相似的味道特性。例如,所述的混合型过敏原产品可以具有一种或多于一种选自,但不限于咸味、坚果味、海产品味、烧烤味和棕色调味料的香味。在另一个实例中,所述的混合型过敏原产品没有加工产生的任何异味。
65.在另一个实施方案中,关注一种制备基本上不含能生存复制的生物的混合型过敏
原产品的方法,其中所述2至20种单独的食物过敏原在掺混之前通过干热灭菌进行灭菌以获得混合型过敏原产品。
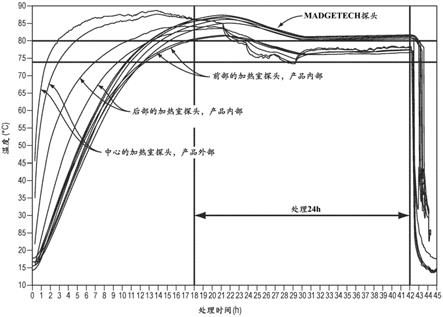
66.在某些实施方案中,制备混合型过敏原产品的方法进一步包括将混合型过敏原产品与一种或多于一种益生菌掺混,所述的益生菌选自包括,但不限于如下各项的组:乳杆菌属(lactobacillus)种类、双歧杆菌属(bifidobacterium)种类、anacaerostipes种类和芽孢杆菌属(bacillus)种类。例如,一种或多种益生菌可以选自包括,但不限于如下各项的组:鼠李糖乳杆菌(lactobacillus rhamnosis)、粪厌氧棒杆菌、长双歧杆菌、乳糖双歧杆菌(bifidobacterium lactis)、植物乳杆菌(lactobacillus plantarum)、嗜酸乳杆菌(lactobacillus acidophilus)、干酪乳杆菌(lactobacillus casei)、短乳杆菌(lactobacillus brevis)、唾液乳杆菌(lactobacillus salivarius)、乳酸乳球菌(lactococcus lactis)、凝结芽孢杆菌(bacillus coagulans)、德氏乳杆菌保加利亚亚种(lactobacillus bulgaricus)、加氏乳杆菌(lactobacillus gasseri)、类干酪乳杆菌(lactobacillus paracasei)、凝结芽孢杆菌和双歧双歧杆菌(bifidobacterium bifidum)。在一个具体实施方案中,制备混合型过敏原产品的方法进一步包括掺混混合型过敏原产品与鼠李糖乳杆菌和/或长双歧杆菌。如本技术中所使用的,“益生菌”是指包含在摄入时对宿主产生有益影响的微生物的培养物(纯的或混合的)。
67.在其它实施方案中,制备混合型过敏原产品的方法进一步包括将混合型过敏原产品与一种或多于一种益生元掺混,所述益生元选自包括,但不限于如下各项的组:果糖寡糖、菊粉、异麦芽寡糖、拉克替醇、乳蔗糖(lactosucrose)、乳果糖、焦糊精、大豆寡糖、木寡糖(xylooligosaccharide)、反式半乳寡聚糖、寡糖、可溶性玉米纤维、β
‑
葡聚糖、低聚果糖(oligofructose)和二聚物。在一个具体实施方案中,制备混合型过敏原产品的方法进一步包括将混合型过敏原产品与果糖寡糖掺混。如本技术中所使用的,术语“益生元”是指促进特定的、期望的细菌菌株的生长、增殖和/或活性的特定膳食食物或营养物。
68.根据需要,所公开的混合型过敏原产品还可以包含一种或多种维生素。可以存在的维生素包括,例如,维生素a(例如,约1至约35,000国际单位的量),维生素c(例如,约1至约1,000毫克的量),维生素d(例如,约1至约4,000国际单位,即约0.025至约100微克的量),维生素e(例如,约1至约450国际单位的量),维生素k(例如,约1至约250微克的量),维生素b
‑
1(硫胺;例如约1至约15毫克的量),维生素b
‑
2(核黄素;例如约1至约17毫克的量),维生素b
‑
3(烟酸;例如约1至约200毫克的量),维生素b
‑
5(泛酸;例如约1至约100毫克的量),维生素b
‑
6(吡多辛;例如约1至约30毫克的量),维生素b
‑
9(叶酸;例如约1至约4,000微克的量),维生素b
‑
12(钴胺素;例如约1至约250微克的量),维生素h(生物素;例如约1至约1,000微克的量)及其组合。在某些实施方案中,所述混合型过敏原产品包含维生素d。在某些实施方案中,所述混合型过敏原产品包含400国际单位,即约10微克的维生素d。
69.还关注制备混合型过敏原产品的方法,其中将混合型过敏原产品进一步与生理学上可接受的递送介质混合以产生生理学上可接受的组合物。可以将混合型过敏原产品进一步掺入多种制剂中以施用于受试者。更具体地,可以通过与适当的、生理学上可接受的载体或稀释剂(例如,植物油)组合,将混合型过敏原产品配制成生理学上可接受的组合物。
70.在某些实施方案中,所公开的混合型过敏原产品被设计用于儿童或成人食物过敏的口服免疫治疗,例如,作为可分散的粉末或颗粒、食品、片剂、锭剂、糖锭、软糖剂、乳剂等。
可以根据用于制造口服组合物的任何便利方案制备预期用于口服使用的组合物,且这类组合物可以包含一种或多种选自甜味剂(例如,甘油、丙二醇、山梨醇或蔗糖)、矫味剂、着色剂和防腐剂的物质,以便提供适合的制剂。
71.还关注制备混合型过敏原产品的方法,其中将混合型过敏原产品与儿童或成人不过敏的食物混合或掺合。例如,食品可以包括,但不限于:婴儿或幼儿配方、婴儿食品(例如,适合婴儿或幼儿食用的泥状食品)、薯片、饼干、面包、涂抹酱、奶油、酸奶、液体饮料、含巧克力的产品、糖果、冰淇淋、谷物、咖啡、泥状食品等。
72.在整个说明书中,当将设备、装置和系统描述为具有、包括或包含特定组件时,或者将工艺和方法描述为具有、包括或包含特定步骤时,预期另外存在基本上由所列举的组件组成或由它们组成的设备、装置和系统,并且存在基本上由所列举的加工步骤组成或由所列举的加工步骤组成的工艺和方法。
73.本技术中提供的所有实施例仅用于示例目的,而不应以任何方式被解释为限制。
实施例
74.实施例1
75.本实施例描述了包含在示例性干粉状混合型过敏原产品中的致敏性食物成分的选择,该干粉状混合型过敏原产品包含16种单独的完全食物过敏原(杏仁、腰果、榛子、花生、美洲山核桃、开心果、核桃、芝麻、大豆、鸡蛋、牛奶、燕麦、小麦、鳕鱼、鲑鱼和虾)。
76.成分的来源主要侧重于国内商业上可获得性,但只可国际获得的单独完全食物过敏原除外。每个每种单独的完全食物过敏原的多种选择的成功商业采购导致了选择标准的发展,以便选择被测试的最佳商业食物过敏原。筛选的属性包括:蛋白质含量;膨松材料含量;感官特性例如味道、异常气味的存在和砂砾感;以及溶解度。蛋白质含量相当低或具有大比例膨松材料的成分从竞争中被淘汰。干尝单独的完全食物过敏原以确定异味的存在并且评估砂砾感。
77.表1显示了混合型过敏原产品的样品配方和为掺混和灭菌提供的单独的完全食物过敏原的代表性预称量批次量。
78.表1
79.单独的完全食物过敏原配方(g)配方(%)灭菌运行批量(kg)实际批量(kg)杏仁粉50%0.68956.62033.1033.10腰果粉35%0.1072010.29451.4751.47鳕鱼粉0.022912.20011.0011.00全蛋粉0.067426.47332.3732.37榛子粉0.088248.47242.3642.36乳蛋白分离物0.035343.39316.966.35燕麦蛋白0.062666.01730.0830.08花生粉0.061225.87929.3929.39美洲山核桃粉0.098169.42547.1347.13开心果粉0.088678.51442.5742.57鲑鱼蛋白粉0.075607.25936.3036.30
芝麻籽粉0.061005.85729.2829.28虾粉0.042614.09220.4620.46大豆蛋白分离物0.037363.58817.9417.94核桃粉0.083167.98539.9339.93小麦谷蛋白0.040963.93319.6719.67总计1.04146100.00500.00489.39
80.实施例2
81.本实施例描述了用于制备混合型过敏原产品的示例性掺混方法,该混合型过敏原产品包含16种单独的完全食物过敏原(杏仁、腰果、榛子、花生、美洲山核桃、开心果、核桃、芝麻、大豆、鸡蛋、牛奶、燕麦、小麦、鳕鱼、鲑鱼和虾)。
82.清洁、消毒1,000千克螺带式掺混机(印度prince industries)并对三磷酸腺苷(atp)和过敏原进行了测试。将表1中所示的16种单独的完全食物过敏原的实际批量(以kg为单位)装入螺带式掺混机中,并在30hz掺混15分钟。
83.使松散状混合型过敏原材料从螺带式掺混机中排放到衬里大桶中(每桶40至50千克)。
84.实施例3
85.本实施例描述了用于制备混合型过敏原产品的可替代性掺混和研磨方法,该混合型过敏原产品包含16种单独的完全食物过敏原(杏仁、腰果、榛子、花生、美洲山核桃、开心果、核桃、芝麻、大豆、鸡蛋、牛奶、燕麦、小麦、鳕鱼、鲑鱼和虾)。
86.称重所有单独的完全食物过敏原以制成8千克批量。将单独的完全食物过敏原转移到配备了d
‑
30碗和安全笼的d500 hobart混合器中。将单独的完全食物过敏原与桨式附件“b”平板状搅拌器在设置1上混合2分钟。将掺混的完全食物过敏原转移到大型食品级塑料袋中,密封并在室温下储存直至研磨。将掺混的完全食物过敏原缓慢送入配备了#20目筛并设置为9,000rpm的quadro sls
‑
l1a fitzmill,以实现直径<500微米的目标粒径。在包装前,使研磨的完全食物过敏原通过金属检测器和#35目筛。
87.实施例4
88.进行了热敏感性的初步试验,以确定松散状混合型过敏原材料对灭菌处理的适合性。
89.将松散状混合型过敏原材料放入平锅中,并且在实验室烘箱中经受不同温度5分钟。
90.如图1中所示,除了随着温度的升高颜色稍微变深外,松散状混合型过敏原材料在95℃、105℃、110℃或120℃热处理5分钟时未表现出会使该材料不适合灭菌处理的任何其他物理变化。
91.实施例5
92.本实施例描述了一种示例性干热灭菌工艺,该工艺可用于制备混合型过敏原产品,该混合型过敏原产品包含16种单独的食物过敏原(杏仁、腰果、榛子、花生、美洲山核桃、开心果、核桃、芝麻、大豆、鸡蛋、牛奶、燕麦、小麦、鳕鱼、鲑鱼和虾)的。在us 2014/0023757中描述了与本公开关注的干热灭菌方法类似的干热灭菌方法,该专利申请通过引用并入本技术。
93.可以将如实施例2或3中所述掺混的松散状混合型过敏原材料装入耐热包装袋中。然后可以将该袋装松散状混合型过敏原材料放入隔热处理室,其中通过多个天然气燃烧炉向该处理室提供热。可以使用多个摄入和排出管道使热通过隔热处理室循环,以促进袋装松散状混合型过敏原材料均匀吸热。
94.例如,可以将6袋松散状混合型过敏原材料(每袋称重约25磅/12千克)作为单层放置在托盘上,并且可以将14个托盘装入具有40英尺长、10英尺高和9英尺宽的尺寸的加热室内。
95.然后可以密封加热室并且可以加热该室以达到74℃的目标温度。该室达到目标温度的预热时间可能需要约24小时。
96.可以使用加热室内的六个探头来监测加热室的温度。例如,可以在加热室的后部放置两个探头,可以在加热室的中部放置两个探头,并且可以在加热室的前部放置两个探头。
97.一旦达到目标温度,则可以将加热室维持24小时期限。
98.可以监测隔热处理室、多个天然气燃烧炉和袋装松散状混合型过敏原材料的温度,以确保松散状混合型过敏原材料采用约65℃至约175℃的温度干热灭菌24小时期限。
99.在干热处理之后,可以从加热室中卸载经灭菌的混合型过敏原产品。可以测量经灭菌的混合型过敏原产品样品的水分活度、湿度水平和平皿总计数,并将其与干热灭菌之前的松散状混合型过敏原材料样品进行比较。
100.例如,可以稀释样品并将其铺在普通回收培养基的培养皿上,以测量总需氧微生物和肠杆菌计数的每克产品或材料的菌落形成单位(cfu/g)。可以根据制造商的说明书(3m,st.paul,minnesota),分别通过稀释样品并铺展在3m petrifilm
tm
大肠杆菌/大肠菌群和3m petrifilm
tm staph express计数板上,测定大肠杆菌/大肠菌群和金黄色葡萄球菌计数。
101.可以根据制造商的说明书,使用pcr检测系统(hygiena,camarillo,california)另外测试样品中利斯特菌属和沙门菌属的存在。
102.也可以根据制造商的说明书,通过稀释样品并铺展到3m petrifilm
tm
霉菌和酵母计数板上测定总霉菌和酵母计数。
103.实施例6
104.本实施例描述了用于松散状混合型过敏原材料灭菌的干热过程的验证。
105.在这种干热方法中,将来源于屎肠球菌(enterococcus faecium)8459的菌株830用作替代微生物,以评价干热灭菌对沙门菌属和克罗诺杆菌属病原体的致死性。1830具有的耐热性类似于或大于沙门菌属和克罗诺杆菌属的耐热性。验证旨在使存活的1830生物的数量实现至少5
‑
log减少。进行了两次验证试验以评估变异性。
106.在干热灭菌之前,用约1.4x1061830生物接种了70个耐热袋,每袋包含25克如实施例2或3所述掺混的松散状混合型过敏原材料。将每个接种过的耐热袋放入盒中。
107.将6个接种过的松散状混合型过敏原材料袋不导入干热灭菌过程,并且用作未处理的对照样品。
108.对于验证试验1和2,分别将14个托盘装载到如图2a和2b中所示的加热室中,每个托盘包含四盒松散状混合型过敏原材料的经接种的耐热袋。在1号、6号、9号和14号托盘上,将第二个接种过的松散状混合型过敏原材料的耐热袋放入3号和/或4号盒中。
109.在整个验证运行过程中使用加热室探头监测加热室的温度:两个位于加热室的前部,两个位于加热室的中间,两个位于加热室的后部。此外,还包括madgetech探头,以便在干热灭菌过程中监测加热室的温度。将madgetech探头放置在已选择经接种的松散状混合型过敏原材料的耐热袋内,或放置在盒外面。
110.分别如验证试验1和2的图3a和3b中所示,madgetech探头记录的温度在室内的不同位置相对均匀。加热室探头记录的温度因室内位置的不同(即后部、中间或前部)而异,但在干热灭菌处理过程中,同一位置的两个探头之间的温度相对相似。
111.对于验证试验1(图3a),将干热处理最初设置在175
°
f/80℃。所有探头达到目标温度花了18小时。一旦达到目标温度,则将温度降至165
°
f/74
°
f并在此温度下再维持24小时。
112.对于验证试验2(图3b),将干热处理设置在165
°
f/74℃。所有探针达到目标温度花了17小时。一旦达到目标温度,则将干热灭菌温度维持在165
°
f/74℃另外24小时。
113.如表2中所示,验证试验1干热灭菌后经灭菌的混合型过敏原产品的水分活度和含湿量低于干热处理前松散状混合型过敏原材料的水分活度和含湿量。干热灭菌前松散状混合型过敏原材料和干热灭菌后混合型过敏原产品在选择性培养基上的平皿总计数相似。
114.表2
[0115][0116]
如表3中所示,未经干热灭菌处理的松散状混合型过敏原材料样品具有8.1
±
0.1log cfu/g的平均1830计数。
[0117]
表3
[0118]
[0119]
如表4中所示,与未经干热处理的经接种的松散状混合型过敏原材料样品相比,在验证试验1中干热灭菌后所有样品中均实现了1830cfu/g的大于5log减少。
[0120]
表4
[0121]
[0122]
[0123][0124]
如表5中所示,验证试验2干热灭菌后灭菌的混合型过敏原产品的水分活度与干热处理前松散状混合型过敏原材料的水分活度相似。与未经干热灭菌的松散状混合型过敏原材料相比,验证试验2中干热灭菌处理后的水分含量和平皿总计数更低。
[0125]
表5
[0126][0127]
如表6中所示,未经干热灭菌处理的松散状混合型过敏原材料样品具有8.1
±
0.1log cfu/g的平均1830计数。
[0128]
表6
[0129][0130]
如表7中所示,与验证试验1中的干热灭菌类似,与未经干热处理的经接种的松散状混合型过敏原材料样品相比,验证试验2中的干热灭菌导致所有样品中1830cfu/g的大于5log减少。
[0131]
表7
[0132]
[0133]
[0134][0135]
实施例7
[0136]
可以测量用干热灭菌处理的混合型过敏原产品样品的粒度分布,并将其与未接受干热灭菌应用的相应松散状混合型过敏原材料的颗粒进行比较。可以使用振动筛和一系列筛目尺寸将样品过滤3分钟,所述筛目尺寸由:#10、#12、#14、#16、#18、#20、#25、#30、#35、#40和#50筛网组成。可以单独去除过滤的颗粒和每个筛网保留的颗粒,称重,并且将分布绘制为%重量与粒径(以微米单位)的图。
[0137]
实施例8
[0138]
可以将用干热灭菌处理的混合型过敏原产品样品的蛋白质完整性与未接受干热
灭菌应用的松散状混合型过敏原材料比较。可以通过sds
‑
page解析未经灭菌和经干热灭菌的样品中存在的所有蛋白质来评估蛋白质完整性。
[0139]
可以将1毫克松散状混合型过敏原材料或经干热灭菌的混合型过敏原产品称入2毫升微管中。基于它们评估的蛋白质浓度,可以用包含5%2
‑
巯基乙醇(biorad,hercules,加利福尼亚州)的laemmli缓冲液将样品稀释至1毫克/毫升的蛋白质浓度。蛋白质混悬液可以通过轻轻倒置或间歇涡旋混合5分钟进行混合,然后加热至95℃至100℃5分钟。可以以1,000rpm离心样品1分钟,然后可以在浸入1x sds
‑
page运行缓冲液(biorad,hercules,加利福尼亚州)的4
‑
20%聚丙烯酰胺梯度凝胶(biorad,hercules,加利福尼亚州)上装载每孔10微升每种样品,一式三份。凝胶可以在100v下运行80
‑
90分钟(或200v运行30
‑
40分钟)。然后可以在室温下在定轨振荡器上用蒸馏水洗涤凝胶3次,每次洗涤5分钟。凝胶可以在固定液(sigma
‑
aldrich,st.louis,密苏里州)或50%甲醇、10%醋酸中固定15分钟。凝胶可以用ex blue凝胶染色试剂(sigma
‑
aldrich,st.louis,密苏里州)染色2小时或过夜,然后通过在蒸馏水中洗涤1
‑
2小时或过夜来脱去染色。洗涤完成时,可以用透明塑料覆盖凝胶并使用凝胶读数器对其扫描。可以使用imagej公共领域软件(nih,bethesda,马里兰州)分析蛋白质带密度测定。
[0140]
实施例9
[0141]
可以将用干热灭菌处理的混合型过敏原产品样品的视觉和感官特征与未接受干热灭菌应用的散装混合型过敏原材料比较。也可以进行经干热灭菌的混合型过敏原产品和未经灭菌的松散状混合型过敏原的味道特性的比较。
[0142]
参考文献的并入
[0143]
出于所有目的本说明书中提及的所有出版物和专利通过引用以其全部内容并入本说明书中。在存在冲突的情况下,以本技术(包括本技术中的任何定义)为准。
[0144]
等效方案
[0145]
尽管已经讨论了本发明的特定实施方案,但上述说明为示例性的而非限制性的。在阅读本说明书后,本发明的许多变化对于本领域技术人员而言将变得显而易见。本发明的全部范围应当通过参考权利要求及其等效方案的全部范围和本说明书以及这些变化来确定。
[0146]
除非另有显示,否则在本说明书和权利要求中使用的所有表示成分、反应条件等的量的数值应理解为在所有情况下都被术语“约”修饰。因此,除非有相反的指示,否则本说明书和所附权利要求中阐述的数值参数为近似值,其可以根据本发明寻求获得的期望特性的不同而变化。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。