用于卵口服免疫疗法的制剂、制备方法和用于卵变态反应的治疗
1.相关申请的交叉引用
2.本技术要求2018年12月17日提交的美国临时申请62/780,853和2018年12月17日提交的美国临时申请62/780,862的优先权权益;这些专利中的每一者的内容均全文以引用方式并入本文。
技术领域
3.本发明涉及用于卵口服免疫疗法的制剂和制备此类制剂的方法,并且涉及用于患者中的卵变态反应的口服免疫疗法治疗。
背景技术:
4.ige介导的卵变态反应是儿童期最常见的食物变态反应之一,并且可与重度速发型超敏反应(诸如危及生命的过敏症)相关联。估计西方国家的卵变态反应发病率为约0.5%至2.5%。虽然大多数儿童通常随时间推移而发展出卵变态反应,但纵向研究表明这种情况可能直到生命的第二个十年才发生,其中在年龄为18岁的个体中,大约20%的个体中会持续存在卵变态反应。
5.临床上识别出两种主要的卵变态反应表型:(1)对生卵清和烘焙全卵两者的变态反应,以及(2)只对生卵清的变态反应。约20%至30%的卵变态反应个体对生卵清和烘焙全卵两者是变应性的,70%至80%的卵变态反应个体只对生卵清是变应性的。
6.目前用于管理卵变态反应的护理标准是卵的饮食避免和培训患者/家人识别和管理变态反应症状以及急救药物(例如,肾上腺素自动注射器(eai))的大致使用。然而,对于卵变态反应患者来说避免卵是特别困难的,因为卵作为许多食物产品中的成分无所不在,并且其作为儿童期营养物质也是非常重要的。回避的负担和对意外暴露的持续恐惧可不利地影响患有卵变态反应的个体及其家人的健康相关生活质量。使医疗需求复杂化的是,日常携带和紧急使用用于治疗过敏症的eai被认为是不充分的,这可能导致不良后果,包括住院和死亡。
7.通常认为,基于已估计群体阈值的研究,摄入仅毫克量的卵蛋白质可触发变应性反应。虽然在整个卵变态反应群体中,触发变应性反应的阈值水平变化很大,但估计ed10(预计在10%的具有特定食物变态反应的个体中诱发反应的引发剂量)在3.7mg至5.8mg卵蛋白质范围内。因此,对卵的意外变应性反应是常见的。
8.目前可用的疗法被设计成当发生变态反应时仅治疗变应性反应的症状。因此,在没有治愈的情况下,具有降低意外暴露事件中重度变应性反应风险的潜力的疗法代表了一种迫切未满足的医疗需求。然而,开发用于通过口服免疫疗法递送卵变应原的仔细校准的剂型仍然是一个挑战,特别是对于较低剂量形式。对于较低的剂量,控制口服免疫治疗剂量中的变应原性材料对于限制与该疗法有关的不良事件是特别重要的。因此,批量制备过程,尤其是对于制备低剂量时,应在整个混合产品中具有足够的均匀度,以确保在包装产品中
具有充分的剂量均匀度。
9.近年来,已研究了用于卵变态反应的口服免疫疗法(oit),其包括将变应原性蛋白质以递增的剂量向患者口服施用以获得脱敏状态。然而,期望进一步改善治疗的安全性和/或功效。
技术实现要素:
10.本文描述了卵清蛋白质制剂、包含卵清蛋白质制剂的剂型、以及制备此类卵清蛋白质制剂和剂型的方法。
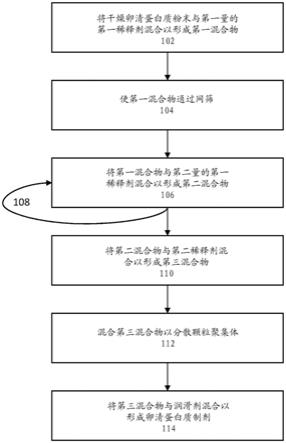
11.在一些实施方案中,制备卵清蛋白质制剂的方法包括:(a)将干燥卵清蛋白质粉末与第一量的第一稀释剂混合以形成第一混合物;(b)使所述第一混合物通过网筛;(c)在步骤(a)和(b)之后,将所述第一混合物与第二量的所述第一稀释剂混合以形成第二混合物;(d)将所述第二混合物与第二稀释剂混合以形成第三混合物;(e)将所述第三混合物以比步骤(c)中用于混合的剪切力更高的剪切力混合;以及(f)将第三混合物与润滑剂混合以形成卵清蛋白质制剂。在一些实施方案中,卵清蛋白质制剂具有约0.05重量%至约2.5重量%的卵清蛋白质。在一些实施方案中,卵清蛋白质制剂具有约0.1重量%至约0.7重量%的卵清蛋白质。在一些实施方案中,步骤(b)包括使至少部分的第二量的第一稀释剂与第一混合物通过网筛。在一些实施方案中,步骤(b)包括使第二量的第一稀释剂与第一混合物通过网筛。在一些实施方案中,步骤(c)包括多个子步骤,其中每个子步骤包括(i)将部分的第二量的第一稀释剂添加到第一混合物中,以及(ii)将该部分的第二量的第一稀释剂与第一混合物混合。在一些实施方案中,步骤(c)包括三个或更多个子步骤。在一些实施方案中,步骤(c)包括在将第二量的第一稀释剂添加到第一混合物中时连续混合第一混合物和第二量的第一稀释剂。在一些实施方案中,将第一混合物与第二量的第一稀释剂在转鼓式共混机中混合。在一些实施方案中,将第二混合物与第二稀释剂在转鼓式共混机中混合。在一些实施方案中,使用锥式磨机混合第三混合物。在一些实施方案中,将第三混合物与润滑剂在转鼓式共混机中混合。在一些实施方案中,将第三量的第一稀释剂与第三混合物混合。在一些实施方案中,将第三量的第一稀释剂和润滑剂与第三混合物共混合。在一些实施方案中,步骤(f)包括(i)使第三混合物和润滑剂一起通过网筛,以及(ii)将第三混合物和润滑剂混合以形成卵清蛋白质制剂。在一些实施方案中,卵清蛋白质制剂基本上不含胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂具有约40重量%至约70重量%的第一稀释剂。在一些实施方案中,卵清蛋白质制剂具有约30重量%至约50重量%的第二稀释剂。在一些实施方案中,卵清蛋白质制剂具有约0.1重量%至约2重量%的润滑剂。
12.在一些实施方案中,制备卵清蛋白质制剂的方法包括(a)将干燥卵清蛋白质粉末与第一量的第一稀释剂混合以形成第一混合物;(b)将第二量的所述第一稀释剂与所述第一混合物混合以形成第二混合物;(c)将所述第二混合物与第二稀释剂混合以形成第三混合物;(d)将所述第三混合物以比步骤(b)中用于混合的剪切力更高的剪切力混合;以及(e)将所述第三混合物与润滑剂混合以形成所述卵清蛋白质制剂。在一些实施方案中,在步骤(a)中以比步骤(b)中用于混合的剪切力更高的剪切力将干燥卵清蛋白质粉末与第一量的第一稀释剂混合。在一些实施方案中,卵清蛋白质制剂具有约1重量%至约70重量%的卵清蛋白质。在一些实施方案中,在步骤(a)中使用锥式磨机将干燥卵清蛋白质粉末与第一量的
第一稀释剂混合。在一些实施方案中,步骤(b)包括两个混合子步骤,其中一个混合子步骤处于比另一个混合子步骤更高的剪切力。在一些实施方案中,步骤(c)包括在与第二稀释剂混合以形成第三混合物之前,将第二混合物与另外量的第一稀释剂混合。在一些实施方案中,步骤(c)还包括将第二混合物与另外量的第一稀释剂和第二稀释剂共混合以形成第三混合物。在一些实施方案中,在步骤(d)中使用锥式磨机混合第三混合物。在一些实施方案中,将第二量的第一稀释剂和第一混合物在转鼓式共混机中混合。在一些实施方案中,将第二混合物与第二稀释剂在转鼓式共混机中混合。在一些实施方案中,将第三量的第一稀释剂与第三混合物混合。在一些实施方案中,将第三量的第一稀释剂和润滑剂与第三混合物共混合。在一些实施方案中,步骤(e)包括(i)将部分的第三混合物与润滑剂混合;(ii)使(i)的所述混合物通过网筛;以及(iii)将(ii)的所述混合物与另外部分的所述第三混合物混合以形成所述卵清蛋白质制剂。在一些实施方案中,将第三混合物与润滑剂在转鼓式共混机中混合。在一些实施方案中,卵清蛋白质制剂具有约9重量%至约85重量%的第一稀释剂。在一些实施方案中,卵清蛋白质制剂具有约10重量%至约50重量%的第二稀释剂。在一些实施方案中,卵清蛋白质制剂具有约10重量%至约20重量%的第二稀释剂。在一些实施方案中,卵清蛋白质制剂具有约0.1重量%至约2重量%的润滑剂。在一些实施方案中,卵清蛋白质制剂包含助流剂。在一些实施方案中,在步骤(a)期间或之前,将助流剂与卵清蛋白质粉末和第一量的第一稀释剂混合。在一些实施方案中,助流剂为胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂具有约2重量%至约70重量%的卵清蛋白质。在一些实施方案中,卵清蛋白质制剂基本上不含胶态二氧化硅,并且可包含约1重量%至约5重量%的卵清蛋白质。
13.在另一个实施方案中,制备卵清蛋白质制剂的方法包括:(a)将干燥卵清蛋白质粉末、第一稀释剂和助流剂混合以形成第一混合物;(b)以比步骤(a)中用于混合的剪切力更高的剪切力将第二稀释剂与第一混合物混合以形成第二混合物;(c)将第二混合物与润滑剂混合以形成卵清蛋白质制剂。在一些实施方案中,卵清蛋白质制剂具有约50重量%至约80重量%的卵清蛋白质。在一些实施方案中,将干燥卵清蛋白质粉末、第一稀释剂和助流剂在转鼓式共混机中混合。在一些实施方案中,在步骤(b)中使用锥式磨机将第二稀释剂和第一混合物混合。在一些实施方案中,将第二混合物和润滑剂在转鼓式共混机中混合。在一些实施方案中,将第二量的第一稀释剂与第二混合物混合。在一些实施方案中,将第二量的第一稀释剂和润滑剂与第二混合物共混合。在一些实施方案中,助流剂包括胶态二氧化硅。在一些实施方案中,步骤(c)包括(i)将部分的第二混合物与润滑剂混合;(ii)使所述部分的所述第二混合物和所述润滑剂通过网筛;以及(iii)将(ii)的混合物与另外部分的第二混合物的混合以形成卵清蛋白质制剂。
14.在上述方法的一些实施方案中,卵清蛋白质制剂以约5kg或更大的批次大小制备。在一些实施方案中,卵清蛋白质制剂以约5kg至约50kg的批次大小制备。
15.在上述方法的一些实施方案中,该方法还包括测定卵清蛋白质制剂的卵清蛋白质共混物均匀度。在一些实施方案中,卵清蛋白质制剂具有约15%或更小的卵清蛋白质共混物均匀度相对标准偏差(rsd)。
16.在上述方法的一些实施方案中,该方法还包括将卵清蛋白质制剂包装在多个剂量容器中。在一些实施方案中,剂量容器为胶囊或小袋。在一些实施方案中,该方法还包括测
定该多个剂量容器的卵清蛋白质含量均匀度。在一些实施方案中,该多个剂量容器的卵清蛋白质含量均匀度相对标准偏差(rds)为约15%或更小。
17.在上述方法的一些实施方案中,第一稀释剂为预先胶凝化的淀粉。
18.在上述方法的一些实施方案中,第二稀释剂为微晶纤维素。
19.在上述方法的一些实施方案中,润滑剂为硬脂酸镁。
20.在上述方法的一些实施方案中,干燥卵清蛋白质粉末包含约50重量%至约90重量%的卵清蛋白质。
21.在上述方法的一些实施方案中,形成干燥卵清蛋白质粉末包括喷雾干燥液体卵清。
22.在上述方法的一些实施方案中,卵清蛋白质粉末已去除葡萄糖。
23.在上述方法的一些实施方案中,干燥卵清粉末已经过巴氏灭菌。
24.在上述方法的一些实施方案中,干燥卵清蛋白质粉末来源于鸡蛋。
25.在上述方法的一些实施方案中,该方法还包括表征干燥卵清蛋白质粉末中的类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶。
26.在上述方法的一些实施方案中,该方法还包括表征卵清蛋白质制剂中的类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶。
27.在一些实施方案中,表征类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶包括获得高效液相色谱(hplc)图谱。在一些实施方案中,hplc图谱为反相hplc(rp
‑
hplc)图谱。在一些实施方案中,hplc图谱是为尺寸排阻色谱hplc(sec
‑
hplc)图谱。在一些实施方案中,该方法包括将所获得的hplc图谱与参考hplc图谱进行比较。
28.在一些实施方案中,表征类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶包括对类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶的量进行定量。在一些实施方案中,对类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶的量进行定量包括测量类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶与卵清蛋白质粉末或卵清蛋白质制剂中的总蛋白质相比的量。在一些实施方案中,对类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶的量进行定量包括测量类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶与卵清蛋白质粉末或卵清蛋白质制剂中类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶的总量相比的量。
29.在一些实施方案中,表征类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶包括测量类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶在卵清蛋白质粉末或卵清蛋白质制剂中的效能。在一些实施方案中,类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶在卵清蛋白质粉末或卵清蛋白质制剂中的效能相对于类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶在参考样品中的效能进行测量。在一些实施方案中,使用免疫测定测量类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶的效能。在一些实施方案中,免疫测定包括使用特异性结合类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶的抗体。在一些实施方案中,免疫测定包括使用包含两种或更多种选自由以下项组成的组的抗体的抗体库:特异性结合类卵粘蛋白的抗体、特异性结合卵清蛋白的抗体、特异性结合卵转铁蛋白的抗体或特异性结合溶菌酶的抗体。在一些实施方案中,抗体为ige抗体或igg抗体。在一些实施方案中,使用酶联免疫吸附测定(elisa)测量类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶的效能。
30.本文还描述了根据上述方法中的任一种制备的卵清蛋白质制剂。
31.在一些实施方案中,卵清蛋白质制剂包含干燥卵清蛋白质粉末、第一稀释剂、第二稀释剂和润滑剂,其中该卵清蛋白质制剂基本上不含胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂包含约0.1重量%至约3.5重量%的卵清蛋白质。在一些实施方案中,第一稀释剂为预胶化淀粉。在一些实施方案中,第二稀释剂为微晶纤维素。在一些实施方案中,润滑剂为硬脂酸镁。在一些实施方案中,卵清蛋白质制剂基本上由卵清蛋白质粉末、第一稀释剂、第二稀释剂和润滑剂组成。
32.本文还描述了治疗患者中的卵变态反应的方法,以及在用于卵变态反应的口服免疫疗法期间调整包含卵清蛋白质的药物组合物的剂量的方法。
33.在一个实施方案中,治疗患者中的卵变态反应的方法包括根据口服免疫疗法计划表向患者口服施用多个剂量的包含卵清蛋白质的药物组合物,该口服免疫疗法计划表包括:(a)上调剂量阶段,该上调剂量阶段包括向患者口服施用一系列约1mg至约300mg卵清蛋白质的递增剂量,其中在剂量递增之前向患者施用给定剂量至少两周,并且其中该上调剂量阶段的长度为约20周至约44周;和(b)维持阶段,该维持阶段包括向患者口服施用包含卵清蛋白质的多个维持剂量,其中该维持阶段的长度为约12周或更长。
34.在一些实施方案中,患者在治疗开始时具有约7ku
a
/l或更高的卵清特异性血清ige(ew
‑
ige)水平。在一些实施方案中,患者在治疗开始时具有约5ku
a
/l或更高的卵清特异性血清ige(ew
‑
ige)水平。
35.在一些实施方案中,在上调剂量阶段期间向患者施用的一系列递增剂量包括至少1mg剂量的卵清蛋白质和300mg剂量的卵清蛋白质。在一些实施方案中,在上调剂量阶段期间向患者施用的一系列递增剂量包括至少10种不同剂量的卵清蛋白质。在一些实施方案中,在上调剂量阶段期间向患者施用的一系列递增剂量包括约1mg、约3mg、约6mg、约12mg、约20mg、约40mg、约80mg、约120mg、约160mg、约200mg、约240mg和约300mg卵清蛋白质的剂量。
36.在一些实施方案中,只有当患者耐受先前剂量时,才递增在上调剂量阶段期间施用的剂量。
37.在一些实施方案中,在上调剂量阶段期间向患者施用的最大剂量为约300mg卵清蛋白质。
38.在一些实施方案中,在维持阶段期间向患者施用的维持剂量为约300mg卵清蛋白质或更多。在一些实施方案中,在维持阶段期间向患者施用的维持剂量为约300mg卵清蛋白质。
39.在一些实施方案中,只有当患者在上调剂量阶段期间耐受向患者施用的最大剂量时,才向患者施用维持剂量。
40.在一些实施方案中,患者在维持阶段结束时耐受约600mg生卵清蛋白质的剂量。在一些实施方案中,患者在维持阶段结束时耐受约1000mg生卵清蛋白质的剂量。在一些实施方案中,患者在维持阶段结束时耐受约2000mg生卵清蛋白质的剂量。在一些实施方案中,患者在维持阶段结束时耐受约2000mg熟卵清蛋白质的累积剂量。在一些实施方案中,患者在维持阶段结束时耐受约2000mg烘焙卵清蛋白质的累积剂量。
41.在一些实施方案中,患者在治疗开始之前不能耐受约300mg生卵清蛋白质的剂量。在一些实施方案中,患者在治疗开始之前不能耐受约2000mg熟卵清蛋白质的累积剂量。在
一些实施方案中,患者在治疗开始之前耐受约2000mg烘焙卵清蛋白质的累积剂量。在一些实施方案中,患者在治疗开始之前不能耐受约2000mg烘焙卵清蛋白质的累积剂量。在一些实施方案中,患者在治疗开始之前耐受约2000mg烘焙卵清蛋白质的累积剂量。
42.在一些实施方案中,口服免疫疗法计划表包括在上调剂量阶段之前的初始递增阶段,该初始递增阶段包括在一天内向患者口服施用一系列递增剂量的约0.2mg至约2mg的卵清蛋白质,其中向患者施用任何给定剂量的单次施用,并且其中剂量间隔至少15分钟。
43.在一些实施方案中,只有当患者在治疗的第一天耐受约1.2mg生卵清蛋白质的剂量时,才根据口服免疫疗法计划表对患者进行治疗。
44.在一些实施方案中,患者在治疗开始之前为约4岁或以上。在一些实施方案中,患者在治疗开始之前为约4岁至约26岁。
45.本文还描述了在用于受试者中的卵变态反应的口服免疫疗法期间调整包含卵清蛋白质的药物组合物的剂量的方法,该口服免疫疗法包括(i)上调剂量阶段,该上调剂量阶段包括向患者口服施用一系列递增剂量的卵清蛋白质,和(ii)维持阶段,该维持阶段包括向患者口服施用包含卵清蛋白质的多个维持剂量;该方法包括:向患者口服施用第一剂量的药物组合物;以及向患者口服施用第二剂量的药物组合物,其中如果患者经历与施用第一剂量有关的不良事件,则减少、跳过第二剂量或者延迟至少部分该剂量。在一些实施方案中,如果患者经历与施用第一剂量有关的不良事件,则第二剂量被分成第一部分和第二部分,其中第一部分根据预定给药计划表施用,并且其中第二部分相对于预定给药计划表延迟。在一些实施方案中,第二部分在施用第一部分后延迟约8小时至约12小时。在一些实施方案中,如果患者经历与施用第一剂量有关的不良事件,则跳过第二剂量。在一些实施方案中,如果患者经历与施用第一剂量有关的不良事件,则第二剂量相对于第一剂量减少。在一些实施方案中,在递增药物组合物的后续剂量之前,该后续剂量相对于第一剂量减少约一周或更长时间。在一些实施方案中,在尝试递增药物组合物的后续剂量之前,该后续剂量相对于第一剂量减少约一周至约两周。在一些实施方案中,在递增药物组合物的后续剂量之前,该后续剂量相对于第一剂量减少约一周至约两周。在一些实施方案中,与施用第一剂量有关的不良事件为轻度变应原性不良事件。在一些实施方案中,与施用第一剂量有关的不良事件为中度变应原性不良事件或重度变应原性不良事件。在一些实施方案中,第一剂量和第二剂量在口服免疫疗法的上调剂量阶段期间施用于患者。在一些实施方案中,第一剂量和第二剂量在口服免疫疗法的维持阶段期间施用于患者。
46.本文还描述了在用于受试者中的卵变态反应的口服免疫疗法期间调整包含卵清蛋白质的药物组合物的剂量的方法,该口服免疫疗法包括(i)上调剂量阶段,该上调剂量阶段包括向患者口服施用一系列递增剂量的卵清蛋白质,和(ii)维持阶段,该维持阶段包括向患者口服施用包含卵清蛋白质的多个维持剂量;该方法包括:向患者口服施用第一剂量的药物组合物;以及向患者口服施用第二剂量的药物组合物,其中如果患者经历与对与施用第一剂量无关的变应原增加的敏感性相关联的并发因素,则减少或跳过第二剂量。在一些实施方案中,与对变应原增加的敏感性相关联的并发因素为特应性疾病发作、炎症、疾病或月经。在一些实施方案中,如果患者经历与对与施用第一剂量无关的变应原增加的敏感性相关联的并发因素,则跳过第二剂量。在一些实施方案中,如果患者经历与对与施用第一剂量无关的变应原增加的敏感性相关联的并发因素,则第二剂量相对于第一剂量减少。在
一些实施方案中,在递增药物组合物的后续剂量之前,该后续剂量相对于第一剂量减少约一周或更长时间。在一些实施方案中,在尝试递增药物组合物的后续剂量之前,该后续剂量相对于第一剂量减少约一周至约两周。在一些实施方案中,在递增药物组合物的后续剂量之前,该后续剂量相对于第一剂量减少约一周至约两周。在一些实施方案中,第一剂量和第二剂量在口服免疫疗法的上调剂量阶段期间施用于患者。在一些实施方案中,第一剂量和第二剂量在口服免疫疗法的维持阶段期间施用于患者。在一些实施方案中,与对变应原增加的敏感性相关联的并发因素为患者对其具有变应性的食物的非预期暴露。
47.在上述方法的一些实施方案中,药物组合物中的卵清蛋白质为生卵清蛋白质。
48.在上述方法的一些实施方案中,在施用之前将药物组合物与食物媒介物混合。
49.本文还提供了用于治疗上述卵变态反应的方法的药物组合物,其中该药物组合物包含根据前述制备卵清蛋白质制剂的方法制备的卵清蛋白质制剂。
50.本文还提供了用于制备用于根据上述治疗卵变态反应的方法治疗患者中的卵变态反应的方法的药物的药物组合物,其中该药物组合物包含根据前述制备卵清蛋白质制剂的方法制备的卵清蛋白质制剂。
附图说明
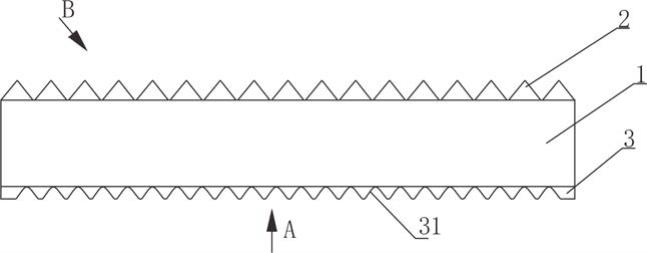
51.图1示出了制备卵清蛋白质制剂的示例性方法,尤其是对于较低剂量水平。
52.图2示出了制备卵清蛋白质制剂的示例性方法,尤其是对于中等剂量水平。
53.图3示出了制备卵清蛋白质制剂的示例性方法,尤其是对于较高剂量水平。
54.图4示出了用于根据与口服免疫疗法期间施用卵清蛋白质有关的不良事件的严重程度来调整剂量的示例性决策树。
55.图5示出了具有经鉴定的卵清蛋白、类卵粘蛋白、卵转铁蛋白和溶菌酶的干燥卵清蛋白质粉末的尺寸排阻色谱hplc色谱图。
56.图6示出了具有经鉴定的卵清蛋白、类卵粘蛋白、卵转铁蛋白和溶菌酶的干燥卵清蛋白质粉末的反相hplc色谱图。
57.图7示出了干燥卵清蛋白质粉末(泳道3
‑
5;约2μg蛋白质/孔)和蛋白质标准品(类卵粘蛋白、卵清蛋白、溶菌酶和卵转铁蛋白;泳道7
‑
10)的sds
‑
page凝胶。
58.图8示出了被染色以鉴定卵清蛋白、类卵粘蛋白、卵转铁蛋白和溶菌酶的干燥卵清蛋白质粉末(泳道3
‑
5)和蛋白质标准品(类卵粘蛋白、卵清蛋白、溶菌酶和卵转铁蛋白;泳道7
‑
10)的免疫印迹。
59.图9示出了包含卵清蛋白质的药物组合物的临床研究的示意图。
60.图10示出了包含卵清蛋白质的药物组合物的临床研究的示意图。
61.图11示出了使用改进的rp
‑
hplc方法的干燥卵清蛋白质粉末的反相hplc色谱图,其中鉴定出类卵粘蛋白、溶菌酶、卵转铁蛋白和卵清蛋白的相对保留时间峰。
62.图12a示出了制备卵清蛋白质制剂的示例性方法,尤其是对于较低剂量水平。
63.图12b示出了制备卵清蛋白质制剂的另一种示例性方法,尤其是对于较低剂量水平。
64.图12c示出了制备卵清蛋白质制剂的另一种示例性方法,尤其是对于较低剂量水平。
65.图13a示出了制备卵清蛋白质制剂的示例性方法,尤其是对于中等剂量水平。
66.图13b示出了制备卵清蛋白质制剂的另一种示例性方法,尤其是对于中等剂量水平。
67.图13c示出了制备卵清蛋白质制剂的另一种示例性方法,尤其是对于中等剂量水平。
68.图14a示出了制备卵清蛋白质制剂的示例性方法,尤其是对于较高剂量水平。
69.图14b示出了制备卵清蛋白质制剂的另一种示例性方法,尤其是对于较高剂量水平。
具体实施方式
70.本文描述了卵清蛋白质制剂以及制备此类卵清蛋白质制剂的方法。卵清蛋白质制剂包含干燥卵清蛋白质粉末,连同一种或多种稀释剂、润滑剂和(在一些制剂中)助流剂,并且可用于通过口服免疫疗法治疗卵变态反应。因为高度变应性患者可能易受制剂中含有的变应原的量的微小变化的影响,所以希望仔细校准制剂中含有的卵变应原的量和质量,例如通过使用本文所述的质量控制和/或制备过程。本文所述的制备方法允许产生具有小心控制的量的卵变应原的卵清蛋白质制剂。
71.在制备卵清蛋白质制剂中的一个重大挑战是批次大小的扩大。较小的研究平台上批次中的均匀度比用于商业生产的大规模制备更容易获得。获得足够均匀的制剂共混物对于低剂量制剂是特别具有挑战性和重要的,其中食用此类剂量的患者可能对卵清变应原特别敏感。本文所述的制备方法提供了卵清蛋白质制剂制备的扩大,包括大于5千克的批次。
72.在制备卵清蛋白质制剂的一些方法中,该方法包括(a)将干燥卵清蛋白质粉末与第一量的第一稀释剂混合以形成第一混合物;(b)使所述第一混合物通过网筛;(c)在步骤(a)和(b)之后,将所述第一混合物与第二量的所述第一稀释剂混合以形成第二混合物;(d)将所述第二混合物与第二稀释剂混合以形成第三混合物;(e)将所述第三混合物以比步骤(c)中用于混合的剪切力更高的剪切力混合;以及(f)将第三混合物与润滑剂混合以形成卵清蛋白质制剂。在步骤(e)中,将第三混合物混合以解离颗粒附聚物。步骤(c)可在多个子步骤中进行,以用第二量的第一稀释剂的两个或更多个不同部分系列稀释混合物。这种制备制剂的方法对于用于制备含有该制剂的较低剂量剂量容器(诸如约0.1mg至约12mg的剂量)的制剂特别有用。该制剂可具有例如约0.05重量%至约2.5重量%的卵清蛋白质。较低剂量制剂中不需要包含助流剂(例如,胶态二氧化硅)。
73.在制备卵清蛋白质制剂的一些方法中,该方法包括(a)将干燥卵清蛋白质粉末与第一量的第一稀释剂混合以形成第一混合物;(b)将第二量的所述第一稀释剂与所述第一混合物混合以形成第二混合物;(c)将所述第二混合物与第二稀释剂混合以形成第三混合物;(d)将所述第三混合物以比步骤(b)中用于混合的剪切力更高的剪切力混合;以及(e)将所述第三混合物与润滑剂混合以形成所述卵清蛋白质制剂。在步骤(d)中,将第三混合物混合以解离混合物中的颗粒附聚物。步骤(a)也可以比步骤(b)中用于混合的剪切力更高的剪切力进行,该剪切力可解离混合物中的颗粒附聚物。这种制备制剂的方法对于用于制备含有该制剂的中剂量剂量容器(诸如约3mg至约240mg的剂量)的制剂特别有用。该制剂可具有例如约1重量%至约70重量%的卵清蛋白质。
74.在制备卵清蛋白质制剂的一些方法中,该方法包括(a)将干燥卵清蛋白质粉末、第一稀释剂和助流剂混合以形成第一混合物;(b)以比步骤(a)中用于混合的剪切力更高的剪切力将第二稀释剂与第一混合物混合以形成第二混合物;(c)将第二混合物与润滑剂混合以形成卵清蛋白质制剂。进行步骤(b)中的混合,使得该混合使颗粒附聚物解离。这种制备制剂的方法对于用于制备含有该制剂的较高剂量剂量容器(诸如约200mg和更大(诸如至多600mg、或至多300mg)的剂量)的制剂特别有用。该制剂可具有例如约50重量%至约80重量%的卵清蛋白质。本文所述的卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:干燥卵清蛋白质粉末、一种或多种稀释剂(例如,两种稀释剂)和润滑剂。在一些实施方案中,卵清蛋白质制剂基本上不含助流剂或基本上不含胶态二氧化硅。任选地,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:干燥卵清蛋白质粉末、一种或多种稀释剂(例如,两种稀释剂)、润滑剂和助流剂(诸如胶态二氧化硅)。
75.卵清蛋白质制剂可被包装在剂量容器诸如胶囊或小袋中。剂量容器中卵清蛋白质的剂量取决于包装在容器中的制剂的量和制剂中卵清蛋白质的浓度。例如,剂量容器中卵清蛋白质的剂量可为0.1mg至约1000mg卵清蛋白质。
76.应小心地控制用于制备制剂的干燥卵清蛋白质粉末、所制备的卵清蛋白质制剂和所制备的包含卵清蛋白质制剂的剂量容器,以确保向待通过口服免疫疗法治疗卵变态反应的患者准确施用卵清蛋白质剂量。如本文进一步所述,可使用一种或多种方法来评估干燥卵清蛋白质粉末、卵清蛋白质制剂或剂量容器的质量。此类方法包括测量粉末或制剂的蛋白质含量、表征粉末或制剂中的一种或多种变应原性卵清蛋白质(例如,卵清蛋白、类卵粘蛋白、卵转铁蛋白和/或溶菌酶)、测定制剂的共混物均匀度、测量来自大批剂量容器的制剂的可递送量或测量大批剂量容器中的含量均匀度。
77.本文还描述了治疗患者中的卵变态反应的方法,该方法根据口服免疫疗法计划表向患者口服施用多个剂量的包含卵清蛋白质的药物组合物,该口服免疫疗法计划表包括(a)上调剂量阶段,该上调剂量阶段包括向患者口服施用一系列约1mg至约300mg卵清蛋白质的递增剂量,其中在剂量递增之前向患者施用给定剂量至少两周,并且其中该上调剂量阶段的长度为约20周至约44周;和(b)维持阶段,该维持阶段包括向患者口服施用包含卵清蛋白质的多个维持剂量,其中该维持阶段的长度为约12周或更长。
78.可响应于与施用药物组合物有关的不良事件或与对与向患者施用药物组合物无关的变应原增加的敏感性相关联的一些其他并发因素(诸如特应性疾病发作、炎症、疾病、月经或患者对其具有变应性的食物的非预期暴露)来调整(例如,通过减少剂量、跳过剂量、延迟(全部或部分)剂量施用或延迟剂量增加)向患者施用的药物组合物的剂量。
79.本文所述的口服免疫疗法(oit)治疗计划表旨在使对卵蛋白质具有变应性的患者安全地脱敏,使得患者能够通过意外暴露摄入卵蛋白质而没有中度变应原性不良事件或重度变应原性不良事件。根据个体患者的治疗结果,患者可在治疗后保持避免食用熟卵。
80.定义
81.如本文所用,单数形式“一个”、“一种”和“该”包括多个指代物,除非上下文明确地另外指明。
82.本文提及的“约”值或参数包括(并描述)涉及该值或参数本身的变化。例如,提及
“
约x”的描述包括对“x”的描述。
[0083]“不良事件”是与口服免疫疗法暂时相关联的任何不利且非预期的迹象(包括异常实验室发现)、症状或疾病、或其恶化,无论是否与口服免疫疗法有关。
[0084]“基本上由”所列材料组成的组合物包括仅占组合物至少99.95重量%的那些材料。添加剂、杂质或其他组分可占组合物的小于0.05重量%。
[0085]
术语“熟的”是指在不燃烧组合物的情况下对组合物进行热处理,这导致组合物中的一种或多种蛋白质的至少部分地改性或变性。术语“烘焙”是指在至少176℃的温度处对组合物进行至少20分钟的热处理,并且组合物没有燃烧。
[0086]
术语“脱敏”在本文中用于指由于对食物变应原的口服免疫疗法而使受试者对食物变应原的变应性反应阈值增加。对食物变应原的脱敏可使用本领域已知的方法(包括口服食物挑战)进行测试。脱敏可以是部分的,其中与治疗前相比,受试者耐受增加量的食物变应原,但仍然对更高剂量的食物变应原有反应;或者脱敏可以是完全的,其中患者耐受所有测试剂量的食物变应原。
[0087]
除非另外指明,否则术语“有效”、“功效”或“有效性”在本文中用于指疗法诱导免疫调节(诸如脱敏)或维持所需免疫状态(诸如脱敏状态)的能力。
[0088]“递增剂量”是在口服免疫疗法过程期间高于向患者施用的紧接先前剂量的向患者施用的第一剂量。
[0089]
如本文所用,“维持阶段”是指卵蛋白质口服免疫疗法的包括向患者施用卵清蛋白质(即维持剂量)并且在上调剂量阶段完成后发生的阶段。
[0090]
如本文所用,“轻度变应性不良事件”是指观察到或经历的与短暂不适相关联但不需要立即进行医疗干预(诸如住院或肾上腺素)并且基本上不干扰日常活动的oit治疗相关变应性不良事件。
[0091]
如本文所用,“中度变应性不良事件”是指观察到或经历的与足以干扰日常活动的程度的不适相关联并且可提示医疗干预和/或另外观察的oit治疗相关变应性不良事件。
[0092]
如本文所用,短语“重度变应性不良事件”是指观察到或经历的需要住院和/或施用肾上腺素或其他挽救生命的医疗干预的oit治疗相关变应性不良事件。
[0093]
术语“受试者”或“患者”在本文中同义地用于描述任何年龄的人。
[0094]
如果组合物包含小于0.005重量%的材料或不含该材料,则该组合物“基本上不含”该材料。
[0095]
当将剂量施用于患者并且被患者完全食用而没有响应于该剂量的任何中度或重度变应性不良事件时,患者“耐受”该剂量。即使观察到或经历轻度变应性不良事件,患者也被认为耐受该剂量。“最高耐受剂量”是指在口服食物挑战期间向患者施用的患者耐受而没有任何中度或重度变应性不良事件的最大剂量。“累积耐受剂量”是在口服食物挑战期间向患者施用的至多并且包括最高耐受剂量而没有任何中度或重度变应性不良事件的剂量的总和。
[0096]
术语“治疗(treat)”、“治疗(treating)”和“治疗(treatment)”在本文中同义地使用,是指向受疾病状态或病症折磨的受试者提供有益效果的任何动作,包括通过减轻、抑制、压制或消除至少一种症状来改善病症;延迟疾病进展;延迟疾病复发;抑制疾病;或者部分或完全降低对变应原的响应或反应。
[0097]“上调剂量阶段”是指口服免疫疗法的一个阶段,其特征在于一系列增加的食物变应原剂量,其以施用低于口服免疫疗法期间施用于患者的最高剂量的食物变应原剂量开始,并且在实现口服免疫疗法期间施用于患者的最高剂量时结束。
[0098]
术语“重量百分比”、“重量百分数”和“重量%”在本文中同义地使用,并且是指组合物中所列组分相对于组合物总重量的百分比。
[0099]
应当理解,本文所述的本发明的方面和变型包括“由...组成”和/或“基本上由...组成”的方面和变型。
[0100]
在提供值的范围的情况下,应当理解,该范围的上限和下限之间的每个中间值以及该所述范围中的任何其他所述值或中间值涵盖在本公开的范围内。在所述范围包括上限或下限的情况下,排除那些所包括的限值中的任一者的范围也包括在本公开中。
[0101]
应当理解,本文所述的各种实施方案的一个、一些或所有特性可被组合以形成本发明的其他实施方案。本文所用的章节标题仅用于组织目的,不应被解释为限制所述主题。
[0102]
上文关于“实施方案”所述的特征和偏好是不同的偏好,并且不仅限于该具体实施方案;在技术上可行的情况下,它们可与来自其他实施方案的特征自由组合,并且可形成特征的优选组合。提供该描述是为了使本领域的普通技术人员能够制备和使用本发明,并且是在专利申请及其要求的上下文中提供的。对所述实施方案的各种修改对于本领域的技术人员而言将是显而易见的,并且本文的一般原理可应用于其他实施方案。因此,本发明并非旨在限于所示的实施方案,而是要符合与本文所述的原理和特征一致的最广泛的范围。
[0103]
本文提及的所有出版物、专利和专利申请的公开内容均据此全文以引用方式并入。就以引用方式并入的任何参考文献与本公开冲突的程度而言,应以本公开为准。
[0104]
卵清蛋白质制剂
[0105]
本文所述的卵清蛋白质制剂包含干燥卵清(dew)蛋白质粉末,并且可用一种或多种赋形剂配制。通常,制剂包含一种或多种不同的稀释剂(优选地两种不同的稀释剂)和润滑剂。一些卵清蛋白质制剂还包含助流剂,但在某些制剂中也可省去助流剂。例如,在较低剂量制剂(例如,具有小于约2.5重量%的卵清蛋白质的制剂)中通常省去助流剂。因此,在一些制剂中,卵清蛋白质制剂基本上不含助流剂或基本上不含胶态二氧化硅。当包装在剂量容器中时,赋形剂和赋形剂的比例可根据卵清蛋白质的剂量进行选择。
[0106]
干燥卵清蛋白质粉末通常来源于家禽(优选地来源于鸡(家鸡(gallus dosticus)))卵清。干燥卵清蛋白质粉末经常被用作食物成分,尽管其可被配制成用作治疗卵变态反应的口服免疫疗法制剂。使用未配制的干燥卵清蛋白质粉末进行口服免疫疗法治疗是不可取的,因为安全治疗需要仔细的剂量施用,尤其是在较低剂量处,这在没有配制的情况下难以持续获得。干燥卵清蛋白质粉末通常具有约80%至约85%的蛋白质含量,但添加到制剂批次中的干燥卵清蛋白质粉末的量可基于干燥卵清蛋白质粉末的实际蛋白质含量进行调整,同时调整一种或多种赋形剂(诸如这些稀释剂中的一种稀释剂,诸如预胶化淀粉)的量以获得期望的剂量水平。例如,干燥卵清蛋白质粉末的蛋白质含量可在约50重量%与约90重量%(诸如约70重量%至约90重量%、约75重量%至约90重量%、或约70重量%至约85重量%)之间。干燥卵清蛋白质粉末的剩余重量可包括少量脂肪、碳水化合物、维生素、矿物质、或天然存在于卵清中的其他组分。干燥卵清蛋白质粉末还可包含残余的水。
[0107]
干燥卵清蛋白质粉末一般通过对干燥卵清进行喷雾干燥而来源于液体卵清。优选
地,对干燥卵清蛋白质粉末进行巴氏灭菌或灭菌(例如,通过照射),但应注意使得变应原性蛋白质在制备过程期间不变性。虽然预计喷雾干燥和巴氏灭菌不会使蛋白质变性,但可使用质量控制过程(诸如测定一种或多种变应原性蛋白质诸如卵清蛋白、卵转铁蛋白、类卵粘蛋白和/或溶菌酶的效能或相对效能)来评估干燥卵清蛋白质粉末和/或所制备的卵清蛋白质制剂。也可使用聚丙烯酰胺凝胶电泳(page)(例如sds
‑
page)或免疫印迹来检测溶菌酶或卵转铁蛋白的降解,当降解时,溶菌酶或卵转铁蛋白从凝胶中消失或褪色。
[0108]
可通过从破碎的蛋中分离液体卵清和卵黄来制备干燥卵清蛋白质粉末。如果需要,可使用本领域已知的合适的酸或碱来调整卵清的ph。葡萄糖可从液体卵清中去除,这可减少可通过美拉德反应发生的干燥卵清蛋白质粉末的褐变。可例如通过向液体卵清中添加葡萄糖氧化酶、过氧化氢酶和过氧化氢溶液或通过发酵(例如,通过向卵清中添加酵母)来去除葡萄糖。
[0109]
为了干燥液体卵清,可使液体卵清通过喷雾干燥器。液体卵清通过喷雾干燥器喷嘴雾化到室中,并使用热空气流进行干燥。设定热的量和暴露时间以将液体卵清干燥成粉末,但不使卵清内的变应原性蛋白质(例如溶菌酶、卵清蛋白、类卵粘蛋白和卵转铁蛋白)变性。
[0110]
可在干燥过程后对干燥卵清蛋白质粉末进行巴氏灭菌。巴氏灭菌杀灭有害细菌诸如沙门氏菌(salmonella),但不使干燥卵清蛋白质粉末中的变应原性蛋白质变性。为了对干燥卵清蛋白质粉末进行巴氏灭菌,可将该粉末在约50℃至约60℃处(并且优选地在约54℃至约60℃处)保持约7天或更长。巴氏灭菌过程可持续至少直到干燥卵清粉末对活的沙门氏菌属和/或大肠杆菌(e.coli)呈阴性(它们中的任一者均可例如通过差异培养或其他合适的方式来评估)。
[0111]
干燥卵清蛋白质粉末可包括在粉末加工过程期间添加的材料,诸如葡萄糖氧化酶、过氧化氢酶、过氧化氢、用于调整ph的酸或碱、或用于组分(例如,盐、缓冲剂、稳定剂等)中的任一者的媒介物。然而,这些添加剂相对较少,并且通常优选的是,在制备卵清蛋白质制剂之前,干燥卵清蛋白质粉末基本上不含添加剂,其中将制剂赋形剂与干燥卵清蛋白质粉末混合。
[0112]
由于卵清蛋白质制剂是通过组合和共混粉末制备的,因此干燥卵清蛋白质粉末的粒度被鉴定为可能影响批量生产的制剂的共混物均匀度和/或剂量容器的批次的含量均匀度的潜在因素,尤其是在最低剂量强度处。粉末粒度可影响共混过程、颗粒对载体赋形剂或加工设备表面的粘附性、或共混过程后的离析。用于本文所述制剂中的干燥卵清蛋白质粉末中的颗粒的中值粒径(d
50
)通常为约30μm至约150μm(诸如约30μm至约50μm、约50μm至约80μm、约80μm至约120μm、或约120μm至约150μm)。d
10
通常为约3μm或更高(并且小于中值粒径)。d
90
通常为约250μm或更小(并且大于中值粒径),诸如约200μm或更小、或约175μm或更小。粒度分布度量(d
50
、d
90
、d
10
)是指以累积质量(或累积体积,其等同于均匀致密颗粒的质量)或以累积数量计的参考百分位数(即第50、第90或第10)处的粒径。可使用标准激光衍射技术(例如,动态激光散射),其中颗粒悬浮在不溶解颗粒的溶剂(诸如甲醇、乙醇或其他合适的溶剂)中,或者通过筛分分析来测量粒度。
[0113]
选择包含在卵清蛋白质制剂中的赋形剂,使得该制剂能够以准确且一致含量的卵清蛋白质进行包装(例如,包装到胶囊、小袋或其他合适的包装中)。制剂的赋形剂包括一种
或多种(并且优选地两种)不同的稀释剂和润滑剂。在一些制剂中,包含助流剂。然而,在一些实施方案中,助流剂从制剂中省去。例如,在一些制剂(诸如具有小于约5重量%的卵清蛋白质的较低剂量制剂)中,卵清蛋白质制剂不含或基本上不含胶态二氧化硅。包含在制剂中的示例性稀释剂包括预胶化淀粉和微晶纤维素或它们的组合。硬脂酸镁被发现为合适的润滑剂,并且通常包含在制剂中。如果包含在制剂中,则助流剂优选地为胶态二氧化硅。
[0114]
将卵清蛋白质制剂包装到剂量容器中,并且卵清蛋白质制剂的量和制剂中卵清蛋白质的浓度决定了剂量容器中卵清蛋白质的剂量。剂量容器不是整个食用的,而是在食用之前取出内容物。卵清蛋白质制剂一旦被取出,就可与食物媒介物(诸如酸奶、燕麦片、布丁、苹果调味料或其他合适的食物媒介物)混合以帮助食用。因为剂量准确性在施用口服免疫疗法时特别重要,所以卵清蛋白质制剂应具有良好的流动特性以确保容器内容物的充分部分被取出和食用。本文所述的制剂允许容器中的卵清蛋白质制剂在食用之前充分流出容器。
[0115]
预胶化淀粉和微晶纤维素是特别有用的稀释剂,因为它们是与卵清蛋白质粉末混合的自由流动的粉末。较低卵清蛋白质剂量制剂(例如,约10mg或更少的剂量)包含的微晶纤维素的百分比高于较高剂量,因为这确保了用于包装在容器中并从容器中取出(诸如包装在胶囊中或从胶囊中取出)的卵清蛋白质制剂的良好流动性和堆积密度。例如,较低剂量(例如,约10mg或更少)的卵清蛋白质制剂可包含约25重量%至约60重量%(诸如约25重量%至约30重量%、约30重量%至约40重量%、约40重量%至约50重量%、或约50重量%至约60重量%)的微晶纤维素,而较高剂量(例如超过约10mg)的卵清蛋白质制剂可包含约5重量%至约25重量%(诸如约5重量%至约10重量%、约10重量%至约15重量%、约15重量%至约20重量%、或约20重量%至约25重量%)。
[0116]
硬脂酸镁被发现是防止卵清蛋白质在制备过程期间粘附到设备表面上的有用润滑剂。一般来讲,卵清蛋白质制剂包含约0.2重量%至约2重量%诸如约0.2重量%至约0.4重量%、约0.4重量%至约0.6重量%、约0.6重量%至约1重量%、约1重量%至约1.5重量%、或约1.5重量%至约2重量%的硬脂酸镁。在一些实施方案中,卵清蛋白质制剂包含约0.5重量%的硬脂酸镁。
[0117]
助流剂诸如胶态二氧化硅可被包含在较高剂量(例如,超过约6mg卵清蛋白质的剂量或超过约12mg卵清蛋白质的剂量)的卵清蛋白质制剂中。发现在较大剂量中省去助流剂导致部分的卵清蛋白质制剂残留在容器中,这将导致患者剂量不足。然而,在卵清制剂中包含助流剂允许基本上所有的卵清蛋白质制剂在倒出时可从容器递送。发现胶态二氧化硅的添加形成软的低密度附聚物。高剪切混合步骤(诸如锥式磨机)是一种被发现用于改善含有胶态二氧化硅的制剂的含量均匀度的解决方案。优选地,破坏这些低密度附聚物的高剪切混合步骤不改变任何共混物组分的初级粒度。因此,助流剂诸如胶态二氧化硅可以例如约0.2重量%至约2重量%(诸如约0.2重量%至约0.4重量%、约0.4重量%至约0.6重量%、约0.6重量%至约1重量%、约1重量%至约1.5重量%、或约1.5重量%至约2重量%)的量包含在卵清蛋白质制剂中。包含助流剂可增加较高剂量中卵清蛋白质粉末从容器的可递送性。在一些实施方案中,容器中约95重量%或更多(诸如约96重量%或更多、约97重量%或更多、约98重量%或更多、约99重量%或更多、或约99.5重量%或更多)的卵清蛋白质制剂可从容器递送。此外,卵清蛋白质制剂可从容器可靠地递送。例如,在一些实施方案中,剂量容
器选自包括多个剂量容器的批次,平均可递送的卵清蛋白质制剂为约95重量%或更多(诸如约96重量%或更多、约97重量%或更多、约98重量%或更多、约99重量%或更多、或约99.5重量%或更多)。
[0118]
对于较低剂量的卵清蛋白质制剂(例如,约6mg卵清蛋白质或更少),发现二氧化硅干扰质量控制分析,并且特别是定量蛋白质浓度。如前所讨论的,剂量容器中所包含的卵清蛋白质的量应准确,以最小化意外过量的风险,尤其是当向受试者施用低剂量时。还发现,在较高剂量量的卵清蛋白质制剂中所包含以确保从剂量容器的充分可递送性的助流剂可在以较低剂量量使用的卵清蛋白质制剂中省去,同时保持从容器的充分可递送性。在一些实施方案中,即使当卵清蛋白质制剂不含胶态二氧化硅时,包含6mg卵清蛋白质或更少(诸如在约0.1mg与约6mg之间的卵清蛋白质)的剂量容器中约95重量%或更多(诸如约96重量%或更多、约97重量%或更多、约98重量%或更多、约99重量%或更多、或约99.5重量%或更多)的卵清蛋白质制剂也可从容器递送。此外,卵清蛋白质制剂可从容器可靠地递送。例如,在一些实施方案中,剂量容器选自包括多个剂量容器的批次,平均可递送的卵清蛋白质制剂为约95重量%或更多(诸如约96重量%或更多、约97重量%或更多、约98重量%或更多、约99重量%或更多、或约99.5重量%或更多)。
[0119]
卵清蛋白质制剂剂量
[0120]
本文所述的卵清蛋白质制剂被包装在剂量容器诸如胶囊或小袋中。在口服免疫疗法的过程期间,向患有卵变态反应的患者施用不同剂量的卵清蛋白质,并且基于治疗阶段和/或卵清蛋白质的耐受性来选择剂量。简而言之,患者在上调剂量阶段(通常通过每天施用卵清蛋白质制剂,定期增加剂量(例如,每两周增加一次剂量))期间口服摄入增加量的卵清蛋白质,之后是更高剂量水平的维持阶段。本文提供了示例性口服免疫疗法给药计划表的进一步解释。对于施用,将卵清蛋白质制剂从剂量容器中取出并口服。例如,包含卵清蛋白质制剂的胶囊不是整个食用的,而是在向患者口服施用之前将卵清蛋白质制剂从胶囊中取出。优选地,在食用前将卵清蛋白质制剂与食物媒介物混合。
[0121]
包装在剂量容器中的具有给定卵清蛋白质浓度的卵清蛋白质制剂的量设定了该剂量容器中卵清蛋白质的量(即,剂量)。因此,容器的剂量取决于制剂中的卵清蛋白质浓度和添加到容器中的制剂的量。剂量容器中卵清蛋白质的预期剂量(即标签声明)可在例如约0.1mg至约600mg卵清蛋白质的范围内,或为在该范围内的任何量。以举例的方式,剂量容器的剂量(标签声明)可为0.2mg、1mg、3mg、6mg、12mg、20mg、40mg、80mg、120mg、160mg、200mg、240mg或300mg卵清蛋白质。
[0122]
容器中卵清蛋白质制剂的量受限于容器的大小,但通常在约100mg至约1000mg诸如约100mg至约250mg、约250mg至约400mg、约400mg至约600mg、或约600mg至约1000mg的范围内。以举例的方式,在一些实施方案中,容器(诸如胶囊)中包含约180mg卵清蛋白质制剂。在一些实施方案中,容器(诸如胶囊或小袋)中包含约500mg卵清蛋白质制剂。较小的容器可更适用于较小的剂量大小。例如,获得约0.1mg至约10mg(或约0.2mg至约6mg)卵清蛋白质剂量的卵清蛋白质制剂可包含在容量为约180mg的容器中(例如,胶囊大小为2)。较大剂量的卵清蛋白质制剂可包含在较大的容器大小中,例如约12mg至约300mg的剂量可包含在容量为约500mg的容器中(例如,胶囊大小为00)。示例性胶囊大小可为000、00、0、1、2或3。
[0123]
因为剂量容器本身不被摄入(容器的内容物被摄入),所以容器的材料不需要是可
食用的。然而,在容器被无意食用的情况下,具有可食用的容器是有用的。容器优选地限制内容物暴露于水分或空气中。示例性容器可为基于羟丙甲纤维素的容器(诸如胶囊)或箔衬小袋。容器应易于打开,使得容器中的卵清蛋白质制剂可从容器中流出。
[0124]
在一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约0.1重量%至约0.3重量%的干燥卵清蛋白质粉末、约50重量%至约70重量%的第一稀释剂(诸如预胶化淀粉)、约35重量%至约45重量%的第二稀释剂(诸如微晶纤维素)和约0.25重量%至约0.75重量%的润滑剂(诸如硬脂酸镁)。在一些实施方案中,卵清蛋白质制剂基本上不含助流剂或基本上不含胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂包含约0.08重量%至约0.24重量%的卵清蛋白质。卵清蛋白质制剂可以0.2mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如2号胶囊)中。剂量容器可包含约170mg至约190mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约0.15mg至约0.25mg(诸如约0.17mg至约0.23mg、约0.18mg至约0.22mg、或约0.19mg至约0.21mg)之间。
[0125]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约0.1重量%至约0.3重量%的干燥卵清蛋白质粉末、约50重量%至约70重量%的预胶化淀粉、约35重量%至约45重量%的微晶纤维素和约0.25重量%至约0.75重量%的硬脂酸镁。在一些实施方案中,卵清蛋白质制剂基本上不含助流剂或基本上不含胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂包含约0.08重量%至约0.24重量%的卵清蛋白质。卵清蛋白质制剂可以0.2mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如2号胶囊)中。剂量容器可包含约170mg至约190mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约0.15mg至约0.25mg(诸如约0.17mg至约0.23mg、约0.18mg至约0.22mg、或约0.19mg至约0.21mg)之间。
[0126]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约0.5重量%至约0.8重量%的干燥卵清蛋白质粉末、约50重量%至约70重量%的第一稀释剂(诸如预胶化淀粉)、约35重量%至约45重量%的第二稀释剂(诸如微晶纤维素)和约0.25重量%至约0.75重量%的润滑剂(诸如硬脂酸镁)。在一些实施方案中,卵清蛋白质制剂基本上不含助流剂或基本上不含胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂包含约0.4重量%至约0.64重量%的卵清蛋白质。卵清蛋白质制剂可以1mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如2号胶囊)中。剂量容器可包含约170mg至约190mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约0.75mg至约1.25mg(诸如约0.85mg至约1.15mg、约0.9mg至约1.1mg、或约0.95mg至约1.05mg)之间。
[0127]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约0.5重量%至约0.8重量%的干燥卵清蛋白质粉末、约50重量%至约70重量%的预胶化淀粉、约35重量%至约45重量%的微晶纤维素和约0.25重量%至约0.75重量%的硬脂酸镁。在一些实施方案中,卵清蛋白质制剂基本上不含助流剂或基本上不含胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂包含约0.4重量%至约0.64重量%的卵清蛋白质。卵清蛋白质制剂可以1mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如2号胶囊)中。剂量容器可包含约170mg至约190mg的制剂。因为制剂的实际
填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约0.75mg至约1.25mg(诸如约0.85mg至约1.15mg、约0.9mg至约1.1mg、或约0.95mg至约1.05mg)之间。
[0128]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约1.8重量%至约2.4重量%的干燥卵清蛋白质粉末、约50重量%至约70重量%的第一稀释剂(诸如预胶化淀粉)、约35重量%至约45重量%的第二稀释剂(诸如微晶纤维素)和约0.25重量%至约0.75重量%的润滑剂(诸如硬脂酸镁)。在一些实施方案中,卵清蛋白质制剂基本上不含助流剂或基本上不含胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂包含约1.44重量%至约1.92重量%的卵清蛋白质。卵清蛋白质制剂可以3mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如2号胶囊)中。剂量容器可包含约170mg至约190mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约2.25mg至约3.75mg(诸如约2.55mg至约3.45mg、约2.7mg至约3.3mg、或约2.85mg至约3.15mg)之间。
[0129]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约1.8重量%至约2.4重量%的干燥卵清蛋白质粉末、约50重量%至约70重量%的预胶化淀粉、约35重量%至约45重量%的微晶纤维素和约0.25重量%至约0.75重量%的硬脂酸镁。在一些实施方案中,卵清蛋白质制剂基本上不含助流剂或基本上不含胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂包含约1.44重量%至约1.92重量%的卵清蛋白质。卵清蛋白质制剂可以3mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如2号胶囊)中。剂量容器可包含约170mg至约190mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约2.25mg至约3.75mg(诸如约2.55mg至约3.45mg、约2.7mg至约3.3mg、或约2.85mg至约3.15mg)之间。
[0130]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约4重量%至约4.5重量%的干燥卵清蛋白质粉末、约45重量%至约65重量%的第一稀释剂(诸如预胶化淀粉)、约35重量%至约45重量%的第二稀释剂(诸如微晶纤维素)和约0.25重量%至约0.75重量%的润滑剂(诸如硬脂酸镁)。在一些实施方案中,卵清蛋白质制剂基本上不含助流剂或基本上不含胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂包含约1.44重量%至约1.92重量%的卵清蛋白质。卵清蛋白质制剂可以6mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如2号胶囊)中。剂量容器可包含约170mg至约190mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约4.5mg至约7.5mg(诸如约5.1mg至约6.9mg、约5.4mg至约6.6mg、约5.7mg至约6.3mg、或约5.8mg至约6.2mg)之间。
[0131]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约4重量%至约4.5重量%的干燥卵清蛋白质粉末、约45重量%至约65重量%的预胶化淀粉、约35重量%至约45重量%的微晶纤维素和约0.25重量%至约0.75重量%的硬脂酸镁。在一些实施方案中,卵清蛋白质制剂基本上不含助流剂或基本上不含胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂包含约1.44重量%至约1.92重量%的卵清蛋白质。卵清蛋白质制剂可以6mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如2号胶囊)中。剂量容器可包含约170mg至约190mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约4.5mg至约7.5mg(诸如约5.1mg至
约6.9mg、约5.4mg至约6.6mg、约5.7mg至约6.3mg、或约5.8mg至约6.2mg)之间。
[0132]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约2.5重量%至约3.5重量%的干燥卵清蛋白质粉末、约70重量%至约85重量%的第一稀释剂(诸如预胶化淀粉)、约10重量%至约20重量%的第二稀释剂(诸如微晶纤维素)、约0.25重量%至约0.75重量%的润滑剂(诸如硬脂酸镁)和约0.25重量%至约0.75重量%的助流剂(诸如胶态二氧化硅)。在一些实施方案中,卵清蛋白质制剂包含约2重量%至约2.8重量%的卵清蛋白质。卵清蛋白质制剂可以12mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如00号胶囊)中。剂量容器可包含约480mg至约520mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约9mg至约15mg(诸如约10.2mg至约13.8mg、约10.8mg至约13.2mg、约11.4mg至约12.6mg、或约11.7mg至约12.3mg)之间。
[0133]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约2.5重量%至约3.5重量%的干燥卵清蛋白质粉末、约70重量%至约85重量%的预胶化淀粉、约10重量%至约20重量%的微晶纤维素、约0.25重量%至约0.75重量%的硬脂酸镁和约0.25重量%至约0.75重量%的胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂包含约2重量%至约2.8重量%的卵清蛋白质。卵清蛋白质制剂可以12mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如00号胶囊)中。剂量容器可包含约480mg至约520mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约9mg至约15mg(诸如约10.2mg至约13.8mg、约10.8mg至约13.2mg、约11.4mg至约12.6mg、或约11.7mg至约12.3mg)之间。
[0134]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约4.5重量%至约5.5重量%的干燥卵清蛋白质粉末、约70重量%至约85重量%的第一稀释剂(诸如预胶化淀粉)、约10重量%至约20重量%的第二稀释剂(诸如微晶纤维素)、约0.25重量%至约0.75重量%的润滑剂(诸如硬脂酸镁)和约0.25重量%至约0.75重量%的助流剂(诸如胶态二氧化硅)。在一些实施方案中,卵清蛋白质制剂包含约3.6重量%至约4.4重量%的卵清蛋白质。卵清蛋白质制剂可以20mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如00号胶囊)中。剂量容器可包含约480mg至约520mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约15mg至约25mg(诸如约17mg至约23mg、约18mg至约22mg、约19mg至约21mg、或约19.5mg至约20.5mg)之间。
[0135]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约4.5重量%至约5.5重量%的干燥卵清蛋白质粉末、约70重量%至约85重量%的预胶化淀粉、约10重量%至约20重量%的微晶纤维素、约0.25重量%至约0.75重量%的硬脂酸镁和约0.25重量%至约0.75重量%的胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂包含约3.6重量%至约4.4重量%的卵清蛋白质。卵清蛋白质制剂可以20mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如00号胶囊)中。剂量容器可包含约480mg至约520mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约15mg至约25mg(诸如约17mg至约23mg、约18mg至约22mg、约19mg至约21mg、或约19.5mg至约20.5mg)之间。
[0136]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约8重量%至约12重量%的干燥卵清蛋白质粉末、约65重量%至约85重量%的第一稀释剂(诸如预胶化淀粉)、约10重量%至约20重量%的第二稀释剂(诸如微晶纤维素)、约0.25重量%至约0.75重量%的润滑剂(诸如硬脂酸镁)和约0.25重量%至约0.75重量%的助流剂(诸如胶态二氧化硅)。在一些实施方案中,卵清蛋白质制剂包含约6.4重量%至约9.6重量%的卵清蛋白质。卵清蛋白质制剂可以40mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如00号胶囊)中。剂量容器可包含约480mg至约520mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约30mg至约50mg(诸如约34mg至约46mg、约36mg至约44mg、约38mg至约42mg、或约39mg至约41mg)之间。
[0137]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约8重量%至约12重量%的干燥卵清蛋白质粉末、约65重量%至约85重量%的预胶化淀粉、约10重量%至约20重量%的微晶纤维素、约0.25重量%至约0.75重量%的硬脂酸镁和约0.25重量%至约0.75重量%的胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂包含约6.4重量%至约9.6重量%的卵清蛋白质。卵清蛋白质制剂可以40mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如00号胶囊)中。剂量容器可包含约480mg至约520mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约30mg至约50mg(诸如约34mg至约46mg、约36mg至约44mg、约38mg至约42mg、或约39mg至约41mg)之间。
[0138]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约16重量%至约24重量%的干燥卵清蛋白质粉末、约55重量%至约75重量%的第一稀释剂(诸如预胶化淀粉)、约10重量%至约20重量%的第二稀释剂(诸如微晶纤维素)、约0.25重量%至约0.75重量%的润滑剂(诸如硬脂酸镁)和约0.25重量%至约0.75重量%的助流剂(诸如胶态二氧化硅)。在一些实施方案中,卵清蛋白质制剂包含约12.8重量%至约19.2重量%的卵清蛋白质。卵清蛋白质制剂可以80mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如00号胶囊)中。剂量容器可包含约480mg至约520mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约60mg至约100mg(诸如约68mg至约92mg、约72mg至约88mg、约76mg至约84mg、或约78mg至约82mg)之间。
[0139]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约16重量%至约24重量%的干燥卵清蛋白质粉末、约55重量%至约75重量%的预胶化淀粉、约10重量%至约20重量%的微晶纤维素、约0.25重量%至约0.75重量%的硬脂酸镁和约0.25重量%至约0.75重量%的胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂包含约12.8重量%至约19.2重量%的卵清蛋白质。卵清蛋白质制剂可以80mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如00号胶囊)中。剂量容器可包含约480mg至约520mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约60mg至约100mg(诸如约68mg至约92mg、约72mg至约88mg、约76mg至约84mg、或约78mg至约82mg)之间。
[0140]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下
列物质组成:约24重量%至约36重量%的干燥卵清蛋白质粉末、约45重量%至约65重量%的第一稀释剂(诸如预胶化淀粉)、约10重量%至约20重量%的第二稀释剂(诸如微晶纤维素)、约0.25重量%至约0.75重量%的润滑剂(诸如硬脂酸镁)和约0.25重量%至约0.75重量%的助流剂(诸如胶态二氧化硅)。在一些实施方案中,卵清蛋白质制剂包含约19.2重量%至约28.8重量%的卵清蛋白质。卵清蛋白质制剂可以120mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如00号胶囊)中。剂量容器可包含约480mg至约520mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约90mg至约150mg(诸如约102mg至约138mg、约108mg至约132mg、约114mg至约126mg、或约117mg至约123mg)之间。
[0141]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约24重量%至约36重量%的干燥卵清蛋白质粉末、约45重量%至约65重量%的预胶化淀粉、约10重量%至约20重量%的微晶纤维素、约0.25重量%至约0.75重量%的硬脂酸镁和约0.25重量%至约0.75重量%的胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂包含约19.2重量%至约28.8重量%的卵清蛋白质。卵清蛋白质制剂可以120mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如00号胶囊)中。剂量容器可包含约480mg至约520mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约90mg至约150mg(诸如约102mg至约138mg、约108mg至约132mg、约114mg至约126mg、或约117mg至约123mg)之间。
[0142]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约32重量%至约38重量%的干燥卵清蛋白质粉末、约35重量%至约55重量%的第一稀释剂(诸如预胶化淀粉)、约10重量%至约20重量%的第二稀释剂(诸如微晶纤维素)、约0.25重量%至约0.75重量%的润滑剂(诸如硬脂酸镁)和约0.25重量%至约0.75重量%的助流剂(诸如胶态二氧化硅)。在一些实施方案中,卵清蛋白质制剂包含约25.6重量%至约30.4重量%的卵清蛋白质。卵清蛋白质制剂可以160mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如00号胶囊)中。剂量容器可包含约480mg至约520mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约120mg至约200mg(诸如约136mg至约184mg、约144mg至约176mg、约152mg至约168mg、或约156mg至约154mg)之间。
[0143]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约32重量%至约38重量%的干燥卵清蛋白质粉末、约35重量%至约55重量%的预胶化淀粉、约10重量%至约20重量%的微晶纤维素、约0.25重量%至约0.75重量%的硬脂酸镁和约0.25重量%至约0.75重量%的胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂包含约25.6重量%至约30.4重量%的卵清蛋白质。卵清蛋白质制剂可以160mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如00号胶囊)中。剂量容器可包含约480mg至约520mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约120mg至约200mg(诸如约136mg至约184mg、约144mg至约176mg、约152mg至约168mg、或约156mg至约154mg)之间。
[0144]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约40重量%至约60重量%的干燥卵清蛋白质粉末、约25重量%至约45重量%
的第一稀释剂(诸如预胶化淀粉)、约10重量%至约20重量%的第二稀释剂(诸如微晶纤维素)、约0.25重量%至约0.75重量%的润滑剂(诸如硬脂酸镁)和约0.25重量%至约0.75重量%的助流剂(诸如胶态二氧化硅)。在一些实施方案中,卵清蛋白质制剂包含约32重量%至约48重量%的卵清蛋白质。卵清蛋白质制剂可以200mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如00号胶囊)中。剂量容器可包含约480mg至约520mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约150mg至约250mg(诸如约170mg至约230mg、约180mg至约220mg、约190mg至约210mg、或约195mg至约205mg)之间。
[0145]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约40重量%至约60重量%的干燥卵清蛋白质粉末、约25重量%至约45重量%的预胶化淀粉、约10重量%至约20重量%的微晶纤维素、约0.25重量%至约0.75重量%的硬脂酸镁和约0.25重量%至约0.75重量%的胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂包含约32重量%至约48重量%的卵清蛋白质。卵清蛋白质制剂可以200mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如00号胶囊)中。剂量容器可包含约480mg至约520mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约150mg至约250mg(诸如约170mg至约230mg、约180mg至约220mg、约190mg至约210mg、或约195mg至约205mg)之间。
[0146]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约50重量%至约70重量%的干燥卵清蛋白质粉末、约15重量%至约35重量%的第一稀释剂(诸如预胶化淀粉)、约10重量%至约20重量%的第二稀释剂(诸如微晶纤维素)、约0.25重量%至约0.75重量%的润滑剂(诸如硬脂酸镁)和约0.25重量%至约0.75重量%的助流剂(诸如胶态二氧化硅)。在一些实施方案中,卵清蛋白质制剂包含约40重量%至约56重量%的卵清蛋白质。卵清蛋白质制剂可以240mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如00号胶囊)中。剂量容器可包含约480mg至约520mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约180mg至约300mg(诸如约204mg至约276mg、约216mg至约264mg、约228mg至约252mg、或约234mg至约246mg)之间。
[0147]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约50重量%至约70重量%的干燥卵清蛋白质粉末、约15重量%至约35重量%的预胶化淀粉、约10重量%至约20重量%的微晶纤维素、约0.25重量%至约0.75重量%的硬脂酸镁和约0.25重量%至约0.75重量%的胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂包含约40重量%至约56重量%的卵清蛋白质。卵清蛋白质制剂可以240mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如00号胶囊)中。剂量容器可包含约480mg至约520mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约180mg至约300mg(诸如约204mg至约276mg、约216mg至约264mg、约228mg至约252mg、或约234mg至约246mg)之间。
[0148]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约60重量%至约85重量%的干燥卵清蛋白质粉末、约5重量%至约25重量%的第一稀释剂(诸如预胶化淀粉)、约10重量%至约20重量%的第二稀释剂(诸如微晶纤维
素)、约0.25重量%至约0.75重量%的润滑剂(诸如硬脂酸镁)和约0.25重量%至约0.75重量%的助流剂(诸如胶态二氧化硅)。在一些实施方案中,卵清蛋白质制剂包含约48重量%至约68重量%的卵清蛋白质。卵清蛋白质制剂可以300mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如00号胶囊)中。剂量容器可包含约480mg至约520mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约225mg至约375mg(诸如约255mg至约345mg、约270mg至约330mg、约285mg至约315mg、或约292mg至约308mg)之间。
[0149]
在另一个示例中,卵清蛋白质制剂包含下列物质、基本上由下列物质组成、或由下列物质组成:约60重量%至约85重量%的干燥卵清蛋白质粉末、约5重量%至约25重量%的预胶化淀粉、约10重量%至约20重量%的微晶纤维素、约0.25重量%至约0.75重量%的硬脂酸镁和约0.25重量%至约0.75重量%的胶态二氧化硅。在一些实施方案中,卵清蛋白质制剂包含约48重量%至约68重量%的卵清蛋白质。卵清蛋白质制剂可以300mg的预期卵清蛋白质剂量(即,标签声明)被包装在剂量容器(诸如胶囊,例如00号胶囊)中。剂量容器可包含约480mg至约520mg的制剂。因为制剂的实际填充量可变化,所以剂量容器中卵清蛋白质的实际剂量可在约225mg至约375mg(诸如约255mg至约345mg、约270mg至约330mg、约285mg至约315mg、或约292mg至约308mg)之间。
[0150]
在一个方面,卵清蛋白质制剂包含主要的卵清变应原gal d 1、gal d 2、gal d 3和gal d 4。每种单独变应原的量可表示为卵清蛋白质制剂中总蛋白质的百分比。在一个示例中,具有300mg标签声明的卵清蛋白质制剂的剂量包含约300mg卵清蛋白质和78%gal d 2,这意味着该剂量包含约234mg的gal d 2。在本领域中应当理解,卵清蛋白质可为高度糖基化的。因此,卵清变应原的质量意指分离出的蛋白质的质量,其可能包括相当一部分碳水化合物。确保卵清蛋白质制剂具有一致且已知量的主要卵清变应原对于确保该组合物适用于卵变态反应的口服免疫疗法是重要的。
[0151]
在一些实施方案中,与总卵清蛋白质质量相比,卵清蛋白质制剂包含在约5%与约20%之间的gal d 1,诸如约5%至约10%、约10%至约15%、约15%至约20%、约5%至约15%或约10%至约20%的gal d 1中的任一者。
[0152]
在一些实施方案中,与总卵清蛋白质质量相比,卵清蛋白质制剂包含在约45%至约90%之间的gal d 2,诸如约45%至约50%、约50%至约60%、约60%至约70%、约70%至约80%、约80%至约90%、约45%至约60%、约60%至约80%或约70%至约90%的gal d 2中的任一者。
[0153]
在一些实施方案中,与总卵清蛋白质质量相比,卵清蛋白质制剂包含在约1%与约20%之间的gal d 3,诸如约1%至约5%、约5%至约10%、约10%至约15%、约15%至约20%、约5%至约15%的gal d 3中的任一者。
[0154]
在一些实施方案中,与总卵清蛋白质质量相比,卵清蛋白质制剂包含在约0.1%与约10%之间的gal d 4,诸如约0.1%至约3%、约3%至约6%、约6%至约9%、约7%至约10%之间的gal d 4中的任一者。
[0155]
制备卵清蛋白质制剂的方法
[0156]
制备卵清蛋白质制剂的方法可影响所制备的大批制剂的批次均匀度、剂量容器批次的含量均匀度或卵清蛋白质制剂从容器的可递送性。因为口服免疫疗法过程期间施用的
卵清蛋白质的剂量可具有宽范围(例如,约0.2mg至约300mg),并且剂量一致性对于减少与治疗有关的不良反应是重要的,所以用于不同剂量的制剂制备方法被设计成生产具有一致剂量的剂量容器。
[0157]
为了产生一致的剂量,制备制剂的具体方法可在剂量之间不同。优化共混物均匀度和含量均匀度的工艺开发努力集中在较低剂量(例如,小于约3mg的剂量)上,并且确保充分的制剂流动性的工艺开发努力集中在较高剂量(例如,约300mg)上。还开发了用于中等剂量强度以充分平衡最终产品的期望特性的方法。
[0158]
本文所述的方法还克服了随制备过程的扩大而带来的挑战。确保具有较大制剂量的批次均匀度可能是具有挑战性的,并且本文所述的方法克服了这些挑战。即使当制备约5kg或更多(诸如约5kg至约100kg,例如约5kg至约7kg、约7kg至约10kg、约10kg至约15kg、约15kg至约25kg、约25kg至约50kg或约50kg至约100kg)的卵清蛋白质制剂批量时,也可使用该制备方法。
[0159]
在制备过程期间使用诸如混合(例如使用转鼓式共混机或锥式磨机)、使一种或多种粉末或混合物通过网筛和/或当将稀释剂添加到混合物中时进行系列稀释的制备步骤。所用的具体步骤可取决于制剂中的卵清蛋白质浓度或剂型的标签声明(即,剂型的卵清蛋白质制剂的预期量)。一般来讲,将一个或多个较高剪切力的混合步骤(相对于制备过程中的其他步骤较高的剪切力)结合到制备过程序列中以将干燥卵清蛋白质粉末均匀地分散到混合物中。较高的剪切力混合还分散了胶态二氧化硅的软低密度附聚物(如果存在于制剂中),这通常在胶态二氧化硅原料中观察到。使用较高的力混合并不旨在减小任何混合物组分的初级粒度。
[0160]
在已制备制剂后,可评估制剂中一种或多种变应原性卵清蛋白质(例如卵清蛋白、类卵粘蛋白、卵转铁蛋白和/或溶菌酶)的质量和/或制剂的共混物均匀度。一种或多种变应原性蛋白质的质量可例如通过表征卵清蛋白、类卵粘蛋白、卵转铁蛋白和/或溶菌酶中的一种或多种来评估(例如,通过测定一种或多种蛋白质的量或相对量、或一种或多种蛋白质的效能或相对效能)。制剂的共混物均匀度可通过测定制剂的蛋白质含量来评估,可将其与制剂的预期蛋白质含量(例如,标签声明或预期浓度)进行比较。例如,测定制剂的共混物均匀度可包括鉴定与制剂相关联的预期蛋白质含量、测量来自制剂的样品中的蛋白质含量以及将测得的蛋白质含量与预期的蛋白质含量进行比较。可使用来自制剂的多个样品(例如,2、3、4、5、6、7、8、9、10或更多个样品)来测量共混物均匀度,并且可测量平均共混物均匀度和/或相对标准偏差(rsd)。通过使用本文所述的制备方法,来自卵清蛋白质制剂的多个样品的共混物均匀度rsd为约15%或更小(例如,约0.5%至约15%、或约1%至约10%、或约5%或更小(例如,约1%至约5%、或约2%至约5%)。
[0161]
所制备的制剂可以预定量包装在剂量容器诸如胶囊或小袋中。添加到每个剂量容器中的制剂的量旨在提供等于剂量容器的标签声明的卵清蛋白质的量。由于在制备和包装期间发生的真实世界的变化,可能存在与标签声明和单个剂量容器中卵清蛋白质的实际量的一些偏差。因此,可测量所制备的大批剂量容器的含量均匀度。含量均匀度基于来自剂量容器的制剂的可递送蛋白质含量。剂量容器与剂量容器中预期量的卵清蛋白质相关联。因此,测定多个剂量容器的含量均匀度可包括鉴定与该多个剂量容器相关联的预期蛋白质含量、测量从该多个剂量容器取出的样品(例如,1、2、3、4、5、6、7、8、9、10或更多个剂量容器)
的可输送蛋白质含量以及将测得的蛋白质含量与预期的蛋白质含量进行比较。当从多个剂量容器中取出多个样品时,可测定平均含量均匀度和/或含量均匀度rsd。通过使用本文所述的制备方法,多个剂量容器的含量均匀度rsd为约12%或更小(例如,约4%至约12%、或约5%至约12%)。
[0162]
低剂量制备方法
[0163]
通常认为共混物均匀度和含量均匀度处于对应于共混物中低百分比的药物物质的低剂量强度的更大风险。剂量容器中的这些较低剂量通常为约12mg卵清蛋白质或更少,但可使用类似的方法产生更大的剂量。制剂制备方法通常产生具有约0.05重量%至约4重量%的卵清蛋白质(诸如在约0.1重量%至约0.7重量%、约0.7重量%至约1.5重量%、约1.5重量%至约2.5重量%、或约2.5重量%至约4重量%之间的卵清蛋白质)的制剂。
[0164]
所制备的卵清蛋白质制剂通常包含两种稀释剂(例如预胶化淀粉和微晶纤维素)。将一种或多种稀释剂以逐步的方式与卵清蛋白质粉末混合(即,卵清蛋白质粉末的系列稀释),其中在将另外量的稀释剂添加到混合物之前,将卵清蛋白质粉末和部分的稀释剂(但不是全部)混合。在进一步系列稀释之前,使包含卵清蛋白质粉末和稀释剂的第一部分的第一混合物通过网筛,增强了完全制备的卵清蛋白质制剂的共混物均匀度。
[0165]
如图1所示,在步骤102处将干燥卵清蛋白质粉末与第一量的第一稀释剂(例如,预胶化淀粉)混合。可将干燥卵清蛋白质粉末和第一量的第一稀释剂添加到任何合适的容器诸如料格或袋中,并且可在进行下一步之前混合在一起。混合可例如通过摇动容器、或通过使用叶轮、共混机(诸如转鼓式共混机)或任何其他合适的装置来进行。
[0166]
一旦将干燥卵清蛋白质粉末与第一量的第一稀释剂混合以形成第一混合物,就使第一混合物通过网筛(参见图1的步骤104)。网筛的尺寸通常为约250μm至约850μm(诸如约300μm至约710μm、或约425μm至约600μm)。网筛的尺寸是指网筛中开口的平均尺寸。
[0167]
一旦第一混合物已通过网筛,可通过将第一混合物与另外量的第一稀释剂混合来进一步稀释该混合物,以形成第二混合物,如图1的步骤106所示。另选地,可将第一混合物和部分的另外量的第一稀释剂通过对应于图1的步骤104的网筛共筛分。可通过摇动组合的组分,或通过使用叶轮、共混机(诸如转鼓式共混机)或任何其他合适的装置,将第一混合物和另外量的第一稀释剂混合。另外量的第一稀释剂可以逐步的方式添加以系列稀释混合物,如图1中箭头108所示。例如,可在多个迭代子步骤中将第一混合物与第二量的第一稀释剂混合。子步骤可包括将部分的第二量的第一稀释剂添加到第一混合物中,以及将该部分的第二量的第一稀释剂与第一混合物混合。然后可添加第二量的第一稀释剂的另一部分,将其进一步混合。这些稀释子步骤可进行1次、2次、3次、4次、5次或更多次,直至所需量的第一稀释剂已与干燥卵清蛋白质粉末混合。任选地,在添加另外部分的第二量的第一稀释剂之前,可使混合物通过网筛。
[0168]
另选地,第一混合物和第二量的第一稀释剂可通过在将第二量的第一稀释剂添加到混合物中时连续混合第一混合物而混合在一起。即,不是将第二量的第一稀释剂逐步添加到第一混合物中以形成第二混合物,而是在添加第二量的第一稀释剂的同时将混合物混合。
[0169]
一旦形成第二混合物,就可将第二混合物与第二稀释剂(例如,微晶纤维素)混合以形成第三混合物,如图1的步骤110所示。可通过摇动组合的组分,或通过使用叶轮、共混
机(诸如转鼓式共混机)或任何其他合适的装置,将第二混合物和第二稀释剂混合。还使混合物以比用于形成先前混合物更高的剪切力经受混合,如步骤112所示。较高剪切力混合可发生在第二混合物与第二稀释剂的初始混合之后,或者可为用于混合第二混合物与第二稀释剂的混合力。这可例如使用锥式磨机(其可例如使用圆形磨机叶轮或方形磨机叶轮来配备)或其他合适的装置来进行。在一些实施方案中,使用较高剪切力混合来混合第二混合物和第二稀释剂以初始形成第三混合物,并且在一些实施方案中,在第三混合物经受较高剪切力混合之前,将第二混合物和第二稀释剂预混合以形成第三混合物。较高的剪切力混合增加了干燥卵清蛋白质粉末在制剂中的均匀分散,并且分散了可能形成的软的低密度附聚物。使用较高的剪切力混合并不旨在减小任何混合物组分的初级粒度,而是仅旨在解离颗粒的附聚物。
[0170]
将润滑剂(例如,硬脂酸镁)添加到混合物中以形成卵清蛋白质制剂,如步骤114所示。润滑剂可在制备过程期间添加到任何混合物中,但在某些点上与包含干燥卵清蛋白质粉末、第一稀释剂和第二稀释剂的混合物混合。例如,润滑剂可在较高剪切力混合步骤之前、之后或期间与第三混合物混合。可将另外量的一种或多种稀释剂(例如,第一稀释剂,诸如预胶化淀粉)与润滑剂共添加到混合物中。另外,可将第三混合物与润滑剂(以及任选的另外量的第一稀释剂)混合,然后与另外量的第三混合物混合。在一个示例性实施方案中,将第三混合物、另外量的第一稀释剂和润滑剂混合,通过网筛,然后与另外量的第三混合物混合以形成卵清蛋白质制剂。在一些实施方案中,在与包含卵清蛋白质的混合物混合之前,将润滑剂和另外量的第一稀释剂混合(并且任选地,使混合物通过网筛)。
[0171]
任选地,可使卵清蛋白质制剂通过网筛。网筛的尺寸通常为约250μm至约850μm(诸如约300μm至约710μm、或约425μm至约600μm)。
[0172]
可测定使用这些方法生产的一批卵清蛋白质制剂的共混物均匀度或质量特征,如本文进一步所述。在一些实施方案中,该方法还包括测定卵清蛋白质制剂的共混物均匀度和/或质量特征。
[0173]
在制备卵清蛋白质制剂的示例性方法中,该方法可包括(a)将干燥卵清蛋白质粉末与第一量的第一稀释剂(诸如预胶化淀粉)混合以形成第一混合物;(b)通过网筛将第一混合物与第一稀释剂的第二部分共筛分;(c)在步骤(a)和(b)之后,将第一混合物与第一稀释剂的第二部分混合以形成第二混合物;(d)将第二混合物与第一稀释剂的第三部分混合以形成第三混合物;(e)将第三混合物与第一稀释剂的第四部分混合以形成第四混合物;(f)将第四混合物与第一稀释剂的第五部分混合以形成第五混合物;(g)将第五混合物与第二稀释剂(诸如微晶纤维素)混合以形成第六混合物;(h)将第六混合物的第一部分与润滑剂(诸如硬脂酸镁)以及任选的第一稀释剂的第六部分混合,以形成第七混合物;(j)使第七混合物通过网筛;以及(k)将(j)的筛选混合物与第六混合物的第二部分混合以形成卵清蛋白质制剂。步骤(g)可包括两个混合子步骤,其中一个混合子步骤处于比另一个混合子步骤更高的剪切力。在一个示例性实施方案中,步骤(g)任选地包括两个子步骤,其中第一子步骤处于比第二子步骤更低的剪切力(诸如利用转鼓式共混机),并且第二子步骤处于比第一子步骤更高的剪切力(诸如利用锥式磨机)。这种制备制剂的方法对于用于制备含有该制剂的较低剂量剂量容器(诸如约0.1mg至约12mg的剂量(诸如约0.2mg、约1mg、约3mg、约6mg或约12mg的剂量容器,或其间的任何剂量))的制剂特别有用。制剂可具有例如约0.05重量%
至约2.5%的卵清蛋白质。在一些实施方案中,制剂不含或基本上不含助流剂。在一些实施方案中,制剂不含或基本上不含胶态二氧化硅。可测定使用这些方法生产的一批卵清蛋白质制剂的共混物均匀度或质量特征,如本文进一步所述。在一些实施方案中,该方法还包括测定卵清蛋白质制剂的共混物均匀度和/或质量特征。
[0174]
制备卵清蛋白质的低剂量制剂的示例性方法在图12a中示出。在步骤402中,将干燥卵清蛋白质粉末(其优选地特征在于确保总蛋白质水平和特定变应原水平)与第一量的第一稀释剂(诸如预胶化淀粉)混合以形成第一混合物。在一些实施方案中,步骤402还包括在与第一量的第一稀释剂混合之前表征干燥卵清蛋白质粉末。在步骤404中,将第一混合物与第二量的第一稀释剂共筛分。在步骤406中,将共筛分的第一混合物和第二量的第一稀释剂混合以形成第二混合物。步骤408允许以逐步的方式将另外量的第一稀释剂添加到第二混合物中。步骤408可包括添加另外量的第一稀释剂并混合的一个、两个、三个或更多个子步骤。连续进行这些步骤允许更大的含量均匀度。在步骤410中,将第二混合物与第二稀释剂(诸如微晶纤维素)混合以形成第三混合物。在步骤412中,通过高剪切混合(诸如通过锥式磨机)混合第三混合物以分散颗粒聚集体。在步骤414中,将部分的分散的第三混合物与润滑剂混合以形成第四混合物。步骤414还可包括将该部分的分散的第三混合物与另外量的第一稀释剂混合。在步骤416中,使第四混合物通过网筛。在步骤418中,将筛选的第四混合物和另外部分的分散的第三混合物的组合,随后在步骤420中混合以形成卵清蛋白质制剂。可测定使用这些方法生产的一批卵清蛋白质制剂的共混物均匀度或质量特征,如本文进一步所述。在一些实施方案中,该方法还包括测定卵清蛋白质制剂的共混物均匀度和/或质量特征。
[0175]
在制备卵清蛋白质制剂的另一个示例性方法中,该方法可包括(a)将干燥卵清蛋白质粉末与第一量的第一稀释剂(诸如预胶化淀粉)混合以形成第一混合物;(b)通过网筛将第一混合物与第一稀释剂的第二部分共筛分;(c)将第一混合物与第一稀释剂的第二部分混合以形成第二混合物;(d)将第二混合物与第一稀释剂的第三部分混合以形成第三混合物;(e)将第三混合物与第一稀释剂的第四部分混合以形成第四混合物;(f)将第四混合物与第一稀释剂的第五部分混合以形成第五混合物;(g)将第五混合物与第二稀释剂(诸如微晶纤维素)混合以形成第六混合物;(h)任选地使用比步骤(g)中用于混合第五混合物与第二稀释剂的剪切力更高的剪切力来混合第六混合物;(i)将润滑剂(诸如硬脂酸镁)与第一稀释剂的第六部分混合以形成第七混合物,并且任选地使第七混合物通过网筛;以及(k)将第七混合物与第六混合物混合以形成卵清蛋白质制剂。这种制备制剂的方法对于用于制备含有该制剂的较低剂量剂量容器(诸如约0.1mg至约12mg的剂量(诸如约0.2mg、约1mg、约3mg、约6mg或约12mg的剂量容器,或其间的任何剂量))的制剂特别有用。制剂可具有例如约0.05重量%至约2.5%的卵清蛋白质。在一些实施方案中,制剂不含或基本上不含助流剂。在一些实施方案中,制剂不含或基本上不含胶态二氧化硅。在一些实施方案中,可测定使用这些方法产生的干燥卵清蛋白质粉末(即,在配制之前)和/或卵清蛋白质制剂(即,在配制之后)的共混物均匀度或质量特征,如本文进一步所述,诸如使用hplc测定(例如,rp
‑
hplc)或elisa测定来确定卵清蛋白、类卵粘蛋白、溶菌酶和/或卵转铁蛋白中的一者或多者的浓度或图谱、或组合物的总蛋白质含量。配制的组合物可被包装在例如胶囊或小袋中。
[0176]
制备卵清蛋白质的低剂量制剂的示例性方法在图12b中示出。在步骤422处,将干
燥卵清蛋白质粉末与第一稀释剂(诸如预胶化淀粉)的第一部分混合以形成第一混合物。在步骤424处,使第一混合物与第一稀释剂的第二部分通过网筛共筛分,并且在步骤426处将组合的第一混合物和第一稀释剂的第二部分混合以形成第二混合物。在步骤428处,将第二混合物与第一稀释剂的第三部分混合(例如,使用共混机,诸如转鼓式共混机)以形成第三混合物。在步骤430处,将第三混合物与第一稀释剂的第四部分混合(例如,使用共混机,诸如转鼓式共混机)以形成第四混合物。在步骤432处,将第四混合物与第一稀释剂的第五部分混合(例如,使用共混机,诸如转鼓式共混机)以形成第五混合物。在步骤434处,将第五混合物与第二稀释剂(诸如微晶纤维素)混合以形成第六混合物。任选地,使用比在步骤434处使用的剪切力更高的剪切力混合第六混合物,例如使用锥式磨机。在步骤436处,将第一稀释剂的第六部分与润滑剂(诸如硬脂酸镁)混合以形成第七混合物,在步骤438处将该第七混合物与第六混合物混合以形成第八混合物(例如,配制的组合物)。
[0177]
在制备卵清蛋白质制剂的另一个示例性方法中,该方法可包括(a)将干燥卵清蛋白质粉末与第一量的第一稀释剂(诸如预胶化淀粉)混合以形成第一混合物;(b)通过网筛将第一混合物与第一稀释剂的第二部分共筛分,并且任选地混合共筛分的组合物;(c)使用一个或多个另外部分的第一稀释剂(例如,1、2、3、4、5或更多个另外部分)系列稀释共筛分的组合物,并且在添加每个部分之后混合该组合物以形成第三混合物;(d)将第三混合物与第二稀释剂(诸如微晶纤维素)混合以形成第四混合物;(e)将另一个另外部分的第一稀释剂与润滑剂(诸如硬脂酸镁)混合以形成第五混合物;以及(f)将第四混合物与第五混合物混合以形成配制的组合物。这种制备制剂的方法对于用于制备含有该制剂的较低剂量剂量容器(诸如约0.1mg至约12mg的剂量(诸如约0.2mg、约1mg、约3mg、约6mg或约12mg的剂量容器,或其间的任何剂量))的制剂特别有用。制剂可具有例如约0.05重量%至约2.5%的卵清蛋白质。在一些实施方案中,制剂不含或基本上不含助流剂。在一些实施方案中,制剂不含或基本上不含胶态二氧化硅。在一些实施方案中,可测定使用这些方法产生的干燥卵清蛋白质粉末(即,在配制之前)和/或卵清蛋白质制剂(即,在配制之后)的共混物均匀度或质量特征,如本文进一步所述,诸如使用hplc测定(例如,rp
‑
hplc)或elisa测定来确定卵清蛋白、类卵粘蛋白、溶菌酶和/或卵转铁蛋白中的一者或多者的浓度或图谱、或组合物的总蛋白质含量。配制的组合物可被包装在例如胶囊或小袋中。
[0178]
制备卵清蛋白质的低剂量制剂的示例性方法在图12c中示出。在步骤440处,将干燥卵清蛋白质粉末与第一稀释剂(诸如预胶化淀粉)的第一部分混合以形成第一混合物。在步骤442处,通过网筛将第一混合物与第一稀释剂的第二部分共筛分。在步骤444处,将第一混合物与第二量的第一稀释剂混合以形成第二混合物。在步骤446处,通过将第二混合物与一个或多个另外部分的第一稀释剂混合来系列稀释第二混合物以形成第三混合物。系列稀释可例如在1、2、3、4、5或更多个子步骤中进行,其中在每个子步骤处将部分的第一稀释剂与组合物混合,然后添加另外部分的第一稀释剂。在步骤448处,将第三混合物与第二稀释剂(诸如微晶纤维素)混合以形成第四混合物。在步骤450处,将第一稀释剂的另一部分与润滑剂(诸如硬脂酸镁)混合以形成第五混合物,在步骤452处将该第五混合物与第四混合物混合以形成配制的组合物。
[0179]
然后可将卵清蛋白质制剂包装在包装中,例如包装在胶囊或小袋中,以在剂量容器中获得期望剂量的卵清蛋白质。剂量容器中可包含约100mg至约1000mg(诸如约100mg至
约250mg、约250mg至约400mg、约400mg至约600mg、或约600mg至约1000mg)的卵清蛋白质制剂。以举例的方式,在一些实施方案中,容器(诸如胶囊)中包含约180mg卵清蛋白质制剂,以在剂量容器中获得期望量的卵清蛋白质制剂。
[0180]
一旦将卵清蛋白质制剂包装在剂量容器中,就可测定剂量容器的含量均匀度。
[0181]
中等剂量制备方法
[0182]
当制备用于特定剂量(诸如剂量容器中的约3mg至约300mg,尽管可使用类似的方法产生更大的剂量)的制剂时,共混物均匀度和含量均匀度与卵清蛋白质制剂的流动性相平衡。制剂制备方法通常产生具有约1.5重量%至约60重量%的卵清蛋白质(诸如在约1.5重量%至约3重量%、约3重量%至约8重量%、约8重量%至约15重量%、约15重量%至约30重量%、或约30重量%至约60重量%之间的卵清蛋白质)的制剂。
[0183]
所制备的卵清蛋白质制剂通常包含两种稀释剂(例如预胶化淀粉和微晶纤维素)、润滑剂和任选的助流剂(诸如胶态二氧化硅)。然而,对于一些中等强度剂型,胶态二氧化硅不包含在制剂中。
[0184]
如图2所示,在步骤202处将干燥卵清蛋白质粉末与第一量的第一稀释剂(例如,预胶化淀粉)混合以形成第一混合物。任选地,助流剂(诸如胶态二氧化硅)也可在该步骤处与干燥卵清蛋白质粉末混合。混合优选地使用较高剪切力来完成,以分散颗粒聚集体。这可例如使用锥式磨机混合器(其可配置有圆形磨机叶轮或方形磨机叶轮)来完成。
[0185]
可通过将第一混合物与另外量的第一稀释剂混合来进一步稀释第一混合物,以形成第二混合物,如图2的步骤204所示。可通过摇动组合的组分,或通过使用叶轮、共混机(诸如转鼓式共混机)或任何其他合适的装置,将第一混合物和另外量的第一稀释剂混合。
[0186]
可将第二混合物与第二稀释剂(例如,微晶纤维素)混合以形成第三混合物,如图2的步骤206所示。任选地,将另外量的第一稀释剂添加到第二混合物或第三混合物中。可将第二混合物在与第二稀释剂混合之前与另外量的第一稀释剂混合。另选地,可将另外量的第一稀释剂与第二混合物和第二稀释剂共混合。可通过摇动组合的组分,或通过使用叶轮、共混机(诸如转鼓式共混机)或任何其他合适的装置,将第二混合物和第二稀释剂(以及任选的另外量的第一稀释剂)混合。
[0187]
还使第三混合物以比用于形成第二混合物更高的剪切力经受混合,如步骤208所示,这可分散混合物中的颗粒聚集体。较高剪切力混合可发生在第二混合物与第二稀释剂的初始混合之后,或者可为用于混合第二混合物与第二稀释剂的混合力。这可例如使用锥式磨机(其可例如使用圆形磨机叶轮或方形磨机叶轮来配备)或其他合适的装置来完成。在一些实施方案中,使用较高剪切力混合来混合第二混合物和第二稀释剂以初始形成第三混合物,并且在一些实施方案中,在第三混合物经受较高剪切力混合之前,将第二混合物和第二稀释剂预混合以形成第三混合物。较高的剪切力混合增加了干燥卵清蛋白质粉末在制剂中的均匀分散,并且分散了可能形成的软的低密度附聚物。使用较高的剪切力混合并不旨在减小任何混合物组分的初级粒度,而是仅旨在解离颗粒的附聚物。
[0188]
将润滑剂(例如,硬脂酸镁)添加到混合物中以形成卵清蛋白质制剂,如步骤210所示。润滑剂可在制备过程期间添加到任何混合物中,但在某些点上与包含干燥卵清蛋白质粉末、第一稀释剂和第二稀释剂的混合物混合。例如,润滑剂可在较高剪切力混合步骤之前、之后或期间与第三混合物混合。可将另外量的一种或多种稀释剂(例如,第一稀释剂,诸
如预胶化淀粉)与润滑剂共添加到混合物中。在一些实施方案中,可将第三混合物与润滑剂(以及任选的另外量的第一稀释剂)混合,然后与另外量的第三混合物混合。在一个示例性实施方案中,将第三混合物、另外量的第一稀释剂和润滑剂混合,通过网筛,然后与另外量的第三混合物混合以形成卵清蛋白质制剂。
[0189]
任选地,可使卵清蛋白质制剂通过网筛。网筛的尺寸通常为约250μm至约850μm(诸如约300μm至约710μm、或约425μm至约600μm)。
[0190]
制备卵清蛋白质的中等剂量制剂的示例性方法在图13a中示出。在步骤502中,将干燥卵清蛋白质粉末(其优选地特征在于确保总蛋白质水平和特定变应原水平)与第一量的第一稀释剂(诸如预胶化淀粉)混合以形成第一混合物。步骤502还可包括与助流剂(诸如胶态二氧化硅)混合以改善流动性。在一些实施方案中,步骤502还包括在与第一量的第一稀释剂混合之前表征干燥卵清蛋白质粉末。在步骤504中,将第一混合物与第二量的第一稀释剂混合以形成第二混合物。504的混合步骤可包括两个子步骤,其中一个子步骤处于比另一个子步骤更高的剪切力。在该方法的示例性实施方案中,步骤504包括两个子步骤,其中第一子步骤处于比第二子步骤更高的剪切力(诸如利用锥式磨机),并且第二子步骤处于更低的剪切力(诸如利用转鼓式共混机)。步骤506为任选的,并且允许添加另外量的第一稀释剂。在示例性实施方案中,步骤506包括将第二混合物与另外量的第一稀释剂混合。在另一个示例性实施方案中,跳过步骤506。在步骤508中,将第二混合物与第二稀释剂(诸如微晶纤维素)混合以形成第三混合物。步骤508还可包括将第二混合物与另外量的第一稀释剂混合。在步骤510中,利用高剪切混合步骤(诸如锥式磨机)混合第三混合物以分散颗粒聚集体。在步骤512中,将部分的分散的第三混合物与润滑剂(诸如硬脂酸镁)混合以形成第四混合物。步骤512任选地包括将第三混合物与另外量的第一稀释剂混合。在步骤514中,使第四混合物通过网筛。在步骤516中,将筛选的第四混合物与另外量的分散的第三混合物混合,随后在步骤518中混合以形成卵清蛋白质制剂。
[0191]
可测定使用这些方法生产的一批卵清蛋白质制剂的共混物均匀度或质量特征,如本文进一步所述。在一些实施方案中,该方法还包括测定卵清蛋白质制剂的共混物均匀度和/或质量特征。
[0192]
在制备卵清蛋白质制剂的一些方法中,该方法包括(a)将干燥卵清蛋白质粉末与第一量的第一稀释剂混合以形成第一混合物;(b)将第一混合物与第一稀释剂的第二部分混合以形成第二混合物;(c)将第二混合物与第一稀释剂的第三部分混合以形成第三混合物;(d)将所述第三混合物与第二稀释剂混合以形成第四混合物;(e)将第四混合物与第一稀释剂的第四部分和润滑剂混合以形成第五混合物;(f)使第五混合物通过网筛;(g)将(f)的筛选混合物与另外量的第四混合物混合以形成卵清蛋白质制剂。在步骤(b)中,混合步骤可包括两个子步骤,其中一个子步骤处于比另一个子步骤更高的剪切力。在一个示例性实施方案中,步骤(b)包括两个子步骤,其中第一子步骤包括利用比第二子步骤更高的剪切力混合(诸如利用锥式磨机),并且第二子步骤包括利用共混机混合(诸如利用转鼓式共混机)。在步骤(d)中,混合步骤可包括两个子步骤,其中一个子步骤处于比另一个子步骤更高的剪切力。在一个示例性实施方案中,步骤(d)包括两个子步骤,其中第一子步骤包括利用比第二子步骤更低的剪切力混合。在一些实施方案中,制剂不含或基本上不含助流剂。在一些实施方案中,制剂不含或基本上不含胶态二氧化硅。在一些实施方案中,可测定使用这些
方法产生的干燥卵清蛋白质粉末(即,在配制之前)和/或卵清蛋白质制剂(即,在配制之后)的共混物均匀度或质量特征,如本文进一步所述,诸如使用hplc测定(例如,rp
‑
hplc)或elisa测定来确定卵清蛋白、类卵粘蛋白、溶菌酶和/或卵转铁蛋白中的一者或多者的浓度或图谱、或组合物的总蛋白质含量。配制的组合物可被包装在例如胶囊或小袋中。
[0193]
在制备卵清蛋白质制剂的另一个方法中,该方法包括(a)将干燥卵清蛋白质粉末与第一量的第一稀释剂(诸如预胶化淀粉)混合以形成第一混合物;(b)将第一混合物与第一稀释剂的第二部分混合以形成第二混合物,并且任选地以比用于混合第一混合物与第一稀释剂的第二部分的剪切力更低的剪切力混合第二混合物;(c)将第二混合物与第一稀释剂的第三部分混合以形成第三混合物;(d)将第三混合物与第二稀释剂(诸如微晶纤维素)混合以形成第四混合物,并且任选地使用比用于混合第三混合物与第二稀释剂的剪切力更高的剪切力来混合第四混合物;(e)将第一稀释剂的第四部分与润滑剂(诸如硬脂酸镁)混合以形成第五混合物,并且任选地使第五混合物通过网筛;以及(f)将第四混合物与第五混合物混合。在一些实施方案中,制剂不含或基本上不含助流剂。在一些实施方案中,制剂不含或基本上不含胶态二氧化硅。在一些实施方案中,可测定使用这些方法产生的干燥卵清蛋白质粉末(即,在配制之前)和/或卵清蛋白质制剂(即,在配制之后)的共混物均匀度或质量特征,如本文进一步所述,诸如使用hplc测定(例如,rp
‑
hplc)或elisa测定来确定卵清蛋白、类卵粘蛋白、溶菌酶和/或卵转铁蛋白中的一者或多者的浓度或图谱、或组合物的总蛋白质含量。配制的组合物可被包装在例如胶囊或小袋中。
[0194]
图13b示出了制备卵清蛋白质制剂的另一种示例性方法。步骤520包括将干燥卵清蛋白质粉末与第一稀释剂(诸如预胶化淀粉)的第一部分混合以形成第一混合物。在步骤522处,将第一混合物与第一稀释剂的第二部分混合以形成第二混合物。该步骤可包括具有不同混合剪切力的两个或更多个子步骤。例如,可使用第一混合剪切力(例如,使用锥式磨机)将第一混合物与第一稀释剂的第二部分混合以形成第二混合物,并且可使用低于第一剪切力的第二剪切力(例如,使用共混机,诸如转鼓式共混机)进一步混合第二混合物。在步骤524处,将第二混合物与第一稀释剂的第三部分混合以形成第三混合物。在步骤526处,将第三混合物与第二稀释剂(诸如微晶纤维素)混合以形成第四混合物。该步骤可包括具有不同混合剪切力的两个或更多个子步骤。例如,可使用第一混合剪切力(例如,使用共混机,诸如转鼓式共混机)将第三混合物与第二稀释剂混合以形成第四混合物,并且可使用高于第一剪切力的第二剪切力(例如,使用锥式磨机)进一步混合第四混合物。在步骤528处,将第一稀释剂的第四部分与润滑剂(诸如硬脂酸镁)混合以形成第五混合物,任选地使该第五混合物通过网筛。在步骤530处,将第四混合物与第五混合物混合以形成卵清蛋白质制剂。
[0195]
在制备卵清蛋白质制剂的另一种方法中,该方法包括(a)将干燥卵清蛋白质粉末与第一量的第一稀释剂(诸如预胶化淀粉)和助流剂(诸如胶态二氧化硅)混合以形成第一混合物;(b)将第一混合物与第一稀释剂的第二部分混合以形成第二混合物,并且任选地以比用于混合第一混合物与第一稀释剂的第二部分的剪切力更低的剪切力混合第二混合物;(c)将第二混合物与第一稀释剂的第三部分混合以形成第三混合物;(d)将第三混合物与第二稀释剂(诸如微晶纤维素)和第一稀释剂的第四部分混合以形成第四混合物,并且任选地使用比用于混合第三混合物与第二稀释剂的剪切力更高的剪切力来混合第四混合物;(e)将第一稀释剂的第五部分与润滑剂(诸如硬脂酸镁)混合以形成第五混合物,并且任选地使
该第五混合物通过网筛;以及(f)将第四混合物与第五混合物混合。在一些实施方案中,可测定使用这些方法产生的干燥卵清蛋白质粉末(即,在配制之前)和/或卵清蛋白质制剂(即,在配制之后)的共混物均匀度或质量特征,如本文进一步所述,诸如使用hplc测定(例如,rp
‑
hplc)或elisa测定来确定卵清蛋白、类卵粘蛋白、溶菌酶和/或卵转铁蛋白中的一者或多者的浓度或图谱、或组合物的总蛋白质含量。配制的组合物可被包装在例如胶囊或小袋中。
[0196]
图13c示出了制备卵清蛋白质制剂的另一种示例性方法。步骤532包括将干燥卵清蛋白质粉末与第一稀释剂(诸如预胶化淀粉)的第一部分和助流剂(诸如胶态二氧化硅)混合以形成第一混合物。在步骤534处,将第一混合物与第一稀释剂的第二部分混合以形成第二混合物。该步骤可包括具有不同混合剪切力的两个或更多个子步骤。例如,可使用第一混合剪切力(例如,使用锥式磨机)将第一混合物与第一稀释剂的第二部分混合以形成第二混合物,并且可使用低于第一剪切力的第二剪切力(例如,使用共混机,诸如转鼓式共混机)进一步混合第二混合物。在步骤536处,将第二混合物与第一稀释剂的第三部分和第二稀释剂(诸如微晶纤维素)混合以形成第三混合物。该步骤可包括具有不同混合剪切力的两个或更多个子步骤。例如,可使用第一混合剪切力(例如,使用共混机,诸如转鼓式共混机)将第三混合物与第二稀释剂混合以形成第四混合物,并且可使用高于第一剪切力的第二剪切力(例如,使用锥式磨机)进一步混合第四混合物。在步骤538处,将第一稀释剂的第四部分与润滑剂(诸如硬脂酸镁)混合以形成第五混合物,任选地使该第五混合物通过网筛。在步骤540处,将第五混合物与第四混合物混合。
[0197]
然后可将卵清蛋白质制剂包装在包装中,例如包装在胶囊或小袋中,以在剂量容器中获得期望剂量的卵清蛋白质。剂量容器中可包含约100mg至约1000mg(诸如约100mg至约250mg、约250mg至约400mg、约400mg至约600mg、或约600mg至约1000mg)的卵清蛋白质制剂。以举例的方式,在一些实施方案中,容器(诸如胶囊)中包含约180mg卵清蛋白质制剂,以在剂量容器中获得期望量的卵清蛋白质制剂。在一些实施方案中,容器(诸如胶囊)中包含约500mg卵清蛋白质制剂,以在剂量容器中获得期望量的卵清蛋白质制剂。
[0198]
一旦将卵清蛋白质制剂包装在剂量容器中,就可测定剂量容器的含量均匀度。
[0199]
高剂量制备方法
[0200]
用于某些强度剂量(诸如约100mg或更高)的卵清蛋白质制剂的制备被设计成优先考虑制剂的流动性。卵清蛋白质粉末可粘附到包装材料,从而限制制剂从容器的可递送性。为了增加流动性,除一种或多种稀释剂(诸如预胶化淀粉和/或微晶纤维素)和润滑剂(诸如硬脂酸镁)之外,通常还用助流剂(诸如胶态二氧化硅)制备制剂。在一些实施方案中,卵清蛋白质制剂具有约50重量%至约80重量%(诸如约50重量%至约60重量%、约60重量%至约70重量%、或约70重量%至约80重量%)的卵清蛋白质。
[0201]
为了制备卵清蛋白质制剂,将干燥卵清蛋白质粉末、第一稀释剂(诸如预胶化淀粉)和助流剂(诸如胶态二氧化硅)混合在一起,如图3的步骤302所示。可通过摇动组合的组分、或通过使用叶轮、共混机(诸如转鼓式共混机)或任何其他合适的装置来混合组分。
[0202]
然后将第一混合物与第二稀释剂(诸如微晶纤维素)混合以形成第二混合物,如步骤304所示。可使用比用于混合卵清蛋白质粉末与第一稀释剂和助流剂的剪切力更高的剪切力来混合第一混合物和第二稀释剂。较高的剪切力可解离混合物内的颗粒附聚物。
[0203]
还将第二混合物与润滑剂混合以形成卵清蛋白质制剂,如步骤306所示。任选地,另外量的第一稀释剂也可在润滑剂与第二混合物混合之前、之后或同时与第二混合物混合。在一些实施方案中,可将第二混合物与润滑剂(以及任选的另外量的第一稀释剂)混合,然后与另外量的第二混合物混合。在一个示例性实施方案中,将第二混合物、另外量的第一稀释剂和润滑剂混合,通过网筛,然后与另外量的第二混合物混合以形成卵清蛋白质制剂。
[0204]
任选地,可使卵清蛋白质制剂通过网筛。网筛的尺寸通常为约250μm至约850μm(诸如约300μm至约710μm、或约425μm至约600μm)。
[0205]
制备卵清蛋白质的高剂量制剂的示例性方法在图14a中示出。在步骤602中,将干燥卵清蛋白质粉末(其优选地特征在于确保总蛋白质水平和特定变应原水平)与第一量的第一稀释剂(诸如预胶化淀粉)和助流剂(诸如胶态二氧化硅)混合以形成第一混合物。在一些实施方案中,步骤602还包括在与第一量的第一稀释剂混合之前表征干燥卵清蛋白质粉末。在步骤604中,然后将第一混合物与第二稀释剂混合以形成第二混合物,然后利用高剪切混合步骤(诸如锥式磨机)混合以分散颗粒聚集体。在步骤606中,将部分的分散的第二混合物与润滑剂混合以形成第三混合物。步骤606还可包括将第二混合物与另外量的第一稀释剂混合。在步骤608中,使第三混合物通过网筛。在步骤610中,将筛选的第三混合物和第二量的分散的第二混合物组合,随后在步骤612中混合以形成卵清蛋白质制剂。
[0206]
在制备卵清蛋白质制剂的一些方法中,该方法包括(a)将干燥卵清蛋白质粉末与第一量的第一稀释剂(诸如预胶化淀粉)混合以形成第一混合物;(b)将第一混合物与第二稀释剂(诸如微晶纤维素)混合,任选地以比步骤(a)中用于形成第一混合物的剪切力更高的剪切力混合;(c)将第一稀释剂的第二部分与润滑剂(诸如硬脂酸镁)混合以形成第三混合物,并且任选地使该第三混合物通过网筛;以及(d)将第二混合物与第三混合物混合。在一些实施方案中,可测定使用这些方法产生的干燥卵清蛋白质粉末(即,在配制之前)和/或卵清蛋白质制剂(即,在配制之后)的共混物均匀度或质量特征,如本文进一步所述,诸如使用hplc测定(例如,rp
‑
hplc)或elisa测定来确定卵清蛋白、类卵粘蛋白、溶菌酶和/或卵转铁蛋白中的一者或多者的浓度或图谱、或组合物的总蛋白质含量。配制的组合物可被包装在例如胶囊或小袋中。
[0207]
制备卵清蛋白质的高剂量制剂的另一个示例性方法在图14b中示出。在步骤614处,将干燥卵清蛋白质粉末与第一稀释剂(诸如预胶化淀粉)的第一部分与助流剂(诸如胶态二氧化硅)混合以形成第一混合物。在步骤616处,将第一混合物与第二稀释剂(诸如微晶纤维素)混合以形成第二混合物。在一些实施方案中,将第一混合物与第二稀释剂以比步骤614处将干燥卵清蛋白质粉末与第一稀释剂的第一部分和助流剂混合以形成第一混合物(其可例如使用共混机诸如转鼓式共混机混合)更高的剪切力混合(例如,使用锥式磨机)。在步骤618处,将第一稀释剂的第二部分与润滑剂(诸如硬脂酸镁)混合以形成第三混合物,任选地使该第三混合物通过网筛。在步骤620处,将第二混合物与第三混合物混合。
[0208]
可测定使用这些方法生产的一批卵清蛋白质制剂的共混物均匀度或质量特征,如本文进一步所述。在一些实施方案中,该方法还包括测定卵清蛋白质制剂的共混物均匀度和/或质量特征。
[0209]
然后可将卵清蛋白质制剂包装在包装中,例如包装在胶囊或小袋中,以在剂量容器中获得期望剂量的卵清蛋白质。剂量容器中可包含约100mg至约1000mg(诸如约100mg至
约250mg、约250mg至约400mg、约400mg至约600mg、或约600mg至约1000mg)的卵清蛋白质制剂。以举例的方式,在一些实施方案中,容器(诸如胶囊)中包含约500mg卵清蛋白质制剂,以在剂量容器中获得期望量的卵清蛋白质制剂。
[0210]
一旦将卵清蛋白质制剂包装在剂量容器中,就可测定剂量容器的含量均匀度。
[0211]
质量控制方法
[0212]
本文所述的剂型和卵清蛋白质制剂可用于口服免疫疗法,其中向对一种或多种卵蛋白质具有变应性的患者施用增加的剂量,以使患者对这些蛋白质脱敏。由于对变应原性蛋白质的变应性应答可能是重度的,甚至危及生命,因此希望对所施用的剂量进行充分的定量控制和定性控制两者。为了确保对施用于患者的产品的质量控制,可监测干燥卵清蛋白质粉末、卵清蛋白质制剂和包含卵清蛋白质制剂的剂量容器(和剂量容器批次)的各种参数。此类质量控制方法可包括表征一种或多种变应原性卵清蛋白质(类卵粘蛋白、卵清蛋白、卵转铁蛋白和/或溶菌酶)、测定蛋白质含量、测定卵清蛋白质制剂的共混物均匀度、测定包含卵清蛋白质制剂的大批剂量容器的含量均匀度或可递送质量,或测定干燥卵清蛋白质粉末或卵清蛋白质制剂的水活度。质量控制方法可包括在制备过程中以确保卵清蛋白质制剂或剂量容器的一致制备。
[0213]
卵清中的变应原性蛋白质包括gal d 1(类卵粘蛋白)、gal d 2(卵清蛋白)、gal d 3(卵转铁蛋白)和gal d 4(溶菌酶)。卵清蛋白质制剂或干燥卵清蛋白质粉末中的这些蛋白质中的一种或多种(或全部)可使用本文所述的方法来表征。一种或多种变应原性卵清蛋白质的表征可包括确定一种或多种蛋白质的存在、一种或多种免疫显性卵清蛋白质的量或相对量、或一种或多种免疫显性卵清蛋白质的效能或相对效能。
[0214]
表征类卵粘蛋白、卵清蛋白、卵转铁蛋白和/或溶菌酶的一种方法包括使用高效液相色谱(hplc)分析干燥卵清蛋白质粉末或卵清蛋白质制剂。示例性hplc技术包括尺寸排阻色谱(sec
‑
hplc)和反相hplc(rp
‑
hplc)。例如,rp
‑
hplc充分分离所有四种变应原性卵清蛋白质以用于定性或定量分析。可获得hplc图谱,并且可鉴定代表类卵粘蛋白、卵清蛋白、卵转铁蛋白和/或溶菌酶的峰或将其与参考标准品比较以进行定性评估。
[0215]
表征类卵粘蛋白、卵清蛋白、卵转铁蛋白和/或溶菌酶可包括确定干燥卵清蛋白质粉末(药物物质)和/或卵清蛋白质制剂(药物产品)中类卵粘蛋白、卵清蛋白、卵转铁蛋白和/或溶菌酶中的一种或多种的存在。这可例如通过聚丙烯酰胺凝胶电泳(page)(诸如sds
‑
page)、免疫印迹或hplc(诸如sec
‑
hplc或rp
‑
hplc)来完成。变应原性蛋白质通常在一致的时间点从hplc柱洗脱,并且可使用参考标准品(诸如纯化的可商购获得的类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶)来鉴定峰。可使用hplc图谱例如基于保留时间来鉴定干燥卵清蛋白质粉末或卵清蛋白质制剂中的变应原性蛋白质。还可将hplc图谱与参考标准品进行定性比较,以确定所测试的干燥卵清蛋白质粉末或卵清蛋白质制剂的一致性。
[0216]
表征类卵粘蛋白、卵清蛋白、卵转铁蛋白和/或溶菌酶可包括对卵清蛋白质制剂或干燥卵清蛋白质粉末中类卵粘蛋白、卵清蛋白、卵转铁蛋白和/或溶菌酶的量进行定量。hplc(例如sec
‑
hplc或rp
‑
hplc)方法可用于充分定量蛋白质,例如通过确定hplc图谱中的峰面积。卵清蛋白质制剂或干燥卵清蛋白质粉末中类卵粘蛋白、卵清蛋白、卵转铁蛋白和/或溶菌酶的浓度可例如使用该方法通过将与类卵粘蛋白、卵清蛋白、卵转铁蛋白和/或溶菌酶相关联的蛋白质峰与参考品进行比较来确定。表征蛋白质的另一个示例包括确定类卵粘
蛋白、卵清蛋白、卵转铁蛋白和/或溶菌酶的相对量,这可使用hplc图谱来确定。相对量可与卵清蛋白质制剂或干燥卵清蛋白质制剂中的总蛋白质进行比较(例如通过与所有蛋白质峰的总面积进行比较)或与类卵粘蛋白、卵清蛋白、卵转铁蛋白和/或溶菌酶的总量进行比较。hplc图谱通过测量蛋白质从柱中洗脱时的吸光度来建立,诸如约210nm至约280nm的光波长。hplc图谱中由于蛋白质引起的峰面积与测定样品中该蛋白质的量相关。然而,由于蛋白质的吸光度差异,不同蛋白质之间的峰面积比率可能不一定反映不同蛋白质的重量比。可通过校准所研究的蛋白质的峰面积与质量来确定不同蛋白质的重量比。因此,蛋白质的相对量可为例如来自hplc图谱的相对峰面积或蛋白质的相对重量。由于质量控制方法用于确保批次之间的一致性,因此可使用变应原性蛋白质的相对量的任何基础。
[0217]
还可表征类卵粘蛋白、卵清蛋白、卵转铁蛋白和/或溶菌酶中的一种或多种,以确定干燥卵清蛋白质粉末或卵清蛋白质制剂中变应原性卵清蛋白质的效能或相对效能(相对于参考样品中蛋白质的效能)。变应原性蛋白质的效能或相对效能可由于变应原性蛋白质的变性而改变,并且测量干燥卵清蛋白质粉末或卵清蛋白质制剂中变应原性蛋白质的效能或相对效能可用于监测粉末和/或制剂的质量或一致性。在一些实施方案中,在体外测量干燥卵清蛋白质粉末或卵清蛋白质制剂中一种或多种卵清蛋白质的效能。在一些实施方案中,使用单一变应原性蛋白质(例如,类卵粘蛋白)来表示粉末或制剂的效能或相对效能。效能可被报告为例如通过效能测定测量的ec
50
或ec
50
的比率(即,相对效能)。可用于确定一种或多种变应原性卵清蛋白质的效能的示例性免疫测定技术包括酶联免疫吸附测定(elisa)、放射免疫测定(ria)、免疫印迹、表面等离子共振(spr)或多重免疫测定。测量卵清蛋白质制剂中卵清蛋白、卵转铁蛋白、类卵粘蛋白或溶菌酶的效能的另一种方法可包括基于细胞的测定(例如嗜碱性粒细胞组胺释放测定)。参见例如santos等人,basophil activation test:food challenge in a test tube or specialist research tool?,clinical and translational allergy,第6卷,第10期,第1
‑
9页(2016)。
[0218]
效能测定中使用的报告分子以高特异性结合所测定的变应原性蛋白质,并且通常为抗体。抗体可为单克隆抗体或多克隆抗体。在一些实施方案中,抗体为igg抗体或ige抗体。用于测定效能或相对效能的抗体特异性结合被测蛋白质(例如卵清蛋白、卵转铁蛋白、类卵粘蛋白或溶菌酶)。包括特异性结合两种或更多种不同蛋白质的抗体的抗体库也可用于同时确定两种或更多种测定蛋白质的效能或相对效能。例如,该库可包括特异性结合卵清蛋白的抗体、特异性结合卵转铁蛋白的抗体、特异性结合类卵粘蛋白的抗体和/或特异性结合溶菌酶的抗体中的两种或更多种。抗体库可为混合在一起的单独纯化的抗体库,或者可来源于用全卵蛋白质或卵清蛋白质免疫的动物。当测量相对效能时,对于测试样品和参考样品,应使用相同的抗体或抗体库。
[0219]
在包装成剂型之前或之后,可确定干燥卵清蛋白质粉末或卵清蛋白质制剂的蛋白质含量,以监测制备过程期间的质量。蛋白质含量可作为浓度(例如,组合物的重量百分比)或参考蛋白质的目标(即,预期)量(例如,目标剂量的x%)报告。通常测量干燥卵清蛋白质粉末的蛋白质含量以确定在制备过程中应包含多少干燥卵清蛋白质粉末,从而在所制备的卵清蛋白质制剂中获得预期的卵清蛋白质浓度。蛋白质含量也可用于测量卵清蛋白质制剂中的共混均匀度或包含卵清蛋白质制剂的大批制备的剂量容器中的含量均匀度。测量蛋白质含量的示例性方法包括吸光度、lowry测定、bradford测定、燃烧测定、二喹啉甲酸(bca)
academy of allergy and clinical immunology practall consensus report,j.allergy clin.immunol.,第130卷,第6期,第1260
‑
74页(2012)。
[0228]
针对生卵清蛋白质以确定生卵清蛋白质的最高耐受剂量或累积耐受剂量的口服食物挑战可包括口服施用一系列递增量的生卵清蛋白质。剂量可在例如约1mg与约2000mg之间、或约1mg至约300mg之间的范围内。患者不需要摄入所有剂量的口服食物挑战,因为口服食物挑战通常在患者遭受中度或重度变应原性不良事件之后终止。用于口服食物挑战的一组示例性生卵清剂量示于表1中。对于表1所示的示例性口服食物挑战剂量,如果患者耐受的卵清蛋白质的最高剂量为30mg(最高耐受剂量),则累积耐受剂量为44mg卵清蛋白质。
[0229]
表1:用于口服食物挑战的生卵清蛋白质剂量
[0230]
生卵清蛋白质剂量(mg)累积剂量(mg)11341014304410014430044460010441000204420004044
[0231]
在一些实施方案中,患者在治疗开始时耐受的生卵清蛋白质的最高剂量(即,最高耐受剂量)为约2000mg或更少、约1000mg或更少、约600mg或更少、约300mg或更少、约100mg或更少、约30mg或更少、约10mg或更少、或约3mg或更少。在一些实施方案中,患者在治疗开始时耐受的生卵清蛋白质的最高累积剂量(即,最高耐受剂量)为约444mg或更少、约144mg或更少、约44mg或更少、约14mg或更少、或约4mg或更少。由于一些患者对生卵清蛋白质高度敏感,为了降低治疗过程期间重度不良事件的风险,在一些实施方案中,最高耐受剂量为约0.2mg生卵清蛋白质或更多、约0.4mg生卵清蛋白质或更多,约0.8mg生卵清蛋白质或更多、约1.0mg生卵清蛋白质或更多、约1.2mg生卵清蛋白质或更多、或约2mg生卵清蛋白质或更多。在一些实施方案中,累积耐受剂量为约0.2mg生卵清蛋白质或更多、约0.6mg生卵清蛋白质或更多、约1.4mg生卵清蛋白质或更多、约2.4mg生卵清蛋白质或更多、约2.6mg生卵清蛋白质或更多、约4.4mg生卵清蛋白质或更多、或约4.6mg生卵清蛋白质或更多。
[0232]
熟卵蛋白质或烘焙卵蛋白质的口服食物挑战也可用于确定熟卵蛋白质或烘焙卵蛋白质的最高耐受剂量。熟或烘焙卵蛋白质可来自熟或烘焙卵清、或熟或烘焙全卵(即卵清和卵黄)。对于口服食物挑战,使用一系列剂量的熟卵蛋白质(其可例如在烘焙食物产品诸如面包、松饼、饼干或蛋糕中烹饪、或油炸)。表2示出了用于口服食物挑战的一组示例性熟或烘焙卵剂量,其在烘焙松饼中具有熟全卵蛋白质的剂量。在一些实施方案中,将烘焙卵蛋白质或烘焙卵清蛋白质在约176℃至约260℃(诸如约176℃至约232℃、约176℃至约220℃、或约176℃至约205℃)处加热约20分钟至约60分钟(诸如约20分钟至约45分钟、约20分钟至约35分钟、或约20分钟至约30分钟)。
[0233]
表2:用于口服食物挑战的熟全卵蛋白质剂量
[0234]
剂量编号熟/烘焙卵蛋白质剂量(mg)累积剂量(mg)1125125225037535008754500137556252000
[0235]
虽然用本文所述的口服免疫疗法治疗的一些患者能够耐受熟卵蛋白质,但一些患者不能耐受任何或大量熟或烘焙卵蛋白质。在一些实施方案中,患者在治疗开始时耐受的熟卵蛋白质或烘焙卵蛋白质的最高剂量(即,最高耐受剂量)为约625mg或更少、约500mg或更少、约250mg或更少、或约125mg或更少。在一些实施方案中,患者在治疗开始时耐受的熟卵蛋白质或烘焙卵蛋白质的最高累积剂量(即,最高耐受剂量)为约2000mg或更少、约1375mg或更少、约875mg或更少、约375mg或更少、或约125mg或更少。
[0236]
口服免疫疗法治疗计划表
[0237]
通过根据口服免疫疗法(oit)计划表向患者口服多个剂量的包含卵清蛋白质的药物组合物来治疗患者的卵变态反应。oit计划表通常包括上调剂量阶段,然后是维持阶段。任选地,oit计划表还包括初始递增阶段,该阶段发生在上调剂量阶段开始之前。
[0238]
剂量可在包含药物组合物(本文也称为“卵清蛋白质制剂”)的一个或多个剂量容器(例如,胶囊或小袋)中提供。剂量容器通常不是整个摄入的,但通常在施用之前打开,并且口服食用包含在其中的药物组合物。药物组合物可与由患者食用的食物媒介物混合。示例性食物媒介物包括苹果酱、布丁、燕麦片、饮料(例如,奶昔)或与药物组合物混合的任何其他合适的食物产品。
[0239]
上调剂量阶段
[0240]
oit计划表的上调剂量阶段包括向患者口服施用一系列递增日剂量的卵清蛋白质。卵清蛋白质通常是生的,但其可以不影响蛋白质表位递呈的方式进行巴氏灭菌或以其他方式处理。卵清蛋白质包含在卵清蛋白质制剂内,该卵清蛋白质制剂可例如根据本文所述的方法制备。该剂量的卵清蛋白质优选地每天施用于患者,但如果患者经历与施用该卵清蛋白质有关的一个或多个不良事件或与对与施用该卵清蛋白质无关的变应原增加的敏感性相关联的并发因素(诸如特应性疾病发作、炎症、疾病、月经或患者对其具有变应性的食物的非预期暴露),则可跳过、延迟该剂量,或延迟部分的该剂量。
[0241]
卵清蛋白质的系列递增剂量通常在约1mg至约300mg的范围内。在剂量递增至较高剂量之前,每日向患者施用给定剂量(除非进行调整)持续至少两周的时间段。例如,由于与卵清蛋白质有关的不良事件或与对与该卵清蛋白质无关的变应原增加的敏感性相关联的一些其他并发因素,递增至更高的剂量可能花费长于两周的时间,这证明延迟增加剂量是合理的。只有当患者耐受先前剂量时,才递增在上调剂量阶段期间施用的剂量。因此,在一些情况下,相同的剂量可向患者施用超过两周,诸如三周或更多周、或者四周或更多周。为了确保剂量不会过快递增,上调剂量阶段通常持续约20周或更长时间,例如约20周至约44周。
[0242]
上调剂量阶段可包括向受试者施用可在约1mg至约300mg的范围内的4、5、6、7、8、9或10或更多种不同剂量。不同的剂量在该剂量范围内间隔开,但不需要均匀间隔开。可向受
试者施用的示例性剂量可包括约1mg、约3mg、约6mg、约12mg、约20mg、约40mg、约80mg、约120mg、约160mg、约200mg、约240mg和约300mg卵清蛋白质。在一些实施方案中,上调剂量阶段包括施用至少1mg剂量和300mg的卵清蛋白质。在一些实施方案中,在上调剂量阶段期间向患者施用的最大剂量为300mg卵清蛋白质。
[0243]
递增剂量优选地在临床环境(例如,医生办公室、医院或在发生中度或重度变应性不良事件时允许立即进行医疗响应的其他设施)中施用。例如,如果患者已完成了为期两周的80mg剂量的卵清蛋白质的每日施用,则可在临床环境中施用120mg剂量的卵清蛋白质。如果患者耐受递增剂量,则可在临床环境之外向受试者施用该剂量的以下剂量,诸如由患者在家中自行施用。
[0244]
维持阶段
[0245]
在上调剂量阶段之后,oit计划表包括维持阶段。维持阶段包括向患者施用一定剂量的卵清蛋白质一段时间,并且旨在治疗完成后维持脱敏状态。一般来讲,维持阶段的长度为约12周或更长,但它不需要有明确的终点。在一些实施方案中,维持剂量每天施用,但可对剂量施用进行调整,如本文所讨论的。
[0246]
维持阶段期间施用的卵清蛋白质剂量(即,“维持剂量”)通常是患者在上调剂量阶段期间获得的最高耐受剂量,但在某些情况下剂量可减少。例如,如果患者成功完成了包括施用300mg卵清蛋白质的上调剂量阶段,则维持剂量通常为300mg卵清蛋白质,但可减少。例如,如果患者经历与施用卵清蛋白质有关的一个或多个不良事件或与对与施用该卵清蛋白质无关的变应原增加的敏感性相关联的并发因素(诸如特应性疾病发作、炎症、疾病或月经),则可减少、跳过、延迟该维持剂量,或延迟一部分。
[0247]
初始递增阶段
[0248]
任选地,在oit计划表中,初始递增阶段先于上调剂量阶段。初始递增阶段包括在一天内向患者口服施用一系列递增剂量的卵清蛋白质。剂量相隔一段时间,通常为约20分钟或更长(诸如约20分钟至约60分钟,或约20分钟至约30分钟)。时间间隔允许在施用下一剂量之前监测患者与卵清蛋白质有关的不良事件。一般来讲,初始递增阶段发生在临床环境中。
[0249]
施用于受试者卵清蛋白质剂量可为例如约0.2mg卵清蛋白质至约2mg卵清蛋白质。初始递增阶段可包括2、3、4、5、6或更多个剂量。施用于受试者的示例性剂量可包括约0.2mg、约0.4mg、约0.8mg、约1.2mg和约2mg卵清蛋白质。在另一个示例性实施方案中,施用于受试者的剂量可包括约0.2mg、约0.4mg、约0.8mg、约1.0mg和约2mg卵清蛋白质。
[0250]
剂量调整
[0251]
如果患者经历与施用一定剂量的卵清蛋白质有关的不良事件(即,对该剂量的变应性应答)或与对与施用该剂量的卵清蛋白质无关的变应原增加的敏感性相关联的并发因素,则可稍微调整口服免疫疗法计划表。与施用卵清蛋白质有关的不良事件可为轻度变应原性不良事件、中度变应原性不良事件或重度变应原性不良事件。这种剂量调整可发生在oit计划表的上调剂量阶段或oit计划表的维持阶段期间。剂量调整可为减少剂量、跳过预定剂量施用、延迟部分的剂量或延迟剂量递增。通过调整剂量方案,经历更严重的不良事件(如果剂量响应于与施用卵清蛋白质有关的不良事件而调整)或经历不良事件或不良事件的严重程度(如果剂量响应于与施用卵清蛋白质无关的不良事件而调整)的风险降低。
[0252]
可能导致剂量调整的与施用卵清蛋白质有关的不良事件可为例如超敏反应、过敏症(例如过敏性休克)或胃肠道症状(诸如腹痛或呕吐)。图4示出了根据与施用卵清蛋白质有关的不良事件的严重程度来调整剂量的示例性决策树。
[0253]
可能导致剂量调整的与对变应原增加的敏感性相关联的并发因素可为将增强患者对变应原的敏感性的与施用药物组合物同时发生的任何事件或患者状态。这可能是由于例如由与对变应原增加的敏感性相关联的并发因素引起的免疫学变化。与对变应原增加的敏感性相关联的示例性并发因素包括特应性疾病(例如湿疹、哮喘或鼻结膜炎)的发作、对除卵清蛋白质之外的变应原的变应性反应、炎症(例如,由于手术或外伤性损伤)、疾病(诸如感染)和月经。并发因素也可为患者对其具有变应性的食物的非预期暴露(例如,食用)。患者对其具有变应性的食物可为卵,或者可为患者对其也具有变应性的一些其他食物,诸如牛奶、花生、树坚果、小麦、贝类或大豆。
[0254]
药物组合物的剂量可通过减少药物组合物的剂量来调整。剂量减少是暂时的,并且可在一段时间后增加,例如在不良事件或与对变应原增加的敏感性相关联的并发因素过去后增加。相对于先前施用的剂量,该剂量可减少至多约50%,或减少至低于50%的下一个可用剂量。在一些实施方案中,该剂量比先前施用的剂量减少1个剂量水平或2个剂量水平。在一些实施方案中,在临床环境中施用一个或多个(诸如第一)减少的剂量。一旦剂量减少,可在递增后续剂量之前,将减少的剂量施用于患者约一周或更长时间(诸如两周或更长时间、在约一周与约四周之间、或在约一周与约两周之间)。递增剂量优选地在临床环境中施用,使得可监测患者与药物组合物的施用有关的不良事件。应当尝试施用递增剂量,但如果导致变应性应答,则可继续向患者施用减少的剂量。
[0255]
在一些实施方案中,通过跳过一个或多个预定剂量的施用来调整剂量。例如,如果计划每天施用剂量,则可在重新开始施用药物组合物之前跳过一个、两个、三个或更多个日剂量。药物组合物的施用可以与先前施用相同的剂量或以减少的剂量恢复。如果跳过多于一个剂量,则通常优选的是在临床环境中施用于患者的下一个剂量。
[0256]
调整药物组合物的剂量可包括延迟部分的药物组合物的施用。例如,第一部分可按计划施用于患者,并且第二部分在下一计划剂量施用之前的时间施用于患者。在一些实施方案中,剂量分成两个近似相等的部分。第二部分可在施用第一部分后约8小时至约16小时、或约8小时至约12小时施用于患者。
[0257]
在上调剂量阶段期间,还可通过延迟施用于患者的剂量的预定递增来调整剂量施用。oit计划表通常具有预设的递增时间,诸如每两周一次。然而,如果患者正在经历不良事件或与对变应原增加的敏感性相关联的并发因素,则递增剂量水平可增加不良事件或更严重的不良事件的风险。因此,递增可被延迟,例如直到不良事件或并发因素消退。在一些实施方案中,递增可延迟约一周或更长、约两周或更长、或约三周或更长。
[0258]
在一个示例中,在用于受试者中的卵变态反应的口服免疫疗法期间调整包含卵清蛋白质的药物组合物的剂量的方法,该方法包括向患者口服施用第一剂量的药物组合物;以及向患者口服施用第二剂量的药物组合物,其中如果患者经历与施用第一剂量有关的不良事件,则减少、跳过第二剂量或延迟至少部分该剂量;其中该口服免疫疗法包括(i)上调剂量阶段,该上调剂量阶段包括向患者口服施用一系列递增剂量的卵清蛋白质,和(ii)维持阶段,该维持阶段包括向患者口服施用包含卵清蛋白质的多个维持剂量;该方法包括:如
果患者经历与施用第一剂量有关的不良事件,则延迟第二剂量可包括将第二剂量分成第一部分和第二部分,其中第一部分根据预定给药计划表施用,并且其中第二部分相对于预定给药计划表延迟(例如,延迟约8小时至约16小时,或延迟约8小时至约12小时)。在一些实施方案中,与施用第一剂量有关的不良事件为轻度变应原性不良事件、中度变应原性不良事件或重度变应原性不良事件。在一些实施方案中,第一剂量和第二剂量在上调剂量阶段期间施用于患者,并且在一些实施方案中,第一剂量和第二剂量在维持阶段期间施用于患者。
[0259]
在另一个示例中,在用于受试者中的卵变态反应的口服免疫疗法期间调整包含卵清蛋白质的药物组合物的剂量的方法,该方法包括向患者口服施用第一剂量的药物组合物;以及向患者口服施用第二剂量的药物组合物,其中如果患者经历与对与施用第一剂量无关的应变原增加的敏感性相关联的并发因素,则减少或跳过第二剂量,其中该口服免疫疗法包括(i)上调剂量阶段,该上调剂量阶段包括向患者口服施用一系列递增剂量的卵清蛋白质,和(ii)维持阶段,该维持阶段包括向患者口服施用包含卵清蛋白质的多个维持剂量;该方法包括:与对变应原增加的敏感性相关联的并发因素可为例如特应性疾病发作、炎症、疾病或月经。在一些实施方案中,第一剂量和第二剂量在口服免疫疗法的上调剂量阶段期间施用于患者,并且在一些实施方案中,第一剂量和第二剂量在口服免疫疗法的维持阶段期间施用于患者。
[0260]
口服免疫疗法治疗终点
[0261]
本文所述的口服免疫疗法旨在使患者对卵变应原脱敏,以降低由于意外暴露于卵清蛋白质而引起的不良变应性事件的风险。对生卵清蛋白质和/或熟卵蛋白质(熟卵清蛋白质或全卵蛋白质,诸如烘焙卵清蛋白质或烘焙全卵蛋白质)的脱敏程度可使用食物挑战来测量,如上文参考患者的基线特征所述。成功的治疗可通过治疗后与治疗开始时相比对生卵清蛋白质或熟(或烘焙)卵蛋白质的最高耐受剂量的增加或累积耐受剂量的增加来指示。
[0262]
在一些实施方案中,患者在上调剂量阶段结束后能够耐受约300mg生卵清蛋白质、约600mg生卵清蛋白质、约1000mg生卵清蛋白质或约2000mg生卵清蛋白质的剂量。在一些实施方案中,患者在维持阶段结束后能够耐受约300mg生卵清蛋白质、约600mg生卵清蛋白质、约1000mg生卵清蛋白质或约2000mg生卵清蛋白质的剂量。在一些实施方案中,患者在上调剂量阶段结束时能够耐受约444mg生卵清蛋白质、约1044mg生卵清蛋白质、约2044mg生卵清蛋白质或约4044mg生卵清蛋白质的累积剂量。在一些实施方案中,患者在维持阶段结束时能够耐受约444mg生卵清蛋白质、约1044mg生卵清蛋白质、约2044mg生卵清蛋白质或约4044mg生卵清蛋白质的累积剂量。
[0263]
在一些实施方案中,当患者在治疗开始时不能耐受约625mg熟(或烘焙)卵蛋白质、约500mg熟(或烘焙)卵蛋白质、约250mg熟(或烘焙)卵蛋白质或约125mg熟(或烘焙)卵蛋白质的剂量时,患者在上调剂量阶段结束时能够耐受约625mg熟(或烘焙)卵蛋白质的剂量。在一些实施方案中,当患者在治疗开始时不能耐受约625mg熟(或烘焙)卵蛋白质、约500mg熟(或烘焙)卵蛋白质、约250mg熟(或烘焙)卵蛋白质或约125mg熟(或烘焙)卵蛋白质的剂量时,患者在维持阶段结束时能够耐受约625mg熟(或烘焙)卵蛋白质的剂量。在一些实施方案中,患者在上调剂量阶段结束时能够耐受约2000mg熟(或烘焙)卵蛋白质的累积剂量,其中患者在治疗开始时不能耐受约2000mg熟(或烘焙)卵蛋白质、约1375mg熟(或烘焙)卵蛋白质、约875mg熟(或烘焙)卵蛋白质、约375mg熟(或烘焙)卵蛋白质或约125mg熟(或烘焙)卵蛋
白质的累积剂量。在一些实施方案中,患者在维持阶段结束时能够耐受约2000mg熟(或烘焙)卵蛋白质的累积剂量,其中患者在治疗开始时不能耐受约2000mg熟(或烘焙)卵蛋白质、约1375mg熟(或烘焙)卵蛋白质、约875mg熟(或烘焙)卵蛋白质、约375mg熟(或烘焙)卵蛋白质或约125mg熟(或烘焙)卵蛋白质的累积剂量。
[0264]
示例性实施方案
[0265]
以下实施方案为示例性的,并且不应被认为是对本文所述发明的限制。
[0266]
实施方案1:制备卵清蛋白质制剂的方法,所述方法包括:
[0267]
(a)将干燥卵清蛋白质粉末与第一量的第一稀释剂混合以形成第一混合物;
[0268]
(b)使所述第一混合物通过网筛;
[0269]
(c)在步骤(a)和(b)之后,将所述第一混合物与第二量的所述第一稀释剂混合以形成第二混合物;
[0270]
(d)将所述第二混合物与第二稀释剂混合以形成第三混合物;
[0271]
(e)将所述第三混合物以比步骤(c)中用于混合的剪切力更高的剪切力混合;以及
[0272]
(f)将所述第三混合物与润滑剂混合以形成所述卵清蛋白质制剂。
[0273]
实施方案2:根据实施方案1所述的方法,其中所述卵清蛋白质制剂具有约0.05重量%至约2.5重量%的卵清蛋白质。
[0274]
实施方案3:根据实施方案1或2所述的方法,其中所述卵清蛋白质制剂具有约0.1重量%至约0.7重量%的卵清蛋白质。
[0275]
实施方案4:根据实施方案1
‑
3中任一项所述的方法,其中步骤(b)包括使至少部分的所述第二量的所述第一稀释剂与所述第一混合物通过所述网筛。
[0276]
实施方案5:根据实施方案1
‑
3中任一项所述的方法,其中步骤(b)包括使所述第二量的所述第一稀释剂与所述第一混合物通过所述网筛。
[0277]
实施方案6:根据实施方案1
‑
5中任一项所述的方法,其中步骤(c)包括多个子步骤,其中每个子步骤包括(i)将部分的所述第二量的所述第一稀释剂添加到所述第一混合物中,以及(ii)将所述部分的所述第二量的所述第一稀释剂与所述第一混合物混合。
[0278]
实施方案7:根据实施方案6所述的方法,其中步骤(c)包括三个或更多个子步骤。
[0279]
实施方案8:根据实施方案1
‑
5中任一项所述的方法,其中步骤(c)包括在将所述第二量的所述第一稀释剂添加到所述第一混合物中时连续混合所述第一混合物和所述第二量的所述第一稀释剂。
[0280]
实施方案9:根据实施方案1
‑
8中任一项所述的方法,其中将所述第一混合物与所述第二量的所述第一稀释剂在转鼓式共混机中混合。
[0281]
实施方案10:根据实施方案1
‑
9中任一项所述的方法,其中将所述第二混合物与所述第二稀释剂在转鼓式共混机中混合。
[0282]
实施方案11:根据实施方案1
‑
10中任一项所述的方法,其中使用锥式磨机混合所述第三混合物。
[0283]
实施方案12:根据实施方案1
‑
11中任一项所述的方法,其中将所述第三混合物与所述润滑剂在转鼓式共混机中混合。
[0284]
实施方案13:根据实施方案1
‑
12中任一项所述的方法,其中将第三量的所述第一稀释剂与所述第三混合物混合。
[0285]
实施方案14:根据实施方案13所述的方法,其中将所述第三量的所述第一稀释剂和所述润滑剂与所述第三混合物共混合。
[0286]
实施方案15:根据实施方案1
‑
14中任一项所述的方法,包括在将所述润滑剂与所述第三混合物混合之前,将所述润滑剂与另外部分的所述第一稀释剂或所述第二稀释剂混合。
[0287]
实施方案16:根据实施方案15所述的方法,其中在将所述润滑剂与所述第三混合物混合之前,使所述润滑剂与另外部分的所述第一稀释剂或所述第二稀释剂的混合物通过网筛。
[0288]
实施方案17:制备卵清蛋白质制剂的方法,所述方法包括:
[0289]
(a)将干燥卵清蛋白质粉末与第一量的第一稀释剂混合以形成第一混合物;
[0290]
(b)通过网筛将所述第一混合物与所述第一稀释剂的第二部分共筛分以形成第二混合物;
[0291]
(c)使用一个或多个另外部分的所述第一稀释剂系列稀释所述第二混合物以形成第三混合物;
[0292]
(d)将所述第三混合物与第二稀释剂混合以形成第四混合物;
[0293]
(e)将另外部分的所述第一稀释剂或所述第二稀释剂与润滑剂混合以形成第五混合物;以及
[0294]
(f)将所述第四混合物与所述第五混合物混合。
[0295]
实施方案18:根据实施方案17所述的方法,包括在步骤(c)之前混合所述第二混合物。
[0296]
实施方案19:根据实施方案17或18所述的方法,包括在步骤(e)之前,使用比用于混合所述第三混合物与所述第二稀释剂的剪切力更高的剪切力来混合所述第四混合物。
[0297]
实施方案20:根据实施方案17
‑
19中任一项所述的方法,包括在步骤(f)之前筛分所述第五混合物。
[0298]
实施方案21:根据实施方案1
‑
20中任一项所述的方法,其中所述卵清蛋白质制剂基本上不含胶态二氧化硅。
[0299]
实施方案22:根据实施方案1
‑
21中任一项所述的方法,其中所述卵清蛋白质制剂具有约40重量%至约70重量%的所述第一稀释剂。
[0300]
实施方案23:根据实施方案1
‑
22中任一项所述的方法,其中所述卵清蛋白质制剂具有约30重量%至约50重量%的所述第二稀释剂。
[0301]
实施方案24:根据实施方案1
‑
23中任一项所述的方法,其中所述卵清蛋白质制剂具有约0.1重量%至约2重量%的所述润滑剂。
[0302]
实施方案25:制备卵清蛋白质制剂的方法,所述方法包括:
[0303]
(a)将干燥卵清蛋白质粉末与第一量的第一稀释剂混合以形成第一混合物;
[0304]
(b)将第二量的所述第一稀释剂与所述第一混合物混合以形成第二混合物;
[0305]
(c)将所述第二混合物与第二稀释剂混合以形成第三混合物;
[0306]
(d)将所述第三混合物以比步骤(b)中用于混合的剪切力更高的剪切力混合;以及
[0307]
(e)将所述第三混合物与润滑剂混合以形成所述卵清蛋白质制剂。
[0308]
实施方案26:根据实施方案25所述的方法,其中在步骤(a)中以比步骤(b)中用于
混合的剪切力更高的剪切力将干燥卵清蛋白质粉末与第一量的第一稀释剂混合。
[0309]
实施方案27:根据实施方案25或26所述的方法,其中所述卵清蛋白质制剂具有约1重量%至约70重量%的卵清蛋白质。
[0310]
实施方案28:根据实施方案25
‑
27中任一项所述的方法,在步骤(a)中使用锥式磨机将所述干燥卵清蛋白质粉末与所述第一量的所述第一稀释剂混合。
[0311]
实施方案29:根据实施方案25
‑
28中任一项所述的方法,其中步骤(b)包括两个混合子步骤,其中一个混合子步骤处于比另一个混合子步骤更高的剪切力。
[0312]
实施方案30:根据实施方案25
‑
29中任一项所述的方法,其中步骤(c)还包括在与所述第二稀释剂混合以形成所述第三混合物之前,将所述第二混合物与另外量的所述第一稀释剂混合。
[0313]
实施方案31:根据实施方案25
‑
29中任一项所述的方法,其中步骤(c)还包括将所述第二混合物与另外量的所述第一稀释剂和所述第二稀释剂共混合以形成所述第三混合物。
[0314]
实施方案32:根据实施方案25
‑
31中任一项所述的方法,在步骤(d)中使用锥式磨机混合所述第三混合物。
[0315]
实施方案33:根据实施方案25
‑
32中任一项所述的方法,其中将所述第二量的所述第一稀释剂和所述第一混合物在转鼓式共混机中混合。
[0316]
实施方案34:根据实施方案25
‑
33中任一项所述的方法,其中将所述第二混合物与所述第二稀释剂在转鼓式共混机中混合。
[0317]
实施方案35:根据实施方案25
‑
33中任一项所述的方法,其中将第三量的所述第一稀释剂与所述第三混合物混合。
[0318]
实施方案36:根据实施方案35所述的方法,其中所述第三量的所述第一稀释剂和所述润滑剂与所述第三混合物共混合。
[0319]
实施方案37:根据实施方案25
‑
36中任一项所述的方法,其中步骤(e)包括:(i)将部分的所述第三混合物与润滑剂混合;(ii)使(i)所述部分的所述混合物通过网筛;以及(iii)将(ii)的所述混合物与另外部分的所述第三混合物混合以形成所述卵清蛋白质制剂。
[0320]
实施方案38:根据实施方案25
‑
37中任一项所述的方法,其中将所述第三混合物与所述润滑剂在转鼓式共混机中混合。
[0321]
实施方案39:根据实施方案25
‑
38中任一项所述的方法,其中所述卵清蛋白质制剂具有约9重量%至约85重量%的所述第一稀释剂。
[0322]
实施方案40:根据实施方案25
‑
39中任一项所述的方法,其中所述卵清蛋白质制剂具有约10重量%至约50重量%的所述第二稀释剂。
[0323]
实施方案41:根据实施方案25
‑
40中任一项所述的方法,其中所述卵清蛋白质制剂具有约10重量%至约20重量%的所述第二稀释剂。
[0324]
实施方案42:根据实施方案25
‑
41中任一项所述的方法,其中所述卵清蛋白质制剂具有约0.1重量%至约2重量%的所述润滑剂。
[0325]
实施方案43:根据实施方案25
‑
42中任一项所述的方法,其中所述卵清蛋白质制剂包含助流剂。
[0326]
实施方案44:根据实施方案43所述的方法,其中在步骤(a)期间或之前,将所述助流剂与所述卵清蛋白质粉末和所述第一量的所述第一稀释剂混合。
[0327]
实施方案45:根据实施方案43或44所述的方法,其中所述助流剂为胶态二氧化硅。
[0328]
实施方案46:根据实施方案25
‑
45中任一项所述的方法,其中所述卵清蛋白质制剂具有约2重量%至约70重量%的卵清蛋白质。
[0329]
实施方案47:根据实施方案25
‑
44中任一项所述的方法,其中所述卵清蛋白质制剂基本上不含胶态二氧化硅。
[0330]
实施方案48:根据实施方案47所述的方法,其中所述卵清蛋白质制剂具有约1重量%至约5重量%的卵清蛋白质。
[0331]
实施方案49:制备卵清蛋白质制剂的方法,所述方法包括:
[0332]
(a)将干燥卵清蛋白质粉末、第一稀释剂和助流剂混合以形成第一混合物;
[0333]
(b)以比步骤(a)中用于混合的剪切力更高的剪切力将第二稀释剂与第一混合物混合以形成第二混合物;
[0334]
(c)将第二混合物与润滑剂混合以形成卵清蛋白质制剂。
[0335]
实施方案50:根据实施方案49所述的方法,其中所述卵清蛋白质制剂具有约50重量%至约80重量%的卵清蛋白质。
[0336]
实施方案51:根据实施方案49或50所述的方法,其中将所述干燥卵清蛋白质粉末、所述第一稀释剂和所述助流剂在转鼓式共混机中混合。
[0337]
实施方案52:根据实施方案49
‑
51中任一项所述的方法,其中在步骤(b)中使用锥式磨机混合所述第二稀释剂和所述第一混合物。
[0338]
实施方案53:根据实施方案49
‑
52中任一项所述的方法,其中将所述第二混合物和所述润滑剂在转鼓式共混机中混合。
[0339]
实施方案54:根据实施方案49
‑
53中任一项所述的方法,其中将第二量的所述第一稀释剂与所述第二混合物混合。
[0340]
实施方案55:根据实施方案54所述的方法,其中将所述第二量的所述第一稀释剂和所述润滑剂与所述第二混合物共混合。
[0341]
实施方案56:根据实施方案49
‑
55中任一项所述的方法,其中所述助流剂包括胶态二氧化硅。
[0342]
实施方案57:根据实施方案49
‑
56中任一项所述的方法,其中步骤(c)包括:(i)将部分的所述第二混合物与所述润滑剂混合;(ii)使所述部分的所述第二混合物和所述润滑剂通过网筛;以及(iii)将(ii)与另外部分的所述第二混合物混合以形成所述卵清蛋白质制剂。
[0343]
实施方案58:根据实施方案1
‑
57中任一项所述的方法,其中所述卵清蛋白质制剂以约5kg或更大的批次大小制备。
[0344]
实施方案59:根据实施方案58所述的方法,其中所述卵清蛋白质制剂以约5kg至约50kg的批次大小制备。
[0345]
实施方案60:根据实施方案1
‑
59中任一项所述的方法,包括测定所述卵清蛋白质制剂的卵清蛋白质共混物均匀度。
[0346]
实施方案61:根据实施方案1
‑
60中任一项所述的方法,其中所述卵清蛋白质制剂
具有约15%或更小的卵清蛋白质共混物均匀度相对标准偏差(rsd)。
[0347]
实施方案62:根据实施方案1
‑
61中任一项所述的方法,包括将所述卵清蛋白质制剂包装在多个剂量容器中。
[0348]
实施方案63:根据实施方案62所述的方法,其中所述剂量容器为胶囊或小袋。
[0349]
实施方案64:根据实施方案62或63所述的方法,包括测定所述多个剂量容器的卵清蛋白质含量均匀度。
[0350]
实施方案65:根据实施方案62
‑
64中任一项所述的方法,其中所述多个剂量容器具有约15%或更小的卵清蛋白质含量均匀度相对标准偏差(rds)。
[0351]
实施方案66:根据实施方案1
‑
65中任一项所述的方法,其中所述第一稀释剂为预胶化淀粉。
[0352]
实施方案67:根据实施方案1
‑
66中任一项所述的方法,其中所述第二稀释剂为微晶纤维素。
[0353]
实施方案68:根据实施方案1
‑
67中任一项所述的方法,其中所述润滑剂为硬脂酸镁。
[0354]
实施方案69:根据实施方案1
‑
68中任一项所述的方法,其中所述干燥卵清蛋白质粉末包含约50重量%至约90重量%的卵清蛋白质。
[0355]
实施方案70:根据实施方案1
‑
69中任一项所述的方法,其中所述干燥卵清蛋白质粉末的形成包括喷雾干燥液体卵清。
[0356]
实施方案71:根据实施方案1
‑
70中任一项所述的方法,其中所述卵清蛋白质粉末已去除葡萄糖。
[0357]
实施方案72:根据实施方案1
‑
71中任一项所述的方法,其中所述干燥卵清蛋白质粉末已经过巴氏灭菌。
[0358]
实施方案73:根据实施方案1
‑
72中任一项所述的方法,其中所述干燥卵清蛋白质粉末来源于鸡蛋。
[0359]
实施方案74:根据实施方案1
‑
73中任一项所述的方法,还包括表征所述干燥卵清蛋白质粉末中的类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶。
[0360]
实施方案75:根据实施方案1
‑
74中任一项所述的方法,还包括表征所述卵清蛋白质制剂中的类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶。
[0361]
实施方案76:根据实施方案74或75所述的方法,其中表征类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶包括获得高效液相色谱(hplc)图谱。
[0362]
实施方案77:根据实施方案76所述的方法,其中所述hplc图谱为反相hplc(rp
‑
hplc)图谱。
[0363]
实施方案78:根据实施方案76所述的方法,其中所述hplc图谱为尺寸排阻色谱hplc(sec
‑
hplc)图谱。
[0364]
实施方案79:根据实施方案76
‑
78中任一项所述的方法,包括将所获得的hplc图谱与参考hplc图谱进行比较。
[0365]
实施方案80:根据实施方案74
‑
79中任一项所述的方法,其中表征类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶包括对类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶的量进行定量。
[0366]
实施方案81:根据实施方案80所述的方法,其中对类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶的所述量进行定量包括测量类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶与所述卵清蛋白质粉末或所述卵清蛋白质制剂中总蛋白质相比的量。
[0367]
实施方案82:根据实施方案80所述的方法,其中对类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶的所述量进行定量包括测量类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶与所述卵清蛋白质粉末或所述卵清蛋白质制剂中类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶的总量相比的量。
[0368]
实施方案83:根据实施方案74
‑
82中任一项所述的方法,其中表征类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶包括测量类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶在所述卵清蛋白质粉末或所述卵清蛋白质制剂中的效能。
[0369]
实施方案84:根据实施方案83所述的方法,其中类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶在所述卵清蛋白质粉末或所述卵清蛋白质制剂中的所述效能相对于类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶在参考样品中的效能进行测量。
[0370]
实施方案85:根据实施方案83或84所述的方法,其中使用免疫测定测量类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶的所述效能。
[0371]
实施方案86:根据实施方案85所述的方法,其中所述免疫测定包括使用特异性结合类卵粘蛋白的抗体、特异性结合卵清蛋白的抗体、特异性结合卵转铁蛋白的抗体或特异性结合溶菌酶的抗体中的一种或多种。
[0372]
实施方案87:根据实施方案85所述的方法,其中所述免疫测定包括使用包含两种或更多种选自由以下项组成的组的抗体的抗体库:特异性结合类卵粘蛋白的抗体、特异性结合卵清蛋白的抗体、特异性结合卵转铁蛋白的抗体和特异性结合溶菌酶的抗体。
[0373]
实施方案88:根据实施方案86和87所述的方法,其中所述抗体为ige抗体或igg抗体。
[0374]
实施方案89:根据实施方案84
‑
88中任一项所述的方法,其中类卵粘蛋白、卵清蛋白、卵转铁蛋白或溶菌酶的所述效能使用酶联免疫吸附测定(elisa)来测量。
[0375]
实施方案90:卵清蛋白质制剂,所述卵清蛋白质制剂根据实施方案1
‑
89中任一项所述的方法制备。
[0376]
实施方案91:卵清蛋白质制剂,所述卵清蛋白质制剂包含干燥卵清蛋白质粉末、第一稀释剂、第二稀释剂和润滑剂,其中所述卵清蛋白质制剂基本上不含胶态二氧化硅。
[0377]
实施方案92:根据实施方案91所述的卵清蛋白质制剂,其中所述卵清蛋白质制剂包含约0.1重量%至约3.5重量%的卵清蛋白质。
[0378]
实施方案93:根据实施方案91或92所述的卵清蛋白质制剂,其中所述第一稀释剂为预胶化淀粉。
[0379]
实施方案94:根据实施方案91
‑
93中任一项所述的卵清蛋白质制剂,其中所述第二稀释剂为微晶纤维素。
[0380]
实施方案95:根据实施方案91
‑
94中任一项所述的卵清蛋白质制剂,其中所述润滑剂为硬脂酸镁。
[0381]
实施方案96:根据实施方案91
‑
95中任一项所述的卵清蛋白质制剂,其中所述卵清蛋白质制剂基本上由所述卵清蛋白质粉末、所述第一稀释剂、所述第二稀释剂和所述润滑
剂组成。
[0382]
实施方案97:治疗患者中的卵变态反应的方法,包括:
[0383]
根据口服免疫疗法计划表向所述患者口服施用多个剂量的包含卵清蛋白质的药物组合物,所述口服免疫疗法计划表包括:
[0384]
(a)上调剂量阶段,所述上调剂量阶段包括向所述患者口服施用一系列约1mg至约300mg的卵清蛋白质的递增剂量,其中在所述剂量递增之前向所述患者施用给定剂量至少两周,并且其中所述上调剂量阶段的长度为约20周至约44周;以及
[0385]
(b)维持阶段,所述维持阶段包括向所述患者口服施用包含卵清蛋白质的多个维持剂量,其中所述维持阶段的长度为约12周或更长。
[0386]
实施方案98:根据实施方案97所述的方法,其中所述患者在治疗开始时具有约7kua/l或更高的卵清特异性血清ige(ew
‑
ige)水平。
[0387]
实施方案99:根据实施方案97所述的方法,其中所述患者在治疗开始时具有约5kua/l或更高的卵清特异性血清ige(ew
‑
ige)水平。
[0388]
实施方案100:根据实施方案97
‑
99中任一项所述的方法,其中在所述上调剂量阶段期间向所述患者施用的所述一系列递增剂量包括至少1mg剂量的卵清蛋白质和300mg剂量的卵清蛋白质。
[0389]
实施方案101:根据实施方案97
‑
100中任一项所述的方法,其中在所述上调剂量阶段期间向所述患者施用的所述一系列递增剂量包括至少10种不同剂量的卵清蛋白质。
[0390]
实施方案102:根据实施方案97
‑
101中任一项所述的方法,其中在所述上调剂量阶段期间向所述患者施用的所述一系列递增剂量包括约1mg、约3mg、约6mg、约12mg、约20mg、约40mg、约80mg、约120mg、约160mg、约200mg、约240mg和约300mg卵清蛋白质的剂量。
[0391]
实施方案103:根据实施方案97
‑
102中任一项所述的方法,其中只有当所述患者耐受所述先前剂量时,才递增在所述上调剂量阶段期间施用的剂量。
[0392]
实施方案104:根据实施方案97
‑
103中任一项所述的方法,其中在所述上调剂量阶段期间向所述患者施用的最大剂量为约300mg卵清蛋白质。
[0393]
实施方案105:根据实施方案97
‑
104中任一项所述的方法,其中在所述维持阶段期间向所述患者施用的维持剂量为约300mg卵清蛋白质或更多。
[0394]
实施方案106:根据实施方案97
‑
105中任一项所述的方法,其中在所述维持阶段期间向所述患者施用的维持剂量为约300mg卵清蛋白质。
[0395]
实施方案107:根据实施方案97
‑
106中任一项所述的方法,其中只有当所述患者在所述上调剂量阶段期间耐受向所述患者施用的所述最大剂量时,才向所述患者施用所述维持剂量。
[0396]
实施方案108:根据实施方案97
‑
107中任一项所述的方法,其中所述患者在所述维持阶段结束时耐受约600mg生卵清蛋白质的剂量。
[0397]
实施方案109:根据实施方案97
‑
108中任一项所述的方法,其中所述患者在所述维持阶段结束时耐受约1000mg生卵清蛋白质的剂量。
[0398]
实施方案110:根据实施方案97
‑
109中任一项所述的方法,其中所述患者在所述维持阶段结束时耐受约2000mg生卵清蛋白质的剂量。
[0399]
实施方案111:根据实施方案97
‑
110中任一项所述的方法,其中所述患者在所述维
持阶段结束时耐受约2000mg熟卵清蛋白质的累积剂量。
[0400]
实施方案112:根据实施方案97
‑
111中任一项所述的方法,其中所述患者在所述维持阶段结束时耐受约2000mg烘焙卵清蛋白质的累积剂量。
[0401]
实施方案113:根据实施方案97
‑
112中任一项所述的方法,其中所述患者在治疗开始之前不能耐受约300mg生卵清蛋白质的剂量。
[0402]
实施方案114:根据实施方案97
‑
113中任一项所述的方法,其中所述患者在治疗开始之前不能耐受约2000mg熟卵清蛋白质的累积剂量。
[0403]
实施方案115:根据实施方案97
‑
114中任一项所述的方法,其中所述患者在治疗开始之前不能耐受约2000mg烘焙卵清蛋白质的累积剂量。
[0404]
实施方案116:根据实施方案97
‑
113中任一项所述的方法,其中所述患者在治疗开始之前耐受约2000mg熟卵清蛋白质的累积剂量。
[0405]
实施方案117:根据实施方案97
‑
113和116中任一项所述的方法,其中所述患者在治疗开始之前耐受约2000mg烘焙卵清蛋白质的累积剂量。
[0406]
实施方案118:根据实施方案97
‑
117中任一项所述的方法,其中所述口服免疫疗法计划表包括在所述上调剂量阶段之前的初始递增阶段,所述初始递增阶段包括在一天内向所述患者口服施用一系列递增剂量的约0.2mg至约2mg的卵清蛋白质,其中向所述患者施用任何给定剂量的单次施用,并且其中所述剂量间隔至少15分钟。
[0407]
实施方案119:根据实施方案118所述的方法,其中只有当所述患者在治疗的第一天耐受约1.0mg生卵清蛋白质的剂量时,才根据所述口服免疫疗法计划表对所述患者进行治疗。
[0408]
实施方案120:根据实施方案97
‑
119中任一项所述的方法,其中所述患者在所述治疗开始之前为约4岁或以上。
[0409]
实施方案121:根据实施方案97
‑
120中任一项所述的方法,其中所述患者在治疗开始之前为约4岁至约26岁。
[0410]
实施方案122:在用于受试者中的卵变态反应的口服免疫疗法期间调整包含卵清蛋白质的药物组合物的剂量的方法,所述口服免疫疗法包括(i)上调剂量阶段,所述上调剂量阶段包括向所述患者口服施用一系列递增剂量的所述卵清蛋白质,和(ii)维持阶段,所述维持阶段包括向所述患者口服施用包含所述卵清蛋白质的多个维持剂量;所述方法包括:
[0411]
向所述患者口服施用第一剂量的所述药物组合物;以及
[0412]
向所述患者口服施用第二剂量的所述药物组合物,其中如果所述患者经历与施用所述第一剂量有关的不良事件,则减少、跳过所述第二剂量或者延迟至少部分所述剂量。
[0413]
实施方案123:根据实施方案122所述的方法,其中如果所述患者经历与施用所述第一剂量有关的不良事件,则所述第二剂量被分成第一部分和第二部分,其中所述第一部分根据预定给药计划表施用,并且其中所述第二部分相对于所述预定给药计划表延迟。
[0414]
实施方案124:根据实施方案123所述的方法,其中所述第二部分在施用所述第一部分后延迟约8小时至约12小时。
[0415]
实施方案125:根据实施方案122所述的方法,其中如果所述患者经历与施用所述第一剂量有关的不良事件,则跳过所述第二剂量。
[0416]
实施方案126:根据实施方案122所述的方法,其中如果所述患者经历与施用所述第一剂量有关的不良事件,则所述第二剂量相对于所述第一剂量减少。
[0417]
实施方案127:根据实施方案126所述的方法,其中在递增所述药物组合物的后续剂量之前,所述后续剂量相对于所述第一剂量减少约一周或更长时间。
[0418]
实施方案128:根据实施方案126或127所述的方法,其中在尝试递增所述药物组合物的后续剂量之前,所述后续剂量相对于所述第一剂量减少约一周至约两周。
[0419]
实施方案129:根据实施方案126
‑
128中任一项所述的方法,其中在递增所述药物组合物的后续剂量之前,所述后续剂量相对于所述第一剂量减少约一周至约两周。
[0420]
实施方案130:根据实施方案122
‑
129中任一项所述的方法,其中与施用所述第一剂量有关的所述不良事件为轻度变应原性不良事件。
[0421]
实施方案131:根据实施方案122
‑
130中任一项所述的方法,其中与施用所述第一剂量有关的所述不良事件为中度变应原性不良事件或重度变应原性不良事件。
[0422]
实施方案132:根据实施方案122
‑
131中任一项所述的方法,其中所述第一剂量和所述第二剂量在所述口服免疫疗法的所述上调剂量阶段期间施用于所述患者。
[0423]
实施方案133:根据实施方案122
‑
131中任一项所述的方法,其中所述第一剂量和所述第二剂量在所述口服免疫疗法的所述维持阶段期间施用于所述患者。
[0424]
实施方案134:在用于受试者中的卵变态反应的口服免疫疗法期间调整包含卵清蛋白质的药物组合物的剂量的方法,所述口服免疫疗法包括(i)上调剂量阶段,所述上调剂量阶段包括向所述患者口服施用一系列递增剂量的所述卵清蛋白质,和(ii)维持阶段,所述维持阶段包括向所述患者口服施用包含所述卵清蛋白质的多个维持剂量;所述方法包括:
[0425]
向所述患者口服施用第一剂量的所述药物组合物;以及
[0426]
向所述患者口服施用第二剂量的所述药物组合物,其中如果所述患者经历与对与施用所述第一剂量无关的变应原增加的敏感性相关联的并发因素,则减少或跳过所述第二剂量。
[0427]
实施方案135:根据实施方案134所述的方法,其中与对变应原增加的敏感性相关联的所述并发因素为特应性疾病发作、炎症、疾病或月经。
[0428]
实施方案136:根据实施方案134或135所述的方法,其中如果所述患者经历与对与施用所述第一剂量无关的变应原增加的敏感性相关联的并发因素,则跳过所述第二剂量。
[0429]
实施方案137:根据实施方案134或135所述的方法,其中如果所述患者经历与对与施用所述第一剂量无关的变应原增加的敏感性相关联的并发因素,则所述第二剂量相对于所述第一剂量减少。
[0430]
实施方案138:根据实施方案137所述的方法,其中在递增所述药物组合物的后续剂量之前,所述后续剂量相对于所述第一剂量减少约一周或更长时间。
[0431]
实施方案139:根据实施方案137或138所述的方法,其中在尝试递增所述药物组合物的后续剂量之前,所述后续剂量相对于所述第一剂量减少约一周至约两周。
[0432]
实施方案140:根据实施方案137
‑
139中任一项所述的方法,其中在递增所述药物组合物的后续剂量之前,所述后续剂量相对于所述第一剂量减少约一周至约两周。
[0433]
实施方案141:根据实施方案134
‑
140中任一项所述的方法,其中所述第一剂量和
所述第二剂量在所述口服免疫疗法的所述上调剂量阶段期间施用于所述患者。
[0434]
实施方案142:根据实施方案134
‑
141中任一项所述的方法,其中所述第一剂量和所述第二剂量在所述口服免疫疗法的所述维持阶段期间施用于所述患者。
[0435]
实施方案143:根据实施方案134
‑
142中任一项所述的方法,其中与对变应原增加的敏感性相关联的并发因素为所述患者对其具有变应性的食物的非预期暴露。
[0436]
实施方案144:根据实施方案97
‑
143中任一项所述的方法,其中所述药物组合物中的所述卵清蛋白质为生卵清蛋白质。
[0437]
实施方案145:根据实施方案97
‑
144中任一项所述的方法,其中在施用之前将所述药物组合物与食物媒介物混合。
[0438]
实施方案146:用于根据实施方案97
‑
145中任一项所述的方法中的药物组合物。
[0439]
实施方案147:根据实施方案146所述的药物组合物,其中所述药物组合物包含根据实施方案1
‑
96中任一项所述的方法制备的卵清蛋白质制剂。
[0440]
实施方案148:药物组合物,其用于制备用于根据实施方案97
‑
145中任一项所述的方法治疗患者中的卵变态反应的方法的药物。
[0441]
实施方案149:根据实施方案148所述的药物组合物,其中所述药物组合物包含根据实施方案1
‑
96中任一项所述的方法制备的卵清蛋白质制剂。
[0442]
实施例
[0443]
通过参考作为本技术的示例性实施方案提供的以下非限制性示例,可更好地理解本技术。给出以下实施例是为了更全面地说明实施方案,然而,决不应被解释为限制本技术的广泛范围。虽然本文已示出和描述了本技术的某些实施方案,但显而易见的是,此类实施方案仅以举例的方式提供。在不脱离本发明的实质和范围的情况下,本领域的技术人员可想到许多变型、改变和替换。应当理解,在实施本文所述的方法时,可采用本文所述实施方案的各种替代形式。
[0444]
实施例1:干燥卵清蛋白质粉末的表征
[0445]
许多干燥卵清蛋白质粉末得自商业供应商并进行分析以评估用于制备卵清蛋白质制剂的粉末的质量。某些表征方法包括将来自一批或多批干燥卵清蛋白质粉末的样品与参考标准品进行比较。参考标准品是随时间推移监测的并且发现具有稳定特征的干燥卵清蛋白质粉末的样品。
[0446]
通过二喹啉甲酸(bca)测定(一种总蛋白质定量方法)测量干燥卵清蛋白质粉末中的蛋白质含量。在水中制备样品,离心,并过滤上清液。然后将上清液添加至96孔微孔板,并将bca试剂添加至每个孔。在37℃处培养包含样品的等分试样和参考标准品的若干稀释液的板。在562nm处测量吸光度,并且相对于参考标准曲线评估样品吸光度以确定干燥卵清蛋白质粉末样品中的蛋白质浓度。以干燥卵清蛋白质粉末中的蛋白质重量与干燥卵清蛋白质粉末的总重量相比的百分比报告的蛋白质含量报告于表3中。
[0447]
表3:药物物质批次中的总蛋白质
[0448] 批次a批次b蛋白质含量(重量%)75%75%
[0449]
使用尺寸排阻色谱(sec
‑
hplc)作为建立变应原性蛋白质的hplc谱图的一种方法,以及测定干燥卵清蛋白质粉末的蛋白质含量的正交方法。流动相是磷酸盐缓冲盐水溶液
(ph6.8),其也用于溶解干燥卵清粉末样品。在220nm处测量柱洗脱液的吸光度。先前已通过注射四种卵清变应原性蛋白质的可商购获得的纯化参考产品来确定峰的身份:卵清蛋白(ova)、类卵粘蛋白(ovm)、卵转铁蛋白(ovt)和溶菌酶(lys)。sec
‑
hplc色谱图在图5中示出,其中鉴定出卵转铁蛋白、类卵粘蛋白、卵清蛋白和溶菌酶峰。剩余的峰尚未被鉴定。表4给出了两批干燥卵清蛋白质粉末的四个卵清变应原峰的峰面积百分比。尽管类卵粘蛋白和卵清蛋白具有由它们的氨基酸序列测定的不同分子量,但它们使用这种sec
‑
hplc方法共洗脱。这可能是由于蛋白质糖基化和蛋白质结构赋予它们相似的表观分子量和保留时间。
[0450]
表4:sec
‑
hplc色谱图中的峰面积百分比
[0451]
卵清蛋白质批次c批次d卵转铁蛋白1113卵清蛋白和类卵粘蛋白6675溶菌酶3.4未积分
[0452]
为了提高分辨率并允许变应原在卵清中的物理分离,开发了反相hplc(rp
‑
hplc)方法。rp
‑
hplc方法基于使用宽孔c4柱的反相分离。采用二元流动相梯度(流动相a:0.05%tfa的水溶液;流动相b:0.05%tfa和5%水的乙腈溶液)以实现干燥卵清蛋白质粉末中变应原性蛋白质的基线分离。用uv检测器在210nm的波长处收集数据。通过将来自干燥卵清蛋白质粉末样品的色谱峰与商业纯化的卵转铁蛋白、卵清蛋白、类卵粘蛋白和溶菌酶蛋白质标准品进行比较来鉴定色谱峰。如图6所示,rp
‑
hplc解析了卵转铁蛋白、卵清蛋白、类卵粘蛋白和溶菌酶色谱峰。表5中示出了如通过色谱峰面积测定的干燥卵清蛋白质粉末参考标准品以及批次a和批次b的干燥卵清蛋白质粉末中类卵粘蛋白、溶菌酶、卵转铁蛋白和卵清蛋白中的每一者的相对量(与总蛋白质的量相比)。
[0453]
表5:变应原性卵清蛋白质的相对量(峰面积百分比)
[0454][0455]
变应原性卵清蛋白质通过sds
‑
page进一步表征。将干燥卵清蛋白质粉末中的蛋白质用水提取,使用二硫苏糖醇还原,并使用三甘氨酸凝胶(4%
‑
20%梯度)分离。使用考马斯蓝染色检测蛋白质谱带。从商业来源获得纯化的卵清蛋白质变应原(类卵粘蛋白、卵清蛋白、溶菌酶和卵转铁蛋白)并将其用作分析的比较标准品。sds
‑
page数据(图7)证实了所分析的样品中4种卵清蛋白质变应原组分的存在,从而为sec
‑
hplc和rp
‑
hplc数据提供了另外的蛋白质图谱数据。另外,所有谱带的染色模式和强度在批次之间是一致的。图7中所示的sds
‑
page凝胶的上样列于表6中。
[0456]
表6:上样到图7的sds
‑
page凝胶和图8的免疫印迹
[0457]
泳道123456样品缓冲剂mwm批次a参考标准品批次d缓冲剂泳道789101112
样品ovmovalysovtmwm缓冲剂
[0458]
mwm,分子量标记物;ref.std.,参考标准品;ovm,类卵粘蛋白;ova,卵清蛋白;lys,溶菌酶;ovt,卵转铁蛋白。
[0459]
还进行了干燥卵清蛋白质粉末的免疫印迹分析,以进一步表征干燥卵清蛋白质粉末中的变应原性卵清蛋白质。作为sds
‑
page,如上所述形成凝胶(参见表6)。将分离的蛋白质谱带从凝胶转移至pvdf膜,并用5%脱脂乳封闭缓冲剂封闭该膜。然后用来自用卵清蛋白、类卵粘蛋白、卵转铁蛋白或溶菌酶中的一者免疫的兔的合并血清处理该膜。如图8所示,对于三批干燥卵清蛋白质粉末,蛋白质谱带分布和强度在各批之间是一致的,在预期分子量处具有谱带并且对于卵清蛋白质变应原具有类似的免疫反应性模式。
[0460]
elisa用于测定相对于参考标准品来自批次a和批次b的干燥卵清蛋白质粉末中的类卵粘蛋白的相对效能。在室温处在磷酸盐缓冲盐水(pbs)中提取干燥卵清蛋白质粉末样品中的蛋白质,将其涡旋、离心并过滤,然后系列稀释并吸附到elisa板上。然后将板用5%脱脂乳封闭,洗涤,并与一抗(兔抗类卵粘蛋白igg)一起温育。依次地,再次洗涤板,引入缀合至辣根过氧化物酶的二抗,然后添加tmb底物。通过比色反应测定样品中抗类卵粘蛋白与类卵粘蛋白的结合程度。用逻辑曲线拟合公式(例如,4参数曲线拟合)拟合数据,并且测定ec
50
值。ec
50
值反映了类卵粘蛋白在干燥卵清蛋白质粉末批次中的效能,并且基于ec
50
值的比率计算干燥卵清蛋白质粉末的相对效能(表7)。具体地,所用的4参数曲线拟合公式为y=(a
–
d)/(1 (x/c)
b
) d,其中a为最小渐近线,b为曲线斜率的变化,c为曲线的拐点(c表示对应于下渐近线和上渐近线之间的中间响应的半最大有效浓度(ec
50
),并且d为最大渐近线。通过将参考标准品的ec
50
除以样品的ec
50
,得到样品的相对效能。参考标准品可例如来自先前验证批次的干燥卵清蛋白质粉末或先前验证批次的药物组合物。
[0461]
表7:干燥卵清蛋白质粉末批次的相对效能
[0462]
批次相对效能a1.0b1.2
[0463]
使用激光衍射测量干燥卵清蛋白质粉末批次的粒度分布。将干燥卵清蛋白质粉末分散在甲醇中,泵送通过流动池,并通过激光衍射进行分析。测定d
50
(中值粒径,按颗粒体积计)、d
10
(第10百分位数处的粒径,按颗粒体积计)和d
90
(第90百分位数处的粒径,按颗粒体积计),并在表8中给出。
[0464]
表8:干燥卵清蛋白质粉末的粒度分布
[0465]
粒度参考标准品批次a批次bd
10
(μm)151412d
50
(μm)777466d
90
(μm)170166162
[0466]
通过将5g干燥卵清蛋白质粉末置于样品杯中并将其置于水活度仪(aqualab 4tev)中来测量干燥卵清蛋白质粉末的水活度。在仪器的密封室内,使样品中水的液相和气相在25℃处平衡以得到a
w
,即顶部空间的相对湿度。该测定的结果示于表9中。
[0467]
表9:干燥卵清蛋白质粉末的水活度
[0468][0469]
实施例2:用于卵清蛋白质制剂的赋形剂的评估
[0470]
在制剂和工艺开发期间,制备了五批卵清蛋白质制剂并将其封装在胶囊剂型中。制剂被制备成在0或00号胶囊中产生200mg或300mg剂量。每种制剂的含量和测量的特征示于表10中。卵清蛋白质制剂的可递送质量百分比来自胶囊取样。
[0471]
表10:卵清蛋白质制剂和胶囊表征的汇总
[0472][0473][0474]
当重新打开胶囊以递送干燥卵清蛋白质制剂内容物用于含量均匀度测试时,当制剂中不包含胶态二氧化硅时,平均约6重量%至9重量%的制剂保持粘附在重新打开的胶囊的内部(批次1
‑
3)。另外,在这些批次的封装期间记录在线观察结果,即当重新打开和摇动胶囊以模拟粉末内容物的递送时,干燥卵清蛋白质制剂保持粘附在重新打开的胶囊壳的两端内。
[0475]
随后将胶态二氧化硅作为助流剂添加到300mg剂量强度的共混制剂中,以改善粉末流动和施用期间从胶囊壳的可递送质量。胶态二氧化硅的添加导致粉末可从拉分式胶囊壳中递送的容易程度显著改善。对于300mg剂量强度的后续制剂和工艺开发批次(批次4
‑
6),平均可递送质量在99重量%至100重量%的范围内。来自重新打开的胶囊的递送粉末是自由流动的,带有一些软附聚物(由于封装期间的填压),这些软附聚物在轻轻夹在两个手指之间时变成粉末。
[0476]
实施例3:卵清蛋白质制剂的制备
[0477]
制备用于具有0.2mg、1mg、6mg、12mg和300mg标签声明的剂型的干燥卵清蛋白质制剂,并且以7kg批次制备用于具有3mg、20mg、40mg、80mg、120mg、160mg、200mg和240mg标签声明的剂型的干燥卵清蛋白质制剂。干燥卵清蛋白质制剂的标称蛋白含量为80重量%,其中针对干燥卵清蛋白质制剂的蛋白含量的变化对预胶化淀粉的量进行调整。
[0478]
为了评估制备过程的充分性,在最终混合步骤之后评估以7kg规模制备的代表性批次的共混物均匀度。使用取样机在10个不同位置从所制备的制剂中提取相当于1至3个胶囊的制剂样品。使用二喹啉甲酸(bca)测定来测定来自该组的每个样品的蛋白质含量。结果总结于表11中。
[0479]
表11:代表性批次的共混物均匀度结果
[0480][0481][0482]
%lc:标签声明的百分比
[0483]
将0.2mg、1mg、6mg、12mg和300mg标签声明的卵清蛋白质制剂填充到基于羟丙甲纤维素的拉分式胶囊壳中以提供单独的测量剂量。对于0.2mg至6mg的剂量强度,选择具有180mg目标粉末填充重量的#2号拉分式胶囊壳。选择具有500mg目标填充重量的#00号胶囊壳用于较高的剂量强度,以容纳至多300mg的卵清蛋白质与足够的稀释剂、润滑剂和助流剂,以允许稳健的加工和可递送质量。使用bosch gkf701封装器以每分钟至多700粒胶囊的生产速率将卵清蛋白质制剂封装在胶囊中。将制剂送入封装器并使用一系列填压销填压到定量给料盘中。可调整定量给料盘厚度和填压销位置以调节胶囊填充重量。通过封装器打开空的胶囊壳,将粉末的填压块插入每个打开的胶囊壳的主体中,然后闭合胶囊壳。
[0484]
通过以0.2mg、1mg、6mg、12mg和300mg剂量声明对一组十个所制备的胶囊取样来测量胶囊的可递送质量百分比。将胶囊称重、打开,并将包含在胶囊内的制剂倒出。测量可从胶囊递送的制剂的质量。然后将压缩空气吹入胶囊中以去除残余的制剂,并且称量空的胶囊。每种剂量声明的递送质量百分比和rsd汇总于表12中。
[0485]
表12:代表性批次的可递送质量汇总
[0486][0487]
还通过将可递送质量中的蛋白质含量与标称剂量(即,标签声明)进行比较来确定胶囊的含量均匀度。使用bca测定来确定蛋白质含量。不同剂量处多批剂量容器的含量均匀度汇总于表13中。
[0488]
表13:代表性批次的含量均匀度汇总
[0489][0490]
实施例4:用于治疗卵变态反应的口服免疫疗法研究
[0491]
将进行含有来源于鸡蛋的生的干燥卵清蛋白质粉末和赋形剂的药物组合物在口服免疫疗法方案中的功效和安全性的随机、双盲、安慰剂对照研究。用非活性化合物和对应赋形剂配制的安慰剂将用于本研究的安慰剂组。图9提供了研究的示意图。
[0492]
符合条件的受试者是(1)年龄为4至26岁的人类个体;(2)具有医师诊断的ige介导的鸡蛋变态反应,该变态反应在已知口服暴露于卵或含卵食物2小时内发展出变应原性反应;(3)具有≥7ku
a
/l的血清卵清特异性ige水平;(4)在筛选双盲安慰剂对照食物挑战(dbpcfc)中食用单剂量≤300mg干燥卵清蛋白质之后发展出剂量限制性变态反应症状;(5)对于具有生育能力的女性个体,使用可靠的节育方法;以及(6)根据排除标准不另外排除。
[0493]
排除标准包括(1)在筛选前60天内重度或危及生命的过敏症或过敏性休克的病史;(2)嗜酸性食管炎(eoe)或其他嗜酸性gi疾病的病史;慢性、复发性或重度的胃食管反流性疾病(gerd);吞咽困难的症状;任何病因的复发性gi症状;(3)肥大细胞病症病史(例如,系统性肥大细胞增多症、色素性荨麻疹、慢性特发性或慢性物理性荨麻疹而非单纯人工性荨麻疹[例如,寒冷性荨麻疹、胆碱能性荨麻疹],或遗传性或特发性血管性水肿);(4)具有不受控制或难以控制的轻度或中度哮喘、或重度持续性哮喘;(5)高剂量皮质类固醇药物使用史(例如,1mg/kg
‑
2mg/kg处泼尼松或等同物>3天);(6)心血管疾病史(包括不受控制或未充分控制的高血压);(7)慢性疾病史(哮喘、特应性皮炎或变应性鼻炎除外),其变得不稳定或需要改变慢性治疗方案或处于变得不稳定或需要改变慢性治疗方案的显著风险中,包括在筛选前5年内的恶性肿瘤和自身免疫疾病;(8)心血管疾病史,包括不受控制或未充分控制的高血压;(9)使用β
‑
阻滞剂(口服)、血管紧张素转化酶抑制剂、血管紧张素受体阻滞剂、钙通道阻滞剂或三环抗抑郁药;(10)在筛选和退出皮肤点刺测试(spt)和食物挑战以及剂量递增的第一天之前,不能中止可能干扰评估药物的5个半衰期的变应性反应的抗组胺剂和其他药物;(11)缺乏受试者对其不具有变应性的可用适口媒介物食物;(12)对小麦或燕麦的超敏反应;(13)对肾上腺素或肾上腺素自动注射器中的任何赋形剂的超敏反应;(14)使用任何治疗性抗体或任何免疫调节疗法(包括免疫抑制药物(除了在筛选前6个月内的维持阶段使用的空气变应原或毒液免疫疗法));(15)目前接受或在筛选前的5年内接受任何类型的卵或其他食物变应原免疫疗法;(16)在筛选之前,在30天或研究产品的5个半衰期(以较长者为准)内参与另一项临床研究;(17)在对任何非卵变应原的免疫疗法的建立/上调剂量阶段;以及(18)怀孕或目前母乳喂养。
[0494]
初始筛选将包括干燥卵清双盲安慰剂对照食物挑战(dbpcfc)和开放式烘焙全卵食物挑战。dbpcfc是在医学监督下通过如下进行的程序:在2个单独的天中,以测量的、增加
剂量给不知晓挑战日的随机顺序的受试者、父母/护理者和研究地点工作人员喂食干燥卵清和安慰剂。直到dbpcfc的两天结束之后,研究地点人员才会知道挑战顺序。食物挑战材料将由不参与dbpcfc给药、监测或评估结果的指定非盲人员制备。在该研究中进行的dbpcfc将遵循符合用于安全性、评估和评分的实际变态反应(practall)指南(sampson等人,j.allergy clin.immunol.,第130卷,第1260
‑
1274页(2012))。dbpcfc程序在筛选期间以及在研究退出时进行。筛选和退出dbpcfc给药计划表的汇总提供于下表14中。
[0495]
表14:筛选和退出dbpcfc挑战剂量
[0496][0497][0498]
开放式烘焙全卵食物挑战是在医学监督下通过以测量的、增加的剂量喂食测试食物产品(具有卵的烘焙食物产品)进行的程序。在该研究下进行的挑战将遵循符合用于安全性、评估和评分的practall指南的程序。在筛选期间以及在研究退出时进行开放式烘焙全卵食物挑战。在挑战期间,受试者将尝试根据给药计划表食用一个完整的松饼,其中一个松饼含有一个完整卵的大约三分之一,这相当于大约2000mg卵蛋白质。筛选和开放式烘焙全卵食物挑战给药计划表的汇总提供于下表15中。
[0499]
表15:筛选和退出开放式烘焙全卵食物挑战剂量
[0500][0501]
将符合条件的个体以2:1随机分配进行药物组合物或安慰剂的盲化治疗。随机化将通过筛选时开放式烘焙全卵食物挑战中对烘焙卵的基线反应性进行分层。在研究过程期间,将允许耐受大约2000mg累积烘焙卵蛋白质(一个松饼,其含有一个全卵的大约三分之一)的受试者食用烘焙卵产品。在开放式烘焙全卵食物挑战期间具有剂量限制性变态反应症状的受试者将被认为是烘焙卵不耐受的,并且将被指导避免研究期间所有形式的鸡蛋。
[0502]
受试者将在第1天在研究地点处在医学监督下开始初始剂量递增,在耐受的情况下,以20分钟至30分钟的间隔施用逐步剂量递增的研究产品(0.2mg、0.4mg、0.8mg、1.2mg和
2mg的至多5个单剂量)。在第1天耐受至少1.2mg单剂量的受试者将在第2天返回以接受单次验证性1mg剂量。耐受验证性1mg剂量而没有超过不是剂量限制性的轻度变态反应症状的受试者将开始上调剂量期。在第1天不耐受1.2mg剂量或在第2天不耐受1mg剂量的受试者将在研究早期中止。
[0503]
上调剂量将为大约6个月(22周
‑
40周),其中剂量递增大约每2周发生一次。在上调剂量期间研究产品的日剂量将为1mg、3mg、6mg、12mg、20mg、40mg、80mg、120mg、160mg、200mg、240mg和300mg。每个新剂量水平处的第一剂量的研究产品将在研究地点处在医学监督下施用;每个剂量水平处的剩余剂量将在耐受的情况下在家中每日施用。
[0504]
在40周内达到300mg/天剂量并耐受第一个300mg剂量而没有超过不是剂量限制性的轻度变态反应症状的受试者将开始维持期。在第1天的40周内未达到300mg/天剂量的受试者将在研究早期中止。
[0505]
开始维持治疗的受试者将继续每天以300mg/天给药研究产品大约12周,这可延长至多另外的4周以适应维持的最后2周期间的剂量调整。研究地点访问将大约每4周发生一次。在维护访问期间,将在研究地点处在医疗监督下施用研究产品;随后的维持剂量将在耐受的情况下在家中每日施用。
[0506]
如研究人员所批准,根据受试者经历的不良事件或其他并发因素,将允许在上调剂量阶段或维持阶段期间进行剂量调整。在上调剂量阶段或维持阶段期间,可根据以下中的一者,响应于剂量相关的变应性反应来调整剂量:(1)在研究地点处在医学监督下施用下一剂量的研究产品;(2)将研究产品剂量递增延迟另外的1周至2周;(3)将研究产品剂量水平降低1或2个剂量水平;(4)暂时保持研究产品;或(5)停止研究产品给药并在研究早期中止受试者。症状的严重程度将指导对于急性和慢性或复发性症状的研究产品剂量减少。
[0507]
还可出于除由药物组合物引起的变应性反应之外的原因(诸如哮喘或其他特应性疾病的发作、疾病或月经)来调整剂量。根据研究人员的判断,剂量减少的量可在1个剂量水平(即,先前剂量水平)至大约50%(四舍五入至最接近的可行整个剂量)的范围内。最低剂量水平为1mg。如果剂量由于除了对药物组合物的变应性反应之外的原因而减少,则将给予该减少的剂量2周,并且受试者将完全恢复(即,基线状态)至少3天,这取决于根据研究人员评估的疾病严重程度,然后在研究地点处尝试剂量重新递增。如果满足以下剂量调整条件中的任一者,则将停止给药并且受试者将早期中止:在3次连续失败尝试后,剂量水平不能递增,其中每次递增尝试之间间隔至少2周;或者在3次尝试降低剂量水平后,不能耐受剂量降低。
[0508]
在维持结束时,受试者将具有在退出dbpcfc时至多2000mg干燥卵清蛋白质(累积4043或4044mg)的单次最高挑战剂量,随后在退出dbpcfc的第二天后7天内进行开放式烘焙全卵食物挑战。所有受试者在退出dbpcfc之前必须耐受300mg每日剂量的研究产品至少连续2周。
[0509]
完成退出dbpcfc和开放式烘焙全卵食物挑战的受试者将退出(完成)该研究。在退出研究之后以及在解决了对受试者的所有主要数据查询之后,研究治疗分配对于受试者将是非盲性的。对于研究早期中止的受试者,研究治疗分配在研究完成后将是非盲性的。
[0510]
研究的研究终点包括(1)用该药物组合物治疗与用安慰剂治疗相比,耐受至少300mg生卵清蛋白质、至少600mg生卵清蛋白质、至少1000mg生卵清蛋白质或至少2000mg生
卵清蛋白质的单次最高剂量而在退出dbpcfc时具有不超过轻度变态反应症状的受试者的比例;(2)在筛选时不能耐受约2000mg烘焙卵蛋白质的累积剂量并且随后在退出研究时耐受约2000mg烘焙卵蛋白质的累积剂量的受试者的比例;以及(3)治疗的安全性汇总。
[0511]
实施例5:用于治疗卵变态反应的口服免疫疗法研究
[0512]
将进行含有来源于鸡蛋的生的干燥卵清蛋白质粉末和赋形剂的药物组合物在口服免疫疗法方案中的功效和安全性的随机、双盲、安慰剂对照研究。用非活性化合物和对应赋形剂配制的安慰剂将用于本研究的安慰剂组。图10提供了研究的示意图。
[0513]
符合条件的受试者是(1)年龄为4至26岁的人类个体;(2)具有医师诊断的ige介导的鸡蛋变态反应,该变态反应在已知口服暴露于卵或含卵食物2小时内发展出变应原性反应;(3)具有≥5ku
a
/l的血清卵清特异性ige水平;(4)在筛选双盲安慰剂对照食物挑战(dbpcfc)中食用单剂量≤300mg干燥卵清蛋白质之后发展出剂量限制性变态反应症状;(5)对于具有生育能力的女性个体,使用可靠的节育方法;以及(6)根据排除标准不另外排除。
[0514]
排除标准包括(1)在筛选前60天内重度或危及生命的过敏症或过敏性休克的病史;(2)嗜酸性食管炎(eoe)或其他嗜酸性gi疾病的病史;慢性、复发性或重度的胃食管反流性疾病(gerd);吞咽困难的症状;任何病因的复发性gi症状;(3)肥大细胞病症病史(例如,系统性肥大细胞增多症、色素性荨麻疹、慢性特发性或慢性物理性荨麻疹而非单纯人工性荨麻疹[例如,寒冷性荨麻疹、胆碱能性荨麻疹],或遗传性或特发性血管性水肿);(4)具有不受控制或难以控制的轻度或中度哮喘、或重度持续性哮喘;(5)高剂量皮质类固醇药物使用史(例如,1mg/kg
‑
2mg/kg处泼尼松或等同物>3天);(6)心血管疾病史(包括不受控制或未充分控制的高血压);(7)慢性疾病史(哮喘、特应性皮炎或变应性鼻炎除外),其变得不稳定或需要改变慢性治疗方案或处于变得不稳定或需要改变慢性治疗方案的显著风险中,包括在筛选前5年内的恶性肿瘤和自身免疫疾病;(8)心血管疾病史,包括不受控制或未充分控制的高血压;(9)使用β
‑
阻滞剂(口服)、血管紧张素转化酶抑制剂、血管紧张素受体阻滞剂、钙通道阻滞剂或三环抗抑郁药;(10)在筛选和退出皮肤点刺测试(spt)和食物挑战以及剂量递增的第一天之前,不能中止可能干扰评估药物的5个半衰期的变应性反应的抗组胺剂和其他药物;(11)缺乏受试者对其不具有变应性的可用适口媒介物食物;(12)对小麦或燕麦的超敏反应;(13)对肾上腺素或肾上腺素自动注射器中的任何赋形剂的超敏反应;(14)使用任何治疗性抗体或任何免疫调节疗法(包括免疫抑制药物(除了在筛选前6个月内的维持阶段使用的空气变应原或毒液免疫疗法));(15)目前接受或在筛选前的5年内接受任何类型的卵或其他食物变应原免疫疗法;(16)在筛选之前,在30天或研究产品的5个半衰期(以较长者为准)内参与另一项临床研究;(17)在对任何非卵变应原的免疫疗法的建立/上调剂量阶段;以及(18)怀孕或目前母乳喂养。
[0515]
初始筛选将包括干燥卵清双盲安慰剂对照食物挑战(dbpcfc)和开放式烘焙全卵食物挑战。dbpcfc是在医学监督下通过如下进行的程序:在2个单独的天中,以测量的、增加剂量给不知晓挑战日的随机顺序的受试者、父母/护理者和研究地点工作人员喂食干燥卵清和安慰剂。直到dbpcfc的两天结束之后,研究地点人员才会知道挑战顺序。食物挑战材料将由不参与dbpcfc给药、监测或评估结果的指定非盲人员制备。在该研究中进行的dbpcfc将遵循符合用于安全性、评估和评分的实际变态反应(practall)指南(sampson等人,j.allergy clin.immunol.,第130卷,第1260
‑
1274页(2012))。dbpcfc程序在筛选期间以及
在研究退出时进行。筛选和退出dbpcfc给药计划表的汇总提供于下表3中。
[0516]
表16:筛选和退出dbpcfc挑战剂量
[0517][0518]
开放式烘焙全卵食物挑战是在医学监督下通过以测量的、增加的剂量喂食测试食物产品(具有卵的烘焙食物产品)进行的程序。在该研究下进行的挑战将遵循符合用于安全性、评估和评分的practall指南的程序。在筛选期间以及在研究退出时进行开放式烘焙全卵食物挑战。在挑战期间,受试者将尝试根据给药计划表食用一个完整的松饼,其中一个松饼含有一个完整卵的大约三分之一,这相当于大约2000mg卵蛋白质。筛选和开放式烘焙全卵食物挑战给药计划表的汇总提供于下表4中。
[0519]
表17:筛选和退出开放式烘焙全卵食物挑战剂量
[0520][0521]
将符合条件的个体以2:1随机分配进行药物组合物或安慰剂的盲化治疗。随机化将通过筛选时开放式烘焙全卵食物挑战中对烘焙卵的基线反应性进行分层。在研究过程期间,将允许耐受大约2000mg累积烘焙卵蛋白质(一个松饼,其含有一个全卵的大约三分之一)的受试者食用烘焙卵产品。在开放式烘焙全卵食物挑战期间具有剂量限制性变态反应症状的受试者将被认为是烘焙卵不耐受的,并且将被指导避免研究期间所有形式的鸡蛋。
[0522]
受试者将在第1天在研究地点处在医学监督下开始初始剂量递增,在耐受的情况下,以20分钟至30分钟的间隔施用逐步剂量递增的研究产品(0.2mg、0.4mg、0.8mg、1.0mg和2mg的至多5个单剂量)。在第1天耐受至少1.0mg单剂量的受试者将在第2天返回以接受单次验证性1.0mg剂量。耐受验证性1.0mg剂量而没有超过不是剂量限制性的轻度变态反应症状的受试者将开始上调剂量期。在第1天不耐受1.0mg剂量或在第2天不耐受1mg剂量的受试者将在研究早期中止。
[0523]
上调剂量将为大约6个月(22周
‑
40周),其中剂量递增大约每2周发生一次。在上调
剂量期间研究产品的日剂量将为1mg、3mg、6mg、12mg、20mg、40mg、80mg、120mg、160mg、200mg、240mg和300mg。每个新剂量水平处的第一剂量的研究产品将在研究地点处在医学监督下施用;每个剂量水平处的剩余剂量将在耐受的情况下在家中每日施用。
[0524]
在40周内达到300mg/天剂量并耐受第一个300mg剂量而没有超过不是剂量限制性的轻度变态反应症状的受试者将开始维持期。在第1天的40周内未达到300mg/天剂量的受试者将在研究早期中止。
[0525]
开始维持治疗的受试者将继续每天以300mg/天给药研究产品大约12周,这可延长至多另外的4周以适应维持的最后2周期间的剂量调整。研究地点访问将大约每4周发生一次。在维护访问期间,将在研究地点处在医疗监督下施用研究产品;随后的维持剂量将在耐受的情况下在家中每日施用。
[0526]
如研究人员所批准,根据受试者经历的不良事件或其他并发因素,将允许在上调剂量阶段或维持阶段期间进行剂量调整。在上调剂量阶段或维持阶段期间,可根据以下中的一者,响应于剂量相关的变应性反应来调整剂量:(1)在研究地点处在医学监督下施用下一剂量的研究产品;(2)将研究产品剂量递增延迟另外的1周至2周;(3)将研究产品剂量水平降低1或2个剂量水平;(4)暂时保持研究产品;或(5)停止研究产品给药并在研究早期中止受试者。症状的严重程度将指导对于急性和慢性或复发性症状的研究产品剂量减少。
[0527]
还可出于除由药物组合物引起的变应性反应之外的原因(诸如哮喘或其他特应性疾病的发作、疾病或月经)来调整剂量。根据研究人员的判断,剂量减少的量可在1个剂量水平(即,先前剂量水平)至大约50%(四舍五入至最接近的可行整个剂量)的范围内。最低剂量水平为1mg。如果剂量由于除了对药物组合物的变应性反应之外的原因而减少,则将给予该减少的剂量2周,并且受试者将完全恢复(即,基线状态)至少3天,这取决于根据研究人员评估的疾病严重程度,然后在研究地点处尝试剂量重新递增。如果满足以下剂量调整条件中的任一者,则将停止给药并且受试者将早期中止:在3次连续失败尝试后,剂量水平不能递增,其中每次递增尝试之间间隔至少2周;或者在3次尝试降低剂量水平后,不能耐受剂量降低。
[0528]
在维持结束时,受试者将具有在退出dbpcfc时至多2000mg干燥卵清蛋白质(累积4043或4044mg)的单次最高挑战剂量,随后在退出dbpcfc的第二天后7天内进行开放式烘焙全卵食物挑战。所有受试者在退出dbpcfc之前必须耐受300mg每日剂量的研究产品至少连续2周。
[0529]
完成退出dbpcfc和开放式烘焙全卵食物挑战的受试者将退出(完成)该研究。在退出研究之后以及在解决了对受试者的所有主要数据查询之后,研究治疗分配对于受试者将是非盲性的。对于研究早期中止的受试者,研究治疗分配在研究完成后将是非盲性的。
[0530]
研究的研究终点包括(1)用该药物组合物治疗与用安慰剂治疗相比,耐受至少300mg生卵清蛋白质、至少600mg生卵清蛋白质、至少1000mg生卵清蛋白质或至少2000mg生卵清蛋白质的单次最高剂量而在退出dbpcfc时具有不超过轻度变态反应症状的受试者的比例;(2)在筛选时不能耐受约2000mg烘焙卵蛋白质的累积剂量并且随后在退出研究时耐受约2000mg烘焙卵蛋白质的累积剂量的受试者的比例;以及(3)治疗的安全性汇总。
[0531]
实施例6:rp
‑
hplc测定
[0532]
开发了用于干燥卵清蛋白质粉末(药物物质)和卵清蛋白质的药物组合物(药物产
品)的高分辨率鉴定和蛋白质图谱的rp
‑
hplc方法。
[0533]
为了制备用于测定的药物物质,将50mg药物物质(对应于约40mg卵清蛋白质)称量到1000ml烧瓶中并用800ml水稀释。然后将样品在轨道式震荡器上摇动30分钟,然后用水稀释至0.04mg/ml卵清蛋白质浓度。然后通过0.45微米注射器式滤器过滤稀释的样品,弃去前2ml。
[0534]
为了制备用于测定的药物组合物(即药物产品),稀释剂的体积取决于被测样品的剂量强度。可将特定剂量水平的10粒胶囊共混在一起并用水稀释至约0.05mg/ml卵清蛋白质浓度。然后可将稀释的药物产品样品在轨道式震荡器上摇动30分钟并稀释至约0.038mg/ml至约0.042mg/ml卵清蛋白质浓度的工作浓度。然后可将样品转移到15ml锥形离心管中并以3,200rpm离心30分钟。然后可将澄清的上清液通过0.45微米注射器式滤器过滤,弃去前2ml。
[0535]
使用改进的rp
‑
hplc方法,主要的卵清蛋白质组分被良好分辨,典型的保留时间为约15.5分钟(肌红蛋白)、16.1分钟(碳酸酐酶)、7.8分钟(类卵粘蛋白)、12.2分钟(溶菌酶)、14.4分钟(卵转铁蛋白)和18.1分钟(卵清蛋白)。使用改进的rp
‑
hplc方法的药物制剂的样品rp
‑
hplc色谱图在图11中示出。药物物质或药物产品的分析样品可与单个蛋白质(即,纯化的变应原或其他卵清蛋白质)的参考标准品和/或药物物质或药物产品的先前验证的样品进行比较。配制药物的稀释剂表现出宽的保留曲线,在22分钟后具有最大振幅。通过与稀释剂和任选的任何其他单独赋形剂的参考标准品比较,减去可归因于稀释剂的面积,可计算每个单个蛋白质的峰面积。
[0536]
实施例7:稳定性研究
[0537]
用卵清蛋白质的药物制剂样品进行稳定性研究。样品在正常、加速和胁迫稳定性条件下进行测试,诸如储存在25℃
‑
40℃之间。
[0538]
在一个实验中,将0.2mg胶囊与1g干燥剂小袋一起储存在高密度聚乙烯瓶中。将瓶储存在5℃
±
3℃、25℃/60%rh、30℃/65%rh或40℃/75%rh处。
[0539]
在不同的时间点,测定样品的外观、可递送质量、蛋白质图谱(通过rp
‑
hplc)、总蛋白质(通过bca)和相对效能(通过elisa)。通过打开单个胶囊并将少量产品置于干净的表面皿上来评估外观。在白色背景下观察该材料是否存在异物。通过以下方式评估可递送质量:称量完整胶囊的重量,将胶囊排空到配衡容器中,使用压缩空气从胶囊壳中吹出剩余的内容物,称量空胶囊,然后确定从胶囊中取出的质量的多少百分比被递送到配衡容器中。通过测量可归因于gal d 1、gal d 2、gal d 3和gal d 4的rp
‑
hplc峰面积的比例来评估蛋白质图谱。对于较早的时间点(在1个月与6个月之间),使用实施例1中所述的第一种rp
‑
hplc方法。对于稍后的时间点,使用实施例6中所述的改进的rp
‑
hplc方法。两种rp
‑
hplc方法均用于6个月的时间点。如实施例1中所述,通过elisa评估相对效能,并且通过bca评估总蛋白质。bca被报告为占标签声明的总卵清蛋白质的百分比。
[0540]
0.2mg胶囊在2℃
‑
8℃储存后的结果汇总于下表中。对于6个月的时间点,采用实施例1的较老的rp
‑
hplc方法和实施例6的改进的rp
‑
hplc两者。在6个月时间点的第一值对应于第一种rp
‑
hplc方法,并且在6个月时间点的第二值对应于改进的rp
‑
hplc方法。
[0541][0542]
药物制剂的主要变应原水平和相对效能在2℃
‑
8℃之间储存后在0与12个月之间是稳定的。
[0543]
0.2mg胶囊在25℃/60%rh加速稳定性储存条件后的结果汇总于下表中。对于6个月的时间点,采用所述的较老的rp
‑
hplc方法和改进的rp
‑
hplc方法两者。在6个月时间点的第一值对应于第一种rp
‑
hplc方法,并且在6个月时间点的第二值对应于改进的rp
‑
hplc方法。
[0544][0545]
药物制剂的主要变应原水平和相对效能在25℃/60%rh储存后在0与12个月之间是稳定的。
[0546]
0.2mg胶囊在30℃/65%rh加速稳定性储存条件后的结果汇总于下表中。对于6个月的时间点,采用前述实施例中所述的较老的rp
‑
hplc方法和改进的rp
‑
hplc方法两者,但仅报告较老的rp
‑
hplc值来比较t=0时间点。
[0547][0548]
药物制剂的主要应变原和相对效能在30℃/65%rh储存的加速稳定性条件后在0与6个月之间是稳定的。
[0549]
0.2mg胶囊在40℃/75%rh的胁迫稳定性储存条件后的结果汇总于下表中。对于6
个月的时间点,采用前述实施例中所述的较老的rp
‑
hplc方法和改进的rp
‑
hplc方法两者,但是仅报告较老的rp
‑
hplc方法值来比较t=0、1和3个月时间点。
[0550][0551]
即使在40℃/75%rh的胁迫稳定性储存条件下,药物制剂的主要变应原和相对效能在0与6个月之间也是稳定的。
[0552]
用包含1mg、6mg、12mg和300mg药物产品剂量的许多胶囊完成稳定性研究。结果表明,药物制剂在不同的储存条件下跨剂量水平是稳定的。
[0553]
实施例8:患者的卵变态反应口服免疫疗法
[0554]
用卵清蛋白质的药物组合物治疗患者诊断出的卵变态反应。患者根据口服免疫疗法计划表经历初始剂量递增、上调剂量阶段和维持阶段。如果受试者经历对先前剂量的不利变应性反应和/或经历与对与施用一定剂量的药物制剂无关的变应原增加的敏感性相关联的并发因素,则可调整上调剂量阶段或维持阶段期间的指示剂量。
[0555]
可在药物组合物的第一剂量之前、口服免疫疗法期间和/或口服免疫疗法之后评估患者的血清总ige、卵清特异性ige、总igg4和卵清特异性igg4水平。可在口服免疫治疗之前、期间和/或之后评估患者对一定剂量的生卵清和/或烘焙卵清的反应性。
[0556]
实施例9:卵清蛋白质制剂的低剂量制备
[0557]
用于制备口服免疫疗法的低剂量(包括0.2mg和1mg剂量)的配制药物组合物可如下制备。起始药物物质为干燥卵清蛋白质粉末。通过与参考标准品或预定义的接受标准进行比较,表征干燥卵清蛋白质粉末以确保一致的总蛋白质水平和变应原水平,诸如gal d 1、gal d 2、gal d 3和gal d 4的水平。还例如通过针对类卵粘蛋白的elisa并与预定义的接受标准进行比较,证实了卵清蛋白质粉末的相对效能。
[0558]
将干燥卵清蛋白质粉末与预胶化淀粉的第一部分手动混合以形成第一混合物。然后使第一混合物与预胶化淀粉的第二部分通过网筛共筛分,然后将共筛分的材料手动混合以形成第二混合物。然后通过共混机(例如,转鼓式共混机)将第二混合物与预胶化淀粉的第三部分混合以形成第三混合物。然后通过共混机(例如,转鼓式共混机)将第三混合物与预胶化淀粉的第四部分混合以形成第四混合物。然后通过共混机(例如,转鼓式共混机)将第四混合物与预胶化淀粉的第五部分混合以形成第五混合物。然后通过共混机(例如,转鼓式共混机)将第五混合物与微晶纤维素混合,然后通过高剪切混合(例如,在锥式磨机中)进一步混合以形成第六混合物。单独地,将预胶化淀粉的第六部分和硬脂酸镁混合在一起以形成第七混合物,然后使其通过网筛以筛分第七混合物。然后将第七混合物与第六混合物在共混机(例如,转鼓式共混机)中混合以形成卵清蛋白质制剂。
[0559]
一旦配制好,就通过评估总蛋白质、含量均匀度、个体变应原水平(诸如gal d 1、
gal d 2、gal d 3和gal d 4的水平)、变应原的相对效能(诸如通过针对类卵粘蛋白的elisa)和水活度来表征整体制剂。根据预定接受标准判断每个评估。一旦整体制剂被验证,就将其分配到容器诸如胶囊或小袋中。来自相同制备批次的容器形成一批。还评估来自同一批的单个容器或多个容器。然后分配包括多个容器的验证批次用于卵变态反应的口服免疫疗法。
[0560]
实施例10:卵清蛋白质制剂的低剂量制备
[0561]
用于制备口服免疫疗法的低剂量(包括3mg和6mg剂量)的配制药物组合物可如下制备。起始药物物质为干燥卵清蛋白质粉末。通过与参考标准品或预定义的接受标准进行比较,表征干燥卵清蛋白质粉末以确保一致的总蛋白质水平和变应原水平,诸如gal d 1、gal d 2、gal d 3和gal d 4的水平。还例如通过针对类卵粘蛋白的elisa并与预定义的接受标准进行比较,证实了卵清蛋白质粉末的相对效能。
[0562]
将干燥卵清蛋白质粉末与预胶化淀粉的第一部分混合以形成第一混合物。通过高剪切混合(例如,锥式磨机)将第一混合物与预胶化淀粉的第二部分混合,然后在共混机(诸如转鼓式共混机)中进一步混合以形成第二混合物。然后将第二混合物与预胶化淀粉的第三部分混合以形成第三混合物。然后将第三混合物与微晶纤维素在共混机(诸如转鼓式共混机)中混合以形成第四混合物,然后通过高剪切混合(例如,在锥式磨机中)将该第四混合物进一步混合。单独地,将预胶化淀粉的第四部分和硬脂酸镁混合在一起以形成第五混合物,使该第五混合物通过网筛。然后将筛分的第五混合物与第四混合物混合以形成卵清蛋白质制剂。
[0563]
一旦配制好,就通过评估总蛋白质、含量均匀度、个体变应原水平(诸如gal d 1、gal d 2、gal d 3和gal d 4的水平)、变应原的相对效能(诸如通过针对类卵粘蛋白的elisa)和水活度来表征整体制剂。根据预定接受标准判断每个评估。一旦整体制剂被验证,就将其分配到容器诸如胶囊或小袋中。来自相同制备批次的容器形成一批。还评估来自同一批的单个容器或多个容器。然后分配包括多个容器的验证批次用于卵变态反应的口服免疫疗法。
[0564]
实施例11:卵清蛋白质制剂的中等剂量制备
[0565]
用于制备口服免疫疗法的中等剂量(包括12mg剂量)的配制药物组合物可如下制备。起始药物物质为干燥卵清蛋白质粉末。通过与参考标准品或预定义的接受标准进行比较,表征干燥卵清蛋白质粉末以确保一致的总蛋白质水平和变应原水平,诸如gal d 1、gal d 2、gal d 3和gal d 4的水平。还例如通过针对类卵粘蛋白的elisa并与预定义的接受标准进行比较,证实了卵清蛋白质粉末的相对效能。
[0566]
将干燥卵清蛋白质粉末与预胶化淀粉的第一部分和胶态二氧化硅手动混合以形成第一混合物。然后使用高剪切混合(例如,在锥式磨机中)将第一混合物与预胶化淀粉的第二部分混合以形成第二混合物,然后在共混机(例如,转鼓式共混机)中以较低剪切力将第二混合物进一步混合。然后将第二混合物与预胶化淀粉的第三部分混合(使用例如共混机,如转鼓式共混机)以形成第三混合物。然后将第三混合物与预胶化淀粉的第四部分和微晶纤维素在共混机(诸如转鼓式共混机)中混合以形成第四混合物,通过高剪切混合(例如,使用锥式磨机)将该第四混合物进一步混合。单独地,将预胶化淀粉的第五部分与硬脂酸镁混合以形成第五混合物,使该第五混合物通过网筛。然后将筛分的第五混合物与第四混合
物混合以形成卵清蛋白质制剂。
[0567]
一旦配制好,就通过评估总蛋白质、含量均匀度、个体变应原水平(诸如gal d 1、gal d 2、gal d 3和gal d 4的水平)、变应原的相对效能(诸如通过针对类卵粘蛋白的elisa)和水活度来表征整体制剂。根据预定接受标准判断每个评估。一旦整体制剂被验证,就将其分配到容器诸如胶囊或小袋中。来自相同制备批次的容器形成一批。还评估来自同一批的单个容器或多个容器。然后分配包括多个容器的验证批次用于卵变态反应的口服免疫疗法。
[0568]
实施例12:卵蛋白质制剂的中等剂量制备
[0569]
用于制备口服免疫疗法的中等剂量(包括20mg和40mg剂量)的配制药物组合物可如下制备。起始药物物质为干燥卵清蛋白质粉末。通过与参考标准品或预定义的接受标准进行比较,表征干燥卵清蛋白质粉末以确保一致的总蛋白质水平和变应原水平,诸如gal d 1、gal d 2、gal d 3和gal d4的水平。还例如通过针对类卵粘蛋白的elisa并与预定义的接受标准进行比较,证实了卵清蛋白质粉末的相对效能。
[0570]
将干燥卵清蛋白质粉末与预胶化淀粉的第一部分和胶态二氧化硅手动混合以形成第一混合物。然后通过高剪切混合(例如,在锥式磨机中)将第一混合物与预胶化淀粉的第二部分混合以形成第二混合物,然后在共混机(例如,转鼓式共混机)中将该第二混合物进一步混合。然后将第二混合物与预胶化淀粉的第三部分和微晶纤维素在共混机(诸如转鼓式共混机)中混合以形成第三混合物,然后通过高剪切混合(例如,在锥式磨机中)将该第三混合物进一步混合。单独地,将预胶化淀粉的第四部分和硬脂酸镁混合以形成第四混合物,然后使该第四混合物通过网筛。然后将筛分的第四混合物与第三混合物混合以形成卵清蛋白质制剂。
[0571]
一旦配制好,就通过评估总蛋白质、含量均匀度、个体变应原水平(诸如gal d 1、gal d 2、gal d 3和gal d 4的水平)、变应原的相对效能(诸如通过针对类卵粘蛋白的elisa)和水活度来表征整体制剂。根据预定接受标准判断每个评估。一旦整体制剂被验证,就将其分配到容器诸如胶囊或小袋中。来自相同制备批次的容器形成一批。还评估来自同一批的单个容器或多个容器。然后分配包括多个容器的验证批次用于卵变态反应的口服免疫疗法。
[0572]
实施例13:卵清蛋白质制剂的高剂量制备
[0573]
用于制备口服免疫疗法的高剂量(包括120mg、160mg、200mg、240mg和300mg剂量)的配制药物组合物可如下制备。通过与参考标准品或预定义的接受标准进行比较,表征干燥卵清蛋白质粉末以确保一致的总蛋白质水平和变应原水平,诸如gal d 1、gal d 2、gal d 3和gal d 4的水平。还例如通过针对类卵粘蛋白的elisa并与预定义的接受标准进行比较,证实了卵清蛋白质粉末的相对效能。
[0574]
将干燥卵清蛋白质粉末与预胶化淀粉的第一部分和胶态二氧化硅手动混合以形成第一混合物。然后通过高剪切混合(例如,在锥式磨机中)将第一混合物与微晶纤维素混合以形成第二混合物,然后在共混机(诸如转鼓式共混机)中将该第二混合物进一步混合。单独地,将预胶化淀粉的第二部分与硬脂酸镁混合以形成第三混合物,然后使该第三混合物通过网筛。然后将筛分的第三混合物与第二混合物在共混机(诸如转鼓式共混机)中混合以形成卵清蛋白质制剂。
[0575]
一旦配制好,就通过评估总蛋白质、含量均匀度、个体变应原水平(诸如gal d 1、gal d 2、gal d 3和gal d 4的水平)、变应原的相对效能(诸如通过针对类卵粘蛋白的elisa)和水活度来表征整体制剂。根据预定接受标准判断每个评估。一旦整体制剂被验证,就将其分配到容器诸如胶囊或小袋中。来自相同制备批次的容器形成一批。还评估来自同一批的单个容器或多个容器。然后分配包括多个容器的验证批次用于卵变态反应的口服免疫疗法。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。