1.本发明属于肿瘤微生物学技术领域,涉及靶向识别猪鼻支原体的核酸适体及其在靶向结合猪鼻支原体、猪鼻支原体感染的细胞;作为检测猪鼻支原体感染的试剂、检测猪鼻支原体感染细胞的试剂、检测猪鼻支原体感染细胞体内活体成像的试剂中的应用。
背景技术:
2.恶性肿瘤是一类生物体内正常细胞在众多内因和外因作用下,出现过度增殖、转移和浸润等现象,从而危害人体正常器官功能并导致死亡的一种恶性疾病。肿瘤的发生因素包括宿主的遗传因素以及外部的物理、化学和微生物等诱因。据已有的研究报道,病原微生物的感染是造成肿瘤发生发展的一个重要外部因素,16%的人类癌症可归因于病原微生物的感染,如幽门螺旋杆菌引起胃癌、乙型肝炎病毒促发肝癌、eb病毒诱发鼻咽癌,病原微生物的定植可诱发细胞的基因突变、蛋白表达变化、细胞形态变化乃至细胞发生恶性转变、异常增殖、迁移和侵袭能力增加等现象。
3.猪鼻支原体是一种最初发现于猪呼吸道中的正常菌群,在特定条件下可引发猪肺炎、浆膜炎、关节炎、咽鼓管炎以及中耳炎,但近年来,发现其与人类肿瘤的发生发展有密切联系,根据报道,通过特异性识别猪鼻支原体的抗体pd4检测人类肿瘤组织标本中的感染情况,发现在胃癌、结肠癌、食管癌、肺癌和乳腺癌的病人样本中,感染率为39%
‑
55%,利用pcr进行检测也发现,在59.3%的卵巢癌、52%的前列腺癌中也发现有猪鼻支原体感染,另一项研究显示,发现89%的在肝癌病患的ctc循环肿瘤细胞中有猪鼻支原体感染,并且已感染者的预后生存期短于未感染者。目前在临床工作中暂未将支原体检测列为肿瘤筛查的诊断项目,更多的支原体检测应用于体外细胞培养之中,在治疗方面,多利用抗生素进行治疗,但抗生素的耐药性目前已非常普遍,并且对真核细胞仍旧会产生一定的副作用和毒性,缺乏特异性、对人体内正常菌群的杀伤也是其固有缺陷。因此开发新型的可用于体内外的快速检测方法和无毒副作用的治疗方法具有重要意义。
4.核酸适体既可以作为高灵敏度的分子检测探针,又可以作为一种靶向配体荷载药物进行疾病的治疗,与抗体相比,核酸适配体还具有诸多额外的优势,如合成成本低、稳定性好、易于修饰、无免疫原性,可用于疾病的诊断与治疗,具有较大的学术与应用价值。
技术实现要素:
5.本发明的主要目的是提供一种新型的与猪鼻支原体高亲和力、高特异性结合的核酸适体及其应用。
6.该核酸适体特异性强,灵敏度高,能够靶向结合猪鼻支原体、靶向结合猪鼻支原体感染的细胞;作为检测猪鼻支原体感染的试剂、作为检测猪鼻支原体感染细胞的试剂以及作为检测猪鼻支原体感染细胞体内活体成像的试剂。
7.一种与猪鼻支原体特异性结合的核酸适体,序列如下:
8.seq no.1:
[0009]5’‑
accgaccgtgctggactcacgtcgtccatttccttgaaaaaggcacgggttccatgaactcactatgagcgagcctggcg
‑3’
;
[0010]
或者在seq no.1的3’端区段进行碱基删减获得与其功能相同的核酸适体;
[0011]
或者在seq no.1的中间区段进行碱基更换获得与其功能相同的核酸适体。
[0012]
所述的在seq no.1的3’端区段进行碱基删减获得与其功能相同的核酸适体;优选如下序列的核酸适体:
[0013]
seq no.7:
[0014]5’‑
accgaccgtgctggactcacgtcgtccatttccttgaaaaaggcacgggttccatgaactcactatgagc
‑3’
。
[0015]
所述的在seq no.1的中间区段进行碱基更换获得与其功能相同的核酸适体;优选如下序列中的一种或几种的核酸适体:
[0016]
seq no.2:
[0017]5’‑
accgaccgtgctggactcaagcggtttccgtgaacctgcgagttccctgaatacttgtactatgagcgagcctggcg
‑3’
[0018]
seq no.3:
[0019]5’‑
accgaccgtgctggactcagatccatttccttgaaaaaggcacgggttcccagaactcaactatgagcgagcctggcg
‑3’
[0020]
seq no.4:
[0021]5’‑
accgaccgtgctggactcaatcgggatccatgtatccaggttcgttccttgaatggcacactatgagcgagcctggcg
‑3’
[0022]
seq no.5:
[0023]5’‑
accgaccgtgctggactcaactgctgagccaattcttaataaagcacgggttcctagaactcaactatgagcgagcctggcg
‑3’
[0024]
seq no.6:
[0025]5’‑
accgaccgtgctggactcaatcgggatcctagatccagcgagttccccgaatgctttgcactatgagcgagcctggcg
‑3’
。
[0026]
所述的核酸适体,
[0027]
所述的功能包括以下中的一种或多种:
[0028]
(1)靶向结合猪鼻支原体;
[0029]
(2)靶向结合猪鼻支原体感染的细胞;
[0030]
(3)作为检测猪鼻支原体感染的试剂;
[0031]
(4)作为检测猪鼻支原体感染细胞的试剂;
[0032]
(5)作为检测猪鼻支原体感染细胞体内活体成像的试剂。
[0033]
上述的核酸适体,通过对核酸适体连接上荧光物质、放射性物质、治疗性物质、生物素、或酶标记物质,得到具有相同功能的核酸适体衍生物。
[0034]
本发明的第二个目的是提供所述的核酸适体或者核酸适体衍生物在靶向结合猪鼻支原体或者猪鼻支原体感染的细胞中的应用。用于科学研究,排除诊断目的。
[0035]
本发明的第三个目的是提供所述的核酸适体或者核酸适体衍生物在制备靶向结合猪鼻支原体试剂中的应用。
[0036]
本发明的第四个目的是提供所述的核酸适体或者核酸适体衍生物在制备靶向结合猪鼻支原体感染的细胞试剂中的应用。
[0037]
本发明的第五个目的是提供所述的核酸适体或者核酸适体衍生物在制备检测猪鼻支原体感染的试剂中的应用。
[0038]
本发明的第六个目的是提供所述的核酸适体或者核酸适体衍生物在制备检测猪鼻支原体感染细胞的试剂中的应用。
[0039]
本发明的第七个目的是提供所述的核酸适体或者核酸适体衍生物在制备检测猪鼻支原体感染细胞体内活体成像的试剂中的应用。
[0040]
本发明的特点在于:
[0041]
利用猪鼻支原体感染细胞和cell
‑
selex核酸适体筛选技术,制备一个包含10
14
‑
10
15
个不同dna序列的文库,以被猪鼻支原体感染的细胞为正筛细胞,以未被猪鼻支原体感染的细胞作为反筛细胞,在筛选过程中,移除结合反筛细胞的dna,保留结合正筛细胞的dna并进行pcr扩增,如此重复这个筛选过程并通过连接在dna分子上的荧光基团检测dna与细胞的结合能力,直到通过测序获得明确的dna序列。
[0042]
核酸适体是一种类似抗体,但具有分子量小、热稳定性好、容易化学修饰、低免疫原性的核酸类分子探针和核酸药物。本发明所述的识别和靶向结合猪鼻支原体的核酸适体,能高亲和力高特异性结合猪鼻支原体和被猪鼻支原体感染的细胞,可用于检测细胞是否存在猪鼻支原体感染,其识别机制是结合细胞表面的猪鼻支原体的p37蛋白,并可通过结合猪鼻支原体p37蛋白,阻断猪鼻支原体感染细胞,以及治疗被猪鼻支原体感染的细胞,并具有抑制猪鼻支原体带来的细胞迁移和侵袭能力增强的作用,还能增加猪鼻支原体感染细胞对吉西他滨的药物敏感性。
[0043]
总之,所述的识别猪鼻支原体的核酸适体,可用于制备检测猪鼻支原体的诊断试剂,还可用于制备预防和治疗猪鼻支原体感染的试剂、用于制备抑制由猪鼻支原体带来的细胞迁移和侵袭的治疗试剂和逆转由猪鼻支原体带来的吉西他滨耐药性等,具有很好的应用前景。
附图说明
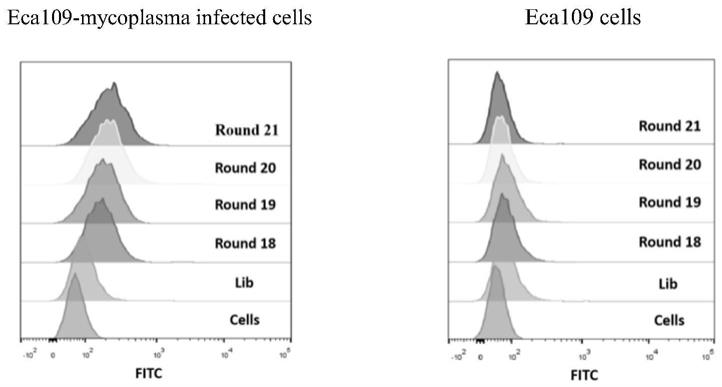
[0044]
图1为流式细胞术检测核酸适体筛选过程中dna文库对猪鼻支原体感染的eca109
‑
mycoplasma infected细胞和未感染的eca109细胞的结合能力;
[0045]
图1中横坐标为dna荧光强度,纵坐标为细胞数目。
[0046]
图2为本发明实施例中核酸适体(seq no.1/seq no.2/seq no.3/seq no.4/seq no.5/seq no.6/seq no.7)与eca109
‑
mycoplasam infected细胞以及未感染的eca109细胞的结合能力;
[0047]
图2中横坐标为dna荧光强度,纵坐标为细胞数目。
[0048]
图3为使用激光共聚焦显微镜检测本发明实施例中核酸适体(seq no.1/seq no.2/seq no.3/seq no.4/seq no.5/seq no.6/seq no.7)与eca109
‑
mycoplasam infected细胞的结合情况。
[0049]
图4为本发明实施例中核酸适体(seq no.1/seq no.2/seq no.3/seq no.4/seq no.5/seq no.6/seq no.7)与eca109
‑
mycoplasma infected细胞的亲和解离常数k
d
值。
[0050]
图5为本发明实施例中核酸适体seq no.1与seq no.1/seq no.2/seq no.3/seq no.4/seq no.5/seq no.6/seq no.7竞争性结合实验结果。
[0051]
图6为使用激光共聚焦显微镜检测猪鼻支原体与核酸适体seq no.7在细胞上的共定位情况。
[0052]
图7为使用流式细胞术检测本发明实施例中核酸适体seq no.7与猪鼻支原体直接结合的能力。
[0053]
图8为采用小动物活体成像仪检测seq no.7核酸适体对被猪鼻支原体感染细胞的小鼠移植瘤模型中的靶向富集作用。
[0054]
图9为运用核酸适体拖下实验和聚丙烯酰胺凝胶电泳分析seq no.7核酸适体的具体蛋白靶标。
[0055]
图10为质谱鉴定聚丙烯酰胺凝胶电泳目的蛋白条带中的具体蛋白分析表格。
[0056]
图11为基于核酸适体的elona实验检测p37纯蛋白与seq no.7的亲和解离常数。
[0057]
图12为使用seq no.7核酸适体抑制猪鼻支原体感染的eca109细胞的迁移能力。
[0058]
图13为使用seq no.7核酸适体抑制猪鼻支原体感染的eca109细胞的侵袭能力。
[0059]
图14为使用seq no.7核酸适体阻断猪鼻支原体感染eca109细胞。
[0060]
图15为使用seq no.7核酸适体减少已感染猪鼻支原体的eca109细胞中的猪鼻支原体含量。
[0061]
图16为使用seq no.7核酸适体增强猪鼻支原体感染的eca109细胞对吉西他滨药物的敏感性。
具体实施方式
[0062]
以下结合实施例旨在进一步说明本发明,而非限制本发明。
[0063]
实施例1构建猪鼻支原体感染细胞模型
[0064]
细胞来源:本实验所用的eca109细胞(食管癌细胞)来自武汉中科院细胞库。筛选过程以感染支原体的eca109细胞(eca109
‑
mycoplasma infected)为正向筛选,未感染的eca109细胞为反向筛选。
[0065]
猪鼻支原体(atcc 17981)从美国atcc购买得到,在hayflick培养基中培养5天至培养基颜色从橙红色变为黄色,利用梯度稀释法检测支原体浓度为106ccu/ml,培养eca109细胞至80%密度,将猪鼻支原体菌液用细胞培养基稀释10倍与细胞共同培养,培养2天后传代并再次加入支原体菌液,重复这个过程将细胞传代2次后停止添加支原体,继续正常培养细胞并传代,用支原体pcr检测试剂盒检测细胞被支原体感染的程度以确认细胞已完全被支原体感染。
[0066]
实施例2 cell
‑
selex技术筛选核酸适体。
[0067]
设计核酸文库:
[0068]5’‑
accgaccgtgctggactcannnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnactatgagcgagcctggcg
‑3’
(n代表a、t、c、g四种碱基);seq no.8
[0069]
正向引物:5
’‑
fitc
‑
accgaccgtgctggactca
‑3’
seq no.9
[0070]
反向引物:5
’‑
biotin
‑
cgccaggctcgctcatagt
‑3’
seq no.10
[0071]
筛选过程
[0072]
本发明以被猪鼻支原体感染的eca109
‑
mycoplasma infected细胞作为正筛选细胞,以未被感染的eca109细胞作为反筛选细胞。
[0073]
1、正筛选:
[0074]
a.用结合缓冲液溶解上述文库,95℃变性5min,立即放置于冰上复性10min,然后移去eca109
‑
mycoplasma infected细胞的培养基,加入文库溶液,放置在4℃孵育1小时,孵育完后,将上清溶液去除,用洗涤缓冲液冲洗细胞数次并弃去,然后加入无菌水,并将细胞挂下,加入到离心管中,95℃加热裂解5min,冰上冷却10min,6000rpm离心5min,吸取上清液即得到第一轮正筛选后产物。
[0075]
b.以步骤a中得到的产物作为pcr模板,上述引物作为pcr引物,进行pcr扩增,扩增条件为:95℃30s,58℃30s,72℃30s,72℃5min,扩增10个循环,得到初步扩增产物,之后以扩增产物为模板再次进行扩增以得到更大量的产物。
[0076]
c.用链霉亲和素修饰的琼脂糖株与步骤b中得到的pcr产物进行孵育以便将dna产物双链中的反义链连接在琼脂糖珠上,然后加入0.2m的naoh将dna双链变性,收集fitc标记的dna正义链,脱去其中的盐离子后溶解在无酶水中。
[0077]
2、反筛选:
[0078]
将上述收集到的dna正义链真空冻干至粉末,溶解在结合缓冲液中,按上述步骤a中的方法将dna正义链与反筛细胞eca109细胞进行孵育1小时,并收集上清液,以排除掉与反筛细胞结合的dna序列,收集的上清液可以与正筛细胞进行下一轮正筛选。
[0079]
3、筛选过程的循环:重复正筛选和反筛选的过程,持续20轮左右,直到筛选到与eca109
‑
mycoplasma infected细胞有较强结合的dna文库。
[0080]
4、筛选过程的监测:将筛选得到不同轮数的dna正义链冻干至粉末,溶解在结合缓冲液中,培养eca109
‑
mycoplasma infected细胞与未感染eca109细胞至80%密度,用0.2%edta消化细胞,进行细胞计数,将每20万细胞与终浓度为250nm的dna正义链进行4℃孵育0.5小时,然后离心去除上清中的核酸序列,用洗涤缓冲液洗细胞3次,通过流式细胞仪进行细胞的荧光检测,结果见图1。
[0081]
5、高通量测序:将筛选21轮后的dna产物进行高通量测序。
[0082]
实施例3流式细胞术检测高通量测序得到的核酸序列对细胞的结合能力
[0083]
将高通量测序得到的富集率最高的核酸序列命名为seq no.1,其序列为:
[0084]5’‑
accgaccgtgctggactcacgtcgtccatttccttgaaaaaggcacgggttccatgaactcactatgagcgagcctggcg
‑3’
;
[0085]
在seq no.1的中间区段进行碱基更换获得与其功能相同的核酸适体:
[0086]
seq no.2:
[0087]5’‑
accgaccgtgctggactcaagcggtttccgtgaacctgcgagttccctgaatacttgtactatgagcgagcctggcg
‑3’
[0088]
seq no.3:
[0089]5’‑
accgaccgtgctggactcagatccatttccttgaaaaaggcacgggttcccagaactcaactatgagcgagcctggcg
‑3’
[0090]
seq no.4:
[0091]5’‑
accgaccgtgctggactcaatcgggatccatgtatccaggttcgttccttgaatggcacactatg
agcgagcctggcg
‑3’
[0092]
seq no.5:
[0093]5’‑
accgaccgtgctggactcaactgctgagccaattcttaataaagcacgggttcctagaactcaactatgagcgagcctggcg
‑3’
[0094]
seq no.6:
[0095]5’‑
accgaccgtgctggactcaatcgggatcctagatccagcgagttccccgaatgctttgcactatgagcgagcctggcg
‑3’
。
[0096]
在seq no.1的3’端区段进行碱基删减获得与其功能相同的核酸适体seq no.7:
[0097]5’‑
accgaccgtgctggactcacgtcgtccatttccttgaaaaaggcacgggttccatgaactcactatgagc
‑3’
。
[0098]
通过上海生工公司合成该序列,并进行fitc标记,将合成好的dna粉末用结合缓冲液溶解。
[0099]
培养eca109
‑
mycoplasma infected细胞和未感染eca
‑
109细胞至80%密度,用0.2%edta溶液消化细胞,将每20万细胞与终浓度为250nm的核酸序列进行4℃孵育0.5小时,然后离心去除上清中的核酸序列,用洗涤缓冲液洗细胞3次,通过流式细胞仪进行细胞的荧光值检测,以初始dna筛选文库对细胞的结合荧光强度作为阴性对照,结果见图2。
[0100]
实施例4激光共聚焦显微镜检测本发明实施例中核酸适体seq no.1/seq no.2/seq no.3/seq no.4/seq no.5/seq no.6/seq no.7与eca109
‑
mycoplasam infected细胞的结合情况。
[0101]
将eca109
‑
mycoplasma infected细胞接种于光学培养皿中至80%密度,弃去上清培养基,加入dpbs润洗一遍,然后加入结合缓冲液,加入标记了fitc荧光素的终浓度为250nm核酸适体,室温孵育1小时后弃去上清液,用洗涤缓冲液润洗3遍,每次5分钟,然后用激光共聚焦显微镜通过488nm激发光观察核酸适体结合细胞的情况,结果见图3。图中结果显示seq no.1/seq no.2/seq no.3/seq no.4/seq no.5/seq no.6/seq no.7结合在细胞表面均发出绿色荧光,而lib没有荧光显现。
[0102]
实施例5流式细胞术检测核酸适体seq no.1/seq no.2/seq no.3/seq no.4/seq no.5/seq no.6/seq no.7对eca109
‑
mycoplasma infected细胞的亲和解离常数
[0103]
将eca109
‑
mycoplasma infected细胞培养至80%密度,用0.2%edta消化细胞,进行细胞计数,分为2组,一组将20万细胞分别与25nm、50nm、75nm、100nm、200nm、300nm、400nm、600nm的核酸适体seq no.1/seq no.2/seq no.3/seq no.4/seq no.5/seq no.6/seq no.7孵育0.5小时,另一组将20万细胞分别与25nm、50nm、75nm、100nm、200nm、300nm、400nm、600nm的初始筛选文库lib孵育0.5小时,然后离心去除上清中的核酸序列,用洗涤缓冲液洗细胞3次,再进行流式细胞术检测细胞的荧光强度,计算每个浓度下的平均荧光强度和对应的浓度值,将核酸适体seq no.1/seq no.2/seq no.3/seq no.4/seq no.5/seq no.6/seq no.7每个浓度下的荧光值减去同样浓度初始筛选文库lib的荧光值,以减除非特异结合产生的荧光值,通过公式y=b
max
x/(k
d
x)进行计算每条核酸适体的k
d
值,其中y为荧光值,b
max
为最大荧光值,x为核酸浓度,k
d
为亲和解离常数,结果见图4。
[0104]
实施例6流式细胞术检测核酸适体seq no.1/seq no.2/seq no.3/seq no.4/seq no.5/seq no.6/seq no.7结合表位竞争性分析。
[0105]
将eca109
‑
mycoplasma infected细胞培养至80%密度,用0.2%edta消化细胞,进行细胞计数,将带有fitc荧光修饰的seq no.1分别与未带有荧光修饰的lib/seq no.1/seq no.2/seq no.3/seq no.4/seq no.5/seq no.6/seq no.7进行混合,带有荧光修饰的seq no.1的终浓度为250nm,未带荧光修饰的核酸序列终浓度为2.5μm,将各组与20万eca109
‑
mycoplasma infected细胞进行孵育0.5小时,然后离心去除上清中的核酸序列,用洗涤缓冲液洗细胞3次,再进行流式细胞术检测细胞的荧光强度,结果见图5。
[0106]
图5中可见fitc标记的seq no.1可结合细胞检测到较强荧光,在加入2.5μm的无标记lib后对其结合无明显影响,加入2.5μm的无标记的核酸适体seq no.1/seq no.2/seq no.3/seq no.4/seq no.5/seq no.6/seq no.7之后,可以明显减弱seq no.1的结合能力,说明有竞争性结合现象,因此可得知所有核酸适体其结合的表位是同一表位,具有相同的靶标和功能。
[0107]
实施例7激光共聚焦实验检测猪鼻支原体与核酸适体seq no.7在eca109
‑
mycoplasma infected细胞上的共定位情况。
[0108]
将eca109
‑
mycoplasma infected细胞接种于光学培养皿中至80%密度,弃去上清培养基,加入dpbs润洗一遍,然后加入结合缓冲液,加入抗猪鼻支原体p37蛋白抗体1μl,室温孵育1小时后洗去上清液,重新加入结合缓冲液,加入2μl偶联fitc荧光素的二抗,再加入标记了cy5荧光素的终浓度为250nm核酸适体seq no.7,同时将浓度为2μg/ml hoechst 33342染色液加入10μl,室温孵育1小时后弃去上清液,用洗涤缓冲液润洗3遍,每次5分钟,然后用激光共聚焦显微镜通过405nm、488nm、640nm激发光观察支原体和核酸适体的定位情况,结果见图6。
[0109]
图6中hoechst 33342染料会将细胞中具有dna的部分染色,当支原体感染细胞时黏附于细胞膜上,由于支原体本身也具有dna结构,因此hoechst 33342会将膜上的支原体染色并呈现出来,p37蛋白为猪鼻支原体特有的膜蛋白,可作为猪鼻支原体的蛋白标志物,因此用hoechst 33342染料表征细胞被支原体感染,用p37抗体表征细胞被猪鼻支原体感染,而核酸适体seq no.7对细胞的染色与前2者的染色分布具有一致性。
[0110]
实施例8流式细胞术检测核酸适体seq no.7直接结合猪鼻支原体的能力
[0111]
在105ccu/ml的猪鼻支原体菌液中加入5μl靶向猪鼻支原体特异性抗原p37蛋白的抗体,再加入偶联了山羊抗鼠二抗的磁珠进行孵育2小时,将猪鼻支原体通过抗体连接在磁珠上,洗脱多余的液体后,将磁珠重悬在结合缓冲液中,加入偶联fitc荧光的核酸适体seq no.7或者初始筛选文库lib孵育30分钟,洗脱3次后,通过流式细胞仪对磁珠的荧光值进行分析,结果见图7。
[0112]
图7中横坐标为荧光强度,纵坐标为磁珠数目,此实验将培养基中培养的猪鼻支原体通过抗体偶联在磁珠上,再利用fitc标记的核酸适体seq no.7结合猪鼻支原体,流式细胞仪检测磁珠上荧光值,此实验去除了细胞的干扰,能进一步阐明核酸适体可以直接结合猪鼻支原体。
[0113]
实施例9动物活体成像仪检测核酸适体seq no.7在荷瘤小鼠模型中体内活体成像中的应用
[0114]
购买4周龄balb/c nude小鼠,每只小鼠皮下注射7
×
106个eca109 mycoplasma infected细胞,待瘤体长到1cm3左右,将小鼠随机分为2组,一组小鼠通过尾静脉注射5nmol
标记cy5荧光分子的核酸适体seq no.7,另一组注射5nmol标记cy5荧光分子的初始筛选核酸文库lib,10分钟后用活体成像仪拍摄小鼠体内cy5荧光的富集情况,之后每隔30分钟拍摄一次,3小时后安乐处死小鼠,解刨出小鼠各器官,检测各器官的荧光核酸适体的分布情况,结果见图8。
[0115]
图8中将eca109 mycoplasma infected细胞植于免疫缺陷小鼠皮下,待肿瘤长至合适大小,从小鼠尾静脉注射cy5荧光素标记的核酸适体seq no.7或cy5荧光素标记初始筛选文库,结果显示核酸适体seq no.7能在小鼠体内结合感染了猪鼻支原体的肿瘤组织部位,表示核酸适体在体内的良好结合能力。
[0116]
实施例10核酸适体拖下实验和质谱鉴定蛋白靶标
[0117]
将eca109
‑
mycoplasma infected细胞大量扩增培养,由于之前的共聚焦实验已经证明核酸适体结合在细胞膜表面,因此通过膜蛋白提取试剂盒提取细胞的膜蛋白,然后将膜蛋白与蛋白封闭液孵育1小时,再将膜蛋白与生物素修饰的核酸适体seq no.7或者生物素修饰的随机dna文库序列进行孵育1小时,然后加入100μl链霉亲和素修饰的琼脂糖珠进行孵育1小时,离心去除上清液,用dpbs洗琼脂糖珠5次,去除不结合的核酸序列,然后向琼脂糖珠中加入50μl蛋白上样缓冲液,95℃温育10min,离心后取上清进行聚丙烯酰胺凝胶电泳,电泳完成后,将电泳胶进行考马斯亮蓝染色,然后洗脱非特异性染色,用扫描仪扫描胶的图片,将差异蛋白条带切下进行质谱分析,结果见图9和图10。
[0118]
图9中可见seq no.7泳道中有一条明显的不同于其他泳道的蛋白,以红框标出,此蛋白很可能为核酸适体特异性结合的蛋白,即靶标蛋白,将其用刀片切下进行质谱分析。
[0119]
图10中展示了经过质谱分析出该条带中蛋白的得分、覆盖率、独特肽段以及相对丰度,从图中可见位列于第一位的为猪鼻支原体高亲和力转运蛋白p37,此蛋白即为核酸适体seq no.7的靶标蛋白。
[0120]
实施例11酶联寡聚核苷酸吸附试验(enzyme
‑
linked oligonucleotide assay,elona)实验检测核酸适体seq no.7与gst
‑
p37纯化蛋白的亲和解离常数
[0121]
利用大肠杆菌系统原核表达出了高纯度的gst
‑
p37和gst蛋白,将gst
‑
p37和gst蛋白稀释到5μg/ml,加入100ul到96孔酶标板中,4℃孵育过夜后将上清弃去,pbst溶液洗孔3次,加入1%bsa溶液封闭2小时,将封闭液弃掉,pbst洗孔3次,分别将600nm、400nm、200nm、100nm、50nm、25nm、12.5nm、6.25nm、3.125nm、1.5nm、0.75nm、0.375nm、0.153nm的biotin修饰的seq no.7核酸适体加入gst和gst
‑
p37孔中,同时在对照孔中加入相同浓度的biotin修饰的初始筛选文库lib作为对照,室温孵育2小时,将溶液弃掉,用pbst洗孔3次,加入1:2000稀释的辣根过氧化物酶标记链霉亲和素溶液,室温孵育1小时,用pbst洗孔3次后,加入200μl tmb显色液显色5分钟,然后加入50μl tmb显色终止液,使用酶标仪检测od450的吸光度,用各个浓度的seq no.7核酸适体的吸光度减去相应浓度的初始筛选文库lib浓度的吸光度,去除lib的非特异性结合数值,通过公式y=b
max
x/(k
d
x)进行计算亲和解离常数k
d
值,结果见图11。
[0122]
酶联寡聚核苷酸吸附试验是与elisa实验原理相类似的实验,此实验中利用酶标96孔板将带有gst标签的p37蛋白和gst蛋白吸附在孔板底部,gst蛋白为阴性对照蛋白,加入不同浓度的核酸适体seq no.7到吸附有gst
‑
p37蛋白和gst蛋白的孔中孵育,同样也加入不同浓度的初始筛选文库lib到吸附有gst
‑
p37蛋白和gst蛋白的孔中孵育,利用核酸序列
标记的biotin生物素与hrp
‑
亲和素结合,再与底物tmb进行显色,反映出seq no.7或lib对蛋白的结合能力,将seq no.7组的酶标仪读值减去lib组的读值,去除非特异结合,制作标准曲线,利用公式计算出亲和解离常数k
d
,图中显示出seq no.7的k
d
值为4.75
±
1.16nm,证明能高亲和力结合gst
‑
p37蛋白,不结合gst蛋白,说明其对p37的是特异性结合。
[0123]
实施例12核酸适体seq no.7抑制eca109
‑
mycoplasma infected细胞的迁移能力的实验。
[0124]
将eca109
‑
mycoplasma infected细胞接种于96孔板中,待细胞密度达到95%,使用划痕仪进行细胞划痕处理,弃去上清培养基,更换为1%血清浓度的培养基,加入核酸适体seq no.7和初始筛选文库lib序列至终浓度为2μm,在24小时后时间点利用显微镜拍摄细胞划痕愈合的图像,结果见图12。
[0125]
图12中将细胞用仪器划出等距离的沟痕,去除沟痕中的细胞,然后将培基的血清含量降低至1%,抑制其增殖能力,一定时间后,细胞会利用其迁移能力向沟痕中移动,以沟痕的宽度来衡量其迁移能力的高低,图中显示出,相比与lib,seq no.7组的沟痕宽度更宽,说明seq no.7可以抑制细胞的迁移能力。
[0126]
实施例13核酸适体seq no.7抑制eca109
‑
mycoplasma infected细胞的侵袭能力的实验。
[0127]
将corning matrigel基质胶与dmem培养基1:10比例配比,加入8μm transwell小室的上室中,37℃温育2小时使基质胶凝结在小室底部,弃去未凝结的上清液,用1%血清浓度dmem将eca109
‑
mycoplasma infected细胞接种于小室上室中并加入核酸适体seq no.7和初始筛选文库lib至终浓度为2μm,下室中加入10%血清的dmem培养基,48h后弃去培养基,用棉签擦去上室中未侵袭的细胞,然后进行多聚甲醛固定和结晶紫染色,拍摄染色细胞的数量,结果见图13。
[0128]
细胞的侵袭是指由细胞外泌酶蛋白分解细胞外基质的能力,实验中以matrigel基质胶模拟细胞外基质,当细胞酶解matrigel基质胶后能穿过transwell小室,到达小室底部,进而被结晶紫染色,染色的细胞数量能反映细胞的侵袭能力的高低,图中可见相比与lib,seq no.7组染色的细胞数量更少,说明seq no.7可以抑制细胞的侵袭能力。
[0129]
实施例14核酸适体seq no.7阻断猪鼻支原体感染细胞的实验。
[0130]
扩增p37基因的引物:
[0131]
p37
‑
qpcr
‑
f:5'
‑
tatctcattgaccttgactaac
‑
3'seq no.11
[0132]
p37
‑
qpcr
‑
r:5'
‑
attttcgccaatagcatttg
‑
3'seq no.12
[0133]
扩增gapdh的引物:
[0134]
gapdh
‑
f:5'
‑
tgaaggtcggagtcaacgg
‑
3'seq no.13
[0135]
gapdh
‑
r:5'
‑
cctggaagatggtgatggg
‑
3seq no.14
[0136]
将未感染猪鼻支原体的eca109细胞接种于24孔板中至80%密度,设置初始筛选文库lib处理孔、核酸适体seq no.7处理孔,然后在孔板中都加入猪鼻支原体至105ccu/ml,加入核酸适体seq no.7至终浓度为0.1μm、0.2μm、0.4μm、0.6μm、0.8μm、1μm、2μm、4μm或加入初始筛选文库lib至终浓度为同样的浓度,放置培养箱培养24小时后,弃去上清培养基,用dpbs润洗细胞3遍,用0.2%edta溶液消化细胞并置于离心管中,离心去除上清液,加入dpbs洗一遍,离心去除dpbs,加入100μl去离子超纯水,95℃温育10min,12000rpm离心2min,取上
清液进行实时荧光定量pcr检测ct值,计算p37基因的含量,以gapdh基因作为参照计算2^
‑
δδct
,通过比值确定细胞上感染猪鼻支原体的比率,结果见图14。
[0137]
图14中在未感染的细胞中加入猪鼻支原体,然后加入核酸适体seq no.7或lib,随着seq no.7浓度的递增,通过qpcr检测到细胞表面的猪鼻支原体含量逐渐减少,而lib无此作用,证明核酸适体具有阻断猪鼻支原体感染的作用。
[0138]
实施例15核酸适体seq no.7治疗猪鼻支原体感染细胞的实验。
[0139]
将已感染猪鼻支原体的eca109
‑
mycoplasma infected细胞接种在24孔板中,设置初始筛选文库lib处理孔(lib)、核酸适体seq no.7处理孔(seq no.7),在相应的孔加入dna文库或者核酸适体至2μm,放置在培养箱培养24小时后,弃去上清培养基,用dpbs润洗细胞3遍,用0.2%edta溶液消化细胞并置于离心管中,离心去除上清液,加入dpbs洗一遍,离心去除dpbs,加入100μl去离子超纯水,95℃温育10min,12000rpm离心2min,取上清液进行p37和gapdh的实时荧光定量pcr(与实施例14是相同的引物),以gapdh基因作为参照计算2^
‑
δδct
,进而计算感染率,结果见图15。
[0140]
图15为使用seq no.7治疗已被猪鼻支原体感染的细胞,经过核酸适体处理后的细胞感染程度降低。
[0141]
实施例16核酸适体seq no.7增强猪鼻支原体感染细胞对吉西他滨吉他西滨的药物敏感性。
[0142]
将已感染猪鼻支原体的eca109
‑
mycoplasma infected细胞接种在96孔板中,每孔5000个细胞,设置以下几个实验组:无处理组(nc,除了细胞,什么都不加)、gem组(即仅仅添加吉他西滨组),gem 初始筛选文库lib处理组(添加吉他西滨 lib)、gem 核酸适体seq no.7处理组(添加吉他西滨 seq no.7),接种后在核酸适体seq no.7处理组的孔中加入核酸适体seq no.7至2μm,在初始筛选文库lib处理组的孔中加入初始筛选文库lib至终浓度为2μm,将细胞放置在培养箱培养24小时之后待细胞贴壁,弃去上清,添加新鲜培养基100μl,然后在除nc组之外的所有孔中加入吉西他滨溶液至终浓度为3μm,将培养板放置在培养箱孵育72小时后在孔中加入10μl cck8溶液,根据酶标仪od450的读值计算细胞存活率,结果见图16。
[0143]
图16中,由于已有研究报道猪鼻支原体可引起细胞对化疗药物吉西他滨的耐药性,因此在加入核酸适体seq no.7之后,减少了细胞上猪鼻支原体的含量,逆转了耐药性,因此能增强吉西他滨的作用,使细胞存活率更低。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

