用于基因组应用和治疗应用的核酸分子的克隆复制和扩增的系统和方法
1.本技术为一项发明专利申请的分案申请,其母案的申请日为2015年04月11日、申请号为cn201580030686.1、发明名称为“用于基因组应用和治疗应用的核酸分子的克隆复制和扩增的系统和方法”。
技术领域
2.本发明的实施方案大体上涉及核酸分子的复制和扩增的领域。更确切地说,本发明的某些实施方案涉及使用滚环复制从生物样品复制dna分子。本发明的其它实施方案涉及使用滚环扩增从生物样品扩增dna分子。本发明的某些实施方案可以用于表征源自于生物样品的基因组中的序列变异。本发明的某些实施方案可以用于对源自于生物样品的整个染色体或其部分进行分子计数。本发明的某些实施方案可以用于表征源自于生物样品的基因组中的单倍型结构。本发明的某些实施方案可以应用于基因组科学、生物医药研究、诊断测定、以及疫苗和治疗剂开发中的样品制备和分析。
背景技术:
3.全基因组技术,如高密度基因分型阵列和下一代测序(ngs)可以鉴定给定的个体或物种的序列变异,特别是单核苷酸多态性(snp)和单核苷酸变体(snv),这些在本文被统称为“序列变体”。然而,当前的方法不能确定同一个dna分子上那些序列变体的组合。确定序列变体的组合被称作“定相(phase)”并且同一个dna分子上序列变体的特定组合被称作“单倍型”。举例来说,人类个体是二倍体的,每一个体细胞含有从每一个亲本遗传而来的两组常染色体。表征给定的个体的单倍型状态对于定位疾病基因、阐明群体病史、以及研究顺式作用变体和反式作用变体在表型表达中的平衡来说是重要的。
4.存在三种确定单倍型信息的一般方法:(i)群体推断;(ii)亲本推断;以及(iii)分子单倍型分析。用于对单倍型进行定相的最常见的方法是使用来自从群体基因型或亲本基因型获得的数据的推断和统计方法。然而,在整个基因组上的单倍型信息不能使用计算方法来分辨,特别是当给定的染色体区域的连锁不平衡较低时以及对于罕见变体来说。另一方面,亲本推断方法依靠在家庭谱系的背景下序列变异的基因遗传的原理。虽然在正确执行时是有效的,但是许多生物样品缺乏足够的谱系信息或需要适当的家族样品来推断所关注的给定样品的单倍型状态。
5.已知多种分子单倍型分析方法克服了基于计算的方法的限制。这些分子方法包括分离单个dna分子或单个dna分子的组,然后进行基因分型或测序以确定给定生物样品的单倍型结构的各种策略。一种这样的策略涉及构建大插入序列克隆(即f粘粒(fosmid))文库。然后将这些克隆在多孔板(即96孔板或384孔板)的单个孔中稀释,形成模板文库,进行条形编码以跟踪特定克隆到单个孔,并且通过基因分型或测序方法来表征。
6.对单个染色体或其部分的单倍型进行定相的挑战减少到对微量滴定板内稀释池中更小的dna片段(即在尺寸上从几百兆碱基到数十千碱基至数百千碱基)进行表征。还已
经报道了设定dna片段的尺寸或使用基因组dna而不是形成大插入序列克隆,继而是稀释,通过全基因组方法扩增,形成模板文库,并且测序以确定给定的样品的单倍型。还可以通过流式分选方法或显微解剖方法分离整个染色体或其部分,继而稀释,通过全基因组方法扩增,形成模板文库,并且进行基因分型或测序以确定来自生物样品的给定基因组的单倍型结构。所有这些方法均需要高水平的技术专长以及在对给定的生物样品的单倍型进行定相中形成大量的单个模板文库(约数百个)。
7.大多数的成像系统不能检测单个荧光事件,因此不得不对样品中的dna分子进行扩增。目前存在三种下一代测序方法:(i)乳液pcr(empcr);(ii)固相扩增;以及(iii)基于溶液的滚环复制。对于所有这些方法,通常使用标准物理剪切技术将基因组dna片段化以形成dna片段的文库。存在其中可能不需要片段化的例外。举例来说,一些生物来源,如从癌症患者或妊娠的女性获得的血浆或血清含有通常以小于1,000个碱基对(bp)并且在一些情况下小于500bp的尺寸存在的循环无细胞基因组dna片段。根据是否需要尺寸选择的中间步骤,然后将含有通用引发位点的衔接子序列连接到dna片段末端。使用共同pcr引物进行有限次数的pcr循环。这三种方法在这一步骤上有区别,但是在所有情况下,这些克隆扩增方法限于复制或扩增在尺寸上通常小于1,000bp的小片段,并且在更典型的实例中,限于700bp或更小。举例来说,illumina的固相扩增方法最多仅可以扩增具有700bp的尺寸的dna片段。这一尺寸限制制约了从头组装人类基因组的能力。
8.当前的全基因组技术,特别是ngs的显著缺点在于依赖于源自于短模板文库的序列读段,这些序列读段然后以大规模并行形式被克隆扩增。重要的是,当前的配对末端文库构建方法在本质上会破坏容易地鉴定出在正常人类基因组中存在的并且似乎在许多疾病的产生中特别重要的大的复杂的结构改变的能力。基因组结构变异可以代表早期肿瘤发生和癌症进展、疾病易感性、以及治疗抗性中的驱动力。源自于短模板文库的序列读段使得非常难以经由从头组装来完全分辨新型的、重复的以及疾病改变的序列。因而,大多数的全基因组测序工作仍依靠于将序列读段与参考基因组进行比对。因此,ngs数据集可能含有仍未表征的大段的人类基因组序列,并且对疾病机制的了解可能因缺乏基因组结构信息而有偏差。
9.大多数的全基因组测序工作仍依赖于将序列读段与参考基因组进行比对。虽然比对实验可以捕捉大部分的序列变体,但是需要约10kb至100kb的大模板来分辨大部分的结构变体和/或提供在整个人类基因组上单倍型的定相。许多分子生物学和计算机软件技术已经被用于克服尺寸限制。尽管获得了一定的改进,但是缺点是生物学工作流程的复杂性以及与试剂、劳动力、以及计算机硬件相关的成本显著增加。
10.通过将线性核酸片段的末端连接而形成dna环是一种非常低效的方法,这需要显著量的来自生物样品的起始物质。与通过使给定的dna片段的远端彼此靠近而形成环相关的问题从20世纪80年代起就已经是本领域公认的。举例来说,与通过使dna片段的末端连接在一起以形成环相关的一个问题是“分子内”连接事件(即同一个dna片段的dna环)与“分子间”连接事件(即被称作多联体的两个或更多个dna片段的连接)之间的竞争反应。与通过将dna片段的末端连接在一起以形成环相关的另一个问题是相较于更小的dna片段,必须将更大的dna片段进一步稀释以达到形成分子内环的合理的效率。
11.本领域需要将形成大dna环(即用于桑格测序(sanger sequencing)的5kb至7kb或
更大的大插入序列克隆)与下一代测序方法的高通量复制或扩增性质相结合的创新方法。本发明的某些实施方案通过以非尺寸依赖性方式形成dna环而克服了从大dna片段形成dna环的尺寸限制。本发明的其它实施方案通过掺入非尺寸依赖性dna环,通过形成和复制或扩增可用于许多基因组科学应用的大插入序列模板来克服直接扩增>1千碱基的模板的尺寸限制。本发明还通过提供更简单的使用哑铃状环制备大插入序列模板的工作流程以及改良的用于滚环复制和滚环扩增以形成用于测序应用的多个拷贝的方法来克服当前方法的研究人员工作的复杂性和相关的更高的成本。本发明的某些实施方案还通过提供更简单的用于制备依赖于通用引物序列的模板的工作流程来克服需要单独的等位基因鉴别引物以用于一组不同的异源核酸序列的基因分型和测序应用的限制。
技术实现要素:
12.本发明的一个实施方案是一种复制至少一个dna分子的方法。所述方法包括以下步骤:将至少一个dna分子片段化以形成至少一个片段化的dna分子;使一个或多个发夹结构连接到所述至少一个片段化的dna分子的每一个末端以形成至少一个哑铃状模板;使所述至少一个哑铃状模板与至少一种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;以及在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环复制以形成至少一个复制的哑铃状模板。
13.本发明的另一个实施方案是一种复制至少一个dna分子的方法。所述方法包括以下步骤:将至少一个dna分子片段化以形成至少一个片段化的dna分子;使一个或多个发夹结构连接到所述至少一个片段化的dna分子的每一个末端以形成至少一个哑铃状模板;通过用核酸外切酶处理任何未连接的发夹结构和任何未连接的片段化的核酸分子来将所述至少一个哑铃状模板纯化;使所述至少一个哑铃状模板与至少一种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;以及在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环复制以形成至少一个复制的哑铃状模板。
14.本发明的另一个实施方案是一种扩增至少一个dna分子的方法。所述方法包括以下步骤:将至少一个dna分子片段化以形成至少一个片段化的dna分子;使一个或多个发夹结构连接到所述至少一个片段化的dna分子的每一个末端以形成至少一个哑铃状模板;使所述至少一个哑铃状模板与至少一种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;以及在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环扩增以形成至少一个复制的哑铃状模板。
15.本发明的另一个实施方案是一种检测至少一个复制的哑铃状模板的方法。所述方法包括以下步骤:将至少一个dna分子片段化以形成至少一个片段化的dna分子;使一个或多个发夹结构连接到所述至少一个片段化的dna分子的每一个末端以形成至少一个哑铃状模板;使所述至少一个哑铃状模板与至少一种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环复制以形成至少一个复制的哑铃状模板;以及检测所述至少一个复制的哑铃状模板。在另一个实施方案中,所述检测所述至少一个复制的哑铃状模板的步骤由对所述至少一个复制的哑铃状模板进行测序组成。
16.本发明的另一个实施方案是一种检测至少一个复制的哑铃状模板的方法。所述方法包括以下步骤:将至少一个dna分子片段化以形成至少一个片段化的dna分子;使一个或多个发夹结构连接到所述至少一个片段化的dna分子的每一个末端以形成至少一个哑铃状模板;通过用核酸外切酶处理任何未连接的发夹结构和任何未连接的片段化的核酸分子来将所述至少一个哑铃状模板纯化;使所述至少一个哑铃状模板与至少一种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环复制以形成至少一个复制的哑铃状模板;以及检测所述至少一个复制的哑铃状模板。在另一个实施方案中,所述检测所述至少一个复制的哑铃状模板的步骤由对所述至少一个复制的哑铃状模板进行测序组成。
17.在某些实施方案中,所述检测所述至少一个复制的哑铃状模板的步骤包括使所述至少一个复制的哑铃状模板与寡核苷酸探针接触。在某些实施方案中,所述寡核苷酸探针是标记的寡核苷酸探针。在某些实施方案中,所述寡核苷酸探针是标记的dna探针。在某些实施方案中,所述寡核苷酸探针与荧光团连接。
18.本发明的另一个实施方案是一种检测至少一个扩增的dna分子的方法。所述方法包括以下步骤:将至少一个dna分子片段化以形成至少一个片段化的dna分子;使一个或多个发夹结构连接到所述至少一个片段化的dna分子的每一个末端以形成至少一个哑铃状模板;使所述至少一个哑铃状模板与至少一种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环扩增以形成至少一个扩增的dna分子;以及检测所述至少一个扩增的dna分子。在另一个实施方案中,所述检测所述至少一个扩增的dna分子的步骤由对所述至少一个扩增的dna分子进行测序组成。
19.在某些实施方案中,所述检测所述至少一个扩增的哑铃状模板的步骤包括使所述至少一个扩增的哑铃状模板与寡核苷酸探针接触。在某些实施方案中,所述寡核苷酸探针是标记的寡核苷酸探针。在某些实施方案中,所述寡核苷酸探针是标记的dna探针。在某些实施方案中,所述寡核苷酸探针与荧光团连接。
20.本发明的另一个实施方案是一种复制至少一个dna分子的方法。所述方法包括以下步骤:从样品中分离至少一个dna分子;将至少一个dna分子片段化以形成至少一个片段化的dna分子;使一个或多个发夹结构连接到所述至少一个片段化的dna分子的每一个末端以形成至少一个哑铃状模板;使所述至少一个哑铃状模板与至少一种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;以及在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环复制以形成至少一个复制的哑铃状模板。
21.本发明的另一个实施方案是一种扩增至少一个dna分子的方法。所述方法包括以下步骤:从样品中分离至少一个dna分子;将至少一个dna分子片段化以形成至少一个片段化的dna分子;使一个或多个发夹结构连接到所述至少一个片段化的dna分子的每一个末端以形成至少一个哑铃状模板;使所述至少一个哑铃状模板与至少一种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;以及在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环扩增以形成至少一个扩增的dna分子。
22.本发明的另一个实施方案是一种复制至少一个dna分子的方法。所述方法包括以下步骤:从样品中分离至少一个dna分子;使一个或多个发夹结构连接到所述至少一个dna分子的每一个末端以形成至少一个哑铃状模板;使所述至少一个哑铃状模板与至少一种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;以及在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环复制以形成至少一个复制的哑铃状模板。
23.本发明的另一个实施方案是一种扩增至少一个dna分子的方法。所述方法包括以下步骤:从样品中分离至少一个dna分子;使一个或多个发夹结构连接到所述至少一个dna分子的每一个末端以形成至少一个哑铃状模板;使所述至少一个哑铃状模板与至少一种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;以及在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环扩增以形成至少一个扩增的dna分子。
24.本发明的另一个实施方案是一种检测至少一个扩增的哑铃状模板的方法。所述方法包括将至少一个核酸分子片段化以形成至少一个片段化的核酸分子;使一个或多个发夹结构连接到所述至少一个片段化的核酸分子的每一个末端以形成至少一个哑铃状模板;通过用核酸外切酶处理任何未连接的发夹结构和任何未连接的片段化的核酸分子来将所述至少一个哑铃状模板纯化;使所述至少一个哑铃状模板与至少两种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环扩增以形成至少一个扩增的哑铃状模板;以及检测所述至少一个扩增的哑铃状模板。
25.本发明的另一个实施方案是一种扩增至少一个核酸分子的方法。所述方法包括从样品中分离至少一个核酸分子;使一个或多个发夹结构连接到所述至少一个核酸分子的每一个末端以形成至少一个哑铃状模板;通过用核酸外切酶处理任何未连接的发夹结构和任何未连接的片段化的核酸分子来将所述至少一个哑铃状模板纯化;使所述至少一个哑铃状模板与至少两种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;以及在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环扩增以形成至少一个扩增的哑铃状模板。
26.本发明的实施方案还包括一种试剂盒,所述试剂盒含有能够形成发夹结构的至少一种寡核苷酸;连接酶,用于使所述发夹结构连接到来自样品的至少一个核酸分子以形成至少一个哑铃状模板;核酸外切酶,用于通过消化任何未连接的发夹结构和任何未连接的核酸分子来将所述至少一个哑铃状模板纯化;以及聚合酶和与所述至少一个哑铃状模板的区域基本上互补的至少一种引物,用于复制所述至少一个哑铃状模板以形成至少一个复制的哑铃状模板。
27.本发明的某些实施方案包括一种试剂盒,所述试剂盒含有能够形成发夹结构的至少一种寡核苷酸;连接酶,用于使所述发夹结构连接到来自样品的至少一个核酸分子以形成至少一个哑铃状模板;核酸外切酶,用于通过消化任何未连接的发夹结构和任何未连接的核酸分子来将所述至少一个哑铃状模板纯化;以及复制体和与所述至少一个哑铃状模板的区域基本上互补的至少一种引物,用于复制所述至少一个哑铃状模板以形成至少一个复制的哑铃状模板。
28.本发明的某些实施方案包括一种试剂盒,所述试剂盒含有能够形成发夹结构的至少一种寡核苷酸;连接酶,用于使所述发夹结构连接到来自样品的至少一个核酸分子以形成至少一个哑铃状模板;核酸外切酶,用于通过消化任何未连接的发夹结构和任何未连接的核酸分子来将所述至少一个哑铃状模板纯化;以及聚合酶和与所述至少一个哑铃状模板的至少两个区域基本上互补的至少两种引物,用于扩增所述至少一个哑铃状模板以形成至少一个扩增的哑铃状模板。
29.本发明的某些实施方案包括一种试剂盒,所述试剂盒含有能够形成发夹结构的至少一种寡核苷酸;连接酶,用于使所述发夹结构连接到来自样品的至少一个核酸分子以形成至少一个哑铃状模板;核酸外切酶,用于通过消化任何未连接的发夹结构和任何未连接的核酸分子来将所述至少一个哑铃状模板纯化;以及复制体和与所述至少一个哑铃状模板的至少两个区域基本上互补的至少两种引物,用于扩增所述至少一个哑铃状模板以形成至少一个扩增的哑铃状模板。
附图说明
30.为了可以更详细地了解本发明的特征和益处以及将变得显而易见的其它特征和益处,可以通过参考本发明的示于附图中的实施方案来更具体描述本发明的实施方案,所述附图形成本说明书的一部分。然而,还应当指出的是,所述附图仅图示了本发明的各种实施方案并且因此不被认为是限制了本发明的范围,这是因为本发明也可以包括其它有效的实施方案。
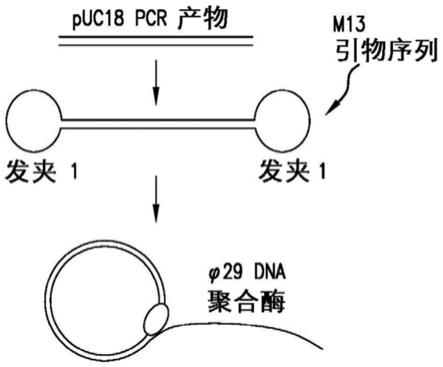
31.图1是根据本发明的一个实施方案的哑铃状模板的滚环复制的示例性方法的示意图。
32.图2是根据本发明的一个实施方案由哑铃状模板产生的滚环产物的琼脂糖凝胶分析的图像。
33.图3是根据本发明的一个实施方案的哑铃状模板的滚环复制的示例性方法的示意图。
34.图4是根据本发明的一个实施方案所产生的哑铃状模板和它们的滚环产物的琼脂糖凝胶分析的图像。
35.图5是根据本发明的一个实施方案所产生的哑铃状模板和它们的滚环产物的琼脂糖凝胶分析的图像。
36.图6是根据本发明的一个实施方案所产生的哑铃状模板的琼脂糖凝胶分析的图像。
37.图7是根据本发明的一个实施方案所产生的哑铃状模板的琼脂糖凝胶分析的图像。
38.图8是根据本发明的一个实施方案所产生的滚环产物的琼脂糖凝胶分析的图像。
39.图9是根据本发明的一个实施方案所产生的滚环产物的琼脂糖凝胶分析的图像。
40.图10是显示根据本发明的一个实施方案通过荧光检测发夹结构的图表。
41.图11a和11b是根据本发明的某些实施方案的示例性装置的图像。
具体实施方式
42.在详细描述本发明的实施方案之前,将对在本发明的实施方案的上下文中所使用的多个术语进行定义。除了这些术语之外,还根据需要在说明书的其它地方定义其它术语。除非本文另外明确定义,否则本说明书中所用的技术术语将具有它们的本领域认可的含义。
43.为了更容易地促进对本发明的理解,鉴于各种术语的常见用法和以下提供的明确定义,本文使用的术语的含义将根据本说明书的上下文而变得显而易见。如本文所用的术语“包含(comprise/comprising)”、“含有(contain/containing)”、“包括(include/including)”以及“诸如”是以它们的开放性的、非限制性的意义使用的。
[0044]“扩增的哑铃状模板”意指由于滚环扩增而产生多个拷贝靶序列的含有一个或多个发夹结构的一个核酸分子。
[0045]“接触”意指通过任何方式引入物质以促进与另一物质的相互作用的过程。举例来说而不限于,可以使哑铃状模板与一种或多种基本上互补的引物接触以促进一个或多个杂交过程以形成能够参与滚环复制或滚环扩增的一个或多个双链双链体区。
[0046]“检测核酸分子”意指使用可以确定所关注的核酸的存在或可以确定关于核酸序列的更详细的信息、在与参考序列相比较时核酸序列的改变、或核酸序列的一个或多个拷贝的存在或不存在的分析方法。
[0047]“哑铃状模板”意指具有一个或多个发夹结构的在结构上呈线性并且在拓扑上呈环状的体外复制型或体外扩增型核酸分子。当变性或基本上变性时,哑铃状模板以环状单链核酸分子的形式存在。哑铃状模板不同于体内复制型环状双链dna,例如而不限于质粒、粘粒、f粘粒、细菌人工染色体、以及酵母人工染色体,它们是借助于克隆载体技术形成的。不同于在适当的宿主细胞中独立复制的这些环状双链dna,哑铃状模板不需要在这样的宿主细胞中繁殖复制。
[0048]“片段化的核酸分子的末端”意指能够或待被使得能够参与连接反应的一个或多个末端核苷酸残基。在某些实施方案中,一个或多个核酸分子可以含有能够或待被使得能够进行连接反应以使一个或多个发夹结构连接到所述核酸分子的每一个末端的功能性末端。举例来说而不限于,5'末端的末端核苷酸含有磷酸酯基并且3'末端的末端核苷酸含有羟基。
[0049]“片段化的核酸分子”意指由片段化过程变成任意更小的核酸分子的任何更大的核酸分子。
[0050]“片段化”意指使用化学剂或生化剂以非序列依赖性方式(即随机)或以序列特异性方式使核酸分子断裂。举例来说,可以通过以下方法将核酸随机地片段化:使用dna酶i、核酸内切酶v、或转座酶的酶法;使用物理方法,如剪切、超声处理、或雾化,其中后者使核酸溶液通过小孔;或使用机械力,例如而不限于声学方法,特别是自适应聚焦声学方法。可以通过pcr,使用随机引物来制备随机的核酸片段。还可以通过序列特异性方法,例如而不限于,使用限制性核酸内切酶和多重pcr将核酸片段化。由一个或多个更大的核酸分子的片段化过程产生的片段的集合被称作文库。
[0051]“发夹结构”意指一种核酸分子,所述核酸分子内的两个或更多个部分序列彼此互补或基本上互补,从而引起部分双链区域和一个或多个内部单链区域的形成。所述发夹结
构还可以含有两个或更多个核酸分子,所述两个或更多个核酸分子由接头连接在一起并且所述两个或更多个核酸分子的两个或更多个部分序列彼此互补或基本上互补,从而引起部分双链区域和一个或多个内部单链区域的形成。
[0052]“分离核酸分子”意指从样品中获得核酸分子的过程。
[0053]“连接剂”意指使两个或更多个核酸分子共价连接,这是通过酶剂,例如而不限于dna连接酶或rna连接酶;或化学剂,例如而不限于使用水溶性碳二亚胺或溴化氰进行的缩合反应以及与自动化dna合成技术相关的标准操作而实现的,从而产生天然核酸骨架结构、修饰的核酸骨架结构、以及它们这两种骨架结构的组合。天然的核酸骨架结构例如而不限于由核苷酸残基之间的一个或多个标准磷酸二酯键组成。修饰的核酸骨架结构例如而不限于由一个或多个修饰的磷酸二酯键组成,所述修饰的磷酸二酯键诸如非桥氧原子被氮原子(即氨基磷酸酯键)或硫原子(即硫代磷酸酯键)取代、桥氧原子被硫原子取代(即硫代磷酸酯)、磷酸二酯键被肽键取代(即肽核酸或pna)、或形成一个或多个另外的共价键(即锁核酸或lna),所述锁核酸在核糖的2'
‑
氧与4'
‑
碳之间具有另外的键。修饰的键可以均是一种类型的修饰或可以是两种或更多种修饰类型的任何组合并且进一步可以包含一个或多个标准磷酸二酯键。
[0054]“接头”意指充当两个其它核酸分子之间的共价键合的分子桥的一个或多个二价基团(连接成员)。接头可以含有一个或多个连接成员和一种或多种类型的连接成员。示例性连接成员包括:
‑
c(o)nh
‑
、
‑
c(o)o
‑
、
‑
nh
‑
、
‑
s
‑
、
‑
s(o)n
‑
(其中n是0、1或2)、
‑
o
‑
、
‑
op(o)(oh)o
‑
、
‑
op(o)(o
‑
)o
‑
、烷二基、烯二基、炔二基、芳二基、杂芳二基或其组合。一些接头具有侧链或侧链官能团(或这两者)。侧链部分可以是亲水性改性剂(即提高接头的水溶性的化学基团),例如而不限于增溶基团,如
‑
so3h、
‑
so3‑
、co2h或co2‑
。
[0055]“核酸分子”意指包括标准规范碱基、高度修饰碱基、非天然碱基、或它们这些碱基的任何组合的任何单链或双链核酸分子。举例来说而不限于,核酸分子含有四种规范dna碱基,即腺嘌呤、胞嘧啶、鸟嘌呤、以及胸腺嘧啶;或四种规范rna碱基,即腺嘌呤、胞嘧啶、鸟嘌呤、以及尿嘧啶。当核苷含有2'
‑
脱氧核糖基时,尿嘧啶可以取代胸腺嘧啶。核酸分子可以从rna转化成dna以及从dna转化成rna。举例来说而不限于,可以使用逆转录酶使mrna形成互补dna(cdna),并且可以使用rna聚合酶使dna形成rna。核酸分子还可以含有一个或多个高度修饰碱基,例如而不限于5
‑
羟甲基尿嘧啶、5
‑
羟尿嘧啶、α
‑
腐胺基胸腺嘧啶、5
‑
羟甲基胞嘧啶、5
‑
羟基胞嘧啶、5
‑
甲基胞嘧啶、n4‑
甲基胞嘧啶、2
‑
氨基腺嘌呤、α
‑
氨基甲酰基甲基腺嘌呤、n6‑
甲基腺嘌呤、肌苷、黄嘌呤、次黄嘌呤、2,6
‑
二氨基嘌呤、以及n7‑
甲基鸟嘌呤。核酸分子还可以含有一个或多个非天然碱基,例如而不限于7
‑
脱氮
‑7‑
羟甲基腺嘌呤、7
‑
脱氮
‑7‑
羟甲基鸟嘌呤、异胞嘧啶(isoc)、5
‑
甲基异胞嘧啶、以及异鸟嘌呤(isog)。仅含有规范碱基、高度修饰碱基、非天然碱基、或它们这些碱基的任何组合的核酸分子还可以含有例如而不限于其中核苷酸残基之间的每一个键可以由标准磷酸二酯键组成,并且此外,可以含有一个或多个修饰的键,例如而不限于非桥氧原子被氮原子取代(即氨基磷酸酯键)、被硫原子取代(即硫代磷酸酯键)、或被烷基或芳基取代(即烷基膦酸酯或芳基膦酸酯);桥氧原子被硫原子取代(即硫代磷酸酯);磷酸二酯键被肽键取代(即肽核酸或pna);或形成一个或多个另外的共价键(即锁核酸或lna),所述锁核酸在核糖的2'
‑
氧与4'
‑
碳之间具有另外的键。术语“2'
‑
脱氧核糖核酸分子”的意思与术语“核酸分子”相同,限制是2'
‑
脱氧核糖基的2'
‑
碳原子含有至少一个氢原子。术语“核糖核酸分子”的意思与术语“核酸分子”相同,限制是核糖基的2'
‑
碳原子含有至少一个羟基。
[0056]“核酸序列”意指核酸分子中存在的规范碱基、高度修饰碱基、非天然碱基、或它们这些碱基的任何组合的顺序。
[0057]“进行”意指提供使得化学反应或生化反应能够进行以获得所期望的产物的所有必要的组分、试剂、以及条件。
[0058]“纯化”意指从给定混合物的所期望的组分分离基本上所有不希望有的组分。举例来说而不限于,纯化哑铃状模板指的是去除没有成功连接以形成任何给定尺寸范围的哑铃状模板的不希望有的核酸分子的方法。
[0059]“复制的哑铃状模板”意指由于滚环复制而产生靶序列的多个拷贝的含有一个或多个发夹结构的一个核酸分子。
[0060]“滚环扩增”或“rca”意指使用两种或更多种引物进行的生化过程,其中除原始的哑铃状模板之外,拷贝的核酸分子也在后续数轮的扩增中用作模板,以制备起始核酸分子的更多拷贝。
[0061]“滚环复制”或“rcr”意指使用一种或多种引物进行的生化过程,其中拷贝的核酸分子在后续数轮的复制中不用作模板,以制备起始核酸分子的更多拷贝。在某些实施方案中,当哑铃状模板是正链时,滚环复制产生负链的更多拷贝。在某些实施方案中,当哑铃状模板是负链时,滚环复制产生正链的更多拷贝。如本文所用的复制不同于扩增,所述扩增在后续数轮的扩增中利用拷贝的核酸以制备起始核酸分子的更多拷贝。
[0062]“样品”意指从含有所关注的核酸分子的生物样品或合成产生的来源中获得的材料。在某些实施方案中,样品是含有数据或信息被寻求的所期望的核酸的生物材料。样品可以包括疑似含有靶核酸分子的至少一个细胞、胎儿细胞、细胞培养物、组织标本、血液、血清、血浆、唾液、尿液、泪液、阴道分泌物、汗液、淋巴液、脑脊髓液、粘膜分泌物、腹膜液、腹水、粪便物、身体渗出物、脐带血、绒毛膜绒毛、羊水、胚胎组织、多细胞胚胎、裂解物、提取物、溶液、或反应混合物。样品还可以包括非人类来源,如非人类灵长类动物、啮齿类动物以及其它哺乳动物、病原物种,包括病毒、细菌、以及真菌。在某些实施方案中,样品还可以包括来自环境来源的分离物,以用于检测人类和非人类物种以及血液、水、空气、土壤、食物中的病原物种,以及用于在没有任何先验知识的情况下鉴定样品中的所有生物体。在某些实施方案中,样品可以含有被降解的核酸分子。核酸分子可以具有切口、断裂或修饰,它们是由暴露于物理力,如剪切力;恶劣环境,如热或紫外光;化学降解过程,如可以用于临床分析或法医分析的化学降解过程;由于微生物或老化所引起的生物降解过程;纯化或分离技术;或其组合所产生的。
[0063]“测序”意指可以鉴定出来自复制的哑铃状模板或扩增的哑铃状模板的核苷酸的顺序的任何生化方法。
[0064]“基本上互补的引物”意指与另一核酸分子形成稳定的双链双链体的核酸分子,尽管所述双链体区内的核酸序列的一个或多个碱基不与所述另一核酸序列碱基配对。
[0065]
单链核酸分子和双链核酸分子的基本结构是由碱基对相互作用决定的。举例来说,两条相反链上互补的或基本上互补的核苷酸之间碱基对的形成将使得这两条链彼此缠绕形成双螺旋结构。这被称作两条或更多条核酸分子链的互补核苷酸的分子间碱基配对。
术语“核苷酸”在本发明中被广义地定义为由糖、碱基以及一个或多个磷酸酯基组成的单元,对于它来说,所述糖例如而不限于由以下各项组成:核糖、具有与核糖基的一个或多个原子连接的另外的化学基团的修饰的核糖、2'
‑
脱氧核糖、或具有与2'
‑
脱氧核糖基的一个或多个原子连接的另外的化学基团的修饰的2'
‑
脱氧核糖;并且对于它来说,所述碱基例如而不限于由规范碱基、高度修饰碱基、或非天然碱基组成,如上述核酸分子定义中所述。互补的核苷酸或基本上互补的核苷酸的碱基配对也可以在同一个dna链分子上发生,这被称作互补的核苷酸或基本上互补的核苷酸的分子内碱基配对。
[0066]
发夹结构可以由给定核酸分子的互补的核苷酸或基本上互补的核苷酸的分子内碱基配对形成,这可以形成茎环结构。发夹结构的茎部分是由互补的核苷酸或基本上互补的核苷酸序列杂交以形成双链段而形成的。发夹结构的环区是核苷酸序列的未配对段的结果。发夹结构的稳定性取决于茎区的长度、核酸序列组成、以及碱基对互补或基本上互补的程度。举例来说,一段五个互补的核苷酸可以被认为比一段三个互补的核苷酸要更稳定,或一段主要由鸟嘌呤和胞嘧啶构成的互补核苷酸可以被认为比一段主要由腺嘌呤和胸腺嘧啶(dna)或尿嘧啶(rna)构成的互补核苷酸要更稳定。可以用修饰的核苷酸取代以改变这些天然碱基的双链茎区的稳定性,所述修饰的核苷酸的实例包括但不限于肌苷、黄嘌呤、次黄嘌呤、2,6
‑
二氨基嘌呤、n6‑
甲基腺嘌呤、5
‑
甲基胞嘧啶、7
‑
脱氮嘌呤、5
‑
羟甲基嘧啶。修饰的核苷酸还可以包括rna物质中存在的许多修饰碱基。天然存在的茎环结构主要存在于rna物质中,如转运rna(trna)、微rna前体、核糖酶以及它们的等同物。
[0067]
核酸发夹结构可以通过有意的设计,使用制造合成寡核苷酸的方法来产生。寡核苷酸被广泛地用作dna测序和pcr的引物、筛选和检测实验的探针、以及用于克隆目的的接头或衔接子。15个核苷酸至25个核苷酸范围的短寡核苷酸可以不经纯化而被直接使用。由于逐步产率小于100%,因此更长的寡核苷酸需要通过高效液相色谱或hplc、或通过制备型凝胶电泳纯化以去除失败的寡核苷酸级分,也被称为n
‑
1、n
‑
2等产物。在某些实施方案中,核酸发夹大致具有约100个碱基。
[0068]
根据实验的性质,给定的发夹结构可以被设计成含有双链双链体的所期望的稳定性,这是通过以下方式来实现的:用如本文所论述的一个或多个高度修饰碱基或非天然碱基和/或一个或多个骨架键进行取代;或包括其它合成碱基,如7
‑
脱氮
‑7‑
羟基嘌呤、isoc以及isog、或它们的等同物;以及形成例如而不限于rna
‑
dna、pna
‑
dna、pna
‑
rna、pna
‑
pna、lna
‑
dna、lna
‑
rna、lna
‑
lna双链双链体。合成设计的发夹结构可用于多种分子生物学技术中,例如而不限于,通过使发夹连接到dna片段的末端而用作dna聚合酶的引发位点、作为探针以鉴定所关注的序列的检测部分、以及由线性片段产生拓扑环状dna分子。在某些实施方案中,一个或多个发夹结构的5'
‑
末端将被磷酸化,例如而不限于使用t4多核苷酸激酶磷酸化,以有助于使用连接剂高效连接到一个或多个片段化的核酸分子的末端。
[0069]
在某些实施方案中,可以使用寡核苷酸探针检测经过扩增或复制的哑铃状模板。所述寡核苷酸探针可以是标记的寡核苷酸探针。所述寡核苷酸探针可以是标记的dna探针。在某些实施方案中,所述寡核苷酸探针可以与荧光团、发色团、放射性同位素、酶、或发光化合物、或其组合中的一种或多种连接。
[0070]
某些发夹结构也已经用作寡核苷酸探针。也被称为分子信标的某些dna探针是被设计成含有具有彼此互补的两个末端的内部探针序列的寡核苷酸。在适当的条件下,所述
末端杂交在一起,从而形成茎环结构。探针序列被包含在分子信标的环部分内并且与茎臂无关。荧光染料与茎上的一个末端连接,并且非荧光猝灭部分或“猝灭剂”与茎的另一个末端连接。在茎环构型中,杂交臂使荧光染料和猝灭剂保持靠近,从而通过众所周知的荧光共振能量转移(fret)过程引起荧光染料信号猝灭。在环结构内的探针序列发现它的预期靶序列并且与其杂交时,茎结构被破坏以有利于更长的和更稳定的探针
‑
靶双链体。探针杂交使得荧光染料和猝灭剂分离(即现在失去靠近的状态),因此染料现在可以在暴露于检测器的适当激发源时发荧光。分子信标已经用于许多分子生物学技术,如实时pcr,以鉴别等位基因差异。
[0071]
在某些实施方案中,发夹结构可以通过使用两个或更多个核酸分子来形成,所述两个或更多个核酸分子然后连接形成单个发夹结构。可以使用连接试剂使两个或更多个核酸分子连接在一起以形成发夹结构。还可以使用接头使两个或更多个核酸分子以化学方式连接在一起以形成发夹结构。在某些实施方案中,一个或多个发夹结构的5'
‑
末端将被磷酸化,例如而不限于使用t4多核苷酸激酶磷酸化,以有助于使用连接剂高效连接到一个或多个片段化的核酸分子的末端。
[0072]
在某些实施方案中,功能上重要的信息可以存在于发夹结构的茎区中。在某些实施方案中,功能上重要的信息可以存在于发夹结构的环区中。功能上重要的信息可以包括例如而不限于对于体外复制、体外扩增、唯一标识(即条形码)以及检测来说必要的序列。在其中功能上重要的信息存在于发夹结构的环区中的某些实施方案中,茎区的长度可以少到四个或六个碱基对。在其中功能上重要的信息存在于发夹结构的茎区中的某些实施方案中,环区的长度可以少到一个或两个碱基。
[0073]
配对模板文库是通过使已经针对给定的尺寸,如2kb选择的经过剪切的基因组dna环化,从而使先前彼此远离的末端靠近来制备的。然后通过机械手段或物理手段将环切成线性dna片段。使用那些被称作连接片段的含有连接的远端的dna片段形成配对模板。“连接片段”是含有更大的dna分子的远端与选择标记的组合的dna分子,并且所述dna分子是通过首先制备dna环,将所述dna环片段化,并且选择含有选择标记的片段而形成的。
[0074]
举例来说而不限于,形成环的方法涉及使用限制性核酸内切酶,如mbo i将高分子量基因组dna部分消化。还可以使用其它已知的4
‑
碱基、6
‑
碱基、或8
‑
碱基“切割剂”或等同物。将非常低浓度的并且与小的选择标记组合的dna片段连接在一起以形成共价dna环。因此,产生环状dna分子,所述环状dna分子具有由dna片段的两个远端侧接的选择标记。连接片段的文库是通过用不同的限制性核酸内切酶,如ecori消化dna环,然后选择由那些远端侧接的标记片段而形成的。连接片段文库用于遗传和物理图谱实验以及测序应用中。
[0075]
更一般来说,当优化倾向于“分子内”连接事件(即同一个核酸分子的dna环)的连接片段相对于“分子间”连接事件(即被称作多联体的两个或更多个核酸分子的连接)的比率时,应当考虑几个因素。所述比率取决于两个参数:分子的一个末端的由该同一个分子的另一个末端所经受的有效局部摩尔浓度(j)以及所有其它dna分子的末端的摩尔浓度(i)。参数j可以根据雅各布
‑
斯托克迈耶方程式(jacobon
‑
stockmayer equation)来确定:
[0076]
j=3.55
×
10
‑8m/kb
3/2
[0077]
其中kb是以千碱基对(kpb)计的核酸分子的长度。对于给定的连接反应,分子内事件的百分比是通过j/(i j)的比率来确定的。也就是说,相较于更小的核酸分子,更大的核
酸分子必须被进一步稀释以实现合理的形成分子内环的效率。为了在分子内连接期间以合理的概率掺入选择标记,它的摩尔浓度应当约等于j。然而,即使在非常稀的连接条件下,形成分子间连接物质的概率仍将存在,从而产生分子内环和两个或更多个核酸分子的线性多联体的混合物。存在与形成大的环状核酸分子相关的多个技术问题,包括:(a)产生和处理非常大的核酸分子而不使它们断裂成更小的核酸分子;(b)鉴定适当的选择标记以富集连接片段;以及(c)需要大量的起始核酸材料来形成完整的代表性的核酸文库。本领域中存在用于处理大核酸分子的非常确实的方法,如脉冲场凝胶电泳,并且已经使用替代策略,如生物素/亲和素或链霉亲和素系统,以提高对连接片段的选择。然而,有关需要大量的起始核酸材料的问题仍没有被充分解决。因此,在考虑对以有限量出现的珍贵的生物样品,如在手术程序期间获得的活检样品或从全血、血浆或血清中获得的游离循环dna进行分析时,通过分子内连接事件的策略形成核酸环很少适用。
[0078]
存在许多从样品中分离核酸的方法。一旦被分离,一个或多个核酸分子就可以通过片段化过程断裂成更小的片段,所述片段化过程例如而不限于是以非序列特异性方式或序列特异性方式进行的。预期非序列特异性或随机的片段化过程会产生片段化的核酸分子沿着所关注的给定基因组的均匀分布或基本上均匀的分布。举例来说而不限于,1,000,000个片段化的核酸分子可以被定位到相等尺寸的1,000个位置(即窗口),其中每一个窗口具有1,000个定位的片段化的核酸分子的计数。在某些实施方案中,从片段化的核酸分子沿所关注的给定基因组的均匀分布或基本上均匀的分布获得的数据可以显示出相对于另外的数据类型偏向有利于某些数据类型,例如而不限于,被研究的基因组的给定区域的gc含量。在某些实施方案中,使用将双链dna非特异性片段化的dna酶i将核酸分子以酶促方式片段化。片段化的产物是具有不同尺寸的5'
‑
磷酸化的二核苷酸、三核苷酸、以及寡核苷酸。dna酶i在含有mn
2
、mg
2
以及ca
2
,但是在缓冲液中没有其它盐的缓冲液中具有最佳的活性。使用dna酶i进行的片段化通常将引起对双链dna的随机消化,当在基于mn
2
的缓冲液存在下使用时,平端双链dna片段占优势。即使在使用基于mn
2
的缓冲条件下,片段化的核酸分子仍可能含有延伸超出片段化的双链体的另一条核酸链的末端的未知序列的一个或多个单链核苷酸的5'
‑
突出末端(在此被称为“5'
‑
末端突出端”)以及延伸超出片段化的双链体的另一条核酸链的末端的未知序列的一个或多个单链核苷酸的3'
‑
突出末端(在此被称为“3'
‑
末端突出端”)。在dna酶i消化后文库的片段尺寸的范围取决于几个因素,例如而不限于(i)用于反应中的dna酶i的量(单位);(ii)反应的温度;以及(iii)反应的时间。
[0079]
在某些实施方案中,使用物理手段或机械手段以非序列特异性方式将核酸分子片段化。举例来说而不限于,可以使用雾化将核酸分子片段化,所述雾化将双链核酸分子剪切成更小的片段。在雾化后文库的片段尺寸的范围取决于几个因素,例如而不限于(i)向雾化器施加的压力;以及(ii)剪切过程的时间。剪切的片段文库含有多种末端类型,包括平端、5'
‑
末端突出端、以及3'
‑
末端突出端。在使用随机片段化方法的情况下一个或多个片段化的核酸分子的末端可以直接使用连接剂连接到衔接头以形成哑铃状模板或被使得能够连接哑铃状模板,参见下文。
[0080]
还可以通过序列特异性片段化过程,例如而不限于使用一种或多种限制性核酸内切酶使来自样品的分离的核酸分子断裂成更小的片段。预期序列特异性片段化过程会产生片段化的核酸分子沿着所关注的给定基因组的不均匀分布或基本上不均匀的分布。对于全
基因组研究,序列特异性片段化过程可能不是最佳的,这是因为可能显著的一定分数的基因组区域预期将具有低频率的限制性核酸内切酶切割位点。切割位点的分布取决于用于给定的片段化过程的限制性核酸内切酶的类型和数量。具有低频率的切割位点的区域将导致基因组信息的表示不足。使用序列特异性片段化方法有几个优点,例如而不限于靶向所关注的基因组的子集,这减少了工作、成本、以及数据分析,并且片段化的核酸分子的末端将被限定为平端或限定的5'
‑
末端突出端核酸序列和限定的3'
‑
末端突出端核酸序列。具有确定的核酸序列的突出末端被称为“粘性末端”。在某些实施方案中,可以使用两种或更多种限制性核酸内切酶来形成每一个末端均具有不同的粘性末端序列的更小的片段。举例来说而不限于,使用两种限制性核酸内切酶(即ecori和bamhi)消化分离的核酸分子,这将产生三种不同的粘性末端类型(即两个末端含有相同的5'
‑
突出端序列5'
‑
aatt[ecori]或5'
‑
突出端序列5'
‑
gatc[bamhi]或两个末端含有不同的粘性末端(即一个末端具有5'
‑
突出端序列5'
‑
aatt并且另一个末端具有5'
‑
突出端序列5'
‑
gatc))。可以使用连接剂使具有5'
‑
aatt的互补粘性末端的一种发夹结构连接到含有ecori粘性末端的片段,并且可以使用连接剂使具有5'
‑
gatc的互补粘性末端的不同的发夹结构连接到含有bamhi粘性末端的片段。可以使用含有不同的发夹结构的互补序列的亲和载体富集含有不同的发夹结构的哑铃状模板,关于更多的细节,参见实施例。
[0081]
还可以通过序列特异性片段化过程,例如而不限于使用多重pcr使来自样品的分离的核酸分子形成更小的片段。举例来说而不限于,两个或更多个pcr引物组可以被设计成特异性扩增包含核酸分子的两个或更多个靶区域。除了设计包括引物的靶标特异性核酸序列之外,具有功能上重要的信息的另外的核酸序列还可以包括例如而不限于一个或多个限制性核酸内切酶切割位点和唯一标识(即条形码)。在某些实施方案中,一个或多个正向pcr引物可以含有一个给定的限制性核酸内切酶切割位点,并且一个或多个反向pcr引物可以含有一个不同的限制性核酸内切酶切割位点。在使扩增的pcr产物与相应的限制性核酸内切酶接触时,所述限制性核酸内切酶中的每一种识别并切割它的切割位点,扩增的pcr产物的末端可以含有不同的粘性末端,这些粘性末端可以用于以可预测的方式连接两种不同的发夹结构。举例来说而不限于,除了靶标特异性核酸序列之外,所有正向pcr引物均含有ecori限制性核酸内切酶切割位点并且所有反向pcr引物均含有bamhi限制性核酸内切酶切割位点。在使用两个或更多个pcr引物组进行多重pcr之后,用ecori和bamhi对扩增的pcr产物进行的限制性核酸内切酶消化将产生具有5'
‑
突出端序列5'
‑
aatt的正向引物末端和具有5'
‑
突出端序列5'
‑
gatc的反向引物末端。可以使用连接剂使具有5'
‑
aatt的互补粘性末端的一种发夹结构仅连接到正向引物末端,并且可以使用连接剂使具有5'
‑
gatc的互补粘性末端的不同的发夹结构仅连接到反向引物末端。在一些实施方案中,来自样品的分离的核酸分子可能不需要任何片段化过程,这是因为这些分离的核酸分子可能是充分片段化的以形成哑铃状模板。举例来说而不限于,来自从妊娠女性或癌症患者获得的血清或血浆、全血的分离的核酸分子在体内是充分片段化的,因此可能不需要另外的片段化来形成哑铃状模板。在某些实施方案中,样品可以是从癌症患者获得的。在某些实施方案中,样品可以是从妊娠个体获得的。在某些实施方案中,样品可以是从病理学标本获得的。在某些实施方案中,样品可以是从福尔马林固定的石蜡包埋(ffpe)标本获得的。在某些实施方案中,样品可以是从环境样品获得的。在某些实施方案中,核酸分子可以具有100bp至100kbp范围的长
度。
[0082]
分离的体内片段化核酸分子文库含有多种末端类型,包括平端、5'
‑
末端突出端、以及3'
‑
末端突出端。片段化的核酸分子的末端可以直接使用连接剂连接到衔接头以形成连接的哑铃状模板或首先经过加工以使得所述末端能够形成连接的哑铃状模板,参见下文。
[0083]
可以通过使用抛光方法,例如而不限于,通过使用表现出3'
‑
核酸外切酶活性的聚合酶来提高含有平端的片段化的核酸分子的百分比。举例来说而不限于,这样的聚合酶可以包括t
4 dna聚合酶、克列诺dna聚合酶(klenow dna polymerase)、或pfu dna聚合酶。这些dna聚合酶的3'
‑
核酸外切酶活性是通过从3'
‑
末端突出端去除未知序列或已知序列的一个或多个单链核苷酸以形成平端片段化的核酸分子来起作用。通过使互补核苷酸以酶促方式掺入到凹入的3'
‑
末端链中来使5'
‑
末端突出端变成平端,从而也形成平端片段化的核酸分子。在某些实施方案中,一个或多个片段化的核酸分子的5'
‑
末端可以被磷酸化,例如而不限于使用t4多核苷酸激酶磷酸化,以有助于使用连接剂连接到一个或多个发夹结构的末端以高效形成哑铃状模板。
[0084]
在某些实施方案中,在将片段化的核酸分子平端化和磷酸化之后,双链寡核苷酸衔接子可以被设计成引入功能上重要的信息,例如而不限于复制、扩增和/或唯一标识(即条形码)序列,以及提供任何给定的粘性末端序列。后者序列可以用于有助于使用连接剂用具有互补粘性末端序列的5'
‑
磷酸化的发夹结构高效形成哑铃状模板。在某些实施方案中,可以使用转座酶和转座子复合物来将一个或多个核酸分子片段化,并且同时插入功能上重要的信息,例如而不限于复制、扩增、和/或唯一标识(即条形码)序列以及在插入点处提供能够形成粘性末端序列的任何给定的限制性核酸内切酶切割位点。在某些实施方案中,片段化的核酸分子的末端可以通过其它手段来修饰,例如而不限于,通过将2'
‑
脱氧腺苷(da)核苷酸添加到平端片段化的核酸分子的3'
‑
末端。举例来说而不限于,缺乏3'
‑
核酸外切酶活性的dna聚合酶,如克列诺3'
‑
exo(
‑
)dna聚合酶和taq dna聚合酶可以将2'
‑
脱氧腺苷三磷酸添加到平端片段化的核酸分子的3'
‑
末端以得到具有一个2'
‑
脱氧腺苷一磷酸核苷酸的3'
‑
末端突出端。da加尾法也有助于使用连接剂,用具有一个2'
‑
胸苷一磷酸核苷酸的互补3'
‑
末端突出端的5'
‑
磷酸化的发夹结构进行高效的哑铃状模板构建。在某些实施方案中,平端片段化的核酸分子也可以直接被用于使用连接剂以连接具有相应的平端的5'
‑
磷酸化的发夹结构来形成哑铃状模板。
[0085]
不同于通过分子内连接事件的策略形成核酸环的当前方法,所述策略在考虑对有限量的珍贵的生物样品进行分析时很少适用,本发明的方法大幅提高了形成核酸环的效率。举例来说而不限于,通过分子内连接事件的策略形成核酸环需要数十微克的起始材料,但在形成所期望的核酸环时得到百分之一(1%)或更低的近似效率。与分子内连接策略相关的问题被进一步加重,这是因为这种方法依赖于核酸分子的尺寸并且与连接效率成反比。也就是说,更大尺寸的核酸分子通过分子内连接方法形成更少的环,这是因为反应条件要求与核酸分子的长度成比例越来越稀的浓度。另一方面,本发明中所述的形成哑铃状模板的方法是非常高效的,这是因为所述方法不依赖于分子内连接方法。相反,通过分子间事件形成哑铃状模板,其中可以使得使核酸分子与发夹结构连接的连接效率非常高效。连接反应可以进行到完成或基本上接近完成,这是因为发夹结构的浓度可以足够高的程度(即
100倍)高于核酸分子的浓度。连接反应也不依赖于或基本上不依赖于一个或多个核酸分子的尺寸,这是因为1,000bp尺寸的哑铃状模板可以与5,000bp尺寸或10,000bp尺寸或甚至100,000bp尺寸、或甚至大于100,000bp的哑铃状模板同样高效地形成。在本发明的某些实施方案中,可以从基因组dna以0.5kb、1.0kb、2.5kb、5.0kb、7.5kb、以及10.0kb的尺寸增量构建有效的双重发夹哑铃状模板。在某些实施方案中,然后可以在均相反应溶液中使用滚环机制复制或扩增哑铃状模板。在某些实施方案中,还可以在非均相反应溶液中,使用滚环机制,使用一种或多种固相结合引物,通过在有限稀释中将哑铃状模板引入到基质上来复制或扩增哑铃状模板,以使得一个或多个复制的哑铃状模板或扩增的哑铃状模板是在空间上和在光谱上可分辨的以检测核酸分子。
[0086]
在某些实施方案中,所述哑铃状模板是含有一个或多个发夹结构的正链核酸分子。在某些实施方案中,还可以形成哑铃状模板,由此单链核酸分子的每一个末端连接到发夹结构,由此一个发夹结构可以用作引物以使单链核酸分子延伸和拷贝到发夹结构的另一个末端。在连接步骤后,形成哑铃状模板。在本发明的某些实施方案中,可以使线性双链区解链,例如而不限于通过热、化学手段或酶促手段,并且可以使哑铃状模板转化成完全开放的单链环。在某些实施方案中,可以使用具有含有独特的限制性核酸内切酶切割位点的不同的核酸序列的两个不同的发夹结构形成哑铃状模板。可以使用滚环机制复制这些环状模板以形成靶序列的多个拷贝。在rcr步骤后,可以用适当的限制性核酸内切酶消化线性多联体以产生靶序列的单体单元,然后使其末端连接在一起以形成环状靶序列的多个拷贝。在本发明的某些其它实施方案中,哑铃状模板可以用于转录所关注的基因的rna分子。产生含有一个或多个rna启动子序列的哑铃状模板并且使用这些闭合单链核酸环作为体外转录所关注的基因的rna分子的模板。
[0087]
在某些实施方案中,可以使用核酸外切酶去除没有成功连接以形成哑铃状模板的不希望有的核酸分子。这些不希望有的核酸分子可以具有可以呈平端、5'
‑
突出末端和/或3'
‑
突出末端的形式的一个或多个5'
‑
末端或3'
‑
末端,或可以单链形式存在。这些不希望有的核酸分子包括但不限于未片段化和片段化的核酸分子、可能没有形成发夹结构的寡核苷酸、以及未连接的发夹结构。核酸外切酶iii(也被称作exo iii)催化单核苷酸从双链dna的3'
‑
羟基末端上的逐步去除。在每一个结合事件期间去除有限数量的核苷酸,从而使得dna分子的群体内发生协调的渐进性缺失。exo iii的优选底物是含有平端或5'
‑
突出末端的核酸分子,尽管所述酶也在双链dna中的切口处起作用以产生单链空位。exo iii对单链dna没有活性,因此3'
‑
突出末端对切割具有抗性。抗性的程度取决于延伸的长度,其中四个碱基或更长的延伸基本上对切割具有抗性。这一特性可以被利用以从具有一个抗性末端(3'
‑
突出末端)和一个敏感末端(平端或5'
‑
突出末端)的线性分子产生单向缺失。核酸外切酶iii的活性部分地取决于螺旋结构并且显示出序列依赖性(c>a=t>g)。温度、盐浓度以及酶与dna的比率极大地影响酶活性,从而需要针对特定应用调控反应条件。核酸外切酶vii(也被称作exo vii)在5'
→
3'方向和3'
→
5'方向上切割单链dna。这种酶对线性或环状双链dna没有活性。在形成哑铃状模板时,它可用于去除来自完成的pcr反应和后连接反应的单链寡核苷酸引物和发夹。核酸外切酶vii对单链dna的消化具有非金属依赖性。exo iii和exo vii可以组合用于去除没有成功连接以形成哑铃状模板的不希望有的核酸分子。
[0088]
基质可以包含任何材料,例如而不限于固体材料、半固体材料(即[i]固体载体和
凝胶或基体材料的复合材料或[ii]线性或交联的聚丙烯酰胺、纤维素、交联琼脂糖、以及聚乙二醇)、或流体或液体材料。所述基质还可以包含具有任何尺寸和形状的任何材料,例如而不限于正方形、梯形、球形、类球形、管形、球粒形、杆形、或八面体。所述基质应当含有与本发明相容的特性(即对复制过程、扩增过程、或检测过程表现出最低限度的干扰)。在某些实施方案中,所述基质是无孔的。在某些实施方案中,所述基质是多孔的。在某些实施方案中,所述基质可以包含亲水性多孔基体,如水凝胶。在某些实施方案中,固体材料包括例如而不限于玻璃材料(即硼硅酸盐、可控孔度玻璃、熔融二氧化硅、或掺锗二氧化硅)、硅、氧化锆、二氧化钛、聚合材料(即聚苯乙烯、交联聚苯乙烯、聚丙烯酸酯、聚甲基丙烯酸酯、聚二甲基硅氧烷、聚乙烯、聚氟乙烯、聚氧乙烯、聚丙烯、聚丙烯酰胺、聚酰胺(如尼龙)、葡聚糖、交联葡聚糖、胶乳、环烯烃聚合物、环烯烃共聚物以及其它共聚物和其接枝物)、或金属材料。固体基质可以由例如而不限于以下各项组成:一个或多个膜、平面表面、基本上平面的表面、非平面表面、微量滴定板、球形珠粒、非球形珠粒、光纤、含有球形珠粒的光纤、含有非球形珠粒的光纤、半导体器件、含有球形珠粒的半导体器件、含有非球形珠粒的半导体器件、具有容纳球形珠粒的一个或多个孔的载片、具有容纳非球形珠粒的一个或多个孔的载片、过滤器、测试条、载片、盖片、或试管。在某些实施方案中,半固体材料包括例如而不限于线性或交联的聚丙烯酰胺、纤维素、交联的琼脂糖、以及聚乙二醇。
[0089]
可以通过任何合适的手段使一种或多种引物连接到基质。在某些实施方案中,一种或多种引物与基质的连接例如而不限于是通过共价键合、氢键键合(即由此引物与共价连接到基质的另一个互补的寡核苷酸杂交并且仍发挥复制型或扩增型功能)、范德华力(van der waal force)、物理吸附、疏水性相互作用、离子相互作用或亲和相互作用(即结合对,如生物素/链霉亲和素或抗原/抗体)所介导的。在某些实施方案中,结合对的一个成员与基质连接并且结合对的另一个成员与一种或多种引物连接。一种或多种引物与基质的连接是经由结合对的两个成员的相互作用而发生。
[0090]
一种或多种引物与基质连接的顺序可以是任何排列,这被广义地定义为“引物阵列”,例如而不限于按随机阵列、通过图案化阵列中的随机分配、或通过有序阵列中图案化的已知物。通过滚环机制复制哑铃状模板的引物阵列被广义地定义为“复制的哑铃状模板阵列”。通过滚环机制扩增哑铃状模板的引物阵列被广义地定义为“扩增的哑铃状模板阵列”。通过设计,预期图案化阵列和有序阵列提供在空间上和在光谱上可分辨以用于检测核酸分子的复制的哑铃状模板阵列或扩增的哑铃状模板阵列。在随机阵列的某些实施方案中,一种或多种引物可以共价键合到基质以在平面表面或基本上平面的表面上形成固定的引物的高密度坪。一种或多种引物可以通过任何手段连接,例如而不限于通过涉及滴加、喷涂、电镀或涂铺溶液、乳液、气溶胶、蒸气、或干制剂的方法。通过以有限稀释方式将哑铃状模板引入到基质上,一种或多种引物将接触哑铃状模板,从而使得滚环机制在聚合酶存在下能够产生在空间上和在光谱上可分辨以用于检测核酸分子的一个或多个复制的哑铃状模板(即复制的哑铃状模板阵列)或扩增的哑铃状模板(即扩增的哑铃状模板阵列)。在图案化阵列中的随机分配的某些实施方案中,一种或多种引物可以共价键合到基质以在一个或多个球形珠粒或非球形珠粒上形成高密度的固定的引物。通过使用水包油乳液系统在有限稀释中将哑铃状模板引入到基质上,一种或多种引物将接触哑铃状模板,从而使得滚环机制能够产生一个或多个复制的哑铃状模板或扩增的哑铃状模板。在某些实施方案中,可以
基于分布单个分子的泊松统计(poisson statistics),将复制的哑铃状模板化珠粒或扩增的哑铃状模板化珠粒富集以去除没能复制或扩增哑铃状模板的那些珠粒。在进行或没有进行富集的情况下,复制的哑铃状模板化珠粒或扩增的哑铃状模板化珠粒然后可以有序的图案随机分布在含有孔、凹陷、或其它容器、器皿、特征、或位置的平面的或基本上平面的载片基质、光纤基质、或半导体器件基质上。在图案化阵列中的随机分配的其它某些实施方案中,表面上一个或多个预制的亲水性特征(即斑点)可以由疏水性表面包围以使一种或多种引物共价键合到基质。举例来说而不限于,可以在通过光刻法蚀刻的具有约300纳米斑点的网格图案化阵列的表面改性的硅基质上形成图案化阵列。通过以有限稀释方式将哑铃状模板引入到图案化基质上,引物将接触哑铃状模板,从而使得滚环机制能够产生一个或多个复制的哑铃状模板或扩增的哑铃状模板。在某些实施方案中,可以使预制的亲水性斑点小到甚至仅容纳一个复制的哑铃状模板或扩增的哑铃状模板。由于基于泊松统计分布单个分子产生相当一部分的无模板斑点,因此在滚环程序后,可以使用另外数轮的分布、接触、以及滚环来提高基质上复制的哑铃状模板或扩增的哑铃状模板的密度。在有序阵列中图案化的“已知物”的某些实施方案,可以在基质上可寻址的位置处印刷(即点样阵列)或原位制备一种或多种已知的引物。通过以有限稀释方式将哑铃状模板引入到图案化的基质上,一种或多种引物将接触哑铃状模板,从而使得滚环机制能够产生一个或多个复制的哑铃状模板或扩增的哑铃状模板。
[0091]
使用聚合酶链反应(“pcr”)特异性扩增少量核酸分子,从而产生所关注的靶序列的数千个至数百万个拷贝。一般来说,pcr涉及反复加热以使双链体链变性或解链,冷却以使引物杂交,然后再次加热(通常在dna聚合酶的最佳温度,但是低于变性温度)以使模板序列在体外(即在生物体外)扩增。dna聚合酶从单链模板拷贝或合成互补链。为了使这一酶促反应发生,需要dna的部分双链段。通常,引物与单链模板的互补区杂交。dna聚合酶沿5'至3'的方向合成新生链以形成双链dna。多重pcr允许同时扩增多个靶区域并且已经用于检测x
‑
连锁病症中的一个或多个编码外显子缺失(这些外显子是被转录成信使rna(mrna)并且被翻译成一种或多种蛋白质的基因序列);这样的x
‑
连锁病症包括杜氏肌营养不良症(duchenne muscular dystrophy)和莱
‑
奈二氏综合征(lesch
‑
nyhan syndrome)。在替代方案中,可以使用pcr扩增起始混合物中存在的整个池的核酸,从而引起核酸的任何给定子集的扩增,但不是靶向富集。这是通过使共同序列或共同衔接子连接到片段的末端,并且通过使片段变性,使具有与共同衔接子互补的序列的共同引物杂交,并且拷贝dna片段来扩增片段而实现的。这种类型的pcr被称作“通用pcr”。
[0092]
噬菌体(bacteriophage/phage),如φx174、m13、λ、以及一些病毒可以通过“滚环”机制复制它们对应的基因组。通过从环状模板拷贝来复制整个基因组。不同于pcr,滚环机制可以等温进行(即不需要加热或冷却循环)。
[0093]
滚环方法已经被用作用于复制(即使用仅拷贝原始的哑铃状模板的一种或多种引物)或扩增(即使用拷贝原始的哑铃状模板以及哑铃状模板的拷贝这两者的两种或更多种引物)所关注的核酸分子的体外方法。举例来说,已经使用滚环机制,使用大肠杆菌pol i dna聚合酶和单一寡核苷酸引物复制了具有34个至52个碱基范围的尺寸的环状合成寡核苷酸模板。使用26至74范围的类似尺寸的环的滚环机制使用多种聚合酶,包括大肠杆菌pol i、克列诺dna聚合酶、以及t
4 dna聚合酶。
[0094]
在某些实施方案中,dna环可以形成为“锁式探针”。使用锁式方法的主要缺点在于形成环状核酸分子的尺寸限制,例如而不限于用于靶向cftr g542x基因座的具有46个核苷酸的环。这些锁式环可用于使用dna聚合酶,如dna聚合酶、bst dna聚合酶、以及vent(exo
‑
)dna聚合酶在仅仅几分钟内形成数百个靶拷贝。在某些实施方案中,锁式环可以在滚环扩增机制中使用两种引物,这不仅使得能够拷贝模板环(即负链),而且还使得能够拷贝新合成的一条或多条正链。使用两种不同的具有46个核苷酸的锁式环的rca方法可以用于基因分型应用,例如而不限于针对cftr g542x基因座检测野生型序列和突变型序列。用于基因分型的rca锁式方法的另一个缺点在于所测定的每一个突变的基因座需要单独的等位基因鉴别引物。
[0095]
滚环扩增已经在使用随机六聚体(即多于两种引物)和dna聚合酶的桑格测序应用中用于使用具有5kb至7kb尺寸范围的尺寸的传统的克隆来源,如质粒和噬菌体作为dna环进行基于溶液的模板制备。使用传统的克隆方法形成dna环的缺点在于需要经由适当的细胞宿主繁殖这样的dna环。本发明的哑铃状模板克服了这一限制。使用嵌合dna模板进行的滚环复制已经用于边连接边测序的方法中。模板制备方法使用一系列复杂的定向衔接子连接和iis型限制性内切酶消化以通过分子内连接方法形成具有约300bp尺寸的小dna环,在溶液中使用单一引物和φ29dna聚合酶复制这些小dna环以形成“dna纳米球”。然后使这些纳米球吸附到图案化的基质上以进行它们的边连接边测序方法。纳米球方法的主要限制在于嵌合模板环中可供使用的基因组dna序列的量小(即76bp是实际的靶序列并且其余222bp是衔接子序列)以及需要分子内连接。本发明通过提供使用哑铃状模板的更简单的工作流程克服了通过分子内连接方法构建小环状模板的复杂方法的限制,所述哑铃状模板可以在滚环机制中被复制或扩增。
[0096]
在滚环机制中有用的聚合酶和逆转录酶一般表现出链置换特性,这是在核酸合成期间置换由所述酶所遇到的“下游”核酸链的能力。这些链置换酶也缺乏5'
‑
核酸外切酶活性。任何链置换聚合酶或逆转录酶可以用于滚环复制或滚环扩增中,例如而不限于dna聚合酶、大肠杆菌pol i、克列诺dna聚合酶、bst dna聚合酶(大片段)、bsm dna聚合酶(大片段)、bsu dna聚合酶(大片段)、vent(exo
‑
)dna聚合酶、t7(exo
‑
)dna聚合酶(t7测序酶)、或topotaq(taq dna聚合酶和拓扑异构酶v的嵌合蛋白)、以及它们这些dna聚合酶的突变型式,t
7 rna聚合酶、t
3 rna聚合酶、或sp6 rna聚合酶、以及它们这些rna聚合酶的突变型式、或禽成髓细胞瘤病毒逆转录酶或莫洛尼鼠类白血病病毒逆转录酶(moloney murine leukemia virus reverse transcriptase)、以及这些逆转录酶的突变型式,如thermoscript逆转录酶、superscript逆转录酶或primescript逆转录酶。除了链置换聚合酶和逆转录酶之外,辅助蛋白也可以通过提高滚环机制的稳健性、保真性和/或持续性来进一步增强核酸合成期间下游核酸链的置换。链置换辅助蛋白可以是任何类型并且包括例如而不限于解旋酶、单链结合蛋白、拓扑异构酶、反向旋转酶、以及刺激辅助蛋白的其它蛋白质,例如而不限于大肠杆菌mutl蛋白或硫氧还蛋白。dna解旋酶在体内可用于在dna复制期间将两条互补的或基本上互补的dna链分离或解旋。解旋酶可以在5'到3'方向(例如而不限于噬菌体t7基因4解旋酶、dnab解旋酶以及rho解旋酶)和3'到5'方向(例如而不限于大肠杆菌uvrd解旋酶、pcra、rep、以及丙型肝炎病毒的ns3 rna解旋酶)上使核酸分子解旋。解旋酶
可以从任何来源获得并且包括例如而不限于大肠杆菌解旋酶(即i、ii[uvrd]、iii和iv、rep、dnab、pria以及pcra)、噬菌体t
4 gp41、噬菌体t7基因4解旋酶、sv40大t抗原、rho解旋酶、酵母rad解旋酶、来自腾冲嗜热厌氧杆菌(t.tengcongensis)的热稳定性uvrd解旋酶、和丙型肝炎病毒的ns3 rna解旋酶、以及这些和其它解旋酶的突变型式。单链结合蛋白以比对双链dna更大的亲和力结合单链dna。这些蛋白质协同地结合,从而有利于侵入单链区域并且因此使双链体结构不稳定。举例来说而不限于,单链结合蛋白可以通过去除二级结构而表现出螺旋去稳定活性并且可以置换杂交的核酸分子。单链结合蛋白可以从任何来源获得并且包括例如而不限于噬菌体t4基因32蛋白、rb 49基因32蛋白、大肠杆菌单链结合蛋白、单链结合蛋白或噬菌体t7基因2.5、以及这些和其它单链结合蛋白的突变型式,如噬菌体t7基因2.5f232l。
[0097]
可以使用高度持续性链置换聚合酶,如phi29聚合酶对哑铃状模板进行滚环复制。滚环复制可以分两个步骤进行。首先,在适当的“杂交条件”下使经过尺寸选择的哑铃状模板与哑铃状互补引物杂交,所述杂交条件包括温度、诸如盐、缓冲液和ph值的因素、洗涤剂、以及有机溶剂。可以使用封闭剂,如牛血清白蛋白(bsa)或登哈特试剂(denhardt's reagent)作为杂交条件的一部分。其次,向第一反应混合物提供适当的聚合酶或复制体和核苷酸混合物以产生扩增或复制的哑铃状模板。杂交和扩增或复制条件是基于几个因素来优化的,包括但不限于哑铃状模板的茎区的长度和序列组成、杂交条件、本文使用的特异性聚合酶或复制体、以及反应温度。在某些实施方案中,反应温度可以是约10℃至35℃。在其它实施方案中,反应温度可以是约15℃至30℃。在其它实施方案中,反应温度可以是约20℃至25℃。在某些实施方案中,在选择的时间间隔内升高温度。举例来说而不限于,将反应在10℃维持五分钟,然后在15℃维持五分钟,在20℃维持五分钟,然后在25℃维持五分钟,并且在30℃维持五分钟。
[0098]
被称作“复制体”的复制复合体可以在体外形成以通过制备复制的哑铃状模板或扩增的哑铃状模板的更多拷贝和/或复制或扩增更大的哑铃状模板(即具有>1kb、>5kb、>10kb以及>50kb的尺寸)来增强滚环方法。包括解旋酶、单链结合蛋白、拓扑异构酶以及反向旋转酶的链置换辅助蛋白可以与链置换聚合酶和逆转录酶以任何组合配置成形成用于哑铃状模板的滚环方法的复制型或扩增型复制体复合体。在某些实施方案中,在适当的反应条件下φ29dna聚合酶和φ29单链结合蛋白的组合可以使滚环机制的伸长作用增强数倍。在某些实施方案中,依赖解旋酶和单链结合蛋白的协同活性的聚合酶或逆转录酶的组合可以用于滚环方法中以复制10kb或更大的哑铃状模板或扩增10kb或更大的哑铃状模板。举例来说而不限于,可以通过形成复制体复合体,使用t7测序酶、t7解旋酶以及t7单链结合蛋白的协同活性来扩增10kb质粒。
[0099]
本发明的某些实施方案包括用高度持续性固相rcr系统高效形成10kb尺寸的双重发夹哑铃状物。在某些方面,独特选择的方法特异性双重发夹哑铃状模板是以非尺寸依赖性的和紧密分布的方式(即10kb
±
1kb)形成的,从而允许信息性下游生物信息学处理以进行从头组装。哑铃状模板的形成消除了对大量的起始基因组dna的需要,这是因为这些构建体是用简单的工作流程高效制备的(即分子间连接对比分子内连接)。在使用通常以微量获得的临床样品时,这是一个重要的考虑因素。本发明的实施方案还提供了固相rcr的开发和优化,放宽了由可供使用的聚合酶所施加的当前的尺寸限制,这代表了ngs技术中的技术突
破。这些创新的大模板高密度阵列将使得能够真正从头组装复杂的、新型的和疾病基因组以用于研究应用、临床应用、以及诊断应用,并且还容许更全面的系统生物学研究以研究全基因组dna
‑
dna、dna
‑
rna、以及dna
‑
蛋白质相互作用。
[0100]
与基质连接的复制的哑铃状模板和扩增的哑铃状模板(即复制的哑铃状模板阵列或扩增的哑铃状模板阵列)对于许多不同的目的可以是有用的,包括例如而不限于核酸测序的所有方面(即全基因组从头测序;全基因组重新测序以用于序列变体检测、结构变体检测、确定分子单倍型的相和/或分子计数以用于非整倍体检测;基因集合、全外显子组、或染色体区的靶向测序以用于序列变体检测、结构变体检测、确定分子单倍型的相和/或分子计数以用于非整倍体检测;以及其它靶向测序方法,如rna
‑
seq、chip
‑
seq、methyl
‑
seq等;所有类型的测序活动在此被广义地定义为“测序”)。复制的哑铃状模板阵列和扩增的哑铃状模板阵列还可用于形成核酸分子阵列以研究核酸
‑
核酸结合相互作用、核酸
‑
蛋白质结合相互作用(即定量地测量蛋白质
‑
dna亲和力的荧光配体相互作用表征);以及核酸分子表达阵列(即以将2'
‑
脱氧核糖核酸分子转录成核糖核酸分子,在此被定义为“核糖核酸模板阵列”)以研究核酸结构/功能关系。在某些实施方案中,结构/功能阵列可用于测试可以干扰核糖核酸模板阵列的一种或多种结构/功能关系的小分子抑制剂或激活剂或核酸治疗剂的作用,例如而不限于治疗性反义rna、核糖酶、适体、以及小干扰rna;以及检测核酸
‑
核酸结合相互作用和核酸
‑
蛋白质结合相互作用。在本发明的某些实施方案中,核糖核酸模板阵列可以进一步被翻译成它们相应的氨基酸序列,在此被定义为“蛋白质阵列”,所述蛋白质阵列可用于例如而不限于研究蛋白质
‑
核酸结合相互作用和蛋白质
‑
蛋白质结合相互作用;筛选对一种或多种相关的蛋白质受体具有特异性的配体(特别是孤儿配体);对可以干扰蛋白质阵列的一种或多种结构/功能关系的小分子抑制剂或激活剂或核酸治疗剂进行药物筛选,例如而不限于治疗性反义rna、核糖酶、适体、和小干扰rna。
[0101]
在某些实施方案中,复制的哑铃状模板阵列和扩增的哑铃状模板阵列可以通过提供超出单目的用途以外的另外的信息而可用于不仅仅一个目的,例如而不限于全基因组从头测序,继而检测核酸
‑
蛋白质结合相互作用以鉴定序列特异性核酸
‑
蛋白质基序。相对于依赖固相方法来扩增700bp或更小的片段的dna阵列,本发明的一个优势在于复制或扩增至少>1kb,或优选地>5kb,或更优选地10kb,并且最优选地50kb的大核酸分子。具有增加的模板尺寸的复制的哑铃状模板阵列和扩增的哑铃状模板阵列能够提供进一步的信息,如沿着核酸分子,两个或更多个核酸
‑
蛋白质结合相互作用事件的协同远程相互作用。
[0102]
现在下文将参考附图更充分地描述本发明,其中展示了本发明的实施方案。然而,这些发明可以许多不同的形式被实施,而不应当被视为限于本文所阐述的示例性实施方案;相反,提供这些实施方案以使得本公开将是透彻和完整的,并且将向本领域技术人员充分传达本发明的范围。
[0103]
在本发明的某些实施方案中,经由哑铃状模板高效产生环状dna分子已经与固相滚环复制组合以形成克隆复制的大插入序列(具有10kb的尺寸)的复制的哑铃状模板,所述模板与上文所述的许多不同的目的相容。在本发明的某些实施方案中,经由哑铃状模板高效产生环状dna分子已经与固相滚环扩增组合以形成克隆扩增的大插入序列(具有10kb的尺寸)的扩增的哑铃状模板,所述模板与上文所述的许多不同的目的相容。哑铃状模板高效地形成并且不依赖于片段化的核酸分子尺寸,从而克服了当前的下一代测序方法中显著的
限制。使用哑铃状模板的滚环复制方法或滚环扩增方法克服了在诸如乳液pcr和固相扩增的其它固相扩增方法中所观测到的片段化的核酸分子尺寸的主要限制。
[0104]
本发明的一个实施方案是一种复制至少一个哑铃状模板的方法,所述方法包括以下步骤:将至少一个核酸分子片段化以形成至少一个片段化的核酸分子;使用连接剂使一个或多个发夹结构连接到所述至少一个片段化的核酸分子的每一个末端以形成至少一个哑铃状模板;使所述至少一个哑铃状模板与至少一种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;以及在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环复制以形成至少一个复制的哑铃状模板。
[0105]
本发明的另一个实施方案是一种扩增至少一个哑铃状模板的方法,所述方法包括以下步骤:将至少一个核酸分子片段化以形成至少一个片段化的核酸分子;使用连接剂使一个或多个发夹结构连接到所述至少一个片段化的核酸分子的每一个末端以形成至少一个哑铃状模板;使所述至少一个哑铃状模板与至少两种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;以及在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环扩增以形成至少一个扩增的哑铃状模板。
[0106]
本发明的另一个实施方案是一种检测至少一个复制的哑铃状模板的方法,所述方法包括以下步骤:将至少一个核酸分子片段化以形成至少一个片段化的核酸分子;使用连接剂使一个或多个发夹结构连接到所述至少一个片段化的核酸分子的每一个末端以形成至少一个哑铃状模板;使所述至少一个哑铃状模板与至少一种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环复制以形成至少一个复制的哑铃状模板;以及检测所述至少一个复制的哑铃状模板。在另一个实施方案中,所述检测所述至少一个复制的哑铃状模板的步骤由对所述至少一个复制的哑铃状模板进行测序组成。
[0107]
本发明的另一个实施方案是一种检测至少一个扩增的哑铃状模板的方法,所述方法包括以下步骤:将至少一个核酸分子片段化以形成至少一个片段化的核酸分子;使用连接剂使一个或多个发夹结构连接到所述至少一个片段化的核酸分子的每一个末端以形成至少一个哑铃状模板;使所述至少一个哑铃状模板与至少两种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环扩增以形成至少一个扩增的哑铃状模板;以及检测所述至少一个扩增的哑铃状模板。在另一个实施方案中,所述检测所述至少一个扩增的哑铃状模板的步骤由对所述至少一个扩增的哑铃状模板进行测序组成。
[0108]
本发明的另一个实施方案是一种复制至少一个哑铃状模板的方法,所述方法包括以下步骤:从样品中分离至少一个核酸分子;将至少一个核酸分子片段化以形成至少一个片段化的核酸分子;使用连接剂使一个或多个发夹结构连接到所述至少一个片段化的核酸分子的每一个末端以形成至少一个哑铃状模板;使所述至少一个哑铃状模板与至少一种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;以及在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环复制以形成至少一个复制的哑铃状模板。
[0109]
本发明的另一个实施方案是一种扩增至少一个哑铃状模板的方法,所述方法包括以下步骤:从样品中分离至少一个核酸分子;将至少一个核酸分子片段化以形成至少一个
片段化的核酸分子;使用连接剂使一个或多个发夹结构连接到所述至少一个片段化的核酸分子的每一个末端以形成至少一个哑铃状模板;使所述至少一个哑铃状模板与至少两种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;以及在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环扩增以形成至少一个扩增的哑铃状模板。
[0110]
本发明的另一个实施方案是一种复制至少一个核酸分子的方法,所述方法包括以下步骤:从样品中分离至少一个核酸分子;使用连接剂使一个或多个发夹结构连接到所述至少一个核酸分子的每一个末端以形成至少一个哑铃状模板;使所述至少一个哑铃状模板与至少一种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;以及在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环复制以形成至少一个复制的哑铃状模板。
[0111]
本发明的另一个实施方案是一种扩增至少一个核酸分子的方法,所述方法包括以下步骤:从样品中分离至少一个核酸分子;使用连接剂使一个或多个发夹结构连接到所述至少一个核酸分子的每一个末端以形成至少一个哑铃状模板;使所述至少一个哑铃状模板与至少两种基本上互补的引物接触,其中所述至少一种基本上互补的引物与至少一种基质连接;以及在与所述至少一种基本上互补的引物接触的所述至少一个哑铃状模板上进行滚环扩增以形成至少一个扩增的哑铃状模板。
[0112]
虽然在本文已经在着重于实施方案的情况下描述了实施方案,但是应当了解的是,在所附权利要求书的范围内,所述实施方案可能以除如本文具体所述以外的方式被实施。尽管本发明已仅以它的几种形式被展示,但是对于本领域技术人员来说应当显而易见的是,本发明不限于此,但是在不脱离本发明的范围的情况下容许各种改变。因此,意图涵盖落入所附权利要求书的精神和广泛范围内的所有这些替代方案、改动方案以及变化方案。
[0113]
本领域技术人员将认识到的是,可以对实施本发明的方法作出许多变化和改动而不脱离本发明的范围和精神。在附图和说明书中,已经公开了本发明的实施方案,并且尽管使用了特定的术语,但是它们仅仅是以一般性和描述性的意义使用的而不是用于限制的目的,本发明的范围阐述于以下权利要求书中。已经具体参考这些所示的实施方案相当详细地描述了本发明。然而,将显而易见的是,可以在如前述说明书中所述的本发明的精神和范围内作出各种改动和变化。此外,涉及顺序的语言,如第一和第二,应当在示例性意义上而不是在限制性意义上被理解。举例来说,本领域技术人员可以认识到的是,某些步骤可以被组合成单个步骤。
[0114]
实施例
[0115]
以下实施例进一步说明了组合物和方法。
[0116]
实施例1
[0117]
证实含有两种不同的发夹结构的哑铃状模板的非尺寸依赖性。使用一组引物(即正向:5'
‑
gga tcc gaa ttc gct gaa gcc agt tac ctt cg(seq id no:1)和反向:5'
‑
gga tcc gaa ttc agc cct ccc gta tcg tag tt)(seq id no:2)扩增样品dna,即puc18载体以得到具有425个碱基对的产物。每一个引物的5'
‑
末端均含有bamhi限制性内切酶位点和ecori限制性内切酶位点。然后使用ecori消化pcr产物以提供5'
‑
aatt突出端并且用
qiaquick pcr纯化试剂盒纯化。通过加热到50℃,继而冷却,从而允许寡核苷酸在加下划线的序列处自退火,进而产生5'
‑
aatt突出端以形成发夹结构1(5'
‑
aatt gcgag ttg cga gtt gta aaa cga cgg cca gt ctcgc(seq id no:3))。环结构含有m13通用引物序列。将发夹结构1和puc18 pcr产物分别以10:1摩尔比组合,并且在37℃用5单位的t4多核苷酸激酶处理40分钟,在16℃用400粘性末端单位的t4dna连接酶连接30分钟,然后在65℃灭活10分钟以形成哑铃状模板。当变性时,所述哑铃状模板变成单链环。使用qiaquick pcr清除试剂盒将哑铃状模板纯化以去除过量的未连接的发夹结构。
[0118]
使用m13引物的反向互补序列(rc)对哑铃状模板进行滚环复制,如图1中所示。在此,通过在20μl反应中在含有200μm的dntp和200μg/ml的bsa的φ29反应缓冲液中加热到94℃,持续5分钟并且冷却到57℃,持续1分钟来使2μm的m13
‑
rc引物(5'
‑
act ggc cgt cgt ttt aca a(seq id no:4))和m13对照引物(5'
‑
ttg taa aac gac ggc cagt(seq id no:5))分别与约10ng的puc18哑铃状模板退火。将反应进一步冷却到30℃,此时将10单位的φ29dna聚合酶添加到引发的哑铃状模板中并且孵育30分钟,继而在65℃热灭活10分钟。作为对照,将正常的m13通用测序引物在单独的滚环复制混合物中孵育。然后通过凝胶电泳分析复制的哑铃状模板。如图2中所示,m13
‑
rcr产物(泳道2)产生高分子量产物(孔中的上部条带),而m13对照没有产生可见的滚环复制产物。泳道2中的结果证实了滚环复制方法形成高分子量哑铃状模板。
[0119]
上文所示的方法只是使发夹结构连接到片段化的核酸分子的末端的一种方式。举例来说而不限于,还可以通过ta克隆和平端连接来连接发夹结构,如具有“t
”‑
突出端的发夹结构2(5'
‑
t gcgag ttg cga gtt gta aaa cga cgg cca gt ctcgc(seq id no:6))。还可以用nebnext da加尾试剂盒处理425bp的puc18 pcr扩增子以使“da”残基连接在dna片段的3'
‑
末端处。然后将puc18扩增子和发夹结构2磷酸化并且使用上文所述的方法连接在一起以形成哑铃状模板。这种方法集成到用于全基因组样品的大部分的下一代测序文库构建方法中。
[0120]
实施例2
[0121]
也可以使用基因组dna作为起始样品。举例来说而不限于,可以从卡瑞尔细胞库(coriell cell repositories)获得来自hapmap样品na18507的纯化的基因组dna并且使用标准的下一代测序方法(即使用covaris e210r装置)将其剪切,然后以0.5kb、1.0kb、2.5kb、5.0kb、7.5kb、以及10.0kb的尺寸增量对片段进行尺寸选择。类似于上文所述,可以对dna样品进行片段化以产生不同尺寸的dna片段,对片段的起始数量进行定量,使用相同条件连接hpa/hpb,并且富集hpa
‑
片段
‑
hpb哑铃状模板。将使用双标记荧光显微术来计数共定位荧光信号并且将该数与荧光信号的总数相比较来确定富集因子。nikon eclipse显微镜分析工具可以进行许多分析,包括强度测量、多个荧光信号的共定位、以及如核心包项目中所包括的其它分析。
[0122]
在这个实施例中,在稀释限制性内切酶反应中使用ecor1消化500ng的正常人基因组dna(密理博公司(millipore)),继而在65℃灭活。使在任一末端含有5'
‑
aatt突出端的这些片段连接到稳定和独特的发夹结构hp1。通过在高盐缓冲液中加热到95℃,继而在冰上快速冷却,从而允许寡核苷酸在加下划线的序列处自退火,进而得到5'
‑
aatt突出端以形成hp1(5'
‑
aatt gcgag ttg cga gtt gta aaa cgacgg cca gt ctcgc(seq id no:3))。将hp1
和消化的基因组dna分别以10:1摩尔比组合,并且在16℃使用400粘性末端单位的t
4 dna连接酶连接30分钟,然后在65℃灭活10分钟以形成哑铃状模板,参见图3。稀释消化和hp1连接产生具有约20kb至1kb范围的尺寸的哑铃状模板dna的弥散带(smear)。对哑铃状模板进行凝胶纯化以去除过量的未连接的和自连接的hp1衔接子,并且进行尺寸选择以分离三个不同的片段尺寸,即10kb
‑
6kb、6kb
‑
3kb、以及3kb
‑
2kb。
[0123]
hp1的环结构含有m13通用引物序列。使用m13引物的反向互补序列(rc)对哑铃状模板进行rcr(即使用一种引物),参见图3。在此,通过在20μl反应物中在含有200μm的dntp和200μg/ml的bsa的φ29反应缓冲液中加热到94℃,持续5分钟并且冷却到45℃,持续2分钟来使2μm的m13
‑
rc引物和m13对照引物(未示)分别与约10ng的经过尺寸选择的基因组dna哑铃状模板退火。将反应物进一步冷却到30℃,此时将10单位的φ29dna聚合酶添加到引发的环中并且孵育60分钟,继而在65℃热灭活10分钟。通过琼脂糖凝胶电泳分析起始物质和最终物质。如图4中所示,将ecor1消化的连接hp1的基因组dna上样到泳道1的孔中。将经过尺寸选择和纯化的哑铃状模板上样到泳道2、泳道3、以及泳道4的孔中。被上样到泳道5、泳道6、以及泳道7中的rcr产物似乎是在凝胶电泳后保留在孔中的不动的复合物。预期的m13
‑
rc rcr产物产生高分子量产物(图4的泳道5、泳道6、以及泳道7的孔中的上部条带),而m13对照没有产生可见的rcr产物(未示)。图4的泳道5、泳道6、以及泳道7中的结果证实了使用哑铃状模板形成高分子量dna的rcr方法。
[0124]
实施例3
[0125]
还从大的片段化的da加尾的基因组dna形成复制的哑铃状模板。在此,通过ta克隆和平端连接来连接发夹。ta克隆方法很好地集成到大部分当前的ngs平台中。我们已经设计了具有“t
”‑
突出端的发夹2(hp2)(5'
‑
/phos
‑
ctttttctttcttttct gggttgcgtctgttcgtct agaaaagaaagaaaaagt(seq id no:7))。使用covaris g
‑
管将人类基因组dna(500ng)片段化以实现严格限定的片段长度群体,如图5的泳道1和泳道2中所示。然后使用nebnext ultra dna文库制备试剂盒的末端制备模块对这一基因组dna进行末端修复和da加尾。类似于hp1使hp2自退火,并且使用平端/ta连接酶主混合物(blunt/ta ligase mater mix)(5:1摩尔比)连接到修复的基因组dna。使用核酸外切酶iii和vii去除过量的hp2和未连接的基因组dna。
[0126]
使用qiaex ii珠粒将所得的哑铃状模板纯化并且类似于先前所述的反应进行使用独特引物(5'
‑
aaaaaaa cagacgcaaccc(seq id no:8))的rcr反应。如图5中所示,两个片段化的基因组dna群体显示出covaris g
‑
管的高度可调的片段化能力(泳道1和泳道2)。由末端修复的da加尾的连接hp2的片段产生的rcr产物仍为在凝胶电泳后保留在孔中的高度不动的复合物(泳道3和泳道4)。
[0127]
实施例4
[0128]
在另一个实验中,将约20μl的高分子量正常人基因组dna(gdna)(100ng/μl)与130μl的hplc级h2o组合,并且将总共150μl吸移到covaris g
‑
管中。首先以5600rcf(即相对离心力)将所述管离心1分钟,然后使g
‑
管的取向反转并且以5600rcf离心1分钟。这产生基因组dna的约8千碱基
‑
10千碱基的片段,如图6的泳道2中所示。
[0129]
基因组dna样品还可以使用本领域已知的多种方法来片段化,包括但不限于使用新英格兰生物实验室公司(new england biolabs,neb)的片段化酶、核酸酶、以及限制性内
切酶的酶促片段化;使用机械力的片段化,如经由小号针进行的针剪切、超声处理、点汇剪切、雾化、声学片段化、以及转座体介导的片段化。
[0130]
然后使用多种手段中的一种,如在突出的5'
‑
末端和3'
‑
末端处去除或掺入核苷酸、5'磷酸化、以及da加尾来将片段化的dna的末端制备用于与适当的衔接头连接。将如上文所制备的约55.5μl的于h2o中的片段化的gdna与6.5μl的10
×
末端修复缓冲液(neb)和3μl的末端制备酶混合物(neb)组合并且等分到热循环仪微型管中。然后将这一反应混合物在20℃孵育30分钟,继而在65℃孵育30分钟。通过将反应管放在冰上或放在4℃将反应物冷却并且准备用于随后的步骤。
[0131]
由线性寡核苷酸形成发夹衔接子。将冻干的衔接子在hplc h2o中复原到100μm。将以下组分在微量离心管中组合:10μl的100μm衔接子原液、5μl的10
×
末端修复缓冲液(neb)、1μl的500mm nacl、以及34μl的hplc h2o。将混合物在95℃孵育15分钟,然后立即移到4℃。
[0132]
通过使发夹衔接子连接到片段化的末端修复的gdna的每一个末端上来形成哑铃状模板。将以下组分组合以形成样品反应混合物:65μl如上文所述的具有修复末端的片段化的gdna、3μl如上文所述制备的20μm衔接子、15μl的平端/ta连接主混合物(neb)以及3μl的hplc h2o。使这一连接反应在20℃进行1小时至16小时,然后立即移到4℃。
[0133]
对未连接的衔接头和未连接的片段化的dna进行核酸外切酶消化。将以下组分组合以形成样品反应混合物:1μl的10
×
核酸外切酶vii缓冲液(neb)、1μl的核酸外切酶vii、1μl的核酸外切酶iii、以及7μl的hplc h2o。将这一混合物添加到含有哑铃状模板、未连接的衔接头、以及具有游离末端的片段化的dna的连接反应混合物中。将所得的反应混合物在37℃孵育1小时,然后在95℃孵育10分钟,然后转移回到4℃。
[0134]
图6是对如上文所述所制备的dna产物进行琼脂糖凝胶分析的实施例。泳道1示出了未片段化的基因组dna;泳道2示出了在covaris g
‑
管中片段化后片段化的dna;泳道3示出了在使衔接头连接到1μg的片段化的dna之后形成的产物;泳道4示出了在使衔接头连接到500ng的片段化的dna之后形成的产物;泳道5示出了在没有任何衔接头的情况下使1μg的片段化的dna进行连接反应之后形成的产物;泳道6示出了在没有片段化的dna而只有衔接头的情况下进行连接反应之后形成的产物;泳道7示出了在对通过使衔接头连接到1μg的片段化的dna所获得的产物进行核酸外切酶消化之后形成的产物;泳道8示出了在用exo iii和exo vii对通过使衔接头连接到500ng的片段化的dna所获得的产物进行核酸外切酶消化之后形成的产物;泳道9示出了在用exo iii和exo vii对在没有任何衔接头的情况下进行连接反应的片段化的dna进行核酸外切酶消化之后形成的产物;泳道10示出了在用exo iii和exo vii对在没有片段化的dna而只有衔接头的情况下进行连接反应所获得的产物进行核酸外切酶消化之后形成的产物。泳道11示出了片段化的基因组dna和没有连接的衔接子的消化对照。
[0135]
还对dna样品进行浓缩以去除盐并且浓缩核酸外切酶抗性哑铃状模板。用约4μl的hplc h2o将核酸外切酶消化之后反应混合物的体积调整到100μl溶液。将约10μl的3m乙酸钠(ph 5.2)和5μl的糖原(20mg/ml)添加到所述溶液中,继而添加115μl的冷100%异丙醇。将这一反应混合物在
‑
20℃冷藏>1小时,然后在室温以10rcf离心20分钟。抽吸上清液并且用70%乙醇洗涤沉淀物。将最终的沉淀物干燥约15分钟,然后重悬在30μl的10μm tris
‑
hcl
(ph 8.0)中。
[0136]
图7是对如上文所述所制备的dna产物进行琼脂糖凝胶分析的实例。泳道1示出了在使衔接头10.1连接到片段化的dna并且随后进行乙醇沉淀之后形成的产物;泳道2示出了在使衔接头2.1连接到片段化的dna并且随后进行乙醇沉淀之后形成的产物;泳道3示出了在没有衔接头的情况下使片段化的dna进行连接反应并且随后进行乙醇沉淀之后形成的产物;泳道4示出了在没有片段化的dna的情况下仅使衔接头10.1进行连接反应并且随后进行乙醇沉淀之后没有形成产物;泳道5示出了在没有片段化的dna的情况下仅使衔接头2.1进行连接反应并且随后进行乙醇沉淀之后没有形成产物;泳道6示出了在没有片段化的dna和衔接头的情况下进行连接反应并且随后进行乙醇沉淀之后没有形成产物。
[0137]
还对哑铃状模板进行尺寸选择。通过琼脂糖凝胶电泳分离具有所期望的尺寸的核酸外切酶抗性哑铃状模板以使任何不希望有的产物,如衔接子
‑
衔接子连接产物的残留减到最低限度。制备0.8%(重量/体积)1
×
tae琼脂糖凝胶。制备含有适量的dna上样染料的浓缩的哑铃状模板并且将约20μl的浓缩哑铃状模板上样到琼脂糖凝胶上。在足以分离产物的时间之后,将凝胶用sybrsafe凝胶染色剂染色,并且在灯箱上可视化。使用无菌手术刀切下含有所期望的尺寸范围的哑铃状模板的凝胶区段。使用qiaex ii分离方案分离哑铃状模板并且重悬在30μl的h2o中。
[0138]
然后使用高度持续性链置换聚合酶对哑铃状模板进行滚环复制。用以下组分配制第一反应混合物:5μl的经过尺寸选择的哑铃状模板、1.5μl的10
×
phi29聚合酶缓冲液(neb)、1μl的哑铃状模版互补引物、0.5μl的牛血清白蛋白(bsa)
‑
100mg/ml、以及7μl的hplc h2o。将反应混合物在95℃孵育10分钟,冷却到45℃,持续5分钟,然后进一步冷却到20℃。使用以下组分配制第二反应混合物:1μl的10
×
phi29聚合酶缓冲液(neb)、5μl的10mm dntp混合物、0.5μl的phi29聚合酶、以及3.5μl的hplc h2o。将如上文所述处理后的第一反应混合物和第二反应混合物组合并且在25℃孵育1小时
‑
4小时。然后,将所得混合物加热到65℃,持续20分钟以灭活聚合酶。
[0139]
然后通过琼脂糖凝胶电泳分析滚环复制产物。由于它们的高分子量,因此在电泳后这些滚环复制产物存在于孔中而未进入凝胶。某些另外的早期终止产物也是可见的。
[0140]
图8是对通过对图6中所分析的产物进行滚环复制所制备的dna产物进行琼脂糖凝胶分析的实例。泳道1示出了从图6的泳道7切下的产物的低效滚环反应。泳道2示出了在对从图6的泳道8切下的产物进行滚环复制之后获得的滚环产物,所述产物为在凝胶电泳后保留在孔中的高度不动的复合物。泳道3示出了在对从图6的泳道9切下的产物进行滚环复制之后没有获得滚环产物。泳道4示出了在对从图6的泳道10切下的产物进行滚环复制之后没有获得滚环产物。泳道5示出了在不存在dna的情况下进行的滚环反应没有获得滚环产物。泳道6示出了用片段化的dna产物进行的滚环反应没有获得滚环产物,这表明没有从片段化的dna的随机引发。
[0141]
图9是对通过对图7中所分析的产物进行滚环复制所制备的dna产物进行琼脂糖凝胶分析的实例。泳道1示出了在对图7的泳道1中所分析的经过尺寸选择的产物进行滚环复制之后获得的滚环产物。在凝胶电泳后保留在孔中的不动复合物指示成功的rcr产物。泳道2示出了在对图7的泳道2中所分析的经过尺寸选择的产物进行滚环复制之后获得的滚环产物。泳道3示出了在对图7的泳道3中所分析的经过尺寸选择的产物进行滚环复制之后没有
获得滚环产物。泳道4示出了在对图7的泳道4中所分析的经过尺寸选择的产物进行滚环复制之后没有获得滚环产物。泳道5示出了在对图7的泳道5中所分析的经过尺寸选择的产物进行滚环复制之后没有获得滚环产物。泳道6示出了在对图7的泳道6中所分析的经过尺寸选择的产物进行滚环复制之后没有获得滚环产物。泳道7、泳道8以及泳道9示出了在对照反应中没有获得滚环产物,在所述对照反应中,在没有连接的情况下向滚环反应提供片段化的dna(泳道7);在没有引物的情况下向滚环反应提供片段化的dna(泳道8);以及在没有连接的情况下没有向滚环反应提供片段化的dna(泳道9)。
[0142]
实施例5
[0143]
还可以通过使用针对哑铃状模板的发夹序列的互补区的分子探针或信标来检测滚环复制产物。为了证实这种方法的可行性,形成h3发夹衔接子的滴定系列,浓度在0μm至5μm的范围。将10μm h3发夹的原液连续稀释以实现2倍测试浓度。发夹衔接头3(h3)具有以下序列:
[0144]
5'po4‑
aattg cgagc tatga ccatg attac gccac tggcc gtcgt tttac aactc gc(seq id no:9)
[0145]
举例来说,将10μm的原液稀释成一半以实现5μm的测试样品,将5μm的原液稀释成一半以实现2.5μm的测试样品,诸如此类。这些代表实际测试浓度的两倍(2
×
)。然后将约5μl的2
×
h3衔接子浓缩液与1μl的neb phi29反应缓冲液10
×
、1μl的200μm信标2、以及3μl的hplc h2o组合。分子信标2具有以下序列,并且“5,6
‑
fam”是5
‑
fam和6
‑
fam异构体的混合物并且“iabkfq”是iowablack猝灭剂:
[0146]
5'
‑
/5,6
‑
fam/cggagttgcgagttgtaaaacgacggccagtctccg/3
‑
iabkfq(seq id no:10)
[0147]
在设置这一反应混合物时,将测试样品中h3的浓度降低到最终的1
×
测量浓度。然后将反应混合物在热板上加热到98℃,在该温度维持十分钟,然后在台面上缓慢冷却。在关灯的情况下并且在用锡箔覆盖反应管以防止来自信标的信号损失的情况下进行所有的反应和热循环步骤。一旦冷却到室温,就准备反应以在molecular devices spectramax gemini xps荧光微孔板读数器上进行读数。确切地说,使用spectradrop微孔板载片以有助于测量非常小的体积。将来自每一个滴定反应的约2μl加到微体积载片上。一旦插入机器中,就在室温运行以下程序:
[0148]
激发波长:495nm
[0149]
发射波长:520nm
[0150]
6次闪烁/读数
[0151]
收集并且处理原始数据,如图10中所示。将0μm的rlu(相对发光单位)读数从所有样品中减去以通过消除背景荧光来归一化。
[0152]
表1
[0153]
μm[h3]52.51.250.6250.31250.156250rfu134.896118.25796.35166.29753.1252.3446.489经过调整88.40771.76849.86219.8086.6315.8510
[0154]
实施例6
[0155]
可以设计实验以确定独立于片段长度尺寸制备哑铃状模板的效率。当前的大片段
ngs文库构建方法的主要限制在于通过使长dna片段的末端环化来形成配对模板。在理论上,高效形成哑铃状模板的能力应当具有非尺寸依赖性。这些哑铃状模板可以具有各种尺寸,包括例如而不限于0.5kb、1.0kb、2.5kb、5.0kb、7.5kb、或10.0kb。这些片段尺寸首先可以用pcr,通过使用人类bac dna设计靶向同一个基因组区域的引物来产生。这种方法将允许使用实时pcr来定量不同尺寸的哑铃状模板的拷贝数。在一个实施例中,已经形成用于tcf7l2 rs7903146等位基因的实时pcr试剂,所述试剂是使用生命科技公司(life technologies)的定制taqman测定网站设计的。5'
‑
引物序列是5'
‑
cct caaacc tag cac agc tgt tat(seq id no:11),3'
‑
引物序列是5'
‑
tgaaaactaagg gtg cct cat acg(seq id no:12),并且探针序列是5'
‑
ctt ttt agata[c/t]tat ata att taa(seq id no:13)。在其它实施例中,可以产生不同尺寸的片段,定量扩增子的起始数量,使用相同条件连接发夹结构2,然后用实时pcr定量哑铃状模板的拷贝数。
[0156]
在其它实验中,可以主要经由两种方法,即covaris g
‑
管和neb片段化酶来形成限定的片段群体。随后将根据本文所述的ta克隆方法来制备和分离哑铃状模板。可以使用与发夹序列杂交的分子信标来使用荧光板读数器定量不同尺寸的哑铃状模板的数量。这些实验证实哑铃状模板可以独立于起始基因组dna样品的片段尺寸高效地形成。此外,还可以使用这些分子信标来定量rcr产物和反应效率。
[0157]
实施例7
[0158]
在ngs配对末端测序平台中高效插入哑铃状模板需要在dna模板的每一个末端上存在独特的引物或发夹。这将经由标准的末端修复/da加尾方法,继而连接两个独特的发夹寡核苷酸(即hpa和hpb)来实现,所述寡核苷酸各自含有独特的通用复制/测序引发位点和分子信标位点。在发夹连接后,我们期望由25%的hpa
‑
片段
‑
hpa、50%的hpa
‑
片段
‑
hpb、以及25%的hpb
‑
片段
‑
hpb构成的群体。可以通过捕捉探针色谱,通过首先使连接产物通过含有发夹a的反向互补序列的柱,从而捕捉hpa
‑
片段
‑
hpa模板和hpa
‑
片段
‑
hpb模板,但不捕捉hpb
‑
片段
‑
hpb模板来富集所期望的形式hpa
‑
片段
‑
hpb。在洗脱后,然后使部分富集的样品通过含有发夹b的反向互补序列的第二柱,从而捕捉hpa
‑
片段
‑
hpb模板,但不捕捉hpa
‑
片段
‑
hpa模板。这种双重发夹方法将使用与上文所概述类似的方法来证实;将形成围绕0.5kb、1.0kb、2.5kb、5.0kb、7.5kb、以及10.0kb的独特尺寸的dna片段的群体,对它们进行尺寸选择、纯化、末端修复以及da加尾。然后将这些连接到hpa发夹和hpb发夹并且双重标记,将使用上述技术富集hpa
‑
片段
‑
hpb哑铃状模板。将进行使用φ29dna聚合酶和t7复制体系统的初步实验以使用基于溶液的分子信标评估复制拷贝数对哑铃状模板尺寸的依赖性。
[0159]
实施例8
[0160]
可以优化用于滚环扩增的条件以包括适当的dna聚合酶、复制因子、以及反应条件以使得可以支持10kb哑铃状模板的至少1,000倍复制。以1,000个拷贝的复制倍数作为目标,这是因为这是在illumina cbot仪器上实现的克隆扩增的短模板的等同数目,并且因此,可以预期在测序过程期间所测量的荧光信号的类似水平。可以采用一组dna聚合酶以用于长合成,包括可商购获得的dna聚合酶(longamp、bst、bst 2.0、q5、以及t
7 dna聚合酶)、以及至少12种非市售的专有的家族a、b、以及ddna聚合酶。此外,还可以使用一组复制辅助因子作为复制增强子。可以添加辅助蛋白以提高所期望的滚环产物的产生效率,包括但不限于提高dna聚合酶持续性的持续性夹(processivity clamp)和夹装载因子复合体
(clamp loader complex)、使单链dna区稳定的单链结合蛋白、在dna聚合酶前分离双链dna的解旋酶、用于分辨瓣状dna结构的瓣状核酸内切酶、以及密封dna切口的dna连接酶。这些因子与来自同一家族内的dna聚合酶是可互换的并且可以使用适当的dna聚合酶配偶体测试。举例来说,来自嗜热古菌菌种9
°
n(archaeon thermococcus sp.9
°
n)的核心辅助因子将与家族b dna聚合酶一起使用,而家族adna聚合酶将使用大肠杆菌辅助因子测试。将使用定量pcr来测量复制的哑铃状模板dna。qpcr探针可以靶向如本文所述所形成的2kb哑铃状模板和10kb哑铃状模板的发夹区域。在复制引发的哑铃状模板的情况下,探针可以结合合成的发夹区域的每一段。因此,当与一系列标准的稀释的发夹模板相比较时,可以使用探针强度来指示拷贝数(图11)。除了qpcr之外,还可以通过碱性琼脂糖凝胶电泳监测扩增产物的长度。碱性琼脂糖凝胶电泳将dna分离成单链并且准确地测量总复制产物长度。
[0161]
实施例9
[0162]
在一个实施例中,将用于滚环复制的最佳密度的官能化的引物连接到定制设计的流动池的玻璃表面。如图11a中所示设计夹在两个载玻片之间的定制的切割粘合剂垫圈。使复制子连接到盖片的底侧。所述盖玻片具有用纳米端口配件紧固的入口端口/出口端口。这里的垫圈是具有微通道的3m双面胶带,并且位于标准显微镜载片的顶部。这种设计将必要的光学特性、化学特性以及机械特性与实际需要,如易用性、制造速度、简单性以及成本效益相配合。
[0163]
如图11b中所示,流动池设计由通过将130μm厚的3m双面胶膜垫圈夹在标准的1mm厚的25mm
×
75mm的硼硅酸盐玻璃载片(vwr)与25mm
×
75mm的#1.5h硼硅酸盐盖片(schott nexterion)之间所形成的微通道组成。微流体通道垫圈层是使用激光切割器(universal x
‑
660)从3m双面胶带中切出的,并且入口孔/出口孔是穿过顶部盖片层喷砂而来的。通过将粘合剂垫圈放置在载玻片的顶部上,然后将盖片放置在垫圈的顶部上来密封通道。所得的通道具有130μm深、3mm宽以及4cm长的矩形横截面。使用纳米端口夹具(idex health&science公司)将100μm内径的peek管连接到入口端口和出口端口作为用于交换流动池内的溶液和试剂的装置。
[0164]
可以通过使用化学策略将预先合成的寡核苷酸连接到玻璃表面。鉴定最佳的载体化学物质是重要的,这是因为先前的研究已经证实某些偶联策略可以影响杂交和固相pcr应用的性能。在一个实例中,将玻璃表面用硅烷试剂,如3
‑
氨基丙基三乙氧基硅烷官能化是第一步骤。许多化学偶联策略涉及氨基修饰的寡核苷酸。使用这些末端官能团作为起点容许使用系统方法评价用于使寡核苷酸连接到玻璃表面的不同的中间偶联剂。举例来说而不限于,氰尿酰氯激活法已经用于使寡核苷酸序列5'
‑
nh2‑
ttttttttttttgtaaaacgacggccagt(seq id no:14)连接到盖片表面。其它实例可以利用多种其它激活化学物质,例如1,4
‑
亚苯基二异硫氰酸酯和二羧酸反应。所有这些激活策略均产生类似良好的杂交数据。本发明的实施方案包括不同长度的聚(dt)
n
接头(即n=0、10、20)。
[0165]
在一个实例中,可以利用nikon eclipse fn1显微镜,所述显微镜使用宽带led光源并且提供使用跨越可见光区和近ir区的不同荧光染料的灵活性。在一个实例中,使用da加尾方法,用发夹结构3(5'
‑
t cgcgagctcgcg(seq id no:15))形成puc18哑铃状模板。已经设计了分子信标2(5'
‑
fam
‑
cggag
ctccg
‑
iowablack(seq id no:16))以测定上述流动池中的固相滚环复制反应。加下划线的序列表示双链茎区,第一个加方框的序列表示探针序列,并且第二个加方框的序列表示将结合到固定的m13引物序列的引物序列。由于分子信标应当产生低背景荧光,因此产生表面结合复制子的充分的滚环复制将产生良好的信噪比(snr)。可以凭经验确定0.5kb哑铃状模板的稀释度以将每个视野(fov)25k至50k的复制子密度作为目标。
[0166]
在某些实施例中,表面效应可能抑制一些反应并且可能需要使用钝化剂,如聚乙烯吡咯烷酮或高分子量peg。在某些实例中,可以利用低产率的硫代磷酸酯引物,这是因为φ29dna聚合酶可以对单链dna表现出显著的核酸外切酶活性。
[0167]
实施例10
[0168]
可以将从先前实例中搜集的试剂和条件应用于片段化的人类基因组dna以证实从10kb哑铃状模板形成ngs相容的克隆复制簇的稳健的能力。在某些实例中,10kb哑铃状模板可以产生靶序列的1,000个拷贝。多种dna聚合酶在滚环复制方法中有效地发挥作用,包括但不限于bst、以及vent(exo
‑
)dna聚合酶。最近,一种突变型φ29dna聚合酶被鉴定出将dna合成产率提高到数倍并且可从sygnis公司商购获得。在某些实例中,可以使用复制体复合体以使用t7测序酶、t7解旋酶、以及t7单链结合蛋白的协同活性来复制10kb哑铃状模板。在某些实例中,哑铃状模板(以0.5kb、1.0kb、2.5kb、5.0kb、7.5kb、以及10.0kb的尺寸增量)可以用于溶液测定并且使用实时pcr测试针对tcf7l2来分析。在某些实例中,可以包括辅助蛋白,包括例如而不限于其它解旋酶、单链结合蛋白、硫氧还蛋白、拓扑异构酶、反向旋转酶、或其任何组合以提高滚环复制方法的效率和准确度。
[0169]
在某些实例中,可以用发夹结构3形成0.5kb、1.0kb、2.5kb、5.0kb、7.5kb、或10.0kb的哑铃状模板并且用在基于溶液的实时pcr测定中所鉴定的最佳条件中的若干个来测试。在滚环复制方法后,可以使用分子信标2探测复制的哑铃状模板并且通过荧光显微术分析以确定复制的哑铃状模板的信号强度。在某些实施例中,可以用双重发夹哑铃状模板作为从hapmap样品na18507中分离的真实世界模板进行滚环复制。
[0170]
本发明的实施方案还可以包括一种或多种发夹结构、酶、其它核苷酸以及蛋白质试剂,它们被包装成试剂盒以用于实施本文所述的方法和产生本文所述的组合物。用于实施如本文所述的方法以及检测如本文所述的滚环产物的存在的试剂可以被单独提供或可以被共同包装成试剂盒的形式。举例来说,试剂盒可以被制备成包括一种或多种引物、一种或多种标记的核苷三磷酸、以及用于执行本文所述的方法的各个步骤的相关酶。试剂盒还可以包括一种或多种亲和标记的发夹结构和一个或多个相应的固体载体的包装组合以纯化哑铃状模板。试剂盒的容器内试剂的布置将取决于所涉及的具体试剂。每一种试剂可以被包装在单个容器中,但是各种组合也是可能的。本发明的实施方案还可以包括一种试剂盒,所述试剂盒含有一种或多种寡核苷酸以形成一种或多种发夹结构;一组用于连接的组分,包括连接酶、辅因子、辅助因子、以及适当的缓冲液;以及一组用于复制的组分,包括基本上互补的引物、执行本文所述的各个步骤的酶、辅助因子、以及适当的缓冲液。
[0171]
本发明的某些实施方案包括一种试剂盒,所述试剂盒含有能够形成发夹结构的至少一种寡核苷酸;用于使所述发夹结构连接到来自样品的至少一个核酸分子以形成至少一
个哑铃状模板的第一组的组分,其中所述第一组的组分含有连接酶、辅因子、连接酶适用的缓冲液、以及其组合中的一种或多种;用于通过消化任何未连接的发夹结构和任何未连接的核酸分子来纯化所述至少一个哑铃状模板的第二组的组分,其中所述第二组的组分含有核酸外切酶、核酸外切酶适用的缓冲液、以及其组合中的一种或多种;以及用于复制所述至少一个哑铃状模板以形成至少一个扩增的哑铃状模板的第三组的组分,其中所述第三组的组分含有聚合酶或复制体、核苷酸、辅助因子、以及与所述至少一个哑铃状模板的区域基本上互补的至少一种引物。
[0172]
本发明的实施方案还包括一种试剂盒,所述试剂盒含有能够形成发夹结构的至少一种寡核苷酸;连接酶,用于使所述发夹结构连接到来自样品的至少一个核酸分子以形成至少一个哑铃状模板;核酸外切酶,用于通过消化任何未连接的发夹结构和任何未连接的核酸分子来将所述至少一个哑铃状模板纯化;以及聚合酶和与所述至少一个哑铃状模板的区域基本上互补的至少一种引物,用于复制所述至少一个哑铃状模板以形成至少一个复制的哑铃状模板。
[0173]
本发明的某些实施方案包括一种试剂盒,所述试剂盒含有能够形成发夹结构的至少一种寡核苷酸;连接酶,用于使所述发夹结构连接到来自样品的至少一个核酸分子以形成至少一个哑铃状模板;核酸外切酶,用于通过消化任何未连接的发夹结构和任何未连接的核酸分子来将所述至少一个哑铃状模板纯化;以及复制体和与所述至少一个哑铃状模板的区域基本上互补的至少一种引物,用于复制所述至少一个哑铃状模板以形成至少一个复制的哑铃状模板。
[0174]
本发明的某些实施方案包括一种试剂盒,所述试剂盒含有能够形成发夹结构的至少一种寡核苷酸;连接酶,用于使所述发夹结构连接到来自样品的至少一个核酸分子以形成至少一个哑铃状模板;核酸外切酶,用于通过消化任何未连接的发夹结构和任何未连接的核酸分子来将所述至少一个哑铃状模板纯化;以及聚合酶和与所述至少一个哑铃状模板的至少两个区域基本上互补的至少两种引物,用于扩增所述至少一个哑铃状模板以形成至少一个扩增的哑铃状模板。
[0175]
本发明的某些实施方案包括一种试剂盒,所述试剂盒含有能够形成发夹结构的至少一种寡核苷酸;连接酶,用于使所述发夹结构连接到来自样品的至少一个核酸分子以形成至少一个哑铃状模板;核酸外切酶,用于通过消化任何未连接的发夹结构和任何未连接的核酸分子来将所述至少一个哑铃状模板纯化的核酸外切酶;以及复制体和与所述至少一个哑铃状模板的至少两个区域基本上互补的至少两种引物,用于扩增所述至少一个哑铃状模板以形成至少一个扩增的哑铃状模板。
[0176]
此外,上文已经广泛地概述了本发明的某些目的、特征和技术优势以及具体实施方式以使得可以鉴于如本文所述的本发明的特征和优势更好地理解本发明的实施方案,所述实施方案形成本发明的某些权利要求的主题。应当了解的是,所公开的构思和具体实施方案可以容易地被用作修改或设计其它结构以实现本发明的相同目的的基础。还应当认识到的是,这些等同构造没有脱离如所附权利要求书中所阐述的本发明。当结合附图考虑时,从上述说明中更好地理解关于本发明的组织和操作方法以及另外的目的和优势被认为是本发明的特征的新颖特征。然而,应当明确地了解,提供这样的说明和附图仅是为了说明和描述的目的,而不意在作为对本发明的限制的限定。对于本领域技术人员将显而易见的是,
可以在如前述说明书中所述的本发明的精神和范围内作出各种改动和变化。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

