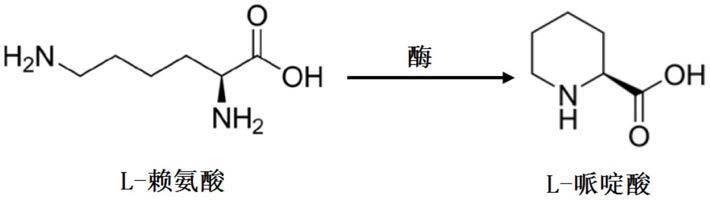
鸟氨酸环化脱氨酶催化合成l
‑
哌啶酸的方法
技术领域
1.本发明属于生物催化技术领域,具体地说,涉及一种利用鸟氨酸环化脱氨酶催化制备l
‑
哌啶酸的方法。
背景技术:
2.l
‑
哌啶酸(cas3105
‑
95
‑
1,l
‑
pipecolic acid,简称pa)是亚氨基酸的一种,在大多数植物中以游离态存在,特别是在豆科植物中发现有较高的浓度,作为一种重要的刚性环状非蛋白质氨基酸,既可以限定多肽的构象,还可作为不同化合物合成库中的多功能骨架,可以广泛用于许多手性药物的合成,哌啶酸及其衍生物是一类应用广泛的医药中间体。例如,新一代局麻药罗哌卡因(ropivacaine)、抗精神病药物硫利哒嗪(thioridazine)、免疫抑制剂雷帕霉素(rapamycin)以及抗肿瘤抗生素山卓霉素(sandramycin)等均是以哌啶酸或其衍生物为主要原料制得的。
3.由于哌啶酸及其衍生物具有的生物活性和广泛的应用前景,围绕其制备,人们已开发出许多合成的新方法和新技术。目前的制备方法主要分为生物化学催化、化学不对称合成和光催化合成。由于l
‑
哌啶酸是手性分子,不对称手性合成较困难,因此利用选择性高的酶催化方法制备高光学纯度的l
‑
哌啶酸一直是研究热点。
[0004][0005]
专利文献cn1529756a报道了根癌土壤杆菌(agrobacterium tumefaciens c58)来源的鸟氨酸环化脱氨酶(ornithine cyclodeaminase,ocd)、始旋链霉菌(streptomyces pristinaespiralis atcc25486)来源的亚氨基肽酶pipa、吸水链霉菌(streptomyces hygroscopicus)来源的赖氨酸环化脱氨酶(rapl)等酶将l
‑
赖氨酸直接脱氨环化转化为l
‑
哌啶酸。专利文献cn109402099a进一步报道了始旋链霉菌(streptomyces pristinaespiralis atcc25486)来源的赖氨酸环化脱氨酶(lysine cyclodeaminase,lcd)及其突变体可将l
‑
赖氨酸转化为l
‑
哌啶酸,证明酶催化方法将l
‑
赖氨酸转化为l
‑
哌啶酸这一路径是个有应用前途的绿色工艺。
[0006]
然而,经实验证实,采用上述专利文献中报道的酶进行l
‑
赖氨酸转化时的实际催化反应效率却相差甚远,明显偏低,远达不到工业化应用的酶活力/催化效率要求。
技术实现要素:
[0007]
为了探索酶催化l
‑
赖氨酸转化法制备l
‑
哌啶酸的工业化可行性,发明人对于众多微生物来源的鸟氨酸环化脱氨酶(ocd)、赖氨酸环化脱氨酶(lcd)、亚氨基肽酶pipa等酶进行了广泛筛选,终于筛选到几种酶活力比上述现有技术酶有明显提高(高出至少一倍)的酶
品种,包括生黑孢链霉菌(streptomyces melanosporofaciens)来源的鸟氨酸环化脱氨酶(ncbi登录号wp_093467660.1,氨基酸序列为seq id no:1);以此酶为基础,我们还对其进行了突变,以便提高其酶活力。具体而言,本发明包括如下技术方案。
[0008]
一种酶催化制备l
‑
哌啶酸的方法,包括如下步骤:以l
‑
赖氨酸为底物,使用鸟氨酸环化脱氨酶seq id no:1、或者其(g69v,g145l)突变体seq id no:3或(g69n,v142h)突变体seq id no:5催化环化脱氨反应,得到l
‑
哌啶酸。
[0009]
其中,鸟氨酸环化脱氨酶突变体seq id no:3其为野生型鸟氨酸环化脱氨酶seq id no:1氨基酸序列g69v、g145l的突变体:
[0010]
mettvltrqhvakivqgkgldlfmdrmidrldeafraesrwgitpardgfvrgpqntavlewmphhqpvdsitiktvaytptnpfthqlptiigtmaryddvtgrllavgdgilptavrtgaasaiasrllahpdsrvlglvgalaqavtqahalsrvfrldrilvhdiepahaesfaerveflgidvevasvaeieaasdiictvtsvgvgdgpvlhgerlrphvhinaigadligkyevplsvlksafvtpdhqgqalregecqqldqselgpelpalcadpalaegrreqptvfdstgfaledhvafdvllelaeeagigdrvqlehlpedalnpysfq(seq id no:3);
[0011]
鸟氨酸环化脱氨酶突变体seq id no:5为seq id no:1氨基酸序列g69n、v142h的突变体:
[0012]
mettvltrqhvakivqgkgldlfmdrmidrldeafraesrwgitpardgfvrgpqntavlewmphhqpndsitiktvaytptnpfthqlptiigtmaryddvtgrllavgdgilptavrtgaasaiasrllahpdsrvlglhgagaqavtqahalsrvfrldrilvhdiepahaesfaerveflgidvevasvaeieaasdiictvtsvgvgdgpvlhgerlrphvhinaigadligkyevplsvlksafvtpdhqgqalregecqqldqselgpelpalcadpalaegrreqptvfdstgfaledhvafdvllelaeeagigdrvqlehlpedalnpysfq(seq id no:5)。
[0013]
更优选地,上述方法采用鸟氨酸环化脱氨酶seq id no:3作为生物催化剂来催化l
‑
哌啶酸的反应。
[0014]
在一种可选的实施方式中,上述鸟氨酸环化脱氨酶seq id no:1或者其突变体seq id no:3或seq id no:5可以呈其表达微生物菌体形式。
[0015]
该反应体系优选为缓冲溶液,可以为磷酸缓冲溶液,例如为ph6.5
‑
7.5、优选ph6.8
‑
7.2、更优选ph7.0左右的缓冲溶液。
[0016]
上述反应温度可以为25
‑
45℃。
[0017]
本发明的第二个方面提供了一种鸟氨酸环化脱氨酶,其氨基酸序列为seq id no:3或seq id no:5。
[0018]
本发明的第三个方面提供了编码上述鸟氨酸环化脱氨酶的基因。
[0019]
优选地,编码鸟氨酸环化脱氨酶seq id no:3的基因的核苷酸序列为seq id no:4。
[0020]
本发明的第四个方面提供了一种微生物,其表达上述的鸟氨酸环化脱氨酶seq id no:3或者seq id no:5。
[0021]
上述微生物可以选自枯草芽孢杆菌、短乳杆菌、大肠杆菌、谷氨酸棒杆菌。优选地,所述微生物是大肠杆菌bl21(de3)。
[0022]
显然,上述微生物可以作为生物催化剂用于l
‑
哌啶酸的生产。
[0023]
本发明提供的鸟氨酸环化脱氨酶酶seq id no:1及其突变体seq id no:3、4能够促进l
‑
赖氨酸发生环化脱氨反应,得到l
‑
哌啶酸,为生物催化法生产l
‑
哌啶酸的工业化提
供了一种新路线。
具体实施方式
[0024]
l
‑
哌啶酸又称l
‑2‑
哌啶酸、l
‑
哌啶甲酸或者l
‑2‑
哌啶甲酸。为了寻找能够具有工业化开发应用价值的酶用于l
‑
赖氨酸转化为l
‑
哌啶酸,发明人对于具有高立体选择性地将氨基酸环化脱氨功能的微生物来源的酶类进行了大量分析,发现以赖氨酸环化脱氨酶(lcd)和鸟氨酸环化脱氨酶(ocd)为主。经对比实验,确认生黑孢链霉菌来源的鸟氨酸环化脱氨酶(ncbi登录号wp_093467660.1)的酶活力比较高;其氨基酸数量(342aa)比现有技术的lcd和ocd稍小,也有利于酶分子结构的研究和改造。
[0025]
在本文中,术语“鸟氨酸环化脱氨酶突变体”、“突变体鸟氨酸环化脱氨酶”、“突变ocd”和“突变酶”表示相同的意义,都是指鸟氨酸环化脱氨酶的突变体。为简要起见,有时为了表述方便起见,在本发明中可以将野生型鸟氨酸环化脱氨酶与其突变体统称为“鸟氨酸环化脱氨酶”,只要不与野生酶seq id no:1混淆即可。其中,野生型鸟氨酸环化脱氨酶的氨基酸序列为seq id no:1:
[0026]
mettvltrqhvakivqgkgldlfmdrmidrldeafraesrwgitpardgfvrgpqntavlewmphhqpgdsitiktvaytptnpfthqlptiigtmaryddvtgrllavgdgilptavrtgaasaiasrllahpdsrvlglvgagaqavtqahalsrvfrldrilvhdiepahaesfaerveflgidvevasvaeieaasdiictvtsvgvgdgpvlhgerlrphvhinaigadligkyevplsvlksafvtpdhqgqalregecqqldqselgpelpalcadpalaegrreqptvfdstgfaledhvafdvllelaeeagigdrvqlehlpedalnpysfq(seq id no:1)。
[0027]
有趣的是,本发明的两个酶活力提高明显的突变体中的突变位点都包含第69位g,且seq id no:3的另一个突变位点第145位g与seq id no:5的另一个突变位点第142位v的位置也很接近,提示第69位和第142
‑
145位附近位点可能处于酶的活性中心,因此有必要进一步通过生物信息学技术进行该酶立体结构的模拟和计算,以便于进一步改良鸟氨酸环化脱氨酶并用于生产实践,这是后续研究内容。
[0028]
由于本发明筛选出的鸟氨酸环化脱氨酶及其突变体的氨基酸数量只有342个,且结构明确,因此本领域技术人员很容易获得其编码基因、包含这些基因的表达盒和质粒、以及包含该质粒的转化体。
[0029]
这些基因、表达盒、质粒、转化体可以通过本领域技术人员所熟知的基因工程构建方式获得。
[0030]
为了在微生物宿主例如基因工程中最常用的大肠杆菌中最佳地表达鸟氨酸环化脱氨酶seq id no:1及其突变体seq id no:3、5,本发明对其表达基因进行了密码子优化。
[0031]
密码子优化是可用于通过增加感兴趣基因的翻译效率使生物体中蛋白质表达最大化的一种技术。不同的生物体由于突变倾向和天然选择而通常示出对于编码相同氨基酸的一些密码子之一的特殊偏好性。例如,在生长快速的微生物如大肠杆菌中,优化密码子反映出其各自的基因组trna库的组成。因此,在生长快速的微生物中,氨基酸的低频率密码子可以用用于相同氨基酸的但高频率的密码子置换。因此,优化的dna序列的表达在快速生长的微生物中得以改良。
[0032]
经过密码子优化,野生型鸟氨酸环化脱氨酶seq id no:1的编码基因可以是seq id no:2,而鸟氨酸环化脱氨酶突变体seq id no:3的编码基因可以是seq id no:4。
[0033]
当作为生物催化剂用于制备l
‑
哌啶酸时,本发明的鸟氨酸环化脱氨酶可以呈现酶的形式或者菌体的形式。所述酶的形式包括游离酶、固定化酶,包括纯化酶、粗酶、发酵液、载体固定的酶等;所述菌体的形式包括存活菌体和死亡菌体。
[0034]
生物催化领域公知,与游离酶法相比,应用固定化酶技术具有生产过程简化、生产效率提高等优点。同时,由于酶可多次使用,且酶的稳定性提高,从而有效提高了单位酶的生产力;其次,固定化酶极易与底物、产物分开,简化了提纯工艺,产率较高,产品质量较好。
[0035]
本领域技术人员容易理解,菌体本身就是一种天然的酶固定化形式,而且不需要进行破碎处理、甚至提取纯化处理,就可以作为一种酶制剂用于催化反应。由于反应底物和反应产物可以很方便地穿过菌体的生物屏障
‑‑
细胞膜,因此不需要对菌体进行破碎处理,这在经济方面是有利的。
[0036]
另一方面,相比分离出的酶的催化,本发明利用微生物的简单发酵就可以源源不断、取之不尽地提供酶或的供应,无需进一步提取、纯化分离酶等操作,经济效益明显,为工业化应用创造条件。
[0037]
以下结合具体实施例对本发明做进一步详细说明。应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。
[0038]
实施例中涉及到多种物质的添加量、含量及浓度,其中所述的百分含量,除特别说明外,皆指质量百分含量。
[0039]
实施例
[0040]
材料和方法
[0041]
实施例中的全基因合成、引物合成及测序皆由苏州金唯智生物科技有限公司完成。
[0042]
本文中的分子生物学实验包括质粒构建、酶切、感受态细胞制备、转化等主要参照《分子克隆实验指南》(第三版),j.萨姆布鲁克,d.w.拉塞尔(美)编著,黄培堂等译,科学出版社,北京,2002)进行。比如感受态细胞转化方法及感受态制备方法均参照第1章96页进行。必要时可以通过简单试验确定具体实验条件。
[0043]
pcr扩增实验根据质粒或dna模板供应商提供的反应条件或试剂盒说明书进行。必要时可以通过简单试验予以调整。
[0044]
lb培养基:5g/l酵母提取物,10g/l胰蛋白胨,10g/l氯化钠。(lb固体培养基另加20g/l琼脂粉。)
[0045]
tb培养基:24g/l酵母提取物、12g/l胰蛋白胨、16.43g/l k2hpo4.3h2o、2.31g/l kh2po4、5g/l甘油,ph7.0
‑
7.5。(tb固体培养基另加20g/l琼脂粉。)
[0046]
l
‑
哌啶酸的hplc检测条件:
[0047]
检测仪器:安捷伦agilent 1200型高效液相色谱仪(安捷伦sb
‑
aq柱)流动相a:3%磷酸二氢钠(15g到500ml水中)a:b(乙腈)95:5流速0.5ml/min柱温箱30℃检测波长210nm检测时间15min
进样量10μll
‑
哌啶酸保留时间6.324min
[0048]
鸟氨酸环化脱氨酶(ocd)酶活力测定
[0049]
反应体系:50mm l
‑
赖氨酸,150mm、ph7.0磷酸钾缓冲液,0.1%triton x
‑
100,20mm feso4,菌浓10v/v%;
[0050]
反应条件:37℃,150rpm;
[0051]
取样时间:30h。
[0052]
酶活单位定义:在ph7.0、温度37℃的条件下,每小时催化底物l
‑
赖氨酸产生1微摩尔(μmol)l
‑
哌啶酸所需要的酶量定义为1个单位(u)。
[0053]
实施例1:构建表达野生型鸟氨酸环化脱氨酶的重组大肠杆菌
[0054]
对于来源于streptomyces melanosporofaciens的野生型鸟氨酸环化脱氨酶seq id no:1,设计适合大肠杆菌表达的优化密码子序列seq id no:2,委托金唯智进行全基因合成,并在基因两端设计限制性内切酶位点nde i和xhoi,亚克隆到浙江华睿生物技术有限公司构建的psh质粒(含ndei/xhoi位点)中,获得重组质粒psh
‑
ocd。将重组质粒psh
‑
ocd转化表达宿主大肠杆菌bl21(de3),得到表达野生型鸟氨酸环化脱氨酶(ocd)的重组大肠杆菌,简写为ocd。
[0055]
实施例2:易错pcr和随机突变库的构建
[0056]
以碱基序列seq id no:2为模板,设计引物对ocd
‑
nde1
‑
f/ocd
‑
xho1
‑
r,应用易错pcr技术构建随机突变体库。
[0057]
正向引物ocd
‑
nde1
‑
f:5
’‑
atatacatatggaaaccaccgtgc
‑3’
,
[0058]
反向引物ocd
‑
xho1
‑
r:5
’‑
gtcgacttactgaaagctatacggg
‑3’
。
[0059]
50μl易错pcr反应体系包括:50ng质粒模板psh
‑
ocd,5μl的dmso,30pmol一对引物ocd
‑
nde1
‑
f和ocd
‑
xho1
‑
r,1x taq buffer,0.2mm dgtp,0.2mm datp,1mm dctp,1mm dttp,7mm mgcl2,(0mm、0.05mm、0.1mm、0.15mm、0.2mm)mncl2,2.5个单位的taq酶(thermo fisher scientific)。
[0060]
pcr反应条件为:95℃5min;94℃30s,60℃30s,72℃2min/kbp;30个循环;72℃10min。胶回收1kb随机突变片段作为大引物,用kod
‑
plus dna聚合酶做megaprimer pcr:94℃5min,;98℃10s,60℃30s,68℃2min/kbp,25个循环;68℃10min。
[0061]
dpni消化质粒模板,电转化大肠杆菌e.coli bl21(de3),得到超过104个克隆的随机突变库。
[0062]
实施例3:随机突变体库的筛选
[0063]
选取突变体库中的转化子接种到含700μl lb培养基的96孔深孔培养板中,培养基中含100μg/ml卡那霉素,37℃培养6h后,加入终浓度0.1mm iptg后,降温至25℃,培养过夜。5000rpm离心10min,弃上清,加入200μl含50mm tris
‑
hcl(ph7.5),重悬菌体,用于ocd酶活力测定。
[0064]
突变体ocd酶活力测定即l
‑
赖氨酸转化实验方案为:
[0065]
反应体系:400mm l
‑
赖氨酸,150mm、ph7.0磷酸钾缓冲液,0.1%triton x
‑
100,20mm feso4,调ph至7.5,菌浓15v/v%;
[0066]
反应条件:37℃,150rpm,24h;
[0067]
终止条件:90℃,5min。
[0068]
反应终止后,13000rpm离心5min,取上清,进行液相检测。
[0069]
经过筛选,找到两株突变体的酶活力明显高于野生型鸟氨酸环化脱氨酶表达菌株ocd,这两株突变菌株编号分别为ocd
‑
1322和ocd
‑
4500。
[0070]
委托金唯智对突变菌株进行基因组测序比对,菌株ocd
‑
4500基因组中的鸟氨酸环化脱氨酶基因序列为seq id no:4,确认其编码的氨基酸序列为seq id no:3,其为(g69v,g145l)突变体。另一个突变菌株ocd
‑
1322表达的鸟氨酸环化脱氨酶的氨基酸序列为seq id no:5,其为(g69n,v142h)突变体。
[0071]
实施例4:突变酶的验证
[0072]
按照实施例1的方法,构建表达鸟氨酸环化脱氨酶(g69v,g145l)突变体seq id no:3和(g69n,v142h)突变体seq id no:5的质粒psh
‑
ocd
‑
4500和psh
‑
ocd
‑
1322。
[0073]
将含有ocd
‑
1322和ocd
‑
4500基因的质粒psh
‑
ocd
‑
1322和psh
‑
ocd
‑
4500分别转化bl21(de3)感受态细胞中,分别得到重组大肠杆菌ocd
‑
1322和ocd
‑
4500。涂kan 坂培养过夜,挑选10个单菌落,接种到含有lb培养基的试管中,培养过夜,离心收集菌体,抽提质粒,基因测序确定突变正确。
[0074]
按照实施例3的方法测定两个突变菌株ocd
‑
1322和ocd
‑
4500的酶活力,并与菌株ocd进行酶活力对比。结果列于下表。
[0075]
表1:各菌株的ocd酶催化l
‑
赖氨酸转化的催化活力比较
[0076]
菌株ocd突变氨基酸酶氨基酸序列相对活力倍数*ocd
‑
seq id no:11.00ocd
‑
1322g69n,v142hseq id no:56.82ocd
‑
4500g69v,g145lseq id no:312.5
[0077]
*酶比活力:以野生酶的发酵活力(u/ml)与菌体浓度od600(od/ml)的比值为100%。
[0078]
上述实验结果表明,从菌体层面讲,突变体seq id no:3的酶活力比野生酶seq id no:1高出11倍多,另一个突变体seq id no:5也比野生酶高出5倍多,都显示出较高的催化l
‑
赖氨酸环化脱氨反应活性。对突变体seq id no:3进行重点考察。
[0079]
实施例5:制备l
‑
哌啶酸
[0080]
从ocd
‑
4500工程菌种的平板上挑选单克隆,接种到5ml lb培养基中,37℃培养过夜;按1v/v%接种到含有100ml tb培养基的1000ml摇瓶中培养4
‑
6小时,od600达到1.2
‑
1.5,加入0.1mm的iptg诱导,降温到25℃培养10
‑
16小时,离心获得菌体,
‑
80℃冻存24小时备用。
[0081]
反应体系200ml,底物l
‑
赖氨酸50g/l,加酶量分别为10v/v%、15v/v%菌浓,37℃,200rpm,控制ph7.0,反应96h,测定l
‑
哌啶酸生成量,计算产物生成率。结果见下表2。
[0082]
表2:突变体seq id no:3菌株催化l
‑
赖氨酸转化的考察
[0083]
[0084]
以上实验表明,鸟氨酸环化脱氨酶seq id no:1及其突变体seq id no:3和seq id no:5均能够催化l
‑
赖氨酸转化,得到l
‑
哌啶酸,其中突变体seq id no:3催化效率更高,具有开发应用前景。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

