囊封有生物活性成分的空心二氧化硅纳米粒子、其制备方法和应用
1.本技术是申请日为2017年8月21日、申请号为201710718231.x、发明名称为“囊封有生物活性成分的空心二氧化硅纳米粒子、其制备方法和应用”的发明专利申请的分案申请。
2.相关申请的交叉引用
3.本技术涉及且要求2016年8月19日所提交的美国临时申请62/376,920的权益,所述美国临时申请的内容整体并入本文供参考。
技术领域
4.本发明涉及空心二氧化硅纳米粒子,其为装载生物活性成分的药物递送系统。具体地说,本发明涉及包含多层二氧化硅壳体和一或多种囊封于所述壳体内的生物活性成分的二氧化硅纳米粒子,以及其在药物递送中的应用。
背景技术:
5.使用巨分子(如蛋白质或核酸)作为治疗剂的新治疗形式的发展产生研发出将这种巨分子递送到其适当细胞目标的新颖有效方法的需求。已发现纳米粒子技术应用于药理学和药物递送。
6.已经研发出用于大分子递送的纳米载体,包括聚合物、脂质体和无机纳米粒子,如二氧化硅纳米粒子。在各种二氧化硅纳米材料中,空心二氧化硅纳米粒子(hsn)因其独特的物理/化学特性(如大孔隙体积、化学/热稳定性、高装载量、可调控的表面特性和优良的生物兼容性)而被认为具有作为药物递送系统的巨大潜力。不同于常见的实心介孔性二氧化硅纳米粒子(msn),hsn可以囊封较大尺寸的物质(如生物活性成分)且因独特形态(即,多孔薄壳和空心的内部空间)而对所述大物质展现较高的装载量,而这又增强了在催化、生物医学等应用中的功效。hsn的形态和特征在很大程度上取决于合成策略,其因应用而异。
7.硬模板方法(已知是用于合成空心二氧化硅纳米粒子的传统方法)是使用固体和硬质粒子(如聚苯乙烯粒子)作为核心模板,且模板材料相对于二氧化硅来说是异质的。鉴于此,可以通过煅烧、溶剂溶解或其它方式来蚀刻核心模板,以在封闭的二氧化硅壳体内留下空心的空间(李y.(li,y.);施j.(shi,j.),空心结构化介孔材料:化学合成、功能化和应用(hollow
‑
structured mesoporous materials:chemical synthesis,functionalization and applications),先进材料(adv mater)2014,26,3176
‑
3205)。虽然纳米粒子尺寸的均一性、纳米粒子形状和空腔维度可以得到精确的控制,但是这类方法需要多步合成工艺以及繁琐的模板蚀刻程序,这是耗时且/或复杂的。
8.软模板方法也使用蚀刻核壳结构中的核心模板以形成空心二氧化硅纳米粒子的构思,但是核心模板比硬模板方法中所用的模板“更软”。举例来说,软核心模板可以是可挠性液体“粒子”,如胶束、乳液、由二氧化硅异质材料组成的囊泡,或甚至气泡。然而,通常认为这些方法所制备的hsn因所述软模板的可挠性而具有不规则的外观和较宽的粒度分布。
举例来说,如果在二氧化硅壳体结构变硬之前,水包油(o/w)型乳液中的油通过介孔逸出,那么将形成特殊的圆帽样hsn(邹c.
‑
j.(tsou,c.
‑
j.);洪y.(hung,y.);牟c.
‑
y.(mou,c.
‑
y.),壳体厚度和孔隙尺寸分布可调的作为宽范围ph纳米传感器应用的空心介孔性二氧化硅纳米粒子(hollow mesoporous silica nanoparticles with tunable shell thickness and pore size distribution for application as broad
‑
ranging ph nanosensor),微孔和介孔材料(microporous and mesoporous materials)2014,190,181
‑
188)。
9.然而,在模板蚀刻程序之前却不能装载生物活性成分,原因是所述程序有可能毁灭其活性。
10.除上述方法之外,结构差异选择性蚀刻方法为合成空心二氧化硅纳米粒子提供了不同构思。在这类方法中,使用不同的二氧化硅源形成纳米粒子内具有结构差异的二氧化硅纳米粒子,即,所述结构在不同位点展现不同强度,具体地说,内层比外层更脆弱。这种现象发现于一些溶胶
‑
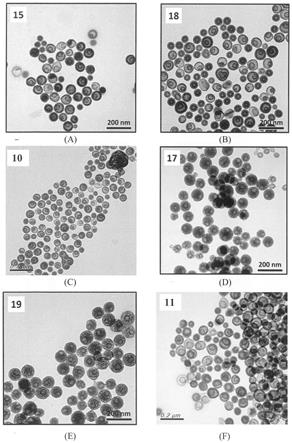
凝胶方法中,包括最通用的史托伯方法(method)。因此,通过选择性地且轻缓地除去纳米粒子中的脆性部分将产生空心的空间。选择性的除去脆性部分相对来说是可控的,尤其是当特殊设计在二氧化硅纳米粒子制造期间提高了结构差异的程度时。
11.张(chang)等人已经公开了一种通过利用微乳液系统中的合成的优点而从头(de novo)将酶囊封于hsn中的方法(用于细胞内生物催化的囊封酶的空心二氧化硅纳米球(enzyme encapsulated hollow silica nanospheres for intracellular biocatalysis),美国化学学会应用材料与界面(acs appl mater interfaces)2014,6,6883
‑
6890;含有酶的空心二氧化硅纳米球的细胞内植入作为蛋白质疗法:超氧化歧化酶和催化酶的级联系统(intracellular implantation of enzymes in hollow silica nanospheres for protein therapy:cascade system of superoxide dismutase and catalase),微小(small)2014,10,4785
‑
4795)。然而,虽然结构差异选择性蚀刻方法可以在某种程度上防止出现使用硬模板或软模板方法所遇到的问题,但是空心二氧化硅纳米粒子的产率非常低(至多约10mg/20ml油)。另外,这些方法所制备的纳米粒子仍有聚集的倾向,这是有待解决的重大问题。
12.因此,仍需要改进的空心二氧化硅纳米粒子作为药物递送系统,以及合成这类空心二氧化硅纳米粒子的有成本效益的简单方法。
技术实现要素:
13.为了克服所属领域中遇到的问题,本技术提供以下解决方案。
14.提供一种二氧化硅纳米粒子,其属于空心二氧化硅纳米粒子(hsn)且尤其可以充当药物递送系统。
15.首先,本发明提供了一种二氧化硅纳米粒子,其包含多层二氧化硅壳体,其中每个壳体具有介孔隙且包围封闭的空心空间,其中最内部的封闭空心空间任选地具有实心二氧化硅核心;以及囊封于所述空间内的一或多种生物活性成分,其中所述生物活性成分的尺寸大于囊封其的壳体的孔隙尺寸,且其中每个空间中的生物活性成分可以相同或不同。
16.其次,本发明还提供了一种制备二氧化硅纳米粒子的方法,包含以下步骤:
17.(a)步骤(a
‑
1)与(a
‑
2)的任一者:
18.(a
‑
1)提供油相、表面活性剂、烷氧基硅烷和/或硅酸盐源、其中任选的含有一或多种生物活性成分的水相和任选的辅助表面活性剂,以形成油包水(w/o)型微乳
19.液;和
20.(a
‑
2)提供油相、表面活性剂、烷氧基硅烷和/或硅酸盐源和任选的辅助表面活
21.性剂,以形成混合物;
22.(b)向(a
‑
1)的w/o微乳液中添加引发试剂,或向(a
‑
2)的混合物添加水性引发试剂、以形成油包水(w/o)型微乳液,接着形成二氧化硅纳米核,所述二氧化硅纳米核与其表面上的生物活性成分键联且/或囊封生物活性成分于其中;
23.(c)提供含有生物活性成分的水相;
24.(d)将烷氧基硅烷和/或硅酸盐源引入,以形成包围(b)的二氧化硅纳米核的另一个二氧化硅层;
25.(e)任选地重复进行步骤(c)和(d)一或多次;
26.(f)实施去稳定化条件以使w/o微乳液去稳定化且收集由微乳液如此形成的所得粒子;以及
27.(g)将步骤(f)中所收集到的粒子分散于水性洗涤相中,以获得二氧化硅纳米粒子;
28.其中步骤(d)和(e)中的烷氧基硅烷和/或硅酸盐源、以及任选地步骤(a)中的烷氧基硅烷和/或硅酸盐源包含至少一种有机烷氧基硅烷,且
29.其中生物活性成分的尺寸大于囊封其的二氧化硅壳体的孔隙尺寸。
30.本技术还提供了通过上述方法所制备的产物。
附图说明
31.图1(a)到1(f)是对照物二氧化硅纳米粒子和本发明二氧化硅纳米粒子的tem影像。
32.图2(a)和2(b)是本发明二氧化硅纳米粒子的氮吸、脱附等温线。
33.图3(a)和3(b)描绘了天冬酰胺酶、peg
‑
天冬酰胺酶和本发明二氧化硅纳米粒子的酶活性测试结果。
34.图4描绘了molt
‑
4白血病细胞系在天冬酰胺酶、对照物二氧化硅纳米粒子和本发明二氧化硅纳米粒子存在下的细胞毒性分析结果。
35.图5(a)和(b)描绘了基于本发明二氧化硅纳米粒子的细胞吸收效率分析(于molt
‑
4细胞中)结果。
36.图6描绘了自由天冬酰胺酶、对照物二氧化硅纳米粒子和本发明二氧化硅纳米粒子诱导molt
‑
4白血病细胞系发生细胞凋亡的能力的测试结果。
37.图7描绘了本发明二氧化硅纳米粒子从小鼠循环系统中清除的结果。
38.图8描绘了ivis荧光成像系统对本发明粒子进行生物分布分析的结果。
具体实施方式
39.为了促进对本文中的公开内容的了解,如本文所用的术语特此定义如下。
40.在本说明书和权利要求书的上下文中,除非另有具体说明,否则单数形式“一(a/an)”和“所述(the)”包括多个所提及的物。除非另有说明,否则本文提供的任何和所有实例或示例性语言(例如“如”)仅用于更好地说明本发明,而非限制本发明的范围。
41.应了解,本说明书中所述的任何数值范围意图包括其中所涵盖的所有子范围。举例来说,“50到70℃”的范围包括所述最小值50℃与所述最大值70℃之间的所有子范围和特定值,包括例如58℃到67℃,和53℃到62℃、60℃或68℃。由于所公开的数值范围是连续的,因此其含有最小值与最大值之间的每一个数值。除非另外说明,否则本说明书中指出的各种数值范围是近似的。
42.在本发明中,术语“约”是指所属领域的技术人员所测量的针对给定值的可接受的偏离,这部分地取决于如何测量或测定所述值。
43.在本发明中,除非具体说明,否则如本文所用的前缀“纳(nano
‑
)”意指约300nm或更小的尺寸。除非具体说明,否则如本文所用的前缀“介(meso
‑
)”不同于iupac提出的定义,意指约5nm或更小的尺寸。
44.在本发明中,如本文所用,术语“硅烷”是指sih4的衍生物。通常,四个氢中的至少一个被如烷基、烷氧基、氨基等如下文所述的取代基置换。如本文所用,术语“烷氧基硅烷”是指具有至少一个直接键结到硅原子的烷氧基取代基的硅烷。如本文所用,术语“有机烷氧基硅烷”是指具有直接键结到硅原子的至少一个烷氧基取代基和至少一个烃基取代基的硅烷。如本文所用,术语“硅酸盐源”是指可以视为正硅酸的盐形式或酯形式的物质,例如正硅酸钠、偏硅酸钠、正硅酸四乙酯(四乙氧基硅烷,teos)、正硅酸四甲酯、正硅酸四丙酯。任选地,烃基取代基可以进一步经杂原子取代或间杂。
45.在本发明中,如本文所用,术语“烃基”是指衍生自烃的单价基团。如本文所用,术语“烃”是指一种仅由碳和氢原子组成的分子。烃实例包括(但不限于)(环)烷烃、(环)烯烃、二烯烃、芳香烃等。当烃基如上文所提及进一步经取代时,取代基可以是卤素、氨基、羟基、硫醇基等。当烃基如上文所提及间杂有杂原子时,所述杂原子可以是s、o或n。在本发明中,烃基优选包含1到30个c原子。
46.在本发明中,术语“烷基”是指饱和的直链或分支链烷基,其优选包含1
‑
30个碳原子且更优选1
‑
20个碳原子。烷基实例包括(但不限于)甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、2
‑
乙基丁基、正戊基、异戊基、1
‑
甲基戊基、1,3
‑
二甲基丁基、正己基、1
‑
甲基己基、正庚基、异庚基、1,1,3,3
‑
四甲基丁基、1
‑
甲基庚基、3
‑
甲基庚基、正辛基、2
‑
乙基己基、1,1,3
‑
三甲基己基、1,1,3,3
‑
四甲基戊基、壬基、癸基、十一烷基、1
‑
甲基十一烷基、十二烷基、1,1,3,3,5,5
‑
六甲基己基、十三烷基、十四烷基、十五烷基、十六烷基、十七烷基、十八烷基或其类似物。
47.在本发明中,如本文所用,术语“烷氧基(alkoxyl)”或“烷氧基(alkoxy)”意指具有式
“‑
o
‑
烷基”的基团,其中“烷基”在所述式中的定义具有如上所述的“烷基”的含义。
48.在本发明中,如本文所用,术语“环烷基”意指含有3到10个环碳原子且更优选3到8个环碳原子的饱和或部分不饱和环状碳基团,所述环状碳基团任选地在环上含有烷基取代基。环烷基实例包括(但不限于)环丙基、环丙烯基、环丁基、环戊基、环己基、2
‑
环己烯
‑1‑
基以及其类似物。
49.在本发明中,术语“卤素”或“卤基”表示氟、氯、溴或碘。
50.在本发明中,如本文所用,术语“氨基”意指式
‑
nr1r2的官能团,其中r1和r2各自独立地表示氢或如上文所定义的烃基。
51.在本发明中,如本文所用,术语“水相”意指与水基本上可混溶的相。水相实例包括(但不限于)水本身、水性缓冲液、二甲亚砜(dmso)水溶液、烷醇水溶液等。可以基于对合成和/或存在于水相中的物质的稳定性的需求来调节水相以便呈酸性、中性或碱性。
52.在本发明中,如本文所用,术语“油相”意指与如上文所提及的水相基本上不混溶的相。油相实例包括(但不限于)经取代或未经取代的液体(环)烷烃,如己烷、癸烷、辛烷、十二烷、环己烷等;经取代或未经取代的芳香族溶剂,如苯、甲苯、二甲苯等。
53.在本发明中,如本文所用,术语“生物活性成分”是指在生物体中具有活性的物质。生物活性成分的实例包括(但不限于)酶、蛋白质药物、抗体、疫苗、抗生素或核苷酸药物。
54.囊封有生物活性成分的空心二氧化硅纳米粒子
55.在一个态样中,本发明提供了一种二氧化硅纳米粒子,其包含:多层二氧化硅壳体,其中每个壳体具有介孔隙且包围封闭的空心空间,最内部的封闭空心空间任选地具有实心二氧化硅核心,所述二氧化硅核心具有介孔隙;以及囊封于所述空间内的一或多种生物活性成分,其中生物活性成分的尺寸大于囊封其的壳体的孔隙尺寸,且其中每个空间中的生物活性成分可以相同或不同。
56.在本发明的二氧化硅纳米粒子的一个实施例中,其具有含有纳米核和至少一个封闭壳体的核壳结构,且纳米核与壳体之间存在着空间。在一个实施例中,纳米核是实心的。在另一个实施例中,纳米核是空心的且由此也可以视为封闭的空心壳体。在一个实施例中,二氧化硅纳米粒子具有一个空心纳米核和一个外壳,即,总共两个封闭壳体。在另一个实施例中,二氧化硅纳米粒子具有一个实心纳米核和一个封闭的外壳。在一个实施例中,二氧化硅纳米粒子具有一个空心核和两个或更多个封闭壳体,即,总共三个或更多个封闭壳体。在另一个实施例中,二氧化硅纳米粒子具有一个实心纳米核和两个或更多个封闭外壳。
57.本发明的空心二氧化硅纳米粒子的粒度是根据封闭的最外层壳体的外径来定义。在一个实施例中,本发明的二氧化硅纳米粒子的粒度范围是约20mm到约500nm,优选约20nm到150nm,更优选小于100nm或小于30nm。
58.在一个实施例中,本发明的二氧化硅纳米粒子的壳体各自独立地具有至少约2nm、至少约3nm或至少约5nm;且至多约15nm、至多约12nm或至多10nm的厚度;或厚度是在前述上限和下限的任何组合所形成的范围内。
59.本发明的空心二氧化硅纳米粒子的纳米核和壳体具有介孔性,且介孔隙具有约5nm或更小、优选3nm或更小、更优选2nm或更小的尺寸。
60.在一个实施例中,每个壳体包围封闭的空心空间,且纳米核与壳体之间或各个壳体之间的距离小于75nm,优选在约2nm到75nm范围内,更优选在约2nm到50nm范围内。
61.在一个实施例中,壳体的外表面和内表面可以独立地是未经修饰或经修饰的。壳体表面的修饰可以从头(de novo)进行或可以是后修饰。修饰的实例可以是(但不限于)亲水性修饰,如聚(乙二醇)(peg)修饰、聚乙烯亚胺(pei)修饰、3
‑
(三羟基硅烷基)丙基甲基膦酸酯(thpmp)修饰、n
‑
(三甲氧基硅烷基丙基)乙二胺三乙酸(edtas)修饰、n
‑
[3
‑
(三甲氧基硅烷基)丙基]乙二胺修饰、n
‑
[3
‑
(三甲氧基硅烷基)丙基]
‑
n,n,n
‑
三甲基铵(ta
‑
三甲氧基硅烷)修饰、(3
‑
巯基丙基)三甲氧基硅烷(mptms)修饰、两性离子型硅烷修饰;特异性修饰,
如生物标记修饰,例如抗体修饰、连接基团修饰、靶向肿瘤的配位体修饰等;或非特异性活性修饰,如壳体表面特性的修饰,例如电荷类型或分布的修饰等。
[0062]
空心二氧化硅纳米粒子包含囊封于空间内的一或多种生物活性成分。在一个实施例中,生物活性成分囊封于每个壳体之间。在一个实施例中,空心二氧化硅纳米粒子具有一个实心纳米核和一个封闭的外壳,且生物活性成分囊封于纳米核与壳体之间。在另一个实施例中,对于纳米核和最外层的壳体来说,生物活性成分可以连接到其表面。在一个实施例中,生物活性成分的尺寸大于介孔隙的尺寸。在其它实施例中,尺寸小于或等于介孔隙的额外治疗剂可以从头(de novo)装载或被动地装载到空心二氧化硅纳米粒子中。
[0063]
在一个实施例中,生物活性成分可以选自具有水溶性的生物活性成分或已进行表面修饰以能够分散或溶解于水相中的生物活性成分。在一个实施例中,生物活性成分是酶、蛋白质药物、抗体、疫苗、抗生素或核苷酸药物。酶的实例包括(但不限于)阿加糖酶(agalsidase)、伊米苷酶(imiglucerase)、他利苷酶(taliglucerase)、维拉苷酶(velaglucerase)、阿糖苷酶(alglucerase)、赛贝利酶(sebelipase)、拉罗尼酶(laronidase)、艾杜硫酶(idursulfase)、埃洛磺酶(elosulfase)、加硫酶(galsulfase)、阿葡糖苷酶(alglucosidase)、天冬酰胺酶(asparaginase)、谷氨酰胺酶(glutaminase)、精氨酸脱亚胺酶(arginine deiminase)、精氨酸酶(arginase)、甲硫氨酸酶(methioninase)、半胱氨酸酶(cysteinase)、高半胱氨酸酶(homocysteinase)、苯丙氨酸羟化酶、苯丙胺酸氨裂解酶、尿酸氧化酶、催化酶、辣根过氧化酶、超氧化歧化酶或谷胱甘肽过氧化酶。
[0064]
其它治疗剂的实例包括(但不限于)小红莓(doxorubicin)、姜黄素(curcumine)、太平洋紫杉醇(paclitaxel)、伊沙匹隆(ixabepilone)、吉西他滨(gemcitabine)、伊立替康(irinotecane)、sn
‑
38、5
‑
fu、道诺霉素(daunorubicin)、多西他赛(docetaxel)等。
[0065]
不受理论束缚,本发明的二氧化硅纳米粒子展现约400m2/g或更小(例如50到200m2/g)的bet表面积,这取决于所囊封的生物活性剂的类型和量、二氧化硅纳米粒子壳体表面上的层的多层的数目以及修饰。
[0066]
本发明的二氧化硅纳米粒子可以通过(但不限于)结构差异选择性蚀刻方法制备。优选的是,本发明的二氧化硅纳米粒子在制备期间不煅烧。鉴于此,本发明的二氧化硅纳米粒子优选在纳米核和封闭壳体的表面内或上具有有机二氧化硅残基,例如有机烷氧基硅烷残基。
[0067]
囊封有生物活性成分的二氧化硅纳米粒子的制备方法
[0068]
本发明还提供一种制备其中囊封生物活性成分的二氧化硅纳米粒子的方法。所述方法包含以下步骤:
[0069]
(a)步骤(a
‑
1)与(a
‑
2)的任一者:
[0070]
(a
‑
1)提供油相、表面活性剂、烷氧基硅烷和/或硅酸盐源、其中任选的含有一或多种生物活性成分的水相和任选的辅助表面活性剂,以形成油包水(w/o)型微乳
[0071]
液;和
[0072]
(a
‑
2)提供油相、表面活性剂、烷氧基硅烷和/或硅酸盐源和任选的辅助表面活
[0073]
性剂,以形成混合物;
[0074]
(b)向(a
‑
1)的w/o微乳液中添加引发试剂,或向(a
‑
2)的混合物添加水性引发试剂、以形成油包水(w/o)型微乳液,接着形成二氧化硅纳米核,所述二氧化硅纳米核与其表
面上的生物活性成分键联且/或囊封生物活性成分于其中;
[0075]
(c)提供含有生物活性成分的水相;
[0076]
(d)将烷氧基硅烷和/或硅酸盐源引入,以形成包围(b)的二氧化硅纳米核的另一个二氧化硅层;
[0077]
(e)任选地重复进行步骤(c)和(d)一或多次;
[0078]
(f)实施去稳定化条件以使w/o微乳液去稳定化且收集由微乳液如此形成的所得粒子;以及
[0079]
(g)将步骤(f)中所收集到的粒子分散于水性洗涤相中,以获得二氧化硅纳米粒子;
[0080]
其中步骤(d)和(e)中的烷氧基硅烷和/或硅酸盐源、以及任选地步骤(a)中的烷氧基硅烷和/或硅酸盐源包含至少一种有机烷氧基硅烷,且
[0081]
其中生物活性成分的尺寸大于囊封其的二氧化硅壳体的孔隙尺寸。
[0082]
在步骤(a
‑
1)中,选择油相、表面活性剂和水相的量,以便在这些物质混合之后形成油包水(w/o)型微乳液。一般来说,为了形成w/o微乳液,油相的量比表面活性剂和水相的量大得多。形成w/o微乳液的方式在所属领域中通常已知,且在本发明中可以使用对生物活性成分的活性无损的方式。油相、水相、生物活性成分、烷氧基硅烷和硅酸盐源的定义和实例已详细地描述如上。
[0083]
用于形成w/o微乳液的表面活性剂在所属领域中是常用且熟知的。本发明优选使用非离子型表面活性剂。非离子型表面活性剂的实例包括(但不限于)聚(氧化乙烯)壬基苯基醚(例如co
‑
520)、聚氧乙二醇脱水山梨糖醇烷基酯、聚乙二醇烷基醚、葡萄糖苷烷基醚、聚乙二醇辛基苯基醚、聚乙二醇烷基苯基醚、甘油烷基酯、聚丙二醇烷基醚、泊洛沙姆(poloxamer)、椰油酰胺单乙醇胺(椰油酰胺mea)、椰油酰胺二乙醇胺(椰油酰胺dea)、月桂基二甲基胺氧化物、聚乙氧基化动物脂胺等。
[0084]
任选地,可以利用辅助表面活性剂促进微乳液的形成或稳定微乳液。辅助表面活性剂的实例包括(但不限于)烷醇类,例如己醇、聚乙二醇400(peg 400)、peg 600等。
[0085]
必要时可以将少量共溶剂引入水相中以达到生物活性成分的良好分散或溶解。共溶剂的实例包括(但不限于)二甲亚砜(dmso)、乙醇、pei、peg、聚赖氨酸、聚精氨酸、精氨酸溶液、谷氨酸盐溶液、精氨酸
‑
谷氨酸盐混合溶液、单醣、双醣、寡醣、多醣、氯化钠、氯化钾、硫酸钠、tris缓冲液、硫酸缓冲液等。
[0086]
在一个实施例中,在步骤(a
‑
1)中,其中任选的含有一或多种生物活性成分的水相是在烷氧基硅烷和/或硅酸盐源之前提供。在另一个实施例中,在步骤(a
‑
1)中,烷氧基硅烷和/或硅酸盐源是在其中任选的含有一或多种生物活性成分的水相之前提供。在又另一个实施例中,在步骤(a
‑
1)中,其中任选的含有一或多种生物活性成分的水相与烷氧基硅烷和/或硅酸盐源同时提供。即,含有一或多种生物活性成分的水相与烷氧基硅烷和/或硅酸盐源在步骤(a)中引入的次序是可交换的或同时的。
[0087]
在另一个实施例中,采用步骤(a
‑
2);亦即,提供油相、表面活性剂、烷氧基硅烷和/或硅酸盐源和任选的辅助表面活性剂,以形成混合物。
[0088]
接着,作为步骤(b),添加引发试剂以引发二氧化硅的形成。在步骤(b)中,引发试剂是一种可以触发二氧化硅形成反应的物质。引发试剂的实例包括(但不限于)酸性物质,
如酸或酸性水溶液,例如盐酸、硫酸等;碱性物质,如碱或碱性水溶液,如氨水、氢氧化钠水溶液;以及离子源,如盐、盐和缓冲剂的溶液,例如氟化钠、磷酸盐缓冲剂等。在一个实施例中,当采用步骤(a
‑
2)时,步骤(b)中所引入之所述引发试剂为水性引发试剂,其不仅触发了w/o型微乳液的形成,也触发了二氧化硅形成反应。反应经引发后,形成二氧化硅纳米核,其中生物活性成分连接到二氧化硅纳米核的表面且/或囊封于二氧化硅纳米核内。
[0089]
在一个实施例中,当步骤(a
‑
1)中所使用的水相不包含生物活性成分时,步骤(b)中所形成的二氧化硅纳米核一开始就不连接到且/或囊封任何生物活性成分。在一个实施例中,当步骤(a
‑
1)中使用含有生物活性成分的水相时,步骤(b)中所形成的二氧化硅纳米核将连接到且/或囊封生物活性成分。
[0090]
在后续的步骤(c)和(d)中,分别引入含有生物活性成分的另一水相和另一烷氧基硅烷和/或硅酸盐源。然后,形成包围二氧化硅纳米核的另一个二氧化硅层,这继而使二氧化硅粒子变成双层。
[0091]
双层二氧化硅粒子形成后,作为步骤(e),可以任选地进一步重复步骤(c)和(d)的操作一或多次,以形成包围现有二氧化硅粒子的一或多个额外的层(例如第三、第四
…
等层)。
[0092]
然后,作为步骤(f),实施使w/o微乳液去稳定化的条件且收集由微乳液如此形成的所得粒子。去稳定化条件的实例包括(但不限于)添加去稳定化剂,如醇、过量表面活性剂等。所收集的粒子可快速的以水、烷醇类(例如c1‑3醇,如乙醇、异丙醇等)或水性烷醇类溶液润洗。
[0093]
最后,作为步骤(g),将步骤(f)中所收集的粒子分散于水性洗涤相中,以获得所要求的二氧化硅纳米粒子。洗涤相可为水、烷醇类(例如c1‑3醇,如乙醇、异丙醇等)或水性烷醇类溶液。
[0094]
通过本发明的方法所制得的奈米核和层在其表面上具有介孔隙。不受理论束缚,可通过使用不同种类的表面活性剂、辅助表面活性剂和/或烷氧基硅烷和/或硅酸盐源来调整介孔隙的尺寸。
[0095]
优选的,本方法中所使用的表面活性剂与辅助表面活性剂的总体积对烷氧基硅烷和/或硅酸盐源的总体机的比例经控制。在一个实施例中,所述比例至少为3.5:1,优选至少为约4.5:1,更优选至少为约5.5:1;或至多为约9.0:1,优选至多为约8.0:1,更优选至多为约7.5:1;或所述比例落于前述任意比例所形成之范围。
[0096]
在一个实施例中,当使用步骤(e)时,即,提供且引入含有生物活性成分的额外水相和烷氧基硅烷和/或硅酸盐源时,可以根据实施者的期望在步骤(g)中来调整壳体的数目。决定壳体数目的因素包括重复进行(c)和(d)的次数、在这些步骤中所用的烷氧基硅烷和/或硅酸盐源的类型、步骤(g)中的洗涤时间、步骤(g)中进行洗涤的温度等。举例来说,当二氧化硅纳米粒子具有双层结构时,需进行步骤(e)至少一次。在一个实施例中,进行步骤(e)一次,而在洗涤后产生仅具有单层的二氧化硅纳米粒子。此外,洗涤的温度和/或时间可基于烷氧基硅烷和/或硅酸盐源对洗涤的耐受性而决定。举例来说,当温度较高时,洗涤的效果可能较为明显,反之亦然。洗涤的温度可例如为至多80℃、至多70℃等,或可为环境温度(20℃、25℃或37℃)。在一个实施例中,洗涤之后,二氧化硅纳米核维持实心,同时形成了包围二氧化硅纳米核的一或多个壳体和封闭的空心空间。在一个实施例中,每一层(包括二
氧化硅纳米核)是包围封闭的空心空间的壳体。
[0097]
在一个实施例中,步骤(a)、(d)和(e)中所用的烷氧基硅烷和/或硅酸盐源各自独立地是相同或不同的。在一个实施例中,烷氧基硅烷和/或硅酸盐源包含四乙氧基硅烷(teos)、四甲氧基硅烷(tmos)、硅酸钠或其混合物。在一个实施例中,有机烷氧基硅烷是2
‑
[甲氧基(聚乙烯氧基)丙基]
‑
三甲氧基硅烷(peg
‑
三甲氧基硅烷)、3
‑
氨基丙基三甲氧基硅烷(aptms)、丙基三乙氧基硅烷、丁基三甲氧基硅烷、辛基三甲氧基硅烷、二苯基二乙氧基硅烷、正辛基三乙氧基硅烷、巯基丙基三甲氧基硅烷、氯甲基三甲氧基硅烷、异丁基三乙氧基硅烷、3
‑
氨基丙基三乙氧基硅烷、乙基三甲氧基苯乙烯硅烷、甲基三乙氧基硅烷、苯基三乙氧基硅烷(pteos)、苯基三甲氧基硅烷(ptmos)、甲基三甲氧基硅烷(mtmos)、乙基三乙酰氧基硅烷(etas)、n
‑
(三甲氧基硅烷基丙基)乙二胺三乙酸(edtas)、(3
‑
三羟基硅烷基)丙基甲基膦酸酯(thpmp)、甲基三乙酰氧基硅烷(mtas)、n
‑
[3
‑
(三甲氧基硅烷基)丙基]乙二胺、三甲氧基硅烷基丙基(聚乙烯亚胺)、氯化n
‑
三甲氧基硅烷基丙基
‑
n,n,n
‑
三甲基铵、(3
‑
巯基丙基)三甲氧基硅烷(mptms)、两性离子型硅烷或其混合物。在一个实施例中,烷氧基硅烷和/或硅酸盐源是teos与aptms的混合物、thpmp、aptms与teos的混合物,或edtas、aptms与teos的混合物。在一个实施例中,步骤(a)中所用的烷氧基硅烷和/或硅酸盐源是thpmp、aptms与teos的混合物;或edtas、aptms与teos的混合物。在一个实施例中,步骤(d)和/或(e)中所用的烷氧基硅烷和/或硅酸盐源是aptms与teos的混合物。
[0098]
本发明还提供通过如上文所述的任一种方法制备的二氧化硅纳米粒子。
[0099]
以下实例是为了本发明所属领域的技术人员更了解本发明而提供,然而不希望限制本发明的范围。
[0100]
实例
[0101]
材料、方法和测试模型
[0102]
经peg修饰的天冬酰胺酶(peg
‑
天冬酰胺酶)
[0103]
如所属领域中所知,天冬酰胺酶(“asnases”)适用于治疗急性成淋巴细胞性白血病(all)患者。因此,天冬酰胺酶用作本发明的生物活性成分的一个实例。为了提高天冬酰胺酶于水相中的溶解度,我们用scm
‑
peg
‑
mptms部分来修饰天冬酰胺酶的表面;所述产物在下文被称作peg
‑
天冬酰胺酶。不受理论束缚,咸信peg
‑
天冬酰胺酶可以与烷氧基硅烷和/或二氧化硅源共结合且这种共结合可以有助于peg
‑
天冬酰胺酶随后的囊封。peg
‑
天冬酰胺酶的制备说明如下:将顺丁烯二酰亚胺
‑
聚(乙二醇)
‑
丁二酰亚胺基酯(mal
‑
peg
‑
scm)(6.4mg)和(3
‑
巯基丙基)三甲氧基硅烷(mptms)(5μl)与天冬酰胺酶(1mg)混合,将混合物溶解于nah2po4缓冲溶液(50mm,ph 7.8)中且在4℃搅拌溶液6小时。然后,通过在4℃下在nah2po4缓冲溶液(50mm,ph 7.8)中渗析2天以多余的试剂来提纯所述产物(peg
‑
天冬酰胺酶)。最后用超滤器浓缩peg
‑
天冬酰胺酶。
[0104]
荧光团标记的天冬酰胺酶
[0105]
在基于荧光的分析中,可以将天冬酰胺酶与荧光团结合;在此,例如异硫氰酸若丹明(ritc)或异硫氰酸荧光素(fitc)。ritc标记的peg
‑
天冬酰胺酶的合成可以通过类似于peg
‑
天冬酰胺酶合成方法的方法来完成,同时将ritc与mal
‑
peg
‑
scm和mptms一起引入,且还可以使其与天冬酰胺酶共价结合。
[0106]
透射电子显微镜(tem)
[0107]
使用透射电子显微镜(tem)评估且直接检查二氧化硅纳米粒子的外观,如每一层的尺寸、壳体的数目和厚度、封闭的空心空间的维度等。通过在75kv加速电压下操作的日立h
‑
7100透射电子显微镜获取tem影像,且将样品分散于乙醇中且声波处理30秒,随后沉积于经碳涂布的铜网上且在空气中干燥。
[0108]
动态光散射(dls)
[0109]
在malvern zetasizer nano zs(malvern,uk)上,利用动态光散射(dls)对不同溶液环境中的二氧化硅纳米粒子进行尺寸测量。二氧化硅纳米粒子的浓度是0.2
‑
0.3mg/ml。分析不同溶液中的(溶剂化)粒度:h2o(ph 6~7)、含有10%胎牛血清(fbs)的杜尔贝科氏改良型伊格尔氏培养基(dulbecco's modified eagle medium,dmem)、含有20%fbs的杜尔贝科氏改良型伊格尔氏培养基(dmem)、含有10%fbs的rpmi培养基1640,以及pbs缓冲溶液(ph 7.4)。
[0110]
用于表征的天冬酰胺酶活性测试
[0111]
利用通过检测氨的奈氏比色法(nesslerization method)(马歇本,l.t.(mashburn,l.t.)和瑞士顿,j.c.(wriston,j.c.),生物化学和生物物理学研究通讯(biochemical and biophysical research communications),1963,12(1),50
‑
55),对天冬酰胺酶活性进行定量评估。具体地说,将天冬酰胺酶或含有天冬酰胺酶的二氧化硅纳米粒子分别离心且分散于200μl的0.05m tris缓冲液(ph 8.6)中,且然后与其受质(即,1.7ml的含有0.01ml
‑
天冬酰胺的0.05m tris缓冲液,ph 8.6;l
‑
天冬酰胺购自pro
‑
spec)一起在37℃下培育10分钟到72小时;在相同条件培育未添加天冬酰胺酶的平行对照组。通过添加100μl的1.5m三氯乙酸(tca)来淬灭反应。然后对样品进行离心,且用7ml的去离子水(18.2mω电阻率)稀释500μl上清液且与1ml的奈斯勒氏试剂(nessler's reagent)(购自默克公司(merck);含有氢氧化钾和四碘合汞酸钾)混合而形成淡黄色的溶液(含有氨)。在室温下培育混合物10分钟,且用光谱仪测量480nm吸亮度。硫酸铵用作标准物以建立校准曲线。1个活性单位(u)的天冬酰胺酶定义为天冬酰胺酶在37℃、ph 8.6下所产生的氨的量(微摩尔/分钟/毫克)。
[0112]
合成实例1
[0113]
peg
‑
hsn的合成
[0114]
实例1a:peg
‑
天冬酰胺酶@peg
‑
hsn 15
[0115]
将20ml癸烷(作为油相)、3.5ml co
‑
520(作为表面活性剂)和1.1ml己醇(作为任选的辅助表面活性剂)混合。然后,将200μl teos和25μl aptms乙醇溶液(来自含有200μl aptms的1.4ml乙醇的储液)(作为烷氧基硅烷和/或二氧化硅源)添加到混合物中且在20℃下搅拌混合物。十五分钟后,将500μl nh4oh(28
‑
30wt.%)(作为引发试剂)逐滴添加到混合物中,以引发二氧化硅烷氧基硅烷和/或二氧化硅源发生水解和形成二氧化硅纳米核。2小时后,向微乳液中缓慢添加700μl h2o(其中含有2385.2μg peg
‑
天冬酰胺酶,作为水相)。再过10分钟后,向微乳液中添加300μl teos和100μl aptms乙醇溶液(作为烷氧基硅烷和/或二氧化硅源)且在20℃下搅拌微乳液12小时以形成包围二氧化硅纳米核的第二个二氧化硅层。然后,添加500μl peg
‑
三甲氧基硅烷和50μlteos两者以修饰二氧化硅纳米粒子的表面。24小时后,使用95%乙醇将微乳液系统去稳定化。通过在15,500rpm下离心25分钟来收集所得粒子且用乙醇快速润洗。然后,将粒子转移到200ml去离子水中,在50℃下洗涤2小时。最
后,形成空心二氧化硅纳米粒子(hsn),通过离心来收集且用乙醇洗涤两次。最后将所述产物(peg
‑
天冬酰胺酶@peg
‑
hsn 15)在99.5%乙醇中分散且储存。peg
‑
天冬酰胺酶囊封于内层与外层之间的空间内。
[0116]
实例1b:利用如上述实例1a中所述的类似程序制备不含天冬酰胺酶的对照组空心二氧化硅纳米粒子(peg
‑
hsn 18),例外为水相中不含有天冬酰胺酶。
[0117]
实例1c:peg
‑
天冬酰胺酶@peg
‑
hsn 10
[0118]
将20ml癸烷(作为油相)、3.5ml co
‑
520(作为表面活性剂)和1.1ml己醇(作为任选的辅助表面活性剂)混合。然后,将350μl含有669.5μg peg
‑
天冬酰胺酶的h2o添加到溶液中(作为含有生物活性成分的水相)。2分钟后,将200μl teos和25μl aptms乙醇溶液(来自含有200μl aptms的1.4ml乙醇的储液)(作为烷氧基硅烷和/或二氧化硅源)添加到微乳液中且在20℃下搅拌微乳液。十五(15)分钟后,将500μl nh4oh(28
‑
30wt.%)(作为引发试剂)逐滴添加到微乳液中,以引发二氧化硅烷氧基硅烷和/或二氧化硅源发生水解和形成二氧化硅纳米核。2小时后,向微乳液中缓慢添加350μl含有669.5μgpeg
‑
天冬酰胺酶的h2o(作为含有生物活性成分的水相)。再过10分钟后,向微乳液中添加300μl teos和100μl aptms乙醇溶液(作为烷氧基硅烷和/或二氧化硅源)且在20℃下搅拌微乳液12小时以形成包围二氧化硅纳米核的第二个二氧化硅层。然后,添加500μl peg
‑
三甲氧基硅烷和50μl teos两者以修饰二氧化硅纳米粒子的表面。24小时后,使用95%乙醇将微乳液系统去稳定化。通过在15,500rpm下离心25分钟来收集所得粒子且用乙醇快速润洗。然后,将粒子转移到200ml去离子水中,在50℃下洗涤2小时。最后,形成空心二氧化硅纳米粒子(hsn),通过离心来收集且用乙醇洗涤两次。最后将所述产物(peg
‑
天冬酰胺酶@peg
‑
hsn 10)分散于99.5%乙醇且储存。peg
‑
天冬酰胺酶囊封于内层中的空间内以及内层与外层之间的空间内。
[0119]
表面经ta
‑
三甲氧基硅烷修饰的peg
‑
hsn的合成
[0120]
实例1d:peg
‑
天冬酰胺酶@peg
‑
hsn 17
[0121]
使用氯化n
‑
[3
‑
(三甲氧基硅烷基)丙基]
‑
三甲基铵制备表面经ta
‑
三甲氧基硅烷修饰的二氧化硅纳米粒子说明如下。将20ml癸烷(作为油相)、3.5ml co
‑
520(作为表面活性剂)和1.1ml己醇(作为任选的辅助表面活性剂)混合。然后,将200μl teos和25μlaptms乙醇溶液(来自含有200μl aptms的1.4ml乙醇的储液)(作为烷氧基硅烷和/或二氧化硅源)添加到混合物中且在20℃下搅拌混合物。十五分钟后,向混合物中逐滴添加500μl nh4oh(28
‑
30wt.%)(作为引发试剂)以引发二氧化硅烷氧基硅烷和/或二氧化硅源发生水解且形成二氧化硅纳米核历时2小时。二氧化硅烷氧基硅烷和/或二氧化硅源水解后,引入100μl氯化n
‑
[3
‑
(三甲氧基硅烷基)丙基]
‑
三甲基铵(ta
‑
三甲氧基硅烷,95%)且搅拌2小时。然后,向微乳液中缓慢添加700μl h2o(其中含有2385.2μg peg
‑
天冬酰胺酶,作为水相)。再过10分钟后,向微乳液中添加300μl teos和100μl aptms乙醇溶液(作为烷氧基硅烷和/或二氧化硅源)且在20℃下搅拌微乳液12小时以形成包围二氧化硅纳米核的第二个二氧化硅层。然后,添加500μl peg
‑
三甲氧基硅烷和50μlteos两者以修饰粒子外表面。24小时后,使用95%乙醇将微乳液系统去稳定化。通过在15,500rpm下离心25分钟来收集粒子且用乙醇快速润洗。然后将粒子转移到200ml去离子水中且在50℃下将其洗涤2小时。最后,形成hsn,通过离心来收集且用乙醇洗涤两次。所述产物(peg
‑
天冬酰胺酶@peg
‑
hsn 17)最后在99.5%乙醇储存。
[0122]
实例1e:利用如上述实例1d中所述的类似程序提供不含天冬酰胺酶的对照组空心二氧化硅纳米粒子(peg
‑
hsn 19),例外为水相中不含天冬酰胺酶。
[0123]
实例1f:peg
‑
天冬酰胺酶@peg
‑
hsn 11
[0124]
使用氯化n
‑
[3
‑
(三甲氧基硅烷基)丙基]
‑
三甲基铵制备表面经ta
‑
三甲氧基硅烷修饰的二氧化硅纳米粒子说明如下。将20ml癸烷(作为油相)、3.5ml co
‑
520(作为表面活性剂)和1.1ml己醇(作为任选的辅助表面活性剂)混合。然后,将350μl含有669.5μgpeg
‑
天冬酰胺酶的h2o添加到混合物中(含有生物活性成分的水相)。2分钟后,将25μl氯化n
‑
[3
‑
(三甲氧基硅烷基)丙基]
‑
三甲基铵(ta
‑
三甲氧基硅烷,95%)引入微乳液中。然后,将200μl teos和25μl aptms乙醇溶液(含有200μl aptms的1.4ml乙醇)(作为烷氧基硅烷和/或二氧化硅源)添加到微乳液中且在20℃下搅拌微乳液。十五分钟后,向微乳液中逐滴添加500μl nh4oh(28
‑
30wt.%)(作为引发试剂)以引发二氧化硅烷氧基硅烷和/或二氧化硅源发生水解且形成二氧化硅纳米核历时2小时。二氧化硅烷氧基硅烷和/或二氧化硅源水解后,引入25μl氯化n
‑
[3
‑
(三甲氧基硅烷基)丙基]
‑
三甲基铵(ta
‑
三甲氧基硅烷,95%)且搅拌2小时。然后,向微乳液中缓慢添加350μl h2o(其中含有669.5μg peg
‑
天冬酰胺酶,作为水相)。再过10分钟后,向微乳液中添加300μl teos和100μl aptms乙醇溶液(作为烷氧基硅烷和/或二氧化硅源)且在20℃下搅拌微乳液12小时以形成包围二氧化硅纳米核的第二个二氧化硅层。然后,添加500μl peg
‑
三甲氧基硅烷和50μl teos两者以修饰粒子外表面。24小时后,使用95%乙醇将微乳液系统去稳定化。通过在15,500rpm下离心25分钟来收集粒子且用乙醇快速润洗。然后将粒子转移到200ml去离子水中且在50℃下将其洗涤2小时。最后,形成hsn,通过离心来收集且用乙醇洗涤两次。所述产物(peg
‑
天冬酰胺酶@peg
‑
hsn 17)最后在99.5%乙醇中储存。peg
‑
天冬酰胺酶囊封于内层中的空间内以及内层与外层之间的空间内。
[0125]
囊封有生物活性成分且具有单层的peg
‑
hsns亦使用不同的洗涤条件而制得。
[0126]
通过这些合成程序获得的产物粒子产量各自是约100mg/20ml油。
[0127]
实例2
[0128]
tem和dls测量
[0129]
对如实例1中合成的空心二氧化硅纳米粒子进行tem测量且结果描绘于图1中。可以观察到成功地制得了双层空心二氧化硅纳米粒子,其中每一层界定封闭的空心空间。粒度和其标准差出示于表1中。
[0130]
表1
[0131][0132]
tem结果表明,peg
‑
天冬酰胺酶@peg
‑
hsn 10、11、15和17具有约60nm到95nm的平均粒子尺寸和较小的粒度标准差,这反映了粒子的均一性和本发明中所公开的制备方法的优势。
[0133]
通过动力学光散射(dls)在不同溶液环境中测量的空心二氧化硅纳米粒子的粒度出示于表2中。
[0134]
表2
[0135][0136]
单位:nm
[0137]
dls结果表明,peg
‑
hsn 18和19以及peg
‑
天冬酰胺酶@peg
‑
hsn 10、11和15在约60nm到约110nm的范围内良好地分散于含有血清的培养基中,这被视为非常适合于细胞吸收。虽然peg
‑
天冬酰胺酶@peg
‑
hsn 17的粒度扩大(可能因表面修饰所致的粒子ζ电位高而引起),但是粒子的尺寸就细胞吸收来说仍然是可接受的。
[0138]
氮吸、脱附等温线和bet表面积
[0139]
图2描绘了peg
‑
天冬酰胺酶@peg
‑
hsn 15和peg
‑
天冬酰胺酶@peg
‑
hsn 17的氮吸、脱附等温线。根据等温线,已揭露peg
‑
天冬酰胺酶@peg
‑
hsn 15和peg
‑
天冬酰胺酶@peg
‑
hsn 17的bet表面积分别是117.40m2/g和120.00m2/g。
[0140]
实例3
[0141]
为了评估二氧化硅纳米粒子的潜在治疗作用,利用上述方法获得自由天冬酰胺酶
和囊封于二氧化硅纳米粒子中的天冬酰胺酶的酶活性。
[0142]
图3(a)描绘了自由天冬酰胺酶和peg
‑
天冬酰胺酶的酶活性结果。观察到自由天冬酰胺酶与经修饰的天冬酰胺酶展现了类似的酶活性,这意味着为了提高水溶性和peg
‑
天冬酰胺酶与二氧化硅源之间结合的概率而进行的天冬酰胺酶表面修饰不会影响天冬酰胺酶活性。
[0143]
图3(b)描绘了peg
‑
天冬酰胺酶、peg
‑
天冬酰胺酶@peg
‑
hsn 15和peg
‑
天冬酰胺酶@peg
‑
hsn 17的酶活性结果。观察到,如根据10分钟或1小时测试所测量,peg
‑
天冬酰胺酶@peg
‑
hsn 15和peg
‑
天冬酰胺酶@peg
‑
hsn 17的酶活性类似。这些结果揭露了囊封于hsn中的天冬酰胺酶的活性未发生显着变化,从而确保了二氧化硅纳米粒子在治疗中、在酶活性表达时的有效性。
[0144]
实例4
[0145]
胰蛋白酶耐受性分析
[0146]
如所属领域中所知,天冬酰胺酶疗法的副作用之一是急性胰脏炎,其导致胰脏释放胰蛋白酶且导致血液中的胰蛋白酶升高。因此,天冬酰胺酶更容易遭受胰蛋白酶降解。为了确定本文所公开的二氧化硅纳米粒子防止其中所囊封的天冬酰胺酶被胰蛋白酶降解的保护作用,对自由天冬酰胺酶或囊封于二氧化硅纳米粒子中的天冬酰胺酶进行胰蛋白酶消化,且通过天冬酰胺酶活性分析来测定天冬酰胺酶的残留活性。因此,进行胰蛋白酶耐受性测试以评估二氧化硅纳米粒子对其中所囊封的天冬酰胺酶的保护作用。
[0147]
将皆含有0.8u天冬酰胺酶的自由天冬酰胺酶和囊封于peg
‑
hsn中的天冬酰胺酶离心且分散于200μl tris缓冲液(0.05m,ph 8.6)中,与胰蛋白酶(1.5u/40μl,于nah2po4缓冲溶液中)混合,且在37℃下进行胰蛋白酶消化2小时。消化后,通过天冬酰胺酶活性分析来测定样品中的天冬酰胺酶活性。
[0148]
对以下群组进行胰蛋白酶耐受性分析:自由天冬酰胺酶、经peg
‑
三甲氧基硅烷修饰的天冬酰胺酶(“peg
‑
天冬酰胺酶”)囊封于无ta修饰的双层peg
‑
hsn中(“peg
‑
天冬酰胺酶@peg
‑
hsn 15”)、经peg
‑
三甲氧基硅烷修饰的天冬酰胺酶囊封于具有ta修饰的双层peg
‑
hsn中(“peg
‑
天冬酰胺酶@peg
‑
hsn 17”),其中所有群组含有0.8u天冬酰胺酶。测定每组相较于对照组(自由天冬酰胺酶,不进行胰蛋白酶消化)的相对天冬酰胺酶活性。结果表明,peg
‑
天冬酰胺酶@peg
‑
hsn 15与17均能够在6小时内达到约100%相对活性。相比之下,自由天冬酰胺酶在消化之后,在8小时内仅能达到10%相对天冬酰胺酶活性。鉴于上文所述,囊封于双层二氧化硅纳米粒子中的天冬酰胺酶对胰蛋白酶消化的耐受性强于自由天冬酰胺酶。结果揭露了本文公开的二氧化硅纳米粒子能够对其中所囊封的蛋白质/酶提供防止蛋白酶降解的优良保护作用。
[0149]
实例5
[0150]
如所属领域中所知,l
‑
天冬酰胺的耗乏使得肿瘤细胞(如急性白血病细胞)中的蛋白质合成受到抑制,由此引起细胞死亡。通过以下实验来测试囊封于二氧化硅纳米粒子中的天冬酰胺酶的细胞毒性:
[0151]
细胞培养
[0152]
molt
‑
4和杰卡特细胞(jurkat cells)(均是人类急性成淋巴细胞性白血病悬浮细胞系,获自生物资源收集和研究中心)、4t1(小鼠乳腺癌细胞系,这个肿瘤是动物iv期人类
乳癌;由另一个实验室赠送获得)和a549(人类肺癌细胞系,由另一个实验室赠送获得)在含有10%胎牛血清(fbs)中的rpmi
‑
1640培养基中培育,获自生物资源收集和研究中心的bxpc
‑
3(人类胰脏癌细胞系)在含有10mm hepes、1mm丙酮酸钠和10%胎牛血清(fbs)的rpmi
‑
1640培养基中、在增湿的5%co2氛围中、在37℃下培育,且所有前述培养基均含有100u/ml青霉素和100μg/ml链霉素。当细胞达到约60
‑
70%汇合时,收获其用于继代培养。
[0153]
细胞毒性分析(利用wst
‑
1分析)
[0154]
在这个实验中,用分别含有0.4、0.4、0.2或1u/ml天冬酰胺酶的自由天冬酰胺酶、peg
‑
天冬酰胺酶@peg
‑
hsn 15和17处理白血病细胞系(molt
‑
4和杰卡特)、乳癌细胞系(4t1)和胰脏细胞系(bxpc
‑
3)。peg
‑
hsn 18和19作为对照组处理(peg
‑
天冬酰胺酶@peg
‑
hsn 15和17的对照组、不含天冬酰胺酶)。具体地说,在24孔盘中按照每孔4
×
105个细胞接种急性白血病细胞(molt
‑
4和杰卡特)且按照每孔2x104个细胞接种4t1细胞系,且用前述群组处理24或72小时。在96孔盘中按照每孔4x103个细胞接种胰脏细胞系(bxpc
‑
3)且用前述群组处理48小时。然后将细胞与wst
‑
1试剂(克隆科技公司(clontech))一起在37℃下培育30分钟,且用微定量盘式读取器(bio
‑
red,型号680)测量450nm吸亮度以检测活细胞产生的黄色甲臜染料。未经任何处理的细胞用作100%细胞存活率对照物。如图4所示,peg
‑
天冬酰胺酶@peg
‑
hsn 15与17均展现了类似于自由天冬酰胺酶的针对molt
‑
4白血病细胞系的优良细胞毒性。结果表明,用二氧化硅纳米粒子囊封天冬酰胺酶对其生物活性不会产生显着影响。另外,由于peg
‑
hsn 18与19均未展现明显的细胞毒性,因此相信peg
‑
天冬酰胺酶@peg
‑
hsn 15和17的细胞毒性仅仅归因于天冬酰胺酶。除molt
‑
4白血病细胞系之外,我们还对杰卡特白血病细胞系、4t1乳癌细胞系和bxpc
‑
3胰脏癌细胞系进行了细胞毒性分析。结果表明,peg
‑
天冬酰胺酶@peg
‑
hsn 15与17均展现了针对这些癌细胞株的细胞毒性。
[0155]
实例6
[0156]
细胞吸收分析
[0157]
通过facs calibur流式细胞术(bd biosciences)来测定molt
‑
4和a549细胞对二氧化硅纳米粒子的细胞吸收效率。与二氧化硅纳米粒子中的天冬酰胺酶共结合的发红光荧光素染料(若丹明
‑
b
‑
异硫氰酸酯;ritc)充当定量测定粒子的细胞吸收效率的标记。molt
‑
4和a549细胞的细胞培养条件与实例5所述相同。具体地说,在6孔盘中每孔接种1
×
106个molt
‑
4细胞或2
×
105个a549细胞且与peg
‑
天冬酰胺酶@peg
‑
hsn 15和17(每毫升粒子0.9mg)一起在含有血清的培养基中培育24小时。然后用pbs洗涤细胞两次,收获,离心且进行流式细胞术分析以检测其荧光信号。根据具有荧光信号的细胞与全部细胞的比率来计算细胞吸收率;平均荧光强度(mfi)是具有荧光信号的细胞的荧光强度的平均值。如图5(a)所示,peg
‑
天冬酰胺酶@peg
‑
hsn 15和17在molt
‑
4白血病细胞系中均展现了良好的细胞吸收效率,且经ta
‑
三甲氧基硅烷修饰的二氧化硅纳米粒子peg
‑
天冬酰胺酶@peg
‑
hsn 17的细胞吸收效率更高。不受理论束缚,通过ta修饰所产生的带更多正电荷的peg
‑
天冬酰胺酶@peg
‑
hsn 17使得二氧化硅纳米粒子更容易被细胞吸收。结果还表明,对二氧化硅纳米粒子进行的不同修饰可以用于调节其特性,如细胞吸收效率。如图5(b)所示,两组的平均荧光强度(mfi)类似。除molt
‑
4白血病细胞系之外,还证实peg
‑
天冬酰胺酶@peg
‑
hsn 15和17能够被a549肺癌细胞系(实体肿瘤细胞系)吸收。
[0158]
实例7
[0159]
细胞凋亡分析
[0160]
为了研究天冬酰胺酶疗法对细胞凋亡程度的影响,在6孔盘中接种1
×
106个molt
‑
4细胞(molt
‑
4的细胞培养条件与实例2所述相同)且在含有血清的培养基中、在37℃下用自由天冬酰胺酶、含有0.4u/ml天冬酰胺酶的peg
‑
天冬酰胺酶@peg
‑
hsn 15和17以及peg
‑
hsn 18和19(peg
‑
天冬酰胺酶@peg
‑
hsn 15和17对照组,不囊封天冬酰胺酶)处理24小时。通过离心(400g,10分钟,4℃)收获细胞,用pbs洗涤,用4'6
‑
二甲脒基
‑2‑
苯基吲哚二盐酸盐(dapi;1μg/ml)染色10分钟,用pbs再次洗涤,且再悬浮于6孔盘中的1ml pbs中。在倒置式荧光显微镜(奥林巴斯(olympus),放大率40x,汞灯用于uv激发)下观察细胞的核形态变化和细胞凋亡主体(dna片段化所产生)。如图6所示,用自由天冬酰胺酶(d))和peg
‑
天冬酰胺酶@peg
‑
hsn 15和17(e)和f))处理的molt
‑
4细胞展现了细胞凋亡迹象。结果表明,囊封于中本文所公开的二氧化硅纳米粒子中的天冬酰胺酶展现了类似于自由天冬酰胺酶的诱导细胞凋亡的功效。
[0161]
实例8
[0162]
二氧化硅纳米粒子从循环系统中的清除
[0163]
使用peg
‑
天冬酰胺酶@peg
‑
hsn(具有与天冬酰胺酶共结合的ritc)研究其从小鼠循环系统中清除的速率。具体地说,将peg
‑
天冬酰胺酶@peg
‑
hsn 15和17(于pbs中,30mg/ml剂量)静脉内注射到具有4t1肿瘤的balb/c裸小鼠(8周龄)中。在双光子显微镜下观察小鼠耳朵中的血管,且在注射后的10、30、60和120分钟获取实时影像。如图7中所示,peg
‑
天冬酰胺酶@peg
‑
hsn 15的信号衰减非常缓慢(甚至在注射后120分钟后,仍然可以检测到信号)(图7、上行);相比之下,peg
‑
天冬酰胺酶@peg
‑
hsn 17的荧光信号在相同的时间点则弱得多(图7、下行)。循环时间越长,表明在血液中的半衰期越长。结果表明,带更多正电荷的peg
‑
天冬酰胺酶@peg
‑
hsn 17(具有ta
‑
三甲氧基硅烷修饰)更容易从血液中被清除。可以推断出,可以利用修饰(如ta修饰)调节二氧化硅纳米粒子在血液中的半衰期。另外,尽管在血液中的循环时间不同,但是peg
‑
天冬酰胺酶@peg
‑
hsn 15和17在血液中良好分散且不形成明显的聚集物,这表明二氧化硅纳米粒子具有良好的活体内稳定性。
[0164]
实例9
[0165]
生物分布分析
[0166]
将peg
‑
天冬酰胺酶@peg
‑
hsn 15和17(于pbs中,30mg/ml剂量)静脉内注射到具有肿瘤的balb/c裸小鼠(9周龄)中。在ivis荧光成像系统(lumina)下观察二氧化硅纳米粒子在主要器官(包括心脏、肺、脾、肝脏和肾脏)、肿瘤、尿液和血液中的生物分布。如图8所示,在注射24小时后,peg
‑
天冬酰胺酶@peg
‑
hsn 15(上行)和17(下行)主要分别滞留于肿瘤和肝脏、以及肝脏中;两种纳米粒子均可以在肾脏中发现到;在尿液和血液中未观察到显着的信号。结果表明,peg
‑
天冬酰胺酶@peg
‑
hsn 15可以更容易地滞留于肿瘤组织中且提供了将生物活性成分递送到肿瘤的有效方式;结果还表明,peg
‑
天冬酰胺酶@peg
‑
hsn 15使纳米粒子呈现出优良的强化渗透性和滞留(epr)作用,以使其在肿瘤中积累。相信peg
‑
天冬酰胺酶@peg
‑
hsn 17在肿瘤中的积累少是因其从循环系统中快速清除所致。结果表明,可以利用修饰(如ta修饰)调节二氧化硅纳米粒子的生物分布特征。
[0167]
本发明所属领域的技术人员应该了解,可以对本发明的教示和公开内容进行变更和润饰,而这些变更和润饰不脱离本发明的精神和范围。根据上述内容,本技术希望涵盖其
任何变更和润饰,条件是所述变更或润饰属于如所附权利要求书或其等效物所限定的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

