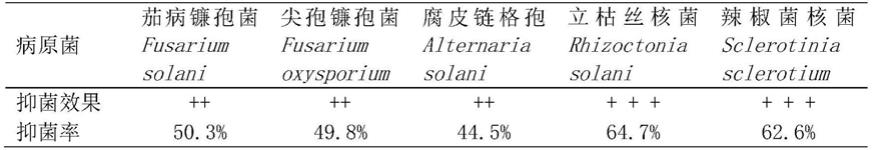
1.本发明属于紫外光固化领域,具体涉及一种菲并咪唑衍生物及其制备方法和应用。
背景技术:
2.紫外(uv)光固化技术是涂料、油墨、粘合剂等领域中的一种环境友好型绿色技术,与传统的含溶剂体系比,uv光固化技术具有无溶剂排放、效率高、节能等突出特点。uv光固化的主体材料一般由低聚物、单体和光引发剂组成,在足够紫外光作用下全部固化,随着uv光固化材料应用越来越广泛,出现一些光引发剂迁移的问题。而通过引入大分子量基团可有效降低光引发剂的迁移性问题,使引发剂达到残留小、无迁移问题。如肟酯类光引发剂oex
‑
2是近年来研究较多的一类uv光引发剂。又如中国专利cn106349213a公开了一种自供氢型光引发剂及其制备方法,其中该光引发剂引入了光敏基团,既可以提高引发剂的光敏感性,增强引发剂的吸光能力,导致引发剂吸收光谱发生明显的红移,又可以提高引发剂的热稳定性。
3.设计合成新型含光敏基团的光引发剂成为近年来光固化技术领域研究的热点之一。
技术实现要素:
4.本发明的目的在于,提供一种菲并咪唑衍生物,可以用作光引发剂。本发明以含三氟甲基苯基的菲并咪唑基团为电子受体,借助特定的电子给体基团r的性质,合成出系列d
‑
π
‑
a结构的含有吸光光敏基团的菲并咪唑衍生物,可以作为光引发剂,用于紫外光固化体系或3d打印技术领域中。本发明的菲并咪唑衍生物具有一定的共轭链长度,可以增大其光子吸收截面,作为紫外光固化体系的光引发剂,在365nm波长引发聚合反应,具有较高的聚合效率。
5.本发明的另一目的在于,提供上述菲并咪唑衍生物的制备方法。
6.本发明的另一目的在于,提供上述菲并咪唑衍生物在制备紫外光固化引发剂中的应用。
7.为解决上述技术问题,本发明采用如下技术方案:
8.一种菲并咪唑衍生物,具有如式(i)所示的结构式:
[0009][0010]
式(i)中,r为电子给体基团,r选自苯并五元不饱和杂环类基团、取代或非取代的
二苯并五元环类基团、取代或非取代的二苯并五元杂环类基团、至少两个二元苯并五元杂环通过二元苯并五元杂环中苯环上的碳原子与二元苯并五元杂环中的杂原子相连形成的基团且二元苯并五元杂环是取代或非取代的、至少两个二元苯并五元杂环通过二元苯并五元杂环上的杂原子连接在同一个苯环上形成的基团、杂蒽类基团、六元杂环碳原子上经甲基单取代或多取代的杂蒽类基团、两个杂蒽通过杂蒽中六元环上碳原子相连的基团或取代的苯胺类基团;
[0011]
其中,上述基团中的杂原子独立地选自s、o、n中的一种或几种的组合;取代的基团独立地选自甲基、苯基、甲氧基、甲氧苯基或叔丁基苯基。
[0012]
需要说明的是,上述取代,可以是单取代或多取代,理论上,可发生取代的位点均可以进行取代;取代基团的数量优选为1~4。
[0013]
上述基团中,电子给体基团r可通过杂原子或碳原子与电子受体进行结合。
[0014]
现有已知的菲并咪唑衍生物通常用在制药领域,或作为发光材料(尤其蓝光材料)应用在电子产品中。
[0015]
本发明人创造性地发现,菲并咪唑(结构式为)c2及n1这两个位点的取代修饰会对材料的性能产生重要的影响,特别是c2位上的修饰基团对整个分子的共轭长度会产生重要的影响,决定着衍生物的吸光/发光性能,例如在c2位上修饰苯基并连接特定的电子给体基团,借助特定的电子给体基团r的性质,可以增大化合物的光子吸收截面,提高吸光范围;并且以含三氟甲基苯基的菲并咪唑衍生物为电子受体,制备得到具有d
‑
π
‑
a(电子给体
‑
π
‑
电子受体,doner
‑
π
‑
accepter)结构的菲并咪唑衍生物,电子受体中的三氟甲基具有一定的抗氧与增溶作用,增强聚合效果。该菲并咪唑衍生物与碘鎓盐一起作用,在365nm波长引发聚合反应,具有较高的聚合效率。
[0016]
优选地,所述苯并五元不饱和杂环类基团为
[0017]
优选地,所述取代或非取代的二苯并五元环类基团为
[0018]
优选地,所述取代或非取代的二苯并五元杂环类基团为优选地,所述取代或非取代的二苯并五元杂环类基团为其中,r
′
独立地选自h或t
‑
bu。
[0019]
优选地,所述至少两个二元苯并五元杂环通过二元苯并五元杂环中苯环上的碳原子与二元苯并五元杂环中的杂原子相连形成的基团为成的基团为其中r
′
独立地选自h或t
‑
bu。
[0020]
优选地,所述
[0021]
至少两个二元苯并五元杂环通过二元苯并五元杂环上的杂原子连接在同一个苯环上形成的基团为
[0022]
优选地,所述杂蒽类基团为
[0023]
优选地,所述六元杂环碳原子上经甲基单取代或多取代的杂蒽类基团为
[0024]
优选地,所述两个杂蒽通过杂蒽中六元环上碳原子相连的基团为
[0025]
优选地,所述取代的苯胺类基团为优选地,所述取代的苯胺类基团为其中,r
′
独立地选自h或t
‑
bu。
[0026]
优选地,所述菲并咪唑衍生物具有如下结构式:
[0027]
[0028]
[0029]
[0030][0031]
进一步优选地,所述菲并咪唑衍生物具有如下结构式:
[0032]
[0033][0034]
所述菲并咪唑衍生物的制备方法,包括如下步骤:
[0035]
s1.将9,10
‑
菲醌、4
‑
三氟甲基苯胺、4
‑
溴苯甲醛与催化剂溶于有机溶剂中,在110~120℃下反应,得到具有式(ii)所示结构的中间产物,
[0036][0037]
s2.将s1.得到的中间产物、含有上述电子给体基团r的化合物、催化剂溶于有机溶剂中,在70~190℃下化合物中的电子给体基团r取代s1.得到的中间产物中的溴原子,得到具有如式(i)所示结构的菲并咪唑衍生物。
[0038]
优选地,s1.中9,10
‑
菲醌、4
‑
三氟甲基苯胺、4
‑
溴苯甲醛、乙酸铵的摩尔比为1~1.2:1~1.2:1~1.2:1~10。
[0039]
进一步优选地,s1.中9,10
‑
菲醌、4
‑
三氟甲基苯胺、4
‑
溴苯甲醛、乙酸铵的摩尔比为1:1:1:6。
[0040]
优选地,s1.中所述催化剂为乙酸铵。
[0041]
优选地,s1.中所述机溶剂为乙酸。
[0042]
优选地,s1.中所述反应在惰性气氛中进行。
[0043]
进一步优选地,s1.中所述惰性气氛为氮气、氦气或氩气中的一种或几种组成的气氛。
[0044]
优选地,s1.中所述反应的温度为120℃。
[0045]
优选地,s1.中所述反应的时间为6~8h。
[0046]
优选地,s1.中反应结束后,还包括后处理,所述后处理依次为萃取
→
减压蒸馏
→
分离纯化。
[0047]
优选地,s2.中所述含有上述电子给体基团r的化合物中,r可以与硼酸基团或氢原子相连。
[0048]
优选地,s2.中所述催化剂为碱性盐或四三苯基膦钯中的一种或两种的组合。
[0049]
进一步优选地,所述碱性盐为碳酸钾或叔丁醇钾中的一种或两种的组合。
[0050]
优选地,s2.中所述中间产物、碱性盐、含有上述电子给体基团r的化合物中的电子
给体基团的摩尔比为1:1.5:(1~1.2)。
[0051]
优选地,s2.中所述有机溶剂为四氢呋喃、邻二氯苯或甲苯中的任意一种。
[0052]
优选地,当s2.中所述有机溶剂为四氢呋喃时,s2.中反应的温度为70~75℃;当s2.中所述有机溶剂为邻二氯苯时,s2.中反应的温度为180~190℃;当s2.中所述有机溶剂为甲苯时,s2.中反应的温度为110~120℃。
[0053]
优选地,s2.中所述反应的时间为10~16h。
[0054]
优选地,s2.中反应结束后,还包括后处理,所述后处理依次为萃取、减压蒸馏、分离纯化。
[0055]
优选地,所述萃取剂为二氯甲烷或饱或饱和食盐水中的一种或两种。
[0056]
优选地,所述分离纯化选用硅胶柱色谱层析法。
[0057]
上述菲并咪唑衍生物在制备紫外光固化引发剂中的应用也在本发明的保护范围之内。
[0058]
与现有技术相比,本发明的有益效果是:
[0059]
本发明以含三氟甲基苯基的菲并咪唑基团为电子受体,借助特定的电子给体基团r的性质,合成出系列d
‑
π
‑
a结构的含有吸光光敏基团的菲并咪唑衍生物,可以作为光引发剂,用于紫外光固化体系或3d打印技术领域中。本发明的菲并咪唑衍生物具有一定的共轭链长度,可以增大其光子吸收截面,作为紫外光固化体系的光引发剂,在365nm波长下引发聚合反应,具有较高的聚合效率,50s内菲并咪唑衍生物的双键转化率高达88.34%。
附图说明
[0060]
图1为实施例1制备的菲并咪唑衍生物a1的1hmnr图;
[0061]
图2为实施例1制备的菲并咪唑衍生物a1的质谱图;
[0062]
图3为实施例2制备的菲并咪唑衍生物a4的1hmnr图;
[0063]
图4为实施例2制备的菲并咪唑衍生物a4的质谱图;
[0064]
图5为实施例3制备的菲并咪唑衍生物a21的1hmnr图;
[0065]
图6为实施例3制备的菲并咪唑衍生物a21的质谱图;
[0066]
图7为实施例4制备的菲并咪唑衍生物a39的质谱图;
[0067]
图8为实施例5制备的菲并咪唑衍生物a23的质谱图;
[0068]
图9为实施例6制备的菲并咪唑衍生物a26的质谱图;
[0069]
图10为实施例制备的菲并咪唑衍生物a1、a4、a21、a23、a26、a39在二氯甲烷溶液中紫外的吸收图;
[0070]
图11为实施例制备的菲并咪唑衍生物a1、a4、a21、a23、a26、a39作为光引发剂与碘鎓盐共作用的双键转换率图。
具体实施方式
[0071]
以下结合具体实施例和附图来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。除非特别说明,本发明所用试剂和材料均为市购。
[0072]
实施例1
[0073]
本实施例提供一种菲并咪唑衍生物,结构式如a1所示:
[0074][0075]
该化合物的反应方程式及制备方法如下:
[0076][0077]
s1.将9,10
‑
菲醌(2.08g,10mmol)、4
‑
三氟甲基苯胺(1.61g,10mmol)、4
‑
溴苯甲醛(1.83g,10mmol)、乙酸铵(462mg,60mmol)依次加入250ml圆底烧瓶,并溶于乙酸溶剂;在氮气保护的条件下,将上述反应物加热至120℃并反应8h;待反应结束后,将反应液冷却至室温,用二氯甲烷和饱和食盐水(体积比为1:1)萃取反应液3次,取有机相,减压蒸馏得到粗产物;再通过硅胶柱色谱层析法,以二氯甲烷/石油醚为洗脱剂,进行分离纯化,得到含三氟甲基苯基的菲并咪唑衍生物(产率为77.27mol%);
[0078][0079]
s2.将s1所得产物含三氟甲基苯基的菲并咪唑衍生物(517mg,1mmol)、二苯并[b,d]呋喃
‑2‑
硼酸(212mg,1mmol)、碳酸钾(210mg,1.5mmol)、四三苯基膦钯(23mg,0.02mmol)依次加入250ml圆底烧瓶,并溶于四氢呋喃和水组成的混合溶剂;在氮气保护的条件下,将上述反应物加热至120℃并反应12h;待反应结束后,将反应液冷却至室温,用二氯甲烷和饱和食盐水萃取三次;取有机相,减压蒸馏后得到粗产物;再通过硅胶柱色谱层析法,以二氯甲烷/石油醚为洗脱剂,进行分离纯化,得到菲并咪唑衍生物a1,产率为91.2mol%。
[0080]
对制备得到的菲并咪唑衍生物a1的化学结构进行测定:
[0081]
使用布鲁克400mhz超导核磁共振仪,溶剂为氘代氯仿,进行结构式测定,测定得到的氢谱如图1所示,特征波数(ppm)为1h nmr(400mhz,chloroform
‑
d)δ8.92(d,j=7.9hz,1h),8.78(d,j=8.4hz,1h),8.71(d,j=8.3hz,1h),8.01
–
7.86(m,6h),7.72(ddd,j=26.1,11.6,5.9hz,6h),7.59
–
7.29(m,7h),7.13(d,j=8.3hz,1h).,可以看出,分子氢谱波峰能与
目标产物一一对应;
[0082]
质谱检测:将实施例1制得的菲并咪唑衍生物a1溶于二氯甲烷,配成浓度为1mg/ml的溶液,采用液质联用仪lcms
‑
2020,进行质谱测试,测试结果如图2所示,从图中可以得出菲并咪唑衍生物a1的相对分子质量为650.12,减去一个h,与所合成的a1的相对分子质量一致。
[0083]
紫外吸收光谱检测:使用岛津紫外可见分光光度计uv
‑
2700,扫描范围是250~700nm;将实施例制备得到的a1与碘鎓盐(具体为c
12
h
10
f6ip)共作用下作为新型光引发剂,在365nm波长uv光源(光照强度为30mw/cm2)下引发引发单体三羟甲基丙烷三丙烯酸的聚合反应(a1用量为单体的1wt%;碘鎓盐用量为单体的1.5wt%)。结果(见图10和11)表明:50s内a1的双键转化率为88.34%(通过实时红外计算双键对应的峰面积变化得到),是传统商用引发剂叔胺(叔胺/碘鎓盐用量分别为单体的1wt%、1.5wt%,相同条件下,双键的转化率为32%)的2.765倍。
[0084]
实施例2
[0085]
本实施例提供一种菲并咪唑衍生物,结构式如a4所示:
[0086][0087]
该化合物的制备方法与实施例1的不同之处在于,将s2.中二苯并[b,d]呋喃
‑2‑
硼酸(212mg,1mmol)替换为2
‑
硼酸二苯并噻吩(228mg,1mmol),最终制备得到菲并咪唑衍生物a4,产率为81.82mol%。
[0088]
其中a4的核磁氢谱的特征波数(ppm)(见图3)为1h nmr1h nmr(400mhz,chloroform
‑
d)δ8.90(dd,j=7.9,1.4hz,1h),8.76(d,j=8.4hz,1h),8.69(d,j=8.3hz,1h),8.30(d,j=1.8hz,1h),8.19(dt,j=7.3,3.6hz,1h),7.92
–
7.83(m,4h),7.76(t,j=7.3hz,1h),7.70
–
7.58(m,8h),7.54
–
7.44(m,3h),7.31
–
7.26(m,1h),7.13
–
7.07(m,1h);a4的质谱(图4)分析得到相对分子量为621.09;紫外光吸收检测(具体条件同实施例1,见图10),结果(见图11)表明50s内a4的双键转化率为65.35%,是传统商用引发剂叔胺/碘鎓盐的2.05倍。
[0089]
实施例3
[0090]
本实施例提供一种菲并咪唑衍生物,结构式如a21所示:
[0091][0092]
该化合物的制备方法与实施例1的不同之处在于,将s2.中二苯并[b,d]呋喃
‑2‑
硼酸(212mg,1mmol)替换为4
‑
硼酸三苯胺(289mg,1mmol),最终制备得到菲并咪唑衍生物a21,产率为76.42mol%。
[0093]
其中a21的核磁氢谱的特征波数(ppm)(见图5)为1h nmr(400mhz,chloroform
‑
d)δ8.92(d,j=7.9hz,1h),8.79(d,j=8.4hz,1h),8.72(d,j=8.3hz,1h),7.89(d,j=8.1hz,2h),7.78
–
7.74(m,1h),7.71
–
7.66(m,3h),7.56
–
7.51(m,5h),7.49
–
7.45(m,2h),7.35
–
7.27(m,4h),7.13(dtd,j=9.2,4.8,4.1,2.1hz,8h),7.04(tt,j=7.1,1.2hz,2h);a21的质谱(图6)分析得到相对分子量为682.19;紫外光吸收检测(具体条件同实施例1,见图10),结果(见图11)表明50s内a21的双键转化率为60.47%,是传统商用引发剂叔胺/碘鎓盐的1.89倍。
[0094]
实施例4
[0095]
本实施例提供一种菲并咪唑衍生物,结构式如a39所示:
[0096][0097]
该化合物的制备方法与实施例1的不同之处在于,将s2.中二苯并[b,d]呋喃
‑2‑
硼酸(212mg,1mmol)替换为3,6
‑
叔丁基咔唑(279mg,1mmol),最终制备得到菲并咪唑衍生物a39,产率为22.37mol%。
[0098]
其中a39的核磁氢谱的特征波数(ppm)为:1h nmr(400mhz,chloroform
‑
d)δ9.08(s,1h),8.15(d,j=2.0hz,2h),7.98(d,j=8.8hz,1h),7.78(qq,j=15.5,7.6,6.4hz,4h),7.58(dd,j=8.5,4.3hz,2h),7.49(d,j=9.0hz,1h),7.39
–
7.32(m,1h),7.31
–
7.27(m,11h),7.26(s,1h),7.18(d,j=8.7hz,1h),7.12(s,1h),5.34
–
5.29(m,4h),1.36(s,1h),1.31(d,j=1.3hz,1h),1.28(s,13h),0.93
–
0.86(m,1h);a39的质谱(图7)分析得到相对分
子量为716.26;
[0099]
紫外光吸收检测(具体条件同实施例1,见图10),结果(见图11)表明50s内a39的双键转化率为64.8%,是传统商用引发剂叔胺/碘鎓盐的2.025倍。
[0100]
实施例5
[0101]
本实施例提供一种菲并咪唑衍生物,结构式如a23所示:
[0102][0103]
该化合物的制备方法与实施例1的不同之处在于,将s2.中二苯并[b,d]呋喃
‑2‑
硼酸(212mg,1mmol)替换为二苯胺(169mg,1mmol),最终制备得到菲并咪唑衍生物a23,产率为32.36mol%。
[0104]
其中a23的核磁氢谱的特征波数(ppm)为:1h nmr(400mhz,chloroform
‑
d)δ8.80(d,j=8.5hz,1h),8.71(d,j=8.3hz,1h),7.91(t,j=9.0hz,2h),7.80
–
7.65(m,4h),7.57(t,j=7.6hz,1h),7.44(dt,j=14.0,7.1hz,2h),7.30(d,j=8.0hz,4h),7.08(dd,j=18.8,9.1hz,5h),6.94(d,j=8.6hz,2h);a23的质谱(图8)分析得到相对分子量为606.19;
[0105]
紫外光吸收检测(具体条件同实施例1,见图10),结果(见图11)表明50s内a23的双键转化率为57.18%,是传统商用引发剂叔胺/碘鎓盐的1.78倍。
[0106]
实施例6
[0107]
本实施例提供一种菲并咪唑衍生物,结构式如a26所示:
[0108][0109]
该化合物的制备方法与实施例1的不同之处在于,将s2.中二苯并[b,d]呋喃
‑2‑
硼酸(212mg,1mmol)替换为吩噁嗪(183mg,1mmol),最终制备得到菲并咪唑衍生物a26,产率为
67.2mol%。
[0110]
其中a26的核磁氢谱的特征波数(ppm)为:1h nmr(400mhz,chloroform
‑
d)δ8.93(s,1h),8.81(d,j=8.4hz,1h),8.74(d,j=8.3hz,1h),7.93(d,j=8.2hz,2h),7.82
–
7.67(m,6h),7.58(ddd,j=8.4,7.0,1.3hz,1h),7.38
–
7.28(m,3h),7.15(dd,j=8.4,1.3hz,1h),6.74
–
6.52(m,6h),5.90(s,2h);a26的质谱(图9)分析得到相对分子量为620.17;
[0111]
紫外光吸收检测(具体条件同实施例1,见图10),结果(见图11)表明50s内a23的双键转化率为41.42%,是传统商用引发剂叔胺/碘鎓盐的1.29倍。
[0112]
以上所述的具体实施方式,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施方式而已,并不用于限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。