1.本技术涉及生物发酵技术领域,具体涉及一种燕麦发酵提取物制备过程的精确控制方法,以及该方法制备获得的燕麦发酵提取物。
背景技术:
2.燕麦是禾本科草本植物,是我国重要的农作物之一。研究表明,燕麦具有良好的生物活性和药用价值,可用于食品、饲料、医药、化妆品和工业原料等方面。
3.作为一种功能性配料,燕麦中具有多种功能成分,例如蛋白质、不饱和脂类、维生素、多酚、生物碱、皂苷类等,还含有大量的抗氧化物,主要有谷胱甘肽、多酚类物质、植酸甾醇和维生素等。此外,燕麦中还含有大量的β
‑
葡聚糖,β
‑
葡聚糖具有抗老祛皱、促进角质层再生、伤口愈合、疤痕淡化、抗敏消炎等作用,目前是化妆品中常用的保湿成分之一。
4.然而,燕麦中所含有的上述活性物质广泛存在于种子颗粒中,并与淀粉和大分子蛋白等融合在一起,单纯的水提取效果非常差,尤其是其中的大分子淀粉和蛋白质的存在,降低了燕麦提取物作为化妆品原料的稳定性,并具有潜在的致敏性。
5.现有技术中为了更好的提取燕麦中的活性物质,通常采用酶解处理的方法,例如加入淀粉酶、蛋白酶等,但酶解后得到的提取物中分解得到的糊精和淀粉糖类物质难于分离出来,影响应用性能。申请人的在先申请提供了一种通过用菌发酵的方式提取燕麦提取物的方法,但通过该方法获得的燕麦提取物中各种活性成分的含量仍有待提高。
技术实现要素:
6.为了解决上述问题,本技术旨在提供一种燕麦发酵提取物制备过程的精确控制方法,以在好氧发酵过程中进行精确的阶段性氧消耗速率水平优化。
7.一方面,本技术提供了一种燕麦发酵提取物制备过程的精确控制方法,所述方法包括:
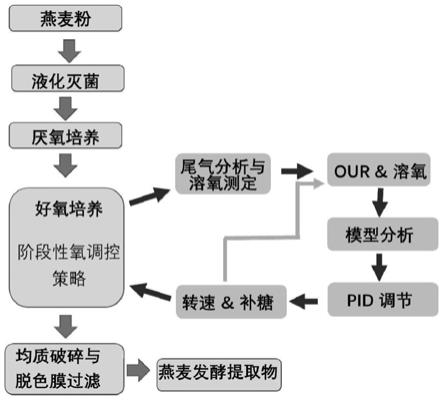
8.以燕麦为发酵底物,先接种厌氧菌进行厌氧发酵,获得发酵液,再向所述发酵液中接种好氧菌进行好氧发酵,获得所述燕麦发酵提取物;
9.控制好氧发酵过程中溶氧不低于45%,并通过控制氧消耗速率控制所述好氧发酵的过程,具体包括:
10.在好氧发酵的第一阶段控制氧消耗速率为30
±
2.1mmol/l/h,
11.在好氧发酵的第二阶段控制氧消耗速率为45
±
2.2mmol/l/h,
12.在好氧发酵的第三阶段控制氧消耗速率为55
±
2.5mmol/l/h。
13.进一步地,所述第一阶段为好氧发酵开始后的第0
‑
16h,
14.所述第二阶段为好氧发酵开始后的第17
‑
32h,
15.所述第三阶段为好氧发酵开始后的第33
‑
48h。
16.进一步地,通过调整转速和补糖过程以控制氧消耗速率,具体包括:
17.在第一阶段控制转速为250
‑
300rpm,补糖流加速率为1
‑
2g/l/h;
18.在第二阶段控制转速为300
‑
360rpm,补糖流加速率为1
‑
3g/l/h;
19.在第三阶段控制转速为360
‑
400rpm,补糖流加速率为2.5
‑
3g/l/h。
20.进一步地,所述氧消耗速率利用尾气分析系统和数据采集分析系统获得;和/或,
21.所述有氧发酵培养至发酵液的od600值不低于140。
22.进一步地,所述发酵底物采用含有质量浓度3%~5%燕麦的燕麦发酵培养液;和/或,
23.所述厌氧菌包括双歧杆菌,并采用od600值大于8的双歧杆菌菌液,接种量8%
‑
11%;和/或,
24.所述好氧菌包括酵母菌,并采用od600值大于100的酵母菌菌液,接种量14%
‑
16%。
25.进一步地,所述双歧杆菌采用金双歧杆菌bifidobacterium hlxz006,所述酵母菌采用酿酒酵母saccharomyces cerevisiae hlgj4809。
26.进一步地,所述燕麦发酵培养液的制备方法包括:
27.将燕麦粉用纯化水分散后加热到100℃
‑
105℃糊化后,于82℃
‑
90℃下用液化酶200
‑
400u/l液化并添加辅料配制发酵培养基,120℃
‑
130℃下灭菌处理30分钟;
28.优选的,所述辅料含量包括:酵母浸粉0.4%
‑
0.6%,蛋白胨0.3%
‑
0.6%,磷酸氢二铵0.4%
‑
0.6%,消泡剂0.01%
‑
0.03%。
29.进一步地,所述步骤一中厌氧发酵的步骤包括:
30.向燕麦发酵培养液中通入无菌氮气并使溶氧浓度降到0.6%以下,将双歧杆菌接种到所述发酵培养基中,控制发酵温度37.5℃~38.5℃,ph 5.0~5.6,并通过补糖控制乳酸含量在不高于8g/l,发酵时长45~50小时;和/或,
31.所述步骤二中好氧发酵的步骤包括:
32.以已完成厌氧发酵的发酵液为底物,切换通入无菌空气并将溶氧达到饱和,接种酵母菌,控制发酵温度27℃~29℃,ph 5.8~6.0。
33.进一步地,所述方法还包括以下步骤:对完成好氧发酵的发酵液进行破壁匀浆处理,并用膜过滤;
34.优选的,所述破壁匀浆处理中控制温度不高于30℃,匀浆压力1400
‑
1500mpa,匀浆液浓缩至原体积的20%~25%,采用50~100纳米的膜进行过滤,得到所述燕麦发酵提取物。
35.另一方面,本技术还提供了采用上述方法获得的燕麦发酵提取物,所述燕麦发酵提取物中的氨基酸不低于3000mg/l,谷胱甘肽不低于1000mg/l,黄酮不低于70mg/l。
36.本技术提供的燕麦发酵提取物制备过程好氧阶段的供氧水平的精确控制方法,采用向燕麦经双歧杆菌厌氧发酵液中接种酵母菌进行的有氧发酵过程氧消耗速率水平的精准调控方法,获得的燕麦发酵提取物β
‑
葡聚糖、谷胱甘肽、氨基酸、总酚、皂苷和黄酮等含量显著提升。
37.其中,燕麦培养基厌氧发酵阶段选用益生菌双歧杆菌(bifidobacterium)进行对增殖培养,形成有机酸类和氨基酸类代谢物,同时还能够分泌蛋白酶水解燕麦中的大分子蛋白成为寡肽。接下来通过酿酒酵母(saccharomyces cerevisiae hlgj4809)好氧发酵进一步提升燕麦发酵提取物中活性组分含量,制备高质量的燕麦发酵提取物。
38.在酵母好氧培养阶段,供氧水平的控制,严重影响着培养过程中酵母菌的生长速率、底物的消耗速率、和功效成分的合成速率,如何精确控制过程中的供氧水平及氧消耗速率水平,是燕麦发酵制备化妆品活性原料的关键。
39.通过本技术能够带来如下有益效果:
40.本技术提供的燕麦发酵提取物制备过程工艺的精确控制方法,采用阶段式的氧消耗速率调控方案,并充分考虑到了酵母菌的生长和呼吸代谢特性状态,根据设计的过程溶氧 our组合控制模型,通过搅拌和补糖速率控制氧消耗速率在最适水平,以对好氧培养阶段供氧水平及氧消耗速率的阶段性精准调控,制备的燕麦提取物中谷胱甘肽、氨基酸、黄酮等多种活性成分含量显著提升,形成过程可精确有效控制的燕麦发酵提取物生产工艺。
附图说明
41.此处所说明的附图用来提供对本技术的进一步理解,构成本技术的一部分,本技术的示意性实施例及其说明用于解释本技术,并不构成对本技术的不当限定。在附图中:
42.图1是实施例1提供的控制方法的工艺流程图;
43.图2是实施例1提供的控制方法中的发酵过程曲线图,其中,在0
‑
48h期间为厌氧发酵阶段,48
‑
96h期间为好氧发酵阶段。
具体实施方式
44.为了更清楚的阐释本技术的整体构思,下面以实施例的方式对本发明的整体方案进行详细说明。在下文的描述中,给出了大量具体的细节以便提供对本发明更为彻底的理解。然而,对于本领域技术人员来说显而易见的是,本发明可以无需一个或多个这些细节而得以实施。在其他的例子中,为了避免与本发明发生混淆,对于本领域公知的一些技术特征未进行描述。
45.如未特殊说明,下述实施例中各原料组分均可通过商业途径购得,所使用的实验仪器均为实验室常规实验仪器,性能测试方法为本领域已知测试方法。其中,所涉及的实验仪器包括:上海国强生化装备有限责任公司提供的15l和50l自动发酵罐;上海舜宇恒平科学仪器有限公司提供的过程质谱仪;722型紫外
‑
可见光分光光度计;旋转式摇床。
46.其中,下述实施例中的菌种采用华东理工大学国家生化工程技术中心提供的金双歧杆菌bifidobacterium hlxz006和酿酒酵母saccharomyces cerevisiae hlgj4809。
47.在接种前,采用以下方法获得金双歧杆菌菌液,具体步骤为:
48.培养温度37℃,转速150rpm,厌氧培养48小时。培养过程中,当糖浓度降到0.4g/l时开始补糖,控制补糖速率为0.2g/l/h,启动补糖8小时后调整到0.3g/l/h,通过调整补糖速率控制培养过程中乳酸含量不高于8g/l,当od值达到8.0以上即可。
49.其中,金双歧杆菌的种子培养基组分以及含量如下:蛋白胨1.8%,酵母浸粉0.8%,葡萄糖0.5%,磷酸氢二钾0.2%,柠檬酸三铵0.2%,乙酸钠0.5%,硫酸镁0.02%,硫酸锰0.004%,半胱氨酸0.1%,吐温0.1%。上述培养基在121℃下灭菌处理30分钟。
50.在接种前,采用以下方法获得酿酒酵母菌液,具体步骤为:
51.温度28℃,ph6.0,通气量1080l/h,转速起步300rpm;当溶氧回升时,开始流加葡萄糖,其中葡萄糖流加速率为:起步流加速率1g/l/h,4小时后调整到2g/l/h,8小时后调整到
3g/l/h,12小时后调整到4g/l/h;通过调节补糖速率和转速来控制溶氧不低于25%%,当od值大于100时,进行移种。
52.其中,酿酒酵母的种子培养基组分以及含量如下:蛋白胨3%,酵母粉3%,葡萄糖0.5%,培养过程中需要补糖和氨水进行调ph在6.0。
53.实施例1
54.本实施例提供了一种燕麦发酵提取物制备过程的精确控制方法,该方法包括如下步骤:
55.步骤一、厌氧发酵过程:将燕麦粉用纯化水分散后加热到100℃糊化后,于85℃下用液化酶300u/l液化并添加辅料配制发酵培养基,121℃下灭菌处理30分钟;辅料含量为:酵母浸粉0.5%,蛋白胨0.5%,磷酸氢二铵0.5%,消泡剂0.02%。
56.将长好的金双歧杆菌种子培养液按照10%接种量接种到发酵罐中,控制温度在37.5~38.5℃,发酵罐转速200rpm,通氮气保持厌氧培养环境,并用氨水间歇式控制ph为5.5;当糖浓度降到0.4g/l时开始补糖,控制补糖速率为0.2g/l/h,启动补糖8小时后调整到0.3g/l/h,通过调整补糖速率控制培养过程中乳酸含量不高于8g/l,当od值达到8.0以上即可。
57.步骤二、好氧发酵阶段:
58.当上述发酵液在厌氧发酵指标达到后,将发酵罐进气的氮气切换成无菌空气,控制通气比1vvm,将溶氧回升到100%后,控制初始葡萄糖浓度提升到5g/l;按照15%接种量将酵母种子液接种到发酵罐中,控制发酵温度27.5
‑
28.5℃,初始转速250rpm;当ph降到5.8氨水自动控制在5.8
‑
6.0;
59.培养过程中通过搅拌和补糖速率控制氧消耗速率(our)在最适水平,具体控制策略为:
60.好氧培养前期时长为第48~64小时(即好氧发酵开始后第0
‑
16h),调整转速在250
‑
300rpm之间,补糖流加速率在1
‑
2g/l/h之间,控制氧消耗速率为30
±
2.1mmol/l/h;
61.好氧培养中期时长为第64~80小时(即好氧发酵开始后第17
‑
32h),调整转速在300
‑
360rpm之间,补糖流加速率在1
‑
3g/l/h之间,控制氧消耗速率为45
±
2.2mmol/l/h;
62.好氧培养后期时长为第80~96小时(即好氧发酵开始后第33
‑
48h),调整转速在360
‑
400rpm之间,补糖流加速率在2.5
‑
3g/l/h之间,控制氧消耗速率为55
±
2.5mmol/l/h。
63.上述厌氧发酵阶段和好氧发酵阶段的具体参数变化过程如图2所示。
64.步骤三、燕麦发酵提取物制备
65.将发酵结束获得的发酵液利用高压匀浆机进行破碎处理,其中匀浆压力1400~1500mpa,在2
‑
4个循环后破壁率80%以上,将高压匀浆处理后的匀浆液利用50~100纳米的膜进行过滤去除大分子蛋白和菌体碎片,得到无菌滤液。添加一定量的活性炭进行脱色处理,处理后经板框压滤后得到燕麦发酵提取物。
66.对比例1
67.对比例1与实施例1的发酵步骤大致相同,区别在于,对比例1中好氧发酵阶段中的氧消耗速率全程控制在高水平状态60
±
4.5mmol/l/h,同时溶氧也控制在45%。当残留糖浓度降到0.4g/l,开始补糖,补糖速率为起步流加速率2g/l/h,2小时后调整到2.5g/l/h,4小时后调整到4g/l/h,6小时后调整到5g/l/h,12小时后调整到4g/l/h,过程中当发酵液od值
达到115
‑
120时,将补糖速率控制在2.5
‑
3.0g/l/h,直到发酵总周期到96小时。
68.对比例2
69.对比例2与实施例1的发酵步骤大致相同,区别在于,对比例2中好氧发酵阶段中的氧消耗速率全程控制在低水平状态35
±
4.5mmol/l/h,同时溶氧也控制在45%。当残留糖浓度降到0.4g/l,开始补糖,初始补糖速率为起步流加速率2g/l/h,过程中根据our控制调节补糖速率,直到发酵总周期到96小时。
70.功效试验
71.对实施例1和对比例1
‑
2制备获得的燕麦发酵提取物分别进行主要有效成分的定性分析和定量测量。其中,利用基于同位素内标的液相质谱和气相质谱法检测氨基酸和有机酸含量,利用苯胺蓝显色法测定β
‑
葡聚糖含量,通过液相色谱检测谷胱甘肽含量,利用行业通用的特征显色比色法分别测定总黄酮、生物碱和皂苷等系列小分子代谢物含量。所得结果如表1所示。
72.表1
[0073][0074]
由表1中的数据可知,实施例1提供的制备方法所获得的燕麦发酵提取物,含有种类丰富的生物活性物质,除了保留了燕麦本身具有的总酚、皂苷和黄酮类组分外,还极大地丰富了氨基酸、β
‑
葡聚糖、谷胱甘肽、有机酸等生物活性营养物质。特别是氨基酸含量、谷胱甘肽含量以及总黄酮含量显著提升,分别可达到4213mg/l、1647mg/l和102.6mg/l。
[0075]
并且,对比例2中好氧发酵阶段控制发酵过程中氧消耗速率在35
±
4.5mmol/l/h,得到的燕麦发酵提取物中,氨基酸、有机酸、谷胱甘肽的含量显著低于实施案例1,说明较低的氧消耗速率不利于这些活性成分的积累。对比例2的控制模式下,β
‑
葡聚糖、总酚、皂苷、和总黄酮的含量与实施例1比较接近。都明显高于对比例1,充分说明高的过程氧消耗速率控制,不利于燕麦中关键活性组分的保留。
[0076]
从对比例1、对比例2和实施例1的批培养的菌浓和糖消耗数据来看,好氧培养过程中,对比例1高的氧消耗速率控制下糖消耗量比实施例1增加了39.2%以上,但菌体浓度od并没有增加,反而随着体积的稀释,显著下降。充分说明高的氧消耗速率,发酵底物消耗成
本显著增加。对比例2较低的氧消耗速率控制模式下,尽管糖消耗指标略有下降,但单位体积菌体浓度明显偏低,不利于燕麦发酵提取物中氨基酸、谷胱甘肽等活性成分的积累。
[0077]
以上所述仅为本技术的实施例而已,并不用于限制本技术。对于本领域技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原理之内所作的任何修改、等同替换、改进等,均应包含在本技术的权利要求范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

