malat1表达的调节剂
1.序列表
2.本技术连同电子格式的序列表一起提交。序列表作为2020年2月20日创建的大小为596kb的标题为biol00359woseq_st25.txt的文件提交。序列表的电子格式中的信息以引用的方式整体并入本文。
技术领域
3.本发明实施方案提供可用于抑制malat1表达的方法、化合物和组合物,其可以用于治疗、预防或改善与malat1相关的癌症。
背景技术:
4.肺腺癌转移相关转录物1(metastasis associated lung adenocarcinoma transcript 1;malat1)是在许多人细胞类型中表达的非编码lncrna并且在哺乳动物物种中是高度保守的。malat1最初从转移性nsclc患者中鉴定出来并且在多种类型的癌症中被上调(zhang x.等人,rna biol.2017,ping j等人,2003)。
5.本文所提供的某些实施方案涉及可用于抑制malat1表达的有效且可耐受的化合物和组合物,其可以用于治疗、预防、改善与malat1相关的癌症或减慢其进展。
具体实施方式
6.应理解,前述一般性描述和下文详细描述仅是示例性和说明性的并且不限制实施方案,如所要求保护的。在本文中,除非另外明确陈述,否则单数的使用包括复数。如本文所用,除非另外陈述,否则“或”的使用是指“和/或”。此外,术语“包括(including)”以及其他形式(诸如“包括(includes)”和“包括(included)”)的使用不具有限制性。
7.本文所用的章节标题仅用于组织目的并且不应解释为限制所描述的主题。本技术中引用的所有文档或文档的部分(包括但不限于专利、专利申请、文章、书籍、论文以及genbank和ncbi参考序列记录)特此明确地针对本文所讨论的文档的部分以引用的方式并入以及以全文引用的方式并入。
8.应理解,本文所包含的实例中的各seq id no中所示的序列与糖部分、核苷间键或核碱基的任何修饰无关。因此,由seq id no限定的化合物可独立地包含糖部分、核苷间键或核碱基的一个或多个修饰。ion编号所述的化合物指示核碱基序列、化学修饰和基序的组合。
9.除非另外指示,否则以下术语具有以下含义:
[0010]“2
’‑
脱氧核苷”是指包含2
’‑
h(h)呋喃糖基糖部分的核苷,如天然存在的脱氧核糖核酸(dna)中所存在的。在某些实施方案中,2
’‑
脱氧核苷可包含修饰的核碱基或可包含rna核碱基(尿嘧啶)。
[0011]“2
’‑
o
‑
甲氧基乙基”(也是2
’‑
moe和2
’‑
o(ch2)2‑
och3)是指在呋喃糖基环的2’位处的o
‑
甲氧基
‑
乙基修饰。2
’‑
o
‑
甲氧基乙基修饰的糖是修饰的糖。
[0012]“2
’‑
moe核苷”(也是2
’‑
o
‑
甲氧基乙基核苷)是指包含2
’‑
moe修饰的糖部分的核苷。
[0013]“2
’‑
取代核苷”或“2
‑
修饰核苷”是指包含2
’‑
取代或2
’‑
修饰糖部分的核苷。如本文所用,关于糖部分的“2
’‑
取代”或“2
‑
修饰”是指糖部分包含至少一个除h或oh之外的2
’‑
取代基。
[0014]“3’靶位点”是指靶核酸中与具体化合物的3
’‑
最末端(3
’‑
most)核苷酸互补的核苷酸。
[0015]“5’靶位点”是指靶核酸中与具体化合物的5
’‑
最末端核苷酸互补的核苷酸。
[0016]“5
‑
甲基胞嘧啶”是指具有连接至5位的甲基的胞嘧啶。
[0017]“约”是指在值的
±
10%内。例如,如果陈述“化合物实现对malat1的约70%抑制”,则表示在60%和80%的范围内的malat1水平受到抑制。
[0018]“施用(administration或administering)”是指向个体引入本文所提供的化合物或组合物以执行其预期功能的途径。可以使用的施用途径的实例包括但不限于肠胃外施用,诸如皮下、静脉内或肌肉内注射或输注。
[0019]“伴随施用”或“共同施用”是指两种或更多种化合物以其两者的药理学作用均在患者体内显现的任何方式施用。伴随施用不需要两种化合物在单一药物组合物中、以相同剂型、通过相同施用途径或同时施用。两种化合物的作用本身无需同时显现。所述作用仅需重叠一段时间而无需在时间上共同延长。伴随施用或共同施用涵盖并行或依序施用。
[0020]“改善”是指改进或减轻相关的疾病、病症或病状的至少一种指标、征象或症状。在某些实施方案中,改善包括延迟或减慢病状或疾病的一种或多种指标的进展或严重程度。指标的进展或严重程度可通过本领域技术人员已知的主观或客观量度来确定。
[0021]“动物”是指人或非人动物,包括但不限于小鼠、大鼠、兔、狗、猫、猪以及包括但不限于猴和黑猩猩的非人灵长类动物。
[0022]
如本公开中所用的”抗体”是指免疫球蛋白或者其片段或衍生物,并且涵盖包含抗原结合位点的任何多肽,不管它是体外产生还是体内产生的。所述术语包括但不限于多克隆抗体、单克隆抗体、单特异性抗体、多特异性抗体、非特异性抗体、人源化抗体、单链抗体、嵌合抗体、合成抗体、重组抗体、杂交抗体、突变抗体和接枝抗体。出于本公开的目的,除非如在“完整抗体”中那样通过术语“完整”另外修饰,否则术语“抗体”还包括抗体片段,诸如fab、f(ab’)2、fv、scfv、fd、dab以及其他保留抗原结合功能(即特异性结合例如ctla
‑
4或pd
‑
l1的能力)的抗体片段。通常,此类片段将包含抗原结合结构域。
[0023]“抗ctla
‑
4抗体”是指特异性结合ctla
‑
4多肽的抗体或其抗原结合片段。示例性抗ctla
‑
4抗体描述于例如美国专利6,682,736、7,109,003、7,123,281、7,411,057、7,824,679、8,143,379、7,807,797和8,491,895(曲美木单抗(tremelimumab)在其中是11.2.1)中,所述专利以引用的方式并入本文。曲美木单抗(美国专利6,682,736)是示例性抗ctla
‑
4抗体。曲美木单抗vl、vh和cdr氨基酸序列提供于本文的seq id no:1
‑
8。
[0024]“抗ox40抗体”是指特异性结合ox40的抗体或其抗原结合片段。ox40抗体包括对ox40具有特异性的单克隆和多克隆抗体以及其抗原结合片段。在某些方面,本文所述的抗ox40抗体是单克隆抗体(或其抗原结合片段),例如鼠单克隆抗体、人源化单克隆抗体或完全人单克隆抗体。在一个具体实施方案中,ox40抗体是ox40受体激动剂,诸如weinberg等
machinery)。
[0033]“反义寡核苷酸”是指具有与靶核酸或其区域或区段互补的核碱基序列的寡核苷酸。在某些实施方案中,反义寡核苷酸可与靶核酸或其区域或区段特异性杂交。
[0034]“双环核苷”或“bna”是指包含双环糖部分的核苷。“双环糖”或“双环糖部分”是指包含两个环的修饰的糖部分,其中第二环是通过连接第一环中的两个原子从而形成双环结构的桥形成。在某些实施方案中,双环糖部分的第一环是呋喃糖基部分。在某些实施方案中,双环糖部分不包含呋喃糖基部分。
[0035]“分支基团”是指具有能够与至少3个基团形成共价键的至少3个位置的原子团。在某些实施方案中,分支基团提供多个反应性位点,以用于通过缀合接头和/或可切割部分将系留配体连接至寡核苷酸。
[0036]“细胞靶向部分”是指能够结合一种或多种具体细胞类型的缀合基团或缀合基团的一部分。
[0037]“cet”或“限制性乙基(constrained ethyl)”是指包含连接4
’‑
碳与2
’‑
碳的桥的双环呋喃糖基糖部分,其中所述桥具有式:4
’‑
ch(ch3)
‑
o
‑2’
。
[0038]“cet核苷”是指包含cet修饰的糖部分的核苷。
[0039]
化合物中的“化学修饰”描述化合物中的任何单元相对于此类单元的原始状态通过化学反应形成的取代或变化。“修饰核苷”是指独立地具有修饰的糖部分和/或修饰的核碱基的核苷。“修饰寡核苷酸”是指包含至少一个修饰的核苷间键、修饰的糖和/或修饰的核碱基的寡核苷酸。
[0040]“化学上不同的区域”是指化合物的在某种程度上与同一化合物的另一区域相比在化学上不相同的区域。例如,具有2
’‑
o
‑
甲氧基乙基核苷酸的区域与具有没有2
’‑
o
‑
甲氧基乙基修饰的核苷酸的区域化学上不同。
[0041]“嵌合反义化合物”是指具有至少2个化学上不同的区域的反义化合物,各位置具有多个亚基。
[0042]“手性富集群体”是指多个具有相同分子式的分子,其中群体内在具体手性中心处含有具体立体化学构型的分子的数目或百分比大于当所述具体手性中心是无规立构时预期群体内在相同具体手性中心处含有相同具体立体化学构型的分子的数目或百分比。在各分子内具有多个手性中心的手性富集分子群体可含有一个或多个无规立构手性中心。在某些实施方案中,分子是修饰寡核苷酸。在某些实施方案中,分子是包含修饰寡核苷酸的化合物。
[0043]“可切割键”是指能够分割的任何化学键。在某些实施方案中,可切割键选自:酰胺、聚酰胺、酯、醚、磷酸二酯中的一个或两个酯、磷酸酯、氨基甲酸酯、二硫化物或肽。
[0044]“可切割部分”是指在生理条件下(例如在细胞、动物或人体内)被切割的键或原子团。
[0045]
关于寡核苷酸的“互补”是指在沿相反方向将两个核碱基序列对齐时,此类寡核苷酸或其一个或多个区域的核碱基序列与另一寡核苷酸或核酸或其一个或多个区域的核碱基序列匹配。除非另外指定,否则如本文所述的核碱基匹配或互补核碱基限于以下各对:腺嘌呤(a)与胸腺嘧啶(t)、腺嘌呤(a)与尿嘧啶(u)、胞嘧啶(c)与鸟嘌呤(g),以及5
‑
甲基胞嘧啶(
m
c)与鸟嘌呤(g)。互补寡核苷酸和/或核酸不必在各核苷处均具有核碱基互补性并且可
包括一个或多个核碱基错配。相比之下,关于寡核苷酸的“完全互补”或“100%互补”是指此类寡核苷酸在各核苷处均具有核碱基匹配而无任何核碱基错配。
[0046]“缀合基团”是指连接至寡核苷酸的原子团。缀合基团包括缀合部分和将缀合部分连接至寡核苷酸的缀合接头。
[0047]“缀合接头”是指包含至少一个将缀合部分连接至寡核苷酸的键的原子团。
[0048]“缀合部分”是指通过缀合接头连接至寡核苷酸的原子团。
[0049]
寡核苷酸的上下文中的“连续”是指核苷、核碱基、糖部分或核苷间键彼此紧邻。例如,“连续核碱基”是指在序列中彼此紧邻的核碱基。
[0050]“设计”或“被设计来”是指设计与所选核酸分子特异性杂交的化合物的过程。
[0051]“稀释剂”是指组合物中缺乏药理学活性但是药学上必需或期望的成分。例如,注射组合物中的稀释剂可以是液体,例如盐水溶液。
[0052]“不同修饰的”是指彼此不同的化学修饰或化学取代基,包括不存在修饰。因此,例如,moe核苷和未修饰的dna核苷是“不同修饰的”,即使dna核苷是未修饰的。同样地,dna和rna是“不同修饰的”,即使两者均为天然存在的未修饰核苷。如果不包含不同核碱基就相同的核苷不是不同修饰的。例如,包含2
’‑
ome修饰的糖和未修饰的腺嘌呤核碱基的核苷和包含2
’‑
ome修饰的糖和未修饰的胸腺嘧啶核碱基的核苷不是不同修饰的。
[0053]“剂量”是指在单次施用中或在指定时间段中提供的化合物或药剂的指定量。在某些实施方案中,可以两次或更多次推注、片剂或注射施用剂量。例如,在某些实施方案中,在期望皮下施用时,期望剂量可需要不易由单次注射提供的体积。在此类实施方案中,可使用两次或更多次注射来实现期望剂量。在某些实施方案中,可以两次或更多次注射施用剂量以使个体的注射部位反应最小化。在其他实施方案中,化合物或药剂通过在延长时间段内输注或以连续方式进行施用。剂量可规定为每小时、每天、每周或每个月的药剂的量。
[0054]“给药方案”是被设计来实现一种或多种期望效果的剂量组合。
[0055]“双链反义化合物”是指包含两种彼此互补并且形成双螺旋的寡聚化合物的反义化合物,并且其中两种所述寡聚化合物中的一种包含寡核苷酸。
[0056]“有效量”是指足以在需要所述化合物的个体中实现期望生理结果的化合物的量。有效量可在个体中根据以下因素而变化:待治疗个体的健康和身体状况、待治疗个体的分类学组、组合物的配方、个体的医学病状评估以及其他相关因素。
[0057]“功效”是指产生期望效果的能力。
[0058]“表达”包括基因的编码信息借以转化成细胞中存在并且起作用的结构的所有功能。此类结构包括但不限于转录和翻译的产物。
[0059]“间隔体(gapmer)”是指如下寡核苷酸,其包含具有多个核苷的内部区域,所述多个核苷支持位于具有一个或多个核苷的外部区域之间的核糖核酸酶h切割,其中构成内部区域的核苷与构成外部区域的一个或多个核苷是化学上不同的。内部区域可称为“间隙”并且外部区域可称为“侧翼”。
[0060]“杂交”是指寡核苷酸和/或核酸的退火。虽然不限于具体机制,但是最常见的杂交机制涉及互补核碱基之间的氢键合,其可以是watson
‑
crick氢键合、hoogsteen氢键合或反向hoogsteen氢键合。在某些实施方案中,互补核酸分子包括但不限于反义化合物和核酸靶标。在某些实施方案中,互补核酸分子包括但不限于寡核苷酸和核酸靶标。
[0061]“紧邻”是指相同种类的紧邻元件之间没有居间元件(例如,紧邻核碱基之间没有居间核碱基)。
[0062]“免疫检查点抑制剂”是指抑制了抑制免疫反应的蛋白质的表达或活性的剂。在一个实施方案中,免疫检查点抑制剂是抑制ctla
‑
4或pd
‑
1途径的剂。具体检查点抑制剂包括抑制pd
‑
1、pd
‑
l1或ctla
‑
4的抗体。
[0063]“免疫调节剂”是指增强免疫反应(例如,抗肿瘤免疫反应)的剂。本公开的示例性免疫调节剂包括:抗体,诸如抗ctla
‑
4抗体、抗pd
‑
l1抗体、抗pd
‑
1抗体和这些抗体中的任一者的抗原片段;以及ox40激动剂,包括蛋白质,诸如ox40配体融合蛋白、ox40抗体或其片段。在一个实施方案中,免疫调节剂是免疫检查点抑制剂。
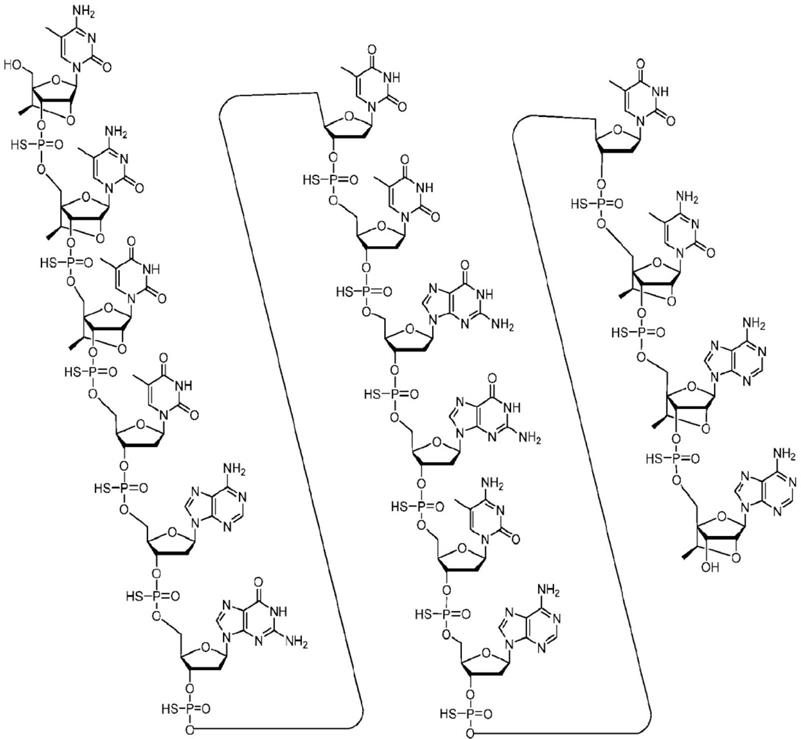
[0064]“个体”是指被选择用于治疗或疗法的人或非人动物。
[0065]“抑制表达或活性”是指表达或活性相对于未处理或对照样品中的表达或活性的降低或阻断并且不一定指示表达或活性的全部消除。
[0066]“核苷间键”是指在寡核苷酸中的相邻核苷之间形成共价键的基团或键。“修饰的核苷间键”是指除天然存在的磷酸酯核苷间键之外的任何核苷间键。非磷酸酯键在本文中称为修饰的核苷间键。
[0067]“延长的寡核苷酸”是相对于本文所公开的寡核苷酸(例如,亲本寡核苷酸)具有一个或多个另外核苷的那些寡核苷酸。
[0068]“连接核苷”是指由核苷间键连接在一起的相邻核苷。
[0069]“接头
‑
核苷”是指将寡核苷酸连接至缀合部分的核苷。接头
‑
核苷位于化合物的缀合接头内。不将接头
‑
核苷视为化合物的寡核苷酸部分的一部分,即使它们与寡核苷酸是连续的。
[0070]“错配”或“非互补”是指当将第一寡核苷酸和第二寡核苷酸对齐时,第一寡核苷酸的核碱基不与第二寡核苷酸或靶核酸的对应核碱基互补。例如,包括但不限于通用(universal)核碱基、肌苷和次黄嘌呤的核碱基能够与至少一个核碱基杂交但相对于与其杂交的核碱基仍是错配或非互补的。作为另一实例,当第一寡核苷酸和第二寡核苷酸对齐时,第一寡核苷酸的不能与第二寡核苷酸或靶核酸的对应核碱基杂交的核碱基是错配或非互补核碱基。
[0071]“调节”是指改变或调整细胞、组织、器官或有机体中的特征。例如,调节malat1 rna可以指增加或降低细胞、组织、器官或有机体中的malat1 rna和/或malat1蛋白的水平。“调节剂”影响细胞、组织、器官或有机体中的变化。例如,malat1化合物可以是降低细胞、组织、器官或有机体中的malat1 rna和/或malat1蛋白的量的调节剂。
[0072]“moe”是指甲氧基乙基。
[0073]“单体”是指寡聚物的单一单元。单体包括但不限于核苷和核苷酸。
[0074]“基序”是指寡核苷酸中的未修饰和/或修饰的糖部分、核碱基和/或核苷间键的模式。
[0075]“天然”或“天然存在的”是指在自然界中存在。
[0076]“非双环的修饰的糖”或“非双环的修饰的糖部分”是指包含不在糖的两个原子之间形成桥以形成第二环的修饰(诸如取代)的修饰的糖部分。
[0077]“核酸”是指由单体核苷酸构成的分子。核酸包括但不限于核糖核酸(rna)、脱氧核
糖核酸(dna)、单链核酸和双链核酸。
[0078]“核碱基”是指能够与另一核酸的碱基配对的杂环部分。如本文所用,“天然存在的核碱基”是腺嘌呤(a)、胸腺嘧啶(t)、胞嘧啶(c)、尿嘧啶(u)和鸟嘌呤(g)。“修饰的核碱基”是经过化学修饰的天然存在的核碱基。“通用碱基”或“通用核碱基”是除天然存在的核碱基和修饰的核碱基之外的核碱基,并且能够与任一核碱基配对。
[0079]“核碱基序列”是指与任何糖或核苷间键无关的核酸或寡核苷酸中的连续核碱基的顺序。
[0080]“核苷”是指包含核碱基和糖部分的化合物。核碱基和糖部分各自独立地为未修饰或修饰的。“修饰的核苷”是指包含修饰的核碱基和/或修饰的糖部分的核苷。修饰的核苷包括缺乏核碱基的无碱基核苷。
[0081]“寡聚化合物”是指包含单一寡核苷酸和任选的一种或多种另外特征(诸如缀合基团或末端基团)的化合物。
[0082]“寡核苷酸”是指各自可彼此独立地为修饰或未修饰的连接核苷的聚合物。除非另外指示,否则寡核苷酸由8
‑
80个连接核苷组成。“修饰寡核苷酸”是指其中至少一个糖、核碱基或核苷间键被修饰的寡核苷酸。“未修饰的寡核苷酸”是指不包含任何糖、核碱基或核苷间修饰的寡核苷酸。
[0083]“亲本寡核苷酸”是指以下寡核苷酸,其序列用作针对更多具有类似序列但具有不同长度、基序和/或化学性质的寡核苷酸的设计基础。新设计的寡核苷酸可具有与亲本寡核苷酸相同或重叠的序列。
[0084]“肠胃外施用”是指通过注射或输注施用。肠胃外施用包括皮下施用、静脉内施用、肌肉内施用、动脉内施用、腹膜内施用或颅内施用,例如鞘内或脑室内施用。
[0085]“药学上可接受的载剂或稀释剂”是指适用于向个体施用的任何物质。例如,药学上可接受的载剂可以是无菌水溶液,诸如pbs或注射用水。
[0086]“药学上可接受的盐”是指化合物(诸如寡聚化合物或寡核苷酸)的生理学上和药学上可接受的盐,即保留亲本化合物的期望生物活性并且不赋予其非期望毒理学作用的盐。
[0087]“药剂”是指当向个体施用时提供治疗益处的化合物。
[0088]“药物组合物”是指适于向个体施用的物质的混合物。例如,药物组合物可包含一种或多种化合物或其盐以及无菌水溶液。
[0089]“硫代磷酸酯键”是指非桥接氧原子中的一个被硫原子置换的修饰的磷酸酯键。硫代磷酸酯核苷间键是修饰的核苷间键。
[0090]“磷部分”是指包含磷原子的原子团。在某些实施方案中,磷部分包含单磷酸酯、二磷酸酯或三磷酸酯或者硫代磷酸酯。
[0091]“部分”是指核酸的限定数目的连续(即,连接的)核碱基。在某些实施方案中,部分是靶核酸的限定数目的连续核碱基。在某些实施方案中,部分是寡聚化合物的限定数目的连续核碱基。
[0092]“预防”是指延迟或预先阻碍疾病、病症或病状的发作、发展或进展,持续数分钟至无限期的时间段。
[0093]“前药”是指在体外处于一种形式、当向个体施用时在体内或其细胞内代谢成另一
形式的化合物。在某些实施方案中,代谢形式是化合物(例如,药物)的活性或更具活性的形式。通常,前药在体内的转化通过细胞或组织中存在的一种或多种酶(例如,内源性酶或病毒酶)或一种或多种化学物质的作用和/或通过生理学条件促进。
[0094]“降低”是指下降至较小程度、大小、量或数目。
[0095]“refseq no.”是分配给序列以指示所述序列的具体靶转录物(例如,靶基因)的字母和数字的独特组合。关于靶基因的此类序列和信息(统称为基因记录)可以见于基因序列数据库中。基因序列数据库包括ncbi参考序列数据库、genbank、欧洲核苷酸档案库(european nucleotide archive)和日本dna数据库(后三者形成国际核苷酸序列数据库合作(international nucleotide sequence database collaboration)或insdc)。
[0096]“区域”定义为靶核酸的具有至少一个可鉴定结构、功能或特征的部分。
[0097]“rnai化合物”是指至少部分地通过risc或ago2但不通过核糖核酸酶h起作用以调节靶核酸和/或靶核酸所编码的蛋白质的反义化合物。rnai化合物包括但不限于双链sirna、单链rna(ssrna)和微小rna(包括微小rna模拟物)。
[0098]“区段”定义为核酸内的区域的较小部分或子部分。
[0099]“副作用”是指除期望作用以外的可归因于治疗的生理疾病和/或病状。在某些实施方案中,副作用包括注射部位反应、肝功能测试异常、肾功能异常、肝毒性、肾毒性、中枢神经系统异常、肌病和不适。例如,血清中的转氨酶水平增加可指示肝毒性或肝功能异常。例如,胆红素增加可指示肝毒性或肝功能异常。
[0100]
关于化合物的“单链”是指所述化合物仅具有一个寡核苷酸。“自身互补”是指寡核苷酸至少部分地与自身杂交。由一个寡核苷酸组成的化合物是单链化合物,其中所述化合物的寡核苷酸是自身互补的。单链化合物可以能够结合互补化合物以形成双螺旋。
[0101]“位点”定义为靶核酸内的独特核碱基位置。
[0102]“可特异性杂交”是指寡核苷酸在所述寡核苷酸与靶核酸之间具有足够程度的互补性以诱导期望效果,同时对非靶核酸表现出最小作用或没有作用。在某些实施方案中,特异性杂交在生理条件下发生。
[0103]
关于靶核酸的“特异性抑制”是指降低或阻断靶核酸的表达,同时对非靶核酸表现出较少作用、最小作用或没有作用。降低不一定指示靶核酸表达的全部消除。
[0104]“标准细胞测定”是指实施例中所述的一项或多项测定以及其合理变型。
[0105]“标准体内实验”是指一个或多个实施例中所述的一个或多个程序以及其合理变型。
[0106]
在具有相同分子式的分子群体的上下文中,“无规立构手性中心”是指具有随机立体化学构型的手性中心。例如,在包含无规立构手性中心的分子群体中,具有无规立构手性中心的(s)构型的分子数可与具有无规立构手性中心的(r)构型的分子数相同但不一定相同。当手性中心的立体化学构型是未设计成控制立体化学构型的合成方法的结果时,其被视为随机的。在某些实施方案中,无规立构手性中心是无规立构硫代磷酸酯核苷间键。
[0107]“糖部分”是指未修饰的糖部分或修饰的糖部分。“未修饰的糖部分”或“未修饰的糖”是指2
’‑
oh(h)呋喃糖基部分,如rna(“未修饰的rna糖部分”)中所存在;或2
’‑
h(h)部分,如dna(“未修饰的dna糖部分”)中所存在。未修饰的糖部分在1’、3’和4’位中的每一个处均具有一个氢,在3’位具有氧并且在5’位具有两个氢。“修饰的糖部分”或“修饰的糖”是指修
饰的呋喃糖基糖部分或糖替代物。“修饰的呋喃糖基糖部分”是指包含代替未修饰的糖部分的至少一个氢的非氢取代基的呋喃糖基糖。在某些实施方案中,修饰的呋喃糖基糖部分是2
’‑
取代糖部分。此类修饰的呋喃糖基糖部分包括双环糖和非双环糖。
[0108]“糖替代物”是指除呋喃糖基部分之外具有可以将核碱基连接至另一基团的部分(诸如核苷间键、缀合基团或寡核苷酸中的末端基团)的修饰的糖部分。包含糖替代物的修饰核苷可以掺入寡核苷酸内的一个或多个位置,并且此类寡核苷酸能够与互补化合物或核酸杂交。
[0109]“协同(synergy)”或“协同(synergize)”是指大于在相同剂量下各组分单独作用的加成的组合作用。
[0110]“malat1”是指malat1的任何核酸或蛋白质。“malat1核酸”是指编码malat1的任何核酸。例如,在某些实施方案中,malat1核酸包括编码malat1的dna序列、由编码malat1的dna(包括包含内含子和外显子的基因组dna)转录的rna序列以及编码malat1的mrna序列。“malat1 mrna”是指编码malat1蛋白的mrna。靶标可以大写或小写的形式提及。
[0111]“malat1特异性抑制剂”是指能够在分子水平上特异性抑制malat1 rna和/或malat1蛋白表达或活性的任何剂。例如,malat1特异性抑制剂包括能够抑制malat1 rna和/或malat1蛋白的表达的核酸(包括反义化合物)、肽、抗体、小分子和其他剂。
[0112]“靶基因”是指编码靶标的基因。
[0113]“靶向”是指化合物与靶核酸特异性杂交以诱导期望效果。
[0114]“靶核酸”、“靶rna”、“靶rna转录物”和“核酸靶标”全部是指能够由本文所述的化合物靶向的核酸。
[0115]“靶区域”是指靶核酸的由一种或多种化合物所靶向的部分。
[0116]“靶区段”是指靶核酸的由化合物所靶向的核苷酸序列。“5’靶位点”是指靶区段的5
’‑
最末端核苷酸。“3’靶位点”是指靶区段的3
’‑
最末端核苷酸。
[0117]“末端基团”是指共价连接至寡核苷酸的末端的化学基团或原子团。
[0118]“治疗有效量”是指向个体提供治疗益处的化合物、药剂或组合物的量。
[0119]“治疗”是指向动物施用化合物或药物组合物以在动物中实现疾病、病症或病状的改变或改进。
[0120]
某些实施方案
[0121]
某些实施方案提供用于抑制malat1表达的方法、化合物和组合物。
[0122]
某些实施方案提供靶向malat1核酸的化合物。在某些实施方案中,malat1核酸具有refseq或genbank登录号xr_001309.1(seq id no:1)(其以引用的方式整体并入)或genbank登录号ef177381.1(seq id no:2824)(其以引用的方式整体并入)中所示的序列。在某些实施方案中,化合物是反义化合物或寡聚化合物。在某些实施方案中,化合物是单链的。在某些实施方案中,化合物是双链的。
[0123]
某些实施方案提供一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:2
‑
10或36
‑
2813中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物是反义化合物或寡聚化合物。在某些实施方案中,化合物是单链的。在某些实施方案中,化合物是双链的。在某些实施方案中,修饰寡核苷酸由10至30个连接核苷组成。
[0124]
某些实施方案提供一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:2
‑
10中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物是反义化合物或寡聚化合物。在某些实施方案中,化合物是单链的。在某些实施方案中,化合物是双链的。在某些实施方案中,修饰寡核苷酸由10至30个连接核苷组成。
[0125]
某些实施方案提供一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸由9至80个连接核苷组成并且具有包含核碱基序列seq id no:2
‑
10或36
‑
2813中的任一者的至少9个连续核碱基的核碱基序列。在某些实施方案中,化合物是反义化合物或寡聚化合物。在某些实施方案中,化合物是单链的。在某些实施方案中,化合物是双链的。在某些实施方案中,修饰寡核苷酸由10至30个连接核苷组成。
[0126]
某些实施方案提供一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸由9至80个连接核苷组成并且具有包含核碱基序列seq id no:2
‑
10中的任一者的至少9个连续核碱基的核碱基序列。在某些实施方案中,化合物是反义化合物或寡聚化合物。在某些实施方案中,化合物是单链的。在某些实施方案中,化合物是双链的。在某些实施方案中,修饰寡核苷酸由10至30个连接核苷组成。
[0127]
某些实施方案提供一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸由10至80个连接核苷组成并且具有包含核碱基序列seq id no:2
‑
10或36
‑
2813中的任一者的至少10个连续核碱基的核碱基序列。在某些实施方案中,化合物是反义化合物或寡聚化合物。在某些实施方案中,化合物是单链的。在某些实施方案中,化合物是双链的。在某些实施方案中,修饰寡核苷酸由10至30个连接核苷组成。
[0128]
某些实施方案提供一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸由10至80个连接核苷组成并且具有包含核碱基序列seq id no:2
‑
10中的任一者的至少10个连续核碱基的核碱基序列。在某些实施方案中,化合物是反义化合物或寡聚化合物。在某些实施方案中,化合物是单链的。在某些实施方案中,化合物是双链的。在某些实施方案中,修饰寡核苷酸由10至30个连接核苷组成。
[0129]
某些实施方案提供一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸由11至80个连接核苷组成并且具有包含核碱基序列seq id no:2
‑
10或36
‑
2813中的任一者的至少11个连续核碱基的核碱基序列。在某些实施方案中,化合物是反义化合物或寡聚化合物。在某些实施方案中,化合物是单链的。在某些实施方案中,化合物是双链的。在某些实施方案中,修饰寡核苷酸由11至30个连接核苷组成。
[0130]
某些实施方案提供一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸由11至80个连接核苷组成并且具有包含核碱基序列seq id no:2
‑
10中的任一者的至少11个连续核碱基的核碱基序列。在某些实施方案中,化合物是反义化合物或寡聚化合物。在某些实施方案中,化合物是单链的。在某些实施方案中,化合物是双链的。在某些实施方案中,修饰寡核苷酸由11至30个连接核苷组成。
[0131]
某些实施方案提供一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸由12至80个连接核苷组成并且具有包含核碱基序列seq id no:2
‑
10或36
‑
2813中的任一者的至少12个连续核碱基的核碱基序列。在某些实施方案中,化合物是反义化合物或寡聚化合物。在某些实施方案中,化合物是单链的。在某些实施方案中,化合物是双链的。在某些实施方案
中,修饰寡核苷酸由12至30个连接核苷组成。
[0132]
某些实施方案提供一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸由12至80个连接核苷组成并且具有包含核碱基序列seq id no:2
‑
10中的任一者的至少12个连续核碱基的核碱基序列。在某些实施方案中,化合物是反义化合物或寡聚化合物。在某些实施方案中,化合物是单链的。在某些实施方案中,化合物是双链的。在某些实施方案中,修饰寡核苷酸由12至30个连接核苷组成。
[0133]
某些实施方案提供一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:2
‑
10或36
‑
2813中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物是反义化合物或寡聚化合物。在某些实施方案中,化合物是单链的。在某些实施方案中,化合物是双链的。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。
[0134]
某些实施方案提供一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:2
‑
10中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物是反义化合物或寡聚化合物。在某些实施方案中,化合物是单链的。在某些实施方案中,化合物是双链的。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。
[0135]
某些实施方案提供一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸具有由seq id no:2
‑
10或36
‑
2813中的任一者的核碱基序列组成的核碱基序列。在某些实施方案中,化合物是反义化合物或寡聚化合物。在某些实施方案中,化合物是单链的。在某些实施方案中,化合物是双链的。
[0136]
某些实施方案提供一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸具有由seq id no:2
‑
10中的任一者的核碱基序列组成的核碱基序列。在某些实施方案中,化合物是反义化合物或寡聚化合物。在某些实施方案中,化合物是单链的。在某些实施方案中,化合物是双链的。
[0137]
在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成,其中修饰寡核苷酸的核碱基序列包含至少8、9、10、11、12、13、14、15或16个连续核碱基部分,所述部分与seq id no:1的核苷酸1535
‑
1550、2034
‑
2049、2341
‑
2356、4821
‑
4836、4840
‑
4855、4931
‑
4946、5049
‑
5064、5494
‑
5509或5495
‑
5510内的等长部分互补。在某些实施方案中,修饰寡核苷酸由10至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。
[0138]
在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成,其中修饰寡核苷酸的核碱基序列在seq id no:1的核苷酸1535
‑
1550、2034
‑
2049、2341
‑
2356、4821
‑
4836、4840
‑
4855、4931
‑
4946、5049
‑
5064、5494
‑
5509或5495
‑
5510内互补。在某些实施方案中,修饰寡核苷酸由10至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。
[0139]
在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含seq id no:2
‑
10或36
‑
2813中的任一者的核碱基序列的至少8、9、10、11、12、13、14、15或16个连续核碱基部分的核碱基序列。在某些实施方案中,修饰寡核苷酸由10至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。
[0140]
在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含seq id no:2
‑
10中的任一者的核碱基序列的至少8、9、10、11、12、13、14、15或16个连续核碱基部分的核碱基序列。在某些实施方案中,修饰寡核苷酸由10至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。
[0141]
在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:2
‑
10或36
‑
2813中的任一者的核碱基序列的核碱基序列。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。
[0142]
在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:2
‑
10中的任一者的核碱基序列的核碱基序列。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。
[0143]
在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16个连接核苷组成并且具有由seq id no:2
‑
10或36
‑
2813中的任一者的核碱基序列组成的核碱基序列。
[0144]
在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16个连接核苷组成并且具有由seq id no:2
‑
10中的任一者的核碱基序列组成的核碱基序列。
[0145]
在某些实施方案中,前述修饰寡核苷酸中的任一者的至少一个核苷间键是修饰的核苷间键,前述修饰寡核苷酸中的任一者的至少一个糖是修饰的糖,和/或前述修饰寡核苷酸中的任一者的至少一个核碱基是修饰的核碱基。
[0146]
在某些实施方案中,前述修饰寡核苷酸中的任一者的至少一个核苷包含修饰的糖。在某些实施方案中,修饰的糖包含2
’‑
o
‑
甲氧基乙基。在某些实施方案中,修饰的糖是双环糖,诸如4
’‑
ch(ch3)
‑
o
‑2’
基团、4
’‑
ch2‑
o
‑2’
基团或4
’‑
(ch2)2‑
o
‑2’
基团。
[0147]
在某些实施方案中,修饰寡核苷酸的至少一个核苷间键是修饰的核苷间键,诸如硫代磷酸酯核苷间键。
[0148]
在某些实施方案中,前述修饰寡核苷酸中的任一者的至少一个核碱基是修饰的核碱基,诸如5
‑
甲基胞嘧啶。
[0149]
在某些实施方案中,前述修饰寡核苷酸中的任一者具有:
[0150]
间隙区段,其由连接的2
’‑
脱氧核苷组成;
[0151]5’
侧翼区段,其由连接核苷组成;以及
[0152]3’
侧翼区段,其由连接核苷组成;
[0153]
其中间隙区段位于5’侧翼区段与3’侧翼区段之间并且其中各侧翼区段的各核苷包含修饰的糖。在某些实施方案中,修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:2
‑
10或36
‑
2813中的任一者所示的核碱基序列的核碱基序列。在某些实施方案中,修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:2
‑
10中的任一者所示的核碱基序列的核碱基序列。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成并且具有包含seq id no:2
‑
10或36
‑
2813中的任一者所示的核碱基序列的核碱基序列。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成并且具有包含seq id no:2
‑
10中的任一者所示的核碱基序列的核碱基序列。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成并且具有由seq id no:2
‑
10或36
‑
2813中的任一者所示的核碱基序列组成的核碱基序列。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成并且具有由seq id no:2
‑
10中的任一者所示的核碱基序列组成的核碱基序列。
[0154]
在某些实施方案中,化合物包含修饰寡核苷酸或由其组成,所述修饰寡核苷酸由16至80个连接的核碱基组成并且具有包含seq id no:2
‑
10或36
‑
2813中的任一者所示的核碱基序列的核碱基序列,其中修饰寡核苷酸具有:
[0155]
间隙区段,其由连接的2
’‑
脱氧核苷组成;
[0156]5’
侧翼区段,其由连接核苷组成;以及
[0157]3’
侧翼区段,其由连接核苷组成;
[0158]
其中间隙区段位于5’侧翼区段与3’侧翼区段之间并且其中各侧翼区段的各核苷包含修饰的糖。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成。
[0159]
在某些实施方案中,化合物包含修饰寡核苷酸或由其组成,所述修饰寡核苷酸由16至80个连接的核碱基组成并且具有包含seq id no:2
‑
10中的任一者所示的核碱基序列的核碱基序列,其中修饰寡核苷酸具有:
[0160]
间隙区段,其由连接的2
’‑
脱氧核苷组成;
[0161]5’
侧翼区段,其由连接核苷组成;以及
[0162]3’
侧翼区段,其由连接核苷组成;
[0163]
其中间隙区段位于5’侧翼区段与3’侧翼区段之间并且其中各侧翼区段的各核苷包含修饰的糖。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成。
[0164]
在某些实施方案中,化合物包含修饰寡核苷酸或由其组成,所述修饰寡核苷酸由16至80个连接的核碱基组成并且具有包含seq id no:36
‑
2646或2664
‑
2813中的任一者所示的核碱基序列的核碱基序列,其中修饰寡核苷酸具有:
[0165]
间隙区段,其由10个连接的2
’‑
脱氧核苷组成;
[0166]5’
侧翼区段,其由3个连接核苷组成;以及
[0167]3’
侧翼区段,其由3个连接核苷组成;
[0168]
其中间隙区段位于5’侧翼区段与3’侧翼区段之间;其中各侧翼区段的各核苷包含cet核苷;其中各核苷间键是硫代磷酸酯键;并且其中各胞嘧啶是5
‑
甲基胞嘧啶。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成。
[0169]
在某些实施方案中,化合物包含修饰寡核苷酸或由其组成,所述修饰寡核苷酸由16至80个连接的核碱基组成并且具有包含seq id no:2
‑
7中的任一者所示的核碱基序列的核碱基序列,其中修饰寡核苷酸具有:
[0170]
间隙区段,其由10个连接的2
’‑
脱氧核苷组成;
[0171]5’
侧翼区段,其由3个连接核苷组成;以及
[0172]3’
侧翼区段,其由3个连接核苷组成;
[0173]
其中间隙区段位于5’侧翼区段与3’侧翼区段之间;其中各侧翼区段的各核苷包含cet核苷;其中各核苷间键是硫代磷酸酯键;并且其中各胞嘧啶是5
‑
甲基胞嘧啶。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成。
[0174]
在某些实施方案中,化合物包含修饰寡核苷酸或由其组成,所述修饰寡核苷酸具有包含seq id no:8
‑
10中的任一者所示的核碱基序列的核碱基序列;其中修饰寡核苷酸包含糖基序kkk
‑
d
‑
y
‑
d(8)
‑
kkk,其中“k”指示cet修饰的糖部分,“d”指示未修饰的2
’‑
脱氧核糖基糖部分,并且“y”指示2
’‑
o
‑
甲基修饰的糖部分;其中各核苷间键是硫代磷酸酯键;并且其中各胞嘧啶是5
‑
甲基胞嘧啶。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成。
[0175]
在某些实施方案中,化合物包含具有核碱基序列和化学基序:gksgksakstdsuysadsadstdsgdstdsadsgdstdsgkstksak(seq id no:8)的ion 1304884或由其组成,其中“d”表示2
’‑
脱氧核糖,“k”表示cet修饰的糖,“y”表示2
’‑
o
‑
甲基修饰的糖,“s”表示硫代磷酸酯核苷间键,并且“mc”是指5
‑
甲基胞嘧啶。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成。
[0176]
在某些实施方案中,化合物包含具有核碱基序列和化学基序:gksgkstkstdsaystdsadsgdsmcdstdstdsgdsadsmcksaksak(seq id no:9)的ion 1304890或由其组成,其中“d”表示2
’‑
脱氧核糖,“k”表示cet修饰的糖,“y”表示2
’‑
o
‑
甲基修饰的糖,“s”表示硫代磷酸酯核苷间键,并且“mc”是指5
‑
甲基胞嘧啶。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成。
[0177]
在某些实施方案中,化合物包含具有核碱基序列和化学基序:gksmcksaksgdsaystdsadsadstdsgdstdstdsmcdstksmcksak(seq id no:10)的ion 1304906或由其组成,其中“d”表示2
’‑
脱氧核糖,“k”表示cet修饰的糖,“y”表示2
’‑
o
‑
甲基修饰的糖,“s”表示硫代磷酸酯核苷间键,并且“mc”是指5
‑
甲基胞嘧啶。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成。
[0178]
某些实施方案提供一种根据以下化学结构的修饰寡核苷酸:
[0179][0180]
(seq id no:6),或其盐。在某些实施方案中,修饰寡核苷酸是钠盐或钾盐。
[0181]
某些实施方案提供一种根据以下化学结构的修饰寡核苷酸:
[0182]
[0183]
(seq id no:6)。
[0184]
在某些条件下,本文所公开的某些化合物用作酸。尽管此类化合物可以以质子化(游离酸)形式或离子化并且结合阳离子(盐)形式来绘制或描述,但是此类化合物的水溶液以在此类形式之间平衡的状态存在。例如,水溶液中的寡核苷酸的磷酸酯键以在游离酸、阴离子和盐形式之间平衡的状态存在。除非另外指示,否则本文所述的化合物旨在包括所有此类形式。此外,某些寡核苷酸具有若干此类键,各键处于平衡状态。因此,溶液中的寡核苷酸以在多个位置均平衡的形式的整体形式存在。除非另外指示,否则本文所述的寡核苷酸和术语“寡核苷酸”旨在包括所有此类形式。所绘制结构必然描绘单一形式。然而,除非另外指示,否则此类图同样旨在包括对应形式。在本文中,描绘化合物的游离酸(后接术语“或其盐”)的结构明确包括可完全或部分质子化/去质子化/结合阳离子的所有此类形式。在某些情况下,鉴定出一个或多个特定阳离子。
[0185]
在前述实施方案中的任一项中,化合物或寡核苷酸可与编码malat1的核酸至少85%、至少90%、至少95%、至少98%、至少99%或100%互补。
[0186]
在前述实施方案中的任一项中,化合物可以是单链的。在某些实施方案中,化合物包含脱氧核糖核苷酸。在某些实施方案中,化合物是双链的。在某些实施方案中,化合物是双链的并且包含核糖核苷酸。在前述实施方案中的任一项中,化合物可以是反义化合物或寡聚化合物。
[0187]
在前述实施方案中的任一项中,化合物可由8至80个、10至30个、12至50个、13至30个、13至50个、14至30个、14至50个、15至30个、15至50个、16至30个、16至50个、17至30个、17至50个、18至22个、18至24个、18至30个、18至50个、19至22个、19至30个、19至50个或20至30个连接核苷组成。在某些实施方案中,化合物包含寡核苷酸或由其组成。
[0188]
在某些实施方案中,本文所提供的化合物或组合物包含修饰寡核苷酸的盐。在某些实施方案中,盐是钠盐。在某些实施方案中,盐是钾盐。
[0189]
在某些实施方案中,如本文所述的化合物或组合物是高度可耐受的,如通过以下至少一个所证明:与盐水处理的动物相比,丙氨酸转氨酶(alt)或天冬氨酸转氨酶(ast)值的增加不超过4倍、3倍或2倍;或者与对照处理的动物相比,肝、脾或肾重量的增加不超过30%、20%、15%、12%、10%、5%或2%。在某些实施方案中,如本文所述的化合物或组合物是高度可耐受的,如通过与对照处理的动物相比alt或ast未增加所证明。在某些实施方案中,如本文所述的化合物或组合物是高度可耐受的,如通过与对照动物相比肝、脾或肾重量未增加所证明。
[0190]
某些实施方案提供一种组合物,其包含前述实施方案中任一项所述的化合物或其盐以及至少一种药学上可接受的载剂或稀释剂。在某些实施方案中,组合物的粘度小于约40厘泊(cp)、小于约30厘泊(cp)、小于约20厘泊(cp)、小于约15厘泊(cp),或小于约10厘泊(cp)。在某些实施方案中,具有前述粘度中的任一者的组合物包含浓度为约100mg/ml、约125mg/ml、约150mg/ml、约175mg/ml、约200mg/ml、约225mg/ml、约250mg/ml、约275mg/ml或约300mg/ml的本文所提供的化合物。在某些实施方案中,具有前述粘度和/或化合物浓度中的任一者的组合物的温度为室温或约20℃、约21℃、约22℃、约23℃、约24℃、约25℃、约26℃、约27℃、约28℃、约29℃或约30℃。
[0191]
非限制性编号的实施方案包括:
[0192]
e1.一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸的长度为8至80个连接核苷并且具有包含核碱基序列seq id no:2
‑
10中的任一者的至少8个连续核碱基的核碱基序列。
[0193]
e2.一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸的长度为9至80个连接核苷并且具有包含核碱基序列seq id no:2
‑
10中的任一者的至少9个连续核碱基的核碱基序列。
[0194]
e3.一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸的长度为10至80个连接核苷并且具有包含核碱基序列seq id no:2
‑
10中的任一者的至少10个连续核碱基的核碱基序列。
[0195]
e4.一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸的长度为11至80个连接核苷并且具有包含核碱基序列seq id no:2
‑
10中的任一者的至少11个连续核碱基的核碱基序列。
[0196]
e5.一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸的长度为12至80个连接核苷并且具有包含核碱基序列seq id no:2
‑
10中的任一者的至少12个连续核碱基的核碱基序列。
[0197]
e6.一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸的长度为16至80个连接核苷并且具有包含seq id no:2
‑
10中的任一者的核碱基序列的核碱基序列。
[0198]
e7.一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸的长度为16个连接核苷并且具有由seq id no:2
‑
10中的任一者组成的核碱基序列。
[0199]
e8.一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸的长度为8至80个连接核苷并且在seq id no:1的核苷酸1535
‑
1550、2034
‑
2049、2341
‑
2356、4821
‑
4836、4840
‑
4855、4931
‑
4946、5049
‑
5064、5494
‑
5509或5495
‑
5510内互补。
[0200]
e9.如实施方案e1
‑
e8中任一项所述的化合物,其中所述修饰寡核苷酸包含至少一个修饰的核苷间键、至少一个修饰的糖或至少一个修饰的核碱基。
[0201]
e10.如实施方案e9所述的化合物,其中所述修饰的核苷间键是硫代磷酸酯核苷间键。
[0202]
e11.如实施方案e9或e10所述的化合物,其中所述修饰的糖是双环糖。
[0203]
e12.如实施方案e11所述的化合物,其中所述双环糖选自由以下组成的组:4
’‑
(ch2)
‑
o
‑2’
(lna);4
’‑
(ch2)2‑
o
‑2’
(ena);以及4
’‑
ch(ch3)
‑
o
‑2’
(cet)。
[0204]
e13.如实施方案e9或e10所述的化合物,其中所述修饰的糖是2
’‑
o
‑
甲氧基乙基。
[0205]
e14.如实施方案e9
‑
e13中任一项所述的化合物,其中所述修饰的核碱基是5
‑
甲基胞嘧啶。
[0206]
e15.如实施方案e1
‑
e14中任一项所述的化合物,其中所述修饰寡核苷酸包含:
[0207]
间隙区段,其由连接的2
’‑
脱氧核苷组成;
[0208]5’
侧翼区段,其由连接核苷组成;以及
[0209]3’
侧翼区段,其由连接核苷组成;
[0210]
其中所述间隙区段位于所述5’侧翼区段与所述3’侧翼区段之间并且其中各侧翼区段的各核苷包含修饰的糖。
[0211]
e16.一种化合物,其包含修饰寡核苷酸,所述修饰寡核苷酸的长度为16至80个连
接核苷并且具有包含seq id no:2
‑
10中的任一者的核碱基序列,其中所述修饰寡核苷酸包含:
[0212]
间隙区段,其由连接的2
’‑
脱氧核苷组成;
[0213]5’
侧翼区段,其由连接核苷组成;以及
[0214]3’
侧翼区段,其由连接核苷组成;
[0215]
其中所述间隙区段位于所述5’侧翼区段与所述3’侧翼区段之间并且其中各侧翼区段的各核苷包含修饰的糖。
[0216]
e17.一种化合物,其包含长度为16
‑
80个连接的核碱基的修饰寡核苷酸,所述修饰寡核苷酸具有包含seq id no:2
‑
7中的任一者所示的序列的核碱基序列,其中所述修饰寡核苷酸包含:
[0217]
间隙区段,其由10个连接的2
’‑
脱氧核苷组成;
[0218]5’
侧翼区段,其由3个连接核苷组成;以及
[0219]3’
侧翼区段,其由3个连接核苷组成;
[0220]
其中所述间隙区段位于所述5’侧翼区段与所述3’侧翼区段之间,其中各侧翼区段的各核苷包含cet核苷;其中各核苷间键是硫代磷酸酯键;并且其中各胞嘧啶是5
‑
甲基胞嘧啶。
[0221]
e18.如实施方案e1
‑
e17中任一项所述的化合物,其中所述寡核苷酸与seq id no:1至少80%、85%、90%、95%或100%互补。
[0222]
e19.如实施方案e1
‑
e18中任一项所述的化合物,其中所述化合物是单链的。
[0223]
e20.如实施方案e1
‑
e18中任一项所述的化合物,其中所述化合物是双链的。
[0224]
e21.如实施方案e1
‑
e20中任一项所述的化合物,其中所述化合物包含核糖核苷酸。
[0225]
e22.如实施方案e1
‑
e20中任一项所述的化合物,其中所述化合物包含脱氧核糖核苷酸。
[0226]
e23.如实施方案e1
‑
e22中任一项所述的化合物,其中所述修饰寡核苷酸由16至30个连接核苷组成。
[0227]
e24.如前述实施方案中任一项所述的化合物,其中所述化合物由所述修饰寡核苷酸组成。
[0228]
e25.一种化合物,其由如实施方案e1
‑
e24所述的化合物中的任一者的药学上可接受的盐组成。
[0229]
e26.如实施方案25所述的化合物,其中所述药学上可接受的盐是钠盐。
[0230]
e27.如实施方案26所述的化合物,其中所述药学上可接受的盐是钾盐。
[0231]
e28.一种根据以下化学结构的修饰寡核苷酸:
[0232][0233]
(seq id no:6),或其盐。
[0234]
e29.如实施方案e28所述的修饰寡核苷酸,其中所述修饰寡核苷酸是所述钠盐或所述钾盐。
[0235]
e30.一种根据以下化学结构的修饰寡核苷酸:
[0236][0237]
(seq id no:6)。
[0238]
e31.一种组合物,其包含如实施方案e1
‑
e27中任一项所述的化合物或如实施方案e28
‑
e30中任一项所述的修饰寡核苷酸以及药学上可接受的稀释剂或载剂。
[0239]
e32.一种组合物,其包含如实施方案e1
‑
e27中任一项所述的化合物或如实施方案e28
‑
e30中任一项所述的修饰寡核苷酸以及水。
[0240]
e33.一种组合物,其包含如实施方案e1
‑
e27中任一项所述的化合物或如实施方案e28
‑
e30中任一项所述的修饰寡核苷酸,所述组合物用于疗法。
[0241]
e34.一种治疗或改善个体中的癌症的方法,其包括向所述个体施用靶向malat1的化合物,从而治疗或改善所述癌症。
[0242]
e35.如实施方案e34所述的方法,其中所述化合物是靶向malat1的反义化合物。
[0243]
e36.如实施方案e34或e35所述的方法,其中所述癌症是乳腺癌;炎症性乳腺癌;乳腺导管癌;乳腺小叶癌;管状a型乳腺癌;管状b型乳腺癌;基底细胞样乳腺癌;her2阳性(her2 )乳腺癌;her2阴性(her2
‑
)乳腺癌;雌激素受体阴性(er
‑
)乳腺癌;雌激素受体阳性(er )乳腺癌;黄体酮受体阴性(pr
‑
)乳腺癌;黄体酮受体阳性(pr )乳腺癌;er阳性(er )且pr阳性(pr )乳腺癌;er阳性(er )且pr阴性(pr
‑
)乳腺癌;er阴性(er
‑
)且pr阳性(pr )乳腺癌;er阳性(er )且her2阴性(her2
‑
)乳腺癌;er
‑
、pr
‑
且her2
‑
三阴性乳腺癌(er
‑
、pr
‑
、her2
‑
;tnbc);激素受体阴性乳腺癌(er
‑
且pr
‑
);er 、pr 且her2 三阳性乳腺癌(er 、pr 、her2 ;tpbc);肝细胞癌(hcc);头颈部鳞状细胞癌(hnscc);口腔舌头鳞状细胞癌(otscc);肉瘤(例如,上皮样肉瘤、横纹肌样肉瘤和滑膜肉瘤);食道癌;胃癌;卵巢癌;胰腺癌;肺癌;非小细胞肺癌(nsclc);小细胞肺癌(sclc);鳞状细胞癌(scc);头颈癌;头颈部鳞状细胞癌(hnscc);胃肠道癌症;大肠癌;小肠癌;胃癌;结肠癌;结肠直肠癌;膀胱癌;肝癌;胆道癌;泌
尿上皮癌;子宫内膜癌;宫颈癌;前列腺癌;间皮瘤;脊索瘤;肾癌;肾细胞癌(rcc);脑癌;成神经细胞瘤;成胶质细胞瘤;皮肤癌;黑素瘤;基底细胞癌;默克尔细胞癌;血癌;造血系统癌症;骨髓瘤;多发性骨髓瘤(mm);b细胞恶性肿瘤;淋巴瘤;b细胞淋巴瘤;霍奇金淋巴瘤;t细胞淋巴瘤;白血病;或急性淋巴细胞性白血病(all)。
[0244]
e37.如实施方案e34
‑
e36中任一项所述的方法,其中施用所述化合物抑制或减少癌细胞增殖、癌细胞迁移、癌细胞分支形态发生、肿瘤进展、肿瘤生长或转移。
[0245]
e38.如实施方案e34
‑
e37中任一项所述的方法,其中施用所述化合物增加或诱导癌细胞分化、癌细胞粘附或肿瘤分化。
[0246]
e39.如实施方案e34
‑
e38中任一项所述的方法,其中施用所述化合物诱导癌细胞或肿瘤具有囊状、导管状或腺泡状表型或形态。
[0247]
e40.如实施方案e34
‑
e39中任一项所述的方法,其中施用所述化合物诱导癌细胞或肿瘤具有更加分化的表型或结构。
[0248]
e41.如实施方案e40所述的方法,其中所述更加分化的表型或结构包括存在分泌脂质小滴、桥粒结构增加、导管结构极化,或e
‑
钙粘蛋白或酪蛋白水平增加。
[0249]
e42.一种抑制癌细胞中的malat1的表达的方法,其包括使所述癌细胞与靶向malat1的化合物接触,从而抑制所述癌细胞中的malat1的表达。
[0250]
e43.如实施方案e42所述的方法,其中所述癌症是乳腺癌;炎症性乳腺癌;乳腺导管癌;乳腺小叶癌;管状a型乳腺癌;管状b型乳腺癌;基底细胞样乳腺癌;her2阳性(her2 )乳腺癌;her2阴性(her2
‑
)乳腺癌;雌激素受体阴性(er
‑
)乳腺癌;雌激素受体阳性(er )乳腺癌;黄体酮受体阴性(pr
‑
)乳腺癌;黄体酮受体阳性(pr )乳腺癌;er阳性(er )且pr阳性(pr )乳腺癌;er阳性(er )且pr阴性(pr
‑
)乳腺癌;er阴性(er
‑
)且pr阳性(pr )乳腺癌;er阳性(er )且her2阴性(her2
‑
)乳腺癌;er
‑
、pr
‑
且her2
‑
三阴性乳腺癌(er
‑
、pr
‑
、her2
‑
;tnbc);激素受体阴性乳腺癌(er
‑
且pr
‑
);er 、pr 且her2 三阳性乳腺癌(er 、pr 、her2 ;tpbc);肝细胞癌(hcc);头颈部鳞状细胞癌(hnscc);口腔舌头鳞状细胞癌(otscc);肉瘤(例如,上皮样肉瘤、横纹肌样肉瘤和滑膜肉瘤);食道癌;胃癌;卵巢癌;胰腺癌;肺癌;非小细胞肺癌(nsclc);小细胞肺癌(sclc);鳞状细胞癌(scc);头颈癌;头颈部鳞状细胞癌(hnscc);胃肠道癌症;大肠癌;小肠癌;胃癌;结肠癌;结肠直肠癌;膀胱癌;肝癌;胆道癌;泌尿上皮癌;子宫内膜癌;宫颈癌;前列腺癌;间皮瘤;脊索瘤;肾癌;肾细胞癌(rcc);脑癌;成神经细胞瘤;成胶质细胞瘤;皮肤癌;黑素瘤;基底细胞癌;默克尔细胞癌;血癌;造血系统癌症;骨髓瘤;多发性骨髓瘤(mm);b细胞恶性肿瘤;淋巴瘤;b细胞淋巴瘤;霍奇金淋巴瘤;t细胞淋巴瘤;白血病;或急性淋巴细胞性白血病(all)。
[0251]
e44.一种减少或抑制患有癌症的个体中的癌细胞增殖、癌细胞迁移、癌细胞分支形态发生、肿瘤进展、肿瘤生长或转移的方法,其包括向所述个体施用靶向malat1的化合物,从而在所述个体中减少或抑制癌细胞增殖、癌细胞迁移、癌细胞分支形态发生、肿瘤进展、肿瘤生长或转移。
[0252]
e45.一种增加或诱导患有癌症的个体中的癌细胞分化、癌细胞粘附或肿瘤分化的方法,其包括向所述个体施用靶向malat1的化合物,从而在所述个体中增加或诱导癌细胞分化、癌细胞粘附或肿瘤分化。
[0253]
e46.一种在患有癌症的个体中诱导癌细胞或肿瘤具有囊状、导管状或腺泡状表型
或形态的方法,其包括向所述个体施用靶向malat1的化合物,从而诱导所述癌细胞或肿瘤具有囊状、导管状或腺泡状表型或形态。
[0254]
e47.一种诱导癌细胞或肿瘤具有更加分化的表型或结构的方法,其包括向个体施用靶向malat1的化合物,从而诱导所述癌细胞或肿瘤具有更加分化的表型或结构。
[0255]
e48.如实施方案e47所述的方法,其中所述更加分化的表型或结构包括存在分泌脂质小滴、桥粒结构增加、导管结构极化,或e
‑
钙粘蛋白或酪蛋白水平增加。
[0256]
e49.如实施方案e44
‑
e48中任一项所述的方法,其中所述个体患有乳腺癌;炎症性乳腺癌;乳腺导管癌;乳腺小叶癌;管状a型乳腺癌;管状b型乳腺癌;基底细胞样乳腺癌;her2阳性(her2 )乳腺癌;her2阴性(her2
‑
)乳腺癌;雌激素受体阴性(er
‑
)乳腺癌;雌激素受体阳性(er )乳腺癌;黄体酮受体阴性(pr
‑
)乳腺癌;黄体酮受体阳性(pr )乳腺癌;er阳性(er )且pr阳性(pr )乳腺癌;er阳性(er )且pr阴性(pr
‑
)乳腺癌;er阴性(er
‑
)且pr阳性(pr )乳腺癌;er阳性(er )且her2阴性(her2
‑
)乳腺癌;er
‑
、pr
‑
且her2
‑
三阴性乳腺癌(er
‑
、pr
‑
、her2
‑
;tnbc);激素受体阴性乳腺癌(er
‑
且pr
‑
);er 、pr 且her2 三阳性乳腺癌(er 、pr 、her2 ;tpbc);肝细胞癌(hcc);头颈部鳞状细胞癌(hnscc);口腔舌头鳞状细胞癌(otscc);肉瘤(例如,上皮样肉瘤、横纹肌样肉瘤和滑膜肉瘤);食道癌;胃癌;卵巢癌;胰腺癌;肺癌;非小细胞肺癌(nsclc);小细胞肺癌(sclc);鳞状细胞癌(scc);头颈癌;头颈部鳞状细胞癌(hnscc);胃肠道癌症;大肠癌;小肠癌;胃癌;结肠癌;结肠直肠癌;膀胱癌;肝癌;胆道癌;泌尿上皮癌;子宫内膜癌;宫颈癌;前列腺癌;间皮瘤;脊索瘤;肾癌;肾细胞癌(rcc);脑癌;成神经细胞瘤;成胶质细胞瘤;皮肤癌;黑素瘤;基底细胞癌;默克尔细胞癌;血癌;造血系统癌症;骨髓瘤;多发性骨髓瘤(mm);b细胞恶性肿瘤;淋巴瘤;b细胞淋巴瘤;霍奇金淋巴瘤;t细胞淋巴瘤;白血病;或急性淋巴细胞性白血病(all)。
[0257]
e50.如实施方案e34
‑
e49中任一项所述的方法,其中所述化合物是靶向malat1的反义化合物。
[0258]
e51.如实施方案e34
‑
e49中任一项所述的方法,其中所述化合物是如实施方案e1
‑
e27中任一项所述的化合物、如实施方案e28
‑
e30中任一项所述的修饰寡核苷酸,或如实施方案e31或e32所述的组合物。
[0259]
e52.如实施方案e34
‑
e51中任一项所述的方法,其中所述化合物是通过肠胃外施用的。
[0260]
e53.靶向malat1的化合物用于治疗、预防或改善与malat1相关的癌症的用途。
[0261]
e54.如实施方案e53所述的用途,其中所述癌症是乳腺癌;炎症性乳腺癌;乳腺导管癌;乳腺小叶癌;管状a型乳腺癌;管状b型乳腺癌;基底细胞样乳腺癌;her2阳性(her2 )乳腺癌;her2阴性(her2
‑
)乳腺癌;雌激素受体阴性(er
‑
)乳腺癌;雌激素受体阳性(er )乳腺癌;黄体酮受体阴性(pr
‑
)乳腺癌;黄体酮受体阳性(pr )乳腺癌;er阳性(er )且pr阳性(pr )乳腺癌;er阳性(er )且pr阴性(pr
‑
)乳腺癌;er阴性(er
‑
)且pr阳性(pr )乳腺癌;er阳性(er )且her2阴性(her2
‑
)乳腺癌;er
‑
、pr
‑
且her2
‑
三阴性乳腺癌(er
‑
、pr
‑
、her2
‑
;tnbc);激素受体阴性乳腺癌(er
‑
且pr
‑
);er 、pr 且her2 三阳性乳腺癌(er 、pr 、her2 ;tpbc);肝细胞癌(hcc);头颈部鳞状细胞癌(hnscc);口腔舌头鳞状细胞癌(otscc);肉瘤(例如,上皮样肉瘤、横纹肌样肉瘤和滑膜肉瘤);食道癌;胃癌;卵巢癌;胰腺癌;肺癌;非小细胞肺癌(nsclc);小细胞肺癌(sclc);鳞状细胞癌(scc);头颈癌;头颈部鳞状细胞癌(hnscc);
胃肠道癌症;大肠癌;小肠癌;胃癌;结肠癌;结肠直肠癌;膀胱癌;肝癌;胆道癌;泌尿上皮癌;子宫内膜癌;宫颈癌;前列腺癌;间皮瘤;脊索瘤;肾癌;肾细胞癌(rcc);脑癌;成神经细胞瘤;成胶质细胞瘤;皮肤癌;黑素瘤;基底细胞癌;默克尔细胞癌;血癌;造血系统癌症;骨髓瘤;多发性骨髓瘤(mm);b细胞恶性肿瘤;淋巴瘤;b细胞淋巴瘤;霍奇金淋巴瘤;t细胞淋巴瘤;白血病;或急性淋巴细胞性白血病(all)。
[0262]
e55.如实施方案e53或e54所述的用途,其中所述化合物是靶向malat1的反义化合物。
[0263]
e56.如实施方案e53
‑
e55中任一项所述的用途,其中所述化合物是如实施方案e1
‑
e27中任一项所述的化合物、如实施方案e28
‑
e30中任一项所述的修饰寡核苷酸,或如实施方案e31或e32所述的组合物。
[0264]
e57.靶向malat1的化合物在制造用于治疗或改善与malat1相关的癌症的药物中的用途。
[0265]
e58.如实施方案e57所述的用途,其中所述癌症是乳腺癌;炎症性乳腺癌;乳腺导管癌;乳腺小叶癌;管状a型乳腺癌;管状b型乳腺癌;基底细胞样乳腺癌;her2阳性(her2 )乳腺癌;her2阴性(her2
‑
)乳腺癌;雌激素受体阴性(er
‑
)乳腺癌;雌激素受体阳性(er )乳腺癌;黄体酮受体阴性(pr
‑
)乳腺癌;黄体酮受体阳性(pr )乳腺癌;er阳性(er )且pr阳性(pr )乳腺癌;er阳性(er )且pr阴性(pr
‑
)乳腺癌;er阴性(er
‑
)且pr阳性(pr )乳腺癌;er阳性(er )且her2阴性(her2
‑
)乳腺癌;er
‑
、pr
‑
且her2
‑
三阴性乳腺癌(er
‑
、pr
‑
、her2
‑
;tnbc);激素受体阴性乳腺癌(er
‑
且pr
‑
);er 、pr 且her2 三阳性乳腺癌(er 、pr 、her2 ;tpbc);肝细胞癌(hcc);头颈部鳞状细胞癌(hnscc);口腔舌头鳞状细胞癌(otscc);肉瘤(例如,上皮样肉瘤、横纹肌样肉瘤和滑膜肉瘤);食道癌;胃癌;卵巢癌;胰腺癌;肺癌;非小细胞肺癌(nsclc);小细胞肺癌(sclc);鳞状细胞癌(scc);头颈癌;头颈部鳞状细胞癌(hnscc);胃肠道癌症;大肠癌;小肠癌;胃癌;结肠癌;结肠直肠癌;膀胱癌;肝癌;胆道癌;泌尿上皮癌;子宫内膜癌;宫颈癌;前列腺癌;间皮瘤;脊索瘤;肾癌;肾细胞癌(rcc);脑癌;成神经细胞瘤;成胶质细胞瘤;皮肤癌;黑素瘤;基底细胞癌;默克尔细胞癌;血癌;造血系统癌症;骨髓瘤;多发性骨髓瘤(mm);b细胞恶性肿瘤;淋巴瘤;b细胞淋巴瘤;霍奇金淋巴瘤;t细胞淋巴瘤;白血病;或急性淋巴细胞性白血病(all)。
[0266]
e59.如实施方案e57或e58所述的用途,其中所述化合物是靶向malat1的反义化合物。
[0267]
e60.如实施方案e57
‑
e59中任一项所述的用途,其中所述化合物是如实施方案e1
‑
e27中任一项所述的化合物、如实施方案e28
‑
e30中任一项所述的修饰寡核苷酸,或如实施方案e31或e32所述的组合物。
[0268]
e61.靶向malat1的化合物在制备用于治疗或改善与malat1相关的癌症的药物中的用途。
[0269]
e62.如实施方案e61所述的用途,其中所述癌症是乳腺癌;炎症性乳腺癌;乳腺导管癌;乳腺小叶癌;管状a型乳腺癌;管状b型乳腺癌;基底细胞样乳腺癌;her2阳性(her2 )乳腺癌;her2阴性(her2
‑
)乳腺癌;雌激素受体阴性(er
‑
)乳腺癌;雌激素受体阳性(er )乳腺癌;黄体酮受体阴性(pr
‑
)乳腺癌;黄体酮受体阳性(pr )乳腺癌;er阳性(er )且pr阳性(pr )乳腺癌;er阳性(er )且pr阴性(pr
‑
)乳腺癌;er阴性(er
‑
)且pr阳性(pr )乳腺癌;er
阳性(er )且her2阴性(her2
‑
)乳腺癌;er
‑
、pr
‑
且her2
‑
三阴性乳腺癌(er
‑
、pr
‑
、her2
‑
;tnbc);激素受体阴性乳腺癌(er
‑
且pr
‑
);er 、pr 且her2 三阳性乳腺癌(er 、pr 、her2 ;tpbc);肝细胞癌(hcc);头颈部鳞状细胞癌(hnscc);口腔舌头鳞状细胞癌(otscc);肉瘤(例如,上皮样肉瘤、横纹肌样肉瘤和滑膜肉瘤);食道癌;胃癌;卵巢癌;胰腺癌;肺癌;非小细胞肺癌(nsclc);小细胞肺癌(sclc);鳞状细胞癌(scc);头颈癌;头颈部鳞状细胞癌(hnscc);胃肠道癌症;大肠癌;小肠癌;胃癌;结肠癌;结肠直肠癌;膀胱癌;肝癌;胆道癌;泌尿上皮癌;子宫内膜癌;宫颈癌;前列腺癌;间皮瘤;脊索瘤;肾癌;肾细胞癌(rcc);脑癌;成神经细胞瘤;成胶质细胞瘤;皮肤癌;黑素瘤;基底细胞癌;默克尔细胞癌;血癌;造血系统癌症;骨髓瘤;多发性骨髓瘤(mm);b细胞恶性肿瘤;淋巴瘤;b细胞淋巴瘤;霍奇金淋巴瘤;t细胞淋巴瘤;白血病;或急性淋巴细胞性白血病(all)。
[0270]
e63.如实施方案e61或e62所述的用途,其中所述化合物是靶向malat1的反义化合物。
[0271]
e64.如实施方案e61
‑
e63中任一项所述的用途,其中所述化合物是如实施方案e1
‑
e27中任一项所述的化合物、如实施方案e28
‑
e30中任一项所述的修饰寡核苷酸,或如实施方案e31或e32所述的组合物。
[0272]
某些适应症
[0273]
本文所提供的某些实施方案涉及抑制malat1表达的方法,其可用于通过施用靶向malat1的化合物来治疗、预防或改善个体中与malat1相关的癌症。在某些实施方案中,化合物可以是malat1特异性抑制剂。在某些实施方案中,化合物可以是靶向malat1的反义化合物、寡聚化合物或寡核苷酸。
[0274]
可用本文所提供的化合物和方法治疗、预防和/或改善的与malat1相关的癌症的实例包括乳腺癌;炎症性乳腺癌;乳腺导管癌;乳腺小叶癌;管状a型乳腺癌;管状b型乳腺癌;基底细胞样乳腺癌;her2阳性(her2 )乳腺癌;her2阴性(her2
‑
)乳腺癌;雌激素受体阴性(er
‑
)乳腺癌;雌激素受体阳性(er )乳腺癌;黄体酮受体阴性(pr
‑
)乳腺癌;黄体酮受体阳性(pr )乳腺癌;er阳性(er )且pr阳性(pr )乳腺癌;er阳性(er )且pr阴性(pr
‑
)乳腺癌;er阴性(er
‑
)且pr阳性(pr )乳腺癌;er阳性(er )且her2阴性(her2
‑
)乳腺癌;er
‑
、pr
‑
且her2
‑
三阴性乳腺癌(er
‑
、pr
‑
、her2
‑
;tnbc);激素受体阴性乳腺癌(er
‑
且pr
‑
);er 、pr 且her2 三阳性乳腺癌(er 、pr 、her2 ;tpbc);肝细胞癌(hcc);头颈部鳞状细胞癌(hnscc);口腔舌头鳞状细胞癌(otscc);肉瘤(例如,上皮样肉瘤、横纹肌样肉瘤和滑膜肉瘤);食道癌;胃癌;卵巢癌;胰腺癌;肺癌;非小细胞肺癌(nsclc);小细胞肺癌(sclc);鳞状细胞癌(scc);头颈癌;头颈部鳞状细胞癌(hnscc);胃肠道癌症;大肠癌;小肠癌;胃癌;结肠癌;结肠直肠癌;膀胱癌;肝癌;胆道癌;泌尿上皮癌;子宫内膜癌;宫颈癌;前列腺癌;间皮瘤;脊索瘤;肾癌;肾细胞癌(rcc);脑癌;成神经细胞瘤;成胶质细胞瘤;皮肤癌;黑素瘤;基底细胞癌;默克尔细胞癌;血癌;造血系统癌症;骨髓瘤;多发性骨髓瘤(mm);b细胞恶性肿瘤;淋巴瘤;b细胞淋巴瘤;霍奇金淋巴瘤;t细胞淋巴瘤;白血病;或急性淋巴细胞性白血病(all)。
[0275]
在某些实施方案中,乳腺癌具有以下特征中的一个或多个:雄激素受体阳性,生长依赖于雄激素;雌激素受体(er)阴性,生长不依赖于雌激素;黄体酮受体(pr)阴性,生长不依赖于黄体酮;或her2/neu阴性。在某些实施方案中,乳腺癌是er、pr和her2三阴性(er
‑
、
pr
‑
、her2
‑
)乳腺癌。在某些实施方案中,乳腺癌是三阴性且ar阳性(er
‑
、pr
‑
、her2
‑
、ar )的乳腺癌。在某些实施方案中,乳腺癌是er阴性且ar阳性(er
‑
、ar )的乳腺癌。在某些实施方案中,乳腺癌是er阳性且ar阳性(er 、ar )的乳腺癌。在某些实施方案中,乳腺癌是大汗腺型乳腺癌。大汗腺型乳腺癌常常是“三阴性”大汗腺型乳腺癌,是指细胞不表达er、pr或her2受体,并且通常但不必然是ar阳性的。在某些实施方案中,大汗腺型乳腺癌是er、pr和her2三阴性且ar阳性(er
‑
、pr
‑
、her2
‑
、ar )的大汗腺型乳腺癌。在某些实施方案中,大汗腺型乳腺癌是er阴性且ar阳性(er
‑
、ar )的大汗腺型乳腺癌。在某些实施方案中,大汗腺型乳腺癌起源于乳房汗腺。在某些实施方案中,大汗腺型乳腺癌是乳房的导管癌或癌细胞。在某些实施方案中,大汗腺型乳腺癌可以具有以下特征中的任何一个或多个:大量嗜伊红性粒状细胞质;边缘清晰;大的泡状核;细胞核与细胞质的比率为约1:2;和/或顶端细胞质中分泌颗粒(称为顶突(apical snout))的积聚。在某些实施方案中,乳腺癌是er阴性且ar阳性(er
‑
、ar )的分子大汗腺型乳腺癌。在某些方面,er阴性且ar阳性(er
‑
、ar )的分子大汗腺型乳腺癌可进一步是pr阳性、pr阴性、her2阴性或her2阳性的分子大汗腺型乳腺癌。在某些实施方案中,乳腺癌是her2阳性乳腺癌。在某些实施方案中,乳腺癌是pr阳性乳腺癌。在某些实施方案中,乳腺癌是er阳性乳腺癌。乳腺癌可以通过标准组织学技术鉴定为关于激素受体(诸如er、pr或her2)是阳性或阴性的。例如,在一些实施方案中,根据相关asco和cap指南,当少于1%的细胞展示出针对雌激素和黄体酮受体的细胞核染色,并且针对her2的免疫组织化学染色显示出0、1倍或2倍阳性分数并且fish比率(her2基因信号与染色体17信号的比率)小于1.8时,组织学乳腺癌样品可以分类为“三阴性”(er
‑
、pr
‑
、her2
‑
)。(meyer,p.等人,plos one 7(5):e38361(2012))。
[0276]
在某些实施方案中,b细胞淋巴瘤是非霍奇金b细胞淋巴瘤。可以用本文所提供的化合物治疗的某些实施方案的非霍奇金b细胞淋巴瘤的实例包括但不限于弥漫型大b细胞淋巴瘤(dlbcl)、活化型b细胞淋巴瘤(abc
‑
dlbcl)、生发中心b细胞淋巴瘤(gcb dlbcl)、滤泡型淋巴瘤、粘膜相关淋巴组织淋巴瘤(malt)、小细胞淋巴细胞性淋巴瘤、慢性淋巴细胞性白血病、套细胞淋巴瘤(mcl)、伯基特淋巴瘤、纵膈大b细胞淋巴瘤、华氏巨球蛋白血症(macroglobulinemia)、结节边缘区型b细胞淋巴瘤(nmzl)、脾边缘区淋巴瘤(smzl)、血管内大b细胞淋巴瘤、原发性渗出性淋巴瘤以及淋巴瘤样肉芽肿。
[0277]
在某些实施方案中,可以用本文所提供的化合物治疗的t细胞淋巴瘤包括但不限于外周t细胞淋巴瘤和间变性大细胞淋巴瘤(alcl)。
[0278]
在某些实施方案中,可以用本文所提供的化合物治疗的白血病包括但不限于急性淋巴细胞性白血病(all)。
[0279]
在某些实施方案中,治疗、预防或改善个体中与malat1相关的癌症的方法包括向个体施用包含malat1特异性抑制剂的化合物,从而治疗、预防或改善癌症。在某些实施方案中,化合物包含靶向malat1的反义化合物。在某些实施方案中,化合物包含靶向malat1的寡核苷酸。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:2
‑
10中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:2
‑
10中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物包含由seq id no:2
‑
10中的任一者的核碱基序列组成的修饰寡核苷
酸。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:36
‑
2646或2664
‑
2813中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:36
‑
2646或2664
‑
2813中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物包含由seq id no:36
‑
2646或2664
‑
2813中的任一者的核碱基序列组成的修饰寡核苷酸。在前述实施方案中的任一项中,修饰寡核苷酸可以由10至30个连接核苷组成。在某些实施方案中,化合物是ion 1157034、1157111、1157190、1157929、1158161、1158162、1304884、1304890或1304906。在前述实施方案中的任一项中,化合物可以是单链或双链的。在前述实施方案中的任一项中,化合物可以是反义化合物或寡聚化合物。在某些实施方案中,向个体肠胃外施用化合物。在某些实施方案中,施用化合物抑制或减少癌细胞增殖、癌细胞迁移、癌细胞分支形态发生、肿瘤进展、肿瘤生长或转移。在某些实施方案中,施用化合物增加或诱导癌细胞分化、癌细胞粘附或肿瘤分化。在某些实施方案中,施用化合物诱导乳腺癌细胞或乳房肿瘤具有囊状、导管状或腺泡状表型或形态。在某些实施方案中,施用化合物诱导乳腺癌细胞或乳房肿瘤具有更加分化的表型或结构。在某些实施方案中,更加分化的表型或结构包括但不限于存在分泌脂质小滴、桥粒结构增加、导管结构极化,或诸如e
‑
钙粘蛋白或乳蛋白(诸如酪蛋白)的分化标志物的水平增加。
[0280]
在某些实施方案中,治疗或改善癌症的方法包括向个体施用包含malat1特异性抑制剂的化合物,从而治疗或改善癌症。在某些实施方案中,癌症是乳腺癌;炎症性乳腺癌;乳腺导管癌;乳腺小叶癌;管状a型乳腺癌;管状b型乳腺癌;基底细胞样乳腺癌;her2阳性(her2 )乳腺癌;her2阴性(her2
‑
)乳腺癌;雌激素受体阴性(er
‑
)乳腺癌;雌激素受体阳性(er )乳腺癌;黄体酮受体阴性(pr
‑
)乳腺癌;黄体酮受体阳性(pr )乳腺癌;er阳性(er )且pr阳性(pr )乳腺癌;er阳性(er )且pr阴性(pr
‑
)乳腺癌;er阴性(er
‑
)且pr阳性(pr )乳腺癌;er阳性(er )且her2阴性(her2
‑
)乳腺癌;er
‑
、pr
‑
且her2
‑
三阴性乳腺癌(er
‑
、pr
‑
、her2
‑
;tnbc);激素受体阴性乳腺癌(er
‑
且pr
‑
);er 、pr 且her2 三阳性乳腺癌(er 、pr 、her2 ;tpbc);肝细胞癌(hcc);头颈部鳞状细胞癌(hnscc);口腔舌头鳞状细胞癌(otscc);肉瘤(例如,上皮样肉瘤、横纹肌样肉瘤和滑膜肉瘤);食道癌;胃癌;卵巢癌;胰腺癌;肺癌;非小细胞肺癌(nsclc);小细胞肺癌(sclc);鳞状细胞癌(scc);头颈癌;头颈部鳞状细胞癌(hnscc);胃肠道癌症;大肠癌;小肠癌;胃癌;结肠癌;结肠直肠癌;膀胱癌;肝癌;胆道癌;泌尿上皮癌;子宫内膜癌;宫颈癌;前列腺癌;间皮瘤;脊索瘤;肾癌;肾细胞癌(rcc);脑癌;成神经细胞瘤;成胶质细胞瘤;皮肤癌;黑素瘤;基底细胞癌;默克尔细胞癌;血癌;造血系统癌症;骨髓瘤;多发性骨髓瘤(mm);b细胞恶性肿瘤;淋巴瘤;b细胞淋巴瘤;霍奇金淋巴瘤;t细胞淋巴瘤;白血病;或急性淋巴细胞性白血病(all)。在某些实施方案中,化合物包含靶向malat1的反义化合物。在某些实施方案中,化合物包含靶向malat1的寡核苷酸。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:2
‑
10中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:2
‑
10中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物包含由seq id no:2
‑
10中的任一者的核碱基序列组成的修饰寡核苷酸。在某些实施方案
中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:36
‑
2646或2664
‑
2813中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:36
‑
2646或2664
‑
2813中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物包含由seq id no:36
‑
2646或2664
‑
2813中的任一者的核碱基序列组成的修饰寡核苷酸。在前述实施方案中的任一项中,修饰寡核苷酸可以由10至30个连接核苷组成。在某些实施方案中,化合物是ion 1157034、1157111、1157190、1157929、1158161、1158162、1304884、1304890或1304906。在前述实施方案中的任一项中,化合物可以是单链或双链的。在前述实施方案中的任一项中,化合物可以是反义化合物或寡聚化合物。在某些实施方案中,向个体肠胃外施用化合物。在某些实施方案中,施用化合物抑制或减少癌细胞增殖、癌细胞迁移、癌细胞分支形态发生、肿瘤进展、肿瘤生长或转移。在某些实施方案中,施用化合物增加或诱导癌细胞分化、癌细胞粘附或肿瘤分化。在某些实施方案中,施用化合物诱导乳腺癌细胞或乳房肿瘤具有囊状、导管状或腺泡状表型或形态。在某些实施方案中,施用化合物诱导乳腺癌细胞或乳房肿瘤具有更加分化的表型或结构。在某些实施方案中,更加分化的表型或结构包括但不限于存在分泌脂质小滴、桥粒结构增加、导管结构极化,或诸如e
‑
钙粘蛋白或乳蛋白(诸如酪蛋白)的分化标志物的水平增加。
[0281]
在某些实施方案中,个体被鉴定为患有与malat1相关的癌症或有此风险。
[0282]
在某些实施方案中,抑制患有与malat1相关的癌症或有此风险的个体中的malat1表达的方法包括向个体施用包含malat1特异性抑制剂的化合物,从而抑制个体中的malat1表达。在某些实施方案中,施用化合物抑制乳房中的malat1表达。在某些实施方案中,个体患有以下癌症或有此风险:乳腺癌;炎症性乳腺癌;乳腺导管癌;乳腺小叶癌;管状a型乳腺癌;管状b型乳腺癌;基底细胞样乳腺癌;her2阳性(her2 )乳腺癌;her2阴性(her2
‑
)乳腺癌;雌激素受体阴性(er
‑
)乳腺癌;雌激素受体阳性(er )乳腺癌;黄体酮受体阴性(pr
‑
)乳腺癌;黄体酮受体阳性(pr )乳腺癌;er阳性(er )且pr阳性(pr )乳腺癌;er阳性(er )且pr阴性(pr
‑
)乳腺癌;er阴性(er
‑
)且pr阳性(pr )乳腺癌;er阳性(er )且her2阴性(her2
‑
)乳腺癌;er
‑
、pr
‑
且her2
‑
三阴性乳腺癌(er
‑
、pr
‑
、her2
‑
;tnbc);激素受体阴性乳腺癌(er
‑
且pr
‑
);er 、pr 且her2 三阳性乳腺癌(er 、pr 、her2 ;tpbc);肝细胞癌(hcc);头颈部鳞状细胞癌(hnscc);口腔舌头鳞状细胞癌(otscc);肉瘤(例如,上皮样肉瘤、横纹肌样肉瘤和滑膜肉瘤);食道癌;胃癌;卵巢癌;胰腺癌;肺癌;非小细胞肺癌(nsclc);小细胞肺癌(sclc);鳞状细胞癌(scc);头颈癌;头颈部鳞状细胞癌(hnscc);胃肠道癌症;大肠癌;小肠癌;胃癌;结肠癌;结肠直肠癌;膀胱癌;肝癌;胆道癌;泌尿上皮癌;子宫内膜癌;宫颈癌;前列腺癌;间皮瘤;脊索瘤;肾癌;肾细胞癌(rcc);脑癌;成神经细胞瘤;成胶质细胞瘤;皮肤癌;黑素瘤;基底细胞癌;默克尔细胞癌;血癌;造血系统癌症;骨髓瘤;多发性骨髓瘤(mm);b细胞恶性肿瘤;淋巴瘤;b细胞淋巴瘤;霍奇金淋巴瘤;t细胞淋巴瘤;白血病;或急性淋巴细胞性白血病(all)。在某些实施方案中,化合物包含靶向malat1的反义化合物。在某些实施方案中,化合物包含靶向malat1的寡核苷酸。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:2
‑
10中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:2
‑
10中的任一者的核碱基序
列的核碱基序列。在某些实施方案中,化合物包含由seq id no:2
‑
10中的任一者的核碱基序列组成的修饰寡核苷酸。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:36
‑
2646或2664
‑
2813中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:36
‑
2646或2664
‑
2813中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物包含由seq id no:36
‑
2646或2664
‑
2813中的任一者的核碱基序列组成的修饰寡核苷酸。在前述实施方案中的任一项中,修饰寡核苷酸可以由10至30个连接核苷组成。在某些实施方案中,化合物是ion 1157034、1157111、1157190、1157929、1158161、1158162、1304884、1304890或1304906。在前述实施方案中的任一项中,化合物可以是单链或双链的。在前述实施方案中的任一项中,化合物可以是反义化合物或寡聚化合物。在某些实施方案中,向个体肠胃外施用化合物。在某些实施方案中,施用化合物抑制或减少癌细胞增殖、癌细胞迁移、癌细胞分支形态发生、肿瘤进展、肿瘤生长或转移。在某些实施方案中,施用化合物增加或诱导癌细胞分化、癌细胞粘附或肿瘤分化。在某些实施方案中,施用化合物诱导乳腺癌细胞或乳房肿瘤具有囊状、导管状或腺泡状表型或形态。在某些实施方案中,施用化合物诱导乳腺癌细胞或乳房肿瘤具有更加分化的表型或结构。在某些实施方案中,更加分化的表型或结构包括但不限于存在分泌脂质小滴、桥粒结构增加、导管结构极化,或诸如e
‑
钙粘蛋白或乳蛋白(诸如酪蛋白)的分化标志物的水平增加。
[0283]
在某些实施方案中,个体被鉴定为患有与malat1相关的癌症或有此风险。
[0284]
在某些实施方案中,抑制细胞中的malat1表达的方法包括使细胞与包含malat1特异性抑制剂的化合物接触,从而抑制细胞中的malat1表达。在某些实施方案中,细胞是癌细胞。在某些实施方案中,细胞是乳房细胞。在某些实施方案中,细胞处于乳房中。在某些实施方案中,细胞处于患有癌症或有此风险的个体的乳房中,所述癌症诸如乳腺癌;炎症性乳腺癌;乳腺导管癌;乳腺小叶癌;管状a型乳腺癌;管状b型乳腺癌;基底细胞样乳腺癌;her2阳性(her2 )乳腺癌;her2阴性(her2
‑
)乳腺癌;雌激素受体阴性(er
‑
)乳腺癌;雌激素受体阳性(er )乳腺癌;黄体酮受体阴性(pr
‑
)乳腺癌;黄体酮受体阳性(pr )乳腺癌;er阳性(er )且pr阳性(pr )乳腺癌;er阳性(er )且pr阴性(pr
‑
)乳腺癌;er阴性(er
‑
)且pr阳性(pr )乳腺癌;er阳性(er )且her2阴性(her2
‑
)乳腺癌;er
‑
、pr
‑
且her2
‑
三阴性乳腺癌(er
‑
、pr
‑
、her2
‑
;tnbc);激素受体阴性乳腺癌(er
‑
且pr
‑
);er 、pr 且her2 三阳性乳腺癌(er 、pr 、her2 ;tpbc);肝细胞癌(hcc);头颈部鳞状细胞癌(hnscc);口腔舌头鳞状细胞癌(otscc);肉瘤(例如,上皮样肉瘤、横纹肌样肉瘤和滑膜肉瘤);食道癌;胃癌;卵巢癌;胰腺癌;肺癌;非小细胞肺癌(nsclc);小细胞肺癌(sclc);鳞状细胞癌(scc);头颈癌;头颈部鳞状细胞癌(hnscc);胃肠道癌症;大肠癌;小肠癌;胃癌;结肠癌;结肠直肠癌;膀胱癌;肝癌;胆道癌;泌尿上皮癌;子宫内膜癌;宫颈癌;前列腺癌;间皮瘤;脊索瘤;肾癌;肾细胞癌(rcc);脑癌;成神经细胞瘤;成胶质细胞瘤;皮肤癌;黑素瘤;基底细胞癌;默克尔细胞癌;血癌;造血系统癌症;骨髓瘤;多发性骨髓瘤(mm);b细胞恶性肿瘤;淋巴瘤;b细胞淋巴瘤;霍奇金淋巴瘤;t细胞淋巴瘤;白血病;或急性淋巴细胞性白血病(all)。在某些实施方案中,化合物包含靶向malat1的反义化合物。在某些实施方案中,化合物包含靶向malat1的寡核苷酸。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包
含核碱基序列seq id no:2
‑
10中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:2
‑
10中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物包含由seq id no:2
‑
10中的任一者的核碱基序列组成的修饰寡核苷酸。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:36
‑
2646或2664
‑
2813中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:36
‑
2646或2664
‑
2813中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物包含由seq id no:36
‑
2646或2664
‑
2813中的任一者的核碱基序列组成的修饰寡核苷酸。在前述实施方案中的任一项中,修饰寡核苷酸可以由10至30个连接核苷组成。在某些实施方案中,化合物是ion 1157034、1157111、1157190、1157929、1158161、1158162、1304884、1304890或1304906。在前述实施方案中的任一项中,化合物可以是单链或双链的。在前述实施方案中的任一项中,化合物可以是反义化合物或寡聚化合物。
[0285]
在某些实施方案中,减少或抑制患有与malat1相关的癌症或有此风险的个体的癌细胞增殖、癌细胞迁移、癌细胞分支形态发生、肿瘤进展、肿瘤生长或转移的方法包括向个体施用包含malat1特异性抑制剂的化合物,从而减少或抑制个体中的癌细胞增殖、癌细胞迁移、癌细胞分支形态发生、肿瘤进展、肿瘤生长或转移。在某些实施方案中,增加或诱导患有与malat1相关的癌症或有此风险的个体的癌细胞分化、癌细胞粘附或肿瘤分化的方法包括向个体施用包含malat1特异性抑制剂的化合物,从而增加或诱导个体中的癌细胞分化、癌细胞粘附或肿瘤分化。在某些实施方案中,施用化合物诱导乳腺癌细胞或乳房肿瘤具有囊状、导管状或腺泡状表型或形态。在某些实施方案中,施用化合物诱导乳腺癌细胞或乳房肿瘤具有更加分化的表型或结构。在某些实施方案中,更加分化的表型或结构包括但不限于存在分泌脂质小滴、桥粒结构增加、导管结构极化,或诸如e
‑
钙粘蛋白或乳蛋白(诸如酪蛋白)的分化标志物的水平增加。在某些实施方案中,个体患有以下癌症或有此风险:乳腺癌;炎症性乳腺癌;乳腺导管癌;乳腺小叶癌;管状a型乳腺癌;管状b型乳腺癌;基底细胞样乳腺癌;her2阳性(her2 )乳腺癌;her2阴性(her2
‑
)乳腺癌;雌激素受体阴性(er
‑
)乳腺癌;雌激素受体阳性(er )乳腺癌;黄体酮受体阴性(pr
‑
)乳腺癌;黄体酮受体阳性(pr )乳腺癌;er阳性(er )且pr阳性(pr )乳腺癌;er阳性(er )且pr阴性(pr
‑
)乳腺癌;er阴性(er
‑
)且pr阳性(pr )乳腺癌;er阳性(er )且her2阴性(her2
‑
)乳腺癌;er
‑
、pr
‑
且her2
‑
三阴性乳腺癌(er
‑
、pr
‑
、her2
‑
;tnbc);激素受体阴性乳腺癌(er
‑
且pr
‑
);er 、pr 且her2 三阳性乳腺癌(er 、pr 、her2 ;tpbc);肝细胞癌(hcc);头颈部鳞状细胞癌(hnscc);口腔舌头鳞状细胞癌(otscc);肉瘤(例如,上皮样肉瘤、横纹肌样肉瘤和滑膜肉瘤);食道癌;胃癌;卵巢癌;胰腺癌;肺癌;非小细胞肺癌(nsclc);小细胞肺癌(sclc);鳞状细胞癌(scc);头颈癌;头颈部鳞状细胞癌(hnscc);胃肠道癌症;大肠癌;小肠癌;胃癌;结肠癌;结肠直肠癌;膀胱癌;肝癌;胆道癌;泌尿上皮癌;子宫内膜癌;宫颈癌;前列腺癌;间皮瘤;脊索瘤;肾癌;肾细胞癌(rcc);脑癌;成神经细胞瘤;成胶质细胞瘤;皮肤癌;黑素瘤;基底细胞癌;默克尔细胞癌;血癌;造血系统癌症;骨髓瘤;多发性骨髓瘤(mm);b细胞恶性肿瘤;淋巴瘤;b细胞淋巴瘤;霍奇金淋巴瘤;t细胞淋巴瘤;白血病;或急性淋巴细胞性白血病(all)。在某些实施方案中,化合
物包含靶向malat1的反义化合物。在某些实施方案中,化合物包含靶向malat1的寡核苷酸。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:2
‑
10中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:2
‑
10中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物包含由seq id no:2
‑
10中的任一者的核碱基序列组成的修饰寡核苷酸。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:36
‑
2646或2664
‑
2813中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:36
‑
2646或2664
‑
2813中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物包含由seq id no:36
‑
2646或2664
‑
2813中的任一者的核碱基序列组成的修饰寡核苷酸。在前述实施方案中的任一项中,修饰寡核苷酸可以由10至30个连接核苷组成。在某些实施方案中,化合物是ion 1157034、1157111、1157190、1157929、1158161、1158162、1304884、1304890或1304906。在前述实施方案中的任一项中,化合物可以是单链或双链的。在前述实施方案中的任一项中,化合物可以是反义化合物或寡聚化合物。在某些实施方案中,向个体肠胃外施用化合物。在某些实施方案中,个体被鉴定为患有与malat1相关的癌症或有此风险。
[0286]
某些实施方案涉及一种包含malat1特异性抑制剂的化合物,其用于治疗癌症。在某些实施方案中,癌症是乳腺癌;炎症性乳腺癌;乳腺导管癌;乳腺小叶癌;管状a型乳腺癌;管状b型乳腺癌;基底细胞样乳腺癌;her2阳性(her2 )乳腺癌;her2阴性(her2
‑
)乳腺癌;雌激素受体阴性(er
‑
)乳腺癌;雌激素受体阳性(er )乳腺癌;黄体酮受体阴性(pr
‑
)乳腺癌;黄体酮受体阳性(pr )乳腺癌;er阳性(er )且pr阳性(pr )乳腺癌;er阳性(er )且pr阴性(pr
‑
)乳腺癌;er阴性(er
‑
)且pr阳性(pr )乳腺癌;er阳性(er )且her2阴性(her2
‑
)乳腺癌;er
‑
、pr
‑
且her2
‑
三阴性乳腺癌(er
‑
、pr
‑
、her2
‑
;tnbc);激素受体阴性乳腺癌(er
‑
且pr
‑
);er 、pr 且her2 三阳性乳腺癌(er 、pr 、her2 ;tpbc);肝细胞癌(hcc);头颈部鳞状细胞癌(hnscc);口腔舌头鳞状细胞癌(otscc);肉瘤(例如,上皮样肉瘤、横纹肌样肉瘤和滑膜肉瘤);食道癌;胃癌;卵巢癌;胰腺癌;肺癌;非小细胞肺癌(nsclc);小细胞肺癌(sclc);鳞状细胞癌(scc);头颈癌;头颈部鳞状细胞癌(hnscc);胃肠道癌症;大肠癌;小肠癌;胃癌;结肠癌;结肠直肠癌;膀胱癌;肝癌;胆道癌;泌尿上皮癌;子宫内膜癌;宫颈癌;前列腺癌;间皮瘤;脊索瘤;肾癌;肾细胞癌(rcc);脑癌;成神经细胞瘤;成胶质细胞瘤;皮肤癌;黑素瘤;基底细胞癌;默克尔细胞癌;血癌;造血系统癌症;骨髓瘤;多发性骨髓瘤(mm);b细胞恶性肿瘤;淋巴瘤;b细胞淋巴瘤;霍奇金淋巴瘤;t细胞淋巴瘤;白血病;或急性淋巴细胞性白血病(all)。在某些实施方案中,化合物包含靶向malat1的反义化合物。在某些实施方案中,化合物包含靶向malat1的寡核苷酸。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:2
‑
10中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:2
‑
10中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物包含由seq id no:2
‑
10中的任一者的核碱基序列组成的修饰寡核苷酸。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷
酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:36
‑
2646或2664
‑
2813中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:36
‑
2646或2664
‑
2813中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物包含由seq id no:36
‑
2646或2664
‑
2813中的任一者的核碱基序列组成的修饰寡核苷酸。在前述实施方案中的任一项中,修饰寡核苷酸可以由10至30个连接核苷组成。在某些实施方案中,化合物是ion 1157034、1157111、1157190、1157929、1158161、1158162、1304884、1304890或1304906。在前述实施方案中的任一项中,化合物可以是单链或双链的。在前述实施方案中的任一项中,化合物可以是反义化合物或寡聚化合物。
[0287]
某些实施方案涉及一种包含malat1特异性抑制剂的化合物,其用于减少或抑制患有癌症的个体中的癌细胞增殖、癌细胞迁移、癌细胞分支形态发生、肿瘤进展、肿瘤生长或转移。某些实施方案涉及一种包含malat1特异性抑制剂的化合物,其用于增加或诱导患有癌症的个体中的癌细胞分化、癌细胞粘附或肿瘤分化。在某些实施方案中,施用化合物诱导乳腺癌细胞或乳房肿瘤具有囊状、导管状或腺泡状表型或形态。在某些实施方案中,施用化合物诱导乳腺癌细胞或乳房肿瘤具有更加分化的表型或结构。在某些实施方案中,更加分化的表型或结构包括但不限于存在分泌脂质小滴、桥粒结构增加、导管结构极化,或诸如e
‑
钙粘蛋白或乳蛋白(诸如酪蛋白)的分化标志物的水平增加。在某些实施方案中,癌症是乳腺癌;炎症性乳腺癌;乳腺导管癌;乳腺小叶癌;管状a型乳腺癌;管状b型乳腺癌;基底细胞样乳腺癌;her2阳性(her2 )乳腺癌;her2阴性(her2
‑
)乳腺癌;雌激素受体阴性(er
‑
)乳腺癌;雌激素受体阳性(er )乳腺癌;黄体酮受体阴性(pr
‑
)乳腺癌;黄体酮受体阳性(pr )乳腺癌;er阳性(er )且pr阳性(pr )乳腺癌;er阳性(er )且pr阴性(pr
‑
)乳腺癌;er阴性(er
‑
)且pr阳性(pr )乳腺癌;er阳性(er )且her2阴性(her2
‑
)乳腺癌;er
‑
、pr
‑
且her2
‑
三阴性乳腺癌(er
‑
、pr
‑
、her2
‑
;tnbc);激素受体阴性乳腺癌(er
‑
且pr
‑
);er 、pr 且her2 三阳性乳腺癌(er 、pr 、her2 ;tpbc);肝细胞癌(hcc);头颈部鳞状细胞癌(hnscc);口腔舌头鳞状细胞癌(otscc);肉瘤(例如,上皮样肉瘤、横纹肌样肉瘤和滑膜肉瘤);食道癌;胃癌;卵巢癌;胰腺癌;肺癌;非小细胞肺癌(nsclc);小细胞肺癌(sclc);鳞状细胞癌(scc);头颈癌;头颈部鳞状细胞癌(hnscc);胃肠道癌症;大肠癌;小肠癌;胃癌;结肠癌;结肠直肠癌;膀胱癌;肝癌;胆道癌;泌尿上皮癌;子宫内膜癌;宫颈癌;前列腺癌;间皮瘤;脊索瘤;肾癌;肾细胞癌(rcc);脑癌;成神经细胞瘤;成胶质细胞瘤;皮肤癌;黑素瘤;基底细胞癌;默克尔细胞癌;血癌;造血系统癌症;骨髓瘤;多发性骨髓瘤(mm);b细胞恶性肿瘤;淋巴瘤;b细胞淋巴瘤;霍奇金淋巴瘤;t细胞淋巴瘤;白血病;或急性淋巴细胞性白血病(all)。在某些实施方案中,化合物包含靶向malat1的反义化合物。在某些实施方案中,化合物包含靶向malat1的寡核苷酸。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:2
‑
10中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:2
‑
10中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物包含由seq id no:2
‑
10中的任一者的核碱基序列组成的修饰寡核苷酸。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:36
‑
2646或2664
‑
2813中的任一者的至少8个连续
核碱基的核碱基序列。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:36
‑
2646或2664
‑
2813中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物包含由seq id no:36
‑
2646或2664
‑
2813中的任一者的核碱基序列组成的修饰寡核苷酸。在前述实施方案中的任一项中,修饰寡核苷酸可以由10至30个连接核苷组成。在某些实施方案中,化合物是ion 1157034、1157111、1157190、1157929、1158161、1158162、1304884、1304890或1304906。在前述实施方案中的任一项中,化合物可以是单链或双链的。在前述实施方案中的任一项中,化合物可以是反义化合物或寡聚化合物。
[0288]
某些实施方案涉及包含malat1特异性抑制剂的化合物用于制造或制备用于治疗癌症的药物的用途。某些实施方案涉及包含malat1特异性抑制剂的化合物用于制备用于治疗与malat1相关的癌症的药物的用途。在某些实施方案中,癌症是乳腺癌;炎症性乳腺癌;乳腺导管癌;乳腺小叶癌;管状a型乳腺癌;管状b型乳腺癌;基底细胞样乳腺癌;her2阳性(her2 )乳腺癌;her2阴性(her2
‑
)乳腺癌;雌激素受体阴性(er
‑
)乳腺癌;雌激素受体阳性(er )乳腺癌;黄体酮受体阴性(pr
‑
)乳腺癌;黄体酮受体阳性(pr )乳腺癌;er阳性(er )且pr阳性(pr )乳腺癌;er阳性(er )且pr阴性(pr
‑
)乳腺癌;er阴性(er
‑
)且pr阳性(pr )乳腺癌;er阳性(er )且her2阴性(her2
‑
)乳腺癌;er
‑
、pr
‑
且her2
‑
三阴性乳腺癌(er
‑
、pr
‑
、her2
‑
;tnbc);激素受体阴性乳腺癌(er
‑
且pr
‑
);er 、pr 且her2 三阳性乳腺癌(er 、pr 、her2 ;tpbc);肝细胞癌(hcc);头颈部鳞状细胞癌(hnscc);口腔舌头鳞状细胞癌(otscc);肉瘤(例如,上皮样肉瘤、横纹肌样肉瘤和滑膜肉瘤);食道癌;胃癌;卵巢癌;胰腺癌;肺癌;非小细胞肺癌(nsclc);小细胞肺癌(sclc);鳞状细胞癌(scc);头颈癌;头颈部鳞状细胞癌(hnscc);胃肠道癌症;大肠癌;小肠癌;胃癌;结肠癌;结肠直肠癌;膀胱癌;肝癌;胆道癌;泌尿上皮癌;子宫内膜癌;宫颈癌;前列腺癌;间皮瘤;脊索瘤;肾癌;肾细胞癌(rcc);脑癌;成神经细胞瘤;成胶质细胞瘤;皮肤癌;黑素瘤;基底细胞癌;默克尔细胞癌;血癌;造血系统癌症;骨髓瘤;多发性骨髓瘤(mm);b细胞恶性肿瘤;淋巴瘤;b细胞淋巴瘤;霍奇金淋巴瘤;t细胞淋巴瘤;白血病;或急性淋巴细胞性白血病(all)。在某些实施方案中,化合物包含靶向malat1的反义化合物。在某些实施方案中,化合物包含靶向malat1的寡核苷酸。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:2
‑
10中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:2
‑
10中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物包含由seq id no:2
‑
10中的任一者的核碱基序列组成的修饰寡核苷酸。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:36
‑
2646或2664
‑
2813中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:36
‑
2646或2664
‑
2813中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物包含由seq id no:36
‑
2646或2664
‑
2813中的任一者的核碱基序列组成的修饰寡核苷酸。在前述实施方案中的任一项中,修饰寡核苷酸可以由10至30个连接核苷组成。在某些实施方案中,化合物是ion 1157034、1157111、1157190、1157929、1158161、1158162、1304884、1304890或1304906。在前述实施方案中的任一项中,化合物可
以是单链或双链的。在前述实施方案中的任一项中,化合物可以是反义化合物或寡聚化合物。
[0289]
某些实施方案涉及包含malat1特异性抑制剂的化合物用于制造或制备用于减少或抑制患有癌症的个体中的癌细胞增殖、癌细胞迁移、癌细胞分支形态发生、肿瘤进展、肿瘤生长或转移的药物的用途。某些实施方案涉及包含malat1特异性抑制剂的化合物用于制造或制备用于增加或诱导患有癌症的个体中的癌细胞分化、癌细胞粘附或肿瘤分化的药物的用途。在某些实施方案中,施用化合物诱导乳腺癌细胞或乳房肿瘤具有囊状、导管状或腺泡状表型或形态。在某些实施方案中,施用化合物诱导乳腺癌细胞或乳房肿瘤具有更加分化的表型或结构。在某些实施方案中,更加分化的表型或结构包括但不限于存在分泌脂质小滴、桥粒结构增加、导管结构极化,或诸如e
‑
钙粘蛋白或乳蛋白(诸如酪蛋白)的分化标志物的水平增加。在某些实施方案中,癌症是乳腺癌;炎症性乳腺癌;乳腺导管癌;乳腺小叶癌;管状a型乳腺癌;管状b型乳腺癌;基底细胞样乳腺癌;her2阳性(her2 )乳腺癌;her2阴性(her2
‑
)乳腺癌;雌激素受体阴性(er
‑
)乳腺癌;雌激素受体阳性(er )乳腺癌;黄体酮受体阴性(pr
‑
)乳腺癌;黄体酮受体阳性(pr )乳腺癌;er阳性(er )且pr阳性(pr )乳腺癌;er阳性(er )且pr阴性(pr
‑
)乳腺癌;er阴性(er
‑
)且pr阳性(pr )乳腺癌;er阳性(er )且her2阴性(her2
‑
)乳腺癌;er
‑
、pr
‑
且her2
‑
三阴性乳腺癌(er
‑
、pr
‑
、her2
‑
;tnbc);激素受体阴性乳腺癌(er
‑
且pr
‑
);er 、pr 且her2 三阳性乳腺癌(er 、pr 、her2 ;tpbc);肝细胞癌(hcc);头颈部鳞状细胞癌(hnscc);口腔舌头鳞状细胞癌(otscc);肉瘤(例如,上皮样肉瘤、横纹肌样肉瘤和滑膜肉瘤);食道癌;胃癌;卵巢癌;胰腺癌;肺癌;非小细胞肺癌(nsclc);小细胞肺癌(sclc);鳞状细胞癌(scc);头颈癌;头颈部鳞状细胞癌(hnscc);胃肠道癌症;大肠癌;小肠癌;胃癌;结肠癌;结肠直肠癌;膀胱癌;肝癌;胆道癌;泌尿上皮癌;子宫内膜癌;宫颈癌;前列腺癌;间皮瘤;脊索瘤;肾癌;肾细胞癌(rcc);脑癌;成神经细胞瘤;成胶质细胞瘤;皮肤癌;黑素瘤;基底细胞癌;默克尔细胞癌;血癌;造血系统癌症;骨髓瘤;多发性骨髓瘤(mm);b细胞恶性肿瘤;淋巴瘤;b细胞淋巴瘤;霍奇金淋巴瘤;t细胞淋巴瘤;白血病;或急性淋巴细胞性白血病(all)。在某些实施方案中,化合物包含靶向malat1的反义化合物。在某些实施方案中,化合物包含靶向malat1的寡核苷酸。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:2
‑
10中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:2
‑
10中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物包含由seq id no:2
‑
10中的任一者的核碱基序列组成的修饰寡核苷酸。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由8至80个连接核苷组成并且具有包含核碱基序列seq id no:36
‑
2646或2664
‑
2813中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:36
‑
2646或2664
‑
2813中的任一者的核碱基序列的核碱基序列。在某些实施方案中,化合物包含由seq id no:36
‑
2646或2664
‑
2813中的任一者的核碱基序列组成的修饰寡核苷酸。在前述实施方案中的任一项中,修饰寡核苷酸可以由10至30个连接核苷组成。在某些实施方案中,化合物是ion 1157034、1157111、1157190、1157929、1158161、1158162、1304884、1304890或1304906。在前述实施方案中的任一项中,化合物可以是单链或双链的。
在前述实施方案中的任一项中,化合物可以是反义化合物或寡聚化合物。
[0290]
在前述方法或用途中的任一者中,化合物可以靶向malat1。在某些实施方案中,化合物包含修饰寡核苷酸或由其组成,例如,修饰寡核苷酸可以由8至80个连接核苷、10至30个连接核苷、12至30个连接核苷,或20个连接核苷组成。在某些实施方案中,修饰寡核苷酸与seq id no:1至少80%、85%、90%、95%或100%互补。在某些实施方案中,修饰寡核苷酸包含至少一个修饰的核苷间键、至少一个修饰的糖和/或至少一个修饰的核碱基。在某些实施方案中,修饰的核苷间键是硫代磷酸酯核苷间键,修饰的糖是双环糖或2
’‑
o
‑
甲氧基乙基,并且修饰的核碱基是5
‑
甲基胞嘧啶。在某些实施方案中,修饰寡核苷酸包含:间隙区段,其由连接的2
’‑
脱氧核苷组成;5’侧翼区段,其由连接核苷组成;以及3’侧翼区段,其由连接核苷组成,其中间隙区段位于紧邻5’侧翼区段和3’侧翼区段的位置处并且在两者之间,并且其中各侧翼区段的各核苷包含修饰的糖。
[0291]
在前述实施方案中的任一项中,修饰寡核苷酸可以由12至30个、15至30个、15至25个、15至24个、16至24个、17至24个、18至24个、19至24个、20至24个、19至22个、20至22个、16至20个或17或20个连接核苷组成。在某些实施方案中,修饰寡核苷酸与seq id no:1至少80%、85%、90%、95%或100%互补。在某些实施方案中,修饰寡核苷酸的至少一个核苷间键是修饰的核苷间键,修饰寡核苷酸的至少一个糖是修饰的糖,和/或修饰寡核苷酸的至少一个核碱基是修饰的核碱基。在某些实施方案中,修饰的核苷间键是硫代磷酸酯核苷间键,修饰的糖是双环糖或2
’‑
o
‑
甲氧基乙基糖,并且修饰的核碱基是5
‑
甲基胞嘧啶。在某些实施方案中,修饰寡核苷酸具有:间隙区段,其由连接的2
’‑
脱氧核苷组成;5’侧翼区段,其由连接核苷组成;以及3’侧翼区段,其由连接核苷组成,其中间隙区段位于紧邻5’侧翼区段和3’侧翼区段的位置处并且在两者之间,并且其中各侧翼区段的各核苷包含修饰的糖。
[0292]
在前述方法或用途中的任一者中,化合物可以包含修饰寡核苷酸或由其组成,所述修饰寡核苷酸具有:
[0293]
间隙区段,其由连接的2
’‑
脱氧核苷组成;
[0294]5’
侧翼区段,其由连接核苷组成;以及
[0295]3’
侧翼区段,其由连接核苷组成;
[0296]
其中间隙区段位于5’侧翼区段与3’侧翼区段之间并且其中各侧翼区段的各核苷包含修饰的糖。在某些实施方案中,修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:2
‑
10或36
‑
2813中的任一者所示的核碱基序列的核碱基序列。在某些实施方案中,修饰寡核苷酸由16至80个连接核苷组成并且具有包含seq id no:2
‑
10中的任一者所示的核碱基序列的核碱基序列。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成并且具有包含seq id no:2
‑
10或36
‑
2813中的任一者所示的核碱基序列的核碱基序列。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成并且具有包含seq id no:2
‑
10中的任一者所示的核碱基序列的核碱基序列。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成并且具有由seq id no:2
‑
10或36
‑
2813中的任一者所示的核碱基序列组成的核碱基序列。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成并且具有由seq id no:2
‑
10中的任一者所示的核碱基序列组成的核碱基序列。
[0297]
在前述方法或用途中的任一者中,化合物可以包含修饰寡核苷酸或由其组成,所述修饰寡核苷酸由16至80个连接的核碱基组成并且具有包含seq id no:2
‑
10或36
‑
2813中
的任一者所示的核碱基序列的核碱基序列,其中修饰寡核苷酸具有:
[0298]
间隙区段,其由连接的2
’‑
脱氧核苷组成;
[0299]5’
侧翼区段,其由连接核苷组成;以及
[0300]3’
侧翼区段,其由连接核苷组成;
[0301]
其中间隙区段位于5’侧翼区段与3’侧翼区段之间并且其中各侧翼区段的各核苷包含修饰的糖。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成。
[0302]
在前述方法或用途中的任一者中,化合物可以包含修饰寡核苷酸或由其组成,所述修饰寡核苷酸由16至80个连接的核碱基组成并且具有包含seq id no:2
‑
10中的任一者所示的核碱基序列的核碱基序列,其中修饰寡核苷酸具有:
[0303]
间隙区段,其由连接的2
’‑
脱氧核苷组成;
[0304]5’
侧翼区段,其由连接核苷组成;以及
[0305]3’
侧翼区段,其由连接核苷组成;
[0306]
其中间隙区段位于5’侧翼区段与3’侧翼区段之间并且其中各侧翼区段的各核苷包含修饰的糖。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成。
[0307]
在前述方法或用途中的任一者中,化合物可以包含修饰寡核苷酸或由其组成,所述修饰寡核苷酸由16至80个连接的核碱基组成并且具有包含seq id no:36
‑
2646或2664
‑
2813中的任一者所示的核碱基序列的核碱基序列,其中修饰寡核苷酸具有:
[0308]
间隙区段,其由10个连接的2
’‑
脱氧核苷组成;
[0309]5’
侧翼区段,其由3个连接核苷组成;以及
[0310]3’
侧翼区段,其由3个连接核苷组成;
[0311]
其中间隙区段位于5’侧翼区段与3’侧翼区段之间;其中各侧翼区段的各核苷包含cet核苷;其中各核苷间键是硫代磷酸酯键;并且其中各胞嘧啶是5
‑
甲基胞嘧啶。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成。
[0312]
在前述方法或用途中的任一者中,化合物可以包含修饰寡核苷酸或由其组成,所述修饰寡核苷酸由16至80个连接的核碱基组成并且具有包含seq id no:2
‑
7中的任一者所示的核碱基序列的核碱基序列,其中修饰寡核苷酸具有:
[0313]
间隙区段,其由10个连接的2
’‑
脱氧核苷组成;
[0314]5’
侧翼区段,其由3个连接核苷组成;以及
[0315]3’
侧翼区段,其由3个连接核苷组成;
[0316]
其中间隙区段位于5’侧翼区段与3’侧翼区段之间;其中各侧翼区段的各核苷包含cet核苷;其中各核苷间键是硫代磷酸酯键;并且其中各胞嘧啶是5
‑
甲基胞嘧啶。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成。
[0317]
在前述方法或用途中的任一者中,化合物可以包含修饰寡核苷酸或由其组成,所述修饰寡核苷酸具有包含seq id no:8
‑
10中的任一者所示的核碱基序列的核碱基序列;其中修饰寡核苷酸包含糖基序kkk
‑
d
‑
y
‑
d(8)
‑
kkk,其中“k”指示cet修饰的糖部分,“d”指示未
修饰的2
’‑
脱氧核糖基糖部分,并且“y”指示2
’‑
o
‑
甲基修饰的糖部分;其中各核苷间键是硫代磷酸酯键;并且其中各胞嘧啶是5
‑
甲基胞嘧啶。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成。
[0318]
在前述方法或用途中的任一者中,化合物可以包含具有核碱基序列和化学基序:gksgksakstdsuysadsadstdsgdstdsadsgdstdsgkstksak(seq id no:8)的ion 1304884或由其组成,其中“d”表示2
’‑
脱氧核糖,“k”表示cet修饰的糖,“y”表示2
’‑
o
‑
甲基修饰的糖,“s”表示硫代磷酸酯核苷间键,并且“mc”是指5
‑
甲基胞嘧啶。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成。
[0319]
在前述方法或用途中的任一者中,化合物可以包含具有核碱基序列和化学基序:gksgkstkstdsaystdsadsgdsmcdstdstdsgdsadsmcksaksak(seq id no:9)的ion 1304890或由其组成,其中“d”表示2
’‑
脱氧核糖,“k”表示cet修饰的糖,“y”表示2
’‑
o
‑
甲基修饰的糖,“s”表示硫代磷酸酯核苷间键,并且“mc”是指5
‑
甲基胞嘧啶。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成。
[0320]
在前述方法或用途中的任一者中,化合物可以包含具有核碱基序列和化学基序:gksmcksaksgdsaystdsadsadstdsgdstdstdsmcdstksmcksak(seq id no:10)的ion 1304906或由其组成,其中“d”表示2
’‑
脱氧核糖,“k”表示cet修饰的糖,“y”表示2
’‑
o
‑
甲基修饰的糖,“s”表示硫代磷酸酯核苷间键,并且“mc”是指5
‑
甲基胞嘧啶。在某些实施方案中,修饰寡核苷酸由16至30个连接核苷组成。在某些实施方案中,修饰寡核苷酸由16个连接核苷组成。
[0321]
在前述方法或用途中的任一者中,化合物可以是根据以下化学结构的修饰寡核苷酸:
[0322]
[0323]
(seq id no:6),或其盐。在某些实施方案中,修饰寡核苷酸是钠盐或钾盐。
[0324]
在前述方法或用途中的任一者中,化合物可以是根据以下化学结构的修饰寡核苷酸:
[0325][0326]
(seq id no:6)。
[0327]
在前述方法或用途中的任一者中,化合物可以肠胃外施用。例如,在某些实施方案中,化合物可以通过注射或输注进行施用。肠胃外施用包括皮下施用、静脉内施用、肌肉内施用、动脉内施用、腹膜内施用或颅内施用,例如鞘内或脑室内施用。
[0328]
某些组合和组合疗法
[0329]
在某些实施方案中,包含本文所述的化合物的第一剂与一种或多种第二剂共同施用。在某些实施方案中,此类第二剂被设计来治疗与本文所述的第一剂所治疗的相同的疾病、病症或病状。在某些实施方案中,此类第二剂被设计来治疗与本文所述的第一剂所治疗的不同的疾病、病症或病状。在某些实施方案中,第一剂被设计来治疗第二剂的非期望副作用。在某些实施方案中,第二剂与第一剂共同施用以治疗第一剂的非期望作用。在某些实施方案中,此类第二剂被设计来治疗一种或多种如本文所述的药物组合物的非期望副作用。在某些实施方案中,第二剂与第一剂共同施用以产生组合作用。在某些实施方案中,第二剂与第一剂共同施用以产生协同作用。在某些实施方案中,与作为独立疗法施用各剂时实现治疗或预防作用所需的剂量相比,第一剂与第二剂的共同施用允许使用较低剂量。
[0330]
在某些实施方案中,一种或多种本文所提供的化合物或组合物与一种或多种第二剂共同施用。在某些实施方案中,一种或多种本文所提供的化合物或组合物与一种或多种第二剂在不同时间施用。在某些实施方案中,一种或多种本文所提供的化合物或组合物与一种或多种第二剂一起制备于单一制剂中。在某些实施方案中,一种或多种本文所提供的
化合物或组合物与一种或多种第二剂分开制备。在某些实施方案中,第二剂选自:化学治疗剂,包括但不限于卡培他滨(capecitabine)(xeloda)、卡铂(carboplatin)、顺铂(cisplatin)、环磷酰胺、多西他赛(docetaxel)(taxotere)、多柔比星(doxorubicin)、表柔比星(epirubicin)(ellence)、艾日布林(eribulin)(halaven)、氟尿嘧啶(fluorouracil)(5
‑
fu,efudex)、吉西他滨(gemcitabine)(gemzar)、伊沙匹隆(ixabepilone)(ixempra)、甲氨蝶呤(rheumatrex,trexall)、紫杉醇(taxol)或长春瑞滨(vinorelbine)(navelbine);组合方案,包括但不限于ac(多柔比星和环磷酰胺)、ec(表柔比星、环磷酰胺)、ac或ec(表柔比星和环磷酰胺)接着是t(多柔比星和环磷酰胺,接着是紫杉醇或多西他赛)、caf(环磷酰胺、多柔比星和5
‑
fu)、cef(环磷酰胺、表柔比星和5
‑
fu)、cmf(环磷酰胺、甲氨蝶呤和5
‑
fu)、tac(多西他赛、多柔比星和环磷酰胺)、tc(多西他赛和环磷酰胺)、ac
‑
th(多柔比星、环磷酰胺、紫杉醇、曲妥珠单抗(trastuzumab))、ac
‑
thp(多柔比星、环磷酰胺、紫杉醇、曲妥珠单抗、帕妥珠单抗(pertuzumab))、tchp(多西他赛、卡铂、曲妥珠单抗、帕妥珠单抗)、tch(多西他赛、卡铂、曲妥珠单抗)或th(紫杉醇、曲妥珠单抗);激素疗法,包括但不限于选择性雌激素受体调节剂、他莫西芬(tamoxifen)、托瑞米芬(toremifene)(fareston)、氟维司群(fulvestrant)(faslodex)、戈舍瑞林(goserelin)(zoladex)或亮丙瑞林(leuprolide)(eligard,lupron);芳香酶抑制剂(ai),包括但不限于阿那曲唑(anastrozole)(arimidex)、依西美坦(exemestane)(aromasin)或来曲唑(letrozole)(femara);her2靶向疗法,包括但不限于曲妥珠单抗(herceptin)、拉帕替尼(lapatinib)(tykerb)、帕妥珠单抗(perjeta)或来那替尼(neratinib)(nerlynx)。
[0331]
某些实施方案涉及如本文所述的靶向malat1的化合物与第二剂的组合的用途。在具体实施方案中,此类用途是用于治疗罹患癌症的患者的方法中,所述癌症包括但不限于乳腺癌;炎症性乳腺癌;乳腺导管癌;乳腺小叶癌;管状a型乳腺癌;管状b型乳腺癌;基底细胞样乳腺癌;her2阳性(her2 )乳腺癌;her2阴性(her2
‑
)乳腺癌;雌激素受体阴性(er
‑
)乳腺癌;雌激素受体阳性(er )乳腺癌;黄体酮受体阴性(pr
‑
)乳腺癌;黄体酮受体阳性(pr )乳腺癌;er阳性(er )且pr阳性(pr )乳腺癌;er阳性(er )且pr阴性(pr
‑
)乳腺癌;er阴性(er
‑
)且pr阳性(pr )乳腺癌;er阳性(er )且her2阴性(her2
‑
)乳腺癌;er
‑
、pr
‑
且her2
‑
三阴性乳腺癌(er
‑
、pr
‑
、her2
‑
;tnbc);激素受体阴性乳腺癌(er
‑
且pr
‑
);er 、pr 且her2 三阳性乳腺癌(er 、pr 、her2 ;tpbc);肝细胞癌(hcc);头颈部鳞状细胞癌(hnscc);口腔舌头鳞状细胞癌(otscc);肉瘤(例如,上皮样肉瘤、横纹肌样肉瘤和滑膜肉瘤);食道癌;胃癌;卵巢癌;胰腺癌;肺癌;非小细胞肺癌(nsclc);小细胞肺癌(sclc);鳞状细胞癌(scc);头颈癌;头颈部鳞状细胞癌(hnscc);胃肠道癌症;大肠癌;小肠癌;胃癌;结肠癌;结肠直肠癌;膀胱癌;肝癌;胆道癌;泌尿上皮癌;子宫内膜癌;宫颈癌;前列腺癌;间皮瘤;脊索瘤;肾癌;肾细胞癌(rcc);脑癌;成神经细胞瘤;成胶质细胞瘤;皮肤癌;黑素瘤;基底细胞癌;默克尔细胞癌;血癌;造血系统癌症;骨髓瘤;多发性骨髓瘤(mm);b细胞恶性肿瘤;淋巴瘤;b细胞淋巴瘤;霍奇金淋巴瘤;t细胞淋巴瘤;白血病;或急性淋巴细胞性白血病(all)。在某些实施方案中,第二剂选自:化学治疗剂,包括但不限于卡培他滨(xeloda)、卡铂、顺铂、环磷酰胺、多西他赛(taxotere)、多柔比星、表柔比星(ellence)、艾日布林(halaven)、氟尿嘧啶(5
‑
fu,efudex)、吉西他滨(gemzar)、伊沙匹隆(ixempra)、甲氨蝶呤(rheumatrex,trexall)、紫杉醇(taxol)或长春瑞滨(navelbine);组合方案,包括但不限于ac(多柔比星和环磷酰胺)、ec
(表柔比星、环磷酰胺)、ac或ec(表柔比星和环磷酰胺)接着是t(多柔比星和环磷酰胺,接着是紫杉醇或多西他赛)、caf(环磷酰胺、多柔比星和5
‑
fu)、cef(环磷酰胺、表柔比星和5
‑
fu)、cmf(环磷酰胺、甲氨蝶呤和5
‑
fu)、tac(多西他赛、多柔比星和环磷酰胺)、tc(多西他赛和环磷酰胺)、ac
‑
th(多柔比星、环磷酰胺、紫杉醇、曲妥珠单抗)、ac
‑
thp(多柔比星、环磷酰胺、紫杉醇、曲妥珠单抗、帕妥珠单抗)、tchp(多西他赛、卡铂、曲妥珠单抗、帕妥珠单抗)、tch(多西他赛、卡铂、曲妥珠单抗)或th(紫杉醇、曲妥珠单抗);激素疗法,包括但不限于选择性雌激素受体调节剂、他莫西芬、托瑞米芬(fareston)、氟维司群(faslodex)、戈舍瑞林(zoladex)或亮丙瑞林(eligard,lupron);芳香酶抑制剂(ai),包括但不限于阿那曲唑(arimidex)、依西美坦(aromasin)或来曲唑(femara);her2靶向疗法,包括但不限于曲妥珠单抗(herceptin)、拉帕替尼(tykerb)、帕妥珠单抗(perjeta)或来那替尼(nerlynx)。
[0332]
某些实施方案涉及如本文所述的靶向malat1的化合物和第二剂的组合,所述第二剂诸如选自以下的第二剂:化学治疗剂,包括但不限于卡培他滨(xeloda)、卡铂、顺铂、环磷酰胺、多西他赛(taxotere)、多柔比星、表柔比星(ellence)、艾日布林(halaven)、氟尿嘧啶(5
‑
fu,efudex)、吉西他滨(gemzar)、伊沙匹隆(ixempra)、甲氨蝶呤(rheumatrex,trexall)、紫杉醇(taxol)或长春瑞滨(navelbine);组合方案,包括但不限于ac(多柔比星和环磷酰胺)、ec(表柔比星、环磷酰胺)、ac或ec(表柔比星和环磷酰胺)接着是t(多柔比星和环磷酰胺,接着是紫杉醇或多西他赛)、caf(环磷酰胺、多柔比星和5
‑
fu)、cef(环磷酰胺、表柔比星和5
‑
fu)、cmf(环磷酰胺、甲氨蝶呤和5
‑
fu)、tac(多西他赛、多柔比星和环磷酰胺)、tc(多西他赛和环磷酰胺)、ac
‑
th(多柔比星、环磷酰胺、紫杉醇、曲妥珠单抗)、ac
‑
thp(多柔比星、环磷酰胺、紫杉醇、曲妥珠单抗、帕妥珠单抗)、tchp(多西他赛、卡铂、曲妥珠单抗、帕妥珠单抗)、tch(多西他赛、卡铂、曲妥珠单抗)或th(紫杉醇、曲妥珠单抗);激素疗法,包括但不限于选择性雌激素受体调节剂、他莫西芬、托瑞米芬(fareston)、氟维司群(faslodex)、戈舍瑞林(zoladex)或亮丙瑞林(eligard,lupron);芳香酶抑制剂(ai),包括但不限于阿那曲唑(arimidex)、依西美坦(aromasin)或来曲唑(femara);her2靶向疗法,包括但不限于曲妥珠单抗(herceptin)、拉帕替尼(tykerb)、帕妥珠单抗(perjeta)或来那替尼(nerlynx)。
[0333]
在某些实施方案中,如本文所述的靶向malat1的化合物和第二剂通过同时、分开或依序施用所述两种剂来用于组合治疗中。在某些实施方案中,所述两种剂被配制成固定剂量组合产品。在其他实施方案中,所述两种剂作为单独的单元向患者提供,然后所述单独的单元可以同时或连续(依序)使用。
[0334]
在某些实施方案中,如本文所述的靶向malat1的化合物与免疫调节剂组合使用,所述免疫调节剂诸如抗pd
‑
l1抗体(或其抗原结合片段)、抗pd
‑
1抗体(或其抗原结合片段)、抗ctla
‑
4抗体(或其抗原结合片段)或ox40激动剂((例如,ox40配体融合蛋白或ox40激动剂抗体或其抗原结合片段)。
[0335]
在某些实施方案中,如本文所述的靶向malat1的化合物与免疫检查点抑制剂组合使用,所述免疫检查点抑制剂诸如抗pd
‑
l1抗体(或其抗原结合片段)、抗pd
‑
1抗体(或其抗原结合片段)或抗ctla
‑
4抗体(或其抗原结合片段)。
[0336]
抗pd
‑
l1抗体是本领域中已知的。示例性抗pd
‑
l1抗体包括:medi4736(度伐鲁单抗)、mpdl3280a、bms936559、2.7a4、amp
‑
714、mdx
‑
1105和mpdl3280a(阿特珠单抗)。
[0337]
抗pd
‑
1抗体是本领域中已知的。示例性抗pd
‑
1抗体包括:纳武单抗、帕博利珠单抗、皮地利珠单抗和amp
‑
514。
[0338]
抗ctla
‑
4抗体是本领域中已知的。示例性抗ctla
‑
4抗体包括:曲美木单抗和伊匹单抗(ipilimumab)(也称为mdx
‑
010(或bms
‑
734016))。
[0339]
ox40激动剂和抗体是本领域中已知的。示例性ox40激动剂和/或抗体包括:medi6383、9b12和medi0562。
[0340]
在一个实施方案中,组合包括反义寡核苷酸ionis 1158161或其盐以及至少一种选自由以下组成的组的免疫调节剂:medi4736、mpdl3280a、bms936559、2.7a4、amp
‑
714、mdx
‑
1105、纳武单抗、帕博利珠单抗、皮地利珠单抗、mpdl3280a、曲美木单抗、伊匹单抗、medi0562和medi0562。
[0341]
某些抗pd
‑
l1抗体
[0342]
本公开中包括特异性结合并抑制pd
‑
l1的抗体。
[0343]
度伐鲁单抗(medi4736)是示例性抗pd
‑
l1抗体,其对pd
‑
l1多肽具有选择性并且阻断pd
‑
l1与pd
‑
1和cd80受体的结合。度伐鲁单抗可以缓解pd
‑
l1介导的体外人t细胞活化抑制并且通过t细胞依赖性机制抑制异种移植模型中的肿瘤生长。
[0344]
关于度伐鲁单抗(或其片段)用于本文所提供的方法的信息可以见于美国专利8,779,108,其公开内容以引用的方式整体并入本文。度伐鲁单抗的可结晶片段(fc)结构域含有igg1重链的恒定结构域的三重突变,其减少与补体组分c1q和负责介导抗体依赖性细胞介导的细胞毒性(adcc)的fcγ受体的结合。
[0345]
用于本文所提供的方法中的度伐鲁单抗及其抗原结合片段包含重链和轻链或重链可变区和轻链可变区。在某些实施方案中,用于本文所提供的方法中的medi4736或其抗原结合片段包含如美国专利8,779,108和9493565中所公开的2.14h9opt抗体的可变重链和可变轻链cdr序列,所述专利以引用的方式整体并入本文。
[0346]
已公开文献中存在多种抗pd
‑
l1抗体,其可包括在本公开中,包括处于开发中和/或处于临床试验中的化合物,诸如:度伐鲁单抗(medi4736)、mpdl3280a、bms936559、2.7a4、amp
‑
714和mdx
‑
1105。公开可用于本公开的抗pd
‑
l1抗体的专利说明书包括:美国专利7,943,743、8,383,796、9,102,725、9,273,135(bms/medarex)、us2006/0153841(dana farber)、us2011/0271358(dana farber)、美国专利8,552,154和9,102,727(dana farber)、美国专利8,217,149(genentech)(包括已颁布的美国专利8,217,149)、us2012/0039906(inserm)、us2016/0031990(amplimmune)、美国专利8,779,108(medimmune,针对度伐鲁单抗/medi4726和2.7a4)、us2014/0044738(amplimmune,针对amp
‑
714)以及us2010/0285039(约翰霍普金斯大学(john’s hopkins university))。这些公开中的每一个均以引用的方式整体并入本文。
[0347]
某些抗ctla
‑
4抗体
[0348]
特异性结合ctla
‑
4并抑制ctla
‑
4活性的抗体可用于增强抗肿瘤免疫反应。关于曲美木单抗(或其抗原结合片段)用于本文所提供的方法的信息可以见于us 6,682,736(在所述专利中被称为11.2.1),其公开内容以引用的方式整体并入本文。曲美木单抗(也称为cp
‑
675,206、cp
‑
675、cp
‑
675206和替西木单抗(ticilimumab))是对ctla
‑
4具有高度选择性并阻断ctla
‑
4与cd80(b7.1)和cd86(b7.2)的结合的人igg2单克隆抗体。已显示其导致体外免
疫活化,并且用曲美木单抗治疗的一些患者已显示出肿瘤消退。
[0349]
用于本文所提供的方法中的曲美木单抗包含重链和轻链或重链可变区和轻链可变区。在一个特定方面,用于本文所提供的方法中的曲美木单抗或其抗原结合片段包含有包含上文所示的氨基酸序列的轻链可变区和包含上文所示的氨基酸序列的重链可变区。在一个特定方面,用于本文所提供的方法中的曲美木单抗或其抗原结合片段包含重链可变区和轻链可变区,其中重链可变区包含上文所示的kabat定义的cdr1、cdr2和cdr3序列,并且其中轻链可变区包含上文所示的kabat定义的cdr1、cdr2和cdr3序列。本领域普通技术人员将能够容易地鉴定出chothia定义、abm定义或本领域普通技术人员已知的其他cdr定义。在一个特定方面,用于本文所提供的方法中的曲美木单抗或其抗原结合片段包含如美国专利6,682,736中所公开的11.2.1抗体的可变重链和可变轻链cdr序列,所述专利以引用的方式整体并入本文。
[0350]
其他抗ctla
‑
4抗体描述于例如us 20070243184中。在一个实施方案中,抗ctla
‑
4抗体是伊匹单抗,也称为mdx
‑
010;bms
‑
734016。
[0351]
某些ox40激动剂
[0352]
在抗原致敏期间或之后不久,ox40激动剂与cd4 t细胞上的ox40受体相互作用,导致cd4 t细胞对抗原的反应增加。与对单独抗原的反应相比,与抗原特异性cd4 t细胞上的ox40受体相互作用的ox40激动剂可以增加t细胞增殖。与不存在ox40激动剂的情况相比,升高的对抗原的反应可维持实质上更长的时间段。因此,通过ox40激动剂的刺激通过加强抗原(例如,肿瘤细胞)的t细胞识别来增强抗原特异性免疫反应。ox40激动剂描述于例如美国专利6,312,700、7,504,101、7,622,444和7,959,925,所述专利以引用的方式整体并入本文。在癌症治疗中使用此类激动剂的方法描述于例如us2015/0098942和us2015/0157710,所述专利中的每一个以引用的方式整体并入本文。
[0353]
ox40激动剂包括但不限于ox40结合分子,例如结合多肽,例如ox40配体(“ox40l”)或其ox40结合片段、变体或衍生物,诸如可溶性细胞外配体结构域和ox40l融合蛋白,以及抗ox40l抗体(例如单克隆抗体,诸如人源化单克隆抗体)或其抗原结合片段、变体或衍生物。抗ox40单克隆抗体的实例描述于例如美国专利5,821,332和6,156,878,所述专利的公开内容均以引用的方式整体并入本文。在某些实施方案中,抗ox40单克隆抗体是9b12或其抗原结合片段、变体或衍生物,如weinberg,a.d.等人j immunother 29,575
‑
585(2006)中所述,其以引用的方式整体并入本文。在另一个实施方案中,ox40抗体是medi0562,如us 2016/0137740中所述。
[0354]
在某些实施方案中,特异性结合ox40的抗体或其抗原结合片段与mab 9b12结合相同的ox40表位。人源化ox40抗体的实例由morris等人,mol immunol.2007年5月;44(12):3112
‑
3121描述。9b12是针对人ox40(cd134)的细胞外结构域的鼠igg1抗ox40 mab(weinberg,a.d.等人j immunother 29,575
‑
585(2006))。它选自一组抗ox40单克隆抗体,因为其能够引起对ox40信号传导的激动剂反应、稳定性并且由杂交瘤产生的水平高。对于在临床应用中使用,将9b12mab用ph 7.0的磷酸盐缓冲盐水平衡,并且通过透析将其浓度调整至5.0mg/ml。
[0355]“ox40配体”(“ox40l”)(还以不同方式称为肿瘤坏死因子配体超家族成员4、gp34、tax转录活化的糖蛋白
‑
1以及cd252)主要存在于抗原呈递细胞(apc)上,并且可以在活化的
b细胞、树突细胞(dc)、朗格罕细胞(langerhans cell)、浆细胞样dc和巨噬细胞上被诱导(croft,m.,(2010)ann rev immunol 28:57
‑
78)。其他细胞,包括活化的t细胞、nk细胞、肥大细胞、内皮细胞和平滑肌细胞,可以响应于炎症性细胞因子(id.)而表达ox40l。ox40l特异性结合ox40受体。人蛋白描述于美国专利6,156,878中。小鼠ox40l描述于美国专利5,457,035中。ox40l在细胞表面表达并且包括细胞内受体结合结构域、跨膜受体结合结构域和细胞外受体结合结构域。ox40l的功能活性可溶性形式可以如例如美国专利5,457,035、6,312,700、6,156,878、6,242,566、6,528,055、6,528,623、7,098,184和7,125,670中所述通过缺失细胞内结构域和跨膜结构域来产生,所述专利的公开内容均出于所有目的并入本文。ox40l的功能活性形式是保留了特异性结合ox40的能力,即具有ox40“受体结合结构域”的形式。一个实例是人ox40l的氨基酸51至183。下文讨论了确定ox40l分子或衍生物特异性结合ox40的能力的方法。制备并使用ox40l及其衍生物(诸如包括ox40结合结构域的衍生物)的方法描述于美国专利6,156,878、6,242,566、6,528,055、6,528,623、7,098,184和7,125,670中,所述专利还描述了包含连接至其他肽(诸如人免疫球蛋白(“ig”)fc区)的ox40l的可溶性形式的蛋白,其可以被产生以有利于从培养的细胞中纯化ox40配体或增强分子在体内施用给哺乳动物之后的稳定性(还参见美国专利5,457,035和7,959,925,这两个专利均以引用的方式整体并入本文)。
[0356]
ox40l的定义内还包括ox40配体变体,其氨基酸序列与天然存在的ox40配体分子不同但保留了特异性结合ox40受体的能力。此类变体描述于美国专利5,457,035、6,156,878、6,242,566、6,528,055、6,528,623、7,098,184和7,125,670中。在一个相关实施方案中,使用ox40l的突变体,其丧失特异性结合ox40的能力,例如氨基酸51至183,在所述突变体中人ox40l的受体结合结构域的位置180处的苯丙氨酸已置换为丙氨酸(f180a)。
[0357]
ox40激动剂包括其中ox40l的一个或多个结构域共价连接至一个或多个另外的蛋白结构域的融合蛋白。可以用作ox40激动剂的示例性ox40l融合蛋白描述于美国专利6,312,700中,其公开内容以引用的方式整体并入本文。在一个实施方案中,ox40激动剂包括自组装成多聚体(例如,三聚体或六聚体)ox40l融合蛋白的ox40l融合多肽。此类融合蛋白描述于例如美国专利7,959,925中,其以引用的方式整体并入本文。由于能够自发组装成高度稳定的三聚体和六聚体,多聚体ox40l融合蛋白表现出在增强受试体中的抗原特异性免疫反应方面的功效增加。
[0358]
在另一个实施方案中,能够组装成多聚体形式的ox40激动剂包括融合多肽,其在n末端至c末端方向上包括:免疫球蛋白结构域,其中免疫球蛋白结构域包括fc结构域;三聚结构域,其中三聚结构域包括卷曲螺旋三聚结构域;以及受体结合结构域,其中受体结合结构域是ox40受体结合结构域,例如ox40l或其ox40结合片段、变体或衍生物,其中融合多肽可以自组装成三聚体融合蛋白。在一个方面,能够组装成多聚体形式的ox40激动剂能够结合ox40受体并刺激至少一种ox40介导的活性。在某些方面,ox40激动剂包括ox40配体的细胞外结构域。
[0359]
能够组装成多聚体形式的ox40激动剂的三聚结构域用于促进个别ox40l融合多肽分子自组装成三聚体蛋白。因此,具有三聚结构域的ox40l融合多肽自组装成三聚体ox40l融合蛋白。在一个方面,三聚结构域是异亮氨酸拉链结构域或其他卷曲螺旋多肽结构。示例性卷曲螺旋三聚结构域包括:traf2(登录号q12933,氨基酸299
‑
348);血小
板反应蛋白1(登录号po7996,氨基酸291
‑
314);matrilin
‑
4(登录号o95460,氨基酸594
‑
618);cmp(matrilin
‑
1)(登录号np—002370,氨基酸463
‑
496);hsf1(登录号aax42211,氨基酸165
‑
191);以及cubilin(登录号np—001072,氨基酸104
‑
138)。在某些特定方面,三聚结构域包括traf2三聚结构域、matrilin
‑
4三聚结构域或其组合。
[0360]
ox40l fp是人ox40配体igg4p融合蛋白,其特异性结合作为tnfr超家族成员的人ox40受体并触发其信号传导。ox40l fp还描述于us2016/0024176中,所述专利以引用的方式整体并入本文。ox40l fp由三个不同的结构域构成:(1)人ox40配体细胞外受体结合结构域(rbd),其形成同源三聚体(homotrimer)并结合ox40受体;(2)衍生自tnfr相关因子2的异亮氨酸拉链三聚结构域,其使ox40配体rbd的同源三聚体结构稳定;以及(3)人igg4可结晶片段γ(fcγ)结构域,其促进结合ox40受体时融合蛋白的fcγ受体簇集并且在铰链区(igg4p)的位置228处(根据eu编号)含有丝氨酸至脯氨酸取代以促进两组ox40配体rbd同源三聚体的稳定性。igg4p fc结构域与衍生自人肿瘤坏死因子2(traf2)的氨基酸残基310
‑
349的异亮氨酸拉链三聚结构域直接融合。与traf2结构域的c末端融合的是人ox40l(基因名称tnfsf4)的细胞外受体结合结构域(rbd)的氨基酸残基51
‑
183。traf2结构域使ox40l rbd的同源三聚体结构稳定,以实现ox40结合和活化,同时igg4p fc结构域赋予血清稳定性、ox40l三聚体的二聚化并促进六聚体融合蛋白的fcγ受体簇集。一种ox40l fp变体在对应于ox40l中的位置180的氨基酸处具有苯丙氨酸(f)至丙氨酸(a)突变。另一ox40l fp变体具有被人igg1 fc结构域置换的igg4p fc结构域。在具体实施方案中,用于本公开的ox40激动剂是ox40l fp变体中的一种。
[0361]
在具体实施方案中,用于本公开的ox40激动剂已被修饰以增加其血清半衰期。例如,ox40激动剂的血清半衰期可以通过与诸如血清白蛋白、抗体fc区或peg的异源分子的缀合来增加。在某些实施方案中,ox40激动剂可以与其他治疗剂或毒素缀合以形成免疫缀合物和/或融合蛋白。在某些实施方案中,ox40激动剂可以经过配制以便有利于施用并促进活性剂的稳定性。
[0362]
抗体衍生物
[0363]
用于本公开的抗体(例如,抗ctla
‑
4、抗pd
‑
l1、抗pd
‑
1、抗ox40)可包括这些序列的保留特异性结合其靶标的能力的变体。此类变体可通过熟练技术人员使用本领域中熟知的技术由这些抗体的序列衍生得到。例如,可以在fr中和/或cdr中进行氨基酸取代、缺失或添加。尽管fr的变化常常被设计以改善抗体的稳定性和免疫原性,但通常cdr的变化被设计以增加抗体对其靶标的亲和力。fr的变体还包括天然存在的免疫球蛋白同种异型。此类亲和力增加的变化可通过涉及改变cdr并测试抗体对其靶标的亲和力的常规技术来凭经验确定。例如,可以在所公开的cdr中的任一者内进行保守氨基酸取代。各种改变可以根据antibody engineering,第2版,oxford university press,borrebaeck编,1995中所述的方法进行。这些包括但不限于以下核苷酸序列,所述核苷酸序列通过取代编码序列内的功能上等效的氨基酸残基的不同密码子来改变,因此产生“沉默”变化。例如,非极性氨基酸包括丙氨酸、亮氨酸、异亮氨酸、缬氨酸、脯氨酸、苯丙氨酸、色氨酸和甲硫氨酸。极性中性氨基酸包括甘氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺和谷氨酰胺。带正电荷(碱性)的氨基酸包括精氨酸、赖氨酸和组氨酸。带负电荷(酸性)的氨基酸包括天冬氨酸和谷氨酸。
[0364]
本公开的抗体的衍生物和类似物可以通过本领域中熟知的各种技术产生,包括重
组和合成方法(maniatis(1990)molecular cloning,a laboratory manual,第2版,cold spring harbor laboratory,cold spring harbor,n.y.;以及bodansky等人(1995)the practice of peptide synthesis,第2版,spring verlag,berlin,germany)。类似的改组或组合技术还由stemmer(nature(1994)370:389
‑
391)公开,其描述关于β
‑
内酰胺酶基因的技术,但观察到所述方法可用于生成抗体。
[0365]
可使用一个或多个所选择的vh和/或vl基因的随机诱变生成新型的携带衍生自本文所公开的序列的一个或多个序列的vh或vl区域。一种此类技术,易错pcr,由gram等人(proc.nat.acad.sci.u.s.a.(1992)89:3576
‑
3580)描述。
[0366]
可使用的另一方法是引导vh或vl基因的cdr的诱变。此类技术由barbas等人(proc.nat.acad.sci.u.s.a.(1994)91:3809
‑
3813)和schier等人(j.mol.biol.(1996)263:551
‑
567)公开。
[0367]
类似地,可将一个或多个或者全部三个cdr接枝到vh或vl结构域的库中,然后筛选其对ctla
‑
4或pd
‑
l1具有特异性的抗原结合片段。
[0368]
免疫球蛋白可变结构域的一部分将包含实质上如本文所述的cdr中的至少一个和任选的如本文所述的scfv片段的居间框架区。所述部分可包括至少约50%的fr1和fr4中的任一者或两者,所述50%是fr1的c末端50%和fr4的n末端50%。可变结构域的实质部分的n末端或c末端处的另外残基可以是通常与天然存在的可变结构域区域无关的那些。例如,通过重组dna技术构建抗体可导致通过引入以促进克隆或其他操作步骤的接头所编码的n末端或c末端残基的引入。其他操作步骤包括引入接头以将可变结构域连接至另外的蛋白序列,包括免疫球蛋白重链恒定区、其他可变结构域(例如,在双价抗体(diabody)的产生中)或如下文进一步详述中所讨论的蛋白质标记。
[0369]
熟练技术人员将认识到,用于本公开的抗体可包含仅包含来自vl或vh结构域的单一cdr的抗原结合片段。单链特异性结合结构域中的任一者均可以用于筛选能够形成能够例如结合ctla
‑
4和pd
‑
l1的双结构域特异性抗原结合片段的互补结构域。
[0370]
本文所述的用于本公开的抗体可以连接至另一功能分子,例如另一肽或蛋白质(白蛋白、另一抗体等)。例如,可以通过化学交联或通过重组方法连接抗体。抗体也可以美国专利4,640,835、4,496,689、4,301,144、4,670,417、4,791,192或4,179,337中所述的方式连接至多种非蛋白质聚合物中的一种,例如,聚乙二醇、聚丙二醇或聚氧化烯。抗体可以通过与聚合物共价缀合进行化学修饰,例如以增加其循环半衰期。示例性聚合物和连接它们的方法也在美国专利4,766,106、4,179,337、4,495,285和4,609,546中示出。
[0371]
也可将抗体改变成具有不同于天然模式的糖基化模式。例如,可以缺失一个或多个碳水化合物部分和/或将一个或多个糖基化位点添加至原始抗体。将糖基化位点添加至本公开的抗体可通过改变氨基酸序列以含有本领域中已知的糖基化位点共有序列来实现。增加抗体上的碳水化合物部分的数目的另一手段是通过糖苷与抗体的氨基酸残基的化学或酶促偶合。此类方法描述于wo 87/05330和aplin等人(1981)crc crit.rev.biochem.,22:259
‑
306。从抗体中移除任何碳水化合物部分可例如如hakimuddin等人(1987)arch.biochem.biophys.,259:52和edge等人(1981)anal.biochem.,118:131以及thotakura等人(1987)meth.enzymol.,138:350所述以化学方式或以酶促方式实现。也可用可检测或功能标记对抗体加标签。可检测标记包括诸如131i或99tc的放射性标记,也可使
用常规化学方法将其与抗体连接。可检测标记还包括酶标记,诸如辣根过氧化物酶或碱性磷酸酶。可检测标记还包括化学部分,诸如生物素,其可通过结合特定同源可检测部分(例如,标记的抗生物素蛋白)来检测。
[0372]
其中cdr序列仅非实质性不同于本文所示的那些的抗体涵盖在本公开的范围内。通常,氨基酸被具有类似电荷、疏水性或立体化学特征的相关氨基酸取代。此类取代将在技术人员的一般技能内。与在cdr中不同,可以在fr中进行更实质性的变化,而不会不利地影响抗体的结合特性。fr的变化包括但不限于人源化非人来源的框架残基或工程改造某些框架残基,所述框架残基对于抗原接触或稳定结合位点而言是重要的,例如,改变恒定区的类别或亚类,改变可能改变诸如fc受体结合的效应子功能的特定氨基酸残基,例如,如美国专利5,624,821和5,648,260以及lund等人(1991)j.immun.147:2657
‑
2662和morgan等人(1995)immunology 86:319
‑
324中所述,或改变恒定区所来源的物种。
[0373]
本领域技术人员应理解,上文所述的修改不是全部详尽的,并且根据本公开的教导,许多其他修改对于熟练技术人员来说将是明显的。
[0374]
某些化合物
[0375]
在某些实施方案中,本文所述的化合物可以是反义化合物。在某些实施方案中,反义化合物包含寡聚化合物或由其组成。在某些实施方案中,寡聚化合物包含修饰寡核苷酸。在某些实施方案中,修饰寡核苷酸具有与靶核酸的核碱基序列互补的核碱基序列。
[0376]
在某些实施方案中,本文所述的化合物包含修饰寡核苷酸或由其组成。在某些实施方案中,修饰寡核苷酸具有与靶核酸的核碱基序列互补的核碱基序列。
[0377]
在某些实施方案中,化合物或反义化合物是单链的。这一单链化合物或反义化合物包含寡聚化合物或由其组成。在某些实施方案中,这一寡聚化合物包含寡核苷酸和任选的缀合基团或由其组成。在某些实施方案中,寡核苷酸是反义寡核苷酸。在某些实施方案中,寡核苷酸是修饰的。在某些实施方案中,单链反义化合物或寡聚化合物的寡核苷酸包含自身互补的核碱基序列。
[0378]
在某些实施方案中,化合物是双链的。此类双链化合物包含第一修饰寡核苷酸和第二修饰寡核苷酸,所述第一修饰寡核苷酸具有与靶核酸互补的区域,所述第二修饰寡核苷酸具有与第一修饰寡核苷酸互补的区域。在某些实施方案中,修饰寡核苷酸是rna寡核苷酸。在此类实施方案中,修饰寡核苷酸中的胸腺嘧啶核碱基被尿嘧啶核碱基置换。在某些实施方案中,化合物包含缀合基团。在某些实施方案中,修饰寡核苷酸中的一个被缀合。在某些实施方案中,两种修饰寡核苷酸均被缀合。在某些实施方案中,第一修饰寡核苷酸被缀合。在某些实施方案中,第二修饰寡核苷酸被缀合。在某些实施方案中,第一修饰寡核苷酸由12
‑
30个连接核苷组成,并且第二修饰寡核苷酸由12
‑
30个连接核苷组成。在某些实施方案中,修饰寡核苷酸中的一个具有包含seq id no:36
‑
2646或2664
‑
2813中的任一者的至少8个连续核碱基的核碱基序列。在某些实施方案中,修饰寡核苷酸中的一个具有包含seq id no:2
‑
10中的任一者的至少8个连续核碱基的核碱基序列。
[0379]
在某些实施方案中,反义化合物是双链的。此类双链反义化合物包含第一寡聚化合物和第二寡聚化合物,所述第一寡聚化合物具有与靶核酸互补的区域,所述第二寡聚化合物具有与第一寡聚化合物互补的区域。此类双链反义化合物的第一寡聚化合物通常包含修饰寡核苷酸和任选的缀合基团或由其组成。此类双链反义化合物的第二寡聚化合物的寡
核苷酸可以是修饰或未修饰的。双链反义化合物的任一或两种寡聚化合物可包含缀合基团。双链反义化合物的寡聚化合物可包括非互补悬突核苷(overhanging nucleoside)。
[0380]
单链化合物和双链化合物的实例包括但不限于寡核苷酸、sirna、微小rna靶向寡核苷酸和单链rnai化合物,诸如小发夹rna(shrna)、单链sirna(ssrna)和微小rna模拟物。
[0381]
在某些实施方案中,本文所述的化合物具有以下核碱基序列,当在5’至3’方向上书写时,所述核碱基序列包含其所靶向的靶核酸的靶区段的反向补体。
[0382]
在某些实施方案中,本文所述的化合物包含由10至30个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由12至30个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由12至22个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由14至30个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由14至20个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由15至30个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由15至20个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由16至30个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由16至20个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由17至30个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由17至20个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由18至30个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由18至21个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由18至20个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由20至30个连接亚基组成的寡核苷酸。换句话说,此类寡核苷酸分别由12至30个连接亚基、14至30个连接亚基、14至20个亚基、15至30个亚基、15至20个亚基、16至30个亚基、16至20个亚基、17至30个亚基、17至20个亚基、18至30个亚基、18至20个亚基、18至21个亚基、20至30个亚基或12至22个连接亚基组成。在某些实施方案中,本文所述的化合物包含由14个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由16个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由17个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由18个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由19个连接亚基组成的寡核苷酸。在某些实施方案中,本文所述的化合物包含由20个连接亚基组成的寡核苷酸。在其他实施方案中,本文所述的化合物包含由8至80个、12至50个、13至30个、13至50个、14至30个、14至50个、15至30个、15至50个、16至30个、16至50个、17至30个、17至50个、18至22个、18至24个、18至30个、18至50个、19至22个、19至30个、19至50个或20至30个连接亚基组成的寡核苷酸。在某些此类实施方案中,本文所述的化合物包含由以下组成的寡核苷酸:8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、43个、44个、45个、46个、47个、48个、49个、50个、51个、52个、53个、54个、55个、56个、57个、58个、59个、60个、61个、62个、63个、64个、65个、66个、67个、68个、69个、70个、71个、72个、73个、74个、75个、76个、77个、78个、79个或80个连接亚基或上述值中的任何两个所限定的范围。在一些实施方案中,连接亚基是核苷酸、核苷或核碱基。
[0383]
在某些实施方案中,化合物还可包含连接至寡核苷酸的另外的特征或元件,诸如
缀合基团。在某些实施方案中,此类化合物是反义化合物。在某些实施方案中,此类化合物是寡聚化合物。在缀合基团包含核苷(即,将缀合基团连接至寡核苷酸的核苷)的实施方案中,缀合基团的核苷不计入寡核苷酸的长度。
[0384]
在某些实施方案中,化合物可以是缩短或截短的。例如,单一亚基可从5’端缺失(5’截短)或可替代地从3’端缺失(3’截短)。靶向malat1核酸的缩短或截短的化合物可具有两个从化合物的5’端缺失的亚基,或可替代地可具有两个从所述化合物的3’端缺失的亚基。可替代地,缺失的核苷可分散于整个化合物。
[0385]
当单一的另外亚基存在于延长的化合物中时,所述另外亚基可定位于化合物的5’端或3’端。当存在两个或更多个另外亚基时,添加的亚基可彼此相邻,例如在两个亚基添加至化合物的5’端(5’添加)或可替代地添加至所述化合物的3’端(3’添加)的化合物中。可替代地,添加的亚基可分散于整个化合物。
[0386]
可以增加或减小化合物(诸如寡核苷酸)的长度,和/或引入错配碱基而不消除活性(woolf等人,proc.natl.acad.sci.usa1992,89:7305
‑
7309;gautschi等人,j.natl.cancer inst.2001年3月,93:463
‑
471;maher和dolnicknuc.acid.res.1998,16:3341
‑
3358)。然而,寡核苷酸序列、化学性质和基序中的看上去小的变化可能在临床发展所需的许多特性中的一个或多个上产生大的差异(seth等人,j.med.chem.2009,52,10;egli等人,j.am.chem.soc.2011,133,16642)。
[0387]
在某些实施方案中,本文所述的化合物是干扰rna化合物(rnai),其包括双链rna化合物(也称为短干扰rna或sirna)和单链rnai化合物(或ssrna)。此类化合物至少部分地通过risc途径起作用,以降解和/或螯合(sequester)靶核酸(因此,包括微小rna/微小rna
‑
模拟物化合物)。如本文所用,术语sirna旨在等效于用于描述能够介导序列特异性rnai的核酸分子的其他术语,例如短干扰rna(sirna)、双链rna(dsrna)、微小rna(mirna)、短发夹rna(shrna)、短干扰寡核苷酸、短干扰核酸、短干扰修饰寡核苷酸、化学修饰的sirna、转录后基因沉默rna(ptgsrna)等等。此外,如本文所用,术语“rnai”旨在等效于用于描述序列特异性rna干扰的其他术语,诸如转录后基因沉默、转录抑制或表观遗传学。
[0388]
在某些实施方案中,本文所述的化合物可以包含本文所述的靶向malat1的寡核苷酸序列中的任一者。在某些实施方案中,化合物可以是双链的。在某些实施方案中,化合物包含第一链和第二链,所述第一链包含seq id no:2
‑
10或36
‑
2813中的任一者的至少8、9、10、11、12、13、14、15、16、17、18、19或20个连续核碱基的部分。在某些实施方案中,化合物包含第一链和第二链,所述第一链包含seq id no:2
‑
10或36
‑
2813中的任一者的核碱基序列。在某些实施方案中,化合物包含核糖核苷酸,其中第一链在seq id no:2
‑
10或36
‑
2813中的任一者中具有尿嘧啶(u)代替胸腺嘧啶(t)。在某些实施方案中,化合物包含:(i)第一链,其包含与seq id no:2
‑
10或36
‑
2813中的任一者所靶向的malat1上的位点互补的核碱基序列;以及(ii)第二链。在某些实施方案中,化合物包含第一链和第二链,所述第一链包含seq id no:2
‑
10中的任一者的至少8、9、10、11、12、13、14、15、16、17、18、19或20个连续核碱基的部分。在某些实施方案中,化合物包含第一链和第二链,所述第一链包含seq id no:2
‑
10中的任一者的核碱基序列。在某些实施方案中,化合物包含核糖核苷酸,其中第一链在seq id no:2
‑
10中的任一者中具有尿嘧啶(u)代替胸腺嘧啶(t)。在某些实施方案中,化合物包含:(i)第一链,其包含与seq id no:2
‑
10中的任一者所靶向的malat1上的位点互补的核碱基
序列;以及(ii)第二链。在某些实施方案中,化合物包含一个或多个修饰核苷酸,其中糖中的2’位含有卤素(诸如氟基;2
’‑
f)或含有烷氧基(诸如甲氧基;2
’‑
ome)。在某些实施方案中,化合物包含至少一个2
’‑
f糖修饰和至少一个2
’‑
ome糖修饰。在某些实施方案中,至少一个2
’‑
f糖修饰和至少一个2
’‑
ome糖修饰沿着dsrna化合物的一条链以交替的模式排列至少2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17、个18个、19个或20个连续核碱基。在某些实施方案中,化合物在相邻核苷酸之间包含一个或多个除天然存在的磷酸二酯键之外的键。此类键的实例包括磷酰胺、硫代磷酸酯和二硫代磷酸酯键。化合物也可以是化学修饰的核酸分子,如美国专利6,673,661中所教导。在其他实施方案中,化合物含有一条或两条加帽链(capped strand),如例如2000年4月19日提交的wo 00/63364所公开。
[0389]
在某些实施方案中,化合物的第一链是sirna引导链,并且化合物的第二链是sirna随从链。在某些实施方案中,化合物的第二链与第一链互补。在某些实施方案中,化合物的每条链均由16个、17个、18个、19个、20个、21个、22个或23个连接核苷组成。在某些实施方案中,化合物的第一链或第二链可以包含缀合基团。
[0390]
在某些实施方案中,本文所述的化合物可以包含本文所述的靶向malat1的寡核苷酸序列中的任一者。在某些实施方案中,化合物是单链的。在某些实施方案中,这一化合物是单链rnai(ssrnai)化合物。在某些实施方案中,化合物包含seq id no:2
‑
10或36
‑
2813中的任一者的至少8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个或20个连续核碱基的部分。在某些实施方案中,化合物包含seq id no:2
‑
10或36
‑
2813中的任一者的核碱基序列。在某些实施方案中,化合物包含核糖核苷酸,其中在seq id no:2
‑
10或36
‑
2813中的任一者中尿嘧啶(u)代替胸腺嘧啶(t)。在某些实施方案中,化合物包含核碱基序列,其与seq id no:2
‑
10或36
‑
2813中的任一者所靶向的malat1上的位点互补。在某些实施方案中,化合物包含seq id no:2
‑
10中的任一者的至少8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个或20个连续核碱基的部分。在某些实施方案中,化合物包含seq id no:2
‑
10中的任一者的核碱基序列。在某些实施方案中,化合物包含核糖核苷酸,其中在seq id no:2
‑
10中的任一者中尿嘧啶(u)代替胸腺嘧啶(t)。在某些实施方案中,化合物包含核碱基序列,其与seq id no:2
‑
10中的任一者所靶向的malat1上的位点互补。在某些实施方案中,化合物包含一个或多个修饰核苷酸,其中糖中的2’位含有卤素(诸如氟基;2
’‑
f)或含有烷氧基(诸如甲氧基;2
’‑
ome)。在某些实施方案中,化合物包含至少一个2
’‑
f糖修饰和至少一个2
’‑
ome糖修饰。在某些实施方案中,至少一个2
’‑
f糖修饰和至少一个2
’‑
ome糖修饰沿着化合物的一条链以交替的模式排列至少2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个或20个连续核碱基。在某些实施方案中,化合物在相邻核苷酸之间包含一个或多个除天然存在的磷酸二酯键之外的键。此类键的实例包括磷酰胺、硫代磷酸酯和二硫代磷酸酯键。化合物也可以是化学修饰的核酸分子,如美国专利6,673,661所教导。在其他实施方案中,化合物含有加帽链,如例如2000年4月19日提交的wo 00/63364所公开。在某些实施方案中,化合物由16个、17个、18个、19个、20个、21个、22个或23个连接核苷组成。在某些实施方案中,化合物可以包含缀合基团。
[0391]
在某些实施方案中,本文所述的化合物包含修饰寡核苷酸。某些修饰寡核苷酸具有一个或多个不对称中心并且因此产生对映异构体、非对映异构体以及其他立体异构构
型,其可定义为(r)或(s)(就绝对立体化学而言)、α或β(诸如就糖端基异构体而言),或(d)或(l)(诸如就氨基酸而言)等等。除非另外指定,否则本文所提供的修饰寡核苷酸中包括所有此类可能的异构体,包括其外消旋和光学纯形式。同样地,也包括所有顺式和反式异构体以及互变异构形式。
[0392]
本文所述的化合物包括以下变化,在所述变化中一个或多个原子被所指示元素的非放射性同位素或放射性同位素置换。例如,包含氢原子的本文化合物涵盖各1h氢原子的所有可能的氘取代。本文化合物所涵盖的同位素取代包括但不限于:2h或3h代替1h;
13
c或
14
c代替
12
c;
15
n代替
14
n;
17
o或
18
o代替
16
o;以及
33
s、
34
s、
35
s或
36
s代替
32
s。在某些实施方案中,非放射性同位素取代可对化合物赋予新的有利于用作治疗或研究工具的特性。在某些实施方案中,放射性同位素取代可制备适用于研究或诊断目的诸如成像测定的化合物。
[0393]
某些机制
[0394]
在某些实施方案中,本文所述的化合物包含修饰寡核苷酸或由其组成。在某些实施方案中,本文所述的化合物是反义化合物。在某些实施方案中,化合物包含寡聚化合物。在某些实施方案中,本文所述的化合物能够与靶核酸杂交,得到至少一种反义活性。在某些实施方案中,本文所述的化合物选择性地影响一种或多种靶核酸。此类化合物包含核碱基序列,所述核碱基序列与一个或多个靶核酸杂交,得到一种或多种期望的反义活性,并且不与一个或多个非靶核酸杂交或不以产生显著的非期望反义活性的方式与一个或多个非靶核酸杂交。
[0395]
在某些反义活性中,本文所述的化合物与靶核酸的杂交导致切割靶核酸的蛋白质的募集。例如,本文所述的某些化合物导致靶核酸的核糖核酸酶h介导的切割。核糖核酸酶h是切割rna:dna双链体的rna链的细胞核酸内切酶。这一rna:dna双链体中的dna不一定是未修饰dna。在某些实施方案中,本文所述的化合物足够“像dna”以引发核糖核酸酶h活性。此外,在某些实施方案中,间隔体的间隙中的一个或多个不像dna的核苷是容许的。
[0396]
在某些反义活性中,本文所述的化合物或化合物的一部分被加载到rna诱导的沉默复合物(risc)中,最终导致靶核酸的切割。例如,本文所述的某些化合物导致靶核酸被argonaute切割。加载到risc中的化合物是rnai化合物。rnai化合物可以是双链的(sirna)或单链的(ssrna)。
[0397]
在某些实施方案中,本文所述的化合物与靶核酸的杂交不导致切割靶核酸的蛋白质的募集。在某些此类实施方案中,化合物与靶核酸的杂交导致靶核酸的剪接的改变。在某些实施方案中,化合物与靶核酸的杂交导致靶核酸与蛋白质或其他核酸之间的结合相互作用的抑制。在某些此类实施方案中,化合物与靶核酸的杂交导致靶核酸的翻译的改变。
[0398]
可直接或间接地观察反义活性。在某些实施方案中,反义活性的观察或检测涉及观察或检测靶核酸或此类靶核酸所编码的蛋白质的量的变化、核酸或蛋白质的剪接变体的比率的变化,和/或细胞或动物的表型变化。
[0399]
靶核酸、靶区域和核苷酸序列
[0400]
在某些实施方案中,本文所述的化合物包含以下寡核苷酸或由其组成,所述寡核苷酸包含与靶核酸互补的区域。在某些实施方案中,靶核酸是内源性rna分子。在某些实施方案中,靶核酸编码蛋白质。在某些此类实施方案中,靶核酸选自:mrna和前体mrna,包括内含子区、外显子区和非翻译区。在某些实施方案中,靶rna是mrna。在某些实施方案中,靶核
酸是前体mrna。在某些此类实施方案中,靶区域完全在内含子内。在某些实施方案中,靶区域跨越内含子/外显子接点。在某些实施方案中,靶区域至少50%在内含子内。
[0401]
编码malat1的核苷酸序列包括但不限于以下:refseq no.xr_001309.1(seq id no:1),其以引用的方式整体并入本文。
[0402]
杂交
[0403]
在一些实施方案中,在本文所公开的化合物与malat1核酸之间发生杂交。杂交的最常见机制涉及核酸分子的互补核碱基之间的氢键合(例如,watson
‑
crick、hoogsteen或反向hoogsteen氢键合)。
[0404]
可以在不同条件下发生杂交。杂交条件具有序列依赖性并且由待杂交的核酸分子的性质和组成确定。
[0405]
确定序列是否可与靶核酸特异性杂交的方法是本领域中熟知的。在某些实施方案中,本文所提供的化合物可与malat1核酸特异性杂交。
[0406]
互补性
[0407]
当在相反方向上将两个核碱基序列对齐时,寡核苷酸或其一个或多个区域的核碱基序列与另一寡核苷酸或核酸或其一个或多个区域的核碱基序列匹配时,称这一寡核苷酸与另一核酸互补。除非另外指定,否则如本文所述的核碱基匹配或互补核碱基限于以下各对:腺嘌呤(a)和胸腺嘧啶(t)、腺嘌呤(a)和尿嘧啶(u)、胞嘧啶(c)和鸟嘌呤(g),以及5
‑
甲基胞嘧啶(mc)和鸟嘌呤(g)。互补寡核苷酸和/或核酸不必在各核苷处均具有核碱基互补性并且可包括一个或多个核碱基错配。当此类寡核苷酸在各核苷处均具有核碱基匹配而无任何核碱基错配时,寡核苷酸是完全互补或100%互补的。
[0408]
在某些实施方案中,本文所述的化合物包含修饰寡核苷酸或由其组成。在某些实施方案中,本文所述的化合物是反义化合物。在某些实施方案中,化合物包含寡聚化合物。化合物与malat1核酸之间的非互补核碱基可以是容许的,前提条件是化合物仍能够与靶核酸特异性杂交。此外,化合物可在malat1核酸的一个或多个区段上杂交,使得居间或相邻区段不涉及杂交事件(例如,环结构、错配或发夹结构)。
[0409]
在某些实施方案中,本文所提供的化合物或其指定部分与malat1核酸、其靶区域、靶区段或指定部分是、是至少或是至多70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%互补的。在某些实施方案中,本文所提供的化合物或其指定部分与malat1核酸、其靶区域、靶区段或指定部分是70%至75%、75%至80%、80%至85%、85%至90%、90%至95%、95%至100%(或这些范围之间的任何数字)互补的。化合物与靶核酸的互补性百分比可以使用常规方法确定。
[0410]
例如,化合物的20个核碱基中有18个核碱基与靶区域互补并且因此将特异性杂交的化合物将表示90%互补性。在此实例中,其余非互补核碱基可与互补核碱基簇集或交替并且不必彼此连续或与互补核碱基连续。因此,由18个核碱基(其具有4个非互补核碱基,所述核碱基侧接两个与靶核酸完全互补的区域)组成的化合物将与靶核酸具有77.8%的总体互补性。化合物与靶核酸的区域的互补性百分比可以常规地使用本领域中已知的blast程序(基本局部比对搜索工具(basic local alignment search tool))和powerblast程序来确定(altschul等人,j.mol.biol.,1990,215,403 410;zhang和madden,genome res.,1997,7,649 656)。同源性、序列同一性或互补性百分比可以通过例如使用smith和
waterman(adv.appl.math.,1981,2,482489)的算法的gap程序(威斯康星序列分析包(wisconsin sequence analysis package),用于unix的版本8,genetics computer group,university research park,madison wis.)使用默认设置来确定。
[0411]
在某些实施方案中,本文所述的化合物或其指定部分与靶核酸或其指定部分完全互补(即,100%互补)。例如,化合物可与malat1核酸或其靶区域或靶区段或靶序列完全互补。如本文所用,“完全互补”是指化合物的各核碱基均与靶核酸的对应核碱基互补。例如,20个核碱基的化合物与长400个核碱基的靶序列完全互补,只要靶核酸中存在与化合物完全互补的对应的20个核碱基的部分即可。完全互补也可以关于第一核酸和/或第二核酸的指定部分使用。例如,30个核碱基的化合物的20个核碱基的部分可以与长400个核碱基的靶序列“完全互补”。当靶序列具有对应的20个核碱基的部分时,30个核碱基的化合物的20个核碱基的部分与靶序列完全互补,其中各核碱基与化合物的20个核碱基的部分互补。同时,整个30个核碱基的化合物可与靶序列完全互补或不完全互补,这取决于化合物的其余10个核碱基是否也与靶序列互补。
[0412]
在某些实施方案中,本文所述的化合物相对于靶核酸包含一个或多个错配核碱基。在某些此类实施方案中,针对靶标的反义活性因此类错配而减小,但针对非靶标的活性减少更大的量。因此,在某些此类实施方案中,化合物的选择性得到改善。在某些实施方案中,错配特定地位于具有间隔体基序的寡核苷酸内。在某些此类实施方案中,错配位于间隙区的5’端的位置1、2、3、4、5、6、7或8处。在某些此类实施方案中,错配位于间隙区的3’端的位置9、8、7、6、5、4、3、2、1处。在某些此类实施方案中,错配位于侧翼区的5’端的位置1、2、3或4处。在某些此类实施方案中,错配位于侧翼区的3’端的位置4、3、2或1处。在某些实施方案中,错配特定地位于不具有间隔体基序的寡核苷酸内。在某些此类实施方案中,错配位于寡核苷酸的5’端的位置1、2、3、4、5、6、7、8、9、10、11或12处。在某些此类实施方案中,错配位于寡核苷酸的3’端的位置2、3、4、5、6、7、8、9、10、11或12处。
[0413]
非互补核碱基的定位可以是化合物的5’端或3’端。可替代地,一个或多个非互补核碱基可处于化合物的内部位置。当存在两个或更多个非互补核碱基时,其可以是连续的(即,连接的)或不连续的。在一个实施方案中,非互补核碱基位于间隔体寡核苷酸的侧翼区段中。
[0414]
在某些实施方案中,长度为或为至多11个、12个、13个、14个、15个、16个、17个、18个、19个或20个核碱基的本文所述的化合物相对于靶核酸(诸如malat1核酸)或其指定部分包含不超过4个、不超过3个、不超过2个或不超过1个非互补核碱基。
[0415]
在某些实施方案中,长度为或为至多11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个或30个核碱基的本文所述的化合物相对于靶核酸(诸如malat1核酸)或其指定部分包含不超过6个、不超过5个、不超过4个、不超过3个、不超过2个或不超过1个非互补核碱基。
[0416]
在某些实施方案中,本文所述的化合物还包括与靶核酸的一部分互补的那些。如本文所用,“部分”是指靶核酸的区域或区段内限定数目的连续(即,连接的)核碱基。“部分”还可以指化合物中限定数目的连续核碱基。在某些实施方案中,化合物与靶区段中至少8个核碱基的部分互补。在某些实施方案中,化合物与靶区段中至少9个核碱基的部分互补。在某些实施方案中,化合物与靶区段中至少10个核碱基的部分互补。在某些实施方案中,化合
物与靶区段中至少11个核碱基的部分互补。在某些实施方案中,化合物与靶区段中至少12个核碱基的部分互补。在某些实施方案中,化合物与靶区段中至少13个核碱基的部分互补。在某些实施方案中,化合物与靶区段中至少14个核碱基的部分互补。在某些实施方案中,化合物与靶区段中至少15个核碱基的部分互补。在某些实施方案中,化合物与靶区段中至少16个核碱基的部分互补。还涵盖与靶区段中至少9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个或更多个(或由这些值中的任何两个所限定的范围)核碱基的部分互补的化合物。
[0417]
同一性
[0418]
本文所提供的化合物也可与具体核苷酸序列seq id no或由特定ion编号表示的化合物或其部分具有限定的同一性百分比。在某些实施方案中,本文所述的化合物是反义化合物或寡聚化合物。在某些实施方案中,本文所述的化合物是修饰寡核苷酸。如本文所用,如果化合物具有相同的核碱基配对能力,则其与本文所公开的序列是一致的。例如,含有尿嘧啶代替所公开的dna序列中的胸腺嘧啶的rna将被视为与dna序列一致,因为尿嘧啶和胸腺嘧啶都与腺嘌呤配对。还涵盖本文所述的化合物的缩短和延长型式以及相对于本文提供的化合物具有不一致碱基的化合物。不一致碱基可彼此相邻或分散于整个化合物中。化合物的同一性百分比根据相对于与其比较的序列具有一致碱基配对的碱基的数目来计算。
[0419]
在某些实施方案中,本文所述的化合物或其部分与本文所公开的一种或多种化合物或seq id no或其部分具有或具有至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性。在某些实施方案中,本文所述的化合物与具体核苷酸序列、seq id no或由特定ion编号表示的化合物或其部分具有约70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%(或此类值之间的任何百分比)的同一性,其中化合物包含具有一个或多个错配核碱基的寡核苷酸。在某些此类实施方案中,错配位于寡核苷酸的5’端的位置1、2、3、4、5、6、7、8、9、10、11或12处。在某些此类实施方案中,错配位于寡核苷酸的3’端的位置2、3、4、5、6、7、8、9、10、11或12处。
[0420]
在某些实施方案中,本文所述的化合物包含反义化合物或由其组成。在某些实施方案中,将反义化合物的一部分与靶核酸的等长部分相比较。在某些实施方案中,将8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个或25个核碱基的部分与靶核酸的等长部分相比较。
[0421]
在某些实施方案中,本文所述的化合物包含寡核苷酸或由其组成。在某些实施方案中,将寡核苷酸的一部分与靶核酸的等长部分相比较。在某些实施方案中,将8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个或25个核碱基的部分与靶核酸的等长部分相比较。
[0422]
某些修饰的化合物
[0423]
在某些实施方案中,本文所述的化合物包含由连接核苷组成的寡核苷酸或由其组成。寡核苷酸可以是未修饰寡核苷酸(rna或dna)或可以是修饰寡核苷酸。修饰寡核苷酸相对于未修饰rna或dna包括至少一个修饰(即,包含至少一个修饰的核苷(包含修饰的糖部分和/或修饰的核碱基)和/或至少一个修饰的核苷间键)。
[0424]
a.修饰的核苷
[0425]
修饰的核苷包含修饰的糖部分或修饰的核碱基,或修饰的糖部分和修饰的核碱基两者。
[0426]
1.修饰的糖部分
[0427]
在某些实施方案中,糖部分是非双环的修饰的糖部分。在某些实施方案中,修饰的糖部分是双环或三环糖部分。在某些实施方案中,修饰的糖部分是糖替代物。此类糖替代物可包含一个或多个取代,所述取代与其他类型的修饰的糖部分的那些取代相对应。
[0428]
在某些实施方案中,修饰的糖部分是包含具有一个或多个非环取代基的呋喃糖基环的非双环的修饰的糖部分,所述一个或多个非环取代基包括但不限于处于2’、4’和/或5’位的取代基。在某些实施方案中,非双环的修饰的糖部分的一个或多个非环取代基是具有支链的。适于非双环的修饰的糖部分的2
’‑
取代基的实例包括但不限于:2
’‑
f、2
’‑
och3(“ome”或“o
‑
甲基”)和2
’‑
o(ch2)2och3(“moe”)。在某些实施方案中,2
’‑
取代基选自:卤素、烯丙基、氨基、叠氮基、sh、cn、ocn、cf3、ocf3、o
‑
c1‑
c
10
烷氧基、o
‑
c1‑
c
10
取代的烷氧基、o
‑
c1‑
c
10
烷基、o
‑
c1‑
c
10
取代的烷基、s
‑
烷基、n(r
m
)
‑
烷基、o
‑
烯基、s
‑
烯基、n(r
m
)
‑
烯基、o
‑
炔基、s
‑
炔基、n(r
m
)
‑
炔基、o
‑
亚烷基
‑
o
‑
烷基、炔基、烷芳基、芳烷基、o
‑
烷芳基、o
‑
芳烷基、o(ch2)2sch3、o(ch2)2on(r
m
)(r
n
)或och2c(=o)
‑
n(r
m
)(r
n
),其中各r
m
和r
n
独立地为h、氨基保护基,或取代或未取代的c1‑
c
10
烷基,以及以下各项中所述的2
’‑
取代基:cook等人,u.s.6,531,584;cook等人,u.s.5,859,221;以及cook等人,u.s.6,005,087。这些2
’‑
取代基的某些实施方案可以进一步被一个或多个独立地选自以下的取代基取代:羟基、氨基、烷氧基、羧基、苄基、苯基、硝基(no2)、硫醇、硫代烷氧基、硫代烷基、卤素、烷基、芳基、烯基和炔基。适于线性非双环的修饰的糖部分的4
’‑
取代基的实例包括但不限于烷氧基(例如,甲氧基)、烷基以及manoharan等人,wo 2015/106128中所述的那些。适于非双环的修饰的糖部分的5
’‑
取代基的实例包括但不限于:5
’‑
甲基(r或s)、5
’‑
乙烯基和5
’‑
甲氧基。在某些实施方案中,非双环的修饰的糖包含多于一个非桥接糖取代基,例如2
’‑
f
‑5’‑
甲基糖部分以及以下各项中所述的修饰的糖部分和修饰的核苷:migawa等人,us2010/190837和rajeev等人,us2013/0203836。
[0429]
在某些实施方案中,2
’‑
取代的核苷或2
’‑
非双环修饰核苷包含糖部分,所述糖部分包含选自以下的线性2
’‑
取代基:f、nh2、n3、ocf3、och3、o(ch2)3nh2、ch2ch=ch2、och2ch=ch2、och2ch2och3、o(ch2)2sch3、o(ch2)2on(r
m
)(r
n
)、o(ch2)2o(ch2)2n(ch3)2和n
‑
取代的乙酰胺(och2c(=o)
‑
n(r
m
)(r
n
)),其中各r
m
和r
n
独立地为h、氨基保护基,或取代或未取代的c1‑
c
10
烷基。
[0430]
在某些实施方案中,2
’‑
取代的核苷或2
’‑
非双环修饰核苷包含糖部分,所述糖部分包含选自以下的线性2
’‑
取代基:f、ocf3、och3、och2ch2och3、o(ch2)2sch3、o(ch2)2on(ch3)2、o(ch2)2o(ch2)2n(ch3)2和och2c(=o)
‑
n(h)ch3(“nma”)。
[0431]
在某些实施方案中,2
’‑
取代的核苷或2
’‑
非双环修饰核苷包含糖部分,所述糖部分包含选自以下的线性2
’‑
取代基:f、och3和och2ch2och3。
[0432]
包含修饰的糖部分(诸如非双环的修饰的糖部分)的核苷通过核苷的糖部分上的一个或多个取代的一个或多个位置来指代。例如,包含2
’‑
取代或2
‑
修饰的糖部分的核苷被称为2
’‑
取代的核苷或2
‑
修饰的核苷。
[0433]
某些修饰的糖部分包含形成第二环从而得到双环糖部分的桥接糖取代基。在某些
此类实施方案中,双环糖部分在4’与2’呋喃糖环原子之间包括桥。此类4’至2’桥接糖取代基的实例包括但不限于:4
’‑
ch2‑2’
、4
’‑
(ch2)2‑2’
、4
’‑
(ch2)3‑2’
、4
’‑
ch2‑
o
‑2’
(“lna”)、4
’‑
ch2‑
s
‑2’
、4
’‑
(ch2)2‑
o
‑2’
(“ena”)、4
’‑
ch(ch3)
‑
o
‑2’
(称为“限制性乙基”或“cet”,当处于s构型时)、4
’‑
ch2‑
o
‑
ch2‑2’
、4
’‑
ch2‑
n(r)
‑2’
、4
’‑
ch(ch2och3)
‑
o
‑2’
(“限制性moe”或“cmoe”)及其类似物(参见例如seth等人,u.s.7,399,845;bhat等人,u.s.7,569,686;swayze等人,u.s.7,741,457;以及swayze等人,u.s.8,022,193)、4
’‑
c(ch3)(ch3)
‑
o
‑2’
及其类似物(参见例如seth等人,u.s.8,278,283)、4
’‑
ch2‑
n(och3)
‑2’
及其类似物(参见例如prakash等人,u.s.8,278,425)、4
’‑
ch2‑
o
‑
n(ch3)
‑2’
(参见例如allerson等人,u.s.7,696,345和allerson等人,u.s.8,124,745)、4
’‑
ch2‑
c(h)(ch3)
‑2’
(参见例如zhou等人,j.org.chem.,2009,74,118
‑
134)、4
’‑
ch2‑
c(=ch2)
‑2’
及其类似物(参见例如seth等人,u.s.8,278,426)、4
’‑
c(r
a
r
b
)
‑
n(r)
‑
o
‑2’
、4
’‑
c(r
a
r
b
)
‑
o
‑
n(r)
‑2’
、4
’‑
ch2‑
o
‑
n(r)
‑2’
以及4
’‑
ch2‑
n(r)
‑
o
‑2’
,其中各r、r
a
和r
b
独立地为h、保护基或c1‑
c
12
烷基(参见例如imanishi等人,u.s.7,427,672)。
[0434]
在某些实施方案中,此类4’至2’桥独立地包括1至4个独立地选自以下的连接基团:
‑
[c(r
a
)(r
b
)]
n
‑
、
‑
[c(r
a
)(r
b
)]
n
‑
o
‑
、
‑
c(r
a
)=c(r
b
)
‑
、
‑
c(r
a
)=n
‑
、
‑
c(=nra)
‑
、
‑
c(=o)
‑
、
‑
c(=s)
‑
、
‑
o
‑
、
‑
si(r
a
)2‑
、
‑
s(=o)
x
‑
和
‑
n(r
a
)
‑
;
[0435]
其中:
[0436]
x是0、1或2;
[0437]
n是1、2、3或4;
[0438]
各r
a
和r
b
独立地为h、保护基、羟基、c1‑
c
12
烷基、取代的c1‑
c
12
烷基、c2‑
c
12
烯基、取代的c2‑
c
12
烯基、c2‑
c
12
炔基、取代的c2‑
c
12
炔基、c5‑
c
20
芳基、取代的c5‑
c
20
芳基、杂环自由基、取代的杂环自由基、杂芳基、取代的杂芳基、c5‑
c7脂环自由基、取代的c5‑
c7脂环自由基、卤素、oj1、nj1j2、sj1、n3、cooj1、酰基(c(=o)
‑
h)、取代的酰基、cn、磺酰基(s(=o)2‑
j1)或亚磺酰基(s(=o)
‑
j1);并且各j1和j2独立地为h、c1‑
c
12
烷基、取代的c1‑
c
12
烷基、c2‑
c
12
烯基、取代的c2‑
c
12
烯基、c2‑
c
12
炔基、取代的c2‑
c
12
炔基、c5‑
c
20
芳基、取代的c5‑
c
20
芳基、酰基(c(=o)
‑
h)、取代的酰基、杂环自由基、取代的杂环自由基、c1‑
c
12
氨基烷基、取代的c1‑
c
12
氨基烷基或保护基。
[0439]
另外的双环糖部分是本领域中已知的,参见例如:freier等人,nucleic acids research,1997,25(22),4429
‑
4443;albaek等人,j.org.chem.,2006,71,7731
‑
7740;singh等人,chem.commun.,1998,4,455
‑
456;koshkin等人,tetrahedron,1998,54,3607
‑
3630;wahlestedt等人,proc.natl.acad.sci.u.s.a.,2000,97,5633
‑
5638;kumar等人,bioorg.med.chem.lett.,1998,8,2219
‑
2222;singh等人,j.org.chem.,1998,63,10035
‑
10039;srivastava等人,j.am.chem.soc.,2007,129,8362
‑
8379;elayadi等人,curr.opinion invens.drugs,2001,2,558
‑
561;braasch等人,chem.biol.,2001,8,1
‑
7;orum等人,curr.opinion mol.ther.,2001,3,239
‑
243;wengel等人,u.s.7,053,207;imanishi等人,u.s.6,268,490;imanishi等人u.s.6,770,748;imanishi等人,u.s.re44,779;wengel等人,u.s.6,794,499;wengel等人,u.s.6,670,461;wengel等人,u.s.7,034,133;wengel等人,u.s.8,080,644;wengel等人,u.s.8,034,909;wengel等人,u.s.8,153,365;wengel等人,u.s.7,572,582;以及ramasamy等人,u.s.6,525,191;torsten等人,wo 2004/106356;wengel等人,wo 1999/014226;seth等人,wo 2007/134181;seth等人,u.s.7,
547,684;seth等人,u.s.7,666,854;seth等人,u.s.8,088,746;seth等人,u.s.7,750,131;seth等人,u.s.8,030,467;seth等人,u.s.8,268,980;seth等人,u.s.8,546,556;seth等人,u.s.8,530,640;migawa等人,u.s.9,012,421;seth等人,u.s.8,501,805;allerson等人,us2008/0039618;以及migawa等人,us2015/0191727。
[0440]
在某些实施方案中,双环糖部分和掺入此类双糖部分的核苷进一步通过异构构型定义。例如,lna核苷(本文所述)可处于α
‑
l构型或处于β
‑
d构型。
[0441][0442]
α
‑
l
‑
亚甲氧基(4
’‑
ch2‑
o
‑2’
)或α
‑
l
‑
lna双环核苷已掺入显示出反义活性的寡核苷酸中(frieden等人,nucleic acids research,2003,21,6365
‑
6372)。在此,双环核苷的一般描述包括两种异构构型。除非另外指定,否则当在本文的例示实施方案中鉴定特定双环核苷(例如,lna或cet)的位置时,其处于β
‑
d构型。
[0443]
在某些实施方案中,修饰的糖部分包含一个或多个非桥接糖取代基和一个或多个桥接糖取代基(例如,5
’‑
取代和4
’‑2’
桥接的糖)。
[0444]
在某些实施方案中,修饰的糖部分是糖替代物。在某些此类实施方案中,糖部分的氧原子被例如硫、碳或氮原子置换。在某些此类实施方案中,此类修饰的糖部分还包含如本文所述的桥接和/或非桥接取代基。例如,某些糖替代物包含4
’‑
硫原子和2
’‑
位(参见例如,bhat等人,u.s.7,875,733和bhat等人,u.s.7,939,677)和/或5’位上的取代。
[0445]
在某些实施方案中,糖替代物包含具有除5个原子之外的环。例如,在某些实施方案中,糖替代物包括六元四氢吡喃(“thp”)。此类四氢吡喃可进一步修饰或取代。包含此类修饰的四氢吡喃的核苷包括但不限于己糖醇核酸(“hna”)、安尼妥(anitol)核酸(“ana”)、甘露醇(manitol)核酸(“mna”)(参见例如,leumann,cj.bioorg.&med.chem.2002,10,841
‑
854)、氟hna:
[0446][0447]
(“f
‑
hna”,参见例如swayze等人,u.s.8,088,904;swayze等人,u.s.8,440,803;以及swayze等人,u.s.9,005,906;f
‑
hna还可称为f
‑
thp或3
’‑
氟四氢吡喃)以及包含另外的具有下式的修饰的thp化合物的核苷:
[0448][0449]
其中,对于所述修饰的thp核苷中的每一个,独立地:
[0450]
bx是核碱基部分;
[0451]
t3和t4各自独立地为将修饰的thp核苷连接至寡核苷酸的其余部分的核苷间连接基团,或者t3和t4中的一个是将修饰的thp核苷连接至寡核苷酸的其余部分的核苷间连接基团,并且t3和t4中的另一个是h、羟基保护基、连接的缀合基团,或5’或3’末端基团;q1、q2、q3、q4、q5、q6和q7各自独立地为h、c1‑
c6烷基、取代的c1‑
c6烷基、c2‑
c6烯基、取代的c2‑
c6烯基、c2‑
c6炔基或取代的c2‑
c6炔基;并且r1和r2中的每一个独立地选自:氢、卤素、取代或未取代的烷氧基、nj1j2、sj1、n3、oc(=x)j1、oc(=x)nj1j2、nj3c(=x)nj1j2,和cn,其中x是o、s或nj1,并且各j1、j2和j3独立地为h或c1‑
c6烷基。
[0452]
在某些实施方案中,提供修饰的thp核苷,其中q1、q2、q3、q4、q5、q6和q7各自是h。在某些实施方案中,q1、q2、q3、q4、q5、q6和q7中的至少一个不是h。在某些实施方案中,q1、q2、q3、q4、q5、q6和q7中的至少一个是甲基。在某些实施方案中,提供修饰的thp核苷,其中r1和r2中的一个是f。在某些实施方案中,r1是f并且r2是h,在某些实施方案中,r1是甲氧基并且r2是h,并且在某些实施方案中,r1是甲氧基乙氧基并且r2是h。
[0453]
在某些实施方案中,糖替代物包含具有多于5个原子和多于一个杂原子的环。例如,已报道了包含吗啉基糖部分的糖苷以及其在寡核苷酸中的使用(参见例如braasch等人,biochemistry,2002,41,4503
‑
4510和summerton等人,u.s.5,698,685;summerton等人,u.s.5,166,315;summerton等人,u.s.5,185,444;以及summerton等人,u.s.5,034,506)。如此处所用,术语“吗啉基”是指具有以下结构的糖替代物:
[0454][0455]
在某些实施方案中,吗啉基可例如通过添加或改变来自以上吗啉基结构的各种取代基进行修饰。此类糖替代物在本文中称为“修饰的吗啉基”。
[0456]
在某些实施方案中,糖替代物包含非环部分。包含此类非环糖替代物的核苷和寡核苷酸的实例包括但不限于:肽核酸(“pna”)、非环丁基核酸(参见例如,kumar等人,org.biomol.chem.,2013,11,5853
‑
5865)以及manoharan等人,us2013/130378中所述的核苷和寡核苷酸。
[0457]
可以在修饰的核苷中使用的许多其他双环和三环糖和糖替代物环系是本领域已知的。
[0458]
2.修饰的核碱基
[0459]
核碱基(或碱基)修饰或取代在结构上可区别于天然存在或合成的未修饰核碱基,
但在功能上可与所述天然存在或合成的未修饰核碱基互换。天然核碱基和修饰的核碱基均能够参与氢键合。此类核碱基修饰可以对反义化合物赋予核酸酶稳定性、结合亲和力或一些其他有益的生物学特性。
[0460]
在某些实施方案中,本文所述的化合物包含修饰寡核苷酸。在某些实施方案中,修饰寡核苷酸包含一个或多个包含未修饰核碱基的核苷。在某些实施方案中,修饰寡核苷酸包含一个或多个包含修饰核碱基的核苷。在某些实施方案中,修饰寡核苷酸包含一个或多个不包含核碱基的核苷,称为无碱基核苷。
[0461]
在某些实施方案中,修饰的核碱基选自:5
‑
取代的嘧啶、6
‑
氮杂嘧啶、烷基或炔基取代的嘧啶、烷基取代的嘌呤,以及n
‑
2、n
‑
6、和o
‑
6取代的嘌呤。在某些实施方案中,修饰的核碱基选自:2
‑
氨基丙基腺嘌呤;5
‑
羟甲基胞嘧啶;5
‑
甲基胞嘧啶;黄嘌呤;次黄嘌呤;2
‑
氨基腺嘌呤;6
‑
n
‑
甲基鸟嘌呤;6
‑
n
‑
甲基腺嘌呤;2
‑
丙基腺嘌呤;2
‑
硫代尿嘧啶;2
‑
硫代胸腺嘧啶;以及2
‑
硫代胞嘧啶;5
‑
丙炔基(c≡c
‑
ch3)尿嘧啶;5
‑
丙炔基胞嘧啶;6
‑
偶氮尿嘧啶;6
‑
偶氮胞嘧啶;6
‑
偶氮胸腺嘧啶;5
‑
核糖基尿嘧啶(假尿嘧啶);4
‑
硫代尿嘧啶;8
‑
卤素、8
‑
氨基、8
‑
硫醇、8
‑
硫烷基、8
‑
羟基、8
‑
氮杂和其他8
‑
取代的嘌呤;5
‑
卤素特别是5
‑
溴、5
‑
三氟甲基、5
‑
卤代尿嘧啶和5
‑
卤代胞嘧啶;7
‑
甲基鸟嘌呤;7
‑
甲基腺嘌呤;2
‑
f
‑
腺嘌呤;2
‑
氨基腺嘌呤;7
‑
脱氮鸟嘌呤;7
‑
脱氮腺嘌呤;3
‑
脱氮鸟嘌呤;3
‑
脱氮腺嘌呤;6
‑
n
‑
苯甲酰基腺嘌呤;2
‑
n
‑
异丁酰基鸟嘌呤;4
‑
n
‑
苯甲酰基胞嘧啶;4
‑
n
‑
苯甲酰基尿嘧啶;5
‑
甲基4
‑
n
‑
苯甲酰基胞嘧啶;5
‑
甲基4
‑
n
‑
苯甲酰基尿嘧啶;通用碱基;疏水性碱基;混杂碱基;大小扩大的碱基;以及氟化碱基。另外的修饰核碱基包括三环嘧啶,诸如1,3
‑
二氮杂吩噁嗪
‑2‑
酮、1,3
‑
二氮杂吩噻嗪
‑2‑
酮和9
‑
(2
‑
氨基乙氧基)
‑
1,3
‑
二氮杂吩噁嗪
‑2‑
酮(g
‑
clamp)。修饰的核碱基还可包括其中嘌呤或嘧啶碱基被其他杂环置换的那些,例如7
‑
脱氮
‑
腺嘌呤、7
‑
脱氮鸟苷、2
‑
氨基吡啶和2
‑
吡啶酮。另外的核碱基包括以下公开的那些:merigan等人,u.s.3,687,808;the concise encyclopedia of polymer science and engineering,kroschwitz,j.i.编,john wiley&sons,1990,858
‑
859;englisch等人,angewandte chemie,国际版,1991,30,613;sanghvi,y.s.,第15章,antisense research and applications,crooke,s.t.和lebleu,b.编,crc press,1993,273
‑
288;以及第6和15章,antisense drug technology,crooke s.t.编,crc press,2008,163
‑
166和442
‑
443。
[0462]
教导某些上文所说明的修饰核碱基以及其他修饰核碱基的制备的公布包括但不限于:manoharan等人,us2003/0158403;manoharan等人,us2003/0175906;dinh等人,u.s.4,845,205;spielvogel等人,u.s.5,130,302;rogers等人,u.s.5,134,066;bischofberger等人,u.s.5,175,273;urdea等人,u.s.5,367,066;benner等人,u.s.5,432,272;matteucci等人,u.s.5,434,257;gmeiner等人,u.s.5,457,187;cook等人,u.s.5,459,255;froehler等人,u.s.5,484,908;matteucci等人,u.s.5,502,177;hawkins等人,u.s.5,525,711;haralambidis等人,u.s.5,552,540;cook等人,u.s.5,587,469;froehler等人,u.s.5,594,121;switzer等人,u.s.5,596,091;cook等人,u.s.5,614,617;froehler等人,u.s.5,645,985;cook等人,u.s.5,681,941;cook等人,u.s.5,811,534;cook等人,u.s.5,750,692;cook等人,u.s.5,948,903;cook等人,u.s.5,587,470;cook等人,u.s.5,457,191;matteucci等人,u.s.5,763,588;froehler等人,u.s.5,830,653;cook等人,u.s.5,808,027;cook等人,u.s.6,166,199;以及matteucci等人,u.s.6,005,096。
[0463]
在某些实施方案中,靶向malat1核酸的化合物包含一个或多个修饰的核碱基。在某些实施方案中,修饰的核碱基是5
‑
甲基胞嘧啶。在某些实施方案中,各胞嘧啶是5
‑
甲基胞嘧啶。
[0464]
3.修饰的核苷间键
[0465]
rna和dna的天然存在的核苷间键是3’至5’磷酸二酯键。在某些实施方案中,相比于具有天然存在的核苷间键的化合物,通常选择本文所述的具有一个或多个修饰的(即非天然存在的)核苷间键的化合物,因为其具有期望特性,诸如细胞摄取增强、对靶核酸的亲和力增强以及在存在核酸酶的情况下稳定性增加。
[0466]
具有手性中心的代表性核苷间键包括但不限于烷基磷酸酯和硫代磷酸酯。包含具有手性中心的核苷间键的修饰寡核苷酸可以制备成包含无规立构核苷间键的修饰寡核苷酸的群体或包含处于特定立体化学构型的硫代磷酸酯键的修饰寡核苷酸的群体。在某些实施方案中,修饰寡核苷酸的群体包含硫代磷酸酯核苷间键,其中所有硫代磷酸酯核苷间键是无规立构的。可以使用能够随机选择各硫代磷酸酯键的立体化学构型的合成方法生成此类修饰寡核苷酸。尽管如此,如本领域技术人员所理解,每个个别寡核苷酸分子的每个个别硫代磷酸酯具有限定的立体构型。在某些实施方案中,修饰寡核苷酸的群体富集修饰寡核苷酸,所述修饰寡核苷酸包含一个或多个呈特定的独立选择的立体化学构型的特定硫代磷酸酯核苷间键。在某些实施方案中,特定硫代磷酸酯键的特定构型存在于所述群体中的至少65%的分子中。在某些实施方案中,特定硫代磷酸酯键的特定构型存在于所述群体中的至少70%的分子中。在某些实施方案中,特定硫代磷酸酯键的特定构型存在于所述群体中的至少80%的分子中。在某些实施方案中,特定硫代磷酸酯键的特定构型存在于所述群体中的至少90%的分子中。在某些实施方案中,特定硫代磷酸酯键的特定构型存在于所述群体中的至少99%的分子中。修饰寡核苷酸的此类手性富集群体可以使用本领域中已知的合成方法生成,例如以下各项中所述的方法:oka等人,jacs 125,8307(2003);wan等人,nuc.acid.res.42,13456(2014);以及wo 2017/015555。在某些实施方案中,修饰寡核苷酸的群体富集具有至少一个处于(sp)构型的指示硫代磷酸酯的修饰寡核苷酸。在某些实施方案中,修饰寡核苷酸的群体富集具有至少一个处于(rp)构型的硫代磷酸酯的修饰寡核苷酸。在某些实施方案中,包含(rp)和/或(sp)硫代磷酸酯的修饰寡核苷酸分别包含下式中的一个或多个,其中“b”指示核碱基:
[0467][0468]
除非另外指示,否则本文所述的修饰寡核苷酸的手性核苷间键可以是无规立构的或处于特定立体化学构型。
[0469]
在某些实施方案中,靶向malat1核酸的化合物包含一个或多个修饰的核苷间键。在某些实施方案中,修饰的核苷间键是硫代磷酸酯键。在某些实施方案中,反义化合物的各核苷间键是硫代磷酸酯核苷间键。
[0470]
在某些实施方案中,本文所述的化合物包含寡核苷酸。具有修饰的核苷间键的寡核苷酸包括保留磷原子的核苷间键以及不具有磷原子的核苷间键。代表性含磷核苷间键包括但不限于磷酸二酯、磷酸三酯、甲基磷酸酯、氨基磷酸酯和硫代磷酸酯。制备含磷键和非含磷键的方法是熟知的。
[0471]
在某些实施方案中,修饰寡核苷酸的核苷可使用任何核苷间键连接在一起。两种主要类别的核苷间连接基团通过磷原子的存在或不存在来限定。代表性含磷核苷间键包括但不限于磷酸酯(其含有磷酸二酯键(“p=o”)(也称为未修饰或天然存在的键))、磷酸三酯、甲基磷酸酯、氨基磷酸酯和硫代磷酸酯(“p=s”)以及二硫代磷酸酯(“hs
‑
p=s”)。代表性非含磷核苷间连接基团包括但不限于亚甲基甲基亚氨基(
‑
ch2
‑
n(ch3)
‑
o
‑
ch2
‑
)、硫代二酯、硫羰氨基甲酸酯(
‑
o
‑
c(=o)(nh)
‑
s
‑
);硅氧烷(
‑
o
‑
sih2
‑
o
‑
);以及n,n
’‑
二甲基肼(
‑
ch2
‑
n(ch3)
‑
n(ch3)
‑
)。与天然存在的磷酸酯键相比,修饰的核苷间键可以用于改变(通常增加)寡核苷酸的核酸酶抗性。在某些实施方案中,具有手性原子的核苷间键可以制备成外消旋混合物或单独的对映异构体。代表性手性核苷间键包括但不限于烷基磷酸酯和硫代磷酸酯。制备含磷和非含磷核苷间键的方法是本领域技术人员熟知的。
[0472]
中性核苷间键包括但不限于磷酸三酯、甲基磷酸酯、mmi(3
’‑
ch2
‑
n(ch3)
‑
o
‑5’
)、酰胺
‑
3(3
’‑
ch2
‑
c(=o)
‑
n(h)
‑5’
)、酰胺
‑
4(3
’‑
ch2
‑
n(h)
‑
c(=o)
‑5’
)、甲缩醛(formacetal)(3
’‑
o
‑
ch2
‑
o
‑5’
)、甲氧基丙基和硫代甲缩醛(3
’‑
s
‑
ch2
‑
o
‑5’
)。另外的中性核苷间键包括包含硅氧烷(二烷基硅氧烷)、羧酸酯、羧酰胺、硫化物、磺酸酯和酰胺的非离子型键(参见例如:carbohydrate modifications in antisense research;y.s.sanghvi和p.d.cook编,acs symposium series 580;第3和4章,40
‑
65)。另外的中性核苷间键包括包含混合的n、o、s和ch2组成部分的非离子型键。
[0473]
在某些实施方案中,寡核苷酸包含以限定模式或修饰的核苷间键基序的形式沿寡核苷酸或其区域排列的修饰的核苷间键。在某些实施方案中,核苷间键以有间隙的基序的形式排列。在此类实施方案中,两个侧翼区中的每一个中的核苷间键不同于间隙区中的核苷间键。在某些实施方案中,侧翼中的核苷间键是磷酸二酯,并且间隙中的核苷间键是硫代磷酸酯。核苷基序经过独立选择,使得具有有间隙的核苷间键基序的此类寡核苷酸可具有或可不具有有间隙的核苷基序,并且如果其不具有有间隙的核苷基序,则侧翼长度和间隙长度可相同或可不同。
[0474]
在某些实施方案中,寡核苷酸包含具有交替的核苷间键基序的区域。在某些实施方案中,寡核苷酸包含均匀修饰的核苷间键的区域。在某些此类实施方案中,寡核苷酸包含通过硫代磷酸酯核苷间键均匀连接的区域。在某些实施方案中,寡核苷酸通过硫代磷酸酯均匀连接。在某些实施方案中,寡核苷酸的各核苷间键选自磷酸二酯和硫代磷酸酯。在某些实施方案中,寡核苷酸的各核苷间键选自磷酸二酯和硫代磷酸酯,并且至少一个核苷间键是硫代磷酸酯。
[0475]
在某些实施方案中,寡核苷酸包含至少6个硫代磷酸酯核苷间键。在某些实施方案中,寡核苷酸包含至少8个硫代磷酸酯核苷间键。在某些实施方案中,寡核苷酸包含至少10
个硫代磷酸酯核苷间键。在某些实施方案中,寡核苷酸包含至少一个具有至少6个连续硫代磷酸酯核苷间键的区块。在某些实施方案中,寡核苷酸包含至少一个具有至少8个连续硫代磷酸酯核苷间键的区块。在某些实施方案中,寡核苷酸包含至少一个具有至少10个连续硫代磷酸酯核苷间键的区块。在某些实施方案中,寡核苷酸包含至少一个具有至少12个连续硫代磷酸酯核苷间键的区块。在某些此类实施方案中,至少一个此类区块位于寡核苷酸的3’端。在某些此类实施方案中,至少一个此类区块位于寡核苷酸的3’端的3个核苷内。
[0476]
在某些实施方案中,寡核苷酸包含一个或多个甲基磷酸酯键。在某些实施方案中,具有间隔体核苷基序的寡核苷酸包含除一个或两个甲基磷酸酯键之外包含全部硫代磷酸酯键的键基序。在某些实施方案中,一个甲基磷酸酯键在具有间隔体核苷基序的寡核苷酸的中心间隙中。
[0477]
在某些实施方案中,期望布置硫代磷酸酯核苷间键和磷酸二酯核苷间键的数目以维持核酸酶抗性。在某些实施方案中,期望布置硫代磷酸酯核苷间键的数目和位置以及磷酸二酯核苷间键的数目和位置以维持核酸酶抗性。在某些实施方案中,可减少硫代磷酸酯核苷间键的数目,并且可增加磷酸二酯核苷间键的数目。在某些实施方案中,可减少硫代磷酸酯核苷间键的数目,并且可增加磷酸二酯核苷间键的数目,同时仍维持核酸酶抗性。在某些实施方案中,期望减少硫代磷酸酯核苷间键的数目,同时保留核酸酶抗性。在某些实施方案中,期望增加磷酸二酯核苷间键的数目,同时保留核酸酶抗性。
[0478]
某些基序
[0479]
在某些实施方案中,本文所述的化合物包含寡核苷酸。寡核苷酸可以具有基序,例如未修饰和/或修饰的糖部分、核碱基和/或核苷间键的模式。在某些实施方案中,修饰寡核苷酸包含一个或多个包含修饰的糖的修饰核苷。在某些实施方案中,修饰寡核苷酸包含一个或多个包含修饰的核碱基的修饰核苷。在某些实施方案中,修饰寡核苷酸包含一个或多个修饰的核苷间键。在此类实施方案中,修饰寡核苷酸的修饰、未修饰和不同修饰的糖部分、核碱基和/或核苷间键限定模式或基序。在某些实施方案中,糖部分、核碱基和核苷间键的模式各自彼此独立。因此,修饰寡核苷酸可通过其糖基序、核碱基基序和/或核苷间键基序进行描述(如本文所用,核碱基基序描述独立于核碱基序列对核碱基进行的修饰)。
[0480]
a.某些糖基序
[0481]
在某些实施方案中,本文所述的化合物包含寡核苷酸。在某些实施方案中,寡核苷酸包含一种或多种类型的以限定模式或糖基序的形式沿寡核苷酸或其区域排列的修饰的糖和/或未修饰的糖部分。在某些情况下,此类糖基序包括但不限于本文所讨论的任何糖修饰。
[0482]
在某些实施方案中,修饰寡核苷酸包含具有间隔体基序的区域或由其组成,所述间隔体基序包含两个外部区域或“侧翼”和中心或内部区域或“间隙”。间隔体基序的三个区域(5
’‑
侧翼区、间隙区和3
’‑
侧翼区)形成连续的核苷序列,其中各侧翼的核苷的至少一些糖部分不同于间隙的核苷的至少一些糖部分。具体地说,至少各侧翼的最靠近间隙的核苷(5
’‑
侧翼的3
’‑
最末端核苷和3
’‑
侧翼的5
’‑
最末端核苷)的糖部分不同于相邻间隙核苷的糖部分,因此限定侧翼与间隙之间的边界(即,侧翼/间隙接点)。在某些实施方案中,间隙内的糖部分彼此相同。在某些实施方案中,间隙包括一个或多个具有糖部分的核苷,所述糖部分不同于间隙的一个或多个其他核苷的糖部分。在某些实施方案中,两个侧翼的糖基序彼
此相同(对称间隔体)。在某些实施方案中,5
’‑
侧翼的糖基序不同于3
’‑
侧翼的糖基序(不对称间隔体)。
[0483]
在某些实施方案中,间隔体的侧翼包含1
‑
5个核苷。在某些实施方案中,间隔体的侧翼包含2
‑
5个核苷。在某些实施方案中,间隔体的侧翼包含3
‑
5个核苷。在某些实施方案中,间隔体的核苷全部是修饰的核苷。
[0484]
在某些实施方案中,间隔体的间隙包含7
‑
12个核苷。在某些实施方案中,间隔体的间隙包含7
‑
10个核苷。在某些实施方案中,间隔体的间隙包含8
‑
10个核苷。在某些实施方案中,间隔体的间隙包含10个核苷。在某个实施方案中,间隔体的间隙的各核苷是未修饰的2
’‑
脱氧核苷。
[0485]
在某些实施方案中,间隔体是脱氧间隔体。在此类实施方案中,各侧翼/间隙接点的间隙侧的核苷是未修饰的2
’‑
脱氧核苷,并且各侧翼/间隙接点的侧翼侧的核苷是修饰的核苷。在某些此类实施方案中,间隙的各核苷是未修饰的2
’‑
脱氧核苷。在某些此类实施方案中,各侧翼的各核苷是修饰的核苷。
[0486]
在某些实施方案中,修饰寡核苷酸具有完全修饰的糖基序,其中修饰寡核苷酸的各核苷包含修饰的糖部分。在某些实施方案中,修饰寡核苷酸包含具有完全修饰的糖基序的区域或由其组成,其中所述区域的各核苷包含修饰的糖部分。在某些实施方案中,修饰寡核苷酸包含具有完全修饰的糖基序的区域或由其组成,其中完全修饰的区域内的各核苷包含相同修饰的糖部分,在本文中称为均匀修饰的糖基序。在某些实施方案中,完全修饰的寡核苷酸是均匀修饰的寡核苷酸。在某些实施方案中,均匀修饰的寡核苷酸的各核苷包含相同的2
’‑
修饰。
[0487]
在某些实施方案中,修饰寡核苷酸可以包含以下各项中所述的糖基序:swayze等人,us2010/0197762;freier等人,us2014/0107330;freier等人,us2015/0184153;以及seth等人,us2015/0267195,其各自以引用的方式整体并入本文。
[0488]
本文所提供的某些实施方案涉及可用于抑制靶核酸表达的修饰的寡聚化合物,其可以用于治疗、预防、改善与这一靶核酸相关的疾病或减慢所述疾病的进展。在某些实施方案中,修饰的寡聚化合物包含作为具有某些糖基序的间隔体的反义寡核苷酸。在某些实施方案中,本文所提供的间隔体糖基序可以与任何核碱基序列和任何核苷间键基序组合,以形成有效的反义寡核苷酸。
[0489]
在某些实施方案中,一种方法包括使细胞与化合物接触或向受试者施用所述化合物,所述化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16个连接核苷组成并且具有基序:ekk
‑
d9
‑
kkee,其中
‘
d’表示2
’‑
脱氧核糖,
‘
k’表示cet核苷,并且
‘
e’表示2
’‑
moe核苷。在某些实施方案中,细胞是癌细胞。在某些实施方案中,受试者患有癌症。在某些实施方案中,向受试者施用化合物治疗受试者的癌症。
[0490]
在某些实施方案中,一种方法包括使细胞与化合物接触或向受试者施用所述化合物,所述化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16个连接核苷组成并且具有基序:k
‑
d9
‑
kekeke,其中
‘
d’表示2
’‑
脱氧核糖,
‘
k’表示cet核苷,并且
‘
e’表示2
’‑
moe核苷。在某些实施方案中,细胞是癌细胞。在某些实施方案中,受试者患有癌症。在某些实施方案中,向受试者施用化合物治疗受试者的癌症。
[0491]
在某些实施方案中,一种方法包括使细胞与化合物接触或向受试者施用所述化合
物,所述化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16个连接核苷组成并且具有基序:kkk
‑
d8
‑
kekek,其中
‘
d’表示2
’‑
脱氧核糖,
‘
k’表示cet核苷,并且
‘
e’表示2
’‑
moe核苷。在某些实施方案中,细胞是癌细胞。在某些实施方案中,受试者患有癌症。在某些实施方案中,向受试者施用化合物治疗受试者的癌症。
[0492]
在某些实施方案中,一种方法包括使细胞与化合物接触或向受试者施用所述化合物,所述化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16个连接核苷组成并且具有基序:kkk
‑
d9
‑
keke,其中
‘
d’表示2
’‑
脱氧核糖,
‘
k’表示cet核苷,并且
‘
e’表示2
’‑
moe核苷。在某些实施方案中,细胞是癌细胞。在某些实施方案中,受试者患有癌症。在某些实施方案中,向受试者施用化合物治疗受试者的癌症。
[0493]
在某些实施方案中,一种方法包括使细胞与化合物接触或向受试者施用所述化合物,所述化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16个连接核苷组成并且具有基序:kk
‑
d9
‑
kdkdk,其中
‘
d’表示2
’‑
脱氧核糖,
‘
k’表示cet核苷,并且
‘
e’表示2
’‑
moe核苷。在某些实施方案中,细胞是癌细胞。在某些实施方案中,受试者患有癌症。在某些实施方案中,向受试者施用化合物治疗受试者的癌症。
[0494]
在某些实施方案中,化合物包含修饰寡核苷酸,其由16个连接核苷组成并且具有基序:kk
‑
d9
‑
eeekk,其中
‘
d’表示2
’‑
脱氧核糖,
‘
k’表示cet核苷,并且
‘
e’表示2
’‑
moe核苷。在某些实施方案中,一种方法包括使细胞与化合物接触或向受试者施用所述化合物,所述化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16个连接核苷组成并且具有基序:kk
‑
d9
‑
eeekk,其中
‘
d’表示2
’‑
脱氧核糖,
‘
k’表示cet核苷,并且
‘
e’表示2
’‑
moe核苷。在某些实施方案中,细胞是癌细胞。在某些实施方案中,受试者患有癌症。在某些实施方案中,向受试者施用化合物治疗受试者的癌症。
[0495]
在某些实施方案中,一种方法包括使细胞与化合物接触或向受试者施用所述化合物,所述化合物包含修饰寡核苷酸,所述修饰寡核苷酸由16个连接核苷组成并且具有基序:kk
‑
d9
‑
ekeke,其中
‘
d’表示2
’‑
脱氧核糖,
‘
k’表示cet核苷,并且
‘
e’表示2
’‑
moe核苷。在某些实施方案中,细胞是癌细胞。在某些实施方案中,受试者患有癌症。在某些实施方案中,向受试者施用化合物治疗受试者的癌症。
[0496]
b.某些核碱基基序
[0497]
在某些实施方案中,本文所述的化合物包含寡核苷酸。在某些实施方案中,寡核苷酸包含以限定模式或基序的形式沿寡核苷酸或其区域排列的修饰和/或未修饰的核碱基。在某些实施方案中,各核碱基是修饰的。在某些实施方案中,没有核碱基是修饰的。在某些实施方案中,各嘌呤或各嘧啶是修饰的。在某些实施方案中,各腺嘌呤是修饰的。在某些实施方案中,各鸟嘌呤是修饰的。在某些实施方案中,各胸腺嘧啶是修饰的。在某些实施方案中,各尿嘧啶是修饰的。在某些实施方案中,各胞嘧啶是修饰的。在某些实施方案中,修饰寡核苷酸中的一些或全部胞嘧啶核碱基是5
‑
甲基胞嘧啶。
[0498]
在某些实施方案中,修饰寡核苷酸包含修饰核碱基的区块。在某些此类实施方案中,区块位于寡核苷酸的3
’‑
端。在某些实施方案中,区块位于寡核苷酸的3
’‑
端的3个核苷内。在某些实施方案中,区块位于寡核苷酸的5
’‑
端。在某些实施方案中,区块位于寡核苷酸的5
’‑
端的3个核苷内。
[0499]
在某些实施方案中,具有间隔体基序的寡核苷酸包含有包含修饰核碱基的核苷。
在某些此类实施方案中,一个包含修饰核碱基的核苷处于具有间隔体基序的寡核苷酸的中心间隙中。在某些此类实施方案中,所述核苷的糖部分是2
’‑
脱氧核糖基部分。在某些实施方案中,修饰的核碱基选自:2
‑
硫代嘧啶和5
‑
丙炔嘧啶。
[0500]
c.某些核苷间键基序
[0501]
在某些实施方案中,本文所述的化合物包含寡核苷酸。在某些实施方案中,寡核苷酸包含以限定模式或基序的形式沿寡核苷酸或其区域排列的修饰和/或未修饰的核苷间键。在某些实施方案中,基本上各核苷间连接基团均为磷酸酯核苷间键(p=o)。在某些实施方案中,修饰寡核苷酸的各核苷间连接基团均为硫代磷酸酯(p=s)。在某些实施方案中,修饰寡核苷酸的各核苷间连接基团独立地选自硫代磷酸酯核苷间键和磷酸酯核苷间键。在某些实施方案中,修饰寡核苷酸的糖基序是间隔体,并且间隙内的核苷间键全部是修饰的。在某些此类实施方案中,侧翼中的一些或全部核苷间键均为未修饰的磷酸酯键。在某些实施方案中,末端核苷间键是修饰的。
[0502]
4.某些修饰寡核苷酸
[0503]
在某些实施方案中,本文所述的化合物包含修饰寡核苷酸。在某些实施方案中,将上文修饰(糖、核碱基、核苷间键)掺入修饰寡核苷酸中。在某些实施方案中,修饰寡核苷酸通过其修饰、基序和总体长度表征。在某些实施方案中,此类参数各自彼此独立。因此,除非另外指示,否则具有间隔体糖基序的寡核苷酸的各核苷间键可以是修饰或未修饰的,并且可遵循或可不遵循糖修饰的间隔体修饰模式。例如,糖间隔体的侧翼区内的核苷间键可彼此相同或不同,并且可与糖基序的间隙区的核苷间键相同或不同。同样,此类间隔体寡核苷酸可包含一个或多个独立于糖修饰的间隔体模式的修饰核碱基。此外,在某些情况下,通过总体长度或范围并且通过两个或更多个区域(例如,具有指定糖修饰的核苷的区域)的长度或长度范围描述寡核苷酸,在此类情形下,可以选择各范围的数目,从而得到总体长度落在指定范围之外的寡核苷酸。在此类情形下,两种要素必须均满足。例如,在某些实施方案中,修饰寡核苷酸由15
‑
20个连接核苷组成并且具有由三个区域a、b和c组成的糖基序,其中a区由2
‑
6个具有指定糖基序的连接核苷组成,b区由6
‑
10个具有指定糖基序的连接核苷组成,并且c区由2
‑
6个具有指定糖基序的连接核苷组成。此类实施方案不包括以下修饰寡核苷酸,在所述修饰寡核苷酸中a和c各自由6个连接核苷组成并且b由10个连接核苷组成(即使允许那些数目的核苷在a、b和c的要求内),因为此类寡核苷酸的总体长度为22,其超过修饰寡核苷酸的总体长度的上限(20)。在本文中,如果寡核苷酸的描述关于一个或多个参数是沉默的,则此类参数不受限制。因此,仅描述为具有间隔体糖基序而无进一步描述的修饰寡核苷酸可具有任何长度、核苷间键基序和核碱基基序。除非另外指示,否则所有修饰均独立于核碱基序列。
[0504]
某些缀合化合物
[0505]
在某些实施方案中,本文所述的化合物包含寡核苷酸(修饰或未修饰的)和任选的一个或多个缀合基团和/或末端基团或由其组成。缀合基团由一个或多个缀合部分和将缀合部分连接至寡核苷酸的缀合接头组成。缀合基团可连接至寡核苷酸的任一端或两端和/或处于任何内部位置。在某些实施方案中,缀合基团连接至修饰寡核苷酸的核苷的2
’‑
位。在某些实施方案中,连接至寡核苷酸的任一端或两端的缀合基团是末端基团。在某些此类实施方案中,缀合基团或末端基团连接在寡核苷酸的3
’‑
端和/或5
’‑
端。在某些此类实施方
案中,缀合基团(或末端基团)连接在寡核苷酸的3
’‑
端。在某些实施方案中,缀合基团连接在寡核苷酸的3
’‑
端附近。在某些实施方案中,缀合基团(或末端基团)连接在寡核苷酸的5
’‑
端。在某些实施方案中,缀合基团连接在寡核苷酸的5
’‑
端附近。
[0506]
在某些实施方案中,寡核苷酸是修饰的。在某些实施方案中,化合物的寡核苷酸具有与靶核酸互补的核碱基序列。在某些实施方案中,寡核苷酸与信使rna(mrna)互补。在某些实施方案中,寡核苷酸与有义转录物互补。
[0507]
末端基团的实例包括但不限于缀合基团、加帽基团、磷酸酯部分、保护基、修饰或未修饰的核苷,以及两个或更多个独立地修饰或未修饰的核苷。
[0508]
a.某些缀合基团
[0509]
在某些实施方案中,寡核苷酸共价连接至一个或多个缀合基团。在某些实施方案中,缀合基团改变所连接的寡核苷酸的一种或多种特性,包括但不限于药效学、药代动力学、稳定性、结合性、吸收性、组织分布、细胞分布、细胞摄取、电荷和清除率。在某些实施方案中,缀合基团向所连接的寡核苷酸赋予新的特性,例如能够检测寡核苷酸的荧光团或报告基团。
[0510]
某些缀合基团和缀合部分先前已有描述,例如:胆固醇部分(letsinger等人,proc.natl.acad.sci.usa,1989,86,6553
‑
6556);胆酸(manoharan等人,bioorg.med.chem.lett.,1994,4,1053
‑
1060);硫醚,例如己基
‑
s
‑
三苯甲硫醇(manoharan等人,ann.n.y.acad.sci.,1992,660,306
‑
309;manoharan等人,bioorg.med.chem.lett.,1993,3,2765
‑
2770);巯基胆固醇(oberhauser等人,nucl.acids res.,1992,20,533
‑
538);脂族链,例如十二烷二醇或十一烷基残基(saison
‑
behmoaras等人,embo j.,1991,10,1111
‑
1118;kabanov等人,febs lett.,1990,259,327
‑
330;svinarchuk等人,biochimie,1993,75,49
‑
54);磷脂,例如二
‑
十六烷基
‑
外消旋
‑
甘油或1,2
‑
二
‑
o
‑
十六烷基
‑
外消旋
‑
甘油
‑3‑
h
‑
磷酸三乙基铵(manoharan等人,tetrahedron lett.,1995,36,3651
‑
3654;shea等人,nucl.acids res.,1990,18,3777
‑
3783);聚胺或聚乙二醇链(manoharan等人,nucleosides&nucleotides,1995,14,969
‑
973);或金刚烷乙酸、棕榈基部分(mishra等人,biochim.biophys.acta,1995,1264,229
‑
237);十八烷基胺或己基氨基
‑
羰基
‑
氧基胆固醇部分(crooke等人,j.pharmacol.exp.ther.,1996,i,923
‑
937);生育酚基团(nishina等人,molecular therapy nucleic acids,2015,4,e220;doi:10.1038/mtna.2014.72;以及nishina等人,molecular therapy,2008,16,734
‑
740);或galnac集簇(例如,wo2014/179620)。
[0511]
1.缀合部分
[0512]
缀合部分包括但不限于嵌入物、报告分子、聚胺、聚酰胺、肽、碳水化合物(例如,galnac)、维生素部分、聚乙二醇、硫醚、聚醚、胆固醇、巯基胆固醇、胆酸部分、叶酸、脂质、磷脂、生物素、吩嗪、啡啶、蒽醌、金刚烷、吖啶、荧光素、罗丹明、香豆素、荧光团和染料。
[0513]
在某些实施方案中,缀合部分包括活性药物物质,例如阿司匹林(aspirin)、华法林(warfarin)、苯基丁氮酮(phenylbutazone)、布洛芬(ibuprofen)、舒洛芬(suprofen)、芬布芬(fen
‑
bufen)、酮洛芬(ketoprofen)、(s)
‑
( )
‑
普拉洛芬(pranoprofen)、卡洛芬(carprofen)、丹酰肌氨酸、2,3,5
‑
三碘苯甲酸、芬戈莫德(fingolimod)、氟芬那酸(flufenamic acid)、亚叶酸、苯丙噻二嗪(benzothiadiazide)、氯噻嗪(chlorothiazide)、
二氮杂吲哚美辛(indo
‑
methicin)、巴比妥酸盐、头孢菌素、磺胺类药、抗糖尿病药、抗菌剂或抗生素。
[0514]
2.缀合接头
[0515]
缀合部分通过缀合接头连接至寡核苷酸。在某些化合物中,缀合基团是单一化学键(即,缀合部分经由缀合接头通过单键连接至寡核苷酸)。在某些实施方案中,缀合接头包含链结构,诸如烃基链;或重复单元的寡聚物,所述重复单元诸如乙二醇、核苷或氨基酸单元。
[0516]
在某些实施方案中,缀合接头包括选自以下的一个或多个基团:烷基、氨基、氧代基、酰胺、二硫化物、聚乙二醇、醚、硫醚和羟氨基。在某些此类实施方案中,缀合接头包括选自以下的基团:烷基、氨基、氧代基、酰胺和醚基团。在某些实施方案中,缀合接头包括选自以下的基团:烷基和酰胺基团。在某些实施方案中,缀合接头包括选自以下的基团:烷基和醚基团。在某些实施方案中,缀合接头包含至少一个磷部分。在某些实施方案中,缀合接头包括至少一个磷酸酯基团。在某些实施方案中,缀合接头包括至少一个中性连接基团。
[0517]
在某些实施方案中,缀合接头,包括上文所述的缀合接头,是双官能连接部分,例如,本领域中已知可用于将缀合基团连接至亲本化合物(诸如本文提供的寡核苷酸)的那些。一般来说,双官能连接部分包括至少两个官能团。官能团中的一个经过选择结合化合物的特定位点,并且另一个经过选择结合缀合基团。双官能连接部分中所用的官能团的实例包括但不限于用于与亲核基团反应的亲电体和用于与亲电子基团反应的亲核体。在某些实施方案中,双官能连接部分包括选自以下的一个或多个基团:氨基、羟基、羧酸、硫醇、烷基、烯基和炔基。
[0518]
缀合接头的实例包括但不限于吡咯啶、8
‑
氨基
‑
3,6
‑
二氧杂辛酸(ado)、4
‑
(n
‑
马来酰亚胺基甲基)环己烷
‑1‑
羧酸琥珀酰亚胺酯(smcc)和6
‑
氨基己酸(ahex或aha)。其他缀合接头包括但不限于取代或未取代的c1‑
c
10
烷基、取代或未取代的c2‑
c
10
烯基或取代或未取代的c2‑
c
10
炔基,其中优选取代基的非限制性列表包括羟基、氨基、烷氧基、羧基、苄基、苯基、硝基、硫醇、硫代烷氧基、卤素、烷基、芳基、烯基和炔基。
[0519]
在某些实施方案中,缀合接头包含1
‑
10个接头
‑
核苷。在某些实施方案中,此类接头
‑
核苷是修饰的核苷。在某些实施方案中,此类接头
‑
核苷包含修饰的糖部分。在某些实施方案中,接头
‑
核苷是未修饰的。在某些实施方案中,接头
‑
核苷包含任选受保护的杂环碱基,其选自嘌呤、取代的嘌呤、嘧啶或取代的嘧啶。在某些实施方案中,可切割部分是选自以下的核苷:尿嘧啶、胸腺嘧啶、胞嘧啶、4
‑
n
‑
苯甲酰基胞嘧啶、5
‑
甲基胞嘧啶、4
‑
n
‑
苯甲酰基
‑5‑
甲基胞嘧啶、腺嘌呤、6
‑
n
‑
苯甲酰基腺嘌呤、鸟嘌呤和2
‑
n
‑
异丁酰基鸟嘌呤。通常期望接头
‑
核苷在化合物到达靶组织之后从所述化合物上切割下来。因此,接头
‑
核苷通常彼此连接并且通过可切割键与化合物的其余部分连接。在某些实施方案中,此类可切割键是磷酸二酯键。
[0520]
在本文中,接头
‑
核苷不被视为寡核苷酸的一部分。因此,在化合物包含由指定数目或范围的连接核苷组成和/或与参考核酸具有指定的互补性百分比的寡核苷酸并且化合物也包含有包含含有接头
‑
核苷的的缀合接头的缀合基团的实施方案中,那些接头
‑
核苷不计入寡核苷酸的长度并且不用于确定寡核苷酸关于参考核酸的互补性百分比。例如,化合物可包含(1)由8
‑
30个核苷组成的修饰寡核苷酸,以及(2)包含1
‑
10个与修饰寡核苷酸的核
苷连续的接头
‑
核苷的缀合基团。这一化合物中的连续的连接核苷的总数超过30。可替代地,化合物可包含由8
‑
30个核苷组成并且没有缀合基团的修饰寡核苷酸。这一化合物中的连续的连接核苷的总数不超过30。除非另外指示,否则缀合接头包含不超过10个接头
‑
核苷。在某些实施方案中,缀合接头包含不超过5个接头
‑
核苷。在某些实施方案中,缀合接头包含不超过3个接头
‑
核苷。在某些实施方案中,缀合接头包含不超过2个接头
‑
核苷。在某些实施方案中,缀合接头包含不超过1个接头
‑
核苷。
[0521]
在某些实施方案中,期望从寡核苷酸上切割缀合基团。例如,在某些情形下,包含特定缀合部分的化合物被特定细胞类型更好地摄取,但是一旦化合物已经被摄取,便期望缀合基团被切割以释放未缀合或亲本寡核苷酸。因此,某些缀合物可包含一个或多个可切割部分,通常在缀合接头内。在某些实施方案中,可切割部分是可切割键。在某些实施方案中,可切割部分是包含至少一个可切割键的原子团。在某些实施方案中,可切割部分包含具有一个、两个、三个、四个或超过四个可切割键的原子团。在某些实施方案中,可切割部分在细胞或亚细胞区室诸如溶酶体内被选择性切割。在某些实施方案中,可切割部分被内源性酶诸如核酸酶选择性切割。
[0522]
在某些实施方案中,可切割键选自:酰胺、酯、醚、磷酸二酯中的一个或两个酯、磷酸酯、氨基甲酸酯或二硫化物。在某些实施方案中,可切割键是磷酸二酯中的一个或两个酯。在某些实施方案中,可切割部分包含磷酸酯或磷酸二酯。在某些实施方案中,可切割部分是寡核苷酸与缀合部分或缀合基团之间的磷酸酯键。
[0523]
在某些实施方案中,可切割部分包含一个或多个接头
‑
核苷或由其组成。在某些此类实施方案中,一个或多个接头
‑
核苷彼此连接和/或通过可切割键与化合物的其余部分连接。在某些实施方案中,此类可切割键是未修饰的磷酸二酯键。在某些实施方案中,可切割部分是2
’‑
脱氧核苷,其通过磷酸酯核苷间键连接至寡核苷酸的3’或5
’‑
末端核苷并且通过磷酸酯或硫代磷酸酯键共价连接至缀合接头或缀合部分的其余部分。在某些此类实施方案中,可切割部分是2
’‑
脱氧腺苷。
[0524]
组合物和用于配制药物组合物的方法
[0525]
本文所述的化合物可与药学上可接受的活性或惰性物质混合以用于制备药物组合物或制剂。组合物和用于配制药物组合物的方法取决于许多标准,包括但不限于施用途径、疾病程度或待施用的剂量。
[0526]
某些实施方案提供包含一种或多种化合物或其盐的药物组合物。在某些实施方案中,化合物是反义化合物或寡聚化合物。在某些实施方案中,化合物包含修饰寡核苷酸或由其组成。在某些此类实施方案中,药物组合物包含合适的药学上可接受的稀释剂或载剂。在某些实施方案中,药物组合物包含无菌盐水溶液和一种或多种化合物。在某些实施方案中,此类药物组合物由无菌盐水溶液和一种或多种化合物组成。在某些实施方案中,无菌盐水是医药级盐水。在某些实施方案中,药物组合物包含一种或多种化合物和无菌水。在某些实施方案中,药物组合物由一种化合物和无菌水组成。在某些实施方案中,无菌水是医药级水。在某些实施方案中,药物组合物包含一种或多种化合物和磷酸盐缓冲盐水(pbs)。在某些实施方案中,药物组合物由一种或多种化合物和无菌pbs组成。在某些实施方案中,无菌pbs是医药级pbs。组合物和用于配制药物组合物的方法取决于许多标准,包括但不限于施用途径、疾病程度或待施用的剂量。
表示2
’‑
β
‑
d
‑
脱氧核糖基糖部分,下标
‘
k’表示cet糖部分,下标
‘
s’表示硫代磷酸酯核苷间键,胞嘧啶残基前面的上标
‘
m’表示5
‑
甲基胞嘧啶,并且下标
‘
y’表示2
’‑
o
‑
甲基核糖。“起始位点(start site)”指示在人核酸序列中与间隔体互补的5
’‑
最末端核苷。“终止位点(stop site)”指示在人核酸序列中与间隔体互补的3
’‑
最末端核苷。
[0537]
下表中列出的各修饰寡核苷酸均与人malat1核酸序列seq id no:1(genbank登录号:xr_001309.1)互补。
[0538]
表1
[0539]
与人malat1互补的具有ps核苷间键的cet间隔体
[0540][0541][0542]
实施例2:修饰寡核苷酸对a
‑
431细胞中的人malat1的反义抑制
[0543]
在具有类似培养条件的一系列实验中测试了修饰寡核苷酸。各实验的结果在以下所示的单个表中给出。使用自由摄取,用5nm修饰寡核苷酸处理密度为每孔10,000个细胞的经过培养的a
‑
431细胞。在大约48小时的处理期后,从细胞中分离出rna并且通过定量实时rtpcr测量malat1 rna水平。使用人引物探针组rts2736(正向序列aaagcaaggtctccccacaag,在本文中指定为seq id no.:2814;反向序列tgaagggtctgtgctagatcaaaa,在本文中指定为seq id no.:2815;探针序列tgccacatcgccaccccgt,在本文中指定为seq id no.:2816)测量rna水平。如通过所测量,将malat1rna水平归一化为总rna含量。结果作为malat1 rna的量相对于未处理的对照细胞的对照百分比(%utc)在下表给出。
[0544]
表2
[0545]
靶向seq id no.:1的3
‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0546][0547]
实施例3:cet间隔体对a
‑
431细胞中的人malat1的剂量依赖性抑制
[0548]
在a
‑
431细胞中以各种剂量测试了以上研究中所述的修饰寡核苷酸。使用自由摄取,用稀释至下表所述浓度的修饰寡核苷酸处理密度为每孔10,000个细胞的经过培养的a
‑
431细胞。大约48小时后,如先前所述使用人malat1引物
‑
探针组rts2736测量malat1 rna水平。如通过所测量,将malat1 rna水平归一化为总rna含量。结果作为malat1 rna的量相对于未处理的对照细胞的对照百分比(%utc)在下表给出。对excel中的数据的对数/线性图使用线性回归来计算ic50。
[0549]
表3
[0550]
修饰寡核苷酸在a
‑
431中对人malat1 mrna表达的剂量依赖性抑制
[0551][0552]
实施例4:cet间隔体对mda
‑
mb
‑
436细胞中的人malat1的剂量依赖性抑制
[0553]
在mda
‑
mb
‑
436细胞中以各种剂量测试了以上研究中所述的修饰寡核苷酸。使用自由摄取,用稀释至下表所述浓度的修饰寡核苷酸处理密度为每孔5,000
‑
12,000个细胞的经过培养的mda
‑
mb
‑
436细胞。大约48小时后,如先前所述使用人malat1引物
‑
探针组rts 2736测量malat1 rna水平。将malat1 rna水平归一化为使用人引物
‑
探针组hts5002(正向序列cggactatgacttagttgc gttaca,本文指定为seq id no.:2817;反向序列gccatgcca atctcatcttgt,本文指定为seq id no.:2818;探针序列cctt tcttgacaaaacctaacttgcgcaga,本文指定为seq id no.:2819)测量的b
‑
肌动蛋白。结果作为malat1 rna的量相对于未处理的对照细胞的对照百分比(%utc)在下表给出。以下各表表示单独实验。使用“log(抑制剂)对反应
‑
变量斜率(4个参数)”式,使用prism6软件计算表4的ic50。使用“log(抑制剂)对反应
‑
变量斜率(3个参数)”式,使用prism7软件计算表5和表6的ic50。
[0554]
表4
[0555]
修饰寡核苷酸在mda
‑
mb
‑
436细胞中对人malat1 rna表达的剂量依赖性抑制
[0556][0557]
表5
[0558]
修饰寡核苷酸在mda
‑
mb
‑
436细胞中对人malat1 rna表达的剂量依赖性抑制
[0559][0560]
表6
[0561]
修饰寡核苷酸在mda
‑
mb
‑
436细胞中对人malat1 rna表达的剂量依赖性抑制
[0562][0563]
实施例5:靶向人malat1的修饰寡核苷酸在cd
‑
1小鼠中的耐受性
[0564]
用选自上文所述研究的修饰寡核苷酸处理cd
‑
1小鼠并且评价各种血浆化学标志物的水平变化。
[0565]
处理
[0566]
向几组4
‑
6周龄的雄性cd
‑
1小鼠(获自charles river)一周两次皮下注射50mg/kg的修饰寡核苷酸,持续4周(总计8次处理)。一组雄性cd
‑
1小鼠注射pbs。在开始处理后25天(最后一次施用后24小时)将小鼠安乐死。
[0567]
血浆化学标志物
[0568]
为了评价修饰寡核苷酸对肝功能的影响,使用自动化临床化学分析仪(hitachi olympus au400c,melville,ny)测量丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)、血尿素氮(bun)、总胆红素(tbil)和白蛋白(alb)的血浆水平。结果在下表给出。
[0569]
表7
[0570]
cd
‑
1小鼠中的血浆化学标志物
[0571][0572]
体重和器官重量
[0573]
在研究结束时测量cd
‑
1小鼠的体重,并且各组的平均体重在下表给出。在研究结束时测量肾、脾和肝重量并且在下表给出。
[0574]
表8
[0575]
体重和器官重量
[0576]
ion编号体重(g)肝(g)肾(g)脾(g)pbs321.70.50.11157929342.30.50.21158161342.30.50.2
[0577]
实施例6:靶向人malat1的修饰寡核苷酸在cd
‑
1小鼠中的耐受性
[0578]
用选自上文所述研究的修饰寡核苷酸处理cd
‑
1小鼠并且评价各种血浆化学标志物的水平变化。
[0579]
处理
[0580]
向几组4
‑
6周龄的雄性cd
‑
1小鼠(获自charles river)一周两次皮下注射50mg/kg的修饰寡核苷酸,持续4周(总计8次处理)。一组雄性cd
‑
1小鼠注射pbs。在开始处理后24天(最后一次施用后24小时)将小鼠安乐死。
[0581]
血浆化学标志物
[0582]
为了评价修饰寡核苷酸对肝功能的影响,使用自动化临床化学分析仪(hitachi olympus au400c,melville,ny)测量丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)、血尿素氮(bun)和总胆红素(tbil)的血浆水平。结果在下表给出。
[0583]
表9
[0584]
cd
‑
1小鼠中的血浆化学标志物
[0585][0586]
体重和器官重量
[0587]
在研究结束时测量cd
‑
1小鼠的体重,并且各组的平均体重在下表给出。在研究结束时测量肾、脾和肝重量并且在下表给出。
[0588]
表10
[0589]
体重和器官重量
[0590][0591]
实施例7:靶向人malat1的修饰寡核苷酸在cd
‑
1小鼠中的耐受性
[0592]
用选自上文所述研究的修饰寡核苷酸处理cd
‑
1小鼠并且评价各种血浆化学标志物的水平变化。
[0593]
处理向几组4
‑
6周龄的雄性cd
‑
1小鼠(获自charles river)一周两次皮下注射50mg/kg的修饰寡核苷酸,持续4周(总计8次处理)。一组雄性cd
‑
1小鼠注射pbs。在开始处理
后26天(最后一次施用后24小时)将小鼠安乐死。
[0594]
血浆化学标志物
[0595]
为了评价修饰寡核苷酸对肝功能的影响,使用自动化临床化学分析仪(hitachi olympus au400c,melville,ny)测量丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)、血尿素氮(bun)和总胆红素(tbil)的血浆水平。结果在下表给出。
[0596]
表11
[0597]
cd
‑
1小鼠中的血浆化学标志物
[0598][0599]
体重和器官重量
[0600]
在研究结束时测量cd
‑
1小鼠的体重,并且各组的平均体重在下表给出。在研究结束时测量肾、脾和肝重量并且在下表给出。
[0601]
表12
[0602]
体重和器官重量
[0603][0604]
实施例8:靶向人malat1的修饰寡核苷酸在cd
‑
1小鼠中的耐受性
[0605]
用选自上文所述研究的修饰寡核苷酸处理cd
‑
1小鼠并且评价各种血浆化学标志物的水平变化。
[0606]
处理
[0607]
向几组4
‑
6周龄的雄性cd
‑
1小鼠(获自charles river)一周两次皮下注射50mg/kg的修饰寡核苷酸,持续4周(总计8次处理)。一组雄性cd
‑
1小鼠注射pbs。在开始处理后25天(最后一次施用后24小时)将小鼠安乐死。
[0608]
血浆化学标志物
[0609]
为了评价修饰寡核苷酸对肝功能的影响,使用自动化临床化学分析仪(hitachi olympus au400c,melville,ny)测量丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)、血尿素氮(bun)和总胆红素(tbil)的血浆水平。结果在下表给出。
[0610]
表13
[0611]
cd
‑
1小鼠中的血浆化学标志物
[0612][0613]
体重和器官重量
[0614]
在研究结束时测量cd
‑
1小鼠的体重,并且各组的平均体重在下表给出。在研究结束时测量肾、脾和肝重量并且在下表给出。
[0615]
表14
[0616]
体重和器官重量
[0617]
ion编号体重(g)肝(g)肾(g)脾(g)pbs321.60.50.11304890362.00.50.21304906341.80.50.1
[0618]
实施例9:靶向人malat1的修饰寡核苷酸在cd
‑
1小鼠中的耐受性
[0619]
用选自上文所述研究的修饰寡核苷酸处理cd
‑
1小鼠并且评价各种血浆化学标志物的水平变化。
[0620]
处理向几组4
‑
6周龄的雄性cd
‑
1小鼠(获自charles river)一周两次皮下注射50mg/kg的修饰寡核苷酸,持续4周(总计8次处理)。一组雄性cd
‑
1小鼠注射pbs。在开始处理后25天(最后一次施用后24小时)将小鼠安乐死。
[0621]
血浆化学标志物
[0622]
为了评价修饰寡核苷酸对肝功能的影响,使用自动化临床化学分析仪(hitachi olympus au400c,melville,ny)测量丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)、血尿素氮(bun)和总胆红素(tbil)的血浆水平。结果在下表给出。
[0623]
表15
[0624]
cd
‑
1小鼠中的血浆化学标志物
[0625][0626]
体重和器官重量
[0627]
在研究结束时测量cd
‑
1小鼠的体重,并且各组的平均体重在下表给出。在研究结束时测量肾、脾和肝重量并且在下表给出。
[0628]
表16
[0629]
体重和器官重量
[0630]
ion编号体重(g)肝(g)肾(g)脾(g)pbs342.00.50.11304884372.20.50.2
[0631]
实施例10:靶向人malat1的修饰寡核苷酸在食蟹猴中的作用
[0632]
用选自以上实施例中所述的研究的某些ionis修饰寡核苷酸处理食蟹猴。评价修饰寡核苷酸耐受性。
[0633]
研究1
[0634]
处理
[0635]
在研究之前,将猴子隔离,期间每天观察动物的一般健康状况。猴子2
‑
4岁并且重2
‑
4kg。将7组4只随机分配的雄性食蟹猴各自以在背部的4个不同部位之间顺时针旋转的形式皮下注射ionis寡核苷酸或盐水。在第1、3、5和7天的负载剂量之后,对猴子每周一次给药35mg/kg的ionis寡核苷酸,持续6周(在第14、21、28、35和41天)。以类似方式向对照组的4只食蟹猴注射0.9%盐水并用作对照组。
[0636]
在研究期间,每天至少一次观察猴子的不适或窘迫的征象。及时将经历不适或窘迫的任何动物报告给兽医和研究主管。鉴定出健康不佳或可能濒死的任何动物以进行进一步监测和可能的安乐死。在第43天最后一次剂量之后大约48小时通过在深度麻醉的同时进行放血来对动物进行计划安乐死。实施例中描述的方案得到实验动物护理和使用委员会(institutional animal care and use committee;iacuc)的批准。
[0637]
体重和器官重量测量
[0638]
为了评价修饰寡核苷酸对动物总体健康的影响,测量了体重和器官重量。在尸体剖验之前测量终点体重。也测量了器官重量。
[0639]
表17
[0640]
体重和器官重量(g)
[0641][0642][0643]
肾和肝功能
[0644]
为了评价修饰寡核苷酸对肝和肾功能的影响,在第43天从所有研究组收集血液样品。在血液收集之前,将猴子禁食过夜。将血液收集在没有抗凝血剂的管中以供血清分离。将管在室温下保持最少90分钟,然后在3000rpm下离心10分钟以获得血清。使用toshiba120fr neo化学分析仪(toshiba co.,japan)测量各种肝功能标志物的水平。测量血尿素氮(bun)、肌酐(crea)、总蛋白(tp)、丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)和总胆红素(tbil)的血浆水平。
[0645]
表18
[0646]
食蟹猴血浆中的肝功能标志物
[0647][0648]
促炎症性蛋白分析
[0649]
为了评价修饰寡核苷酸在食蟹猴中的任何炎症性作用,取得血液样品以供分析。在血液收集之前,将猴子禁食过夜。在第41天(给药前和给药后24小时),从各动物中收集大约0.8ml血液并放入没有抗凝血剂的管中以供血清分离。将管在室温下保持最少90min,然后在室温下在3,000rpm下离心10min以获得血清。使用toshiba 120fr neo化学分析仪(toshiba co.,japan)测量补体c3。将另一炎症标志物c反应蛋白(crp)与上文针对肝功能所测试的临床化学参数一起进行测试。
[0650]
表19
[0651]
食蟹猴的促炎症性蛋白分析
[0652][0653]
血液学
[0654]
为了评价修饰寡核苷酸在食蟹猴中对血液学参数的任何影响,在第43天从各个可获得的研究动物中收集大约0.5ml血液的血液样品。将样品收集在含有k2‑
edta的管中。使用advia2120i血液学分析仪(siemens,usa)分析样品的红血细胞(rbc)计数、血红蛋白(hgb)、血细胞比容(hct)、血小板计数(plt)、总白血细胞计数(wbc)、嗜中性粒细胞计数(neu)、淋巴细胞计数(lym)和单核细胞计数(mon)。
[0655]
表20
[0656]
食蟹猴的血液学标志物分析
[0657][0658][0659]
尿分析
[0660]
在新鲜尿收集的前一天取出食物过夜,但供应水。在第43天,使用在湿冰上的干净笼子托盘收集所有动物的新鲜尿样品以用于尿分析法和尿化学法(早晨第一次尿)。使用toshiba 120fr自动化化学分析仪(toshiba co.,japan)测量尿分析法/尿化学法参数肌酐(ucre)、微量蛋白(utp)、尿微量白蛋白(ualb)以及蛋白/肌酐(p/c)比。
[0661]
表21
[0662]
食蟹猴的尿分析
[0663][0664]
研究2
[0665]
处理
[0666]
在研究之前,将猴子隔离,期间每天观察动物的一般健康状况。猴子2
‑
4岁并且重2
‑
4kg。将4组4只随机分配的雄性食蟹猴各自以在背部的4个不同部位之间顺时针旋转的形式皮下注射ionis寡核苷酸或盐水。在第1、3、5和7天的负载剂量之后,向猴子每周一次给药35mg/kg的ionis寡核苷酸,持续6周(在第14、21、28、35和41天)。以类似方式向对照组的4只食蟹猴注射0.9%盐水并用作对照组。
[0667]
在研究期间,每天至少一次观察猴子的不适或窘迫的征象。及时将经历不适或窘迫的任何动物报告给兽医和研究主管。鉴定出健康不佳或可能濒死的任何动物以进行进一步监测和可能的安乐死。在第43天最后一次剂量之后大约48小时通过在深度麻醉的同时进行放血来对动物进行计划安乐死。实施例中描述的方案得到实验动物护理和使用委员会(institutional animal care and use committee;iacuc)的批准。
[0668]
体重和器官重量测量
[0669]
为了评价修饰寡核苷酸对动物总体健康的影响,测量了体重和器官重量。在尸体剖验之前测量终点体重。也测量了器官重量。
[0670]
表22
[0671]
体重和器官重量(g)
[0672][0673]
肾和肝功能
[0674]
为了评价修饰寡核苷酸对肝和肾功能的影响,在第43天从所有研究组收集血液样品。在血液收集之前,将猴子禁食过夜。将血液收集在没有抗凝血剂的管中以供血清分离。将管在室温下保持最少90分钟,然后在3000rpm下离心10分钟以获得血清。使用toshiba120fr neo化学分析仪(toshiba co.,japan)测量各种肝功能标志物的水平。测量血尿素氮(bun)、肌酐(crea)、总蛋白(tp)、丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)和总胆红素(tbil)的血浆水平。
[0675]
表23
[0676]
食蟹猴血浆中的肝功能标志物
[0677][0678]
促炎症性蛋白分析
[0679]
为了评价修饰寡核苷酸在食蟹猴中的任何炎症性作用,取得血液样品以供分析。在血液收集之前,将猴子禁食过夜。在第41天(给药前和给药后24小时),从各动物中收集大约0.8ml血液并放入没有抗凝血剂的管中以供血清分离。将管在室温下保持最少90min,然后在室温下在3,000rpm下离心10min以获得血清。使用toshiba 120fr neo化学分析仪(toshiba co.,japan)测量补体c3。将另一炎症标志物c反应蛋白(crp)与上文针对肝功能所测试的临床化学参数一起进行测试。
[0680]
表24
[0681]
食蟹猴的促炎症性蛋白分析
[0682][0683]
血液学
[0684]
为了评价修饰寡核苷酸在食蟹猴中对血液学参数的任何影响,在第43天从各个可获得的研究动物中收集大约0.5ml血液的血液样品。将样品收集在含有k2‑
edta的管中。使用advia2120i血液学分析仪(siemens,usa)分析样品的红血细胞(rbc)计数、血红蛋白(hgb)、血细胞比容(hct)、血小板计数(plt)、总白血细胞计数(wbc)、嗜中性粒细胞计数(neu)、淋巴细胞计数(lym)和单核细胞计数(mon)。
[0685]
表25
[0686]
食蟹猴的血液学标志物分析
[0687][0688]
尿分析
[0689]
在新鲜尿收集的前一天取出食物过夜,但供应水。在第43天,使用在湿冰上的干净笼子托盘收集所有动物的新鲜尿样品以用于尿分析法和尿化学法(早晨第一次尿)。使用toshiba 120fr自动化化学分析仪(toshiba co.,japan)测量尿分析法/尿化学法参数肌酐(ucre)、微量蛋白(utp)、尿微量白蛋白(ualb)和蛋白/肌酐(p/c)比。
[0690]
表26
[0691]
食蟹猴的尿分析
[0692][0693]
实施例11:比较化合物对a431细胞中的人malat1的剂量依赖性抑制
[0694]
在a431细胞中在各种剂量下测试了本领域中所述的某些修饰寡核苷酸并且其在下文的其他实施例中用作比较化合物。比较了本领域中所述的以下修饰寡核苷酸:395240、395243、395244、395248、395251、395252、395253、395254、395255、395256、395257、395259、395267、395269、395272、395275、395280、395283、395287、395290、556089、559497和626112。下表中的化学表示栏指定序列和化学信息,包括5
‑
甲基胞嘧啶、糖化学和核苷间键化学;其中下标
‘
d’表示2
’‑
β
‑
d
‑
脱氧核糖基糖部分,下标
‘
k’表示cet糖部分,下标
‘
e’表示2
’‑
moe糖部分,下标
‘
s’表示硫代磷酸酯核苷间键,胞嘧啶残基前面的上标
‘
m’表示5
‑
甲基胞嘧啶,并且下标
‘
o’表示磷酸二酯核苷间键。“起始位点”指示在人核酸序列中与间隔体互补的5
’‑
最末端核苷。“终止位点”指示在人核酸序列中与间隔体互补的3
’‑
最末端核苷。下表列出的各修饰寡核苷酸均与人malat1核酸序列seq id no:1(genbank登录号:xr_001309.1)互补。
[0695]
表27
[0696]
某些比较化合物
[0697]
[0698][0699]
化合物1058667和1058668在本领域中已有描述。下表中的化学表示栏指定某些比较化合物的序列和化学信息,包括5
‑
甲基胞嘧啶、糖化学和核苷间键化学;其中下标
‘
d’表
示2
’‑
β
‑
d
‑
脱氧核糖基糖部分,下标
‘
l’表示lna糖部分,下标
‘
s’表示硫代磷酸酯核苷间键,并且胞嘧啶残基前面的上标
‘
m’表示5
‑
甲基胞嘧啶。化合物1058667和1058668与小鼠malat1核酸序列互补并且与人malat1核酸序列错配。“起始位点”指示在小鼠核酸序列中与间隔体互补的5
’‑
最末端核苷。“终止位点”指示在小鼠核酸序列中与间隔体互补的3
’‑
最末端核苷。下表列出的各修饰寡核苷酸均与小鼠malat1核酸序列seq id no:2823(从核苷酸5793001至5806000截短的genbank登录号:nc_000085.6的补体)互补。
[0700]
表28
[0701]
某些比较化合物
[0702][0703]
在使用相同培养条件的一系列实验中测试了以下修饰寡核苷酸。各实验的结果在下文所示的单独表中给出。使用自由摄取,用稀释至如下表所指定的不同浓度的修饰寡核苷酸转染密度为每孔10,000个细胞的经过培养的a431细胞。在大约48小时的处理期之后,如先前所述使用人引物
‑
探针组rts2738(上文所述)测量rna水平。如通过所测量,将malat1rna水平归一化为总rna。结果作为相对于pbs对照的malat1 rna的变化百分比给出。
[0704]
对excel中的数据的对数/线性图使用线性回归来计算各修饰寡核苷酸的半最大抑制浓度(ic
50
)并且也在下表给出。
[0705]
表29
[0706]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0707][0708]
表30
[0709]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0710][0711]
实施例12:3
‑
10
‑
3 cet间隔体对a431细胞中的人malat1的反义抑制
[0712]
合成了与malat1核酸互补的修饰寡核苷酸并与上文所述的比较化合物395240、395253、395254、395256、556089和559497相比较来测试所述修饰寡核苷酸对体外malat1 rna水平的影响。在使用相同培养条件的一系列实验中测试了修饰寡核苷酸。各单独实验的结果在以下单独表中给出。
[0713]
除作为5
‑
10
‑
5 moe间隔体(即,其具有10个2
’‑
脱氧核苷的中心间隙区段,各侧侧接侧翼区段,各侧翼区段包含5个2
’‑
o
‑
甲氧基乙基修饰的核苷)的比较化合物395240、395253、395254和395256之外,修饰寡核苷酸全部是3
‑
10
‑
3 cet间隔体(即,其具有10个2
’‑
脱氧核苷的中心间隙区段,各侧侧接侧翼区段,各侧翼区段包含3个cet修饰的核苷)。各修饰寡核苷酸中的核苷间键均为硫代磷酸酯(p=s)键。各修饰寡核苷酸中的所有胞嘧啶核碱基均为5
‑
甲基胞嘧啶。
[0714]“起始位点”指示靶序列的与修饰寡核苷酸互补的5
’‑
最末端核苷。“终止位点”指
示靶序列的与修饰寡核苷酸互补的3
’‑
最末端核苷。如下表所示,修饰寡核苷酸与本文指定为seq id no:1(genbank登录号xr_001309.1)的人malat1 rna转录物或本文指定为seq id no:2824(genbank登录号ef177381.1)的人malat1 rna转录物100%互补。『n/a』指示修饰寡核苷酸不以100%互补性与所述特定靶序列互补。
[0715]
使用自由摄取,用5nm修饰寡核苷酸转染密度为每孔10,000个细胞的经过培养的a431细胞。在48小时的处理期之后,从细胞中分离出rna并且通过定量实时rtpcr测量malat1 rna水平。使用人malat1引物探针组rts2736(上文所述)测量rna水平。如通过所测量,将malat1rna水平归一化为总rna含量。结果作为相对于pbs对照的malat1 rna的变化百分比(%utc)给出。符号指示修饰寡核苷酸在引物探针组的扩增子区域内与靶转录物互补,并且因此相关数据不可靠。在此类情况下,必须进行使用替代引物探针的另外测定以准确评估此类修饰寡核苷酸的效力和功效。在一些情况下,%utc值不可获得。这表示为n.d.(未限定),并且将进行另外的测定以准确评估此类修饰寡核苷酸的效力和功效。
[0716]
标记有三重星号的修饰寡核苷酸先前在实施例1中已有描述。下表中标记有三重星号的修饰寡核苷酸的%utc数据与实施例2中所述的数据相同,因为所述数据来自相同实验。
[0717]
表31
[0718]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0719]
[0720]
[0721][0722]
表32
[0723]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0724]
[0725]
[0726][0727]
实施例13:3
‑
10
‑
3 cet间隔体对a431细胞中的人malat1的反义抑制
[0728]
合成了与malat1核酸互补的修饰寡核苷酸并与上文所述的比较化合物395254和559497相比较来测试所述修饰寡核苷酸对体外malat1 rna水平的影响。在使用相同培养条件的一系列实验中测试了修饰寡核苷酸。各单独实验的结果在以下单独表中给出。
[0729]
除作为5
‑
10
‑
5 moe间隔体(即,其具有10个2
’‑
脱氧核苷的中心间隙区段,各侧侧接侧翼区段,各侧翼区段包含5个2
’‑
o
‑
甲氧基乙基修饰的核苷)的比较化合物395254之外,修饰寡核苷酸全部是3
‑
10
‑
3 cet间隔体(即,其具有10个2
’‑
脱氧核苷的中心间隙区段,各侧侧接侧翼区段,各侧翼区段包含3个cet修饰的核苷)。各修饰寡核苷酸中的核苷间键均为
硫代磷酸酯(p=s)键。各修饰寡核苷酸中的所有胞嘧啶核碱基均为5
‑
甲基胞嘧啶。
[0730]“起始位点”指示靶序列的与修饰寡核苷酸互补的5
’‑
最末端核苷。“终止位点”指示靶序列的与修饰寡核苷酸互补的3
’‑
最末端核苷。如下表所示,修饰寡核苷酸与本文指定为seq id no:1(genbank登录号xr_001309.1)的人malat1 rna转录物或本文指定为seq id no:2824(genbank登录号ef177381.1)的人malat1 rna转录物100%互补。
‘
n/a’指示修饰寡核苷酸不以100%互补性与所述特定靶序列互补。
[0731]
表33
[0732]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0733]
[0734]
[0735][0736]
表34
[0737]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0738]
[0739][0740]
表35
[0741]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0742]
[0743][0744]
表36
[0745]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0746]
[0747]
[0748][0749]
表37
[0750]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0751]
[0752]
[0753][0754]
表38
[0755]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0756]
[0757]
[0758][0759]
表39
[0760]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0761]
[0762][0763]
表40
[0764]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0765]
[0766][0767]
表41
[0768]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0769]
[0770]
[0771][0772]
表42
[0773]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0774]
[0775]
[0776][0777]
表43
[0778]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0779]
[0780]
[0781][0782]
表44
[0783]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0784]
[0785][0786]
表45
[0787]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0788]
[0789][0790]
表46
[0791]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0792]
[0793]
[0794][0795]
表47
[0796]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0797]
[0798]
[0799][0800]
表48
[0801]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0802]
[0803]
[0804][0805]
表49
[0806]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0807]
[0808]
[0809][0810]
表50
[0811]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0812]
[0813]
[0814][0815]
表51
[0816]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0817]
[0818][0819]
[0820]
表52
[0821]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0822]
[0823][0824]
表53
[0825]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0826]
[0827]
[0828][0829]
表54
[0830]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0831]
[0832]
[0833][0834]
表55
[0835]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0836]
[0837][0838]
表56
[0839]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0840]
[0841][0842]
表57
[0843]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0844]
[0845]
[0846][0847]
表58
[0848]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0849]
[0850]
[0851][0852]
表59
[0853]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0854]
[0855][0856]
表60
[0857]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0858]
[0859]
[0860][0861]
表61
[0862]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0863]
[0864]
[0865][0866]
表62
[0867]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0868]
[0869][0870]
表63
[0871]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0872]
[0873][0874]
表64
[0875]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0876]
cet间隔体。间隔体的长度为16个核苷,其中中心间隙区段包含1个2
’‑
o
‑
甲基核苷和9个2
’‑
脱氧核苷的组合。中心间隙区段在5’方向和3’方向上侧接各自包含3个核苷的侧翼区段。5’侧翼区段中的各核苷和3’侧翼区段中的各核苷均具有cet糖修饰。各间隔体中的核苷间键均为硫代磷酸酯(p=s)键。序列和化学表示栏指定序列,包括5
‑
甲基胞嘧啶、糖化学和核苷间键化学;其中下标
‘
d’表示2
’‑
β
‑
d
‑
脱氧核糖基糖部分,下标
‘
k’表示cet糖部分,下标
‘
s’表示硫代磷酸酯核苷间键,胞嘧啶残基前面的上标
‘
m’表示5
‑
甲基胞嘧啶,并且下标
‘
y’表示2
’‑
ome糖部分。“起始位点”指示在人核酸序列中与间隔体互补的5
’‑
最末端核苷。“终止位点”指示在人核酸序列中与间隔体互补的3
’‑
最末端核苷。
[0880]
下表列出的各修饰寡核苷酸均与人malat1核酸序列seq id no:1(genbank登录号:xr_001309.1)互补。
[0881]
表65
[0882]
与人malat1互补的具有2
’‑
ome糖的cet间隔体
[0883]
[0884][0885]
实施例15:3
‑
10
‑
3 cet间隔体对hepg2细胞中的人malat1的反义抑制
[0886]
合成了与malat1核酸互补的修饰寡核苷酸并与上文所述的比较化合物395240和556089相比较来测试所述修饰寡核苷酸对体外malat1 rna水平的影响。在使用相同培养条件的一系列实验中测试了修饰寡核苷酸。各单独实验的结果在以下单独表中给出。
[0887]
除作为5
‑
10
‑
5 moe间隔体(即,其具有10个2
’‑
脱氧核苷的中心间隙区段,各侧侧接侧翼区段,各侧翼区段包含5个2
’‑
o
‑
甲氧基乙基修饰的核苷)的比较化合物395240之外,修饰寡核苷酸全部是3
‑
10
‑
3 cet间隔体(即,其具有10个2
’‑
脱氧核苷的中心间隙区段,各侧侧接侧翼区段,各侧翼区段包含3个cet修饰的核苷)。各修饰寡核苷酸中的核苷间键均为
硫代磷酸酯(p=s)键。各修饰寡核苷酸中的所有胞嘧啶核碱基均为5
‑
甲基胞嘧啶。
[0888]“起始位点”指示靶序列的与修饰寡核苷酸互补的5
’‑
最末端核苷。“终止位点”指示靶序列的与修饰寡核苷酸互补的3
’‑
最末端核苷。如下表所示,修饰寡核苷酸与本文指定为seq id no:1(genbank登录号xr_001309.1)的人malat1 rna转录物或本文指定为seq id no:2824(genbank登录号ef177381.1)的人malat1 rna转录物100%互补。
‘
n/a’指示修饰寡核苷酸不以100%互补性与所述特定靶序列互补。
[0889]
使用电穿孔,用300nm修饰寡核苷酸转染密度为每孔20,000个细胞的经过培养的hepg2细胞。在过夜孵育之后,从细胞中分离出rna并且通过定量实时rtpcr测量malat1 rna水平。使用人引物探针组rts2738(正向序列gaattgcgtcatttaaagcctagtt,在本文中指定为seq id no:2820;反向序列tcatcctaccactcccaattaatct,在本文中指定为seq id no:2821;探针序列acgcatttactaaacgcagacgaaaatgga,在本文中指定为seq id no:2822)测量rna水平。如通过所测量,将malat1 rna水平归一化为总rna含量。结果作为相对于pbs对照的malat1 rna的变化百分比给出。符号指示修饰寡核苷酸在引物探针组的扩增子区域内与靶转录物互补并且因此相关数据不可靠。在此类情况下,必须进行使用替代引物探针的另外的测定以准确评估此类修饰寡核苷酸的效力和功效。
[0890]
表66
[0891]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0892]
[0893][0894]
表67
[0895]3‑
10
‑
3 cet间隔体对malat1 rna的抑制
[0896]
[0897]
[0898][0899]
实施例16:3
‑
10
‑
3 cet间隔体对a431细胞中的人malat1的剂量依赖性抑制
[0900]
选择上文研究中所述的表现出显著的体外malat1 rna抑制的某些修饰寡核苷酸并且与上文所述的比较化合物395240、395243、395244、395248、395253、395254、395255、395256、395280、556089和559497相比较,在a431细胞中在各种剂量下对其进行测试。
[0901]
在使用相同培养条件的一系列实验中测试了修饰寡核苷酸。各实验的结果在下文所示的单独表中给出。使用自由摄取,用稀释至如下表中所指定的不同浓度的修饰寡核苷酸转染密度为每孔10,000个细胞的经过培养的a431细胞。在大约48小时的处理期之后,如先前所述使用人引物
‑
探针组rts2736测量rna水平。如通过所测量,将malat1rna水平归一化为总rna。结果作为相对于pbs对照的malat1 rna的变化百分比给出。
[0902]
对excel中的数据的对数/线性图使用线性回归来计算各修饰寡核苷酸的半最大抑制浓度(ic
50
)并且也在下表给出。下表中标记有三重星号的修饰寡核苷酸的%utc值先前已在上文实施例3(表3)中给出。下表中标记有三重星号的修饰寡核苷酸的%utc和ic
50
数据与实施例3中所给出的数据相同,因为所述数据来自相同实验。
[0903]
表68
[0904]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0905][0906]
表69
[0907]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0908][0909][0910]
实施例17:3
‑
10
‑
3 cet间隔体对a431细胞中的人malat1的剂量依赖性抑制
[0911]
选择上文研究中所述的表现出显著的体外malat1 rna抑制的某些修饰寡核苷酸并在a431细胞中在各种剂量下对其进行测试。
[0912]
在使用相同培养条件的一系列实验中测试了修饰寡核苷酸。各实验的结果在下文所示的单独表中给出。使用自由摄取,用稀释至如下表中所指定的不同浓度的修饰寡核苷酸转染密度为每孔10,000个细胞的经过培养的a431细胞。在大约48小时的处理期之后,如先前所述使用人引物
‑
探针组rts2736测量rna水平。如通过所测量,将malat1 rna水平归一化为总rna。结果作为相对于pbs对照的malat1 rna的变化百分比给出。
[0913]
对excel中的数据的对数/线性图使用线性回归来计算各修饰寡核苷酸的半最大抑制浓度(ic
50
)并且也在下表给出。下表中标记有三重星号的修饰寡核苷酸的%utc值先前已在上文实施例3(表3)中给出。下表中标记有三重星号的修饰寡核苷酸的%utc和ic
50
数据与实施例3中给出的数据相同,因是所述数据来自相同实验。
[0914]
表70
[0915]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0916][0917][0918]
表71
[0919]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0920][0921]
表72
[0922]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0923][0924]
表73
[0925]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0926][0927][0928]
表74
[0929]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0930][0931]
表75
[0932]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0933][0934][0935]
表76
[0936]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0937]
[0938]
表77
[0939]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0940][0941]
表78
[0942]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0943]
[0944][0945]
表79
[0946]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0947][0948]
表80
[0949]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0950]
[0951][0952]
表81
[0953]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0954][0955]
表82
[0956]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0957][0958]
表83
[0959]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0960][0961][0962]
表84
[0963]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0964][0965]
表85
[0966]
由修饰寡核苷酸造成的a431细胞中的人malat1 rna的剂量依赖性百分比减少
[0967][0968]
[0969]
实施例18:cet间隔体对mda
‑
mb
‑
436细胞中的人malat1的剂量依赖性抑制
[0970]
在mda
‑
mb
‑
436细胞中以各种剂量测试了以上研究中所述的修饰寡核苷酸。使用自由摄取,用稀释至下表所述浓度的修饰寡核苷酸处理密度为每孔5,000
‑
12,000个细胞的经过培养的mda
‑
mb
‑
436细胞。大约48小时之后,如先前所述使用人malat1引物
‑
探针组rts2736测量malat1 rna水平。将malat1 rna水平归一化为使用人引物
‑
探针组hts5002(上文所述)测量的b
‑
肌动蛋白。结果作为malat1 rna的量相对于未处理的对照细胞的对照百分比(%utc)在下表给出。使用“log(抑制剂)对反应
‑
变量斜率(4个参数)”式,使用prism6软件计算ic50。下表中标记有三重星号的修饰寡核苷酸的%utc值先前已在上文实施例4(表4)中给出。下表中标记有三重星号的修饰寡核苷酸的%utc数据与表4中给出的数据相同,因为所述数据来自相同实验。
[0971]
表86
[0972]
修饰寡核苷酸在mda
‑
mb
‑
436细胞中对人malat1 rna表达的剂量依赖性抑制
[0973]
[0974]
[0975][0976]
实施例19:靶向人malat1的修饰寡核苷酸在cd
‑
1小鼠中的耐受性
[0977]
balb/c小鼠是常常用于安全性和功效测试的多用途小鼠模型。用选自以上所述研究的修饰寡核苷酸处理小鼠并且评价各种血浆化学标志物的水平变化。
[0978]
研究1
[0979]
向几组4只6至8周龄的雄性balb/c小鼠一周两次皮下注射50mg/kg的修饰寡核苷酸,持续4周(总计8次处理)。一组4只雄性cd
‑
1小鼠注射pbs。在最后一次施用之后24小时将小鼠安乐死。
[0980]
为了评价修饰寡核苷酸对肝和肾功能的影响,使用自动化临床化学分析仪(hitachi olympus au400c,melville,ny)测量天冬氨酸转氨酶(ast)、丙氨酸转氨酶(alt)、总胆红素(tbil)和血尿素氮(bun)的血浆水平。结果在下表给出。测定包括一组4只动物,除了其中星号(*)指示特定测定使用3只动物或更少动物。进一步的研究中不包括引起在修饰寡核苷酸的预期范围之外的任何肝或肾功能标志物水平变化的修饰寡核苷酸。
[0981]
表87
[0982]
雄性balb/c小鼠中的血浆化学标志物
[0983][0984]
在第25天测量体重,并且各组的平均体重在下表给出。在研究结束时测量肝、肾和脾重量并且在下表给出。进一步的研究中不包括引起在修饰寡核苷酸的预期范围之外的器官重量的任何变化的修饰寡核苷酸。
[0985]
表88
[0986]
体重和器官重量(以克计)
[0987]
[0988][0989]
研究2
[0990]
向几组4只4至6周龄的雄性cd
‑
1小鼠一周两次皮下注射50mg/kg/剂量的修饰寡核苷酸,持续4周(总计8次处理)。一组4只雄性cd
‑
1小鼠注射pbs。在最后一次施用之后24小时将小鼠安乐死。下表中标记有三重星号的修饰寡核苷酸的值先前已在上文表7和表8中给出。下表中标记有三重星号的修饰寡核苷酸的数据与表7和表8中给出的数据相同,因为所述数据来自相同实验。
[0991]
为了评价修饰寡核苷酸对肝和肾功能的影响,使用自动化临床化学分析仪(hitachi olympus au400c,melville,ny)测量丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)、血尿素氮(bun)、总胆红素(tbil)和白蛋白(alb)的血浆水平。结果在下表中给出。测定包括一组4只动物,除了其中星号(*)指示特定测定使用3只动物或更少动物。进一步的研究中不包括引起在修饰寡核苷酸的预期范围之外的任何肝或肾功能标志物水平变化的修饰寡核苷酸。
[0992]
表89
[0993]
cd
‑
1雄性小鼠中的血浆化学标志物
[0994][0995]
在研究结束时测量cd
‑
1小鼠的体重,并且各组的平均体重在下表给出。在研究结束时测量肝、肾和脾重量并且在下表给出。进一步的研究中不包括引起在修饰寡核苷酸的预期范围之外的器官重量的任何变化的修饰寡核苷酸。
[0996]
表90
[0997]
体重和器官重量(以克计)
[0998]
[0999][1000]
研究3
[1001]
向几组4只4至6周龄的雄性cd
‑
1小鼠一周两次皮下注射50mg/kg/剂量的修饰寡核苷酸,持续4周(总计8次处理)。一组4只雄性cd
‑
1小鼠注射pbs。在最后一次施用之后24小时将小鼠安乐死。
[1002]
为了评价修饰寡核苷酸对肝和肾功能的影响,使用自动化临床化学分析仪(hitachi olympus au400c,melville,ny)测量丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)、血尿素氮(bun)和总胆红素(tbil)的血浆水平。结果在下表给出。测定包括一组4只动物,除了其中星号(*)指示特定测定使用3只动物或更少动物。进一步的研究中不包括引起在修饰寡核苷酸的预期范围之外的任何肝或肾功能标志物水平变化的修饰寡核苷酸。
[1003]
下表中标记有三重星号的修饰寡核苷酸的值先前已在上文表13和表14中给出。下表中标记有三重星号的修饰寡核苷酸的数据与表13和表14中给出的数据相同,因为所述数据来自相同实验。
[1004]
表91
[1005]
cd
‑
1雄性小鼠中的血浆化学标志物
[1006][1007]
在第1天和第25天测量cd
‑
1雄性小鼠的体重,并且各组的平均体重在下表给出。在研究结束时测量肝、肾和脾重量并且在下表给出。进一步的研究中不包括引起在修饰寡核苷酸的预期范围之外的器官重量的任何变化的修饰寡核苷酸。
[1008]
表92
[1009]
体重和器官重量(以克计)
[1010]
[1011][1012]
研究4
[1013]
向几组4只4至6周龄的雄性cd
‑
1小鼠一周两次皮下注射50mg/kg/剂量的修饰寡核苷酸,持续4周(总计8次处理)。一组4只雄性cd
‑
1小鼠注射pbs。在最后一次施用之后72小时将小鼠安乐死。下表中标记有三重星号的修饰寡核苷酸的值先前已在上文表15和表16中给出。下表中标记有三重星号的修饰寡核苷酸的数据与表15和表16中给出的数据相同,因为所述数据来自相同实验。
[1014]
为了评价修饰寡核苷酸对肝和肾功能的影响,使用自动化临床化学分析仪(hitachi olympus au400c,melville,ny)测量丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)、血尿素氮(bun)和总胆红素(tbil)的血浆水平。结果在下表给出。测定包括一组4只动物,除了其中星号(*)指示特定测定使用3只动物或更少动物。进一步的研究中不包括引起在修饰寡核苷酸的预期范围之外的任何肝或肾功能标志物水平变化的修饰寡核苷酸。
[1015]
表93
[1016]
cd
‑
1雄性小鼠中的血浆化学标志物
[1017][1018]
在第1天和第25天测量cd
‑
1雄性小鼠的体重,并且各组的平均体重在下表给出。在研究结束时测量肝、肾和脾重量并且在下表给出。进一步的研究中不包括引起在修饰寡核苷酸的预期范围之外的器官重量的任何变化的修饰寡核苷酸。
[1019]
表94
[1020]
体重和器官重量(以克计)
[1021][1022][1023]
研究5
[1024]
向几组4只4至6周龄的雄性cd
‑
1小鼠一周两次皮下注射50mg/kg/剂量的修饰寡核
苷酸,持续4周(总计8次处理)。一组4只雄性cd
‑
1小鼠注射pbs。在最后一次施用之后24小时将小鼠安乐死。下表中标记有三重星号的修饰寡核苷酸的值先前已在上文表9和表10中给出。下表中标记有三重星号的修饰寡核苷酸的数据与表9和表10中给出的数据相同,因为所述数据来自相同实验。
[1025]
为了评价修饰寡核苷酸对肝和肾功能的影响,使用自动化临床化学分析仪(hitachi olympus au400c,melville,ny)测量丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)、血尿素氮(bun)和总胆红素(tbil)的血浆水平。结果在下表给出。测定包括一组4只动物,除了其中星号(*)指示特定测定使用3只动物或更少动物。进一步的研究中不包括引起在修饰寡核苷酸的预期范围之外的任何肝或肾功能标志物水平变化的修饰寡核苷酸。
[1026]
表95
[1027]
cd
‑
1雄性小鼠中的血浆化学标志物
[1028][1029][1030]
在第1天和第25天测量cd
‑
1雄性小鼠的体重,并且各组的平均体重在下表给出。在研究结束时测量肝、肾和脾重量并且在下表给出。进一步的研究中不包括引起在修饰寡核苷酸的预期范围之外的器官重量的任何变化的修饰寡核苷酸。
[1031]
表96
[1032]
体重和器官重量(以克计)
[1033]
olympus au400c,melville,ny)测量微量总蛋白(mtp)和肌酐的尿水平。mtp与肌酐的比(mtp/c比)在下表给出。进一步的研究中不包括引起在修饰寡核苷酸的预期范围之外的比率水平变化的ionis寡核苷酸。
[1048]
表99
[1049]
sprague
‑
dawley大鼠中mtp与肌酐的比
[1050][1051]
在第41天测量大鼠的体重,并且各组的平均体重在下表给出。在研究结束时测量肝、脾和肾重量,并且在下表给出。进一步的研究中不包括引起在修饰寡核苷酸的预期范围之外的器官重量的任何变化的ionis寡核苷酸。
[1052]
表100
[1053]
体重和器官重量(g)
[1054][1055]
研究2
[1056]
向几组4只sprague
‑
dawley大鼠各自每周皮下注射50mg/kg的ionis寡核苷酸,持续6周(共7次剂量)。将大鼠安乐死;并且在最后一次剂量之后1天,收获器官、尿和血浆以供进一步分析。
[1057]
血浆化学标志物
[1058]
为了评价修饰寡核苷酸对肝和肾功能的影响,使用自动化临床化学分析仪(hitachi olympus au400c,melville,ny)测量丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)、血尿素氮(bun)和总胆红素(tbil)的血浆水平。结果在下表给出。进一步的研究中不包括引起在修饰寡核苷酸的预期范围之外的任何肝或肾功能标志物水平变化的修饰寡核苷酸。
[1059]
表101
[1060]
sprague
‑
dawley大鼠中的血浆化学标志物
[1061][1062]
在研究结束时,即第43天,将获自大鼠组的血液送到idexx bioanalytics,以用于测量血细胞计数。取得的计数包括红血细胞(rbc)计数、血红蛋白(hgb)、血细胞比容(hct)、血小板计数(plt)、总白血细胞计数(wbc)、嗜中性粒细胞计数(neu)、淋巴细胞计数(lym)和单核细胞计数(mon)。结果在下表给出。进一步的研究中不包括引起在修饰寡核苷酸的预期范围之外的血细胞计数变化的ionis寡核苷酸。
[1063]
表102
[1064]
sprague
‑
dawley大鼠中的血细胞计数
[1065]
为了评价ionis寡核苷酸对肾功能的影响,使用自动化临床化学分析仪(hitachi olympus au400c,melville,ny)测量微量总蛋白(mtp)和肌酐的尿水平。mtp与肌酐的比(mtp/c比)在下表给出。进一步的研究中不包括引起在修饰寡核苷酸的预期范围之外的比率水平变化的ionis寡核苷酸。
[1066]
表103
[1067]
sprague
‑
dawley大鼠中mtp与肌酐的比
[1068][1069]
在第1天和第38天测量大鼠的体重并且各组的平均体重在下表给出。在研究结束时测量肝、脾和肾重量,并且在下表给出。进一步的研究中不包括引起在修饰寡核苷酸的预期范围之外的器官重量的任何变化的ionis寡核苷酸。
[1070]
表104
[1071]
体重和器官重量(g)
[1072]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

