1.本发明涉及细胞制造技术,特别涉及一种确保生物安全性及物理安全性并且适合量产的细胞制造系统。
背景技术:
2.胚胎干细胞(es细胞)是从人或小鼠的早起胚胎建立的干细胞,具有可分化为生物体中全部细胞的多能性。认为人体es细胞可用于帕金森病、年轻糖尿病及白血病等多种疾病的细胞移植疗法。但是,es细胞移植与脏器移植一样,存在引发排斥反应的问题。另外,对于使用破坏人体胚胎而建立的es细胞,从伦理观点出发反对意见很多。
3.与之相对,京都大学山中伸弥教授通过将4种基因:oct3/4、klf4、c
‑
myc和sox2导入到体细胞中,成功建立了诱导性多能干细胞(ips细胞),从而获得了2012年诺贝尔生理学和医学奖(例如,参照专利文献1)。ips细胞是没有排斥反应和伦理问题的理想的多能性细胞,期待用于细胞移植疗法。
4.ips细胞这样的诱导性干细胞通过将基因等诱导因子导入到细胞中而建立,并扩大培养及冷冻保存。但是,例如为了制作临床用ips细胞(glp、gmp等级)等,需要保持为非常洁净的洁净室,花费高昂的维持成本。为了工业化,课题在于如何高效地使用洁净室来努力削减成本。
5.另外,ips细胞的制作大多通过手工作业来进行,但能够制作临床用ips细胞的技术人员少。存在干细胞的建立到保存的一系列作业复杂的问题。在临床用细胞培养中,需要进行以下3个步骤:标准工序(sop:standard of process)的确认、按照sop进行操作、以及确认是否按照sop执行了操作,由人进行这些步骤效果不佳。细胞培养需要每天24小时进行管理,干细胞的保存多达几十年,因此,仅由人力进行管理是有限的。
6.因此,开发出一种完全封闭系统的细胞制造装置,其不需要高度清洁的洁净室,能够在通常管理区域(例如在who
‑
gmp标准中微生物和微粒子中的至少一方为等级d级或其以上)进行作业(例如,参照专利文献2)。另外,为了还排除人力使复杂的细胞制造工序自动化,开发出具有机器人的细胞制造系统,该机器人用于辅助细胞制造。作为与该细胞制造系统相关的现有技术,已知以下文献。但是,所有文献均没有使用能够在通常管理区域进行作业的封闭系统细胞制造装置。
7.在专利文献3~9中公开了在洁净室内配置有操作机器人的自动细胞培养装置,在专利文献10中公开了在处理站内具有旋转式机器人的自动细胞培养传代系统。
8.在专利文献11中公开了具有在多个细胞培养室、原料处理室、产品处理室之间进行细胞输送的机器人的自动细胞培养设施,在专利文献12中公开了对多个细胞培养中的至少一部分进行操作的机器人。
9.在专利文献13~14中公开了细胞培养处理系统,在该细胞培养处理系统中,包含输送机器人的输送装置和各处理装置具有能够灭菌或净化的密闭空间,并且可通过装卸单元进行连结。
10.在专利文献15中公开了具有电动机器人的试样储藏装置,该电动机器人用于输送细胞培养烧瓶等试样容器,在专利文献16中公开了通过机械手进行细胞培养容器的开栓作业的机器人系统。
11.在专利文献17中公开了具有一边照射紫外线一边移动的机器人的自动细胞培养装置,在专利文献18
‑
20中公开了具有用于移动物品的机器人的细胞培养培育箱。
12.在专利文献21~22中公开了具有使细胞培养容器移动至观察位置的第一机械臂以及将细胞培养容器内的细胞转移至产品容器的第二机械臂的培养细胞产品制造装置。
13.在专利文献23中公开了细胞培养系统,其具有:用于培养细胞的多个设备、进行细胞培养操作的机器人、收纳多个设备以及机器人的收纳部、以及设置在收纳部侧面的门。
14.现有技术文献
15.专利文献
16.专利文献1:专利第4183742号公报
17.专利文献2:日本特开2018
‑
019685号公报
18.专利文献3:日本特开2006
‑
115798号公报
19.专利文献4:日本特开2006
‑
149268号公报
20.专利文献5:日本特开2007
‑
275030号公报
21.专利文献6:日本特开2008
‑
054690号公报
22.专利文献7:日本特开2008
‑
237046号公报
23.专利文献8:日本特开2008
‑
237112号公报
24.专利文献9:日本特开2009
‑
291104号公报
25.专利文献10:日本特表2008
‑
533989号公报
26.专利文献11:日本特开2009
‑
219415号公报
27.专利文献12:日本特表2009
‑
502168号公报
28.专利文献13:日本特开2012
‑
147685号公报
29.专利文献14:再公表专利2012/098931号
30.专利文献15:日本特表2013
‑
508673号公报
31.专利文献16:日本特开2018
‑
000020号公报
32.专利文献17:日本特开2018
‑
117586号公报
33.专利文献18:日本特表2018
‑
510660号公报
34.专利文献19:日本特表2018
‑
512889号公报
35.专利文献20:日本特表2018
‑
516591号公报
36.专利文献21:再公表专利2018/147897号
37.专利文献22:再公表专利2018/147898号
38.专利文献23:再公表专利2016/170623号
技术实现要素:
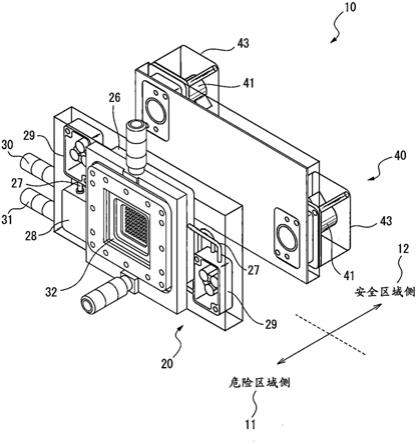
39.发明要解决的课题
40.在使用了封闭系统细胞制造装置的自动细胞制造系统中,能够在通常管理区域进行细胞制造,但为了降低不必要污染的可能性,期望人不进入细胞制造区域。另外,在系统
运转过程中在细胞制造区域存在不知何时进行动作的机器人,因此,需要将人与细胞制造区域隔离来确保安全。
41.另一方面,培养细胞是生物,如果不在适当决定的时间内进行交接、处理、保存则培养细胞会死亡,因此,细胞制造系统需要24小时不停地持续运转,但为了防备封闭系统细胞制造装置万一发生故障,需要准备供人进入的区域。
42.另外,与其他领域的制造业不同,制造物自身存在偏差,因此,对于每个封闭系统细胞制造装置,细胞制造的进展各式各样。因此,还存在以下问题:在按照固定流程的系统控制中无法应对量产化。
43.因此,谋求一种确保生物安全性及物理安全性并且适合量产的细胞制造系统。
44.用于解决课题的手段
45.本公开一方式提供一种细胞制造系统,其具有:辅助细胞制造的机器人;以及由机器人以1对多的方式产生作用的多个封闭系统细胞制造装置,封闭系统细胞制造装置具有机器人产生作用的危险区域侧和所述危险区域侧的相反侧的安全区域侧这样的两面构造。
46.本公开另一方式提供一种细胞制造系统,其具有:辅助细胞制造的机器人;由机器人以1对多的方式产生作用的多个封闭系统细胞制造装置;以及计算机系统,其具有并行执行的多个封闭系统细胞制造装置用任务、以多对一的方式与多个封闭系统细胞制造装置用任务进行通信的机器人用任务,机器人用任务根据多个封闭系统细胞制造装置用任务的请求,从多种机器人用程序模块中启动至少1个程序模块。
47.本公开另一方式提供一种细胞制造系统,其具有:辅助细胞制造的机器人;包围机器人的单元;以及安装在单元且由机器人以1对多的方式产生作用的多个封闭系统细胞制造装置,机器人能够从单元的内侧访问封闭系统细胞制造装置,并且能够从单元外侧维修封闭系统细胞制造装置。
48.本公开另一方式提供一种细胞制造系统,其具有:辅助细胞制造的机器人;与机器人自动行驶的线平行的壁状构造;以及安装在壁状构造上且由机器人以1对多的方式产生作用的多个封闭系统细胞制造装置,机器人能够从壁状构造的表面侧访问封闭系统细胞制造装置,并且能够从壁状构造的背面侧维修封闭系统细胞制造装置。
49.本公开另一方式提供一种细胞制造系统,其具有:辅助细胞制造的机器人;由机器人以1对多的方式产生作用的多个封闭系统细胞制造装置;以及能够在机器人设置场所与封闭系统细胞制造装置保管场所之间输送封闭系统细胞制造装置的往复输送器,往复输送器能够从设置在保管场所的壁状构造的表面侧访问封闭系统细胞制造装置,并且能够从设置在保管场所的壁状构造的背面侧维修封闭系统细胞制造装置。
50.发明效果
51.根据本公开的方式,封闭系统细胞制造装置具有危险区域侧和安全区域侧这样的两面构造,因此,能够提供生物上和物理上都安全的细胞制造系统。另外,还能够提供一种即使对于每个封闭系统细胞制造装置细胞制造的进展各式各样,但通过按需系统控制能够适合量产化的细胞制造系统。并且,还能够根据设备构造的种类来强化维修体制。
附图说明
52.图1是一实施方式的封闭系统细胞制造装置的局部分解图。
53.图2是一实施方式的封闭系统细胞制造装置的分解图。
54.图3是表示单元型细胞制造系统的一例的俯视图。
55.图4a是表示将封闭系统细胞制造装置取出到安全区域侧的结构一例的局部剖视图。
56.图4b是表示将封闭系统细胞制造装置取出到安全区域侧的结构一例的局部剖视图。
57.图4c是表示将封闭系统细胞制造装置取出到安全区域侧的结构一例的局部剖视图。
58.图5是表示线型的细胞制造系统的一例的俯视图。
59.图6是表示往复输送型细胞制造系统的一例的俯视图。
60.图7a是表示往复输送器收取封闭系统细胞制造装置时的状况的俯视图。
61.图7b是表示往复输送器收取封闭系统细胞制造装置时的状况的俯视图。
62.图7c是表示往复输送器收取封闭系统细胞制造装置时的状况的俯视图。
63.图7d是表示往复输送器收取封闭系统细胞制造装置时的状况的俯视图。
64.图8a是表示往复输送器将封闭系统细胞制造装置送到机器人设置场所时的状况的俯视图。
65.图8b是表示往复输送器将封闭系统细胞制造装置送到机器人设置场所时的状况的俯视图。
66.图8c是表示往复输送器将封闭系统细胞制造装置送到机器人设置场所时的状况的俯视图。
67.图9是表示机器人用程序模块的一例的流程图。
68.图10是表示机器人用程序模块的一例的流程图。
69.图11是表示封闭系统细胞制造装置用程序模块的一例的流程图。
70.图12表示通过程序模块内的状态发送处理输出并记录的信息的一例。
71.图13是表示进行按需控制的计算机系统的一例的结构图。
72.图14a是封闭系统细胞制造装置用任务的流程图。
73.图14b是封闭系统细胞制造装置用任务的流程图。
74.图14c是封闭系统细胞制造装置用任务的流程图。
75.图15是机器人用任务的流程图。
76.图16a是表示细胞制造系统的运转区域的俯视图。
77.图16b是表示细胞制造系统的运转区域的俯视图。
78.图16c是表示细胞制造系统的运转区域的俯视图。
79.图17是表示气流控制系统的一例的侧视图。
具体实施方式
80.以下参照附图对本公开实施方式进行详细说明。在各附图中,对相同或类似的结构要素标注相同或类似的附图标记。另外,以下记载的实施方式并非限定保护范围中记载的发明技术范围以及用词含义。
81.1.封闭系统细胞制造装置
82.图1和图2表示本实施方式的封闭系统细胞制造装置10。封闭系统细胞制造装置10例如是进行细胞的初始化、重编程、运命转换、转化等的封闭系统细胞转换装置,进行从体细胞向干细胞的转换、从体细胞向目标细胞的转换等。但是,要注意封闭系统细胞制造装置10也可以是仅进行细胞培养、扩大培养等的装置。封闭系统细胞制造装置10是将应高度洁净的部分全部集中在内部,即使在通常管理区域也能够使用的细胞制造装置。
83.封闭系统细胞制造装置10具有由机器人产生作用的危险区域侧11和危险区域侧的相反侧的安全区域侧12的两面构造。由此,成为如下系统结构:即使在将封闭系统细胞制造装置10固定设置的状态下,也以1对多的方式将机器人与封闭系统细胞制造装置联系起来。不需要使作为作业对象的封闭系统细胞制造装置10旋转或移动,封闭系统细胞制造装置10始终在固定方向上与机器人联系起来。
84.封闭系统细胞制造装置10具有细胞制作用盒20和驱动盒20的驱动基座40。将盒20的正面配置成朝向机器人产生作用的危险区域侧11,将驱动基座40的背面配置成朝向危险区域侧11的相反侧的安全区域侧12。从防止生物污染的观点出发,盒20是一次性的,与之相对,驱动基座40能够重复使用,因此,封闭系统细胞制造装置10具有有助于低成本化的结构。但是,只要能够用清洗液等对盒20进行清洗,并且执行加热灭菌、伽马射线灭菌、紫外线杀菌等从而维持高度清洁的状态,则盒20也可以再利用。盒20对于驱动基座40能够装卸,盒20的背面与驱动基座40的正面连结。封闭系统细胞制造装置10具有能够从安全区域侧12进行维修的构造。
85.盒20构成为进行诱导源细胞从血液、皮肤等体细胞中的分离、分化诱导、扩大培养、细胞块破碎、目标细胞的回收等中的至少1个细胞制作工序。本例的盒20具有:培养成分透过部件21、与培养成分透过部件21的一侧接触的培养侧板22、以及与培养成分透过部件21的另一侧接触的培养基侧板23。另外,盒20具有经由各种贮液槽(未图示)向培养侧板22供给流体的培养侧供给塞24、从培养侧板22排出流体的培养侧排出塞25。对培养侧供给塞24连接例如收纳血液、多能性诱导因子、培养试剂等流体的注射器、玻璃瓶、输液袋等流体供给器(未图示),对培养侧排出塞25连接例如收纳制造过程中的细胞块悬浮液样品、制造后的细胞块悬浮液等流体的注射器、玻璃瓶、输液袋等流体排出器(未图示)。
86.盒20具有:用于保持培养基侧板23的培养基保持层26、经由培养基流路27与培养基保持层26连接的培养基罐28、以及配置在培养基流路27上的泵等2个流体机械29。另外,盒20具有连接流体供给器(未图示)的培养基侧供给塞30和连接流体排出器(未图示)的培养基侧排出塞31,其中,流体供给器收纳未使用的培养基,流体排出器收纳已使用的培养基。在本例中,培养基侧供给塞30和培养基侧排出塞31安装在培养基罐28的侧面,但也可以安装在培养基罐28的正面,无论哪种情况下它们都由机器人操作。上述各种塞只要是确保封闭系统的连接器即可,可以是针式连接器,也可以是无针连接器。对于上述各种流体供给器以及流体排出器,希望具有泵等流体机械。
87.盒20还具有能够通过照相机等传感器从危险区域侧11观察细胞制造工序的窗32。传感器可以设置在机器人的末端执行器附近或者与盒20连结。窗32由具有透明导电膜等的透明树脂、石英玻璃等形成,连接了温度控制部(未图示)。温度控制部将盒20内的温度维持在预定的培养温度。
88.驱动基座40具有:由马达、压电元件等构成的2个驱动部41、保持驱动部41的驱动
保持部件42;以及分别覆盖驱动部41的2个外部气体隔断部件43。驱动部41分别驱动盒20内的2个流体机械29。通过从驱动保持部件42去除外部气体隔断部件43,能够维修驱动部41。另外,通过去除驱动部41,还能够维修盒20的流体机械29等。或者,如以下所述,也可以根据需要将包含盒20和驱动基座40的封闭系统细胞制造装置10取出到安全区域侧12,由此能够对全部这些部件进行维修。
89.2.细胞制造系统的结构
90.细胞制造系统不需要高度洁净的洁净室,在通常管理区域进行细胞制造,但也可以为了防备封闭系统万一破损的情况,使细胞制造区域与外界相比为正压。虽然是通常环境,但为了降低不必要的污染、故障的可能性,以系统运转过程中人不在细胞制造区域中,也不介入到细胞制造区域中为前提。
91.在细胞制造区域中,细胞制造系统具有辅助细胞制造的机器人以及由机器人以1对多的方式产生作用的多个封闭系统细胞制造装置。在通常环境中,利用机器人进行材料的处理、输送、装卸等,因此作业品质的稳定性得以提高。即,消除了在手工作业中往往可能发生的判断错误、作业错误,另外,通过记录机器人程序的执行结果等,也容易记录作业履历。作为细胞制造系统的设备结构,例如能够采用单元型、线型、往复输送型等系统结构。以下,依次对这些设备结构进行说明。
[0092]2‑
1.单元型
[0093]
图3表示单元型的细胞制造系统1的一例。细胞制造系统1是单元型生产系统,其具有:辅助细胞制造的机器人50、包围一台机器人50的单元51、以及安装在单元51上且由机器人50以1对多的方式产生作用的多个封闭系统细胞制造装置10。机器人50包含垂直多关节机器人、水平多关节机器人等工业用机器人。单元51具有多边形、圆形等的壁状构造55,在单元51的壁状构造55上配置多个封闭系统细胞制造装置10。单元51的壁状构造55也可以在空间上分离出危险区域侧11与安全区域侧12。在图3中,在平面上以一层的方式描绘了多个封闭系统细胞制造装置10,但也可以在纸面的垂直方向上多层配置。
[0094]
细胞制造系统1可以并列设置多个单元51,并具备与各单元51联动的材料输送机构52。材料输送机构52例如可以是在材料设置场所与各单元51之间行驶的往复输送器53。往复输送器53可以是在行驶轴轨道54上自动行驶的往复输送器、机器人等,但也可以是无人输送车(agv)、无人机等。另外,材料输送机构52也可以仅是带式输送机。单元51除了仅配置在行驶轴轨道54的单侧以外,也可以配置在两侧。机器人50将细胞制作用盒、注射器、玻璃瓶、输液袋等材料搬入到单元51的内部,对驱动基座装卸细胞制作用盒,对细胞制作用盒装卸流体供给器或流体排出器等,并且将使用完的材料搬出到单元51外部。
[0095]
机器人50能够从单元51的壁状构造55的内侧访问封闭系统细胞制造装置10,并且能够从单元51的壁状构造55的外侧维修封闭系统细胞制造装置10。壁状构造55还起到所谓的机器人50的安全栅的功能。由此,即使维护作业员进入到单元51的外侧,维护作业员也与机器人50隔离,能够确保物理安全性。另外,在细胞制造系统1运转过程中,维护作业员不会进入到单元51的内侧,因此还能够防止生物污染。并且,在特定的封闭系统细胞制造装置10中产生了故障的情况下,即使系统正在运转,也能够从单元51的外侧仅对产生了故障的封闭系统细胞制造装置10进行维修。
[0096]
图4a~图4c表示将包含盒20及驱动基座40的封闭系统细胞制造装置10取出到安
全区域侧12的结构。壁状构造55具有能够配置封闭系统细胞制造装置10的开口56、以及通过铰链等能够在开口位置与封闭位置之间移动的闸门57。如图4a所示,在封闭系统细胞制造装置10被插入到开口56时成为以下状态:闸门57由于封闭系统细胞制造装置10的前进而弹起向开口位置移动,并且封闭系统细胞制造装置10封闭了开口56。另外,如图4b所示,在将封闭系统细胞制造装置10从开口56拔出时成为以下状态:闸门57由于封闭系统细胞制造装置10的后退而倒下向封闭位置移动,并且闸门57封闭了开口56。由此,能够在危险区域侧11及安全区域侧12的空间被自动隔离的状态下进行维修。如图4c所示,在维修时,也可以将封闭系统细胞制造装置10分离为盒20和驱动基座40来进行维修。
[0097]2‑
2.线型
[0098]
图5表示线型的细胞制造系统1的一例。细胞制造系统1是线型生产系统,其具有:辅助细胞制造的机器人50、与机器人50自动行驶的行走轴轨道54平行的壁状构造60、以及安装在壁状构造60上且由机器人50以1对多的方式产生作用的多个封闭系统细胞制造装置10。在壁状构造60上配置有多个封闭系统细胞制造装置10。壁状构造60可以是格状的安全栅等,但也可以是在空间上分离出危险区域侧11与安全区域侧12的构造。在图5中,在平面上以一层的方式描绘了多个封闭系统细胞制造装置10,但也可以在纸面的垂直方向上多层配置。另外,封闭系统细胞制造装置10除了仅配置在行驶轴轨道54的单侧以外,还可以配置在两侧。
[0099]
机器人50自动行驶比较长的距离,但也可以在行驶轴轨道54上配置多个机器人。另外,也可以构成为组合机架将其他的行驶轴轨道上下反转地设置在较高位置,将机器人以悬吊方式安装在行驶架台上。由此,制造工厂的地面空旷,因此,例如能够用作供给材料以及搬出材料的场所等,实现地面面积的有效使用。
[0100]
在1台机器人50负责的封闭系统细胞制造装置10的数量多的情况下,与上述单元型相比,线型可容易地增加与1台机器人相对的封闭系统细胞制造装置的设置个数。另外,在线型的情况下,机器人50的可动范围大,因此,机器人50能够去取材料,搬出使用完的材料。关于材料的供给及搬出,未必需要像单元型那样使材料自身向需要的场所移动。
[0101]
机器人50能够从壁状构造60的表面侧访问封闭系统细胞制造装置10,并且能够从壁状构造60的背面侧维修封闭系统细胞制造装置10。由此,与单元型相同,物理和生物方面都能够确保安全性。另外,即使在系统运转过程中,也能够从壁状构造60的背面侧仅对产生了故障的封闭系统细胞制造装置10进行维修。
[0102]2‑
3.往复输送型
[0103]
图6表示往复输送型的细胞制造系统1的一例。细胞制造系统1是往复输送型生产系统,其具有:辅助细胞制造的机器人50、由机器人50以1对多的方式产生作用的多个封闭系统细胞制造装置10、以及能够在机器人50的设置场所与封闭系统细胞制造装置10的保管场所之间输送封闭系统细胞制造装置10的往复输送器53。往复输送型与线型的不同点在于,机器人50不自动行驶,而是通过往复输送器53在机器人50的设置场所与封闭系统细胞制造装置10的保管场所之间输送封闭系统细胞制造装置10。在封闭系统细胞制造装置10的保管场所设置有用于配置多个封闭系统细胞制造装置10的壁状构造60。壁状构造60可以是格状的安全栅等,但也可以是在空间上分离出危险区域侧与安全区域侧的构造。在图6中,在平面上以一层的方式描绘了多个封闭系统细胞制造装置10,但也可以在纸面的垂直方向
上多层配置。
[0104]
在1台机器人负责的封闭系统细胞制造装置10的数量比线型更多的情况下,可以是固定设置一台或多台机器人50,使用用于输送封闭系统细胞制造装置10的往复输送器53的系统结构。往复输送器53可以是在行驶轴轨道54上行驶的装置,也可以是agv、无人机等。但是,在采用往复输送型的情况下,封闭系统细胞制造装置10(细胞制作用盒与驱动基座的组合)需要独立进行动作。例如,希望封闭系统细胞制造装置10具有cpu、存储器、总线、周边设备(泵、传感器等)等的输入输出接口、无线通信接口等,由电池驱动,并且通过与控制及管理整个系统的上位计算机装置进行无线通信来交换与细胞制造相关的指令、与制造状态相关的信息等。
[0105]
往复输送型的基本动作如下。大量排列的封闭系统细胞制造装置10在保管场所分别独立地运转,与细胞制造相关的制造工序分别进行。在需要进行材料的搬入及搬出、通过传感器的观察等针对封闭系统细胞制造装置10的某些处置时,将这些请求传递给上位计算机装置,往复输送器53根据来自上位计算机装置的指令到封闭系统细胞制造装置10的保管场所收取封闭系统细胞制造装置10。往复输送器53载置封闭系统细胞制造装置10移动至机器人50的设置场所。机器人50从往复输送器53收取封闭系统细胞制造装置10,进行必要的处置。在该处置期间,往复输送器53可以移动到其他场所进行必要的其他处理。在机器人50对于封闭系统细胞制造装置10的处置结束后,往复输送器53再次移动到机器人50的前方,将封闭系统细胞制造装置10再次设置在往复输送器53。往复输送器53输送封闭系统细胞制造装置10,将封闭系统细胞制造装置10返回到保管场所的原来位置。
[0106]
图7a~图7d表示往复输送器53收取封闭系统细胞制造装置10时的状况。往复输送器53移动到配置在保管场所的预定封闭系统细胞制造装置10的附近(参照图7a)。往复输送器53具有滑块55,滑块55向封闭系统细胞制造装置10侧伸长,把持封闭系统细胞制造装置10(参照图7b)。通过使伸长的滑块55复原,封闭系统细胞制造装置10移动到往复输送器53上(参照图7c)。之后,往复输送器53在行进轴轨道54上行驶(参照图7d。)。
[0107]
图8a~图8c表示往复输送器53将封闭系统细胞制造装置10送到机器人50的设置场所时的状况。往复输送器53移动到机器人50附近(参照图8a)。机器人50伸展机械臂,把持往复输送器53上载置的封闭系统细胞制造装置10,将封闭系统细胞制造装置10输送至设置在机器人50附近的夹具(参照图8b)。成为未载置封闭系统细胞制造装置10的状态的往复输送器53为了进行其他处理而从机器人50的设置场所移开(参照图8c)。同时,开始机器人50对封闭系统细胞制造装置10的处置。
[0108]
各封闭系统细胞制造装置10根据细胞制造工序的进展适当地连接流体供给器或流体排出器,在不需要时从封闭系统细胞制造装置10取下,这些作业在封闭系统细胞制造装置10被设置在夹具(未图示)的状态(参照图8c)下进行,该夹具设置在机器人50附近。例如,相对于图8c中的机器人50从封闭系统细胞制造装置10的相反侧向机器人50供给材料。
[0109]
往复输送器53能够从设置在保管场所的壁状构造60的表面侧访问封闭系统细胞制造装置10,并且能够从设置在保管场所的壁状构造60的背面侧维修封闭系统细胞制造装置10。由此,与单元型、线型相同,在物理和生物方面都能够确保安全性。另外,即使在系统运转过程中,也能够从设置在保管场所的壁状构造60的背面侧仅对产生了故障的封闭系统细胞制造装置10进行维修。
[0110]
3.细胞制造系统的动作
[0111]
以下,说明细胞制造区域中的细胞制造系统的动作的一例。
[0112]
(1)通过传感器确认驱动基座的状态
[0113]
使用在机器人50的机械臂前端的末端执行器附近安装的第一传感器(例如照相机、接近传感器、3维视觉传感器等)来确认驱动基座40的状态。所谓驱动基座40的状态例如是指在驱动基座40上是否没有安装不需要的装置,固定盒20的驱动基座40的固定件是否打开等。
[0114]
(2)向驱动基座安装盒
[0115]
机器人50在供给场所把持未使用的盒20,并且安装在预定的驱动基座40上。在把持紧前使用第一传感器来测量供给场所中的盒20的位置姿势,并且在安装紧前使用第一传感器来测量驱动基座40的位置姿势,由此对事先示教的机器人50的目标位置姿势进行校正。由此,即使盒20未准确地定位,机器人50也能够无误地执行把持以及安装。另外,也不需要准备对盒20进行定位的特别机构,因此,能够使系统结构非常简单。并且,还有助于大幅减少机器人动作程序中的事先的示教作业。
[0116]
另一方面,在以不使用传感器的示教回放方式对机器人的目标位置进行示教时,假设是在100处具有驱动基座40的系统的情况下,最坏情况是必须事先进行100种示教。但是,在如上那样采用通过传感器对目标位置进行校正的方式时,在优选的情况下,仅通过事先进行1种示教就能够将盒20适当地安装在100处的驱动基座40上。
[0117]
也可以设置为根据在机器人50的末端执行器的根部是否具有力传感器,在机器人的各关节部是否具有转矩传感器等,对机器人50进行力控制(柔顺控制等),在将机器人50把持的盒20安装在驱动基座40时,即使在盒20与驱动基座40之间的嵌合部位存在相对的位置偏移的状态下,以一方仿照另一方的方式对机器人50的移动目的地进行校正,一边避免产生不合理的力一边执行两者的嵌合。能够避免产生不合理的力而使盒20或驱动基座40损坏的事故。
[0118]
(3)向盒安装流体供给器
[0119]
在利用第一传感器确认了收纳血液、皮肤等体细胞的流体供给器是否为预定人的流体供给器之后,机器人50把持流体供给器,并且与盒20上的培养侧供给塞24连接。在把持紧前使用第一传感器测量流体供给器的位置姿势,在连接紧前使用第一传感器测量培养侧供给塞24的位置姿势,由此对事先示教的机器人50的目标位置姿势进行校正。也可以同时进行上述的力控制。
[0120]
(4)通过传感器确认驱动基座的动作
[0121]
在对驱动基座40进行驱动时,引起流体供给器内的液面变化、盒20的培养基罐28内的液面变化、贮液槽内的液面变化、流量变化等,因此机器人50使用第一传感器来确认这些液面变化。在未引起期待的液面变化时,作为产生了某种不良状况向上位计算机装置提供警报信号。
[0122]
(5)通过传感器确认诱导源细胞的分离
[0123]
在贮液槽中,诱导源细胞(例如单核细胞、纤维芽细胞、成体干细胞等)不断从血液、皮肤等体细胞中分离,在上清液层与沉降层之间出现边界,因此机器人50使用第一传感器确认边界的位置。期待的上清液层和沉降层各自的量已知,判定是否确实产生了与层变
化基准相符的现象。在未产生期待的层变化时,作为产生了某种不良情况向上位计算机装置提供警报信号。
[0124]
(6)通过传感器进行的诱导因子的混合及确认
[0125]
机器人50使用第一传感器将收纳诱导因子(例如包含山中4基因的仙台病毒、重编程因子等)的流体供给器安装到盒20的供给塞24。在组合了流体供给器的吸取或排出,暂时将诱导源细胞分离液引入到流体供给器侧后(诱导源细胞分离液与诱导因子混合),进行将全部流体排出到盒20的控制。必须可靠地进行该控制,因此机器人50使用第一传感器随时监视流体供给器内的液面变化、流量等。驱动部41对于流体供给器的吸取或排出以及与其速度对应地期待的液面变化、流量等已知,判定是否确实产生了与液面变化基准相符的现象。在未产生所期待的变化时,作为产生了某种不良状况向系统侧提供警报信号。还可以在各种贮液槽、培养槽等进行诱导因子的混合和确认。
[0126]
(7)通过传感器进行的培养基ph值的色相分析
[0127]
在使培养基循环的期间,利用第一传感器在流路上的培养基侧板的预定位置测量培养基的颜色,根据由传感器取得的信息来进行色相分析,由此非接触地求出培养基的ph值。培养基的ph值因细胞成长而变化,在变化的推移为期待的程度时,若ph值达到预先设定的值,则判定成为补充新鲜培养基的定时。
[0128]
(8)通过传感器进行的细胞或细胞块的测量
[0129]
在机器人50的末端执行器附近暂时把持第二传感器(例如具有高倍率镜头的照相机、超声波传感器等)并将其挪动,测量盒20的培养侧板22内的细胞或细胞块的个数、尺寸、形状、密度等。在第二传感器是具有高倍率镜头的照相机的情况下,需要在比照相机视野大的区域多次拍摄,因此,第二传感器附带使拍摄位置在xyz方向上微小移动的xyz驱动机构。第二传感器也可以不固定设置在机器人50的末端执行器附近,而是机器人50通过机械手等暂时把持第二传感器,使其接近特定的盒20,使第二传感器暂时与盒20连结,然后机器人50从该处离开执行其他处理。与盒20连结的第二传感器一边使xyz驱动机构进行驱动而使传感器微小地移动,一边对培养侧板22内进行多次测量。在培养侧板22内的测量结束后,机器人50再次把持第二传感器,解除盒20与第二传感器的连结状态,带走第二传感器。机器人50也可以将第二传感器放置在机器人50周边。
[0130]
(9)通过传感器进行的细胞或细胞块的品质分析
[0131]
使用在机器人50的末端执行器附近安装的第三传感器(例如还具有高倍率镜头的照相机、超声波传感器等)详细检查盒20内的细胞或细胞块的状态。使用第三传感器详细捕捉细胞或细胞块的状态,由此识别和判定细胞块是否维持了预定品质。
[0132]
(10)向观察站输送盒
[0133]
机器人50将盒20暂时(数十秒到数分钟这样的数量级的短时间)从驱动基座40分离,向能够通过显微镜执行观察的观察站(显微镜的测定台等)移动。也可以在观察站进行更详细的细胞或细胞块的状态测量。在显微镜观察结束后,机器人50将盒20返回到原来的驱动基座40的位置使两者结合。实际的显微镜观察在观察站中由其他装置进行。
[0134]
(11)向观察站输送细胞悬浮液样品
[0135]
或者,机器人50使用盒20的培养基侧排出塞31将细胞悬浮液样品取出到流体排出器,在保持盒20的封闭系统的状态下将流体排出器输送至能够通过显微镜执行观察的观察
站。在显微镜观察结束后,机器人50废弃流体排出器。实际的显微镜观察在显微镜观察站中由其他装置进行。或者,显微镜观察和其他检查作业可以在不同房间由人来执行。
[0136]
(12)流体排出器从盒的分离及冷冻
[0137]
在全部的细胞制造工序顺利结束后,向流体排出器注入细胞悬浮液,机器人50将流体排出器从盒20分离,将流体排出器输送至冷冻站。
[0138]
(13)驱动基座故障应对
[0139]
在驱动基座40产生了电动机等未正常驱动等故障时,将盒20从驱动基座取下,移动并安装到其他的可使用的驱动基座40。将该情况通知给上位计算机装置,通过与盒20新组合的驱动基座40适当地继续进行盒20内的细胞制造工序。
[0140]
(14)通过传感器确认盒状态
[0141]
在盒20内一系列的细胞制造工序结束时,使用第一传感器连续地测量盒20内的流路、贮液槽、培养侧板22等预定部位的状态。根据在各部位取得的信息,综合地识别以及判定这些部位是正常状态还是产生了某种异常。
[0142]
(15)通过传感器确认驱动基座的状态
[0143]
在盒20内一系列的细胞制造工序结束时,在通过机器人50将盒20取下后,使用第一传感器连续测量与盒20结合的驱动基座40内具有的电动机、电磁阀、传感器等的状态,或者连续测量驱动基座40周围的状态。根据在各部位取得的信息,综合地识别以及判定这些部位是正常状态还是产生了装置不良、从盒20侧漏液等某种异常。
[0144]
4.进行按需控制的计算机系统
[0145]
在细胞制造中制造物自身存在偏差,因此,在本例的计算机系统中,不进行按照固定流程的系统控制,预先准备多个由分割为小的功能单位的流程构成的程序模块,按需启动这些程序模块。程序模块大致有2种。1个是伴随有机器人50的动作的机器人用程序模块(以下,称为rpm),另1个是各个封闭系统细胞制造装置10中的流体机械的驱动、通过传感器(照相机、流量计、温度计等)进行的测量等不伴随机器人50的动作的封闭系统细胞制造装置用程序模块(以下,称为ipm)。
[0146]
图9表示rpm
‑
1的流程图。rpm
‑
1简单地概念性地表示实际的rpm,通过执行rpm
‑
1,实机的机器人50进行动作。rpm
‑
1是进行未必需要传感器的机器人动作的程序模块一例,例如存在以下处理。
[0147]
a)对于细胞制造区域搬入搬出材料
[0148]
b)对于驱动基座装卸盒
[0149]
c)对于盒装卸流体供给器或流体排出器
[0150]
d)向观察站输送盒
[0151]
e)向观察站输送细胞悬浮液样品
[0152]
f)流体排出器从盒的分离及冷冻
[0153]
g)驱动基座故障应对
[0154]
在rpm
‑
1中,例如进行以下处理。
[0155]
(步骤s1)在从上位程序调用了rpm
‑
1时,首先通过状态1发送来输出从上位程序调用了rpm
‑
1的意思。
[0156]
(步骤s2
‑
s5)执行机器人的动作a、动作b、动作c,通过状态2发送来输出这些动作
正常结束的意思。
[0157]
(步骤s6
‑
s7)通过预定传感器测量机器人相关的周边状态,通过状态3发送来输出测量结果。
[0158]
(步骤s8)从外部装置输入针对机器人的预定信号。
[0159]
(步骤s9)根据输入的信号内容进行条件判定,根据判定结果使程序执行的流程分支。
[0160]
(步骤s10
‑
s11)在程序执行流程为其中一方的情况下,执行机器人的动作d,接着通过状态4发送输出动作d正常结束的意思。
[0161]
(步骤s12
‑
s14)在程序执行流程为另一方的情况下,执行机器人的动作e、动作f,接着通过状态5发送输出这些动作e、f正常结束的意思。经过以上步骤,rpm
‑
1的处理完成。
[0162]
图10表示rpm
‑
2的流程图。rpm
‑
2简单地概念性地表示了实际的rpm,通过执行rpm
‑
2,实机的机器人50进行动作。rpm
‑
2是进行使用了传感器的机器人动作的程序模块,例如存在以下处理。
[0163]
h)通过传感器确认驱动基座的状态
[0164]
i)通过传感器确认驱动基座的动作
[0165]
j)通过传感器进行封闭系统细胞制造装置内的观察
[0166]
k)通过传感器确认盒状态
[0167]
在rpm
‑
2中,例如进行以下处理。
[0168]
(步骤s20)在从上位程序调用了rpm
‑
2时,首先通过状态6发送输出启动了rpm
‑
2的意思。
[0169]
(步骤s21)通过机器人动作g将传感器移动到培养侧板附近的预定位置。
[0170]
(步骤s22)执行传感器测量。
[0171]
(步骤s23)根据传感器取得的信息检测细胞,识别细胞或细胞块的个数、密度、尺寸、形状等。
[0172]
(步骤s24)通过状态7发送来输出与在全部步骤中识别出的培养侧板中的细胞相关的信息。另外,如后所述,为了实现可追溯性,将在此发送的信息记录在数据服务器等中。
[0173]
图11表示ipm
‑
3的流程图。ipm
‑
3简单地概念性地表示了实际的ipm,通过执行ipm
‑
3,实机的封闭系统细胞制造装置10(即,盒20与驱动基座40结合而成的装置)进行运转。ipm
‑
3是进行驱动基座等的驱动、基于传感器观察结果进行分支控制等的程序模块。
[0174]
在ipm
‑
3中,例如进行以下处理。
[0175]
(步骤s30)在从上位程序调用了ipm
‑
3时,首先通过状态8发送来输出启动了ipm
‑
3的意思。
[0176]
(步骤s31)接着,开始驱动泵a,使培养侧板背面侧的培养基循环。
[0177]
(步骤s32)通过状态9发送来输出驱动了泵a的意思。
[0178]
(步骤s33)接着,检查是否接收到状态7。状态7通过rpm
‑
2中的处理而发送,如上所述,为了实现可追溯性,将在此发送的信息记录在数据服务器等中,并且交给该ipm
‑
3。
[0179]
(步骤s34)判定在前一步骤中是否接收到状态7,如果未接收到,则再次执行步骤s33。如果接收到,则进入下一步骤。
[0180]
(步骤s35)根据接收到的状态7中包含的与培养侧板中的细胞有关的信息,判定是
否满足预定条件。所谓条件是指识别出的全部细胞的平均尺寸是否为预定值以上等。如果未满足条件,则再次执行步骤33。如果接收到,则进入下一步骤。
[0181]
(步骤s36)停止泵a。
[0182]
(步骤s37)开始驱动泵b,向下一工序输送培养侧板中的细胞悬浮液。
[0183]
(步骤s38)通过状态10发送来输出已开始驱动泵b的意思。
[0184]
通过使例示的多种程序模块联动,能够利用传感器观察封闭系统细胞制造装置内的细胞或细胞块的状态,根据观察结果来推进封闭系统细胞制造装置内的细胞制造工序。根据贮液槽的液量、贮液槽内的上清液量、培养侧板内的细胞或细胞块的个数、尺寸等是否达到预定值来判定封闭系统细胞制造装置中的细胞制造工序进行到哪个阶段。上述状态量由照相机等传感器测量,将测量结果反馈给上位计算机装置。由上位计算机装置根据该反馈的信息进行判断,由此启动适当的程序模块。
[0185]
另外,为了取得由机器人、封闭系统细胞制造装置等进行的处理的作业日志,在程序模块中预先编入了随处进行状态发送的步骤。即,进行某种信息传递。具体而言,该状态发送步骤可以是与外部装置之间的输入输出信号的交换、经由以太网(注册商标)通信、无线通信等向其他计算机的数据输出、或者向数据服务器、云系统的访问等。
[0186]
图12概念性地表示通过程序模块内的状态1发送~状态5发送的处理而输出的记录信息61。在图12中,以在纸面上打印了预定信息的样式进行了描述,但也可以是保存在数据服务器、云服务器中的电子数据。记录信息61可以是为了实现与特定的细胞制造相关的可追溯性而记录的其他各种信息的一部分,例如关于该细胞制造,通过记录信息61以后能够追踪执行了机器人动作e、机器人动作f而未执行机器人动作d。另外,也可以在这些信息中附带日期、时刻等信息。
[0187]
另外,记录信息61如此表示以怎样的内容和顺序进行了细胞制造工序,如果预先决定了sop,则通过将实际进行的工序的记录与sop进行比较,能够判断双方是否一致,在不一致时存在怎样的差异,还能够判断该差异是否在允许范围内。并且,也可以使用不同的多种传感器来单独进行这样的判断,由此消除判断的偏向。
[0188]
在本细胞制造系统中,并行控制大量的封闭系统细胞制造装置(例如100
×
4=400个),在各个封闭系统细胞制造装置中开始细胞制造工序的定时未必与其他封闭系统细胞制造装置相同,另外,在各个封闭系统细胞制造装置中细胞制造工序的推进速度存在差异,因此,各个封闭系统细胞制造装置中的细胞制造进展各异。在封闭系统细胞制造装置中,在细胞制造的中途工序中需要追加安装注射器、玻璃瓶、输液袋等材料,因此,例如可以在之前所示的ipm
‑
3等处理流程中包含请求所需材料的意思的状态发送步骤,在上位程序中接收该状态,启动通过往复输送器等供给所需部件的其他程序模块。由此,能够将各封闭系统细胞制造装置所需的材料适当地按需供给到该封闭系统细胞制造装置附近。换言之,实现了所需物品向所需场所的实时供给,即实现了所谓准时制(just in time)的系统控制。
[0189]
图13表示进行按需控制的计算机系统的一例。概略地说,计算机系统70具备:分别控制1至多台机器人的1至多个机器人控制装置71、控制多个封闭系统细胞制造装置的驱动的驱动控制装置72、照相机等各种传感器73、以及综合控制整个细胞制造系统的1台上位计算机装置74。机器人控制装置71、驱动控制装置72、传感器73以及上位计算机装置74通过有线或无线的网络相互可通信地连接。
[0190]
在上位计算机装置74上生成与n个封闭系统细胞制造装置(在此称为i板。i板#1、i板#2、
…
、i板#n)一一对应的n个封闭系统细胞制造装置用任务75。所谓任务是指例如在多任务os上启动的程序的进程、线程等。另外,还生成与实机的机器人(在此设为1台)对应的机器人用任务76。这些所有任务以时分方式并行执行。机器人用任务76根据封闭系统细胞制造装置用任务75的请求与多个封闭系统细胞制造装置用任务75多对一地进行通信。该通信通过进程间通信、线程间通信等来执行,在为在机器人控制装置71上执行机器人用任务76的计算机系统的情况下,通过以太网(注册商标)通信、无线通信等来执行上述通信。封闭系统细胞制造装置用任务75从预先准备的多种ipm77中启动1个ipm,并且请求机器人用任务76从预先准备的多种rpm78中启动1个rpm。
[0191]
图13a~图13c表示封闭系统细胞制造装置用任务75各自的流程图。任务分别为相同的结构。在封闭系统细胞制造装置用任务75中记载为[ipm
‑
*,c#*]的步骤中,调用并执行已叙述的ipm。但是,在调用ipm时,重要的是其处理是针对哪个封闭系统细胞制造装置的处理,指定为c#*。例如,c#1表示是针对i板#1的处理,c#n表示是针对i板#n的处理。通过该指定,各ipm对物理上不同的封闭系统细胞制造装置发挥作用,与之对应地,该封闭系统细胞制造装置进行运转。
[0192]
多个(1~n)封闭系统细胞制造装置用任务75并行地行进,因此根据时机有可能同时执行多个相同的ipm,例如ipm
‑
1。在这样的情况下,因为c#*的指定不同,所以会产生如下状况:通过从不同任务中调用的ipm
‑
1,物理上不同的封闭系统细胞制造装置分别运转。
[0193]
在封闭系统细胞制造装置用任务75中记载为[rpm
‑
*启动,c#*]的步骤中,并非调用机器人用程序模块,而是在执行该步骤的封闭系统细胞制造装置用任务75与机器人用任务76之间进行通信,向机器人用任务76请求启动rpm
‑
*。重要的是基于该请求的机器人动作以哪个封闭系统细胞制造装置为对象,指定为c#*。另外,对于该步骤仅进行启动请求,该封闭系统细胞制造装置用任务75中的处理流程向前进展。具体而言,若执行了[prm
‑
1,c#*]的步骤,则处理立即进入到下一个[ipm
‑
3,c#*]的步骤。
[0194]
多个(1~n)封闭系统细胞制造装置用任务75并行地行进,因此来自不同的封闭系统细胞制造装置用任务75的rpm
‑
*启动请求有可能多个请求重叠。但是,机器人用任务76以及实机的机器人为1个,因此无法同时实现这些启动请求,从早到晚按顺序来执行。该多个重叠的rpm
‑
*启动请求在一般的计算机系统中通过公知的被称为队列的处理,以先进先出(fifo)的方式进行管理。
[0195]
图15表示机器人用任务76的流程图。在机器人用任务76的一例中,如果接收到来自某个封闭系统细胞制造装置用任务进程的rpm
‑
*启动请求后,根据所指定的rpm
‑
*的编号和表示作为对象的封闭系统细胞制造装置的c#*的信息,调用并执行合适的rpm(在此设为存在1~m的m种)。由此,以指定的封闭系统细胞制造装置为对象开始机器人动作,从而进行预定作业。
[0196]
5.防备万一的污染的气流控制系统
[0197]
图16a~图16c表示细胞制造系统的运转区域80。希望经由传递箱或传递室向正在进行培养的封闭系统细胞制造装置或机器人的设置空间搬入搬出材料。由此,即使产生封闭系统破损等万一的污染,由于控制空气流动,因此也不会产生空气大量外泄的瞬间。
[0198]
以上图为一例,分为细胞制造系统的运转区域80、传递室81、除此以外的区域82,
通过能够隔断这些空间之间的空气流动的门进行分隔,在将材料等搬入到细胞制造系统的运转区域时,按照适当的顺序进行搬入。
[0199]
各区域可以如图16a所示进行各自的正压/负压的气压管理。或者,根据本公开,也可以具有在各区域不进行特别的气压管理的结构。只要如后面所述那样进行门a和门b的动作管理,就能够避免不必要的粉尘吹入细胞制造系统的运转区域的情况。
[0200]
在搬入材料等时,首先,如图16b所示,打开门a,暂时将材料等搬入到传递室81内。此时,可以通过鼓风等将附着于材料的粉尘吹走。或者,也可以进行酒精喷雾、uv照射、通过过氧化氢等进行消毒或灭菌。
[0201]
接着,如图16c所示,在关闭了门a后打开门b,将材料等搬入到细胞制造系统进行运转的区域。搬入后关闭门b,一系列的搬入顺序完成。在搬出使用完的材料时,只要使门的开闭顺序相反即可。细胞制造在封闭系统细胞制造装置内进行,因此,各区域间的空气的隔断性可以不是所谓的cpc(细胞处理中心)等那样严格的隔断性。
[0202]
万一维护作业员要进入细胞制造区域时,也经由传递室81。或者,向细胞制造区域搬入搬出材料的路径与维护作业员进出的路径可以经由不同的传递室、不同的路径。预想搬入搬出的材料的1次存放的体积会变得巨大,因此,也可以在传递室81内设置立体自动仓库。在资材等的存放量不大的情况下,不采用立体自动仓库那样的大型装置,而是通过机器人进行库存品的搬入和搬出管理。
[0203]
图17表示气流控制系统90的一例。本例的气流控制系统90适用于单元型的细胞制造系统。单元51具有形成为多边形、圆形等的壁状构造和打开的上侧开口,壁状构造在空间上分离为危险区域侧11和安全区域侧12。在单元51的内侧配置机器人50,机器人50使用向上方延伸的机械手等从单元51的上方将材料91输送到单元51内部。另外,在单元51的壁状构造上配置了多个封闭系统细胞制造装置(未图示)。气流控制系统90配备在危险区域侧11的空间中,进行使气流从单元51的上方向下方流动的向下流动控制。气流控制系统90具有配置在单元51的下方即排气侧的hepa等过滤器92、将过滤器92净化后的清洁空气排出到单元51外侧的排气风扇93。根据该气流控制系统90,能够得到以下优点。
[0204]
(1)虽然是不需要洁净室的通常管理区域,也能够防止在单元51内可能产生的万一的生物污染。
[0205]
(2)能够防止单元51内的温度不均及湿度不均,防止封闭系统细胞制造装置的温度上升及湿度上升。
[0206]
(3)将清洁空气排出到单元51外侧,因此还能够提高背景制造环境的清洁度。通过设定排气风量,还能够控制微粒浓度。
[0207]
气流控制系统90是为了防备封闭系统万一破损的系统结构,因此气流控制系统未必需要清洁度控制,而且也可以是不需要差压管理的一般空调。另外,需要注意的是,气流控制系统90如果在排气侧具有过滤器92以及排气风扇93,则也可以是向上流动控制。
[0208]
6.运用上的特征
[0209]
以下对运用上的特征进行说明。
[0210]6‑
1.可追溯性
[0211]
将细胞制造过程中的全部动作(启动的任务程序、程序模块内的处理流程的执行日志等)、传感器测量值等信息全部汇集并记录在上位计算机装置中。为了实现可追溯性,
包含上述信息在内将以下那样的信息关联起来存储在数据库中。
[0212]
(1)细胞制作者的个人信息(姓名、年龄、出生年月日、血型、国籍、住址)
[0213]
(2)个人的基因组信息
[0214]
(3)个人的家族结构
[0215]
(4)个人的病史、既往病症、过去/当前的治疗史
[0216]
(5)细胞制作用采血场所、日期时间、采血量
[0217]
(6)细胞制作过程中的全部日志(由机器人用程序模块输出的状态信息、由封闭系统细胞制造装置用程序模块输出的状态信息等)
[0218]
(7)将上述全部日志与预先准备的sop进行比较的结果以及结果是否合格的判定
[0219]
(8)制作出的细胞的检查结果
[0220]
(9)制作出的细胞的保管场所、保管预定期间
[0221]
(10)保管的细胞的利用履历
[0222]6‑
2.识别信息管理以及制造记录的方法
[0223]
id管理、制造记录可以采用以下几种方法。
[0224]
(1)主计算机实时地集中管理的方式
[0225]
(2)记录在各封闭系统细胞制造装置中嵌入的ic芯片中,之后汇集到管理服务器中的方式
[0226]
(3)对与细胞制造相关的全部材料预先分配固有id,这些id以2维条形码、3维条形码、ic芯片等形式粘贴在各材料上,在各封闭系统细胞制造装置中使用材料之前由照相机等传感器读取这些id,并传送给主计算机或上述ic芯片的方式
[0227]6‑
3.封闭系统制造装置的控制方法
[0228]
关于各封闭系统制造装置的控制,可以采用以下几种方法。
[0229]
(1)1台封闭系统制造装置中包含的多台泵、多个传感器由1个控制系统控制(封闭系统制造装置与控制系统为1对1)。
[0230]
(2)n台封闭系统制造装置中包含的泵、多个传感器由field系统(注册商标)那样的网络系统控制。
[0231]
上述实施方式中的软件可以记录在计算机可读取的非暂时性记录介质、cd
‑
rom等中来提供。在本说明书中对各种实施方式进行了说明,但本发明不限于上述各种实施方式,应当知道在保护范围所记载的范围内能够进行各种变更。
[0232]
附图标记说明
[0233]
1细胞制造系统
[0234]
10封闭系统细胞制造装置
[0235]
20盒
[0236]
21培养成分透过部件
[0237]
22培养侧板
[0238]
23培养基侧板
[0239]
24培养侧供给塞
[0240]
25培养侧排出塞
[0241]
26培养基保持层
[0242]
27培养基流路
[0243]
28培养基罐
[0244]
29流体机械
[0245]
30培养基侧供给塞
[0246]
31培养基侧排出塞
[0247]
32窗
[0248]
40驱动基座
[0249]
41驱动部
[0250]
42驱动保持部件
[0251]
43外部气体隔断部件
[0252]
50机器人
[0253]
51单元
[0254]
52材料输送机构
[0255]
53往复输送器
[0256]
54行驶轴轨道
[0257]
55滑块
[0258]
56开口
[0259]
57闸门
[0260]
60壁状构造
[0261]
61记录信息
[0262]
70计算机系统
[0263]
71机器人控制装置
[0264]
72驱动控制装置
[0265]
73传感器
[0266]
74上位计算机装置
[0267]
75封闭系统细胞制造装置用任务
[0268]
76机器人用任务
[0269]
77封闭系统细胞制造装置用程序模块
[0270]
78机器人用程序模块
[0271]
80细胞制造系统的运转区域
[0272]
81传递室
[0273]
82除此以外的区域
[0274]
90气流控制系统
[0275]
91材料
[0276]
92过滤器
[0277]
93排气风扇。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

