中和乙型肝炎病毒的抗体和其用途
1.关于序列表的声明
2.以文本格式代替纸本拷贝提供与本技术相关的序列表,并且在此以引用的方式并入本说明书中。含有序列表的文本文件的名称是930485_402wo_sequence_listing.txt。文本文件为109kb,创建于2019年12月16日,并且以电子方式通过efs
‑
web提交。
3.本公开涉及乙型肝炎病毒(hbv)和抗丁型肝炎病毒(hdv)的免疫疗法和其用途的领域。本文所描述的抗乙型肝炎结合蛋白,例如抗体和其抗原结合片段,能够结合位于hbv包膜蛋白(hbsag)的s结构域的抗原环区中的表位。在某些实施例中,抗乙型肝炎结合蛋白可结合任何或所有已知hbsag基因型,以及hbsag变体,并且可中和hbv感染。本文还提供编码此类结合蛋白的核酸和表达此类结合蛋白的宿主细胞。另外,本公开提供在疾病诊断、防治和治疗中以及筛选方法中使用本文所描述的抗体和抗体片段的方法。
4.作为背景,hbv由(i)含有三种相关表面蛋白(乙型肝炎表面抗原,hbsag)和脂质的包膜以及(ii)包封病毒dna基因组和dna聚合酶的二十面体核衣壳组成。hbv衣壳在rna前基因组复制复合物包装期间在受感染细胞的细胞溶质中形成,且在通过颗粒内腔中前基因组的逆转录进行病毒dna基因组合成期间获得出芽能力。三种hbv包膜蛋白s
‑
hbsag、m
‑
hbsag及l
‑
hbsag在内质网处形成复杂跨膜折叠,并且形成二硫键连接的同二聚体和异二聚体。在细胞内膜处出芽期间,胞质前s区中的短线性结构域与衣壳表面上的结合位点相互作用。病毒粒子随后分泌到血液中。另外,表面蛋白可在不存在衣壳的情况下出芽,并且形成亚病毒颗粒(svp),其相比于病毒粒子svp还以3
‑
4对数过量分泌。高水平hbsag可耗尽hbsag特异性t细胞反应,并且被提出作为患有慢性乙型肝炎(chb)的患者的病毒免疫耐受性的重要因子(chisari fv,isogawa m,wieland sf,《病理生物学(pathologie biologie)》,2010;58:258
‑
66)。
5.乙型肝炎病毒导致潜在危及生命的急性和慢性肝脏感染。急性乙型肝炎的特征在于伴有或不伴有症状的病毒血症,具有发生突发肝炎的风险(liang tj,block tm,mcmahon bj,ghany mg,urban s,guo jt,locarnini s,zoulim f,chang km,lok as.《乙型肝炎的当前和未来疗法:从发现到治愈(present and future therapies of hepatitis b:from discovery to cure)》.《肝病学(hepatology)》.2015年8月3日.doi:10.1002/hep.28025.[纸质版之前的电子版])。尽管1982年以来可获得针对乙型肝炎的有效疫苗,但who报道2亿4000万人慢性感染乙型肝炎,并且每年超过780,000人由于乙型肝炎并发症死亡。大致三分之一的慢性乙型肝炎(chb)患者罹患肝硬化、肝衰竭和肝细胞癌,造成每年600,000人死亡(liang tj,block tm,mcmahon bj,ghany mg,urban s,guo jt,locarnini s,zoulim f,chang km,lok as.《乙型肝炎的当前和未来疗法:从发现到治愈》.《肝病学》.2015年8月3日.doi:10.1002/hep.28025.[纸质版之前的电子版])。
[0006]
对于感染hbv的患者,可能由于共同感染或双重感染hdv而出现严重并发症。根据who,丁型肝炎感染全世界约1500万人。hdv被视为亚病毒卫星,因为其仅可在hbv存在下传播。hdv为已知的最小动物病毒之一(40nm),其中其基因组仅1.6kb且编码s和l hdag。hdv基因组复制所需的所有其它蛋白质(包括rna聚合酶)由宿主细胞提供,并且hdv包膜由hbv提
供。当引入到受纳细胞中时,hdv rna基因组复制并且与hdv编码的蛋白质的多个拷贝缔合,以组装核糖核蛋白(rnp)复合物。rnp由hbv包膜蛋白从细胞中导出,hbv包膜蛋白能够组装脂蛋白囊泡,囊泡在分泌之前出芽到前高尔基体隔室的内腔中。此外,hbv包膜蛋白还提供将hdv靶向到未感染细胞的机制,从而确保hdv传播。
[0007]
由hdv引起的并发症包括在急性感染中发生肝衰竭和迅速发展为肝硬化的更大的可能性,在慢性感染中罹患肝癌的机会增加。与乙型肝炎病毒组合的丁型肝炎在所有肝炎感染中具有最高的死亡率,为20%(fattovich g,giustina g,christensen e,pantalena m,zagni i,realdi g,schalm sw.《丁型肝炎病毒感染对b型代偿性肝硬化的发病率和死亡率的影响(influence of hepatitis delta virus infection on morbidity and mortality in compensated cirrhosis type b)》.《消化道(gut)》.2000年3月;46(3):420
‑
6)。慢性hdv感染的唯一批准的疗法为干扰素
‑
α。然而,用干扰素
‑
α治疗hdv相对低效且耐受不良。用干扰素
‑
α治疗导致四分之一的患者在治疗后六个月具有持续病毒反应。此外,核苷(酸)类似物(na)已在丁型肝炎中进行广泛测试,但其似乎无效。使用na与干扰素的组合治疗也被证明是令人失望的(zaigham abbas,minaam abbas《丁型肝炎的管理:需要新颖治疗选项(management of hepatitis delta:need for novel therapeutic options)》.《世界胃肠病学杂志(world j gastroenterol)》2015年8月28日;21(32):9461
‑
9465)。因此,需要新治疗选项。
[0008]
附图简要说明
[0009]
本文提供的附图旨在更详细地说明本公开中包括的主题。附图并不旨在以任何方式限制本公开。
[0010]
图1显示如在直接基于抗原的elisa分析中所测定,hbc34
‑
v7和本公开的两种工程化抗体(“hbc34
‑
v34”;“hbc34
‑
v35”)在指定浓度下与hbsag adw(上图)和hbsag adr(下图)的结合。所有抗体以igg1(g1m17,1同种异型)形式产生。
[0011]
图2a
‑
2k显示hbc34
‑
v7、hbc34
‑
v34和hbc34
‑
v35与所有已知hbsag基因型(分别为(a)
‑
(j))和与模拟对照(k)的结合。使用表示hbsag抗原外环的基因型代表性序列,如pct公开号wo 2017/060504的实施例5中所示。通过facs进行染色。抗体浓度如图的x轴上所指示。
[0012]
图3a
‑
3v显示某些hbc抗体在体外与hbsag的结合(3a
‑
3r)和对hbsag的中和(3s
‑
3v)。图3a和3b显示在直接基于抗原的elisa分析中具有野生型或变体fc区的hbc34
‑
v7和hbc34
‑
v35与hbsag adw的结合(2个实验;来自“实验1”的数据在图3a中显示,并且来自“实验2”的数据在图3b中显示)。抗原结合曲线在每个图的上图中显示。ec
50
值(通过使用graphpad prism拟合曲线确定)在每个图的中图中显示。与未包被的板(对照)的结合在每个图的下图中显示。fc区:“hbc34v7”和“hbc34
‑
v35”=野生型fc;“hbc34
‑
v35
‑
mlns”=具有m428l/n434s的fc。“hbc34
‑
v35
‑
mlns
‑
gaalie”=具有m428l/n434s/g236a/a330l/i332e的fc。测试三批hbc34
‑
v35。测试两批hbc34
‑
v35
‑
mlns和两批hbc34
‑
v35
‑
mlns
‑
gaalie。使用一批hbc34
‑
v7。图3c
‑
3h显示hbc34
‑
v35、hbc34
‑
v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie与表达来自所有十种已知hbv基因型的hbsag或模拟对照的expi293细胞的结合。通过流式细胞术测定结合。数据表示为经转染群体的平均荧光强度(y轴),经转染群体如通过设门排除用经模拟转染的细胞获得的信号来限定。对于每种hbsag,测试三种测试品的连续稀释液(12点,1比3稀释,从10μg/ml开始)。图3i
‑
3r显示hbc34
‑
v35、hbc34
‑
v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie与表达来自十九(19)种hbsag变体的hbsag或模拟对照的expi293细胞的结合。通过流式细胞术测定结合。数据表示为经转染群体的平均荧光强度,经转染群体如通过设门排除用经模拟转染的细胞获得的信号来限定。对于每种hbsag,测试三种测试品的连续稀释液(12点,1比3稀释,从10μg/ml开始)。抗体浓度如x轴上所显示。图3s和3u显示如通过测量表达ntcp的感染hbvd的hepg2细胞的细胞培养上清液中的hbsag(顶部)和hbeag(底部)的水平来评定,指定hbc抗体针对hbv基因型d的中和能力。数据表示来自两次独立实验之一的平均值
±
sd。图3t和3v显示ec
50
值。ec
50
值的几何平均值和范围(括号中)由两次独立实验确定。
[0013]
图4显示使用hdv假型化系统的个别hbv基因型由hbc34
‑
v35
‑
mlns
‑
gaalie进行的中和(ec50值)。
[0014]
图5
‑
8显示hbc34
‑
v35对hbv感染体内小鼠模型中的血清hbag水平的影响。感染hbv基因型c的scid小鼠用原代人肝细胞移植,并且以1、5或15mg/kg施用hbc34
‑
v35或施用pbs(对照),如实施例5中所描述。图5显示处理之前和之后的血清hbv dna浓度。图6显示处理之前和之后的血清hbsag浓度。图7显示处理之前和之后的血清hbeag浓度。图8显示处理之前和之后的血清hbcrag浓度。“tmt”=处理。
[0015]
图9a
‑
9f显示hbc34
‑
v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie与人fcr的结合。(a)
‑
(e)与fcγr的结合,其通过生物层干涉测量法(bli)评定。加his标签的人fcγr((a)fcγriia等位基因h131;(b)fcγriia等位基因r131;(c)fcγriiia等位基因f158;(d)fcγriiia等位基因v158;(e)fcγriib)以2μg/ml捕获到抗六价his(anti
‑
penta
‑
his)传感器上6分钟。然后,在1μg/ml affinipure f(ab')2片段山羊抗人igg,f(ab')2片段特异性(以通过fab片段交联人mab)存在下,使装载fcγr的传感器暴露于含有2μg/ml每种mab的动力学缓冲液溶液(ph 7.1)5分钟(曲线左侧部分),接着在相同缓冲液中再进行解离步骤4分钟(曲线右侧部分)。使用red96(fort
é
bio)按干涉图案的变化实时测量缔合和解离概况。(f)如使用生物层干涉测量法(bli)所测定,在不同ph下hbc34抗体与fcrn的体外结合。时间点0秒表示从基线缓冲液切换到含有抗体的缓冲液。时间点300秒(竖直虚线)表示在对应ph下切换到空白缓冲液。曲线指示干涉图案的变化的缔合和解离概况。
[0016]
图10显示如通过所测量的,hbc34
‑
v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie与人c1q的结合。抗人fab(ch1)传感器用于通过fab片段以10μg/ml捕获hbc34v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie mab的完整igg1 10分钟。然后使装载igg的传感器暴露于含有3μg/ml纯化人c1q的动力学缓冲溶液(ph 7.1)4分钟(曲线左侧部分),接着在相同缓冲液中再进行解离步骤4分钟(曲线右侧部分)。使用red96(fort
é
bio)按干涉图案的变化实时测量缔合和解离概况。
[0017]
图11a和11b显示在工程化jurkat细胞中使用nfat介导的荧光素酶报告基因的受体连接激活进行的人fcγriiia的体外激活。fcγriiia激活使用经验证的市售生物报告基因分析进行测试,其中重组hbsag(安在时(engerix b))用作靶抗原。将hbc34
‑
v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie以及对照(ctr)mab的连续稀释液与0.2μg/ml hbsag一起在37℃下培育25min。将表达fcγriiia低亲和力等位基因f158(a)或fcγriiia高亲和力等位基因v158(b)的jurkat效应细胞(普洛麦格(promega))再悬浮于分析缓冲液中且随后添加到分析板中。在37℃下培育24小时之后,添加bio
‑
glo
‑
tm
荧光素酶分析试剂(普洛麦格),并且使用光度计(伯腾(bio
‑
tek))定量发光。
[0018]
图12a和12b显示在工程化jurkat细胞中使用nfat介导的荧光素酶报告基因的受体连接激活进行的人fcγriia的体外激活。人fcγriia的激活使用经验证的市售生物报告基因分析来确定,其中重组hbsag(安在时)用作靶抗原。将hbc34v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie以及对照(ctr)mab的连续稀释液与2μg/ml(a)或0.2μg/ml(b)hbsag一起在37℃下培育25min。将表达fcγriia高亲和力等位基因h131的jurkat效应细胞(普洛麦格)再悬浮于分析缓冲液中且随后添加到分析板中。在37℃下培育23小时之后,添加bio
‑
glo
‑
tm
荧光素酶分析试剂(普洛麦格),并且使用光度计(伯腾)定量发光。
[0019]
图13a
‑
13b显示在工程化jurkat细胞中使用nfat介导的荧光素酶报告基因的受体连接激活进行的人fcγriib的体外激活。人fcγriib的激活使用经验证的市售生物报告基因分析进行测试,其中重组hbsag(安在时)用作靶抗原。将hbc34
‑
v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie以及对照mab(ctr)的连续稀释液与1μg/ml hbsag一起在37℃下培育15min。将表达fcγriib的jurkat效应细胞(普洛麦格)再悬浮于分析缓冲液中且随后添加到分析板中。在37℃下培育20小时之后,添加bio
‑
glo
‑
tm
荧光素酶分析试剂(普洛麦格),并且使用光度计(伯腾)定量发光。在图13b中,来自图13a的对照mab命名为“ctr mab1”。命名为“ctr mab2”的第二对照mab是hbc34
‑
v35的一种形式,包括具有增强与fcγriib的结合的以下突变的igg1 fc:g237d/p238d/h268d/p271g/a330r(mimoto等人,《蛋白质工程设计与选择(prot eng des sel)》.26(10):589
‑
598(2013))。
[0020]
图14a和14b显示在hbc34
‑
v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie存在下,人原代nk细胞对plc/prf/5人肝癌细胞的体外杀伤。(a)使用从先前针对表达杂合高(v158)和低(f158)亲和力fcγriiia(f/v)基因分型的一个供体新鲜分离的nk细胞测试adcc。将hbc34
‑
v35、hbc34
‑
v35
‑
mlns、hbc34
‑
v35
‑
mlns
‑
gaalie、抗hbv mab17.1.41和对照mab的连续稀释液添加到分泌hbsag的肝癌细胞系plc/prf/5(也称为亚历山大细胞(alexander cell))中。将plc/prf/5细胞与抗体一起在室温下培育10min。将nk细胞添加到分析板中(效应细胞与靶细胞的比为10:1),并且在37℃下培育4小时。通过测量乳酸脱氢酶(ldh)释放确定细胞死亡。(b)如通过流式细胞术评定,通过hbc34
‑
v35和17.1.41mab进行的plc/prf/5人肝癌细胞染色。将细胞充分洗涤,用甲醛(4%)固定或固定且透化(皂苷0.5%),随后用不同浓度的hbc34
‑
v35和17.1.41mab进行染色。使用alexa647affinipure f(ab')2片段山羊抗人igg,fcγ片段特异性抗体,通过流式细胞术检测这些人(在hbc34
‑
v35情况下,工程化人)mab的结合。
[0021]
图15a和15b显示在hbc34
‑
v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie以及hbsag存在下,原代人nk细胞的体外激活。使用先前针对表达(a)纯合高(v158)或(b)低(f158)亲和力fcγriiia基因分型的两个供体新鲜分离的细胞测试nk细胞的激活。将hbc34
‑
v35、hbc34
‑
v35
‑
mlns
‑
gaalie和hbc34v35
‑
lala mab的连续稀释液与nk细胞一起培育4小时。通过用抗cd107a mab作为鉴别nk细胞活性的功能标志物染色nk细胞,通过流式细胞术测量nk细胞的激活。cd107a也称为lamp
‑
1,是nk细胞脱颗粒的标志物。
[0022]
图16显示hbc34
‑
v35
‑
mlns
‑
gaalie与聚合酶/逆转录酶抑制剂恩替卡韦(entecavir,etv)之间的体外药物相互作用研究的结果。
具体实施方式
[0023]
除非另外定义,否则本文中所用的所有技术和科学术语都具有与所属领域的一般技术人员通常所理解相同的含义。
[0024]
贯穿本公开,除非上下文另外要求,否则术语“包含(comprise)”和其变化形式,如“包含(comprises)”和“包含(comprising)”与例如“具有(having)”、“具有(has)”、“包括(including)”、“包括(includes)”等同义使用,并且将理解为暗示包括所述成员、比率、整数(在适当时包括其分数;例如整数的十分之一和百分之一)、浓度或步骤,但不排除任何其它非所述成员、比率、整数、浓度或步骤。除非另外指示,否则任何浓度范围、百分比范围、比率范围或整数范围应理解为包括所述范围内的任何整数值并且适当时包括其分数(如整数的十分之一和百分之一)。而且,除非另外指示,否则本文所列举的关于任何物理特征如聚合物亚单元、尺寸或厚度等的任何数字范围应被理解为包括所列举范围内的任何整数。术语“由
……
组成”是指术语“包含”的一个实施例,其中排除任何其它非所述成员、整数或步骤。在本公开的上下文中,术语“包含”涵盖术语“由
……
组成”。术语“基本上由
……
组成”不等效于“包含”,并且是指权利要求的指定材料或步骤,或指不实质上影响所要求的主题的基本特征的材料或步骤。
[0025]
另外,应理解,源自本文所描述的结构和取代基的各种组合的个别化合物或化合物的组由本技术公开,其程度如同每种化合物或化合物的组分别地阐述一般。因此,特定结构或特定取代基的选择在本公开的范围内。
[0026]
除非本文另外指示或明显与上下文相矛盾,否则在描述本公开的上下文中(包括在权利要求书的上下文中)使用术语“一(a/an)”和“所述(the)”以及类似指示物应理解为涵盖单数和复数两者。替代方案(例如“或”)的使用应理解为意指替代方案中的一者、两者或其任何组合。本文中值范围的叙述旨在充当个别地提及处于所述范围内的每个单独值的简写方法。除非本文另外指示,否则每个个别值并入到本公开中,如同其在本文中个别地列举一般。本说明书中的任何语言都不应理解为指示任何未要求的要素对于实践本文所公开的主题是必需的。
[0027]
词语“基本上”不排除“完全”;例如“基本上不含”y的组合物可以完全不含y。在某些实施方式中,“基本上”是指相比于参考组合物、方法或用途,本公开的组合物、方法或用途的给定量、效果或活性,并且描述所述量、效果或活性的减少不超过参考组合物、方法或用途的量、效果或活性的50%,如不超过40%、30%、25%、20%、15%、10%、5%或1%或更小。
[0028]
如本文所用,除非另外指示,否则术语“约”意指指定范围、值或结构的
±
20%。
[0029]“任选”或“任选地”意指随后所述的要素、组分、事件或情形可发生或可不发生,且所述描述包括其中所述要素、组分、事件或情形发生的情况以及其中所述要素、组分、事件或情形不发生的情况。
[0030]
如本文所用,术语“疾病”旨在与术语“病症”和“病状”(如医学病状)通常同义,并且可互换地使用,因为它们均反映出人体或动物体的异常情况或其部分中的损害正常功能的一部分的异常情况,通常表现为明显的体征和症状,并且导致患病人或动物的生命持续时间缩短或生活质量降低。
[0031]
如本文所用,提及“治疗”受试者或患者旨在包括预防、防治、减弱、改善及疗法。治
疗的益处包括临床结果改善;与疾病相关的症状减轻或缓解;症状发生率较低;生活质量提高;较长的无疾病状态;疾病程度减弱;疾病状态稳定化;疾病进展延迟;缓解;存活;存活延长;或其任何组合。术语“受试者”或“患者”在本文中可互换使用以意指所有哺乳动物,包括人。受试者的实例包括人、牛、狗、猫、马、山羊、绵羊、猪和兔。在一个实施方式中,患者是人。
[0032]
如本文所用,“氨基酸”是指天然存在或合成的氨基酸,以及以与天然存在的氨基酸类似的方式起作用的氨基酸类似物和氨基酸模拟物。天然存在的氨基酸是由遗传密码编码的氨基酸,以及后来被修饰的那些氨基酸,例如羟基脯氨酸、γ
‑
羧基谷氨酸以及o
‑
磷酸丝氨酸。氨基酸类似物是指具有与天然存在的氨基酸相同的基本化学结构(即,与氢、羧基、氨基以及r基团结合的α碳)的化合物,例如高丝氨酸、正亮氨酸、蛋氨酸亚砜、蛋氨酸甲基锍。此类类似物具有修饰的r基(例如正亮氨酸)或修饰的肽主链,但保留了与天然存在的氨基酸相同的基本化学结构。氨基酸模拟物是指具有与氨基酸的一般化学结构不同的结构但以与天然存在的氨基酸类似的方式起作用的化合物。
[0033]
如本文所用,术语“肽”、“多肽”和“蛋白质”以及这些术语的变化形式是指包含由(普通或修饰的)肽键彼此接合的至少两个氨基酸的分子。举例来说,肽、多肽或蛋白质可包含多个氨基酸或由其构成,所述氨基酸选自遗传密码所定义的20种氨基酸或氨基酸类似物或模拟物,各自由肽键与至少一个其它氨基酸连接。肽、多肽或蛋白质可包含l
‑
氨基酸和/或d
‑
氨基酸(或其类似物或模拟物)或由其构成。术语“肽”、“多肽”、“蛋白质”还包括“肽模拟物”,其被定义为含有非肽结构元件的肽类似物,所述肽能够模拟或拮抗天然亲本肽的生物作用。在某些实施方式中,肽模拟物缺少如易酶促切割的肽键的特征。
[0034]
除遗传密码所定义的20种氨基酸之外,肽、多肽或蛋白质可包含除这些氨基酸外的氨基酸,或其可由除遗传密码所定义的20种氨基酸外的氨基酸构成。在某些实施方式中,本公开的上下文中的肽、多肽或蛋白质可包含由自然过程(如翻译后成熟过程)或由化学过程(例如合成过程)修饰的氨基酸,所述过程在所属领域中已知并且包括本文所描述的过程。此类修饰可出现在多肽中的任何位置;例如在肽骨架中;在氨基酸链中;或在羧基或氨基末端处。肽或多肽可以是支链的,如在泛素化之后,或可以是有或没有分支的环状。术语“肽”、“多肽”和“蛋白质”还包括修饰的肽、多肽和蛋白质。举例来说,肽、多肽或蛋白质修饰可包括乙酰化、酰化、adp
‑
核糖基化、酰胺化、核苷酸或核苷酸衍生物的共价固定、脂质或脂质衍生物的共价固定、磷脂酰肌醇的共价固定、共价或非共价交联、环化、二硫键形成、脱甲基化、包括聚乙二醇化的糖基化、羟基化、碘化、甲基化、豆蔻酰化、氧化、蛋白水解过程、磷酸化、异戊烯化、外消旋化、硒酰化、硫酸化、氨基酸添加(如精氨酰化),或泛素化。此类修饰已在文献中描述(参见《蛋白质结构和分子特性(proteins structure and molecular properties)》(1993)第2版,t.e.creighton,纽约(new york);《蛋白质的翻译后共价修饰(post
‑
translational covalent modifications of proteins)》(1983)b.c.johnson编,学术出版社(academic press),纽约;seifter等人(1990)《蛋白质修饰和非蛋白质辅因子的分析(analysis for protein modifications and nonprotein cofactors)》,《酶学方法(meth.enzymol.)》182:626
‑
646和rattan等人,(1992)《蛋白质合成:翻译后修饰和老化(protein synthesis:post
‑
translational modifications and aging)》,《纽约科学院年鉴(ann ny acad sci)》,663:48
‑
62)。因此,术语“肽”、“多肽”、“蛋白质”可包括例如脂肽、脂蛋白、糖肽、糖蛋白等。还考虑了本公开的蛋白质、肽和多肽的变体。在某些实施方式中,
变体蛋白质、肽和多肽包含与如本文所描述的定义或参考氨基酸序列的氨基酸序列具有至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或99.9%同一性的氨基酸序列或由其组成。
[0035]
如本文所用,“(多)肽”和“蛋白质”在关于氨基酸残基的聚合物可互换使用,例如由肽键连接的多个氨基酸单体。
[0036]“核酸分子”或“多核苷酸”或“核酸”是指包括共价连接的核苷酸的聚合化合物,其可由天然子单元(例如嘌呤或嘧啶碱基)或非天然子单元(例如吗啉环)构成。嘌呤碱基包括腺嘌呤、鸟嘌呤、次黄嘌呤和黄嘌呤,并且嘧啶碱基包括尿嘧啶、胸腺嘧啶和胞嘧啶。核酸单体可通过磷酸二酯键或此类键的类似物连接。磷酸二酯键的类似物包含硫代磷酸酯、二硫代磷酸酯、硒代磷酸酯、二硒代磷酸酯、苯胺硫代磷酸酯、苯胺磷酸酯、氨基磷酸酯等。
[0037]
核酸分子包括聚核糖核酸(rna)、聚脱氧核糖核酸(dna),dna包括cdna、基因组dna和合成dna,其中的任一个可以是单链或双链的。如果是单链的,则核酸分子可以是编码链或非编码(反义链)。多核苷酸(包括寡核苷酸)和其片段可例如通过聚合酶链反应(pcr)或通过体外翻译产生,或通过连接、断裂、核酸内切酶作用或核酸外切酶作用中的任一者产生。
[0038]
编码氨基酸序列的核酸分子包括编码相同氨基酸序列的所有核苷酸序列。核苷酸序列的一些形式还可包括内含子,其程度使得内含子可通过共转录或转录后机制去除。由于遗传密码的冗余或简并,或通过剪接,或两者,不同核苷酸序列可编码相同氨基酸序列。
[0039]
还考虑了本公开的核酸分子的变体。变体核酸分子与如本文所描述的定义或参考多核苷酸的核酸分子具有至少70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或99.9%同一性,或在约65
‑
68℃下0.015m氯化钠、0.0015m柠檬酸钠或在约42℃下0.015m氯化钠、0.0015m柠檬酸钠和50%甲酰胺的严格杂交条件下与多核苷酸杂交。核酸分子变体保留编码融合蛋白或其结合结构域的能力,所述融合蛋白或其结合结构域具有本文所描述的功能,如特异性结合靶分子。
[0040]
如本文所用,术语“序列变体”是指与参考序列相比具有一个或多个改变的任何序列,其中参考序列是任何公开序列和/或“序列和seq id编号表”(序列表)中列出的序列,即seq id no:1到seq id no:139。因此,术语“序列变体”包括核苷酸序列变体和氨基酸序列变体。在某些实施方式中,在核苷酸序列的上下文中的序列变体,参考序列也是核苷酸序列,而在氨基酸序列的上下文中的序列变体的某些实施方式中,参考序列也是氨基酸序列。如本文所用,“序列变体”可与参考序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性。
[0041]“序列同一性百分比”是指如通过比较序列所确定的两个或更多个序列之间的关系。确定序列同一性的方法可设计成给出所比较序列之间的最佳匹配。举例来说,可出于最优比较目的比对序列(例如可在第一和第二氨基酸或核酸序列中的一个或两个中引入空位以进行最优比对)。此外,出于比较目的,可忽略非同源序列。除非另外指示,否则本文所提及的序列同一性百分比在参考序列的长度上计算。在公开可用的计算机程序中可以发现用于确定序列同一性和相似性的方法。序列比对和同一性百分比计算可使用blast程序(例如blast 2.0、blastp、blastn或blastx)进行。blast程序中所用的数学算法可见于altschul等人,《核酸研究(nucleic acids res)》.25:3389
‑
3402,1997中。在本公开的上下文内,应
理解如果使用序列分析软件进行分析,那么分析结果是基于所提及的程序的“默认值”。“默认值”意味着软件初次初始化时最初加载的值或参数的任何集合。
[0042]
在核酸(核苷酸)序列的上下文中的“序列变体”具有改变的序列,其中参考序列中的一个或多个核苷酸经缺失或取代,或一个或多个核苷酸插入到参考核苷酸序列的序列中。核苷酸在本文中通过标准单字母名称(a、c、g或t)提及。归因于遗传密码的简并,核苷酸序列的“序列变体”可引起或不引起相应参考氨基酸序列中的变化,即产生或不产生氨基酸“序列变体”。在某些实施方式中,核苷酸序列变体不产生氨基酸序列变体(例如沉默突变)。在一些实施方式中,考虑了引起一个或多个“非沉默”突变的核苷酸序列变体。在一些实施方式中,本公开的核苷酸序列变体编码与参考氨基酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的氨基酸序列。如本文所公开的核苷酸和氨基序列还指参考或野生型核苷酸或氨基酸序列的密码子优化形式。在本文中所描述的任何实施方式中,本公开的多核苷酸可针对含有多核苷酸的宿主细胞进行密码子优化(参见例如scholten等人,《临床免疫学(clin.immunol.)》119:135
‑
145(2006)。密码子优化可使用已知技术和工具,例如使用optimumgene
tm
工具,或geneart基因合成工具(赛默飞世尔科技(thermo fisher scientific))进行。密码子优化序列包括部分密码子优化的序列(即至少一个密码子经密码子优化以在宿主细胞中表达)和完全密码子优化的序列。
[0043]
在氨基酸序列的上下文中的“序列变体”具有改变的序列,其中与参考氨基酸序列相比,一个或多个氨基酸经缺失、取代或插入。作为改变的结果,此种序列变体具有与参考氨基酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的氨基酸序列。举例来说,参考序列的每100个氨基酸,具有不超过10个改变,即缺失、插入或取代的任何组合的变体序列与参考序列具有“至少90%同一性”。
[0044]“保守取代”是指不显著影响或改变特定蛋白质的结合特征的氨基酸取代。一般而言,保守取代是其中取代的氨基酸残基被具有相似侧链的氨基酸残基置换的取代。保守取代包括见于以下组中的一个中的取代:第1组:丙氨酸(ala或a)、甘氨酸(gly或g)、丝氨酸(ser或s)、苏氨酸(thr或t);第2组:天冬氨酸(asp或d)、谷氨酸(glu或z);第3组:天冬酰胺(asn或n)、谷氨酰胺(gln或q);第4组:精氨酸(arg或r)、赖氨酸(lys或k)、组氨酸(his或h);第5组:异亮氨酸(ile或i)、亮氨酸(leu或l)、蛋氨酸(met或m)、缬氨酸(val或v);和第6组:苯丙氨酸(phe或f)、酪氨酸(tyr或y)、色氨酸(trp或w)。另外地或可替代地,氨基酸可以根据类似功能、化学结构或组成(例如酸性、碱性、脂肪族、芳香族或含硫)分成保守取代组。举例来说,为了取代,脂肪族分组可包括gly、ala、val、leu和ile。其它保守取代组包括:含硫:met和半胱氨酸(cys或c);酸性:asp、glu、asn和gln;小的脂肪族非极性或微极性残基:ala、ser、thr、pro和gly;极性带负电残基和其酰胺:asp、asn、glu和gln;极性带正电残基:his、arg和lys;大的脂肪族非极性残基:met、leu、ile、val和cys;以及大的芳香族残基:phe、tyr和trp。额外信息可见于creighton(1984)《蛋白质(proteins)》,w.h.弗里曼公司(w.h.freeman and company)。
[0045]
氨基酸序列插入可包括长度范围为一个残基到含有一百个或更多个残基的多肽的氨基和/或羧基端融合,以及序列内部插入单个或多个氨基酸残基。末端插入的实例包括
将氨基酸序列的n或c端与报告分子或酶融合。
[0046]
一般来说,序列变体的改变不消除或显著降低相应参考序列的所需功能性。举例来说,优选的是,与具有参考序列(或由参考序列编码)的抗体或抗原结合片段相比,本公开的变体序列不显著减少或完全消除抗体或其抗原结合片段的序列结合相同表位和/或充分中和hbv和hdv感染的功能。可通过使用例如已知计算机程序发现确定哪些核苷酸和氨基酸残基分别可经取代、插入或缺失而不消除所需结构或功能的指导。
[0047]
如本文所用,“源自”指定核酸、肽、多肽或蛋白质的核酸序列或氨基酸序列是指核酸、肽、多肽或蛋白质的来源。源自特定序列的核酸序列或氨基酸序列可具有与产生其的序列或其一部分基本上相同的氨基酸序列,其中“基本上相同”包括如上文所定义的序列变体。源自特定肽或蛋白质的核酸序列或氨基酸序列可源自特定肽或蛋白质中的对应结构域。在此上下文中,“对应”是指具有相同所关注功能或特征。举例来说,“细胞外结构域”对应于(另一蛋白质的)另一“细胞外结构域”,或“跨膜结构域”对应于(另一蛋白质的)另一“跨膜结构域”。因此,所属领域的普通技术人员可容易地鉴别肽、蛋白质和核酸的“对应”部分。同样地,“源自”另一(例如“源”)序列的序列可由所属领域的普通技术人员鉴别为在源序列中具有其来源。
[0048]
源自另一核酸、肽、多肽或蛋白质的核酸序列或氨基酸序列可与(产生其的)起始核酸、肽、多肽或蛋白质相同。然而,源自另一核酸、肽、多肽或蛋白质的核酸序列或氨基酸序列还可相对于(产生其的)起始核酸、肽、多肽或蛋白质具有一个或多个突变,特别地源自另一核酸、肽、多肽或蛋白质的核酸序列或氨基酸序列可为(产生其的)起始核酸、肽、多肽或蛋白质的如上文所描述的功能序列变体。举例来说,在肽/蛋白质中,一个或多个氨基酸残基可被其它氨基酸残基取代,或可发生一个或多个氨基酸残基插入或缺失。
[0049]
如本文所用,术语“突变”涉及核酸序列和/或氨基酸序列与参考序列,例如对应基因组、野生型或参考序列相比的变化。突变(例如与参考基因组序列相比)可以是例如(天然存在的)体细胞突变、自发突变、诱导突变(例如由酶、化学品或辐射诱导的)或通过定点诱变(用于在核酸序列和/或氨基酸序列中进行特定和有意变化的分子生物学方法)获得的突变。因此,术语“突变(mutation/mutating)”应理解为还包括物理产生或诱导突变,例如在核酸序列中或在氨基酸序列中。突变包括一个或多个核苷酸或氨基酸的取代、缺失和插入以及若干连续核苷酸或氨基酸的倒位。为了实现氨基酸序列中的突变,可将突变引入到编码所述氨基酸序列的核苷酸序列中以便表达(重组)突变多肽。可例如通过改变(例如通过定点诱变)编码一个氨基酸的核酸分子的密码子(例如通过改变其中一个、两个或三个核苷酸碱基),以提供编码不同氨基酸或编码相同氨基酸的密码子,或通过合成序列变体来实现突变。
[0050]
在向细胞插入核酸分子的上下文中,术语“引入”意思是“转染”或“转化”或“转导”并且包括提及向真核或原核细胞并入核酸分子,其中所述核酸分子可并入到细胞的基因组(例如染色体、质粒、质体或线粒体dna)中,转化成自发复制子,或瞬时表达(例如经转染mrna)。
[0051]
如本文所用,术语“重组”(例如重组抗体、重组蛋白、重组核酸等)是指通过重组方式制备、表达、产生或分离且并非天然存在的任何分子(抗体、蛋白质、核酸等)。“重组”可与“工程化”或“非天然”同义使用,并且可以指包括至少一种遗传改变或已通过引入外源核酸
分子修饰的生物体、微生物、细胞、核酸分子或载体,其中此类改变或修饰通过基因工程(即人为干预)引入。遗传改变包括例如引入编码蛋白质、融合蛋白或酶的可表达的核酸分子的修饰,或其它核酸分子添加、缺失、取代或细胞的遗传物质的其它功能破坏。其它修饰包括例如非编码调节区,其中修饰改变多核苷酸、基因或操纵子的表达。
[0052]
如本文所用,“异源”或“非内源”或“外源”是指非宿主细胞或受试者原生的任何基因、蛋白质、化合物、核酸分子或活性,或已改变的宿主细胞或受试者原生的任何基因、蛋白质、化合物、核酸分子或活性。异源、非内源或外源包括基因、蛋白质、化合物或核酸分子,其已突变或以其它方式改变,使得结构、活性或两者在原生与改变的基因、蛋白质、化合物或核酸分子之间不同。在某些实施方式中,异源、非内源或外源基因、蛋白质或核酸分子可为非宿主细胞或受试者内源,但实际上编码此类基因、蛋白质的核酸或核酸分子可能已通过缀合、转化、转染、电穿孔等添加到宿主细胞中,其中添加的核酸分子可整合到宿主细胞基因组中或可以染色体外遗传物质形式(例如以质粒或其它自复制载体形式)存在。术语“同源”或“同源物”是指发现于或源自宿主细胞、物种或株系的基因、蛋白质、化合物、核酸分子或活性。举例来说,编码多肽的异源或外源多核苷酸或基因可与原生多核苷酸或基因同源且编码同源多肽或活性,但所述多核苷酸或多肽可具有改变的结构、序列、表达水平或其任何组合。非内源多核苷酸或基因以及编码的多肽或活性可来自相同物种、不同物种或其组合。
[0053]
如本文所用,术语“内源性”或“原生”是指通常存在于宿主细胞或受试者中的多核苷酸、基因、蛋白质、化合物、分子或活性。
[0054]
如本文所用,术语“细胞”、“细胞系”和“细胞培养”可互换使用,且所有此类名称包括子代。因此,词语“转化体”和“转化细胞”包括原代受试者细胞和源自其的培养物,不考虑转移数。还应理解,归因于有意或无意突变,所有子代可能在dna含量方面不完全相同。包括具有与针对最初转化细胞筛选的功能、表型或生物活性相同或基本上相同的功能、表型或生物活性的变体子代。在期望区别的名称时,将从上下文显而易见。
[0055]
本公开部分提供能够中和乙型肝炎和丁型肝炎病毒的抗体、抗原结合片段和融合蛋白。根据本说明书的抗体、抗原结合片段和融合蛋白的实施方式可用于预防、治疗或减弱或诊断hbv和hdv的方法中。在特定实施方式中,本文所描述的抗体、抗原结合片段和融合蛋白结合乙型肝炎病毒表面抗原的两种或更多种不同基因型,并且结合乙型肝炎病毒表面抗原的两种或更多种不同感染性突变体。在具体实施方式中,本文所描述的抗体、抗原结合片段和融合蛋白结合乙型肝炎病毒表面抗原的所有已知基因型,并且结合乙型肝炎病毒表面抗原的所有已知感染性突变体。
[0056]
抗体和抗原结合片段
[0057]
在一个方面,本公开提供一种分离的抗体或其抗原结合片段,其能够结合hbsag的抗原环区并且能够中和乙型肝炎病毒和丁型肝炎病毒感染。
[0058]
如本文所用,并且除非上下文另外明确指示,否则“抗体”是指包含通过二硫键互连的至少两条重(h)链和两条轻(l)链的完整抗体(不过应理解,缺少轻链的重链抗体仍由术语“抗体”涵盖),以及具有或保留结合由完整抗体识别的抗原靶分子的能力的完整抗体的任何抗原结合部分或片段,例如scfv、fab或f(ab')2片段。因此,本文中的术语“抗体”在最广泛意义上使用且包括多克隆和单克隆抗体,包括完整抗体和其功能(抗原结合)抗体片
段,包括片段抗原结合(fab)片段、f(ab')2片段、fab'片段、fv片段、重组igg(rigg)片段、单链抗体片段(包括单链可变片段(scfv))以及单结构域抗体(例如sdab、sdfv、纳米抗体)片段。所述术语涵盖基因工程和/或其它方式修饰的免疫球蛋白形式,如胞内抗体、肽体、嵌合抗体、完全人抗体、人源化抗体和异缀合抗体、多特异性(例如双特异性)抗体、双抗体、三抗体和四抗体、串联双价scfv、串联三价scfv。除非另有说明,否则术语“抗体”应理解为涵盖其功能性抗体片段。所述术语还涵盖完整或全长抗体,包括任何类别或其亚类的抗体,包括igg和其亚类,igm、ige、iga和igd。
[0059]
如本文所用,术语“抗原结合片段”、“片段”和“抗体片段”可互换使用以指代保留抗体的抗原结合活性的本公开抗体的任何片段。抗体片段的实例包括但不限于单链抗体、fab、fab'、f(ab')2、fv或scfv。
[0060]
人抗体是已知的(例如van dijk,m.a.及van de winkel,j.g.,《化学生物学当前观点(curr.opin.chem.biol.)》5(2001)368
‑
374)。人抗体可在免疫接种后能够在不存在内源免疫球蛋白产生的情况下产生全谱系或选定的人抗体的转基因动物(例如小鼠)中产生。此类生殖系突变小鼠中人生殖系免疫球蛋白基因阵列的转移将引起在抗原攻击后产生人抗体(参见例如jakobovits,a.等人,《美国国家科学院院刊(proc.natl.acad.sci.usa)》90(1993)2551
‑
2555;jakobovits,a.等人,《自然(nature)》362(1993)255
‑
258;bruggemann,m.等人,《免疫学年评(year immunol.)》7(1993)3340)。人抗体还可在噬菌体展示库中产生(hoogenboom,h.r.和winter,g.,《分子生物学杂志(j.mol.biol.)》227(1992)381
‑
388;marks,j.d.等人,《分子生物学杂志》222(1991)581
‑
597)。cole等人和boerner等人的技术也可用于制备人单克隆抗体(cole等人,《单克隆抗体和癌症疗法(monoclonal antibodies and cancer therapy)》,alan r.liss,第77页(1985);和boerner,p.等人,《免疫学杂志(j.immunol.)》,147(1991)86
‑
95)。人单克隆抗体可通过使用改进的ebv
‑
b永生化来制备,如traggiai e,becker s,subbarao k,kolesnikova l,uematsu y,gismondo mr,murphy br,rappuoli r,lanzavecchia a.(2004):《由记忆b细胞制造人单克隆抗体的高效方法:强效中和sars冠状病毒(an efficient method to make human monoclonal antibodies from memory b cells:potent neutralization of sars coronavirus)》.《自然
·
医学(nat med.)》10(8):871
‑
5中所描述。如本文所用,术语“人抗体”还包含此类抗体,其例如在可变区中经修饰以产生根据本公开的抗体和抗体片段的特性。
[0061]
如本文所用,术语“可变区”(轻链可变区(v
l
)、重链可变区(v
h
))表示轻链和重链对的每个可变区多肽,其在大多数情况下直接参与抗体与抗原的结合。
[0062]
根据本公开的抗体可以是任何同种型(例如iga、igg、igm、ige、igd;即,包含α、γ、μ、ε或δ重链)。例如在igg同种型内,抗体可以是igg1、igg2、igg3或igg4子类。在具体实施方式中,本公开的抗体是igg1抗体。本文所提供的抗体或抗原结合片段可包括κ或λ轻链。在某些实施方式中,本文所描述的hbsag特异性抗体为igg同种型并且可阻断hbv和hbsag从经感染细胞释放。因此,在某些实施方式中,根据本说明书的抗体可细胞内结合并且从而阻断hbv病毒粒子和hbsag的释放。
[0063]
术语“vl”和“vh”分别是指来自抗体轻链和重链的可变结合区。可变结合区由称为“互补决定区”(cdr)和“框架区”(fr)的离散、明确定义的子区构成。术语“互补决定区”和“cdr”与“高变区”或“hvr”同义,并且在所属技术中已知指tcr或抗体可变区内的氨基酸序
列,其赋予抗原特异性和/或结合亲和力并且由框架序列分隔。一般来说,免疫球蛋白结合蛋白的每个可变区中存在三个cdr;例如对于抗体,vh和vl区包含六个cdr,hcdr1、hcdr2、hcdr3;lcdr1、lcdr2、lcdr3;在本文中也分别称为cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3。如本文所用,cdr的“变体”是指具有至多1
‑
3个氨基酸取代、缺失或其组合的cdr序列的功能变体。
[0064]
免疫球蛋白序列可与编号方案(例如kabat、eu、国际免疫遗传学信息系统(international immunogenetics information system,imgt)和aho)比对,其可允许标注等效残基位置且允许使用抗原受体编号和受体分类(antigen receptor numbering and receptor classification,anarci)软件工具(2016,《生物信息学(bioinformatics)》15:298
‑
300)比较不同分子。应理解,在某些实施方式中,本公开的抗体或抗原结合片段可包含重链(hc)、轻链(lc)或两者的全部或部分。举例来说,全长完整igg抗体单体典型地包括vh、ch1、ch2、ch3、vl和cl。fc组分在本文中进一步描述。在某些实施方式中,本公开的抗体或抗原结合片段包含分别根据本发明所公开的vh和vl序列中的任一个的cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3。
[0065]
表1显示根据本公开的某些示例性抗体的重链可变区(vh)、轻链可变区(vl)、cdr、重链(hc)和轻链(lc)的氨基酸序列。
[0066]
[0067]
[0068]
[0069]
[0070]
[0071]
[0072][0073]
本文所描述的抗体的片段可通过包括用如胃蛋白酶或木瓜蛋白酶的酶消化和/或通过化学还原裂解二硫键的方法从抗体获得。可替代地,抗体的片段可通过克隆并表达重链或轻链序列的一部分获得。本公开涵盖源自如本文所描述的抗体的重链和轻链的单链fv片段(scfv),包括例如包含来自根据本说明书的抗体的cdr的scfv、重链或轻链单体和二聚体、单结构域重链抗体、单结构域轻链抗体以及单链抗体,其中重链和轻链可变结构域由肽接头接合。
[0074]
在某些实施方式中,根据本公开的抗体或其抗原结合片段包含纯化抗体、单克隆抗体、单链抗体、fab、fab'、f(ab')2、fv或scfv。
[0075]
在实施方式中,本公开的抗体和抗原结合片段可以是多特异性(例如双特异性、三特异性、四特异性等)的,并且可以如本文所公开的任何多特异性形式提供。在某些实施方式中,本公开的抗体或抗原结合片段为多特异性抗体,如双特异性或三特异性抗体。双特异性抗体的形式公开于例如spiess等人,《分子免疫学(mol.immunol.)》67(2):95(2015)以及brinkmann和kontermann,《单抗(mabs)》9(2):182
‑
212(2017)中,所述双特异性形式和其制造方法以引用之方式并入本文中,并且包括例如双特异性t细胞接合体(bite)、dart、杵
‑
臼(kih)组合体、scfv
‑
ch3
‑
kih组合体、kih共同轻链抗体、tandab、三重体、tribi微型抗体、fab
‑
scfv、scfv
‑
ch
‑
cl
‑
scfv、f(ab')2
‑
scfv2、四价hcab、胞内抗体、crossmab、双作用fab(daf)(二合一或四合一)、dutamab、dt
‑
igg、电荷对、fab
‑
臂交换、seed体、triomab、luz
‑
y组合体、fcab、κλ
‑
体、正交fab、dvd
‑
igg、igg(h)
‑
scfv、scfv
‑
(h)igg、igg(l)
‑
scfv、scfv
‑
(l)igg、igg(l,h)
‑
fv、igg(h)
‑
v、v(h)
‑
igg、igg(l)
‑
v、v(l)
‑
igg、kih igg
‑
scfab、2scfv
‑
igg、igg
‑
2scfv、scfv4
‑
ig、zybody以及dvi
‑
igg(四合一)。双特异性或多特异性抗体可包含本公开的hbv和/或hdv特异性结合结构域与本公开的另一hbv和/或hdv特异性结合结构域的组合,或与特异性结合hbv和/或hdv(例如在相同或不同表位处)的不同结合结构域的组合,或
与特异性结合不同抗原的结合结构域的组合。
[0076]
本公开的抗体片段可赋予单价或多价相互作用并且含于如上文所描述多种结构中。举例来说,可合成scfv分子以产生三价“三抗体”或四价“四抗体”。scfv分子可包括产生二价微型抗体的fc区结构域。另外,本公开的序列可以是多特异性分子的组分,其中本公开的序列靶向本公开的表位并且分子的其它区结合其它靶标。示例性分子包括但不限于双特异性fab2、三特异性fab3、双特异性scfv和双抗体(holliger和hudson,2005,《自然
·
生物技术(nature biotechnology)》9:1126
‑
1136)。
[0077]
在某些实施方式中,抗体或其抗原结合片段(如本文所描述的那些,包括但不限于scfv)可包含于能够特异性结合如本文所描述的抗原的融合蛋白中。如本文所用,“融合蛋白”是指在单链中具有至少两个不同结构域或基序的蛋白质,其中在蛋白质中结构域或基序并非天然发现在一起或呈给定排列。编码融合蛋白的多核苷酸可使用pcr、重组工程化等构建,或可合成此类融合蛋白。
[0078]
在一些实施方式中,融合蛋白能够在宿主细胞,例如t细胞、nk细胞或nk
‑
t细胞表面表达。在某些实施方式中,融合蛋白包含(i)细胞外组分,其包含抗体或其抗原结合片段(例如scfv);(ii)跨膜组分(例如来自cd4、cd8、cd27、cd28的跨膜结构域,或其功能变体或部分,或其任何组合);和(iii)细胞内组分,其包含来自共刺激蛋白的信号传导结构域,或其功能变体或部分(例如来自cd27、cd28、4
‑
1bb(cd137)、ox40(cd134)、cd2、cd5、icam
‑
1(cd54)、lfa
‑
1(cd11a/cd18)、icos(cd278)、gitr、cd30、cd40、baff
‑
r、hvem、light、mkg2c、slamf7、nkp80、cd160、b7
‑
h3、与cd83特异性结合的配体的信号传导结构域,或其功能变体,或其任何组合)和/或效应结构域(例如来自cd3ε、cd3δ、cd3ζ、cd25、cd79a、cd79b、card11、dap10、fcrα、fcrβ、fcrγ、fyn、hvem、icos、lck、lag3、lat、lrp、nkg2d、notch1、notch2、notch3、notch4、wnt、ror2、ryk、slamf1、slp76、ptα、tcrα、tcrβ、trim、zap70、ptch2,或其任何组合)。
[0079]
在某些实施方式中,包含抗体或抗原结合片段的融合蛋白包含嵌合抗原受体分子(car),其可在用于细胞免疫疗法的宿主细胞,如t细胞、nk细胞或nk
‑
t细胞的细胞表面上表达。car分子和设计原理描述于例如以下中:sadelain等人,《癌症发现(cancer discov.)》,3(4):388(2013);harris和kranz,《药理科学趋势(trends pharmacol.sci.)》,37(3):220(2016);stone等人,《癌症免疫与免疫疗法(cancer immunol.immunother.)》,63(11):1163(2014);xu等人,2018《肿瘤靶点(oncotarget)》9:13991;androulla等人,2018《当代药物生物技术(curr.pharm.biotechnol.)》第19卷(2018年4月);wu等人,2016《生物疗法专家观点(expert opin.biol.ther.)》16:1469;ren等人,2017《蛋白质细胞(protein cell)》8:634;所述car分子、car设计和car设计原理以全文引用的方式并入本文中。
[0080]
贯穿本公开,抗体、其抗原结合片段和融合蛋白可分别或共同(例如以任何组合)称为“结合蛋白”。
[0081]
根据本公开的结合蛋白可以纯化形式提供。举例来说,抗体可存在于基本上不含其它多肽的组合物中,例如其中小于90%(按重量计),通常小于60%并且更通常小于50%的组合物由其它多肽构成。
[0082]
根据本公开的结合蛋白可在人和/或非人(或异源)宿主中具有免疫原性;例如在小鼠中。举例来说,抗体可具有在非人宿主中具有免疫原性,但不在人宿主中具有免疫原性
的独特型。供人使用的本公开的抗体包括典型地不从如小鼠、山羊、兔、大鼠、非灵长类哺乳动物等的宿主分离,并且在一些情况下不通过人源化或从异种小鼠获得的抗体。本文还考虑所公开抗体的变体形式,其经工程化以便在非人动物(如小鼠)中降低已知或潜在的免疫原性和/或其它潜在不利因素,或赋予抗体所需结构和/或功能(例如“鼠化”抗体,其中一个或多个人氨基酸残基、序列或基序由在小鼠中具有降低或消除的免疫原性或其它不利因素或具有所需结构和/或功能的残基、序列或基序置换;例如用于使用小鼠的模型研究)。
[0083]
本公开的示例性鼠化抗体的氨基酸序列提供于表2中。
[0084]
[0085][0086]
如本文所用,“中和抗体”(或抗原结合片段,或融合蛋白)是能中和,即阻止、抑制、降低、妨碍或干扰病原体在宿主(例如宿主生物体或宿主细胞)中引发和/或保持感染的能力的抗体。术语“中和抗体(neutralizing antibody)”和“中和的抗体(an antibody that neutralizes/antibodies that neutralize)”在本文中可互换使用。这些抗体可单独或组合(例如两种或更多种本发明所公开的抗体呈组合形式,或本公开的抗体与另一药剂组合,所述药剂可为或可不为抗体药剂,包括能够中和hbv b和/或d感染的抗体)使用,在适当配制后作为防治或治疗剂、与主动疫苗接种结合、作为诊断工具或作为如本文所描述的生产工具。
[0087]
如本文所用,“特异性结合”或“特异于”是指结合蛋白(例如抗体或其抗原结合片段)或结合结构域与靶分子的缔合或联合,其亲和力或ka(即特定结合相互作用的平衡缔合常数,单位为1/m)等于或大于105m
‑1(其等于这一缔合反应的缔合速率[k
on
]与解离速率[koff]的比率),而不与样品中的任何其它分子或组分显著缔合或联合。结合蛋白或结合结构域可分类为“高亲和力”结合蛋白或结合结构域,或分类为“低亲和力”结合蛋白或结合结构域。“高亲和力”结合蛋白或结合结构域是指具有至少107m
‑1、至少108m
‑1、至少109m
‑1、至少10
10
m
‑1、至少10
11
m
‑1、至少10
12
m
‑1,或至少10
13
m
‑1的ka的结合蛋白或结合结构域。“低亲和力”结合蛋白或结合结构域是指具有至多107m
‑1、至多106m
‑1或至多105m
‑1的ka的结合蛋白或结合结构域。或者,亲和力可以定义为特定结合相互作用的平衡解离常数(kd)且以m为单位(例如10
‑5m到10
‑
13
m)。术语“结合”和“特异性结合”和类似参考不涵盖非特异性粘附。
[0088]
结合蛋白的结合可使用适当分析来确定或评定,例如表面等离子体共振(spr)方法,例如biacore
tm
系统;动力学排阻排除分析,如和生物层干涉测量法(例如使用octet平台);等温滴定量热法(itc)等,抗原结合elisa(例如直接的或间接的)且通过例如450nm下光密度或通过流式细胞术等成像。
[0089]
在某些实施方式中,根据本公开的结合蛋白可结合hbsag的抗原环区。乙型肝炎病毒的包膜一般含有三个“hbv包膜蛋白”(也称为“hbsag”、“乙型肝炎表面抗原”):s蛋白(意为“小”,也称为s
‑
hbsag)、m蛋白(意为“中”,也称为m
‑
hbsag)和l蛋白(意为“大”,也称为l
‑
hbsag)。s
‑
hbsag、m
‑
hbsag和l
‑
hbsag共用相同c端末端(也称为“s结构域”,226个氨基酸),其对应于s蛋白(s
‑
hbsag)并且对于病毒组装和感染性至关重要。s
‑
hbsag、m
‑
hbsag和l
‑
hbsag在内质网(er)中合成、组装,并且通过高尔基体以颗粒形式分泌。s结构域包含四个预测跨膜(tm)结构域,从而s结构域的n端以及c端都暴露于内腔。跨膜结构域tm1和tm2都被认为是共翻译蛋白整合到er膜中必需的,并且跨膜结构域tm3和tm4位于s结构域的c端三分之
一处。hbsag的“抗原环区”位于hbsag的s结构域的预测tm3与tm4跨膜结构域之间,其中抗原环区包含s结构域的氨基酸101
‑
172,s结构域总共含有226个氨基酸(salisse j.和sureau c.,2009,《病毒学杂志(journal of virology)》83:9321
‑
9328)。感染性的决定子存在于hbv包膜蛋白的抗原环区。特别地,hbsag的119与125之间的残基含有cxxc基序,其被视为对于hbv和hdv的感染性很重要(jaoude ga,sureau c,《病毒学杂志》,2005;79:10460
‑
6)。
[0090]
当本文提及hbsag的s结构域的氨基酸序列中的位置时,此类位置参考如seq id no:3(以下所示)中阐述的氨基酸序列或其天然或人工序列变体得到。
[0091]
menitsgflgpllvlqagfflltriltipqsldswwtslnflggttvclgqnsqsptsnhsptscpptcpgyrwmclrrfiiflfilllclifllvlldyqgmlpvcplipgssttstgpcrtcmttaqgtsmypsccctkpsdgnctcipipsswafgkflwewasarfswlsllvpfvqwfvglsptvwlsviwmmwywgpslysilspflpllpiffclwvyi
[0092]
(seq id no:3;氨基酸101
‑
172加下划线显示)
[0093]
举例来说,表述“s结构域的氨基酸101
‑
172”是指来自根据seq id no:3的多肽的位置101
‑
172的氨基酸残基。然而,所属领域的技术人员理解,突变或变化(包括但不限于取代、缺失和/或添加,例如如本文所描述的不同基因型的hbsag或不同hbsag突变体)可在hbsag的s结构域的氨基酸序列中天然发生,或人工引入到hbsag的s结构域的氨基酸序列中而不影响其生物特性。因此,如本文所用,术语“hbsag的s结构域”涵盖所有此类多肽,包括例如根据seq id no:3的多肽和其天然或人工突变体。另外,当本文中描述hbsag的s结构域的序列片段(例如hbsag的s结构域的氨基酸101
‑
172或氨基酸120
‑
130)时,其不仅包括seq id no:3的对应序列片段,而且包括其天然或人工突变体的对应序列片段。举例来说,短语“来自hbsag的s结构域的位置101
‑
172的氨基酸残基”涵盖seq id no:3的位置101
‑
172的氨基酸残基和其突变体(天然或人工突变体)的对应片段。如本文所用,短语“对应序列片段”和“对应片段”是指当序列进行优化比对,即序列经比对以获得最高同一性百分比时,位于序列相同位置的片段。
[0094]
m蛋白(m
‑
hbsag)对应于由称为“前s2”的55个氨基酸的n端结构域延伸的s蛋白。l蛋白(l
‑
hbsag)对应于由称为“前s1”(基因型d)的108个氨基酸的n端结构域延伸的m蛋白。l蛋白的前s1和前s2结构域可存在于病毒颗粒的内表面处(er的胞浆侧上)且被认为在病毒组装中起至关重要的作用,或存在于外表面上(er的内腔侧上),可用于与靶细胞相互作用并且对于病毒感染性很重要。此外,hbv表面蛋白(hbsag)不仅并入病毒粒子包膜中而且可从er
‑
高尔基体中间隔室膜自发地出芽,形成通过分泌从细胞释放的空“亚病毒颗粒”(svp)。
[0095]
在一些实施方式中,抗体、抗原结合片段或融合蛋白结合hbsag的抗原环区,并且能够结合s
‑
hbsag、m
‑
hbsag和l
‑
hbsag中的全部。
[0096]
在一些实施方式中,抗体、抗原结合片段或融合蛋白中和乙型肝炎病毒和丁型肝炎病毒感染。在一些实施方式中,抗体或其抗原结合片段降低乙型肝炎病毒和丁型肝炎病毒的病毒感染性。
[0097]
为了研究和定量实验室中的病毒感染性(或“中和”),可利用标准“中和分析”。对于中和分析,动物病毒典型地在细胞和/或细胞系中传播。可使用中和分析,其中在存在(或不存在)待测试抗体(或抗原结合片段或融合蛋白)的情况下,将培养的细胞与固定量的hbv
或hdv一起培育。在此类分析中,可使用分泌到细胞培养上清液中的乙型肝炎表面抗原(hbsag)或乙型肝炎e抗原(hbeag)的水平和/或可评定hbcag染色以提供读数。举例来说,对于hdv,可评定δ抗原免疫荧光染色。
[0098]
在hbv中和分析的特定实施方式中,在存在或不存在待测试抗体的情况下,将培养的细胞(例如heparg细胞,如分化的heparg细胞)与固定量的hbv一起培育。在此类实施方式中,可例如在37℃下进行培育16小时。所述培育可在培养基(例如补充有4%peg 8000)中进行。培育之后,细胞可经洗涤并且进一步培养。为了测量病毒感染性,可通过酶联免疫吸附分析(elisa)确定例如感染后第7天到第11天分泌到培养上清液中的乙型肝炎表面抗原(hbsag)和乙型肝炎e抗原(hbeag)的水平。另外,可在免疫荧光分析中评定hbcag染色。在hdv中和分析的一个实施方式中,可使用与hbv基本上相同的分析,不同之处在于可使用来自hdv携带者的血清作为分化的heparg细胞上的感染接种物(而不是hbv)。对于检测,可使用δ抗原免疫荧光染色作为读数。
[0099]
本公开的结合蛋白的实施方式具有高中和效力。在某些实施方式中,乙型肝炎病毒(hbv)和丁型肝炎病毒(hdv)的50%中和所需的如本文所描述的抗体浓度是例如约10μg/ml或更小。在其它实施方式中,hbv和hdv的50%中和所需的结合蛋白浓度是约5μg/ml。在其它实施方式中,hbv和hdv的50%中和所需的如本文所描述的结合蛋白浓度是约1μg/ml。在再其它实施方式中,hbv和hdv的50%中和所需的结合蛋白浓度是约750ng/ml。在另外其它实施方式中,hbv和hdv的50%中和所需的如本文所描述的结合蛋白浓度是500ng/ml或更小。在此类实施方式中,hbv和hdv的50%中和所需的如本文所描述的结合蛋白浓度可选自450ng/ml或更小、400ng/ml或更小、350ng/ml或更小、300ng/ml或更小、250ng/ml或更小、200ng/ml或更小、175ng/ml或更小、150ng/ml或更小、125ng/ml或更小、100ng/ml或更小、90ng/ml或更小、80ng/ml或更小、70ng/ml或更小、60ng/ml或更小或50ng/ml或更小。
[0100]
根据本公开的抗体或抗原结合片段(其可中和hbv和hdv两者)适用于预防和治疗乙型肝炎和丁型肝炎。hdv感染典型地与hbv感染同时发生或在其之后发生(例如在不存在hbv的情况下接种hdv不引起丁型肝炎,因为hdv需要hbv支持其自身复制),并且典型地在慢性hbv携带者中观察到丁型肝炎。
[0101]
所公开的结合蛋白的实施方式促进hbsag和hbv的清除。在特定实施方式中,结合蛋白促进hbv和乙型肝炎病毒的亚病毒颗粒(svp)两者的清除。hbsag或亚病毒颗粒的清除可通过测量例如血液样品(例如来自乙型肝炎患者)中的hbsag水平来评定。类似地,hbv的清除可通过测量例如血液样品(例如来自乙型肝炎患者)中的hbv水平来评定。
[0102]
在感染hbv的患者血清中,除感染性颗粒(hbv)之外,典型地存在过量(典型地1,000到100,000倍)的仅由hbv包膜蛋白(hbsag)构成的空亚病毒颗粒(svp),呈相对较小球体和可变长度丝的形式。已显示亚病毒颗粒强烈增强hbv的细胞内病毒复制和基因表达(bruns m.等人1998《病毒学杂志(j virol)》72(2):1462
‑
1468)。这在含有hbv的血清的感染性的情形下也是相关的,因为感染性不仅取决于病毒的数量而且取决于svp的数量(bruns m.等人1998《病毒学杂志》72(2):1462
‑
1468)。此外,过量的亚病毒颗粒可通过吸收中和抗体充当假诱饵并且因此延迟感染的清除。在一些情况下,实现乙型肝炎表面抗原(hbsag)损失视为治疗的理想终点和治愈慢性乙型肝炎(chb)的最接近结果。
[0103]
本公开的结合蛋白的实施方式可促进hbsag的清除。在某些实施方式中,结合蛋白
q129l、hbsag m133h、hbsag m133l、hbsag m133t、hbsag k141e、hbsag p142s、hbsag s143k、hbsag d144a、hbsag g145r以及hbsag n146a。在一些此类实施方式中,结合蛋白能够结合至少15种选自以下的感染性hbsag突变体:hbsag y100c/p120t、hbsag p120t、hbsag p120t/s143l、hbsag c121s、hbsag r122d、hbsag r122i、hbsag t123n、hbsag q129h、hbsag q129l、hbsag m133h、hbsag m133l、hbsag m133t、hbsag k141e、hbsag p142s、hbsag s143k、hbsag d144a、hbsag g145r以及hbsag n146a。在一些实施方式中,结合蛋白能够结合以下感染性hbsag突变体中的每一者:hbsag y100c/p120t;hbsag p120t;hbsag p120t/s143l;hbsag c121s;hbsag r122d;hbsag r122i;hbsag t123n;hbsag q129h;hbsag q129l;hbsag m133h;hbsag m133l;hbsag m133t;hbsag k141e;hbsag p142s;hbsag s143k;hbsag d144a;hbsag g145r;以及hbsag n146a。
[0113]
在某些实施方式中,结合蛋白(例如包括抗体或其抗原结合片段)能够降低患有hbv感染的哺乳动物中hbv dna的血清浓度。在某些实施方式中,结合蛋白能够降低患有hbv感染的哺乳动物中hbsag的血清浓度。在某些实施方式中,结合蛋白能够降低患有hbv感染的哺乳动物中hbeag的血清浓度。在某些实施方式中,结合蛋白能够降低患有hbv感染的哺乳动物中hbcrag的血清浓度。在一些实施方式中,在单次施用结合蛋白之后,结合蛋白能够降低哺乳动物中hbv dna、hbsag、hbeag和/或hbcrag的血清浓度约10、11、12、13、14、15、16、17、18、19、20或更多天。
[0114]
术语“表位”或“抗原表位”包括由同源结合分子,如免疫球蛋白、嵌合抗原受体或其它结合分子、结构域或蛋白质识别且特异性结合的任何分子、结构、氨基酸序列或蛋白质决定子。表位决定子一般含有分子的化学活性表面基团(如氨基酸或糖侧链),且可具有特定的三维结构特征以及特定的电荷特征。
[0115]
在一些实施方式中,结合蛋白能够结合包含hbsag的抗原环区的至少一个、至少两个、至少三个或至少四个氨基酸的表位。在某些实施方式中,结合蛋白能够结合选自hbsag的s结构域的氨基酸115
‑
133、hbsag的s结构域的氨基酸120
‑
133或hbsag的s结构域的氨基酸120
‑
130的至少两个氨基酸。在某些实施方式中,结合蛋白能够结合选自hbsag的s结构域的氨基酸115
‑
133、hbsag的s结构域的氨基酸120
‑
133或hbsag的s结构域的氨基酸120
‑
130的至少三个氨基酸。在一些实施方式中,结合蛋白能够结合选自hbsag的s结构域的氨基酸115
‑
133、hbsag的s结构域的氨基酸120
‑
133或hbsag的s结构域的氨基酸120
‑
130的至少四个氨基酸。如本文所用,氨基酸的位置(例如115
‑
133、120
‑
133、120
‑
130)是指如上文所描述的hbsag的s结构域,其存在于所有三种hbv包膜蛋白s
‑
hbsag、m
‑
hbsag和l
‑
hbsag中,其中s
‑
hbsag典型地对应于hbsag的s结构域。
[0116]
如本文在表位的上下文中所用,术语“由
……
形成”意指结合蛋白所结合的表位可以是线性(连续)或构象(不连续)的。线性或连续表位是由抗体根据其氨基酸的线性序列,或一级结构识别的表位。构象表位可根据三维形状和蛋白质结构识别。因此,如果表位是线性表位并且包含位于选自hbsag的s结构域的氨基酸位置115
‑
133或氨基酸位置120
‑
133的多于一个氨基酸,则表位所包含的氨基酸可位于一级结构的相邻位置(例如为氨基酸序列中的连续氨基酸)。在构象表位(3d结构)情况下,氨基酸序列典型地形成3d结构作为表位,并且因此形成表位的氨基酸可位于或可不位于一级结构的相邻位置(即可为或可不为氨基酸序列中的连续氨基酸)。
[0117]
在某些实施方式中,结合蛋白所结合的表位为构象表位。在一些实施方式中,结合蛋白结合包含hbsag的抗原环区的至少两个氨基酸的表位,其中至少两个氨基酸选自hbsag的s结构域的氨基酸120
‑
133或氨基酸120
‑
130,且其中至少两个氨基酸不位于(一级结构的)相邻位置。在一些实施方式中,结合蛋白结合包含hbsag的抗原环区的至少三个氨基酸的表位,其中至少三个氨基酸选自hbsag的s结构域的氨基酸120
‑
133或氨基酸120
‑
130,且其中三个氨基酸中的至少两者不位于(一级结构的)相邻位置。在一些实施方式中,结合蛋白结合包含hbsag的抗原环区的至少四个氨基酸的表位,其中至少四个氨基酸选自hbsag的s结构域的氨基酸120
‑
133或氨基酸120
‑
130,且其中四个氨基酸中的至少两者不位于(一级结构的)相邻位置。
[0118]
本发明所公开的抗体、抗原结合片段或融合蛋白所结合的氨基酸(即形成表位的氨基酸)(不位于一级结构的相邻位置)在一些情况下由一个或多个氨基酸间隔开,抗体、抗原结合片段或融合蛋白不结合所述一个或多个氨基酸。在一些实施方式中,至少一个、至少两个、至少三个、至少四个或至少五个氨基酸可位于表位所包含的不位于相邻位置的两个氨基酸之间。
[0119]
在某些实施方式中,结合蛋白结合包含hbsag的s结构域的至少氨基酸p120、c121、r122和c124的表位。在其它实施方式中,本公开的结合蛋白结合包含根据seq id no:88的氨基酸序列的表位:
[0120]
pcrxc
[0121]
其中x为任何氨基酸或无氨基酸;x为任何氨基酸;x为t、y、r、s或f;x为t、y或r;或x为t或r。
[0122]
在其它实施方式中,本公开的结合蛋白结合包含根据seq id no:80的氨基酸序列的表位:
[0123]
tgpcrtc
[0124]
或结合与seq id no:80共有至少80%、至少90%或至少95%序列同一性的氨基酸序列。
[0125]
在其它实施方式中,本公开的结合蛋白结合包含根据seq id no:85的氨基酸序列的表位:
[0126]
sttstgpcrtc
[0127]
或结合与seq id no:85共有至少80%、至少90%或至少95%序列同一性的氨基酸序列。
[0128]
在某些实施方式中,本公开的结合蛋白结合包含hbsag的s结构域的至少氨基酸145
‑
151的氨基酸序列的表位:
[0129]
gnctcip
[0130]
(seq id no:81)。
[0131]
在其它实施方式中,本公开的结合蛋白结合包含根据seq id no:80的氨基酸序列和根据seq id no:81的氨基酸序列的表位。
[0132]
在其它实施方式中,本公开的结合蛋白结合包含根据seq id no:85的氨基酸序列和/或根据seq id no:87的氨基酸序列的表位。
[0133]
如上文所描述,本公开的结合蛋白所结合的表位可以是线性(连续)或构象(不连
续)的。在一些实施方式中,本公开的结合蛋白结合构象表位,并且在某些此类实施方式中,构象表位仅在非还原条件下存在。
[0134]
在某些实施方式中,本公开的结合蛋白结合线性表位。在某些此类实施方式中,线性表位在非还原条件和还原条件两者下存在。
[0135]
在特定实施方式中,本公开的结合蛋白结合由根据seq id no:1的氨基酸序列形成的hbsag的抗原环中的表位:
[0136]
x
1 x
2 x
3 tc x
4 x
5 x6a x
7 g
[0137]
其中x1、x2、x3、x4、x5、x6和x7可以是任何氨基酸(seq id no:1)。
[0138]
在一些实施方式中,x1、x2、x3、x4、x5、x6和x7是与seq id no:3的氨基酸120
‑
130相比经过保守取代的氨基酸。在一些实施方式中,x1、x2、x3、x4、x5、x6和x7是与seq id no 5
‑
33中的任一者的氨基酸20
‑
30相比经过保守取代的氨基酸。
[0139]
在具体实施方式中,seq id no:1x1的x1是小氨基酸。如本文所用,“小”氨基酸是指选自下组的任何氨基酸:丙氨酸、天冬氨酸、天冬酰胺、半胱氨酸、甘氨酸、脯氨酸、丝氨酸、苏氨酸以及缬氨酸。在某些此类实施方式中,x1是脯氨酸、丝氨酸或苏氨酸。
[0140]
在某些实施方式中,seq id no:1x2的x2是小氨基酸。在某些实施方式中,x2可选自半胱氨酸或苏氨酸。
[0141]
在一些实施方式中,seq id no:1的x3是带电氨基酸或脂肪族氨基酸。如本文所用,“带电”氨基酸是指选自下组的任何氨基酸:精氨酸、赖氨酸、天冬氨酸、谷氨酸和组氨酸。如本文所用,“脂肪族”氨基酸是指选自下组的任何氨基酸:丙氨酸、甘氨酸、异亮氨酸、亮氨酸和缬氨酸。在某些实施方式中,x3选自精氨酸、赖氨酸、天冬氨酸或异亮氨酸。
[0142]
在一些实施方式中,seq id no:1的x4是小氨基酸和/或疏水性氨基酸。如本文所用,“疏水性”氨基酸是指选自下组的任何氨基酸:丙氨酸、异亮氨酸、亮氨酸、苯丙氨酸、缬氨酸、色氨酸、酪氨酸、蛋氨酸、脯氨酸和甘氨酸。在某些实施方式中,x4选自蛋氨酸或苏氨酸。
[0143]
在一些实施方式中,seq id no:1x5的x5是小氨基酸和/或疏水性氨基酸。在某些实施方式中,x5选自苏氨酸、丙氨酸或异亮氨酸。
[0144]
在一些实施方式中,seq id no:1x6的x6是小氨基酸和/或疏水性氨基酸。在某些实施方式中,x6选自苏氨酸、脯氨酸或亮氨酸。
[0145]
在一些实施方式中,seq id no:1的x7是极性氨基酸或脂肪族氨基酸。如本文所用,“极性”氨基酸是指选自下组的任何氨基酸:天冬氨酸、天冬酰胺、精氨酸、谷氨酸、组氨酸、赖氨酸、谷氨酰胺、色氨酸、酪氨酸、丝氨酸和苏氨酸。在某些此类实施方式中x7是谷氨酰胺、组氨酸或亮氨酸。
[0146]
在一些实施方式中,根据本公开的结合蛋白结合由根据seq id no:2的氨基酸序列形成的hbsag的抗原环中的表位:
[0147]
x
1 x
2 x
3 tc x
4 x
5 x6a x7g
[0148]
其中x1是p、t或s,
[0149]
x2是c或s,
[0150]
x3是r、k、d或i,
[0151]
x4是m或t,
[0152]
x5是t、a或i,
[0153]
x6是t、p或l,并且
[0154]
x7是q、h或l
[0155]
(seq id no:2)。
[0156]
关于由根据seq id no:1或2的氨基酸序列形成的表位,应注意,如本文所用的术语“由
……
形成”不旨在暗示所公开的结合蛋白必定结合seq id no:1或2的每个氨基酸。特别地,结合蛋白可仅结合seq id no:1或2的氨基酸中的一些,从而其它氨基酸残基可充当“间隔子”。
[0157]
在特定实施方式中,根据本公开的结合蛋白结合由选自下表3所示的seq id no 5
‑
33的氨基酸序列的一个或多个、两个或更多个、三个或更多个或四个或更多个氨基酸形成的hbsag的抗原环中的表位。
[0158]
在一些实施方式中,根据本公开结合蛋白结合具有根据下表3所示的seq id no 5
‑
33中的任何一者或多者的氨基酸序列的hbsag的抗原环区,或其序列变体。在某些实施方式中,根据本公开的结合蛋白结合具有根据下表3所示的seq id no 5
‑
33中的任一者的氨基酸序列的hbsag的所有抗原环变体。
[0159]
表3:如本文所用的不同基因型和突变体的hbsag的s结构域的抗原环区(除seq id no:16以外(hbsag的s结构域的残基100
‑
172以便包括相关突变),均是hbsag的s结构域的残基101
‑
172)的示例性氨基酸序列。
[0160]
[0161][0162]
在某些方面,本公开提供分离的抗体或其抗原结合片段,其包含:(i)重链可变区(v
h
),其包含与根据seq id no:41或67的氨基酸序列至少90%(即90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高)同一性的氨基酸序列;和(ii)轻链可变区(v
l
),在根据imgt编号在所述v
l
的位置40处的氨基酸不是半胱氨酸的条件下,其包含与根据seq id no:42;59;65;89、90或111
‑
120中的任一者的氨基酸序列至少90%同一性的氨基酸序列,其中抗体或其抗原结合片段结合hbsag的抗原环区并且中和乙型肝炎病毒和丁型肝炎病毒感染。
[0163]
在另外的实施方式中,(i)v
h
包含与根据seq id no:41或67的氨基酸序列至少95%同一性的氨基酸序列;和/或(ii)v
l
包含与根据seq id no:42、59、65、89、90或111
‑
120中的任一者的氨基酸序列至少95%同一性的氨基酸序列。
[0164]
在某些实施方式中,v
l
的位置40处的氨基酸为丙氨酸。在其它实施方式中,v
l
的40位的氨基酸为丝氨酸。在再其它实施方式中,v
l
的位置40处的氨基酸为甘氨酸。
[0165]
在本文所公开的实施方式中的任一者中,抗体或抗原结合片段可包含根据以下seq id no的cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3序列:(i)分别为34
‑
36、37、38和40;(ii)分别为34、66、36、37、38和40;(iii)分别为34
‑
36、37、39和40;(iv)分别为34、66、36、37、39和40;(v)分别为34
‑
36、37、38和58;(vi)分别为34、66、36、37、38和58;(vii)分别为34
‑
36、37、39和58;或(vii)分别为34、66、36、37、39和58。
[0166]
在一些实施方式中,抗体或抗原结合片段的v
l
包含根据seq id no:89的氨基酸序列或由其组成。在一些实施方式中,抗体或抗原结合片段的v
l
包含根据seq id no:90的氨基酸序列或由其组成。在其它实施方式中,抗体或抗原结合片段的v
l
包含根据seq id no:111
‑
120中的任一者的氨基酸序列或由其组成。在某些实施方式中,v
h
包含根据seq id no:41的氨基酸序列或由其组成。在其它实施方式中,v
h
包含根据seq id no:67的氨基酸序列或由其组成。
[0167]
在特定实施方式中,v
h
包含根据seq id no:41的氨基酸序列或由其组成,并且v
l
包含根据seq id no:89的氨基酸序列或由其组成。在其它实施方式中,v
h
包含根据seq id no:41的氨基酸序列或由其组成,并且v
l
包含根据seq id no:90的氨基酸序列或由其组成。在某些实施方式中,v
h
包含根据seq id no:41的氨基酸序列或由其组成,并且v
l
包含根据seq id no:111
‑
120中的任一者的氨基酸序列或由其组成。在其它实施方式中,v
h
包含根据seq id no:67的氨基酸序列或由其组成,并且v
l
包含根据seq id no:89、90和111
‑
120中的任一者的氨基酸序列或由其组成。
[0168]
在另一方面,本公开提供一种分离的抗体或其抗原结合片段,其包含:(i)重链可变区(v
h
),其包含与根据seq id no:95的氨基酸序列至少90%同一性的氨基酸序列;和(ii)轻链可变区(v
l
),其包含与根据seq id no:96的氨基酸序列至少90%同一性的氨基酸序列,其中抗体或其抗原结合片段结合hbsag的抗原环区并且中和乙型肝炎病毒和丁型肝炎病毒感染。
[0169]
在另外的实施方式中,(i)v
h
包含与根据seq id no:95的氨基酸序列至少95%的同一性的氨基酸序列;和/或(ii)v
l
包含与根据seq id no:96的氨基酸序列至少95%的同一性的氨基酸序列。
[0170]
在某些实施方式中,抗体或抗原结合片段包含分别根据seq id no:97
‑
102的cdrh1、cdrh2、cdrh3、cdrl1、cdrl2和cdrl3序列。
[0171]
在特定实施方式中,v
h
包含根据seq id no:95的氨基酸序列或由其组成;并且v
l
包含根据seq id no:96的氨基酸序列或由其组成。
[0172]
fc部分
[0173]
在一些实施方式中,本公开的结合蛋白(例如抗体或其抗原结合片段)包含fc部分。在某些实施方式中,fc部分可源自人源,例如源自人igg1、igg2、igg3和/或igg4,或源自另一ig种类或同种型。在具体实施方式中,抗体或抗原结合片段可包含源自人igg1的fc部分。
[0174]
如本文所用,术语“fc部分”是指包含以下、由以下组成、基本上由以下组成或源自以下的序列:免疫球蛋白重链的一部分,其恰好在木瓜蛋白酶裂解位点(例如原生igg中的残基216,取重链恒定区的第一个残基为114)上游的铰链区中开始,并且在免疫球蛋白重链的c端处结束。因此,fc部分可为完整fc部分或其一部分(例如结构域)。在某些实施方式中,
完整fc部分包含铰链结构域、ch2结构域和ch3结构域(例如eu氨基酸位置216
‑
446)。额外赖氨酸残基(k)有时存在于fc部分的极c端,但通常从成熟抗体裂解。fc部分内的氨基酸位置已根据kabat的eu编号系统编号,参见例如kabat等人,“免疫学感兴趣的蛋白质的序列(sequences of proteins of immunological interest)”,美国卫生和公共服务部(u.s.dept.health and human services),1983和1987。fc部分的氨基酸位置也可根据imgt编号系统(包括c结构域的独特编号和外显子编号)和kabat编号系统编号。
[0175]
在一些实施方式中,fc部分包含以下中的至少一者:铰链(例如上、中和/或下铰链区)结构域、ch2结构域、ch3结构域或其变体、部分或片段。在一些实施方式中,fc部分包含至少铰链结构域、ch2结构域或ch3结构域。在另外的实施方式中,fc部分为完整fc部分。人igg1同种型的示例性fc部分的氨基酸序列提供于seq id no:137中。fc部分还可包含相对于天然存在的fc部分的一个或多个氨基酸插入、缺失或取代。举例来说,铰链结构域、ch2结构域或ch3结构域中的至少一者或其一部分可缺失。举例来说,fc部分可包含以下或由以下组成:(i)与ch2结构域(或其一部分)融合的铰链结构域(或其一部分),(ii)与ch3结构域(或其一部分)融合的铰链结构域(或其一部分),(iii)与ch3结构域(或其一部分)融合的ch2结构域(或其一部分),(iv)铰链结构域(或其一部分),(v)ch2结构域(或其一部分),或(vi)ch3结构域(或其一部分)。
[0176]
本公开的fc部分可经修饰,使得其与天然存在的免疫球蛋白分子的完整fc部分的氨基酸序列不同,同时保留或增强天然存在的fc部分赋予的至少一种所需功能,和/或降低天然存在的fc部分的非所需功能。此类功能包括例如fc受体(fcr)结合、抗体半衰期调节(例如通过结合fcrn)、adcc功能、蛋白a结合、蛋白g结合和补体结合。所属领域中已描述与此类功能有关的天然存在的fc部分的部分。
[0177]
举例来说,为了激活补体级联,当免疫球蛋白分子连接到抗原靶标时,c1q蛋白质复合物可结合至少两个igg1分子或一个igm分子(ward,e.s.和ghetie,v.,《治疗免疫学(ther.immunol.)》2(1995)77
‑
94)。burton,d.r.描述(《分子免疫学》22(1985)161
‑
206)包含氨基酸残基318到337的重链区参与补体固定。duncan,a.r.和winter,g.(《自然》332(1988)738
‑
740)使用定点诱变,报道glu318、lys320和lys322形成与c1q的结合位点。glu318、lys320和lys 322残基在c1q结合中的作用通过含有这些残基的短合成肽抑制补体介导的溶解的能力得到证实。
[0178]
举例来说,fcr结合可通过(抗体的)fc部分与fc受体(fcr)的相互作用介导,fcr是包括造血细胞的细胞上的特化细胞表面受体。fc受体属于免疫球蛋白超家族,并且显示通过免疫复合物的吞噬作用介导抗体包被的病原体的去除,并且通过抗体依赖性细胞介导的细胞毒性(adcc;van de winkel,j.g.和anderson,c.l.,《白细胞生物学杂志(j.leukoc.biol.)》49(1991)511
‑
524)介导经对应抗体包被的红细胞和各种其它细胞靶标(例如肿瘤细胞)的溶解。fcr由其对免疫球蛋白类别的特异性定义;igg抗体的fc受体称为fcγr,ige的fc受体称为fcεr,iga的fc受体称为fcαr等,并且新生fc受体称为fcrn。fc受体结合描述于例如ravetch,j.v.和kinet,j.p.,《免疫学年鉴(annu.rev.immunol.)》9(1991)457
‑
492;capel,p.j.等人,《免疫方法(immunomethods)》4(1994)25
‑
34;de haas,m.等人,《实验室和临床医学杂志(j lab.clin.med.)》126(1995)330
‑
341;和gessner,j.e.大人,《血液学年鉴(ann.hematol.)》76(1998)231
‑
248中。
[0179]
原生igg抗体的fc结构域交联受体(fcγr)触发广泛多种效应功能,包括吞噬作用、抗体依赖性细胞毒性和炎性介质的释放,以及免疫复合物清除和抗体产生的调节。本文考虑了提供受体(例如fcγr)交联的fc部分。在人类中,迄今已表征三种类别的fcγr,其为:(i)fcγri(cd64),其以高亲和力结合单体igg且在巨噬细胞、单核细胞、嗜中性粒细胞和嗜酸性粒细胞上表达;(ii)fcγrii(cd32),其以中到低亲和力结合复合igg,广泛表达,尤其在白细胞上表达,被认为是抗体介导的免疫的核心参与者,且可分为fcγriia、fcγriib和fcγriic,在免疫系统中执行不同功能,但以相似的低亲和力结合igg
‑
fc,并且这些受体的胞外结构域高度同源;以及(iii)fcγriii(cd16),其以中到低亲和力结合igg并且以两种形式被发现:fcγriiia,其被发现于nk细胞、巨噬细胞、嗜酸性粒细胞和一些单核细胞以及t细胞上,并且被认为介导adcc;和fcγriiib,其在嗜中性粒细胞上高度表达。
[0180]
fcγriia被发现于许多参与杀伤的细胞(例如巨噬细胞、单核细胞、嗜中性粒细胞)上并且似乎能够激活杀伤过程。fcγriib似乎在抑制过程中起作用并且发现于b细胞、巨噬细胞上以及肥大细胞和嗜酸性粒细胞上。重要的是,已显示所有fcγriib中的75%发现于肝脏中(ganesan,l.p.等人,2012:“肝窦内皮上的fcγriib清除小免疫复合物(fcγriib on liver sinusoidal endothelium clears small immune complexes)”,《免疫学杂志(journal of immunology)》189:4981
‑
4988)。fcγriib在称为lsec的肝窦内皮上丰富地表达且在肝脏的库普弗(kupffer)细胞中表达,并且lsec是小免疫复合物清除的主要部位(ganesan,l.p.等人,2012:肝窦内皮上的fcγriib清除小免疫复合物,《免疫学杂志》189:4981
‑
4988)。
[0181]
在一些实施方式中,本文所公开的抗体和其抗原结合片段包含用于结合fcγriib的fc部分,尤其fc区,例如igg型抗体。此外,有可能通过引入突变s267e和l328f工程化fc部分以增强fcγriib结合,如chu,s.y.等人,2008:通过cd19和fcγriib与fc工程化抗体的共接合来抑制b细胞受体介导的原代人b细胞激活(inhibition of b cell receptor
‑
mediated activation of primary human b cells by coengagement of cd19 and fcgammariib with fc
‑
engineered antibodies).《分子免疫学(molecular immunology)》45,3926
‑
3933所描述。从而,可增强免疫复合物的清除(chu,s.等人,2014:xmab7195,一种具有增强的对抑制受体fcγriib的亲和力的fc工程化抗体介导黑猩猩中ige的加速清除(accelerated clearance of ige in chimpanzees is mediated by xmab7195,an fc
‑
engineered antibody with enhanced affinity for inhibitory receptor fcγriib).《美国呼吸和重症监护医学杂志(am j respir crit)》,美国胸腔学会国际会议摘要(american thoracic society international conference abstracts))。在一些实施方式中,本公开的抗体或其抗原结合片段包含具有突变s267e和l328f的工程化fc部分,尤其如chu,s.y.等人,2008:通过cd19和fcγriib与fc工程化抗体的共接合来抑制b细胞受体介导的原代人b细胞激活.《分子免疫学》45,3926
‑
3933所描述。
[0182]
在b细胞上,fcγriib的功能似乎为抑制进一步免疫球蛋白产生和同种型切换为例如ige类别。在巨噬细胞上,认为fcγriib抑制如通过fcγriia介导的吞噬作用。在嗜酸性粒细胞和肥大细胞上,b形式可通过ige与其独立受体结合帮助抑止这些细胞的激活。
[0183]
关于fcγri结合,原生igg中e233
‑
g236、p238、d265、n297、a327和p329中的至少一者的修饰减弱与fcγri的结合。取代到对应位置igg1和igg4中的处于位置233
‑
236处的
igg2残基使igg1和igg4与fcγri的结合减弱103倍,并且消除人单核细胞对抗体敏化红细胞的反应(armour,k.l.等人《欧洲免疫学杂志(eur.j.immunol.)》29(1999)2613
‑
2624)。
[0184]
关于fcγrii结合,发现对fcγriia的结合减弱,例如对于e233
‑
g236、p238、d265、n297、a327、p329、d270、q295、a327、r292和k414中的至少一者的igg突变。
[0185]
人fcγriia的两种等位基因形式为以高亲和力结合igg1 fc的“h131”变体,和以低亲和力结合igg1 fc的“r131”变体。参见例如bruhns等人,《血液(blood)》113:3716
‑
3725(2009)。
[0186]
关于fcγriii结合,发现与fcγriiia的结合减弱,例如对于e233
‑
g236、p238、d265、n297、a327、p329、d270、q295、a327、s239、e269、e293、y296、v303、a327、k338和d376中的至少一者的突变。人igg1上fc受体的结合位点的映射、上文所提及的突变位点和用于测量与fcγri和fcγriia的结合的方法描述于shields,r.l.等人,《生物化学杂志(j.biol.chem.)》276(2001)6591
‑
6604中。
[0187]
人fcγriiia的两种等位基因形式为以低亲和力结合igg1 fc的“f158”变体,和以高亲和力结合igg1 fc的“v158”变体。参见例如bruhns等人,《血液》113:3716
‑
3725(2009)。
[0188]
关于与fcγrii的结合,原生igg fc的两个区似乎参与fcγrii与igg之间的相互作用,即(i)igg fc的下铰链位点,尤其氨基酸残基l、l、g、g(234
‑
237,eu编号),和(ii)igg fc的ch2结构域的相邻区,尤其与下铰链区相邻的上ch2结构域中,例如p331的区中的环和链(wines,b.d.等人,《免疫学杂志》2000;164:5313
‑
5318)。此外,fcγri似乎结合igg fc上的相同位点,而fcrn和蛋白a结合igg fc上的不同位点,其似乎处于ch2
‑
ch3界面(wines,b.d.等人,《免疫学杂志》2000;164:5313
‑
5318)。
[0189]
还考虑提高本公开的fc部分与一(即,一种或多种)fcγ受体的结合亲和力(例如与不包含突变的参考fc部分或含有其的抗体相比)的突变。参见例如delillo和ravetch,《细胞(cell)》161(5):1035
‑
1045(2015)和ahmed等人,《结构生物学杂志(j.struc.biol.)》194(1):78(2016),其fc突变和技术以引用的方式并入本文中。
[0190]
在本文所公开的实施方式中的任一个中,结合蛋白可包含fc部分,其包含选自g236a;s239d;a330l;和i332e的突变;或包含所述突变中的任何两者或更多者的组合;例如s239d/i332e;s239d/a330l/i332e;g236a/s239d/i332e;g236a/a330l/i332e(在本文中也称为“gaalie”);或g236a/s239d/a330l/i332e。在一些实施方式中,fc部分不包含s239d。
[0191]
在某些实施方式中,fc部分可包含参与fcrn结合的fc部分的至少一部分或由其组成。在某些实施方式中,fc部分包含一个或多个氨基酸修饰,其改善对fcrn的结合亲和力(例如增强与其的结合)(例如在约6.0的ph下),并且在一些实施方式中,进而延长包含fc部分的分子的体内半衰期(例如与在其它方面相同但不包含修饰的参考fc部分或抗体相比)。在某些实施方式中,fc部分包含或源自igg fc并且半衰期延长突变包含以下中的任何一者或多者:m428l;n434s;n434h;n434a;n434s;m252y;s254t;t256e;t250q;p257i q311i;d376v;t307a;e380a(eu编号)。在某些实施方式中,半衰期延长突变包含m428l/n434s(在本文中也称为“mlns”)。在某些实施方式中,半衰期延长突变包含m252y/s254t/t256e。在某些实施方式中,半衰期延长突变包含t250q/m428l。在某些实施方式中,半衰期延长突变包含p257i/q311i。在某些实施方式中,半衰期延长突变包含p257i/n434h。在某些实施方式中,半衰期延长突变包含d376v/n434h。在某些实施方式中,半衰期延长突变包含t307a/e380a/
n434a。
[0192]
在一些实施方式中,结合蛋白包括fc部分,其包含取代突变m428l/n434s。在一些实施方式中,结合蛋白包括fc部分,其包含取代突变g236a/a330l/i332e。在某些实施方式中,结合蛋白包括(例如igg)fc部分,其包含g236a突变、a330l突变和i332e突变(gaalie),并且不包含s239d突变(例如在位置239处包含原生s)。在特定实施方式中,结合蛋白包括fc部分,其包含取代突变:m428l/n434s和g236a/a330l/i332e,并且任选地不包含s239d。在某些实施方式中,结合蛋白包括fc部分,其包含取代突变:m428l/n434s和g236a/s239d/a330l/i332e。
[0193]
在某些实施方式中,本公开的结合蛋白包含:根据本文和/或pct公开号2017/060504中的示例性抗hbv抗体(包括抗体hbc34、hbc34
‑
v7、hbc34
‑
v23、hbc34
‑
v31、hbc34
‑
v32、hbc34
‑
v33、hbc34
‑
v34、hbc34
‑
v35,(包括本文所公开的hbc抗体的变体,其包含轻链中位置40处的取代突变(例如原生半胱氨酸被丙氨酸、丝氨酸等取代)以及hbc24)中的任一者的cdr和/或可变结构域和/或重链和/或轻链;以及包含g236a突变、a330l突变和i332e(gaalie)突变的fc部分,其中fc部分任选地进一步包含m428l/n434s(mlns)突变。在某些实施方式中,fc部分不包含s239d。
[0194]
在某些实施方式中,结合蛋白包含:根据seq id no:34的cdrh1氨基酸序列、根据seq id no:35或66的cdrh2氨基酸序列、根据seq id no:36的cdrh3氨基酸序列、根据seq id no:37的cdrl1酸序列、根据seq id no:38或39的cdrl2酸序列和根据seq id no:58或40的cdrl3氨基酸序列;以及包含gaalie突变的fc部分。在某些实施方式中,fc部分不包含s239d突变。在某些实施方式中,fc部分进一步包含mlns突变。
[0195]
在某些实施方式中,结合蛋白包含:根据seq id no:41或67中的任一者的重链可变结构域(vh)氨基酸序列和根据seq id no:42、59、65、89、90和111
‑
120中的任一者的轻链可变结构域(vl)氨基酸序列;以及包含gaalie突变的fc部分。在某些实施方式中,fc部分进一步包含mlns突变。
[0196]
在某些实施方式中,结合蛋白包含根据seq id no:138或91或92的重链氨基酸序列和/或根据seq id no:93或94中的任一者的轻链氨基酸序列。在某些实施方式中,结合蛋白包含根据seq id no:91的重链氨基酸序列和根据seq id no:93的轻链氨基酸序列。在某些实施方式中,结合蛋白包含根据seq id no:91的重链氨基酸序列和根据seq id no:94的轻链氨基酸序列。在某些实施方式中,结合蛋白包含根据seq id no:92的重链氨基酸序列和根据seq id no:93的轻链氨基酸序列。在某些实施方式中,结合蛋白包含根据seq id no:92的重链氨基酸序列和根据seq id no:94的轻链氨基酸序列。
[0197]
在某些实施方式中,结合蛋白包含:根据seq id no:97的cdrh1氨基酸序列、根据seq id no:98的cdrh2氨基酸序列、根据seq id no:99的cdrh3氨基酸序列、根据seq id no:100的cdrl1酸序列、根据seq id no:100的cdrl2酸序列和根据seq id no:102的cdrl3氨基酸序列;以及包含gaalie突变的fc部分。在某些实施方式中,fc部分进一步包含mlns突变。
[0198]
在某些实施方式中,结合蛋白包含:根据seq id no:95的重链可变结构域(vh)氨基酸序列和根据seq id no:96的轻链可变结构域(vh)氨基酸序列;以及包含gaalie突变的fc部分。在某些实施方式中,fc部分进一步包含mlns突变。
[0199]
在本发明所公开的实施方式中的任一个中,本公开的结合蛋白包括包含gaalie突变的fc部分,并且与参考多肽(即包括不包含gaalie突变的fc部分的多肽,其可为结合蛋白)相比,与人fcγriia和/或人fcγriiia的结合增强。
[0200]
在某些实施方式中,参考多肽包括fc部分,其为野生型fc部分(例如相同同种型的),或在取代突变不是或不包含gaalie的条件下,为包含一个或多个取代突变(或插入或缺失)的fc部分。在某些实施方式中,结合蛋白包含具有gaalie突变(和任选的其它取代突变,例如mlns)的hbc34
‑
v35抗体,并且参考多肽是hbc34
‑
v35(包括野生型fc部分)。在某些实施方式中,参考多肽不包含已知或被认为影响与人fcγriia和/或人fcγriiia的结合的取代突变。
[0201]
可使用所属领域中已知的方法确定或检测多肽之间的结合,如fc部分(或包含其的结合蛋白)与人fcγ受体,如人fcγriia、人fcγriiia或人fc fcγriib,或补体蛋白,如c1q之间的结合。举例来说,可根据制造商说明书,使用red96(fortebio,美国加利福尼亚州弗里蒙特(fremont,california usa))进行生物层干涉测量法(bli)分析,以确定所关注的第一多肽(例如包含gaalie突变的hbc34v35)与传感器衬底上捕获的所关注的第二多肽(例如fcγriia(h131)、fcγriia(r131)、fcγriiia(f158)、fcγriiia(v158)或fcγriib)之间的实时缔合和解离。
[0202]
在某些实施方式中,结合蛋白包括包含gaalie突变的fc部分,并且与包括不包含gaalie突变的fc部分的参考多肽相比,与人fcγriia(h131)、人fcγriia(r131)、人fcγriiia(f158)、人fcγriiia(v158)或其任何组合的结合增强。在某些实施方式中,增强的结合通过bli分析中相比于参考结合蛋白的信号偏移增加(例如以下中的一者或多者:较高峰值信号;较大缔合速率;较慢解离速率;较大曲线下面积)而确定。在某些实施方式中,bli分析包含使用octet
(r)
red96(fortebio,美国加利福尼亚州弗里蒙特)仪器。在另外的实施方式中,bli分析包含捕获到抗五标签传感器并且暴露于结合蛋白的加标签的人fcγr。在一些实施方式中,结合蛋白包含igg fab,并且bli分析进一步包含在抗igg fab结合片段的存在下使捕获的人fcγr暴露于结合蛋白以通过fab片段交联结合蛋白。
[0203]
在某些实施方式中,结合蛋白包括包含gaalie突变的fc部分,并且与参考多肽相比,与人fcγriia(h131)、人fcγriia(r131)、人fcγriiia(f158)和/或人fcγriiia(v158)的结合增强,其中增强的结合可包含bli分析中与使用参考结合蛋白观察到的信号偏移相比,大1.5、2、2.5、3倍或更多倍的信号偏移(纳米)。
[0204]
在某些实施方式中,结合蛋白包括包含gaalie突变的fc部分,并且与参考多肽相比,与人fcγriia(h131)、人fcγriia(r131)、人fcγriiia(f158)和人fcγriiia(v158)的结合增强。
[0205]
在本发明所公开的实施方式中的任一个中,结合蛋白包括包含gaalie突变的fc部分,并且与参考多肽相比,与人fcγriib的结合减弱。在某些实施方式中,结合蛋白包括包含gaalie突变的fc部分,并且不结合人fcγriib,如通过例如在bli分析中不存在相比于基线的统计显著信号偏移而确定。
[0206]
在本发明所公开的实施方式中的任一个中,结合蛋白包括包含gaalie突变的fc部分,并且与参考多肽相比,与人c1q(补体蛋白)的结合减弱。在某些实施方式中,结合蛋白包括包含gaalie突变的fc部分,并且不结合人c1q,如通过在bli分析中不存在相比于基线的
统计显著信号偏移而确定。
[0207]
在本发明所公开的实施方式中的任一个中,结合蛋白包括包含gaalie突变的fc部分,并且与参考多肽(即包括不包含gaalie突变的fc部分的多肽,其可为hbsag特异性结合蛋白)相比,更大程度地激活人fcγriia、人fcγriiia或两者。在某些实施方式中,参考多肽包括fc部分,其为野生型fc部分,或在取代突变不是gaalie的条件下,包含一个或多个取代突变。在某些实施方式中,结合蛋白包含具有gaalie突变(和任选的其它取代突变,例如mlns)的hbc34
‑
v35抗体,并且参考多肽是具有野生型fc部分的hbc34
‑
v35。
[0208]
可使用所属领域已知的方法来确定或检测人fcγr的激活。举例来说,充分验证的可商购的生物报告基因分析涉及在稳定表达(i)所关注的fcγr和(ii)处于nfat反应元件的控制下的萤火虫荧光素酶报告基因的jurkat效应细胞(普洛麦格;目录号:g9798)存在下,将hbsag特异性结合蛋白与重组hbsag(安在时,葛兰素史克(glaxosmithkline))一起培育。fc与细胞表面表达的fcγr的结合驱动nfat介导的荧光素酶报告基因的表达。然后根据制造商的说明书,使用bio
‑
glo
‑
tm
荧光素酶分析试剂(普洛麦格)用光度计(例如伯腾)测量发光。通过应用下式,激活表示为超过背景的相对发光单位(rlu)的平均值:(浓度[x]的结合蛋白(例如mab)下的rlu
‑
背景的rlu)。
[0209]
在某些实施方式中,结合蛋白包括包含gaalie突变的fc部分,并且与参考多肽相比,更大程度地激活人fcγriia(h131)、人fcγriia(r131)、人fcγriiia(f158)和/或人fcγriiia(v158)。在某些实施方式中,更大程度的激活是指较高峰值发光和/或较大发光曲线下面积,如使用如本文所描述的发光生物报告基因分析所确定。在某些实施方式中,结合蛋白包括包含gaalie突变的fc部分,并且比参考多肽更大程度地激活人fcγriia(h131)、人fcγriia(r131)和人fcγriiia(f158),其中更大程度的激活包含与使用参考结合蛋白观察到的峰值rlu相比,大1.5、2、2.5、3倍或更多倍的峰值rlu。
[0210]
在本发明所公开的实施方式中的任一个中,包括包含gaalie突变的fc部分的结合蛋白不激活人fcγriib,如在如上文所描述的发光生物报告基因分析中不存在统计显著和/或可测量的rlu而确定。
[0211]
在本发明所公开的实施方式中的任一个中,结合蛋白包括包含gaalie突变的fc部分,并且与参考多肽相比,在hbsag存在下更大程度地激活人自然杀伤(nk)细胞。在某些实施方式中,nk细胞的激活通过cd107a表达(例如通过流式细胞术)确定。在某些实施例中,nk细胞包含包括v158/v158纯合、f158/f158纯合或v158/f158杂合fcγriiia基因型的细胞。
[0212]
应了解,根据本公开包括包含gaalie突变的fc部分的任何结合蛋白可表现或具有本文所描述的特征中的任何一者或多者;例如与参考多肽相比,与人fcγriia和/或人fcγriiia的结合增强;与参考多肽相比,与人fcγriib的结合减弱(和/或不与人fcγriib结合);与参考多肽相比,与人c1q的结合减弱(和/或不与人c1q结合);与参考多肽相比,更大程度地激活fcγriia、人fcγriiia或两者;不激活人fcγriib;和/或与参考多肽(例如对hbsag具特异性且包括不包含gaalie突变的fc部分的抗体)相比,在hbsag存在下更大程度地激活人自然杀伤(nk)细胞。
[0213]
在某些实施方式中,本公开的结合蛋白包括包含突变的fc部分,并且:(i)与包括不包含g236a/a330l/i332e的fc部分的参考多肽相比,与人fcγriia、人fcγriiia或两者的结合增强,其中人fcγriia任选地为h131或r131,和/或人fcγriiia任选地为f158或
v158;(ii)与包括不包含g236a/a330l/i332e的fc部分的参考多肽相比,与人fcγriib的结合减弱;(iii)不结合人fcγriib;(iv)与包括不包含g236a/a330l/i332e的fc部分的参考多肽相比,与人c1q的结合减弱;(v)不结合人c1q;(vi)与包括不包含g236a/a330l/i332e的fc部分的参考多肽相比,更大程度地激活人fcγriia、人fcγriiia或两者,其中人fcγriia任选地为h131或r131,和/或人fcγriiia任选地为f158或v158;(vii)不激活人fcγriib;(viii)与包括不包含g236a/a330l/i332e的fc部分的参考多肽相比,在hbsag存在下更大程度地激活人自然杀伤(nk)细胞,其中参考多肽任选地为结合hb ag的抗体,所述hb ag任选地为hbsag;(ix)hbsag ec
50
为约12.75ng/ml到约19.9ng/ml、或约12.75ng/ml到约12.84ng/ml、或约12.79ng/ml、或约16.22ng/ml到约19.9ng/ml、或约17.97ng/ml,和/或(b)hbeag ec
50
约为约10.78ng/ml到约13.72ng/ml、或约10.78ng/ml到约10.93ng/ml、或约10.85ng/ml、或约11.59ng/ml到约13.72ng/ml、或约12.61ng/ml,其中hbv任选地为hbv基因型d,并且其中ec
50
任选地通过在向hepg2细胞施用抗体或抗原结合片段之后第7天,分别测量过表达ntcp且感染hbv的hepg2细胞分泌的hbsag或hbeag而体外确定;(x)hbsag ec
50
为约10.43ng/ml到约22.41ng/ml、或约13.81ng/ml到约16.56ng/ml、或约15.12ng/ml、或约12.24ng/ml到约22.41ng/ml、或约16.56ng/ml、或约10.43ng/ml到约20.08ng/ml、或约14.47ng/ml,和/或(b)hbeag ec
50
约为约10.39ng/ml到约13.99ng/ml、或约10.63ng/ml到约10.66ng/ml、或约10.64ng/ml、或约10.39ng/ml到约10.60ng/ml、或约10.49ng/ml、或约13.25ng/ml到约13.99ng/ml、或约13.61ng/ml,其中hbv任选地为hbv基因型d,并且其中ec
50
任选地通过在向hepg2细胞施用抗体或抗原结合片段之后第7天,分别测量过表达ntcp且感染hbv的hepg2细胞分泌的hbsag或hbeag而体外确定;(xi)能够结合hbsag变体,其包含hbsag
‑
y100c/p120t、hbsag
‑
p120t、hbsag
‑
p120s/s143l、hbsag
‑
c121s、hbsag
‑
r122d、hbsag
‑
r122i、hbsag
‑
t123n、hbsag
‑
q129h、hbsag
‑
q129l、hbsag
‑
m133h、hbsag
‑
m133l、hbsag
‑
m133t、hbsag
‑
k141e、hbsag
‑
p142s、hbsag
‑
s143k、hbsag
‑
d144a、hbsag
‑
g145r、hbsag
‑
n146a或其任何组合;(xii)与结合hbsag且包括不包含g236a/a330l/i332e的fc部分的参考抗体或抗原结合片段相比,具有与hbsag变体改善的结合,所述变体包含hbsag
‑
y100c/p120t、hbsag
‑
p120t、hbsag
‑
p120s/s143l、hbsag
‑
c121s、hbsag
‑
r122d、hbsag
‑
r122i、hbsag
‑
t123n、hbsag
‑
q129h、hbsag
‑
q129l、hbsag
‑
m133h、hbsag
‑
m133l、hbsag
‑
m133t、hbsag
‑
k141e、hbsag
‑
p142s、hbsag
‑
s143k、hbsag
‑
d144a、hbsag
‑
g145r、hbsag
‑
n146a或其任何组合;和/或(xiii)能够中和(a)基因型a的hbv,ec
50
为约2.34ng/ml;(b)基因型b的hbv,ec
50
为约2.22ng/ml;(c)基因型c的hbv,ec
50
为约0.92ng/ml;(d)基因型d的hbv,ec
50
为约1.10ng/ml;(e)基因型e的hbv,ec
50
为约1.12ng/ml;(f)基因型f的hbv,ec
50
为约1.93ng/ml;(g)基因型g的hbv,ec
50
为约1.43ng/ml;和/或(h)基因型h的hbv,ec
50
为约1.93ng/ml,其中ec
50
任选地使用经工程化以表达hbv基因型的hbsag的重组hdv来确定。
[0214]
可替代地或另外,本公开的结合蛋白的fc部分可包含所属领域中已知的蛋白a结合所需的至少一部分;和/或本公开的抗体的fc部分包含所属领域中已知的蛋白g结合所需的fc分子的至少一部分。在一些实施方式中,保留的功能包含hbsag和hbvg的清除。因此,在某些实施方式中,fc部分包含所属领域中已知的fcγr结合所需的至少一部分。如上所概述,fc部分因此可至少包含(i)原生igg fc的下铰链位点,尤其氨基酸残基l、l、g、g(234
‑
237,eu编号),和(ii)原生igg fc的ch2结构域的相邻区,尤其与下铰链区相邻的上ch2结构
域中的环和链,例如在p331的区中,例如围绕p331的原生igg fc的上ch2结构域中的至少3、4、5、6、7、8、9或10个连续氨基酸(例如在原生igg fc的氨基酸320与340(eu编号)之间)的区。
[0215]
在一些实施方式中,根据本公开的结合蛋白包含fc区。如本文所用,术语“fc区”是指由抗体重链的两个或更多个fc部分形成的免疫球蛋白的部分。举例来说,fc区可以是单体或“单链”fc区(即scfc区)。单链fc区由单一多肽链内连接的fc部分构成(例如在单一连续核酸序列中编码)。示例性scfc区公开于wo 2008/143954 a2中,并且其以引用的方式并入本文中。fc区可以是或包含二聚fc区。“二聚fc区”或“dcfc”是指由两条独立免疫球蛋白重链的fc部分形成的二聚体。二聚fc区可以是两个相同fc部分的同二聚体(例如天然存在的免疫球蛋白的fc区)或两个不相同fc部分的异二聚体(例如二聚fc区的一个fc单体包含至少一个不存在于另一fc单体中的氨基酸修饰(例如取代、缺失、插入或化学修饰),或一个fc单体与另一者相比可截短)。
[0216]
特定实施方式包括具有根据seq id no:91或seq id no:92或seq id no:138的重链(例如vh
‑
铰链
‑
ch1
‑
ch2
‑
ch3)的抗体和抗原结合片段,以及具有根据seq id no:93或seq id no:94的轻链(即vl
‑
cl)的抗体和抗原结合片段。在某些实施方式中,抗体或抗原结合片段包含根据seq id no:91的重链和根据seq id no:93的轻链。在其它实施方式中,抗体或抗原结合片段包含根据seq id no:92的重链和根据seq id no:94的轻链。在其它实施方式中,抗体或抗原结合片段包含根据seq id no:91的重链和根据seq id no:94的轻链。在其它实施方式中,抗体或抗原结合片段包含根据seq id no:92的重链和根据seq id no:93的轻链。在一些实施方式中,抗体或抗原结合片段包含根据seq id no:129的重链或由其组成。在一些实施方式中,抗体或抗原结合片段包含根据seq id no:138的重链,和任选的根据seq id no:93或94中的任一者的轻链或由其组成。这些序列提供于序列表中。
[0217]
本发明所公开的fc部分可包含相同或不同类别和/或子类的fc序列或区。举例来说,fc部分可源自igg1、igg2、igg3或igg4子类的免疫球蛋白(例如人免疫球蛋白),或源自其任何组合。在某些实施方式中,fc区的fc部分为相同类别和子类。然而,fc区(或fc区的一和或多个fc部分)也可以是嵌合的,从而嵌合fc区可包含源自不同免疫球蛋白类别和/或子类的fc部分。举例来说,二聚或单链fc区的fc部分中的至少两者可来自不同免疫球蛋白类别和/或子类。在某些实施方式中,二聚fc区可包含来自两种或更多种不同同种型或子类的序列;例如seed体(“链交换工程化结构域(strand
‑
exchange engineered domain)”),参见davis等人,《蛋白质工程设计与选择》23(4):195(2010)。
[0218]
另外地或可替代地,嵌合fc区可包含一个或多个嵌合fc部分。举例来说,嵌合fc区或部分可包含一个或多个源自第一子类(例如igg1、igg2或igg3子类)的免疫球蛋白的部分,而fc区或部分的其余部分为不同子类。举例来说,fc多肽的fc区或部分可包含源自第一子类(例如igg1、igg2或igg4子类)的免疫球蛋白的ch2和/或ch3结构域和来自第二子类(例如igg3子类)的免疫球蛋白的铰链区。举例来说,fc区或部分可包含源自第一子类(例如igg4子类)的免疫球蛋白的铰链和/或ch2结构域和来自第二子类(例如igg1、igg2或igg3子类)的免疫球蛋白的ch3结构域。举例来说,嵌合fc区可包含来自第一子类(例如igg4子类)的免疫球蛋白的fc部分(例如完整fc部分)和来自第二子类(例如igg1、igg2或igg3子类)的免疫球蛋白的fc部分。举例来说,fc区或部分可包含来自igg4免疫球蛋白的ch2结构域和来
自igg1免疫球蛋白的ch3结构域。举例来说,fc区或部分可包含来自igg4分子的ch1结构域和ch2结构域以及来自igg1分子的ch3结构域。举例来说,fc区或部分可包含来自特定抗体子类的ch2结构域的一部分,例如ch2结构域的eu位置292
‑
340。举例来说,fc区或部分可包含源自igg4部分ch2的氨基酸位置292
‑
340和源自igg1部分的ch2的其余部分(可替代地,ch2的292
‑
340可源自igg1部分并且ch2的其余部分源自igg4部分)。
[0219]
还应了解,本公开的任何抗体、抗原结合片段或fc区或部分可为任何同种异型和/或单倍型。举例来说,人免疫球蛋白g同种异型包括jefferis和lefranc,《单抗》1(4):1
‑
7(2009)中公开的那些,所述同种异型(包括g1m(1(a);2(x);3(f);和17(z));g2m(23(n));g3m(21(g1);28(g5);11(b0);5(b2);13(b3);14(b4);10(b5);15(s);16(t);6(c3);24(c5);26(u);和27(v));a2m(1和2);和km(1;2;和3)和单倍型,和所得氨基酸序列以及其组合以引用的方式并入本文中。在某些实施方式中,本公开的抗体、抗原结合片段或fc区或部分包含igg1同种异型g1m17,k1。
[0220]
此外,fc区或部分可(另外地或可替代地)例如包含嵌合铰链区。举例来说,嵌合铰链可例如部分源自igg1、igg2或igg4分子(例如上和下中间铰链序列),并且部分源自igg3分子(例如中间铰链序列)。在另一实例中,fc区或部分可包含部分源自igg1分子并且部分源自igg4分子的嵌合铰链。在另一实例中,嵌合铰链可包含来自igg4分子的上和下铰链结构域以及来自igg1分子的中间铰链结构域。这类嵌合铰链可例如通过在igg4铰链区的中间铰链结构域中eu位置228处引入脯氨酸取代(ser228pro)而制得。在另一实施例中,嵌合铰链可包含eu位置233
‑
236处的氨基酸来自igg2抗体和/或ser228pro突变,其中铰链的剩余氨基酸来自igg4抗体(例如序列eskygppcppcpappvagp的嵌合铰链)。可用于根据本公开的抗体的fc部分中的其它嵌合铰链描述于us 2005/0163783 a1中。
[0221]
在本文所公开的结合蛋白的一些实施方式中,fc部分或fc区包含源自人免疫球蛋白序列(例如源自来自人igg分子的fc区或fc部分)的氨基酸序列或由其组成。然而,多肽可包含来自另一哺乳动物物种的一个或多个氨基酸。举例来说,灵长类动物fc部分或灵长类动物结合位点可包括于本发明多肽中。可替代地,一个或多个鼠类氨基酸可存在于fc部分或fc区中。
[0222]
核酸分子
[0223]
在另一方面,本公开提供一种核酸分子,其包含编码根据本公开的抗体、抗原结合片段或融合蛋白的多核苷酸。
[0224]
表4显示根据本公开的示例性v
h
、v
l
、ch、cl、hc和lc编码核苷酸序列:
[0225]
[0226]
[0227]
[0228]
[0229]
[0230][0231]
归因于遗传密码的冗余,本公开还包含这些核酸序列的序列变体,并且尤其包含编码相同氨基酸序列的此类序列变体。
[0232]
在某些实施方式中,多核苷酸或核酸分子包含与根据seq id no:103
‑
110和130
‑
136中的任一者的核苷酸序列共有至少80%同一性的核苷酸序列,其中核苷酸序列经密码子优化以由宿主细胞表达。
[0233]
在特定实施方式中,根据本公开的核酸分子包含根据seq id no:103
‑
110和130
‑
136中的任一者的核酸序列或由其组成。
[0234]
在某些实施方式中,多核苷酸包含根据seq id no:103的v
h
编码核苷酸序列和根据seq id no:105的v
l
编码核苷酸序列。在其它实施方式中,多核苷酸包含根据seq id no:103的v
h
编码核苷酸序列和根据seq id no:104的v
l
编码核苷酸序列。在其它实施方式中,多核苷酸包含根据seq id no:108的v
h
编码核苷酸序列和根据seq id no:109的v
l
编码核苷酸序列。
[0235]
本文还提供编码抗体或抗原结合片段的多核苷酸,其中所述多核苷酸包含根据seq id no:103的v
h
编码核苷酸序列和根据seq id no:110的v
l
编码核苷酸序列或由其组成,其中所编码的抗体或抗原结合片段结合hbsag的抗原环区并且中和乙型肝炎病毒和丁型肝炎病毒感染。
[0236]
在本发明所公开的实施方式中的任一个中,多核苷酸可包含根据seq id no:130的ch1
‑
铰链
‑
ch2
‑
ch3编码核苷酸序列,和/或根据seq id no:131的hc(vh
‑
ch1
‑
铰链
‑
ch3
‑
ch3)编码核苷酸序列。在一些实施方式中,多核苷酸包含根据seq id no:132的cl编码核苷酸序列和/或包含根据seq id no:133的lc(vl
‑
cl)编码核苷酸序列。在其它实施例中,多核苷酸包含根据seq id no:134的cl编码核苷酸序列和/或包含根据seq id no:135或seq id no:136的lc(vl
‑
cl)编码核苷酸序列。
[0237]
载体
[0238]
本公开的范围内进一步包括载体,例如表达载体,其包含根据本公开的核酸分子。
[0239]
术语“载体”是指包含核酸分子的构建体。在本公开的上下文中的载体适合于并入或携带所需核酸序列。此类载体可以是存储载体、表达载体、克隆载体、转移载体等。存储载体是允许方便地存储核酸分子的载体。因此,载体可包含对应于例如根据本说明书的所需抗体或其抗体片段的序列。
[0240]
如本文所用,“表达载体”是指含有核酸分子的dna构建体,所述核酸分子可操作地连接到能够实现核酸分子在合适宿主中表达的合适控制序列。此类控制序列包括影响转录的启动子(例如异源启动子)、控制此类转录的任选的操纵序列、编码合适mrna核糖体结合
位点的序列和控制转录与翻译终止的序列。促成所关注的核酸分子转录的表达载体的任一个元件可与载体异源。载体可以是质粒、噬菌体颗粒、病毒或仅仅是潜在基因组插入物。在载体转化到适合宿主中后,其可独立于宿主基因组复制和作用,或在一些情况下,其可整合至基因组本身中。在本说明书中,“质粒”、“表达质粒”、“病毒”和“载体”通常可互换地使用。
[0241]
克隆载体典型地为含有克隆位点的载体,其可用于将核酸序列并入到载体中。克隆载体可以是例如质粒载体或噬菌体载体。
[0242]
转移载体可以是适合于将核酸分子转移到细胞或生物体中的载体,例如病毒载体。在本公开的上下文中,载体可以是例如rna载体或dna载体。载体可以是dna分子。举例来说,本技术意义上的载体包含克隆位点、选择标记(如抗生素耐药因子)和适合于载体倍增的序列(如复制起点)。在一些实施方式中,本技术的上下文中的载体是质粒载体。在某些此类实施方式中,载体包含慢病毒载体或逆转录病毒载体。
[0243]
细胞
[0244]
在另一方面,本公开还提供一种细胞(也称为“宿主细胞”),其表达根据本公开的抗体、抗原结合片段或融合蛋白;或包含根据本公开的载体或多核苷酸。
[0245]
此类细胞的实例包括但不限于真核细胞,例如酵母细胞、动物细胞、昆虫细胞、植物细胞;和原核细胞,包括大肠杆菌(e.coli)。在一些实施例中,细胞是哺乳动物细胞。在某些此类实施例中,细胞是哺乳动物细胞系,如cho细胞(例如dhfr
‑
cho细胞(urlaub等人,《美国国家科学院院刊(pnas)》77:4216(1980),cho
‑
ksv)、人胚肾细胞(例如hek293t细胞)、per.c6细胞、y0细胞、sp2/0细胞、ns0细胞、人肝细胞(例如hepa rg细胞)骨髓瘤细胞或杂交瘤细胞。哺乳动物宿主细胞系的其它实例包括小鼠塞尔托利氏细胞(sertoli cell)(例如tm4细胞);由sv40转化的猴肾cv1细胞系(cos
‑
7);幼仓鼠肾细胞(bhk);非洲绿猴肾细胞(vero
‑
76);猴肾细胞(cv1);人宫颈癌细胞(hela);人肺细胞(w138);人肝细胞(hep g2);犬肾细胞(mdck;水牛鼠肝细胞(brl 3a);小鼠乳腺肿瘤(mmt 060562);tri细胞;mrc 5细胞;以及fs4细胞。适合于抗体产生的哺乳动物宿主细胞系还包括例如yazaki和wu,《分子生物学方法(methods in molecular biology)》,第248卷(b.k.c.lo编,新泽西州特图瓦市胡马纳出版社(humana press,totowa,n.j.)),第255
‑
268页(2003)中描述的那些。
[0246]
在某些实施方式中,宿主细胞是原核细胞,如大肠杆菌。肽在如大肠杆菌的原核细胞中的表达充分确立(参见例如pluckthun,a.《生物/技术(bio/technology)》9:545
‑
551(1991)。举例来说,抗体可以在细菌中产生,确切地说,当不需要糖基化和fc效应功能时。对于抗体片段和多肽在细菌中的表达,参见例如美国专利号5,648,237;5,789,199;和5,840,523。
[0247]
可用于表达本公开的结合蛋白的昆虫细胞是所属领域已知的,并且包括例如草地贪夜蛾(spodoptera frugipera)sf9细胞、粉纹夜蛾(trichoplusia ni)bti
‑
tn5b1
‑
4细胞和草地贪夜蛾sfswt01“mimic
tm”细胞。参见例如palmberger等人,《生物技术杂志(j.biotechnol.)》153(3
‑
4):160
‑
166(2011)。已经鉴别出许多杆状病毒株,其可与昆虫细胞结合使用,确切地说,用于转染草地贪夜蛾细胞。
[0248]
真核微生物(如丝状真菌或酵母)也是用于克隆或表达蛋白质编码载体的合适宿主,并且包括具有“人源化”糖基化路径的真菌和酵母菌株,产生具有部分或完全人糖基化型态的抗体。参见gerngross,《自然
·
生物技术》22:1409
‑
1414(2004);li等人,《自然
·
生
物技术》24:210
‑
215(2006)。
[0249]
植物细胞也可用作表达本公开的结合蛋白的宿主。举例来说,plantibodies
tm
技术(描述于例如美国专利号5,959,177;6,040,498;6,420,548;7,125,978;和6,417,429中)采用转基因植物来产生抗体。
[0250]
在一些实施方式中,融合蛋白由免疫细胞,例如t细胞、nk细胞或nk
‑
t细胞或其任何亚型在细胞表面表达。
[0251]
与本公开相容的任何蛋白质表达系统均可用于产生所公开的结合蛋白。合适的表达系统包括《基因表达系统(gene expression systems)》,学术出版社,fernandez等人编,1999中描述的转基因动物。
[0252]
在特定实施方式中,可用根据本说明书的载体以表达载体转染细胞。术语“转染”是指将核酸分子,如dna或rna(例如mrna)分子引入到细胞,如真核细胞中。在本说明书的上下文中,术语“转染”涵盖技术人员已知的用于将核酸分子引入到细胞,如真核细胞,包括哺乳动物细胞中的任何方法。此类方法涵盖例如电穿孔、脂转染(例如基于阳离子脂质和/或脂质体)、磷酸钙沉淀、基于纳米颗粒的转染、基于病毒的转染或基于阳离子聚合物(如deae
‑
葡聚糖或聚乙烯亚胺等)的转染。在某些实施方式中,引入是非病毒引入。
[0253]
此外,根据本说明书,本公开的细胞可用根据本说明书的载体(例如用于表达抗体或其抗原结合片段)稳定或瞬时转染。在此类实施方式中,用如本文所描述的编码结合蛋白的载体稳定转染细胞。可替代地,可用根据本公开的编码根据本说明书的结合蛋白的载体瞬时转染细胞。在本发明所公开的实施方式中的任一个中,多核苷酸可以是宿主细胞异源的。
[0254]
在相关方面,本公开提供用于产生抗体、抗原结合片段或融合蛋白的方法,其中所述方法包括在足以产生抗体、抗原结合片段或融合蛋白的条件下培养本公开的宿主细胞,并且持续足以产生抗体、抗原结合片段或融合蛋白的时间。
[0255]
因此,本公开还提供异源表达本公开的抗体、抗原结合片段或融合蛋白的重组宿主细胞。举例来说,细胞可以是与完全或部分获得抗体的物种不同的物种(例如表达人抗体或工程化人抗体的cho细胞)。在一些实施方式中,宿主细胞的细胞类型在自然界中不表达所述抗体或抗原结合片段。此外,宿主细胞可将翻译后修饰(ptm;例如糖基化或岩藻糖基化)赋予抗体或抗原结合片段,所述修饰不存于抗体或抗原结合片段的原生状态(或工程化或产生抗体或抗原结合片段的亲本抗体的原生状态)中。此类ptm可引起功能差异(例如降低的免疫原性)。因此,由如本文所公开的宿主细胞产生的本公开的抗体或抗原结合片段可包括一种或多种翻译后修饰,其不同于呈原生状态的抗体(例如由cho细胞产生的人抗体可包含较多翻译后修饰,其不同于从人分离和/或由原生人b细胞或浆细胞产生的抗体。
[0256]
抗体、抗原结合片段或融合蛋白的任选的额外特征
[0257]
本公开的抗体、抗原结合片段和融合蛋白可例如与用于递送到治疗部位的药物偶联或与可检测标记偶联以便于包含所关注细胞的部位的成像。将抗体与药物和可检测标记偶联的方法在所属领域中众所周知,使用可检测标记成像的方法也是如此。标记的抗体可用于广泛多种分析,所述分析采用广泛多种标记。可通过将可检测物质连接到抗体来便于本公开的抗体(或抗原结合片段或融合蛋白)与hbsag,尤其hbsag的抗原环区上所关注的表位之间抗体
‑
抗原复合物形成的检测。合适的检测手段包括使用标记,如放射性核素、酶、辅
酶、荧光剂、化学发光剂、色原、酶底物或辅因子、酶抑制剂、辅基复合物、自由基、颗粒、染料等。合适的酶的实例包括辣根过氧化物酶、碱性磷酸酶、β
‑
半乳糖苷酶或乙酰胆碱酯酶;合适的辅基复合物的实例包括链酶亲和素/生物素和抗生物素蛋白/生物素;合适的荧光材料的实例包括伞酮、荧光素、异硫氰酸荧光素、罗丹明(rhodamine)、二氯三嗪基胺荧光素、丹磺酰氯或藻红素;发光材料的实例是鲁米诺(luminol);生物发光材料的实例包括荧光素酶、荧光素和水母发光蛋白;以及合适的放射性材料的实例包括125i、131i、35s或3h。此类标记的试剂可用于多种众所周知的分析,如放射免疫分析、酶免疫分析(例如elisa)、荧光免疫分析等。因此,根据本公开的标记的抗体、抗原结合片段和融合蛋白可用于此类分析,例如us 3,766,162;us 3,791,932;us 3,817,837;和us4,233,402中所描述。
[0258]
根据本公开的抗体、抗原结合片段或融合蛋白可缀合到治疗性部分,如细胞毒素、治疗剂或放射性金属离子或放射性同位素。放射性同位素的实例包括但不限于i
‑
131、i
‑
123、i
‑
125、y
‑
90、re
‑
188、re
‑
186、at
‑
211、cu
‑
67、bi
‑
212、bi
‑
213、pd
‑
109、tc
‑
99、in
‑
111等。此类抗体缀合物可用于修饰给定生物反应;药物部分不应理解为限于经典的化学治疗剂。举例来说,药物部分可以是具有所需生物活性的蛋白质或多肽。此类蛋白质可包括例如毒素,如相思子毒素、蓖麻毒素a、假单胞菌外毒素或白喉毒素。
[0259]
将此类治疗性部分缀合到抗体的技术是众所周知的。参见例如arnon等人(1985)“用于癌症疗法中药物免疫靶向的单克隆抗体(monoclonal antibodies for immunotargeting of drugs in cancer therapy)”,在《单克隆抗体和癌症疗法(monoclonal antibodies and cancer therapy)》,reisfeld等人编(alan r.liss,inc.),第243
‑
256页中;hellstrom等人编(1987)“用于药物递送的抗体(antibodies for drug delivery)”,在《受控药物递送(controlled drug delivery)》,robinson等人编(第2版;marcel dekker,inc.),第623
‑
653页中;thorpe(1985)“癌症疗法中细胞毒性剂的抗体载体(antibody carriers of cytotoxic agents in cancer therapy:a review)”,在《单克隆抗体'84:生物和临床应用(monoclonal antibodies'84:biological and clinical applications)》,pinchera等人编第475
‑
506页(editrice kurtis,意大利米兰(milano,italy),1985)中;“放射性标记抗体在癌症疗法中的治疗用途的分析、结果和未来前景(analysis,results,and future prospective of the therapeutic use of radiolabeled antibody in cancer therapy)”,在《用于癌症检测和疗法的单克隆抗体(monoclonal antibodies for cancer detection and therapy)》,baldwin等人编(学术出版社,纽约,1985),第303
‑
316页中;以及thorpe等人(1982)《免疫学评论(immunol.rev.)》62:119
‑
158。
[0260]
可替代地,抗体、抗体片段或融合蛋白可缀合到第二抗体或其抗体片段(或第二融合蛋白)以形成如us 4,676,980中所描述的异缀合物。另外,可在标记与本说明书的抗体之间使用接头,例如如us 4,831,175中所描述的。抗体、抗原结合片段和融合蛋白可直接标记有放射性碘、铟、钇或所属领域中已知的其它放射性粒子,例如如us 5,595,721中所描述的。治疗可由用同时或随后施用的缀合和非缀合抗体、抗原结合片段和/或融合蛋白治疗的组合组成,例如如wo00/52031;wo00/52473中所描述的。
[0261]
如本文所描述的抗体、抗原结合片段和融合蛋白还可连接到固体支持物。另外,本公开的抗体、其功能抗体片段或融合蛋白可通过共价缀合到聚合物进行化学修饰,以例如
延长其循环半衰期。聚合物的实例和将其连接到肽的方法显示于us 4,766,106;us 4,179,337;us 4,495,285和us 4,609,546中。在一些实施方式中,聚合物可选自聚氧乙烯化多元醇和聚乙二醇(peg)。peg在室温下可溶于水且具有通式:r(o
‑
ch2‑
ch2)
n
o
‑
r,其中r可以是氢或保护基,如烷基或烷醇基。在某些实施方式中,保护基可具有1个与8个之间的碳。举例来说,保护基可以是甲基。符号n为正整数。在一个实施方式中,n在1与1,000之间。在另一实施方式中,n在2与500之间。在一些实施例中,peg的平均分子量选自1,000与40,000之间、2,000与20,000之间和3,000与12,000之间。此外,peg可具有至少一个羟基,例如peg可具有末端羟基。举例来说,其为被激活以与抑制剂上的游离氨基反应的末端羟基。然而,应理解,可改变反应性基团的类型和量以实现本说明书的共价缀合peg/抗体。
[0262]
水溶性聚氧乙烯化多元醇也可在本文所描述的抗体和抗原结合片段的情形下使用。其包括聚氧乙烯化山梨糖醇、聚氧乙烯化葡萄糖、聚氧乙烯化甘油(pog)等。在一个实施方式中,使用pog。不受任何理论束缚,因为聚氧乙烯化甘油的甘油主链是例如动物和人中甘油单酯、甘油二酯和甘油三酯中天然存在的相同主链,所以这一分支在身体中不一定被视为外来剂。pog的分子量可与peg的分子量处于相同范围内。可用于延长循环半衰期的另一药物递送系统是脂质体。制备脂质体递送系统的方法是所属领域的技术人员已知的。其它药物递送系统是所属领域中已知的,并且描述于例如poznansky等人(1980)和poznansky(1984)中的参考。
[0263]
本公开的抗体、抗原结合片段和融合蛋白可以纯化形式提供。典型地,抗体、结合片段或融合蛋白将存在于基本上不含其它多肽的组合物中,例如其中小于90%(按重量计),通常小于60%并且更通常小于50%的组合物由其它多肽构成。
[0264]
本公开的抗体、融合蛋白或抗原结合片段可在非人(或异源)宿主,例如小鼠中具有免疫原性。特别地,抗体、抗原结合片段或融合蛋白可具有在非人宿主中具有免疫原性,但不在人宿主中具有免疫原性的独特位。特别地,供人使用的本公开的此类分子包括无法容易地从如小鼠、山羊、兔、大鼠、非灵长类哺乳动物等的宿主分离,并且一般无法通过人源化或从异种小鼠获得的分子。
[0265]
抗体、抗原结合片段和融合蛋白的产生
[0266]
根据本公开的抗体、抗原结合片段和融合蛋白可通过所属领域中已知的任何方法制备。举例来说,使用杂交瘤技术制备单克隆抗体的一般方法是众所周知的(kohler,g.和milstein,c.,1975;kozbar等人1983)。在一个实施方式中,使用wo2004/076677中所描述的替代ebv永生化方法。
[0267]
在一个实施方式中,使用wo 2004/076677中所描述的方法产生抗体。在此类方法中,产生抗体的b细胞经ebv和单克隆b细胞激活剂转化。在转化步骤期间可任选地添加细胞生长和分化的额外刺激剂以进一步提高效率。这些刺激剂可以是细胞因子,如il
‑
2和il
‑
15。在一个方面,在永生化步骤期间添加il
‑
2以进一步改善不朽化效率,但其使用并非必需。然后可使用所属领域中已知的方法培养使用这些方法产生的永生化b细胞,并且从其中分离抗体。
[0268]
用于产生抗体的另一方法描述于wo 2010/046775中。在此类方法中,将浆细胞以有限数量或作为单一浆细胞在微孔培养板中培养。可从浆细胞培养物中分离抗体。此外,可从浆细胞培养物提取rna,并且可使用所属领域中已知的方法进行pcr。抗体的vh和vl区可
通过rt
‑
pcr(逆转录酶pcr)扩增,测序并克隆到表达载体中,表达载体接着转染到hek293t细胞或其它宿主细胞中。核酸在表达载体中的克隆、宿主细胞转染、经转染宿主细胞的培养和产生的抗体的分离可使用所属领域的技术人员已知的任何方法进行。
[0269]
如果需要,可使用过滤、离心和各种色谱方法(如fplc或亲和色谱)进一步纯化抗体。纯化抗体(例如单克隆抗体)的技术,包括用于产生药物级抗体的技术是所属领域中众所周知的。
[0270]
分子生物学的标准技术可用于制备编码本说明书的抗体、抗体片段或融合蛋白的dna序列。可以使用寡核苷酸合成技术完全或部分合成所需dna序列。可适当地使用定点诱变和聚合酶链反应(pcr)技术。
[0271]
任何适合的宿主细胞/载体系统均可用于表达编码本公开的抗体或融合蛋白分子或其片段的dna序列。细菌(例如大肠杆菌)和其它微生物系统可部分用于表达抗体片段,如fab和f(ab')2片段,并且尤其fv片段和单链抗体片段,例如单链fv。真核(例如哺乳动物)宿主细胞表达系统可用于产生较大抗体分子,包括完整抗体分子。合适的哺乳动物宿主细胞包括但不限于本文所公开的那些示例性宿主细胞和细胞系。
[0272]
本公开还提供一种用于产生根据本公开的抗体、抗原结合片段或融合蛋白分子的方法,其包括在适合于从编码本说明书的抗体分子的dna表达蛋白质的条件下培养包含编码本公开的核酸的载体的宿主细胞,并且分离抗体分子。
[0273]
抗体分子或抗体片段可仅包含重链或轻链多肽,在这种情况下,仅需要使用重链或轻链多肽编码的序列来转染宿主细胞。为了产生包含重链和轻链两者的产物,细胞系可用两种载体转染,第一载体编码轻链多肽,并且第二载体编码重链多肽。可替代地,可使用单一载体,所述载体包括编码轻链和重链多肽的序列。
[0274]
可替代地,根据本公开的抗体、抗原结合片段和融合蛋白可通过以下产生:(i)在宿主细胞中表达根据本公开的核酸序列,例如通过使用根据本说明书的载体,和(ii)分离表达的所需产物。另外,所述方法可包括(iii)纯化分离的抗体、抗原结合片段或融合蛋白。可筛选产生具有所需特异性或功能的抗体、抗原结合片段或融合蛋白的经转化的b细胞和经培养的浆细胞。
[0275]
可通过任何免疫分析(例如elisa)、通过组织或细胞(包括经转染的细胞)的染色、通过中和分析或通过所属领域中已知的用于鉴别所需特异性或功能的多种其它方法之一进行筛选。分析可基于对一种或多种抗原的简单识别来选择,或可另外基于所需功能来选择,例如选择中和抗体而非仅仅抗原结合抗体,选择可改变靶向细胞的特征的抗体,靶向细胞的特征如其信号级联、其形状、其生长速率、其影响其它细胞的能力、其对其它细胞或其它试剂或条件变化的影响的反应、其分化状态等。
[0276]
然后可从阳性转化的b细胞培养物产生个别转化的b细胞克隆。用于从阳性细胞混合物中分离个别克隆的克隆步骤可使用有限稀释、显微操纵、通过细胞分选的单细胞沉积或所属领域中已知的另一方法进行。
[0277]
可使用所属领域中已知的方法在hek293t细胞或其它已知的宿主细胞中分离、克隆和表达来自经培养的浆细胞的核酸。
[0278]
本文所描述的永生化b细胞克隆或经转染的宿主细胞可以多种方式使用,例如作为单克隆抗体的来源、作为编码所关注的单克隆抗体的核酸(dna或mrna)的来源、用于研究
等。
[0279]
药物组合物
[0280]
本公开还提供一种药物组合物,其包含根据本公开的抗体、抗原结合片段或融合蛋白、根据本公开的核酸、根据本公开的载体和/或根据本公开的细胞。
[0281]
药物组合物还可含有药学上可接受的载剂、稀释剂和/或赋形剂。尽管载剂或赋形剂可使施用便利,但其自身不应诱导对接受组合物的个体有害的抗体产生。其也不应具有毒性。合适的载剂可以是大的、代谢缓慢的大分子,如蛋白质、多肽、脂质体、多糖、聚乳酸、聚乙醇酸、聚合氨基酸、氨基酸共聚物和无活性病毒颗粒。一般来说,根据本公开的药物组合物中的药学上可接受的载剂可以是活性组分或非活性组分。
[0282]
可使用药学上可接受的盐,例如无机酸盐,如盐酸盐、氢溴酸盐、磷酸盐和硫酸盐,或有机酸盐,如乙酸盐、丙酸盐、丙二酸盐和苯甲酸盐。
[0283]
药物组合物中的药学上可接受的载剂可另外含有液体,如水、盐水、甘油和乙醇。另外,此类组合物中可存在辅助物质,如润湿剂或乳化剂或ph缓冲物质。此类载剂使药物组合物能够配制成片剂、丸剂、糖衣丸、胶囊、液体、凝胶、糖浆、浆液和悬浮液,供受试者摄取。
[0284]
本公开的药物组合物可以各种形式制备。举例来说,组合物可制备为注射剂,作为液体溶液或悬浮液。还可制备适合于在注射之前溶解或悬浮在液体媒剂中的固体形式(例如冻干组合物,类似于synagis
tm
和herceptin
tm
,用于含有防腐剂的无菌水复原)。可制备用于局部施用的组合物,例如呈软膏、乳膏或粉末形式。组合物可制备用于口服施用,例如呈片剂或胶囊形式、呈喷雾剂形式、或呈糖浆(任选地调味)形式。组合物可制备用于肺部施用,例如呈使用细粉或喷雾剂的吸入器形式。组合物可制备为栓剂或子宫托。组合物可制备用于鼻、耳或眼部施用,例如呈滴剂形式。组合物可呈试剂盒形式,其设计成使得组合的组合物恰好在向受试者施用之前复原。举例来说,冻干抗体可以具有无菌水或无菌缓冲液的试剂盒形式提供。
[0285]
在特定实施方式中,根据本公开的组合物中的活性成分为抗体分子、抗体片段或其变体或衍生物,确切地说,组合物中的活性成分为如本文所描述的抗体、抗体片段、融合蛋白或其变体和衍生物。因此,其可易于在胃肠道中降解。因此,如果组合物通过使用胃肠道的途径施用,则组合物可含有保护抗体免于降解但在抗体已经从胃肠道吸收后释放抗体的试剂。
[0286]
药学上可接受的载剂的充分论述可在gennaro(2000)《雷明顿:药学科学和实践(remington:the science and practice of pharmacy)》,第20版,isbn:0683306472中获得。
[0287]
本公开的药物组合物可具有在5.5与8.5之间的ph,并且在一些实施方式中,其可在6与8之间。在其它实施方式中,如本文所描述的药物组合物的ph可为约7。ph可通过使用缓冲液维持。组合物可为无菌和/或无热原质的。组合物可相对于人等渗。在某些实施例中,本公开的药物组合物在密封容器中供应。
[0288]
在本公开的范围内,组合物以若干施用形式存在;所述形式包括但不限于适合于例如通过注射或输注,例如通过推注或连续输注肠胃外施用的那些形式。当产品用于注射或输注时,其可在油性或水性媒剂中采取悬浮液、溶液或乳液的形式,并且其可含有配制剂,如悬浮剂、防腐剂、稳定剂和/或分散剂。可替代地,抗体分子可呈干燥形式,用于在使用
之前用适当无菌液体复原。媒剂典型地理解为适合于存储、运输和/或施用化合物,如药学活性化合物,尤其根据本说明书的抗体的材料。举例来说,媒剂可以是生理学上可接受的液体,其适合于存储、运输和/或施用药学活性化合物,尤其根据本说明书的抗体。一旦配制,本公开的组合物可直接施用于受试者。在一个实施方式中,组合物适用于向哺乳动物,例如人受试者施用。
[0289]
本文所描述的药物组合物可通过任何数量的途径施用,包括但不限于口服、静脉内、肌肉内、动脉内、髓内、腹膜内、鞘内、心室内、透皮、经皮、局部、皮下、鼻内、肠内、舌下、阴道内或直肠途径。也可使用无针注射器来施用本说明书的药物组合物。在具体实施方式中,药物组合物可制备用于口服施用(例如呈片剂、胶囊等形式)、用于局部施用或作为注射剂(例如呈液体溶液或悬浮液形式)。还可利用适合于在注射之前溶解或悬浮在液体媒剂中的固体形式,例如药物组合物呈冻干形式。
[0290]
对于注射,例如静脉内、皮肤或皮下注射,或在病痛部位注射,活性成分可以无热原质并且具有合适ph、等渗性和稳定性的肠胃外可接受水溶液的形式提供。视需要,可包括防腐剂、稳定剂、缓冲剂、抗氧化剂和/或其它添加剂。
[0291]
无论是待给予个体的多肽、肽或核酸分子、细胞,还是根据本公开的其它药学适用的化合物,施用一般以“防治有效量”或“治疗有效量”或“有效量”(视具体情况)进行,这足以显示对个体的益处(例如临床结果改善;与疾病相关的症状减轻或缓解;症状发生率较低;生活质量提高;较长的无疾病状态;疾病程度减弱;疾病状态稳定化;疾病进展延迟;缓解;存活;或以统计显著方式延长的存活)。实际施用量和施用速率和时程将取决于所治疗疾病的性质和严重程度。对于注射,根据本公开的药物组合物可例如在预填充注射器中提供。
[0292]
如本文所公开的药物组合物还可以任何口服可接受剂型口服施用,包括但不限于胶囊、片剂、水性悬浮液或溶液。在口服使用的片剂的情况下,常用载剂包括乳糖和玉米淀粉。典型地还添加润滑剂,如硬脂酸镁。对于以胶囊形式口服施用,适用的稀释剂包括乳糖和干燥玉米淀粉。当水性悬浮液需要口服使用时,将活性成分(即如上文所定义的本发明转运体负荷缀合分子)与乳化剂和悬浮剂组合。如果需要,还可添加某些甜味剂、调味剂或着色剂。
[0293]
根据本说明书的药物组合物也可以局部施加,尤其是当治疗靶标包括通过局部施用可容易接近的区域或器官时,例如包括皮肤或任何其它可接近的上皮组织的疾病。容易制备适用于这些区域或器官中的每一个的局部配制物。对于局部施用,药物组合物可配制于合适软膏中,其含有悬浮或溶解于一种或多种载剂中的本发明药物组合物,尤其是其如上文所定义的组分。用于局部施用的载剂包括但不限于矿物油、液体矿脂、白矿脂、丙二醇、聚氧乙烯、聚氧丙烯化合物、乳化蜡和水。可替代地,药物组合物可配制于合适洗剂或乳膏中。在本说明书的上下文中,合适的载剂包括但不限于矿物油、脱水山梨糖醇单硬脂酸酯、聚山梨醇酯60、鲸蜡酯蜡、鲸蜡硬脂醇、2
‑
辛基十二烷醇、苯甲醇和水。
[0294]
剂量可相对于体重表示。因此,表示为[g、mg或其它单位]/kg(或g、mg等)的剂量通常是指每kg(或g、mg等)体重[g、mg或其它单位],即使术语“体重”未明确提及。
[0295]
在具体实施方式中,在单次剂量,例如每日、每周或每月剂量中,药物组合物中抗体或其抗原结合片段的量不超过1g。在某些此类实施方式中,单次剂量不超过选自500mg、
250mg、100mg和50mg的剂量。
[0296]
在一些实施方式中,如本文所描述的组合物或试剂盒进一步包含(i)聚合酶抑制剂,其中所述聚合酶抑制剂任选地包含拉米夫定(lamivudine)、阿德福韦(adefovir)、恩替卡韦、替比夫定(telbivudine)、替诺福韦(tenofovir)或其任何组合;(ii)干扰素,其中所述干扰素任选地包含ifnβ和/或ifnα;(iii)检查点抑制剂,其中所述检查点抑制剂任选地包含抗pd
‑
1抗体或其抗原结合片段、抗pd
‑
l1抗体或其抗原结合片段和/或抗ctla4抗体或其抗原结合片段;(iv)刺激性免疫检查点分子的激动剂;或(v)(i)
‑
(iv)的任何组合。在一些实施方式中,试剂盒包含如本文所描述的组合物或组合,并且进一步包含使用组分预防、治疗、减弱和/或诊断乙型肝炎感染和/或丁型肝炎感染的说明书。
[0297]
在某些实施方式中,本公开的组合物(例如抗体、抗原结合片段、宿主细胞、核酸、载体或药物组合物)与pd
‑
1抑制剂组合使用,所述抑制剂例如pd
‑
1特异性抗体或其结合片段,如匹立珠单抗(pidilizumab)、纳武单抗(nivolumab)、派姆单抗(pembrolizumab)、medi0680(原amp
‑
514)、amp
‑
224、bms
‑
936558或其任何组合。
[0298]
在某些实施方式中,本公开的组合物与pd
‑
l1特异性抗体或其结合片段组合使用,所述抗体其结合片段如bms
‑
936559、度伐单抗(durvalumab)(medi4736)、阿特珠单抗(atezolizumab)(rg7446)、阿维鲁单抗(avelumab)(msb0010718c)、mpdl3280a或其任何组合。
[0299]
在某些实施方式中,本公开的组合物与lag3抑制剂组合使用,所述抑制剂如lag525、imp321、imp701、9h12、bms
‑
986016或其任何组合。
[0300]
在某些实施方式中,本公开的组合物与ctla4抑制剂组合使用。在特定实施方式中,本公开的组合物与ctla4特异性抗体或其结合片段组合使用,所述抗体或其结合片段如伊匹单抗(ipilimumab)、曲美单抗(tremelimumab)、ctla4
‑
ig融合蛋白(例如阿巴西普(abatacept)、贝拉西普(belatacept))或其任何组合。
[0301]
在某些实施方式中,本公开的组合物与b7
‑
h3特异性抗体或其结合片段,如伊诺珠单抗(enoblituzumab,mga271)、376.96或两者组合使用。b7
‑
h3抗体结合片段可以是scfv或其融合蛋白,如例如dangaj等人,《癌症研究(cancer res.)》73:4820,2013中所描述,以及美国专利第9,574,000号和pct专利公开第wo/201640724a1号和第wo2013/025779a1号中所描述的那些。
[0302]
在某些实施方式中,本公开的组合物与cd244抑制剂组合使用。
[0303]
在某些实施方式中,本公开的组合物与blta、hvem、cd160或其任何组合的抑制剂组合使用。抗cd160抗体描述于例如pct公开号wo 2010/084158中。
[0304]
在某些实施方式中,本公开的组合物与tim3抑制剂组合使用。
[0305]
在某些实施方式中,本公开的组合物与gal9抑制剂组合使用。
[0306]
在某些实施方式中,本公开的组合物与腺苷信号传导的抑制剂,如诱饵腺苷受体组合使用。
[0307]
在某些实施方式中,本公开的组合物与a2ar抑制剂组合使用。
[0308]
在某些实施方式中,本公开的组合物与kir抑制剂,如利瑞鲁单抗(lirilumab,bms
‑
986015)组合使用。
[0309]
在某些实施方式中,本公开的组合物与抑制性细胞因子(典型地,除tgfβ外的细胞
因子)或treg发育或活性的抑制剂组合使用。
[0310]
在某些实施方式中,本公开的组合物与ido抑制剂组合使用,所述抑制剂如左旋
‑1‑
甲基色氨酸、艾帕斯塔(epacadostat)(incb024360;liu等人,《血液》115:3520
‑
30,2010)、依布硒啉(ebselen)(terentis等人,《生物化学(biochem.)》49:591
‑
600,2010)、吲哚莫德(indoximod)、nlg919(mautino等人,2013年美国癌症研究协会第104次年度会议(american association for cancer research 104th annual meeting 2013);2013年4月6
‑
10日)、1
‑
甲基
‑
色氨酸(1
‑
mt)
‑
替拉扎明(tira
‑
pazamine)或其任何组合。
[0311]
在某些实施方式中,本公开的组合物与精氨酸酶抑制剂组合使用,所述抑制剂如n(ω)
‑
硝基
‑
l
‑
精氨酸甲酯(l
‑
name)、n
‑
ω
‑
羟基
‑
nor
‑
l
‑
精氨酸(nor
‑
noha)、l
‑
noha、2(s)
‑
氨基
‑6‑
硼己酸(abh)、s
‑
(2
‑
硼乙基)
‑
l
‑
半胱氨酸(bec)或其任何组合。
[0312]
在某些实施方式中,本公开的组合物与vista抑制剂,如ca
‑
170(curis,马萨诸塞州列克星敦(lexington,mass.))组合使用。
[0313]
在某些实施方式中,本公开的组合物与tigit抑制剂(例如com902(compugen,加拿大安大略省多伦多(toronto,ontario canada)))、cd155抑制剂(例如com701(compugen))或两者组合使用。
[0314]
在某些实施方式中,本公开的组合物与pvrig、pvrl2或两者的抑制剂组合使用。抗pvrig抗体描述于例如pct公开号wo 2016/134333中。抗pvrl2抗体描述于例如pct公开号wo 2017/021526中。
[0315]
在某些实施方式中,本公开的组合物与lair1抑制剂组合使用。
[0316]
在某些实施方式中,本公开的组合物与ceacam
‑
1、ceacam
‑
3、ceacam
‑
5或其任何组合的抑制剂组合使用。
[0317]
在某些实施方式中,本公开的组合物与提高刺激性免疫检查点分子的活性的药剂(即为激动剂)组合使用。举例来说,本公开的组合物可与以下组合使用:cd137(4
‑
1bb)激动剂(例如乌瑞鲁单抗(urelumab))、cd134(ox
‑
40)激动剂(例如medi6469、medi6383或medi0562)、来那度胺(lenalidomide)、泊马度胺(pomalidomide)、cd27激动剂(例如cdx
‑
1127)、cd28激动剂(例如tgn1412、cd80或cd86)、cd40激动剂(例如cp
‑
870,893、rhucd40l或sgn
‑
40)、cd122激动剂(例如il
‑
2)、gitr激动剂(例如pct专利公开第wo 2016/054638号中所描述的人源化单克隆抗体)、icos(cd278)激动剂(例如gsk3359609、mab 88.2、jtx
‑
2011、icos 145
‑
1、icos 314
‑
8或其任何组合)。在本文所公开的实施方式中的任一个中,方法可包括单独或以任何组合施用本公开的组合物以及一种或多种刺激性免疫检查点分子的激动剂,包括前述中的任一种。
[0318]
根据本公开的抗体、抗原结合片段或融合蛋白可作为额外活性组分存在于相同药物组合物中,或根据本公开的抗体、抗原结合片段或融合蛋白可包括于第一药物组合物中,并且额外活性组分可包括于不同于第一药物组合物的第二药物组合物中。
[0319]
用途
[0320]
在另一方面,本公开提供根据本公开的抗体、抗原结合片段、融合蛋白、核酸、载体、细胞或药物组合物或试剂盒在(i)防治、治疗或减弱乙型肝炎和/或丁型肝炎;或(ii)诊断乙型肝炎和/或丁型肝炎(例如在人受试者中)中的用途的方法。
[0321]
诊断(例如体外、离体)的方法可包括使抗体、抗体片段(例如抗原结合片段)或融
合蛋白与样品接触。此类样品可从受试者分离,例如从例如鼻道、窦腔、唾液腺、肺、肝、胰、肾、耳、眼、胎盘、消化道、心脏、卵巢、垂体、肾上腺、甲状腺、脑、皮肤或血液获取的分离组织样品。诊断方法还可包括检测抗原/抗体或抗原/融合蛋白复合物,尤其在使抗体、抗体片段或融合蛋白与样品接触之后。此类检测步骤典型地在实验台进行,即不与人或动物身体发生任何接触。检测方法的实例是所属领域的技术人员众所周知的,并且包括例如elisa(酶联免疫吸附分析)。
[0322]
本公开还提供(i)根据本公开的抗体、抗体片段、融合蛋白或其变体和衍生物,(ii)根据本公开的宿主细胞(其可以是永生化b细胞),(iii)根据本公开的核酸或载体或(iv)本公开的药物组合物在(a)制造用于预防、治疗或减弱乙型肝炎和/或丁型肝炎的药剂或(b)诊断乙型肝炎和/或丁型肝炎中的用途。
[0323]
本公开还提供根据本公开的抗体、抗原结合片段或融合蛋白,根据本公开的核酸,根据本公开的载体,根据本公开的细胞或根据本公开的药物组合物,其用作用于预防或治疗乙型肝炎和/或丁型肝炎的药剂。还提供本公开的抗体、抗原结合片段或融合蛋白在制造用于治疗受试者和/或诊断受试者的药剂中的用途。还提供用于治疗受试者(例如人受试者)的方法,其包括向受试者施用有效量的如本文所描述的组合物。在一些实施方式中,受试者可以是人。检查治疗性治疗的功效的一种方式涉及在施用组合物之后监测疾病症状。治疗可以是单剂量方案或多剂量方案。
[0324]
在一个实施方式中,向需要此类治疗的受试者施用根据本公开的抗体、抗体片段、融合蛋白、宿主细胞(例如表达融合蛋白的永生化b细胞克隆,或t细胞、nk
‑
t细胞或nk细胞)或药物组合物。此类受试者包括但不限于特别处于乙型肝炎和/或丁型肝炎风险下或易患乙型肝炎和/或丁型肝炎的受试者。
[0325]
根据本公开的抗体、抗原结合片段、融合蛋白、多核苷酸、载体、宿主细胞、药物组合物和其组合还可用于预防、治疗、减弱和/或诊断乙型肝炎和/或丁型肝炎的试剂盒中。在一些实施例中,试剂盒进一步包含使用组分预防、治疗、减弱和/或诊断乙型肝炎感染和/或丁型肝炎感染的说明书。此外,能够结合如本文所描述的本公开的抗体、抗原结合片段或融合蛋白的hbsag的抗原环区中的表位可用于试剂盒中,试剂盒用于通过检测保护性抗hbv抗体的存在或确定所述抗体的效价来监测施加程序的功效。
[0326]
在某些实施方式中,本公开的组合物或试剂盒进一步包含:聚合酶抑制剂,其中所述聚合酶抑制剂任选地包含拉米夫定、阿德福韦、恩替卡韦、替比夫定、替诺福韦或其任何组合;(ii)干扰素,其中所述干扰素任选地包含ifnβ和/或ifnα;(iii)检查点抑制剂,其中所述检查点抑制剂任选地包含抗pd
‑
1抗体或其抗原结合片段、抗pd
‑
l1抗体或其抗原结合片段和/或抗ctla4抗体或其抗原结合片段;(iv)刺激性免疫检查点分子的激动剂;或(v)(viii)
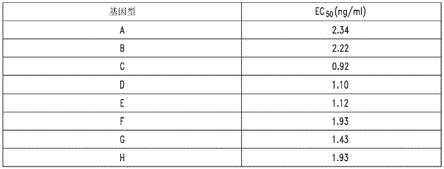
‑
(xii)的任何组合。
[0327]
在一些实施方式中,根据本公开的抗体、抗原结合片段或融合蛋白,根据本公开的核酸,根据本公开的载体,根据本公开的细胞或根据本公开的药物组合物用于治疗或减弱慢性乙型肝炎感染。
[0328]
在特定实施方式中,根据本公开的抗体、抗原结合片段或融合蛋白(i)中和hbv感染,(ii)结合l
‑
hbsag(大hbv包膜蛋白,其存在于感染性hbv颗粒中),从而阻止hbv传播,(iii)结合s
‑
hbsag,从而促进亚病毒颗粒(svp)的清除和/或(iv)可诱导血清转化,即对病
毒的主动免疫反应。
[0329]
在特定实施方式中,根据本公开的抗体、抗原结合片段或融合蛋白,根据本公开的核酸,根据本公开的载体,根据本公开的细胞或根据本公开的药物组合物可用于预防尤其针对乙型肝炎诱导的肝衰竭进行肝移植之后乙型肝炎(再)感染。
[0330]
在其它实施方式中,根据本公开的抗体、其抗原结合片段或融合蛋白,根据本公开的核酸,根据本文所提供的说明书的载体,根据本公开的细胞或根据本公开的药物组合物可用于预防/防治未免疫受试者的乙型肝炎。这例如是在(假设)意外暴露于hbv的情况下(暴露后防治)。术语“未免疫受试者”包括未曾接受疫苗接种并且因此未免疫的受试者,和在疫苗接种之后未显示免疫反应(例如没有可测量的抗乙型肝炎抗体)的受试者。
[0331]
在一些实施方式中,根据本公开的抗体、抗原结合片段或融合蛋白,根据本公开的核酸,根据本公开的载体,根据本公开的细胞或根据本公开的药物组合物用于防治血液透析患者的乙型肝炎。
[0332]
在一些实施方式中,根据本公开的抗体、抗原结合片段或融合蛋白,根据本公开的核酸,根据本公开的载体,根据本公开的细胞或根据本公开的药物组合物用于预防新生儿的乙型肝炎。在此类实施方式中,根据本公开的抗体或其抗原结合片段,根据本公开的核酸,根据本公开的载体,根据本公开的细胞或根据本公开的药物组合物可在出生时或出生后尽快施用。可重复施用直到疫苗接种之后血清转化。
[0333]
此外,本公开还提供根据本公开的抗体、抗原结合片段或融合蛋白,根据本公开的核酸,根据本公开的载体,根据本公开的细胞或根据本公开的药物组合物在乙型肝炎和/或丁型肝炎诊断(例如体外、离体或体内)中的用途。
[0334]
另外,提供根据本公开的抗体、抗原结合片段或融合蛋白,根据本公开的核酸,根据本公开的载体,根据本公开的细胞或根据本公开的药物组合物在确定分离的血液样品是否感染乙型肝炎病毒和/或丁型肝炎病毒中的用途。
[0335]
如上文所描述,诊断方法可包括使抗体、抗体片段或融合蛋白与样品接触。此类样品可从受试者分离,例如从例如鼻道、窦腔、唾液腺、肺、肝、胰、肾、耳、眼、胎盘、消化道、心脏、卵巢、垂体、肾上腺、甲状腺、脑、皮肤或血液获取的分离组织样品。诊断方法还可包括检测抗原/抗体复合物,尤其在使抗体或抗体片段与样品接触之后。此类检测步骤典型地在实验台进行,即不与人或动物身体发生任何接触。检测方法的实例是所属领域的技术人员众所周知的,并且包括例如elisa(酶联免疫吸附分析)。
[0336]
本公开还提供根据一种治疗、预防和/或减弱受试者的乙型肝炎和/或丁型肝炎的方法,其中所述方法包括向受试者施用根据本公开的抗体、抗原结合片段或融合蛋白,根据本公开的核酸,根据本公开的载体,根据本公开的细胞或根据本公开的药物组合物。在某些实施例中,方法进一步包含向受试者施用以下中的一者或多者:(vii)聚合酶抑制剂,其中所述聚合酶抑制剂任选地包含拉米夫定、阿德福韦、恩替卡韦、替比夫定、替诺福韦或其任何组合;(viii)干扰素,其中所述干扰素任选地包含ifnβ和/或ifnα;(ix)检查点抑制剂,其中所述检查点抑制剂任选地包含抗pd
‑
1抗体或其抗原结合片段、抗pd
‑
l1抗体或其抗原结合片段和/或抗ctla4抗体或其抗原结合片段;(x)刺激性免疫检查点分子的激动剂;或(xi)(vii)
‑
(x)的任何组合。
[0337]
在一些实施方式中,乙型肝炎感染是慢性乙型肝炎感染。在一些实施方式中,受试
者已接受肝移植。在一些实施方式中,受试者未针对乙型肝炎免疫。在某些实方式例中,受试者为新生儿。在一些实施方式中,受试者正在经历血液透析或已经历血液透析。
[0338]
本公开还提供一种治疗已接受肝移植的受试者的方法,其包括向已接受肝移植的受试者施用有效量的根据本公开的抗体、抗原结合片段或融合蛋白,根据本公开的核酸,根据本公开的载体,根据本公开的细胞或根据本公开的药物组合物。
[0339]
本文还提供用于检测抗乙型肝炎和/或抗丁型肝炎疫苗中是否存在呈正确构象的表位的方法,其中所述方法包括:(i)使疫苗与根据任何本公开的抗体、抗原结合片段或融合蛋白接触;和(ii)确定是否已形成包含抗原和抗体,或包含抗原和抗原结合片段,或包含抗原和融合蛋白的复合物。
[0340]
如本文所用,术语“疫苗”典型地理解为提供至少一种抗原,如免疫原的防治性或治疗性材料。抗原或免疫原可源自适合于疫苗接种的任何材料。举例来说,抗原或免疫原可源自病原体,如源自细菌颗粒、病毒颗粒、肿瘤(包括实体或液体肿瘤)或其它癌组织。抗原或免疫原刺激身体的适应性免疫系统以提供适应性免疫反应。在某些实施例中,“抗原”或“免疫原”是指可由免疫系统,例如由适应性免疫系统识别,并且能够触发抗原特异性免疫反应,例如通过形成抗体和/或抗原特异性t细胞作为适应性免疫反应的一部分的物质。在一些实施方式中,抗原可以是或可包含可由mhc复合物(例如mhc i类;mhc ii类)呈递给t细胞的肽或蛋白质。在某些实施例中,抗原包含hbv和/或hbd抗原;例如hbsag抗原。
[0341]
在一些情况下,参考实施方式或实施例描述或列出本文所提供的抗体、抗体片段、融合蛋白、核酸、细胞、组合物、用途和方法的要素。然而,应理解,本文所描述的实施例和实施方式可以各种方式组合以创建额外实施例。
[0342]
实施例
[0343]
在下文中,呈现说明本公开的各种实施方式和方面的特定实例。然而,本公开的范围不受本文所描述的具体实施例的限制。
[0344]
实施例1:工程化抗体的产生和测试
[0345]
对来自pct公开号wo 2017/060504的一些hbc34抗体变体的分析展现未配对且表示潜在不利因素的轻链可变区中位置40(imgt编号)处的半胱氨酸氨基酸。在不希望受理论束缚的情况下,未配对的半胱氨酸残基具有潜在反应性,并可潜在通过分子内加扰或分子间二硫化物形成触发聚集。hbc34
‑
v7(wo 2017/060504)的变体经工程化,其中轻链可变区的位置40处的半胱氨酸氨基酸被丝氨酸取代(从而产生“hbc34
‑
v34”)或被丙氨酸取代(从而产生“hbc34
‑
v35”)。编码这些额外变体抗体的核苷酸序列经密码子优化,并且抗体在expichotm细胞(赛默飞世尔(thermofisher))中表达为igg1(g1m17,1同种异型)。编码hbc34
‑
v35的vh和vl结构域的经密码子优化的核苷酸序列分别提供于seq id no:103和104中。
[0346]
使用直接抗原结合elisa研究hbc34
‑
v34和hbc34
‑
v35结合抗原的能力。hbc34
‑
v7用作比较物。如图1所示,hbc34
‑
v34和hbc34
‑
v35均有效结合两种重组hbsag抗原(“adw”,上图;“adr”,下图),并且hbc34
‑
v35与亲本hbc34
‑
v7具有极相似的结合。
[0347]
检查变体抗体与所有已知hbsag基因型((a)
‑
(j))的结合。简单来说,用表达10种hbv基因型a、b、c、d、e、f、g、h、i和j中的每一者的hbsag的质粒转染人上皮细胞(hep2细胞)。所有抗体在多个浓度下测试瞬时转染透化细胞的染色。转染后两天,收集hep2细胞,固定并
用皂苷透化,用于用hbc34和五种选定变体进行免疫染色。包括hbc34
‑
v7作为比较物。使用带有flowjo软件(treestar)的becton dickinson facscanto2
tm
(bd生物科学(bd biosciences))分析抗体与经转染的细胞的结合。如图2a
‑
2j所示,hbc34
‑
v34和hbc34
‑
v35识别所有10种hbv hbsag基因型。hbc34
‑
v35显示比hbc34
‑
v34略微强的染色。
[0348]
这些数据显示抗体变体hbc34
‑
v34和hbc34
‑
v35以与hbc34
‑
v7相当的水平广泛识别且结合hbsag。
[0349]
实施例2:具有修饰的fc区的抗hbsag抗体有效结合抗原
[0350]
fc区中的修饰可为治疗抗体提供优势。hbc34
‑
v35表达为具有野生型fc,或具有含有“mlns”突变(m428l/n434s)的fc,或具有含有mlns与“gaalie”突变(g239a/a330l/i332e)组合的fc的igg1。在两个单独的抗原结合elisa实验中测试每种构建体与重组hbsag(adw)的结合。测试三(3)批hbc34
‑
v35(野生型fc)。测试两(2)批hbc34
‑
v35
‑
mlns和两(2)批hbc34
‑
v35
‑
mlns
‑
gaalie。测试hbc34v7(一批)作为比较物。
[0351]
如图3a和3b所示,引入的fc突变不影响hbc34
‑
v35的抗原结合活性。ec
50
值在各种构建体和两个实验之间略微变化,并且大体上低。
[0352]
评定具有mlns或mlns和gaalie突变的hbc34
‑
v35与表达hbsag基因型(a)
‑
(j)或hbsag变体的expi293细胞的结合。具有野生型igg1 fc的hbc34
‑
v35用作比较物。显示与hbsag基因型的结合的数据显示于图3c
‑
3h中。显示与hbsag变体的结合的数据显示于图3i
‑
3r中。
[0353]
实施例3:抗体的体外中和活性
[0354]
通过测量表达ntcp的hbv感染的hepg2细胞的细胞培养上清液中hbsag(a)和hbeag(b)的水平,比较hbc34、hbc34
‑
v35、hbc34
‑
v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie的中和能力。数据显示于图3s
‑
3v中,并且表示来自两次独立实验之一的平均值
±
sd。
[0355]
实施例4:在hdv假系统中评定的hbc34
‑
v35 mlns
‑
gaalie的泛基因型中和能力
[0356]
为了证实hbc34
‑
v35
‑
mlns
‑
gaalie针对hbv病毒的中和宽度,用hbc34
‑
v35
‑
mlns
‑
gaalie针对八种流行的人hbv基因型进行中和分析。采用利用经工程化以表达表示不同基因型的hbv hbsag的丁型肝炎病毒(hdv)的体外系统。简单来说,由于hbv和hdv具有相同包膜蛋白,因此其通过硫酸乙酰肝素蛋白多糖和ntcp的病毒进入路径相同,并且hdv可用作研究hbsag介导的病毒进入的模型系统(tu 2018;lempp 2016)。此外,hdv可用不同hbv基因型的hbsag包膜/假型化,并且随后用于感染研究(freitas 2014)。
[0357]
hbc34
‑
v35
‑
mlns
‑
gaalie显示对所有测试基因型的中和能力,ec
50
值相似,在0.92ng/ml(基因型c)到2.34ng/ml(基因型a)范围内。这些结果显示hbc34
‑
v35
‑
mlns
‑
gaalie能够携带来自所有八种测试hbv基因型的hbsag的感染性病毒,支持hbc34
‑
v35
‑
mlns
‑
gaalie的体内泛基因型中和活性(图4)。
[0358]
实施例5:体内模型中hb抗原的清除和病毒进入抑制
[0359]
具有移植的人肝细胞的免疫缺陷小鼠用于测试本公开的抗hbv抗体在清除hbsag方面的有效性。简单来说,将原代人肝细胞移植到小鼠肝细胞先前已酶促破坏的scid小鼠中。小鼠为t细胞和b细胞缺陷。这一模型适用于研究hbv感染,包括进入、传播、cccdna调节、肝细胞固有免疫反应和病毒整合到宿主基因组中。
[0360]
在第
‑
28天,用hbv,基因型c以每只小鼠1.0
×
107个病毒基因组通过尾静脉注射接
种小鼠。在初始测量hbv之后进行第0天的处理。hbv感染的小鼠(每个处理组n=4只)施用pbs(对照)或hbc34
‑
v35(1、5或15mg/kg i.p.,2次/周)。除抗原结合fab区之外,抗体经鼠化。
[0361]
在整个研究期间定期收集血浆和血清样品,并且测量病毒载量、hbv dna(通过pcr)和hb ag(hbsag、hbeag、hbcrag)。在第6周处死小鼠。
[0362]
如图5
‑
8所示,用最高测试剂量的hbc34
‑
v35处理减少病毒载量和病毒进入肝细胞。
[0363]
实施例6:体外效应功能研究
[0364]
进行体外研究以检查具有修饰的fc的hbc34抗体的以下能力:(1)结合人fcr和补体;(2)激活fcγriia、fcγriib和fcγriiia;和(3)促进adcc并激活人自然杀伤(nk)细胞。所使用的测试品、细胞系和试剂如下表5
‑
7中所描述。这一实施例中使用以下缩写:glp=良好实验室规范(good laboratory practice);adcc=抗体依赖性细胞毒性;adcp=抗体依赖性细胞吞噬作用;fc=可结晶片段;hbsag=乙型肝炎表面抗原;mab=单克隆抗体;pbs=磷酸盐缓冲盐水;uhpl
‑
sec=超高效液相尺寸排阻色谱;atcc=美国典型培养物保藏中心(american type culture collection);fcγr=fcγ受体;cho细胞=中国仓鼠卵巢细胞;rlu=相对发光单位;bli=生物层干涉测量法。
[0365]
表5.测试品。
[0366]
测试品hbc34
‑
v35
‑
mlns
·
同种型
·
igg1λ
·
相对分子量
·
≈150kda
·
浓度
·
3.47mg/ml
·
来源
·
内部
·
处置和存储条件
·
4℃短期,
‑
80℃长期存储
·
配制缓冲液
·
pbs,ph 7.2测试品hbc34
‑
v35
‑
mlns
‑
gaalie
·
同种型
·
igg1λ
·
相对分子量
·
≈150kda
·
浓度
·
2.1mg/ml/0.86mg/ml
·
来源
·
内部
·
处置和存储条件
·
4℃短期,
‑
80℃长期存储
·
配制缓冲液
·
pbs,ph 7.2测试品hbc34
‑
v35
‑
lala
·
同种型
·
igg1λ
·
相对分子量
·
≈150kda
·
浓度
·
1.2mg/ml
·
来源
·
内部
·
处置和存储条件
·
4℃短期,
‑
80℃长期存储
·
配制缓冲液
·
pbs,ph 7.2测试品mab 17.1.41
·
同种型
·
igg1κ
·
相对分子量
·
≈150kda
·
浓度
·
4.4mg/ml
·
来源
·
内部
·
处置和存储条件
·
4℃短期,
‑
80℃长期存储
·
配制缓冲液
·
pbs,ph 7.2
[0367]
表6.细胞系
[0368]
[0369]
[0370][0371]
表7.其它试剂
[0372]
[0373]
[0374][0375]
实验步骤
[0376]
与人fc
‑
受体的结合的测量
[0377]
hbc34
‑
v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie与人fcγr的结合在仪器(bli,生物层干涉测量法;fort
é
bio)上测量。简单来说,将加his标签的人fcγr(fcγriia等位基因h131、fcγriia等位基因r131、fcγriiaa等位基因f158、fcγriiia等位基因v158和fcγriib)以2μg/ml捕获到抗五his传感器上6分钟。然后,在1μg/ml affinipure f(ab')2片段山羊抗人igg,f(ab')2片段特异性(以通过fab片段交联人mab)存在下,使装载fcγr的传感器暴露于含有2μg/ml每种mab的动力学缓冲液溶液(ph 7.1)4分钟,接着在相同缓冲液中再进行解离步骤4分钟(曲线右侧部分)。使用red96(fort
é
bio)按干涉图案的变化实时测量缔合和解离概况。溶液中hbc34
‑
v35
‑
mlns
‑
gaalie、hbc34
‑
v35
‑
mlns或hbc34
‑
v35与固
定的人fcrn的结合通过octet在ph=6.0或ph=7.4下实时测量。
[0378]
与人补体蛋白c1q的结合的测量
[0379]
hbc34
‑
v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie与人补体的结合在仪器(bli,生物层干涉测量法;fort
é
bio)上测量。简单来说,抗人fab(ch1特异性)传感器用于通过fab片段以10μg/ml捕获hbc34
‑
v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie mab的完整igg1 10分钟。然后使装载igg的传感器暴露于含有3μg/ml纯化人c1q的动力学缓冲溶液(ph 7.1)4分钟(曲线左侧部分),接着在相同缓冲液中再进行解离步骤4分钟(曲线右侧部分)。使用red96(fort
é
bio)按干涉图案的变化实时测量缔合和解离概况。
[0380]
从全血制备人nk细胞
[0381]
遵循制造商的说明书,使用nk分离试剂盒从edta全血中新鲜分离nk细胞。简单来说,将抗凝血液与15ml nk分离混合液在50ml管中混合,并且使用旋转器以大约12转/分钟在室温下培育5分钟。然后将管放置于分离器的磁场中15分钟。磁性标记的细胞粘附于管壁,而聚集的红细胞沉降到底部。然后从上清液收集靶nk细胞,同时管仍在分离器内部。将nk细胞离心,用蒸馏水处理以去除残余红细胞,再次离心并且最后再悬浮于aim
‑
v培养基中。
[0382]
抗体依赖性nk细胞杀伤的确定
[0383]
将mab在aim
‑
v培养基中从100μg/ml连续10倍稀释到0.001μg/ml。将靶细胞(plc/prf/5;macnab等人,《英国癌症杂志(british journal of cancer)》,34(5),1976)以7.5
×
103个细胞/孔在23μl中添加到圆底384孔板中,然后将连续稀释的抗体添加到每个孔中(每孔23μl),并且将抗体/细胞混合物在室温下培育10分钟。在培育之后,将人nk细胞以7.5
×
104个/孔的细胞密度在23μl中添加,产生10:1的效应子与靶标比。还包括用于测量最大溶解(含有靶细胞以及23μl 3%triton x
‑
100)和自发溶解(含有靶细胞和效应细胞,不含抗体)的对照孔。将板在37℃和5%co2下培育4小时。根据制造商的说明书,使用ldh检测试剂盒通过测量乳酸脱氢酶(ldh)释放来确定细胞死亡。简单来说,将板以400
×
g离心4分钟,并且将35μl上清液转移到平坦384孔板中。制备ldh试剂并且将35μl添加到每个孔中。使用动力学方案,每2分钟测量一次490nm和650nm下的吸光度,持续8分钟。通过应用下式确定特异性溶解百分比:(特异性释放
‑
自发释放)/(最大释放
‑
自发释放)
×
100。
[0384]
抗体依赖性nk细胞激活的确定
[0385]
使用先前针对表达纯合高(v158等位基因)或低(f158等位基因)亲和力fcγriiia基因分型的两个供体新鲜分离的细胞测试原代nk细胞的激活。将mab的连续稀释液(在aim
‑
v培养基中从100μg/ml连续10倍稀释到0.0001μg/ml)与nk细胞一起培育4小时。通过用抗cd107a mab(抗cd107 pe,1/35稀释使用)作为nk细胞活性的功能标志物染色nk细胞,通过流式细胞术测量nk细胞的激活。
[0386]
人fcγriiia的抗体依赖性激活的确定
[0387]
将hbc34
‑
v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie在adcc分析缓冲液中从5μg/ml连续4倍稀释到0.076μg/ml。将靶抗原(来自安在时,葛兰素史克的hbsag)以0.6μg/ml在25μl中添加到白色平底96孔板中,然后将连续稀释的抗体添加到每个孔中(每孔25μl),并且将抗体/细胞混合物在室温下培育10分钟。将用于adcc生物分析的效应细胞解冻,并且以7.5
×
104个/孔的细胞密度在25μl中添加(最终hbsag浓度为0.2μg/ml)。还包括用于测量不依赖
抗体的激活(含有hbsag和效应细胞但不含抗体)和板的自发发光(仅含有adcc分析缓冲液的孔)的对照孔。将板在37℃和5%co2下培育24小时。这一生物分析中人fcγriiia(v158或f158变体)的激活引起nfat介导的荧光素酶报告基因表达。根据制造商的说明书,使用bio
‑
glo
‑
tm
荧光素酶分析试剂用光度计测量发光。通过应用下式,数据(即特异性fcγriiia激活)表示为超过背景的相对发光单位(rlu)的平均值:(浓度x的mab下的rlu
‑
背景的rlu)。
[0388]
人fcγriia的抗体依赖性激活的确定
[0389]
将hbc34
‑
v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie在adcp分析缓冲液中从50μg/ml连续5倍稀释到0.00013μg/ml。将靶抗原(来自安在时的hbsag)以0.6或6μg/ml在25μl中添加到白色平底96孔板中,然后将连续稀释的抗体添加到每个孔中(每孔25μl),并且将抗原/抗体在室温下培育25分钟。将用于fcγriia激活生物分析的效应细胞解冻,并且以50.0
×
104个/孔的细胞密度在25μl中添加(最终hbsag浓度分别为0.2或2μg/ml)。还包括用于测量不依赖抗体的激活(含有hbsag和效应细胞但不含抗体)和板的自发发光(仅含有adcp分析缓冲液的孔)的对照孔。将板在37℃和5%co2下培育23小时。这一生物分析中人fcγriia(h131变体)的激活引起nfat介导的荧光素酶报告基因表达。根据制造商的说明书,使用bio
‑
glo
‑
tm
荧光素酶分析试剂用光度计测量发光。通过应用下式,数据(即特异性fcγriia激活)表示为超过背景的相对发光单位(rlu)的平均值:(浓度[x]的mab下的rlu
‑
背景的rlu)。
[0390]
人fcγriib的抗体依赖性激活的确定
[0391]
将hbc34
‑
v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie在adcp分析缓冲液中从100μg/ml连续5倍稀释到0.00026μg/ml。将靶抗原(来自安在时的hbsag)以3μg/ml在25μl中添加到白色平底96孔板中,然后将连续稀释的抗体添加到每个孔中(每孔25μl),并且将抗原/抗体在室温下培育15分钟。将用于fcγriib激活生物分析的效应细胞解冻,并且以75.0
×
104个/孔的细胞密度在25μl中添加(最终hbsag浓度为1μg/ml)。还包括用于测量不依赖抗体的激活(含有hbsag和效应细胞但不含抗体)和板的自发发光(仅含有adcp分析缓冲液的孔)的对照孔。将板在37℃和5%co2下培育20小时。这一生物分析中人fcγriib的激活引起nfat介导的荧光素酶报告基因表达。根据制造商的说明书,使用bio
‑
glo
‑
tm
荧光素酶分析试剂用光度计测量发光。通过应用下式,数据(即特异性fcγriib激活)表示为超过背景的相对发光单位(rlu)的平均值:(浓度[x]的mab下的rlu
‑
背景的rlu)。
[0392]
抗体与人肝癌细胞系plc/prf/5的结合的确定
[0393]
将plc/prf/5细胞在37℃下用胰蛋白酶处理5min,转移到7ml生长培养基中,以400
×
g,4min,4℃离心,并且在4℃下在pbs中充分洗涤。将一些细胞用4%甲醛固定(在4℃下20分钟);将其它细胞固定,并且然后用透化缓冲液透化(在4℃下20分钟)。将细胞沉淀再悬浮于2.64ml洗涤缓冲液(固定的细胞)或透化缓冲液(固定并透化的细胞)(表7)中,并且以200μl/孔分配到96孔圆底板中(对应于100'000个细胞/孔)。将板以400g,4min,4℃离心。将从10μg/ml的最终浓度开始的测试抗体的连续1:5 5点稀释液添加到含细胞的孔中,并且在冰上培育30分钟。在4℃,400
×
g,4min下在洗涤缓冲液(固定细胞)或透化缓冲液(固定并透化的细胞)中洗涤2次之后,将50μl/孔的alexa647标记的二抗(表7)添加到细胞中,并且在冰上培育20min。将细胞用洗涤缓冲液(固定细胞)或透化缓冲液(固定并透化的细胞)再洗涤2次,再悬浮于200μl/孔的洗涤缓冲液(固定细胞)或透化缓冲液(固定并透化的细
胞),并且用细胞荧光计(bd facscanto
tm ii)定量信号(mfi,平均荧光强度)。
[0394]
结果
[0395]
直接抗病毒机制对于体内中和hbv很重要。由fc区与免疫细胞上fcγ受体(fcγr)的相互作用介导的间接、fc依赖性作用机制也可对体内功效和介导内源性免疫反应具有重要作用。fcγr依赖性机制可通过测量与fcγr的结合体外评定以及在人fcγr的抗体依赖性激活中评定(hsieh,y.
‑
t.等人,《免疫学方法杂志(journal of immunological methods)》,441(c),56
‑
66.doi.org/10.1016/j.jim.2016.12.002)。抗体结合fcrn和结合补体的能力是其它所关注的因素。
[0396]
在一组实验中,使用生物层干涉测量法(bli系统,fortebio)并排比较hbc34
‑
v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie结合人fcγr全集(fcγriiia v158和f158等位基因、fcγriia h131和r131等位基因以及fcγriib)的能力。如图9a
‑
9e所示,携带mlns
‑
gaalie突变的fc与fcγr的相互作用改变;具体来说,与单独携带mlns的fc相比,携带这些突变中的两者的fc与fcγriiia和fcγriia的结合增强,并且与fcγriib的结合减弱。
[0397]
如图9f所示,携带mlns fc突变的抗体相对于具有野生型fc的抗体在ph 6.0下与fcrn的结合增加,但在ph 7.4下与fcrn的结合几乎不可测量或不可测量,这与具有野生型fc的抗体相当。
[0398]
此外,如通过生物层干涉测量法所测量,hbc34
‑
v35
‑
mlns
‑
gaalie与c1q的结合消除(图10)。
[0399]
还使用基于细胞的报告基因生物分析测试hbc34
‑
v35
‑
mlns和hbc34
‑
v35
‑
mlns
‑
gaalie激活人fcγriiia和fcγriia的能力。这些分析利用经nfat介导的荧光素酶报告基因工程化的jurkat细胞来反映人fcγr的激活。hbc34
‑
v35
‑
mlns在hbsag存在下不充分激活或不激活人fcγriiia和fcγriia,而hbc34
‑
v35
‑
mlns
‑
gaalie显示所有测试fcγr的剂量依赖性激活(图11a、11b、12a
‑
12b)。即使在100μg/ml下测试时,hbc34
‑
v35
‑
mlns
‑
gaalie也不激活fcγriib(图13a
‑
13b)。
[0400]
还使用从先前针对表达杂合高(v158)和低(f158)亲和力fcγriiia(f/v)基因分型的一个供体的人周边血液单核细胞分离的自然杀伤细胞(nk)测量adcc活性。分离的nk细胞用于测量暴露于以下后对肝癌细胞系plc/pr/5的杀伤:hbc34
‑
v35;hbc34
‑
v35
‑
mlns;hbc34
‑
v35
‑
mlns
‑
gaalie;或另一mab(17.1.41,靶向hbsag的抗原环上的另一表位;参见eren,r.等人,《肝病学》,doi.org/10.1053/jhep.2000.9632;galun,e.等人,《肝病学》,doi.org/10.1053/jhep.2002.31867)。未观察到在hbsag特异性mab hbc34
‑
v35、hbc34
‑
v35
‑
mlns、hbc34
‑
v35
‑
mlns
‑
gaalie和17.1.41存在下的杀伤(图14a)。观察到的缺少plc/pr/5细胞的抗体依赖性杀伤可能与这些细胞表面上hbsag的表达不良有关(图14b),在不希望受理论束缚的情况下,这可能不足以触发nk细胞的杀伤。相反,当plc/pr/5被固定并透化时,在hbc34v35和17.1.41情况下检测到高水平hbsag,指示大多数hbsag发现于细胞内或以分泌形式(即亚病毒颗粒)发现(图14b)。
[0401]
还使用抗cd107a mab检查在hbc34v35
‑
mlns或hbc34
‑
v35
‑
mlns
‑
gaalie和hbsag存在下的原代人nk细胞(v/f)激活。数据显示于图15a和15b中。
[0402]
这些体外数据显示,与非gaalie fc亲本抗体相比,携带gaalie fc突变的本公开的hbv特异性结合蛋白更有效地结合并激活低亲和力激活fcγriia和fcγriiia。携带
gaalie的结合蛋白也不结合和或激活低亲和力抑制性fcγriib。携带gaalie的结合蛋白也不结合c1q。此外,携带gaalie的结合蛋白不促进对肝癌细胞的adcc,但在可溶性hbsag存在下激活人nk细胞。引入mlns突变增加在ph 6.0下与fcrn的结合。
[0403]
实施例7:hbc34
‑
v35
‑
mlns
‑
gaalie与pol/rt抑制剂之间的药物
‑
药物相互作用的体外研究
[0404]
进行体外研究以鉴别hbc34
‑
v35
‑
mlns
‑
gaalie与hbv pol/rt抑制剂恩替卡韦(etv)的可能组合效果。在hepg2.2.15细胞中以棋盘格形式使用hbc34
‑
v35
‑
mlns
‑
gaalie和etv确定体外组合效果。hbsag和hbv dna水平用作读数,并且使用macsynergy ii(uab.edu/medicine/peds/macsynergy)分析数据的组合效果。对于标准化,将从未处理的hepg2.2.15细胞获得的值用作阳性对照,而组织培养基用作阴性对照。99%置信度的协同作用图用于报告。数据显示于图16中。两个读数的协同作用图显示hbc34
‑
v35
‑
mlns
‑
gaalie与etv体外的累加效应。值得注意的是,未观察到拮抗作用。这些数据支持在临床环境中使用核苷类似物与hbc34
‑
v35
‑
mlns
‑
gaalie的组合。
[0405]
实施例8:人单克隆抗体hbc24的鉴别和表征
[0406]
抗hbv人单克隆抗体以与traggiai e.等人,2004,《自然
·
医学》10(8):871
‑
5中所描述类似的方式从人患者分离。通过确定抗体可变区和其中互补决定区(cdr)的核苷酸和氨基酸序列表征抗体,并且将其称为“hbc24”。因此,hbc24为具有如上文表3中所示的cdr、v
h
和v
l
序列的igg1型完全人单克隆抗体。编码hbc24的v
h
和v
l
的示例性核苷酸序列提供于表4中。
[0407]
实施例9:hbc24的生殖系化变体的产生和功能测试
[0408]
分析hbc24在相对于生殖系序列的可变区中体细胞突变的存在。鉴将别的体细胞突变恢复为生殖系序列以产生hbc24变体。使用如本文所描述的分析测试hbc24和变体的hbv和hbd血清型的结合(体外)和中和(体外;体内)。
[0409]
实施例10:将fc修饰引入到hbc24和变体中
[0410]
产生在两个fc单体中含有mlns和gaalie突变的其它hbc24变体。所选变体的hc氨基酸序列提供于seq id no:121和122中。检查变体:(1)与抗原的体外结合;(2)hbv血清型的体外中和,其使用如本文所描述的分析进行。
[0411]
序列和seq id编号的表(序列表):
[0412]
[0413]
[0414]
[0415]
[0416]
[0417]
[0418]
[0419]
[0420]
[0421]
[0422]
[0423]
[0424]
[0425]
[0426]
[0427]
[0428][0429]
上文所描述的各种实施方式可以组合以提供另外的实施方式。本说明书中所提到和/或本技术数据表中所列出的所有美国专利、美国专利申请公开、美国专利申请、外国专利、外国专利申请以及非专利出版物以全文引用的方式并入本文中。必要时,可以修改这些实施方式的各方面以使用各种专利、申请以及公开的观点来提供又另外的实施方式。
[0430]
2018年12月19日提交的美国临时申请62/782,274和2019年6月11日提交的美国临时申请62/860,085以全文以引用的方式并入本文中。
[0431]
可以根据以上详细描述对实施方式进行这些和其它改变。一般来说,在以下权利要求书中,所用术语不应被解释为将权利要求书限于本说明书和权利要求书中所公开的具体实施方式,而应被解释为包括所有可能的实施方式以及这份权利要求书有权获得的等效物的全部范围。因此,权利要求书不受本公开限制。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

