杀白细胞毒素阳性金黄色葡萄球菌的cpa引物及试剂盒和检测方法
技术领域
1.本发明属于生物检测领域,具体涉及一种杀白细胞毒素阳性金黄色葡萄球菌的cpa引物及其检测试剂盒和检测方法。
背景技术:
2.金黄色葡萄球菌是临床上常见的机会致病菌之一,常寄存于人和动物的鼻腔、咽喉、体表皮肤和黏膜上。金葡菌可产生各种侵袭性酶及毒素,如杀白细胞毒素、血浆凝固酶、溶血毒素、毒性休克综合征毒素、肠毒素等。在一定条件下,金葡菌通过其各种毒力因子和侵袭酶的综合调节作用,对人体造成或加重一系列炎症感染,引起疖、毛囊炎、菌血症、菌毒血症、坏死性肺炎等疾病。
3.杀白细胞毒素(pvl)作为金葡菌的重要毒力因子之一,可以加重诱发各种感染。杀白细胞毒素阳性的金黄色葡萄球菌携带pvl基因,该基因存在于噬菌体基因组上,可通过噬菌体携带与金黄色葡萄球菌的染色体结合在细菌中传播,临床pvl阳性金黄色葡萄菌检出率有逐年上升的趋势。
4.随着分子生物学的发展,pcr、荧光定量pcr、免疫检测等现代手段引入杀白细胞毒素的快速检测中,这对金葡菌感染的早判定、早治疗起到了积极作用。然而,pcr、荧光定量pcr法易受污染导致结果假阳性,且需要配置专业的检测仪器;免疫检测法操作过程复杂,对实验人员要求高,同时成本高,不适用于我国基层医疗检测机构。交叉引物恒温扩增(crossing priming amplification,cpa)技术是一种新型核酸等温扩增技术,具有高特异性、高敏感性的特征和操作便捷、结果判定清晰等优点,在快速检测领域显示出广阔的发展前景。但cpa反应的引物设计有难度,需要在有限的产物长度中设计五条引物,且避免五条引物自身发生非特异性扩增而影响结果,因此引物的设计尤为重要。
5.中国专利申请cn 109735636a公开了一种psr检测金黄色葡萄球菌杀白细胞毒素的引物、试剂盒与方法,该方法检测灵敏度不够高,检测限仅为53pg/μl,限制了应用范围。
技术实现要素:
6.为了解决现有方法检测灵敏度不足的问题,本发明的目的在于提供一种杀白细胞毒素阳性金黄色葡萄球菌的cpa引物及其检测试剂盒和检测方法。
7.本发明的目的通过下述技术方案实现:
8.一种cpa检测引物,是针对金黄色葡萄球菌的pvl基因设计的,包括剥离引物4s、5a,交叉扩增引物2a1s,以及特异引物2a、3a;其核苷酸序列分别如下所示:
9.靶点pvl剥离引物4s:5
’‑
gttgggatgttgaagcac
‑3’
(seq id no.1)
10.靶点pvl剥离引物5a:5
’‑
tggataacactggcattt
‑3’
(seq id no.2)
11.靶点pvl交叉引物2a1s:5
’‑
gtccagcatttaagttgcggaccatatggcagagat
‑3’
(seq id no.3)
12.靶点pvl特异引物2a:5
’‑
gtccagcatttaagttgc
‑3’
(seq id no.4)
13.靶点pvl特异引物3a:5
’‑
catttcattaccataag
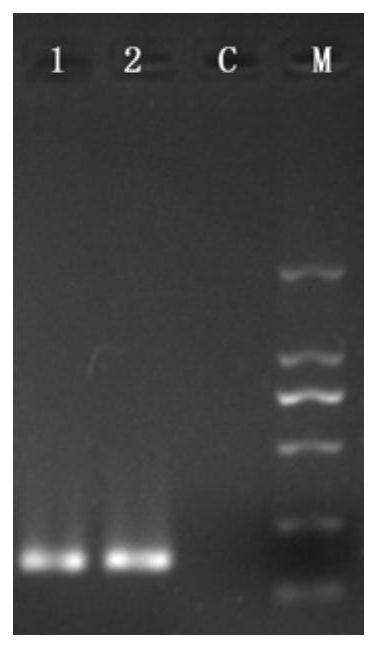
‑3’
(seq id no.5)。
14.一种针对杀白细胞毒素阳性金黄色葡萄球菌的检测试剂盒,包括上述的cpa检测引物;
15.所述试剂盒中,各cpa检测引物的浓度优选10μm;
16.所述的试剂盒还包括如下组分:
17.a、2
×
反应缓冲液:40.0mm的tris
‑
hcl,20.0mm的硫酸铵,20.0mm的氯化钾,16.0mm的硫酸镁,0.2%(v/v)的tween 20,1.4m的甜菜碱,10.0mm的dntps(each);
18.b、bst dna聚合酶;
19.c、钙黄绿素和氯化锰的混合溶液;
20.组分b中所述的bst dna聚合酶优选浓度为8u/μl的bst dna聚合酶水溶液。
21.组分c中所述的钙黄绿素和氯化锰的混合溶液通过如下方法制备得到:
22.(i)将钙黄绿素溶于二甲基亚砜(dmso)中,配制50μm的钙黄绿素溶液;将氯化锰溶于水中,配制1mm的氯化锰水溶液;
23.(ii)取25μl、50μm的钙黄绿素溶液与10μl、1mm的氯化锰水溶液混合均匀,得到钙黄绿素和氯化锰的混合溶液(钙黄绿素与氯化锰的质量比为1:8)。
24.一种针对杀白细胞毒素阳性金黄色葡萄球菌的cpa检测方法,包括如下步骤:
25.(1)提取待检样品的细菌dna作为模板dna,并控制模板dna水溶液的od
260
/od
280
值为1.8~2.0;
26.(2)建立检测pvl的交叉引物恒温扩增反应体系,于60~63℃水浴中保温至少60分钟进行交叉引物恒温扩增反应,待反应完成后于(80
±
2)℃水浴中保温2~3分钟终止反应;
27.其中,交叉引物恒温扩增反应体系为:2
×
反应缓冲液12.5μl,10μm的剥离引物4s和10μm的剥离引物5a各1.5μl,10μm的交叉引物2a1s 2.5μl,10μm的特异引物2a和10μm的特异引物3a各1.25μl,dna模板1.0μl,8u/μl的bst dna聚合酶1.0μl,加去核酸水补足至25μl;最后加入1μl的钙黄绿素与氯化锰的混合溶液;
28.(3)针对靶点pvl的检测,终止反应后肉眼观察反应体系的颜色。待检样品为杀白细胞毒素阴性金黄色葡萄球菌或非金黄色葡萄球菌显示黄色;待检样品为杀白细胞毒素阳性金黄色葡萄球菌显示绿色;
29.步骤(3)优选地,终止反应后对扩增产物做琼脂糖凝胶电泳,杀白细胞毒素阳性金黄色葡萄球菌呈现梯形条带,杀白细胞毒素阴性金黄色葡萄球菌或非金黄色葡萄球菌无扩增条带。
30.本发明相对于现有技术具有如下的优点及效果:
31.(1)本发明针对金黄色葡萄球菌靶序列pvl的保守区域,设计一对剥离引物、交叉引物和特异引物构建交叉引物恒温扩增反应体系,实现了60分钟获得杀白细胞毒素检测结果,改进了现有技术检测周期长、灵敏度低、成本高、现场应用困难等不足。
32.(2)本发明在满足检测可靠性的前提下,实现了高特异性和高灵敏度检测,这对于提高群体疾病和早期疾病的诊断率和准确性具有重要意义。
33.(3)本发明在恒温条件下扩增,减少升温降温的时间成本。同时,该技术不需要特殊、昂贵的仪器和试剂,检测成本较低,扩增产物不需要凝胶电泳,操作简便,可以直观地用
荧光染料显色凭肉眼判断结果。本发明的试剂盒及方法特别适用中小型单位及现场检测。
附图说明
34.图1为交叉引物恒温扩增反应技术检测杀白细胞毒素阳性金黄色葡萄球菌的凝胶电泳结果及显色结果图。其中,图a为凝胶电泳结果;图b为显色结果;1为金黄色葡萄球菌atcc25923,2为金黄色葡萄球菌atcc49775,ng为空白对照。
35.图2为剥离引物筛选的电泳结果图。其中,1:pvl
‑
1剥离引物;2:pvl
‑
2剥离引物;c:空白对照。
36.图3为交叉引物恒温扩增技术检测杀白细胞毒素阳性金黄色葡萄球菌的引物电泳结果图。其中,1
‑
2:pvl
‑
1引物对应的检测结果,3
‑
4:pvl
‑
2对应的检测结果,c:空白对照。
37.图4为检测靶点pvl特异性的实验结果图。其中,1:金黄色葡萄球菌atcc49775;2:金黄色葡萄球菌atcc25923;3:铜绿假单胞菌atcc27853;4:铜绿假单胞菌atcc1014;5:铜绿假单胞菌atcc15442;6:铜绿假单胞菌atcc17934;7:铜绿假单胞菌atcc35032;8:沙门氏菌atcc14028;9:单增李斯特菌atcc19115;10:单增李斯特atcc19114;11:大肠杆菌atcc43895;12:大肠杆菌e019;13:大肠杆菌e020;14:大肠杆菌e043;15:大肠杆菌e044;16:副溶血性弧菌atcc17802;17:副溶血性弧菌atcc27969;18:干酪乳杆菌bm
‑
lc14617;ng1(阴性对照):金黄色葡萄球菌110749;ng2(阴性对照):去核酸水。
38.图5为检测靶点pvl灵敏度实验结果图。其中,1为3.4ng/μl,2为340pg/μl,3为34pg/μl,4为3.4pg/μl,5为340fg/μl,6为34fg/μl,7为3.4fg/μl,8为340ag/μl,ng为阴性对照。
具体实施方式
39.下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
40.实施例1
41.基于交叉引物恒温扩增技术检测杀白细胞毒素阳性金黄色葡萄球菌的方法,包括以下步骤:
42.1、本实施例以杀白细胞毒素阳性金黄色葡萄球菌为例,使用试剂如下:
43.a.浓度各为10μm的剥离引物4s、5a,交叉扩增引物2a1s,以及特异引物2a、3a,引物序列如前文seq id no.1
‑
seq id no.5所示;
44.b.2
×
反应储液:由浓度为40.0mm的tris
‑
hcl,20.0mm的硫酸铵,20.0mm的氯化钾,16.0mm的硫酸镁,0.2%(v/v)的tween 20,1.4m的甜菜碱,10.0mm的dntps(each)组成;
45.c.浓度为8u/μl的bst dna聚合酶(大片段,neb公司)水溶液;
46.d.钙黄绿素和氯化锰的混合溶液:先配制浓度为50μm的钙黄绿素溶液(二甲基亚砜溶解);然后取25μl、50μm的钙黄绿素溶液,与10μl、1mm的氯化锰水溶液混合均匀(钙黄绿素溶液与氯化锰溶液的浓度比为1:8)。
47.2、使用上述试剂利用交叉引物恒温扩增技术检测杀白细胞毒素阳性金黄色葡萄球菌,包括如下步骤:
48.(1)提取待检样品的细菌dna作为模板dna:
49.本实施例同时设置实验组和空白对照组,其中实验组为两株杀白细胞毒素阳性的金葡菌atcc49775和atcc25923,均由公开途径获得;
50.采用dna提取试剂盒(广东东盛生物科技有限公司)提取各组细菌dna,按照试剂盒说明书操作,实验组所得细菌dna水溶液的od
260
/od
280
的值(260nm和280nm下吸光光度比值)为1.8。
51.(2)建立检测pvl的交叉引物恒温扩增反应:
52.在反应管中配制总体积为26μl的交叉引物恒温扩增反应体系:加入2
×
反应储液12.5μl,4s与5a等体积混合引物混合液3.0μl,交叉引物2a1s 2.5μl,特异引物2a与3a等体积混合液2.5μl,bst dna聚合酶1μl,dna模板1.0μl,用去核酸水补充体积至25μl,最后加入上述浓度的钙黄绿素及氯化锰混合液水溶液1μl,混匀即可。此时各物质浓度为:tris
‑
hcl 20.0mm,硫酸铵10.0mm,氯化钾10.0mm,硫酸镁8.0mm,tween 20 0.1%(v/v),甜菜碱0.7m,dntps(each)1.4mm,bst dna聚合酶8u,剥离引物4s、5a各0.6μm,交叉引物2a1s 1.0μm,特异引物2a及3a各0.5μm。将反应管置于63℃水浴中保温反应60分钟,再于80℃水浴中保温2分钟终止反应。
53.空白对照组不加dna模板。
54.(3)显色检测:
55.待反应结束后,用肉眼观察颜色变化。
56.结果如图1所示:空白对照组显色为黄色,说明该样品不含有金葡杀白细胞毒素基因;实验组显色为绿色,说明该金葡携带杀白细胞毒素基因。
57.随后对扩增产物进行2%的琼脂糖凝胶电泳,实验组呈现梯形条带,空白对照组无扩增条带,与肉眼观察结果一致。
58.实施例2
59.交叉恒温扩增反应检测金葡杀白细胞毒素引物筛选试验,包括以下步骤:
60.将检测引物pvl
‑
1和pvl
‑
2按照实施例1中的反应体系和条件建立交叉恒温扩增反应检测方法,进行引物筛选试验。
61.对靶点pvl设计对应的cpa检测引物,引物筛选过程是先将设计的4s和5a引物作为pcr反应的上下游引物,分析该靶点区域是否可使用对应剥离引物进行扩增,同时分析剥离引物是否具有较高的特异性。当反应出现单一条带且与产物大小对应时,即表明该引物具有较好的特异性,若剥离引物出现非特异性扩增时会出现梯状条带,可能导致后续的假阳性结果。
62.2套检测引物设计如下:
63.pvl
‑
1:
64.靶点pvl剥离引物4s:5
’‑
gttgggatgttgaagcac
‑3’
(seq id no.1)
65.靶点pvl剥离引物5a:5
’‑
tggataacactggcattt
‑3’
(seq id no.2)
66.靶点pvl交叉引物2a1s:5
’‑
gtccagcatttaagttgcggaccatatggcagagat
‑3’
(seq id no.3)
67.靶点pvl特异引物2a:5
’‑
gtccagcatttaagttgc
‑3’
(seq id no.4)
68.靶点pvl特异引物3a:5
’‑
catttcattaccataag
‑3’
(seq id no.5)。
69.pvl
‑
2:
70.靶点pvl剥离引物4s:5
’‑
tgaaattaaagtgaaaggac
‑3’
(seq id no.6)
71.靶点pvl剥离引物5a:5
’‑
atcggaatctgatgttgc
‑3’
(seq id no.7)
72.靶点pvl交叉引物2a1s:5
’‑
tgtgatatgttgagctgcagttgttacatcaattgcat
‑3’
(seq i d no.8)
73.靶点pvl特异引物2a:5
’‑
tgtgatatgttgagctgc
‑3’
(seq id no.9)
74.靶点pvl特异引物3a:5
’‑
tcaactgtattggatagc
‑3’
(seq id no.10)。
75.图2实验结果表明设计的两对剥离引物4s和5a扩增出的产物单一,具有较好的特异性。随后将两套引物用于检测金葡杀白毒素。
76.图3实验结果表明,仅pvl
‑
1能成功实现金葡杀白毒素的检测。实验结果表明,所设计的剥离引物即使具有较好的特异性,也无法完全保证后续cpa扩增反应的顺利进行。
77.实施例3
78.交叉恒温扩增反应检测金葡杀白细胞毒素特异性试验,包括以下步骤:
79.将杀白细胞毒素阳性金黄色葡萄球菌与非金黄色葡萄球菌的基因组dna按照实施例1中的反应体系和条件建立交叉恒温扩增反应检测方法,进行特异性试验。
80.其中,非金黄色葡萄球菌为:铜绿假单胞菌atcc27853;铜绿假单胞菌atcc1014;铜绿假单胞菌atcc15442;铜绿假单胞菌atcc17934;铜绿假单胞菌atcc35032;沙门氏菌atcc14028;单增李斯特菌atcc19115;单增李斯特atcc19114;大肠杆菌atcc43895;大肠杆菌e019;大肠杆菌e020;大肠杆菌e043;大肠杆菌e044;副溶血性弧菌atcc17802;副溶血性弧菌atcc27969;干酪乳杆菌bm
‑
lc14617。
81.本发明所涉及的大肠杆菌e019、大肠杆菌e020、大肠杆菌e043和大肠杆菌e044已在文献(周蓉.低温储藏对肠出血大肠杆菌vbnc状态的诱导及毒素表达量的影响研究[d].华南理工大学,2015.)公开,本实验室保存。
[0082]
所涉及的干酪乳杆菌bm
‑
lc14617已在文献(junyan liu,lin li,bing li,brian m.peters,yang deng*,zhenbo xu*,mark e.shirtliff.the viable but nonculturable state induction and genomic analyses of lactobacillus casei bm
‑
lc14617,a beer
‑
spoilage bacterium[j].microbiologyopen,2017,6(5):e00506.)公开,本实验室保存。
[0083]
设置杀白细胞毒素阳性金黄色葡萄球菌atcc49775和atcc25923为阳性对照,杀白细胞毒素阴性金黄色葡萄球菌110749和去核酸水为阴性对照。
[0084]
金黄色葡萄球菌110749已在文献(zhenbo xu*,yanrui liang,shiqi lin,dingqiang chen*,bing li,lin li,yang deng.crystal violet and xtt assays on staphylococcus aureus biofilm quantification[j].current microbiology,2016,73(4):474
‑
482.)公开,本实验室保存。
[0085]
对扩增产物进行2%的琼脂糖凝胶电泳,结果如图4所示。杀白细胞毒素阳性金黄色葡萄球菌基因组的反应体系呈现梯形条带,阴性组无扩增条带,与预期结果一致。
[0086]
如此表明,基于交叉引物恒温扩增反应检测金葡杀白细胞毒素的引物具有较高的特异性。
[0087]
实施例4
[0088]
交叉恒温扩增反应检测金葡杀白细胞毒素的灵敏度对比试验,包括以下步骤:
[0089]
将抽提得到的杀白细胞毒素阳性金黄色葡萄球菌atcc25923的基因组dna进行10倍浓度梯度稀释,分别为3.4ng/μl,340pg/μl,34pg/μl,3.4pg/μl,340fg/μl,34fg/μl,3.4fg/μl,340ag/μl。
[0090]
同时设置阴性对照ng(去核酸水),按照实施例3中的反应体系构建交叉恒温扩增方法并对扩增产物进行2%的琼脂糖凝胶电泳,以确定检测方法的灵敏度。
[0091]
结果如图5所示,样品中杀白细胞毒素阳性金葡菌dna的浓度高于3.4pg/μl的组别均出现了梯形条带,呈现阳性结果。结果表明:建立的金葡杀白细胞毒素交叉恒温扩增反应方法可检测样品中3.4pg/μl反应的杀白细胞毒素阳性金葡菌dna。
[0092]
结论:从上述实验结果可以看出,本发明cpa检测方法相比具有如下优点:
[0093]
检测周期短:常规pcr和荧光定量pcr技术通常需要2~4个小时才能出结果,本发明所提供的检测方法在60分钟内就可对检测结果做出判断。
[0094]
操作便捷:所需仪器简单,仅需要一个普通水浴锅,结合荧光染料可以直观判读检测结果,省去了常规pcr的电泳步骤,在快速检测及现场检测的实践中有广泛的应用前景。
[0095]
特异性强:利用特异性扩增判断目的基因存在与否,从而完成对细菌的定性检测。
[0096]
灵敏度高:常规pcr检测方法的灵敏度为100pg/μl,在先专利的检测限为53pg/μl,而本发明cpa检测方法对杀白细胞毒素阳性金黄色葡萄球菌dna的检测限可达3.4pg/μl,灵敏度比常规pcr高30倍左右,比psr方法高15倍左右,大大拓宽了应用范围。
[0097]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

