1.本发明涉及生化药物检测领域,具体涉及一种小牛血清动物源性成分 种属的检测鉴别方法。
背景技术:
2.小牛血清去蛋白注射液为小牛血清经乙醇沉淀去蛋白、浓缩、多次超 滤除菌等工艺制得的无菌水溶液。其已收载于国家药品标准中,该标准虽 规定了产品的动物种属来源,但并未提出具体的小牛血清种属来源的检测 鉴别方法。由于在小牛血清去蛋白注射液生产过程中,小牛血清去蛋白提 取物要经多次超滤步骤,本产品的制剂中的活性成分与中间体已不具备通 过核酸分子技术来检测鉴别小牛血清的种属来源的条件,小牛血清由于其 经过了搅拌、离心等多道工序而获得,其模板dna的含量更低且不易扩增, 因此,如何能够有效检测出不同种属来源的小牛血清,对于鉴别产品是否 符合国家有关的质量要求尤为关键。
3.聚合酶链式反应法(polymerase chain reaction,pcr)系指通过提取 样品中物种的遗传物质脱氧核糖核酸(dna),对dna中具有种属特异性 的片段进行聚合酶链式反应扩增,并对扩增产物进行检测,以检测不同种 属来源的动物源性成分产品,常规pcr法采用琼脂糖凝胶电泳对pcr扩增 产物进行检测,通过与dna分子量marker进行比较,将样品扩增产物的 片段大小与预期大小进行比较,从而判断样品中是否含有特定的动物源性 成分。
4.国家标准gb/t21101
‑
2007公开了动物源性饲料中猪源性成分定性检测 的pcr方法。该方法属于从固体原料中提取dna,其模板dna浓度相对 有保证,扩增容易。但是,该方法不适用于药品行业中dna浓度较低的液 体动物源性原料,且该方法使用试剂复杂,相对于药品检验实验室不易操 作。
5.国家标准gb/t 20190
‑
2006公开了饲料中牛羊源性成分定性检测的 pcr方法。该方法同样属于从固体原料中提取dna,其模板dna浓度相 对有保证,扩增容易。但该方法不适用于药品行业中dna浓度较低的液体 动物源性原料,且该方法使用试剂复杂,相对于药品检验实验室不易操作。
6.因此,为了有效检测小牛血清去蛋白注射液的小牛血清的种属来源以 确定其是否符合相关质量要求,保证小牛血清原料确实来源于牛源性成分, 亟需一种针对原材料小牛血清的牛、猪及羊源性成分的检测鉴别方法。
7.开发一种专属性好、灵敏度高、扩增速度快、操作简便、成本低的小 牛血清动物源性成分种属的检测方法是有必要的。
技术实现要素:
8.针对以上技术现状,本发明的目的是提供一种专属性好、灵敏度高、 操作简便的小牛血清动物源性成分种属的检测方法,本发明所述方法包括 如下步骤:
9.(1)模板dna制备:提取样品的基因组dna,测定浓度,稀释,作 为样品模板dna;
10.(2)pcr扩增:取步骤(1)中所得样品模板dna,鉴别引物为seq id no:1和seq id no:2;或为seq id no:3和seq id no:4;或为 seq id no:5和seq id no:6;pcr扩增反应体系为样品模板dna、鉴 别引物混合液、pcr扩增试剂、水,扩增条件为:94℃预变性1
‑
5分钟, 然后94
‑
95℃变性30
‑
60秒、50
‑
60℃退火30
‑
45秒、72℃延伸30
‑
60秒,循 环30
‑
35次,72℃延伸5min,4℃保温结束反应;
11.(3)酶切反应:取步骤(2)所得样品模板dna扩增产物,限制性内 切酶为dpn ii酶、mnl i酶、或sau3a i酶,酶切反应体系为扩增产物、限 制性内切酶、酶反应缓冲液、无菌水,酶切反应条件为:37℃60
‑
120分钟,65℃5
‑
20分钟,4℃保温结束反应;作为示例性的说明,37℃酶切60min、 80min、100min、120min。
12.(4)琼脂糖凝胶电泳测定:取步骤(3)所得酶切产物,制胶,点样, 电泳。
13.本发明方法中,所述动物源性成分包括牛源性成分、猪源性成分或羊 源性成分。
14.本发明方法中,作为实施方案之一,所述方法步骤(2)中扩增条件为: 94℃预变性3
‑
5分钟,然后94
‑
95℃变性30
‑
45秒、55
‑
59℃退火30秒、72℃ 延伸30
‑
45秒,循环35次,72℃延伸5min,4℃保温结束反应;
15.本发明方法中,作为实施方案之一,进一步优选扩增条件为:94℃预 变性5分钟,然后94℃变性30秒、57℃退火30秒、72℃延伸30秒,循环 35次,72℃延伸5min,4℃保温结束反应。作为示例性说明,退火温度为 55℃、56℃、57℃、58℃、59℃。
16.本发明方法中,作为实施方案之一,所述方法步骤(3)中酶切反应条 件为:37℃60分钟,65℃20分钟,4℃保温结束反应。
17.本发明方法中,作为实施方案之一,所述方法进一步包括:所述样品 包括对照品和供试品,所述供试品为小牛血清;所述对照品为小牛血清、 猪血清或羊血清。
18.本发明方法中,作为实施方案之一,所述方法进一步包括:步骤(1) 中提取的dna用水稀释制成每1ml中含dna 1.25~5μg的溶液,优选每1ml 中含5μg的溶液。
19.本发明方法中,作为实施方案之一,所述方法进一步包括:步骤(2) 中pcr扩增试剂为premix ex taq hs、taq hs perfect mix、或premix taq
tm
, pcr扩增反应体系为样品模板dna 5
‑
8μl、优选5μl,鉴别引物混合液 0.5
‑
1μl、优选1μl,扩增试剂10μl、无菌水补足至20μl。
20.本发明方法中,作为实施方案之一,所述方法步骤(2)中pcr扩增试 剂为premix ex taq hs,pcr扩增反应体系为样品模板dna 5μl、鉴别引物 混合液1μl、premix ex taq hs 10μl、无菌水补足至20μl。
21.本发明方法中,作为实施方案之一,所述步骤(4)进一步包括:
22.(4
‑
1)琼脂糖凝胶的配制:称取琼脂糖1.5g,加琼脂糖凝胶电泳缓冲 液50ml,加热使完全溶胀,加入核酸染料5μl,趁热将胶液倾注于制胶板上, 涂层厚度约10mm,插入加样梳,静置,待凝胶凝固成无气泡的均匀薄层, 拔出加样梳,即得;
23.(4
‑
2)电泳检测:分别取步骤(3)所得供试品和对照品限制性内切酶 酶切反应液各9μl,加上样缓冲液1μl,混匀,加到琼脂糖凝胶板上,在另 一单独泳道加入dna分子量marker5μl,恒压70
‑
100v、优选80v,电泳 40
‑
80分钟、优选45分钟,置于紫外凝胶成像系统上成像,观察。
24.本发明方法中,作为实施方案之一,所述步骤(4
‑
1)中琼脂糖凝胶电 泳缓冲液按
以下方法制得:取三羟甲基氨基甲烷4.84g,二水合乙二胺四醋 酸二钠0.37g,加水800ml,充分搅拌使溶解。再加冰醋酸1.14ml,搅拌均 匀,用氢氧化钠试液调节ph至8.3,用水稀释至1000ml,即得。
25.本发明方法中,作为实施方案之一,所述步骤(4
‑
2)中上样缓冲液按 以下方法制得:取溴酚蓝0.25g,二水合乙二胺四醋酸二钠1.12g,加水30ml, 充分搅拌使溶解,用氢氧化钠试液调节ph至8.0,加甘油50ml,混匀,用 水稀释至100ml,即得。
26.本发明方法中,作为实施方案之一,所述方法进一步包括:
27.鉴别牛源性成分时,所述对照品为小牛血清,所述步骤(2)中的鉴别 引物为seq id no:1和seq id no:2,所述对照品分别在214bp及57bp 处各有一条dna条带;或
28.鉴别猪源性成分时,所述对照品为猪血清,所述步骤(2)中的鉴别引 物为seq id no:3和seq id no:4,所述对照品分别在196bp及16bp 处各有一条dna条带;或
29.鉴别羊源性成分时,所述对照品为羊血清,所述步骤(2)中的鉴别引 物为seq id no:5和seq id no:6,所述对照品分别在202bp及91bp 处各有一条dna条带。
30.本发明方法中,作为实施方案之一,所述方法进一步包括:鉴别牛源 性成分时,所述步骤(3)中的限制性内切酶为dpn ii酶,酶切体系为扩增 产物5μl、dpn ii反应缓冲液1μl、dpn ii酶0.5μl、加无菌水补足至10μl; 或
31.鉴别猪源性成分时,所述步骤(3)中的限制性内切酶为mnl i酶,酶 切体系为扩增产物5μl、mnl i反应缓冲液1μl、mnl i酶0.5μl、加无菌水补 足至10μl;或
32.鉴别羊源性成分时,所述步骤(3)中的限制性内切酶为sau3a i酶, 酶切体系为扩增产物5μl、sau3a i反应缓冲液1μl、sau3a i酶0.5μl、加无 菌水补足至10μl。
33.本发明方法中,作为实施方案之一,所述步骤(1)中可使用常用的dna 提取试剂盒按照说明书进行提取,作为示例性的说明,可使用promega公 司的magnetic dna purification system for food试剂盒或其他同等 效果的试剂盒。
34.本发明中,作为实施方案之一,所述步骤(1)中测定基因组dna提 取液浓度,照紫外
‑
可见分光光度法(中国药典2020年版四部通则0401), 在260nm的波长处测定吸光度,按下式计算出基因组dna提取液浓度
[0035][0036]
式中c为基因组dna提取液浓度(μg/ml);
[0037]
a
260
为基因组dna提取液在260nm处的吸光度;
[0038]
0.020为每1ml含有1μg dna的溶液在260nm处的吸光度;
[0039]
l为光程(cm);
[0040]
n为基因组dna提取液的稀释倍数。
[0041]
本发明中,作为实施方案之一,所述步骤(1)中测定基因组dna提 取液浓度,可使用基于相同原理的dna浓度测定仪器进行基因组dna提 取液的浓度测定,并根据所使用的仪器操作说明进行浓度计算,作为示例 性说明,可根据epoch超微量核酸分析仪的操作说明测定基因组dna提取 液的浓度。
[0042]
本发明中,作为实施方案之一,所述步骤(2)中可使用常用的pcr扩 增试剂按照说明书配制样品的反应体系,体系中包含taq酶、与taq酶相匹 配的缓冲液、鉴别引物混合液、
供试品或对照品的模板dna以及dntp等 pcr反应所需的成分,作为示例性的说明,可使用宝生物工程大连有限公 司的premix ex taq hs或其他同等效果的试剂。
[0043]
本发明的小牛血清动物源性成分种属鉴别方法相对于现有技术,具有 专属性好、灵敏度高、扩增速度快、操作简便、成本低的优点,更适合于 鉴别药品行业中dna浓度较低的液体动物源性原料,可以有效保证实验室 检验需求。
附图说明
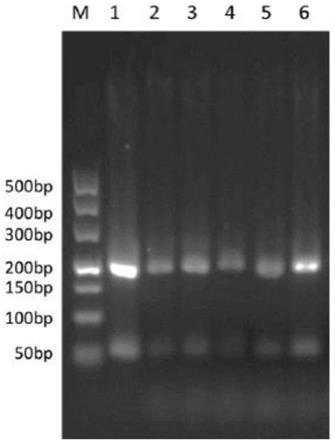
[0044]
图1:实施例1中小牛血清样品牛源性成分鉴别的电泳图,泳道m: dna分子量marker(dl500);泳道1:牛源性成分对照品;泳道2
‑
6:样 品2、3、4、5、8;
[0045]
图2:实施例2中小牛血清样品猪源性成分鉴别的电泳图,其中泳道m: dna分子量marker(dl500);泳道1:猪源性成分对照品;泳道2
‑
7:样 品1、2、3、4、5、8;
[0046]
图3:实施例3中小牛血清样品羊源性成分鉴别的电泳图,泳道m: dna分子量marker(dl500);泳道1:羊源性成分对照品;泳道2
‑
7:样 品1、2、3、4、5、8;
[0047]
图4:实施例4中基因组dna溶液浓度对牛源性成分鉴别的影响电泳 图,其中泳道m:dna分子量marker(dl500);泳道1:样1模板dna (5ng/μl);泳道2:样1模板dna(2.5ng/μl);泳道3:样1模板dna(1.25 ng/μl);泳道4:样1模板dna(0.62ng/μl);泳道5:样1模板dna (0.31 ng/μl);泳道6:样1模板dna (0.16ng/μl);
[0048]
图5:实施例4中基因组dna溶液浓度对猪源性成分鉴别的影响电泳 图,泳道m:dna分子量marker(dl500);泳道1:样6模板dna(5ng/μl); 泳道2:样6模板dna(2.5ng/μl);泳道3:样6模板dna (1.25ng/μl); 泳道4:样6模板dna(0.62ng/μl);泳道5:样6模板dna(0.31ng/μl); 泳道6:样6模板dna(0.16ng/μl);
[0049]
图6:实施例4中基因组dna溶液浓度对羊源性成分鉴别的影响电泳 图,泳道m:dna分子量marker(dl500);泳道1:样7模板dna(5ng/μl); 泳道2:样7模板dna(2.5ng/μl);泳道3:样7模板dna(1.25ng/μl); 泳道4:样7模板dna(0.62ng/μl);泳道5:样7模板dna(0.31ng/μl); 泳道6:样7模板dna(0.16ng/μl);泳道7:样7模板dna(0.08ng/μl); 泳道8:样7模板dna(0.04ng/μl);
[0050]
图7:实施例7中牛、猪及羊源性成分鉴别专属性验证电泳图,其中泳 道m:dna分子量marker(dl500);泳道1:猪源性成分对照品(5ng/μl); 泳道2:牛源性成分对照品(5ng/μl);泳道3:羊源性成分对照品(5ng/μl);
[0051]
图8:实施例8中牛猪混合样品中猪源性成分鉴别电泳图,泳道m: dna分子量marker(dl500);泳道1:猪源性成分对照品;泳道2:猪源 性成分50%;泳道3:猪源性成分10%;泳道4:猪源性成分1%;泳道泳 道5:猪源性成分0.1%;泳道6:猪源性成分0.01%;
[0052]
图9:实施例9中牛羊混合样品中羊源性成分鉴别电泳图,泳道m: dna分子量marker(dl500);泳道1:羊源性成分对照品;泳道2:羊源 性成分50%;泳道3:羊源性成分10%;泳道4:羊源性成分1%;泳道5: 羊源性成分0.1%;泳道6:羊源性成分0.01%;
[0053]
图10:实施例5中pcr扩增条件对鉴别方法的影响电泳图,泳道m: dna marker(dl500);泳道1:55℃;泳道2:56℃;泳道3:57℃;泳 道4:58℃;泳道5:59℃;
[0054]
图11:实施例6中酶切条件对鉴别方法的影响,泳道m:dna marker (dl500);泳道1:60min;泳道2:80min;泳道5:100min;泳道8:120min。
具体实施方式
[0055]
结合以下实施例或试验例对本发明进行进一步的说明,但本发明并不 受限于此。
[0056]
样品:
[0057]
表1样品信息表
[0058][0059]
对照品确认:
[0060]
对提取自样1、样6、样7的基因组dna碱基序列进行测序(委托上 海美吉生物医药有限公司进行),并通过与genbank核酸数据库中的物种序 列进行比对,以此明确上述样品的种属来源。
[0061]
比对结果显示:样1的碱基序列与基因库中搜索到的牛(bos taurus) 最高匹配度为100%,样6的碱基序列与基因库中家猪(sus scrofa)基因匹 配度为100%,样7的碱基序列与羊(ovis aries)基因匹配度为100%。
[0062]
因此,可确认样1、样6、样7的种属来源分别为牛、猪、羊。由于目 前尚无牛、猪及羊源性成分种属鉴别方法的国家标准品,因此,将上述三 个已确认种属来源的基因组dna将分别作为牛、猪、羊源性成分的对照品 使用。
[0063]
试剂与仪器:
[0064]
pcr仪(美国thermo fisher,型号:veriti),紫外凝胶成像系统(美 国proteinsimple,型号:fluorchem fc3),电源及电泳仪(美国bio
‑
rad, 型号:powerpac basic),超微量核酸分析仪(法国biotek,型号:ephoch), dynabeads磁力管架(美国thermo fisher,型号:mpc
‑
s)。
[0065]
基因组dna提取试剂盒:magnetic dna purification system for food(美国promega,批号:0000213187),试剂盒组成包括:裂解缓冲液 a(lysis buffer a)、裂解缓冲液b(lysis buffer b)、沉淀溶液(precipitation solution)、磁珠液(pmps)
[0066]
pcr试剂:premix ex taq hs(大连宝生物,批号:a3202a)
[0067]
rna酶:rnase a(100mg/ml,天根生物技术有限公司,批号:p4506)
[0068]
限制性内切酶:dpn ii(10000u/ml,美国new england biolabs,批号: 0080902);mnl i(5000u/ml,美国new england biolabs,批号:0611403); sau3a i(10000u/ml,大连
宝生物,批号:k3653ca)
[0069]
dpn ii反应缓冲液:nebuffer for dpn ii(美国new england biolabs, 批号:0607)
[0070]
mnl i反应缓冲液:cutsmart buffer(美国new england biolabs,批号: 0051404)
[0071]
sau3a i反应缓冲液:k buffer(大连宝生物,批号:a2701c)
[0072]
核酸染料:gelred(10000
×
,碧云天生物技术有限公司,批号:d0139)
[0073]
琼脂糖:ultrapure agarose(美国life technology,批号:0000424058)
[0074]
dna分子量marker:dl500(大连宝生物,批号:a701a)
[0075]
琼脂糖凝胶电泳缓冲液取三羟甲基氨基甲烷4.84g,二水合乙二胺四 醋酸二钠0.37g,加水800ml,充分搅拌使溶解。再加冰醋酸1.14ml,搅拌 均匀,用氢氧化钠试液调节ph至8.3,用水稀释至1000ml,即得。
[0076]
上样缓冲液取溴酚蓝0.25g,二水合乙二胺四醋酸二钠1.12g,加水 30ml,充分搅拌使溶解,用氢氧化钠试液调节ph至8.0,加甘油50ml,混 匀,用水稀释至100ml,即得。
[0077]
实施例1小牛血清牛源性成分鉴别
[0078]
(1)模板dna制备
[0079]
样品基因组dna提取:
[0080]
分别取样品1(对照品)、样品2
‑
5、8(供试品)各约0.2ml,根据基因 组dna提取试剂盒说明书提取样品基因组dna,具体操作方法如下:
[0081]
(1
‑
1)向0.2ml样品中加入裂解缓冲液a(lysis buffer a)500μl及 rna酶5μl,振荡混匀;
[0082]
(1
‑
2)加入裂解缓冲液b(lysis buffer b)250μl,剧烈振荡15秒;
[0083]
(1
‑
3)室温放置10分钟;
[0084]
(1
‑
4)加入沉淀溶液(precipitation solution)750μl,剧烈振荡15秒;
[0085]
(1
‑
5)每分钟12000转,离心10分钟;
[0086]
(1
‑
6)吸取上清液950μl,转移至另一新的2ml离心管中;
[0087]
(1
‑
7)将磁珠液(pmps)振荡混匀,吸取50μl加入上述上 清液中,剧烈振荡混匀;
[0088]
(1
‑
8)加入800μl异丙醇,上下颠倒混匀10~15次,室温孵育5分钟 后置于dynabeads磁力管架上,待磁珠完全吸附于管壁后,用移液器吸净管 中液体;
[0089]
(1
‑
9)将离心管从磁力管架上取出,加入裂解缓冲液b(lysis buffer b)250μl,上下颠倒混匀2~3次后,重新放置于磁力管架上,待磁珠完全 吸附于管壁后,用移液器吸净管中液体;
[0090]
(1
‑
10)将离心管从磁力管架上取出,加入70%乙醇1ml,上下颠倒混 匀2~3次后,重新放置于磁力管架上,待磁珠完全吸附于管壁后,用移液 器吸净管中液体;
[0091]
(1
‑
11)再次重复第(10)步2次;
[0092]
(1
‑
12)将离心管从磁力管架上取出,打开管盖65℃放置10分钟;
[0093]
(1
‑
13)加入水100μl,关上管盖,振荡混匀,65加热5分钟后将离心 管置于磁力管
架上,待磁珠完全吸附于管壁后,吸取管中液体,置于新的 1.5ml离心管中,即为样品基因组dna提取液。
[0094]
取样品基因组dna提取液2μl,根据epoch超微量核酸分析仪的操作 说明测定基因组dna提取液的浓度。
[0095]
取供试品基因组dna提取液,用水稀释制成每1ml中约含基因组dna 5μg的溶液,作为供试品模板dna。取对照品基因组dna提取液同法操作, 作为对照品模板dna。
[0096]
(2)pcr扩增
[0097]
牛源性成分鉴别引物:
[0098]
上游引物:5
’‑
gcc ata tac tct cct tgg tga ca
‑3’
(seq id no: 1)
[0099]
下游引物:5
’‑
gta ggc ttg gga ata gta cga
‑3’
(seq id no:2) 按下表配制pcr反应体系:
[0100]
表2 pcr反应体系
[0101][0102]
pcr反应条件为:94℃5分钟,循环反应35次(94℃30秒,57℃30 秒,72℃30秒),72℃延伸5min,4℃保温结束反应。
[0103]
(3)酶切反应
[0104]
取步骤(2)中pcr反应产物,按表3配制牛源性成分鉴别的限制性内 切酶酶切反应体系:
[0105]
表3牛源性成分鉴别限制性内切酶酶切体系
[0106][0107]
dpn ii限制性内切酶酶切反应条件为:37℃60分钟,65℃20分钟,4℃ 保温结束反应。
[0108]
(4)琼脂糖凝胶电泳测定:
[0109]
琼脂糖凝胶的配制:
[0110]
称取琼脂糖1.5g,加琼脂糖凝胶电泳缓冲液50ml,加热使完全溶胀, 加入核酸染料5μl,趁热将胶液涂布于制胶板上,涂层厚度约10mm,插入 加样梳,静置,待凝胶凝固成无
气泡的均匀薄层,拔出加样梳,即得。
[0111]
电泳检测:
[0112]
取步骤(3)所得的限制性内切酶酶切反应液9μl,加上样缓冲液1μl, 混匀,加到琼脂糖凝胶板上,在另一单独泳道加入dna分子量marker5μl, 恒压80v,电泳45分钟,置于紫外凝胶成像系统上成像,观察。
[0113]
实验结果:
[0114]
(1)步骤(1)中提取的dna浓度结果见下表:
[0115]
表4样品基因组dna提取液浓度测定结果
[0116][0117]
(2)电泳检测结果:
[0118]
以样1为牛源性成分对照品,对样2~5、样8进行牛源性成分鉴别,对 照品的限制性内切酶酶切反应液应分别在214bp及57bp处各有一条dna 条带,供试品的限制性内切酶酶切反应液dna条带位置均与对照品的一致 (见图1,泳道m:dna分子量marker(dl 500);泳道1:牛源性成分对 照品;泳道2:样2;泳道3:样3;泳道4:样4;泳道5:样5;泳道6: 样8)。
[0119]
结果显示,5批样品均检出牛源性成分。
[0120]
实施例2小牛血清猪源性成分鉴别
[0121]
(1)模板dna制备
[0122]
样品:样6(对照品),样1
‑
5、8(供试品)
[0123]
具体步骤同实施例1步骤(1)。
[0124]
(2)pcr扩增
[0125]
猪源性成分鉴别引物:
[0126]
上游引物:5
’‑
gcc taa atc tcc cct caa tgg ta
‑3’
(seq id no: 3)
[0127]
下游引物:5
’‑
atg aaa gag gca aat aga ttt tcg
‑3’
(seq id no:4)
[0128]
具体步骤同实施例1步骤(2)。
[0129]
(3)酶切反应
[0130]
取步骤(2)中pcr反应产物,按表5配制猪源性成分鉴别的限制性内 切酶酶切反应体系:
[0131]
表5猪源性成分鉴别限制性内切酶酶切体系
[0132][0133]
mnl i限制性内切酶酶切反应条件为:37℃60分钟,65℃20分钟,4℃ 保温结束反应。
[0134]
(4)琼脂糖凝胶电泳测定:
[0135]
具体步骤同实施例1步骤(2)。
[0136]
实验结果:
[0137]
(1)步骤(1)中提取的dna浓度结果见下表:
[0138]
表6样品基因组dna提取液浓度测定结果
[0139][0140][0141]
(2)电泳检测结果:
[0142]
以样6为猪源性成分对照品,对样1~5、样8进行猪源性成分鉴别,对 照品的限制性内切酶酶切反应液应分别在196bp及16bp处各有一条dna 条带,供试品的限制性内切酶酶切反应液均无dna条带(见图2,泳道m: dna分子量marker(dl500);泳道1:猪源性成分对照品;泳道2:样1; 泳道3:样2;泳道4:样3;泳道5:样4;泳道6:样5;泳道7:样8)。
[0143]
结果显示,6批样品均未检出猪源性成分。
[0144]
实施例3小牛血清羊源性成分鉴别
[0145]
(1)模板dna制备
[0146]
样品:样7(对照品),样1
‑
5、8(供试品)
[0147]
具体步骤同实施例1步骤(1)。
[0148]
(2)pcr扩增
[0149]
羊源性成分鉴别引物:
[0150]
上游引物:5
’‑
tat tag gcc tcc ccc ttg tt
‑3’
(seq id no:5)
[0151]
下游引物:5
’‑
ccc tgc tca taa ggg aat agc c
‑3’
(seq id no: 6)
[0152]
具体步骤同实施例1步骤(2)。
[0153]
(3)酶切反应
[0154]
取步骤(2)中pcr反应产物,按表7配制羊源性成分鉴别的限制性内 切酶酶切反应体系:
[0155]
表7羊源性成分鉴别限制性内切酶酶切体系
[0156][0157][0158]
sau3a i限制性内切酶酶切反应条件为:37℃60分钟,65℃20分钟, 4℃保温结束反应。
[0159]
(4)琼脂糖凝胶电泳测定:
[0160]
具体步骤同实施例1步骤(2)。
[0161]
实验结果:
[0162]
(1)步骤(1)中提取的dna浓度结果见下表:
[0163]
表8样品基因组dna提取液浓度测定结果
[0164][0165]
(2)电泳检测结果:
[0166]
以样7为羊源性成分对照品,对样1~5、样8进行羊源性成分鉴别,对 照品的限制性内切酶酶切反应液应分别在202bp及91bp处各有一条dna 条带,供试品的限制性内切酶酶切反应液均无dna条带(见图3,泳道m: dna分子量marker(dl 500);泳道1:羊源性成分对照品;泳道2:样1; 泳道3:样2;泳道4:样3;泳道5:样4;泳道6:样5;泳道7:样8。)。 结果显
示,6批样品均未检出羊源性成分。
[0167]
实施例4模板dna浓度对鉴别方法的影响
[0168]
取实施例1
‑
3中样1、样6基因组dna提取液,通过epoch超微量核 酸测定仪对核酸浓度进行测定,用水稀释至dna浓度分别为5、2.5、1.25、 0.62、0.31、0.16ng/μl,取样7基因组dna提取液,测定浓度后用水稀释 至dna浓度分别为5、2.5、1.25、0.62、0.31、0.16、0.08、0.04ng/μl。将 上述dna稀释液分别作为供试品模板dna,按实施例1
‑
3方法分别进行牛、 猪及羊源性成分种属鉴别。
[0169]
结果显示,在进行牛源性成分鉴别时,当模板dna浓度在1.25~5ng/μl 时,在214bp及57bp处各有1条dna条带,当模板dna浓度小于1.25ng/μl 时,仅在214bp处有1条明显的dna条带(见图4,m:dna分子量marker (dl 500);1:样1模板dna(5ng/μl);2:样1模板dna(2.5ng/μl); 3:样1模板dna(1.25ng/μl);4:样1模板dna(0.62ng/μl);5:样 1模板dna(0.31ng/μl);6:样1模板dna(0.16ng/μl));
[0170]
在进行猪源性成分鉴别时,当模板dna浓度在1.25~5ng/μl时,在196bp 及16bp处各有1条dna条带,当模板dna浓度小于1.25ng/μl时,仅在 196bp处有一条dna条带(见图5,m:dna分子量marker(dl 500);1: 样6模板dna(5ng/μl);2:样6模板dna(2.5ng/μl);3:样6模板 dna(1.25ng/μl);4:样6模板dna(0.62ng/μl);5:样6模板dna(0.31 ng/μl);6:样6模板dna(0.16ng/μl));
[0171]
在进行羊源性成分鉴别时,当模板dna浓度在0.16~5ng/μl时,在202bp 及91bp处各有1条dna条带,当模板dna浓度小于0.16ng/μl时,仅在 202bp处有1条dna条带(见图6,m:dna分子量marker(dl 500);1: 样7模板dna(5ng/μl);2:样7模板dna(2.5ng/μl);3:样7模板 dna(1.25ng/μl);4:样7模板dna(0.62ng/μl);5:样7模板dna(0.31 ng/μl);6:样7模板dna(0.16ng/μl);7:样7模板dna(0.08ng/μl); 8:样7模板dna(0.04ng/μl))。
[0172]
因此,当模板dna浓度在1.25~5ng/μl时,对牛、猪及羊源性成分种 属鉴别均无影响。
[0173]
实施例5 pcr扩增条件对鉴别方法的影响
[0174]
在进行pcr扩增条件考察中,除以下pcr扩增条件不同外,其他条件 均与实施例1
‑
3方法相同,分别进行牛、猪及羊源性成分种属鉴别。
[0175]
pcr扩增条件分别为:94℃预变性5分钟,94
‑
95℃变性30秒、55
‑
59℃ 退火30秒,72℃延伸30秒、循环35次,72℃延伸5min,4℃保温结束反 应。其中退火温度是pcr扩增条件最重要的影响因素,所以主要对退火温 度点进行考察:选取了55、56、57、58、59℃分别退火30秒,其他条件不 变。
[0176]
实验结果:参见图10。
[0177]
结果显示,在进行牛源性成分鉴别时,当退火温度在55℃、56℃、57℃、 58℃、59℃时分别会扩增出相应的特异性条带,但是条带亮度57℃时最佳, 59℃时亮度最弱(见附图10)。
[0178]
因此,pcr扩增条件的退火温度在57℃时特异性条带最亮,浓度最大。
[0179]
实施例6酶切反应条件对鉴别方法的影响
[0180]
在进行酶切反应条件的考察中,除以下酶切反应条件不同外,其他条 件均与实施例1
‑
3方法相同,分别进行牛、猪及羊源性成分种属鉴别。
[0181]
酶切反应条件分别为:37℃60
‑
120min,65℃5
‑
20min,4℃保温结束反 应;其中37℃属于酶切温度是酶切的最重要影响因素,65℃为抑制酶切反 应的温度,所以对其酶切时间进行考察,分别为60min、80min、100min、 120min,其他条件优先选取65℃20min,以保证反应结束。
[0182]
实验结果:参见图11。
[0183]
结果显示,在进行牛源性成分鉴别时,当酶切条件分别为60min、80min、 100min、120min时,特异性条带亮度基本一致(见附图11)。
[0184]
因此,考察酶切条件对鉴别方法的影响时,因为60
‑
120min各个条件点 影响不大,所以从优化试验条件考虑,选取37℃60min。
[0185]
实施例7小牛血清动物源性成分鉴别方法的专属性
[0186]
实验方法:
[0187]
样品:样1(牛源性成分对照品),样6(猪源性成分对照品),样7(样 源性成分对照品)
[0188]
将上述3种对照品,分别按实施例1
‑
3方法进行牛、猪、羊源性种属鉴 别。
[0189]
实验结果:进行牛源性成分种属鉴别时,牛源性成分对照品分别在 214bp及57bp处各有一条dna条带,猪、羊源性成分对照品均无dna条 带;在进行猪源性成分种属鉴别时,猪源性成分对照品分别在196bp及16bp 处各有一条dna条带,牛、羊源性成分对照品均无dna条带;在进行羊 源性成分种属鉴别时,羊源性成分对照品分别在202bp及91bp处各有一条 dna条带,牛、猪源性成分对照品均无dna条带。
[0190]
结果表明,本方法具有专属性(见图7,m:dna分子量marker(dl 500);1:猪源性成分对照品(5ng/μl);2:牛源性成分对照品(5ng/μl); 3:羊源性成分对照品(5ng/μl))。
[0191]
实施例8小牛血清对猪源性成分检测的影响
[0192]
为考察本方法对小牛血清中可能混入的猪源性成分的检出能力,分别 将小牛血清(样1)与猪血清(样6)按一定体积比例混合,配制了一系列 牛猪混合血清样品,使混合样品中猪血清的体积分别为样品总体积的50%、 10%、1%、0.1%、0.01%。按实施例2所述的方法,对混合样品中的猪源性 成分进行鉴别。
[0193]
结果显示,当混合样品中猪血清含量不小于1%时,本方法均可检测猪 源性成分(见图8,m:dna分子量marker(dl 500);1:对照品;2:猪 源性成分50%;3:猪源性成分10%;4:猪源性成分1%;5:猪源性成 分0.1%;6:猪源性成分0.01%)。
[0194]
实施例9小牛血清对羊源性成分检测的影响
[0195]
为考察本方法对小牛血清中可能混入的羊源性成分的检出能力,分别 将小牛血清(样1)与羊血清(样7)按一定体积比例混合,配制了一系列 牛羊混合血清样品,使混合样品中羊血清的体积分别为样品总体积的50%、 10%、1%、0.1%、0.01%。按实施例3所述的方法,对混合样品中的羊源性 成分进行鉴别。
[0196]
结果显示,当混合样品中羊血清含量不小于1%时,本方法可检测羊源 性成分(见图9,泳道m:dna分子量marker(dl 500);泳道1:羊源性 成分对照品;泳道2:羊源性成分50%;泳道3:羊源性成分10%;泳道4: 羊源性成分1%;泳道5:羊源性成分0.1%;泳道6:羊源性成分0.01%)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

