一种阻断或减弱水稻osmir7695表达以改良籽粒性状的方法
技术领域
1.本发明属于植物生物技术领域,具体涉及一种阻断或者减弱水稻中osmir7695的表达以改良水稻籽粒性状的方法。
背景技术:
2.微小rna(microrna,mirna)是一类广泛存在于真核生物和病毒中的,由内源基因编码的,长度约为20-24个核苷酸的非编码单链rna分子。大多数mirna基因以单拷贝、多拷贝或基因簇的形式存在于基因组中,经rna聚合酶ii转录为长约300-1000个碱基的初级mirna(primary mirna,pri-mirna),接着加工为长约70-90个碱基含茎环结构的前体mirna(pre-mirna),然后再经过dicer酶酶切,成为长约20-24个碱基的成熟mirna。成熟的mirna随后组装进rna诱导沉默复合体(rna-induced silencing complex,risc),通过碱基互补配对的方式识别并集合靶基因mrna,根据互补程度的不同指导risc降解靶mrna(完全互补)或者阻遏靶mrna翻译(不完全互补),从而参与真核生物的转录后基因表达调控。
3.植物mirna的长度为21nt左右,大部分植物mirna与靶mrna完全互补配对起作用,其结合区域可以位于靶mrna任何区域。在植物的生长发育过程中,mirna发挥着重要作用,参与了各器官的形态建成、植物激素信号转导、各种生物及非生物胁迫应答等过程。因此,利用丰富的mirna基因资源改良植物遗传性状,为人们生产生活服务成为了新的发展方向。然而,随着越来越多的植物mirna被鉴定和获得,绝大部分mirna的生物学功能还不清楚。比如水稻osmir7695基因就是一条基于高通量测序发现的水稻mirna,其注释前体序列长度487bp,mirbase登录号为mi0025202,位于水稻1号染色体11666716-11667202bp区间,而目前未见关于水稻osmir7695功能的报道。
4.最近,靶基因类似物(target mimicry,tm)或短串联靶标类似物(short tandem target mimic,sttm)的策略被用于mirna分子功能研究,通过获得干扰(或封闭)目标mirna的材料,以期评价mirna针对靶基因去阻遏影响程度,进而分析mirna分子功能。此外,目前也有基于crispr-cas13的rna功能干扰研究报道。
5.crispr-cas9是一种基因编辑系统,之前有基于crispr-cas9方法敲除植物mirna编码基因的突变体创制的报道。而crispr-cas12a(crispr-cpf1)系统是近年来发现的新的基因编辑系统。其与crispr-cas9不同,因其具备“t/a”富集区的pam识别位点、向导rna为结构简单的单一crrna分子、产生粘性末端、删除片断比较大(大多为6bp-13bp)等特性或优点,预期对于定向编辑mirna编码基因可能具备特有优势。但目前,基于crispr-cas12a对植物mirna编码基因进行明确编辑突变体创制,有效解析mirna对应生物功能,进而挖掘有育种价值的植物mirna位点的工作尚未见报道。
技术实现要素:
6.本发明要解决的技术问题是改良水稻籽粒性状。
7.本发明解决技术问题的技术方案是提供一种改良水稻籽粒性状的方法。该方法通
过阻断或者减弱水稻中osmir7695的表达,提高水稻籽粒性状。
8.其中,上述方法中所述的阻断或者减弱水稻中osmir7695的表达可通过敲除水稻osmir7695编码基因或者干扰osmir7695编码基因表达产物的作用进行。
9.其中,上述方法中所述的干扰osmir7695表达产物作用的方法包括rna干扰法、反义rna法、靶基因类似物(target mimicry,tm)法短串联靶标类似物(short tandem target mimic,sttm)法或crspr-cas13法中的至少一种。
10.其中,上述方法中所述的敲除水稻基因组中的osmir7695编码基因的方法包括采用基因组编辑法、同源重组法或随机插入突变法中的至少一种进行。
11.其中,上述方法中所述的基因组编辑法包括巨大核酸酶(meganuclease)法、zfn法、talen法或crispr-cas法中的至少一种。
12.其中,当上述方法中使用crispr-cas法敲除水稻基因组中的osmir7695编码基因时,包括以下步骤:
13.a、设计针对水稻osmir7695编码基因的向导rna;
14.b、构建可表达该向导crrna的cas基因编辑表达载体;
15.c、用步骤a的得到的表达载体转化水稻,利用crispr-cas基因编辑体系得到转化植株;
16.d、收集转化植株的种子,筛选出水稻osmir7695编码基因定向编辑突变体种子,即得提高籽粒性状的水稻突变体。
17.其中,上述方法中的用于敲除水稻基因组中的osmir7695编码基因的crispr-cas法包括crispr-cas9、crispr-cas12a或crispr-cas12b等方法中的至少一种。
18.进一步的,上述方法中所述的针对水稻osmir7695编码基因的向导rna的核苷酸序列为seq id no.2所示(5
’-
attgtggtcttgcctatgtggca-3’)。该向导rna用于crispr-cas12a基因编辑系统。
19.其中,上述方法中所述的提高水稻籽粒性状为提高千粒重、粒长或粒宽中的至少一种。
20.在此基础上,本发明提供了阻断或者减弱水稻中osmir7695的表达的试剂在提高水稻籽粒性状中的用途。
21.其中,上述用途中所述的阻断或者减弱水稻中osmir7695的表达的试剂包括敲除水稻osmir7695编码基因的试剂或者干扰osmir7695编码基因表达产物的试剂中的至少一种。
22.其中,上述用途中所述的干扰osmir7695表达产物作用的试剂包括使用rna干扰法、反义rna法、crispr-cas13法、靶基因类似物(target mimicry,tm)法或短串联靶标类似物(short tandem target mimic,sttm)或crispr-cas13法中的至少一种以减弱osmir7695表达产物作用所使用的试剂。
23.其中,上述用途中所述的rna干扰法减弱osmir7695表达产物作用使用的试剂包括针对osmir7695表达产物的sirna(小干扰rna,small interfering rna)、反义rna、靶基因类似物、短串联靶标类似物、用于crispr-cas13法的向导rna。
24.其中,上述用途中所述的降低水稻osmir7695表达的试剂包括敲除水稻基因组中的osmir7695编码基因的试剂。
25.进一步的,上述用途中所述的敲除水稻基因组中的osmir7695编码基因的试剂包括针对osmir7695编码基因的用于巨大核酸酶(meganuclease)法的巨大核酸酶,用于zfn法的zfn蛋白、用于talen法的talen蛋白,用于crispr-cas法的向导rna、用于同源重组法的重组dna片段、或用于随机插入突变法的t-dna(transfer dna,转移dna)或转座子中至少一种。
26.进一步的,上述用途中所述的用于crispr-cas12a法的向导的核苷酸序列为seq id no.2所示。
27.同时,本发明也提供了一种针对水稻osmir7695编码基因的向导rna。进一步的,该向导rna的编码核苷酸序列为5
’-
attgtggtcttgcctatgtggca-3’(seq id no.2)。
28.同时,本发明提供了装载有上述crrna的载体。
29.进一步的,上述载体为用于crispr-cas基因编辑技术的cas编辑表达载体。优选的,所述的crispr-cas基因编辑技术为crispr-cas12a技术。
30.本发明的有益效果在于:本发明提供了一种改良水稻籽粒性状的方法,该方法通过阻断或者减弱水稻中osmir7695的表达从而来提高水稻籽粒性状。本发明方法中,敲除水稻osmir7695编码基因,或者影响osmir7695编码基因表达产物的作用,是阻断或者减弱水稻中osmir7695的表达的两种主要方式。在本发明的实施例中,敲除水稻osmir7695编码基因后得到了得到籽粒千粒重、粒长或粒宽增加的水稻突变体,表明其籽粒性状得到了很大的改良,而其他农艺性状没有明显改变。本发明方法步骤简明、易于操作,在水稻的品质改良以及基因组功能研究和应用方面具有很好的前景。
附图说明
31.图1、osmir7695位点茎环结构及crispr-cas12a定向突变载体示意图。a、osmir7695位点(mi0025202)茎环结构示意图,下划线碱基区域为成熟osmir7695-5p(mimat0029961),下划线斜体碱基区域为成熟osmir7695-3p(mimat0029962)。b、水稻定向敲除osmir7695定向突变载体(ptx377_osmir7695)t-dna区域结构示意图,加粗为pam位点序列,斜体为osmir7695-crrna序列。
32.图2、osmir7695编辑载体(ptx377_osmir7695)部分水稻t0代转化植株分子鉴定。a、水稻osmir7695编辑载体转化阳性pcr检测结果。b、水稻基因组osmir7695编辑位点sscp鉴定结果,斜体编号植株为候选编辑突变体植株。c、水稻候选编辑突变体osmir7695位点pcr扩增产物sanger测序结果,粗体为lbcas12a编辑识别序列pam位点,斜体为crrna序列,下划线为水稻osmir7695-5p成熟体序列(mimat0029961)。
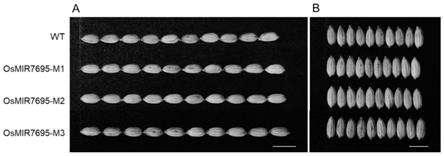
33.图3、水稻osmir7695编辑突变体t3代植株籽粒表型。a、水稻野生型植株(osmir7695_wt)与水稻osmir7695位点编辑突变体植株(osmir7695
–
m1、m2、m3)t3代籽粒粒长对比结果。a、水稻野生型植株(osmir7695_wt)与水稻osmir7695位点编辑突变体植株(osmir7695
–
m1、m2、m3)t3代籽粒粒宽对比结果bar=10mm。
34.图4、水稻osmir7695编辑突变体t3代植株籽粒关键农艺性状鉴定。a、千粒重,n=3;b、籽粒长度,n=10;c、籽粒宽度,n=10;**:极显著差异,p<0.01;*:显著差异,0.01<p<0.05。
具体实施方式
35.目前,在植物mirna公共数据库mirbase(http://www.mirbase.org/index.shtml),大部分收录的植物mirna分子是基于小rna高通量测序获得的,没有具体生物功能实验结果。其中一条基于高通量测序发现的水稻mirna分子信息为osmir7695,其注释前体序列长度487bp,mirbase登录号为mi0025202,位于水稻1号染色体11666716-11667202bp区间。进一步数据检索表明,除了测序数据外,水稻osmir7695生物功能未见公开报道。
36.在本发明前期针对水稻未知生物学功能mirna编码基因进行定向编辑突变体创制大量工作基础上,本发明通过基因组编辑技术,在水稻中敲除了osmir7695编码基因,结果出人意料地发现,得到了籽粒农艺性状明显改良的植株,这些改良性状具体体现在了籽粒千粒重的增加、粒长增长、粒宽增加等方面。同时并没有观察到其他农艺性状的明显改变,说明能提升水稻产量。
37.基于上述的实验,说明了水稻的osmir7695编码基因与水稻籽粒的农艺性状有密切的相关性,而阻断或者减弱水稻中osmir7695的表达,能够有效地改良籽粒的农艺性状。
38.由此,本发明建立并公开了一种新的改良水稻籽粒性状的方法。该方法是通过阻断或者减弱水稻中osmir7695编码基因的表达,以改良籽粒的农艺性状。
39.目前已经知晓,mirna的编码基因在表达过程中会首先得到初级转录物(pri-mirna),随后会被加工成mirna前体(pre-mirna),随后pre-mirna被进一步加工形成成熟mirna。成熟mirna分子再发挥其生物学功能。显然,对于osmir7695编码基因表达的整个过程中的任何一步施加影响,都可能降低osmir7695表达产物的作用,改良水稻籽粒的农艺性状。而敲除水稻osmir7695编码基因,或者干扰osmir7695编码基因表达产物的作用,是本领域可用于阻断或者减弱水稻中osmir7695编码基因的表达的两种主要方式。
40.就本领域技术人员而言,干扰osmir7695表达产物的作用,也就是说干扰osmir7695的生物学功能,有一些现有的方法可以采用。
41.比如,可以使用反义rna方法,设计针对osmir7695的反义rna,从而达到降低osmir7695的生物学功能,以提高水稻籽粒性状的目的。
42.近年来,本领域还开发了靶基因类似物法(target mimicry,tm)法和短串联靶标类似物(short tandem target mimic,sttm)法以干扰(或封闭)目标mirna的作用。显然,本领域技术人员在阅读本发明后,能够设计出靶基因类似物或者串联靶标类似物来降低osmir7695的生物学功能,提高水稻籽粒性状。
43.近年来,crispr-cas13法作为一种新开发的针对rna的编辑工具得到了应用,本领域技术人员能够理解,crispr-cas13法可以用于以阻断或者减弱osmir7695编码基因表达产物的作用。
44.而另一个方向则是从影响osmir7695的转录入手。目前最常用的方法就是从基因组中敲除掉osmir7695编码基因,可以采用的技术手段有基因组编辑法、同源重组法或随机插入突变法等。
45.使用同源重组法时,可以设计特定的重组dna片段,通过同源重组替换到基因组中,从而使水稻不表达osmir7695编码基因。而随机插入突变法可以使用t-dna(transfer dna,转移dna)插入突变法或转座子插入突变法等方法,也可以达到类似的效果。
46.而近年来,本领域关注较多的是基因组编辑技术。而目前常用的用于基因敲除的基因组编辑技术有基因组巨大核酸酶(meganuclease)法、zfn(锌指核酸酶)法、talen(transcription activator-like effectors nucleases)法以及crispr-cas法。这些方法都可以用于敲除osmir7695编码基因的水稻定向编辑突变体的创制,得到籽粒性状提高的突变植株。
47.同时,本领域技术人员也可以想到,任何水稻品种都可以使用上述方法,阻断或者减弱水稻中osmir7695的表达,改良其籽粒的农艺性状。
48.与此同时,本发明也提供了阻断或者减弱水稻中osmir7695的表达的试剂在提高水稻籽粒性状中的用途。
49.这些试剂一方面包括干扰osmir7695表达产物并使其难以正常发挥功能的各类分子,包括且不限于针对osmir7695表达产物设计的rnai分子、反义rna分子、靶基因类似物(target mimicry,tm)分子、短串联靶标类似物(short tandemtarget mimic,sttm)分子,用于crispr-cas13法的向导rna。
50.另一方面则包括可以用于敲除水稻基因组中的osmir7695编码基因的试剂。这些试剂包括且不限于针对osmir7695编码基因的用于巨大核酸酶(meganuclease)法的巨大核酸酶,用于zfn法的zfn蛋白、用于talen法的talen蛋白,用于crispr-cas法的向导rna分子、用于同源重组法的重组dna片段、或用于随机插入突变法的t-dna(transfer dna,转移dna)分子或转座子分子。
51.而用于敲除编码基因的crispr-cas法,目前有crispr-cas9、crispr-cas12a、crispr-cas12b等多种具体的技术体系,本领域技术人员在实施本发明时,能够容易地根据各项具体技术的要求进行对osmir7695编码基因有针对性的编辑工作。
52.在本发明的一个实施例中,使用一种特别设计的针对水稻osmir7695编码基因的向导rna的。其核苷酸序列为5
’-
attgtggtcttgcctatgtggca-3’(seq id no.2),该向导rna用于crispr-cas12a基因编辑系统对水稻osmir7695编码基因进行了基因编辑。当然,本领域技术人员知晓,在crispr-cas12a基因编辑系统中,crrna分子的具体作用是作为向导rna。
53.在此基础上本发明实施例中也得到了能表达上述向导crrna的cas12a定向编辑表达载体(ptx377_osmir7695)。当然,此类cas12a定向编辑表达载体的骨架载体有很多已报道的可以选择。而对于此条crrna来说,可选择ptx377、pypq230(tang x,lowder lg,zhang t,malzahn a,zheng x,voytas df,zhong z,chen y,ren q,li q,kirkland er,zhang y,qi y.2017.acrispr-cpf1 systemfor efficient genome editing and transcriptional repression in plants.nature plants,3:17018;tang x,ren q,yang l,bao y,zhong z,he y,liu s,qi c,liu b,wang y,sretenovic s,zhang y,zheng x,zhang t,qi y,zhang y.2019.single transcript unit crispr2.0systems for robust cas9 and cas12a mediated plant genome editing.plant biotechnology journal,17(7):1431-1445)等识别5
’-
tttv-3’序列pam的植物cas12a定向编辑表达载体。在本发明的一个实施例中,使用了ptx377载体作为骨架载体,取得了好的效果,得到了籽粒性状显著改良的水稻osmir7695编码基因定向编辑突变体材料。
54.具体而言,本发明中使用上述的cas12a定向编辑向导crrna(osmir7695_crrna1)
制备敲除水稻osmir7695编码基因定向编辑突变体材料,以提高改良籽粒性状的方法包括以下主要步骤:
55.a、制备序列如seq id no.2的向导rna的cas12a基因编辑表达载体;
56.b、用步骤a的得到的表达载体转化水稻,利用crispr-cas12a基因编辑体系得到转化植株;
57.c、收集转化植株的种子,筛选出水稻osmir7695编码基因定向编辑突变体种子,即得水稻籽粒性状显著改善的水稻osmir7695编码基因定向编辑突变体。
58.更进一步的,本发明方法可按以下更为具体的步骤进行:
59.(1)crrna靶位点的选择
60.水稻osmir7695编码基因位于1号染色体上,其注释487bp长度的前体dna编码序列如seq id no.1所示,其成熟加工过程茎环结构(stem-loop)示意图如图1a所示。该crrna序列如seq id no.2所示,长度为23bp,其靶位点位于seq id no.1所示的osmir7695前体序列中的127bp-149bp,pam位点为osmir7695前体序列中的123bp-126bp(5
’-
tttg-3’)。根据crrna序列设计合成两条退火形成粘性末端的单链核苷酸序列osmir7695-crrna1-f,序列如seq id no.3和osmir7695-crrna1-r,序列如seq id no.4所示。
61.(2)cas12a定向编辑表达载体构建
62.将osmir7695-crrna1-f和osmir7695-crrna1-r分别稀释10倍,各取10μl混合一起在98℃变性5min,自然冷却,退火产物稀释20倍。退火产物和经bsai进行酶切的骨架载体ptx377连接。经转化大肠杆菌,单菌落pcr和测序鉴定,获得了针对水稻osmir7695编码基因的定向编辑表达载体ptx377_osmir7695,其t-dna区域结构示意图如图1b所示。具体构建方法见参考文献(tang x,lowder lg,zhang t,malzahn a,zheng x,voytas df,zhong z,chen y,ren q,li q,kirkland er,zhang y,qi y.2017.acrispr-cpf1 systemfor efficient genome editing and transcriptional repression in plants.nature plants,3:17018;tang x,ren q,yang l,bao y,zhong z,he y,liu s,qi c,liu b,wang y,sretenovic s,zhang y,zheng x,zhang t,qiy,zhang y.2019.single transcript unit crispr 2.0systems for robust cas9 and cas12a mediated plant genome editing.plant biotechnology journal,17(7):1431-1445)。
63.(3)水稻遗传转化及分子鉴定
64.水稻osmir7695编码基因定向编辑表达载体ptx377_osmir7695经农杆菌介导的水稻遗传转化、筛选、再生获得转化植株,提取单株dna进行阳性鉴定。用设计的特异引物osmir7695-sscp-f(seq id no.5)和osmir7695-sscp-r(seq id no.6)进行pcr扩增,经sscp和sanger测序验证(图2),获得osmir7695定向敲除突变体。水稻遗传转化及分子鉴定具体过程参考文献(tang x,lowder lg,zhang t,malzahn a,zheng x,voytas df,zhong z,chen y,ren q,li q,kirkland er,zhang y,qi y.2017.acrispr-cpf1 systemfor efficient genome editing and transcriptional repression in plants.nature plants,3:17018)中公开的实验方法。
65.以下通过实施例对本发明进行更进一步的详细说明。
66.实施例1水稻osmir7695敲除载体crispr-cas12a的构建
67.(1)crrna设计
68.根据crispr-cas12a对靶位点的识别和剪切规则设计crrna。根据水稻osmir7695前体基因组序列(seq id no.1),设计单链核苷酸序列osmir7695-crrna1-f(5
’-
agatattgtggtcttgcctatgtggca-3’seq id no.3)和osmir7695-crrna1-r(5
’-
ggcctgccacataggcaagaccacaat-3’,seq id no.4)。
69.(2)单链核苷酸序列退火
70.将靶位点的上下游osmir7695-crrna1-f和osmir7695-crrna1-r单链核苷酸序列分别稀释10倍,各取10μl,98℃,变性5min,自然冷却,退火产物稀释20倍待用。
71.(3)酶切、胶回收、连接
72.实验所使用的骨架载体为ptx377,由本实验室根据文献(tang等,a crispr
–
cpf1 system for efficient genome editing and transcriptional repression in plants.nat plants.2017,3:17103)所示载体pypq230构建而来。ptx377用bsai进行酶切,酶切体系的建立和酶切条件参考thermo scientific公司限制性内切酶说明书进行。具体的酶切体系如下:10
×
fast digest buffer5μl,质粒dna或pcr产物10μl(1~1.5μg),限制性内切酶1μl,ddh2o补足至50μl。
73.37℃恒温培养箱反应2h,反应结束后加入10μl的6
×
loading bufer,1%琼脂糖凝胶电泳,切胶回收。胶回收方法按照axygen axypreptm dna gel extraction kit方法进行。
74.将ptx377的酶切回收产物与osmir7695-crrna1-f、osmir7695-crrna1-r的退火稀释产物进行连接,连接体系和条件参考new england biolabs公司t4 dna连接酶说明书进行,具体的连接体系如下:10
×
t4 dna连接酶反应缓冲液2μl,t4 dna连接酶1μl,ptx377酶切产物5μl,退火产物5μl,ddh2o补足20μl。
75.(4)大肠杆菌转化
76.将大肠杆菌dh5α感受态置于冰上慢慢融化,加入1μg质粒,冰上放置20min。42℃热激1min,冰上放置1~2min。加入350μl液体lb,充分混匀,37℃震荡培养45min。12000rpm离心1min,去掉300μl上清,将剩余100μl菌液重悬。将重悬的菌液全部涂布于含有相应抗生素(50mg/l kan)的lb平板上,于37℃倒置培养18~22h。
77.(5)菌落pcr
78.用灭菌牙签挑取lb平板上的单克隆,溶于50μl ddh2o水中,以此菌液作为模板进行pcr扩增。采用25ul体系,体系如下:10
×
pcr buffer 2.5μl,dntp 0.5μl,osmir7695-crrna1-f 0.5μl,zy010-r1(5
’-
aagaccggcaacaggattc-3’)0.5μl,taq dnaenzyme 0.2μl,template 1μl,ddh2o 19.8μl。pcr程序为:94℃,5min
→
(94℃,30s
→
56℃,30s
→
72℃,10-60s)32个循环
→
72℃,5min
→
10℃,5min(taq dnaenzyme,dntp等购自天根生物公司)。pcr结束后,加入5μl 6
×
溴酚蓝,通过琼脂糖凝胶电泳检测。
79.(6)质粒提取及测序验证
80.将菌落pcr验证正确的单克隆,于含有50mg/lkan的lb中摇菌,提取菌液中的质粒,质粒dna的提取按照axygen axypreptm plasmid miniprep kit说明书进行。提取的质粒送擎科生物科技有限公司进行测序验证。并将质粒命名为ptx377_osmir7695,其t-dna结构示意图如图1b所示。
81.实施例2农杆菌介导的水稻遗传转化
82.农杆菌介导转化水稻参考文献(toki等,early infection of scutellum tissue with agrobacterium allows high-speed transformation of rice.the plant journal,2006,47(6):969-976.)中公开的方法。水稻的遗传转化步骤具体如下:
83.将水稻(日本晴)成熟种子去壳消毒;将消毒过的种子接种于含0.4%结冷胶的n-6-d固体培养基上面,32℃连续光照培养1~5天;培养的种子通过农杆菌介导的转化方法将质粒pmir390-1转入水稻当中,转化过的水稻种子在诱导选择培养基中连续32℃光照培养2周;增殖产生的愈伤组织转入re-iii培养基中;从愈伤组织产生的幼小植株转移到hf培养基中诱导根的产生。待获得的抗性再生苗长至15cm左右时,清水洗净根部培养基,移栽至营养土中,温室培养。
84.实施例3水稻osmir7695突变体的分子鉴定
85.(1)水稻苗基因组dna提取
86.水稻苗dna提取采用ctab法,具体操作步骤如下:
87.ctab提取液于65℃水浴锅中预热。取单株叶片一片放入带钢珠的2ml的离心管中,放入液氮速冻,后震荡成粉末状。加入500μl预热的ctab提取液,65℃水浴30~50min,期间充分混匀。加入500μl氯仿:异戊醇(24︰1),充分颠倒混匀,4℃,10000rpm离心10min。取上清,加入等体积的异丙醇沉淀,-20℃沉淀30min~2h。室温,12000rpm离心10min,收集沉淀。去上清,75%乙醇漂洗,12000rpm离心2min。去掉上清,风干dna。加入30~50μl ddh2o溶解dna,-20℃冰箱中保存待用。
88.(2)水稻苗转基因阳性检测
89.运用intron-f1(5
’-
ttctgatcctctccgttcct-3’,seq id no.7)和zy010-r1(5
’-
aagaccggcaacaggattc-3’,seq id no.8)进行pcr扩增,扩增片段大小为1068bp,结果如图2a。pcr扩增体系及反应程序同前菌落pcr。
90.(3)运用sscp突变体检测
91.首先pcr扩增目标片段,然后将pcr产物变性,通过聚丙烯酰胺凝胶电泳进行突变体的初步筛选。具体方法见文章(zheng等,effective screen of crispr/cas9-induced mutants in rice by single-strand conformation polymorphism.plant cell rep,2016,(7):1545-54.)具体操作步骤如下:
92.将检测所得到的阳性植株用引物osmir7695-sscp-f(5
’-
atcgggaggtttcacttaag-3’,seq id no.5)和osmir7695-sscp-r(5
’-
ggtggtgagaggcggaacga-3’,seq id no.6)进行pcr扩增,扩增片段长度为223bp。pcr扩增体系及反应程序同前。取5μlpcr产物加入到5μl sscp变性剂中,充分混匀,95℃变性5min;变性结束后迅速放入冰盒中,冷却10min。配制15%page(29︰1)胶,方法如下:21ml acr/bis(29︰1)胶溶液,150μl10%aps,10μl temed,快速搅拌混匀,用于胶的灌注。丙烯酰胺acr,甲叉双丙烯酰胺bis,过硫酸铵aps和四甲基乙二胺temed均购自amresco公司。待胶凝固后,在4℃条件下,45ma恒流电泳预电泳20min左右。然后断开电源,分别取5μl变性样品按顺序上样。然后在4℃,45ma恒流电泳4~5h。卸胶,用水冲洗2~3遍;染色:加入agno3染液置于摇床染色10min;显色:加入naoh显色剂置于摇床显色5min左右,直至看到清晰条带;染色结束,立即用水冲洗,停止反应。观察:将胶平铺于灯箱上面,观察,照像。
93.sscp结果(图2b)显示:单株osmir7695-1-1,osmir7695-1-2,osmir7695-1-3,
osmir7695-1-5,osmir7695-1-6,osmir7695-1-7的条带与野生型(wt)不一致,初步表明其为突变体。表明crispr-cas12系统能对osmir7695进行定向编辑,从而获得突变体。
94.(4)敲除突变体测序验证
95.将sscp筛选获得的与野生型有差异的单株osmir7695-1-1,osmir7695-1-2,osmir7695-1-3,用引物osmir7695-sscp-f(seq id no.5)和osmir7695-sscp-r(seq id no.6)进行pcr扩增,pcr扩增体系及反应程序同前。送交成都擎科生物公司测序。测序结果(图2c)显示,单株osmir7695-1-1为(-13bp/-13bp)纯合突变体,osmir7695-1-2为(-16bp/-8bp)双等位突变,osmir7695-1-3为(-13bp/wt)杂合突变体。
96.(5)敲除突变体农艺性状检测
97.进一步对osmir7695-1-6的t2代植株进行筛选,获得纯合突变体(编号osmir7695-1-6),命名osmir7695-m,对其t3代osmir7695-m1,osmir7695-m2,osmir7695-m3单株种子分别进行农艺性状分析观察发现种子长度和宽度比对照有明显增加(图3),进一步对其分析发现千粒重从25.56g增加到27.16g、26.87g及27.3g,分别增重6.3%、5.1%、6.8%(图4a)、粒长显著增加,分别从7.46mm增加到7.59mm、7.57mm、7.61mm(图4b),粒宽分别从3.28mm增加到3.31mm、3.30mm、3.36mm(图4c)。其他农艺性状未见明显改变。
98.实验结果表明,通过基于本发明发现的向导crrna(osmir7695_crrna1,序列如seq id no.2所示)构建的水稻osmir7695编码基因定向编辑表达载体ptx377_osmir7695及对应实验方法,可以有效获得不含转基因成分的osmir7695编码基因定向编辑突变体水稻材料,实现籽粒千粒重、粒长及粒宽增加,进而提升水稻产量。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

