1.本发明属于保健食品领域,具体涉及一种海藻多糖组合物与复合果汁混合发酵粉及其制备方法与应用。
背景技术:
2.糖尿病是一种主要由胰腺胰岛素缺乏、周围组织胰岛素抵抗或两者共同引起的慢性疾病,是当前危害人类健康的常见病、多发病,号称是继恶性肿瘤、心血管疾病之后的第三大健康杀手。国际糖尿病联合会(idf)预测,2045年全球成年糖尿病患者数目将超过7.002亿。糖尿病患者主要的特征性表现为多饮、多食、多尿及体重降低,同时包括糖、脂肪、蛋白质、电解质等代谢紊乱。
3.糖尿病及其并发症的治疗应该注意遵循早期、有效和持续控制的原则,以推迟发病的时间和降低并发症发生和恶化的概率。目前,用于糖尿病治疗的手段日新月异,主要涉及药物治疗、饮食结构的优化、运动调节等,其中药物治疗是糖尿病治疗中最主流、最有效的手段。然而,在临床上常用的降血糖药物,均具有一定的毒性或副作用,高的治疗成本以及对糖尿病患者的身体健康产生不同程度的不良影响等特点。因此,从低值的食源性动植物或微生物资源中寻找具有显著改善糖尿病及其并发症的有效成分,研究和开发具有绿色、安全性高以及价格便宜的降糖药物或辅助降糖功能因子成为当前研究的热点领域。
4.海洋藻类是一种重要的海洋植物资源,在我国热带和亚热带海域分布广泛,具有巨大的开发和应用潜力。从海藻中提取得到的蛋白、色素、多酚以及多糖等也具有促进健康和防治慢性病等生理作用。因此,海藻源活性物质的发现、制备、表征或鉴定以及功能评价和机理探讨已经成为当前研究的热点科学问题之一。海藻多糖是海藻中最重要的生物活性分子,因其独特的结构特征,赋予了其多种生物活性,比如:抗氧化、抗肿瘤、降血糖、调节肠道菌群以及免疫调节等。
5.新鲜果汁中含有维生素、钙、磷等多种营养成分,具有增强人体内细胞活力与胃肠道活力,消除疲劳等功效。近年来,随着果蔬深加工技术的深入发展,益生菌在果汁发酵中的广泛应用也得到了更多人的认可。益生菌发酵果汁不仅提高了水果的利用率,使得果汁口感更好,同时也提高了果蔬类食品的安全性与耐储存性。除此之外,益生菌发酵果汁产物中既有水果原料自身的营养成分,又有益生菌的保健作用,且降低了水果中葡萄糖的含量,具有降低血糖、改善乳糖不耐等作用。因此利用益生菌发酵果蔬获得风味独特且具有良好的生物活性的发酵物具有广阔的开发及利用前景。
6.然而,果蔬原料中水分含量高、碳水化合物含量相对较低,因此常规果蔬发酵过程中往往需要另外加入碳源如葡萄糖等以保证益生菌正常繁殖代谢。本发明外加海藻多糖作为培养基碳源,一方面海藻多糖被人体摄入后不会引起血糖升高,另一方面海藻多糖可以作为外加碳源促进益生菌增殖改善果蔬发酵。
技术实现要素:
7.为了克服现有技术存在的不足,本发明的目的是提供一种海藻多糖组合物与复合果汁混合发酵粉及其制备方法与应用。
8.本发明的目的至少通过如下技术方案之一实现。
9.本发明提供的海藻多糖组合物与复合果汁混合发酵粉的制备方法,包括如下步骤:
10.将海藻多糖组合物加入复合果汁中,混合均匀,然后升温进行加热处理,得到混合液,调节所述混合液的ph为酸性,加入鼠李糖乳杆菌菌剂,进行发酵处理,灭菌处理,浓缩,干燥,得到所述海藻多糖组合物与复合果汁混合发酵粉。
11.进一步地,所述海藻多糖组合物的粒度为2
‑
20μm;
12.进一步地,所述海藻多糖组合物为以下海藻多糖中的两种及以上:泡叶藻多糖细微粉、羊栖菜多糖细微粉、墨角藻多糖细微粉、马尾藻多糖细微粉、裙带菜多糖细微粉、巨藻多糖细微粉。
13.优选地,所述海藻多糖组合物为泡叶藻多糖细微粉和羊栖菜多糖细微粉的组合物、墨角藻多糖细微粉和泡叶藻多糖细微粉的组合物、马尾藻多糖细微粉和裙带菜多糖细微粉的组合物、巨藻多糖细微粉和裙带菜多糖细微粉的组合物、墨角藻多糖细微粉和马尾藻多糖细微粉的组合物、泡叶藻多糖细微粉和巨藻多糖细微粉的组合物、泡叶藻多糖细微粉和马尾藻多糖细微粉的组合物中的一种以上。
14.进一步优选地,所述海藻多糖组合物为泡叶藻多糖细微粉和羊栖菜多糖细微粉的质量比为1:1
‑
4的组合物、墨角藻多糖细微粉和泡叶藻多糖细微粉的质量比为1:10
‑
12的组合物、马尾藻多糖细微粉和裙带菜多糖细微粉的质量比为1:7
‑
8的组合物、巨藻多糖细微粉和裙带菜多糖细微粉的质量比为1:1
‑
2的组合物、墨角藻多糖细微粉和马尾藻多糖细微粉的质量比为1:10
‑
15的组合物、泡叶藻多糖细微粉和巨藻多糖细微粉的质量比为1:8
‑
10的组合物、泡叶藻多糖细微粉和马尾藻多糖细微粉的质量比为1:1
‑
2的组合物中的一种以上。
15.进一步地,所述海藻多糖(墨角藻多糖细微粉、羊栖菜多糖细微粉、裙带菜多糖细微粉、马尾藻多糖细微粉、泡叶藻多糖细微粉、巨藻多糖细微粉中的一种)的制备,包括如下步骤:
16.(1)将海藻洗净晾干,然后浸泡在乙醇溶液中,升温进行回流提取处理,过滤取滤渣,干燥,得到乙醇处理后的海藻;
17.(2)将步骤(1)所述乙醇处理后的海藻浸泡在水中,打浆,得到糊状物,然后往糊状物中加入水,得到混合液1,冷藏处理,融化处理,然后进行浸提处理,离心取上清液,得到提取液1;
18.(3)调节步骤(2)所述提取液1的ph为酸性,加入木瓜蛋白酶,得到混合液2,升温进行振荡处理,接着灭酶处理,离心取上清液,浓缩,得到提取液2;
19.(4)将步骤(3)所述提取液2过超滤膜,取分子量大于10kd的组分,得到提取液3,浓缩提取液3,得到浓缩液,往所述浓缩液中加入无水乙醇,静置,离心取沉淀,将所述沉淀复溶,减压浓缩除去乙醇,冷冻干燥,得到粒度为2
‑
20μm的海藻多糖。
20.进一步地,在所述海藻多糖制备的步骤(1)中,所述海藻为泡叶藻、羊栖菜、墨角藻、马尾藻、裙带菜、巨藻中的一种;
21.进一步地,在所述海藻多糖制备的步骤(1)中,所述乙醇溶液的体积百分比浓度为90
‑
100%;
22.进一步地,在所述海藻多糖制备的步骤(1)中,所述回流提取处理的温度为75
‑
85℃,回流提取处理的时间为2
‑
6h;
23.进一步地,在所述海藻多糖制备的步骤(2)中,所述乙醇处理后的海藻浸泡在水中的时间为3
‑
5h;
24.进一步地,在所述海藻多糖制备的步骤(2)中,所述糊状物中,乙醇处理后的海藻与水的质量比为1:3
‑
8;
25.进一步地,在所述海藻多糖制备的步骤(2)中,所述混合液中,乙醇处理后的海藻与水的质量比为1:15
‑
30;
26.进一步地,在所述海藻多糖制备的步骤(2)中,所述冷藏处理的温度为
‑
80~
‑
40℃,冷藏处理的时间为2
‑
5h;
27.进一步地,在所述海藻多糖制备的步骤(2)中,所述融化处理的温度为60
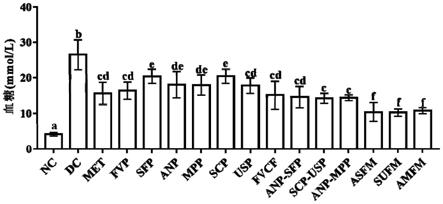
‑
80℃;
28.进一步地,在所述海藻多糖制备的步骤(2)中,所述冷藏处理和融化处理的次数为2
‑
3次;
29.进一步地,在所述海藻多糖制备的步骤(2)中,所述浸提处理的温度为80
‑
100℃,浸提处理的时间为2
‑
8h。
30.进一步地,在所述海藻多糖制备的步骤(3)中,调节所述提取液1的ph为5.5
‑
6.0;
31.进一步地,在所述海藻多糖制备的步骤(3)中,所述混合液2中,木瓜蛋白酶的酶活力为50
‑
200u/l;所述木瓜蛋白酶的体积为混合液2体积的0.5
‑
2%;
32.进一步地,在所述海藻多糖制备的步骤(3)中,所述振荡处理的温度为55
‑
65℃,振荡处理的时间为50
‑
80min;
33.进一步地,在所述海藻多糖制备的步骤(3)中,所述灭酶处理为沸水浴5
‑
10min;
34.优选地,在所述海藻多糖制备的步骤(3)中,在进行灭酶处理后,将灭酶处理后的混合液冷却至20
‑
35℃后再进行离心。
35.进一步地,在所述海藻多糖制备的步骤(3)中,所述提取液2中的固形物含量为2
‑
8wt%;
36.进一步地,在所述海藻多糖制备的步骤(4)中,所述超滤膜(中空超滤膜)的截留分子量为10kd;
37.优选地,在所述海藻多糖制备的步骤(4)中,反复将所述提取液2过超滤膜4
‑
8次。
38.进一步地,在所述海藻多糖制备的步骤(4)中,所述无水乙醇的加入速率为3
‑
8ml/min;
39.进一步地,在所述海藻多糖制备的步骤(4)中,所述浓缩液中的固形物含量为5
‑
12wt%;
40.进一步地,在所述海藻多糖制备的步骤(4)中,所述浓缩液与无水乙醇的体积比为1:4;
41.优选地,在所述海藻多糖制备的步骤(4)中,使用分液漏斗往浓缩液中加入无水乙醇。
42.进一步地,在所述海藻多糖制备的步骤(4)中,所述静置的温度为4℃,静置的时间
为12
‑
16h。
43.进一步地,所述复合果汁的制备,包括:
44.将木瓜、猕猴桃、番石榴洗净,切成碎块,混合得到混合物,然后加入水,打浆,然后在摇床中升温进行提取处理,离心弃去沉淀,过滤取滤液,得到所述复合果汁;
45.进一步地,所述复合果汁的制备过程中,所述木瓜、猕猴桃、番石榴的质量比为5:2:6;
46.进一步地,在所述复合果汁的制备过程中,所述混合物与水的质量比为1:10
‑
15;
47.进一步地,在所述复合果汁的制备过程中,所述提取处理的温度为60
‑
70℃,提取处理的时间为6
‑
8h;
48.进一步地,在所述复合果汁的制备过程中,所述离心的转速为8000
‑
12000r/min,离心的时间为10
‑
15min。
49.进一步地,所述海藻多糖组合物与复合果汁的质量比为1:50
‑
80;
50.进一步地,所述加热处理的温度为100
‑
115℃,加热处理的时间为10
‑
30s;
51.进一步地,所述混合液的ph值调节为3.0
‑
4.0;
52.优选地,所述混合液的ph值调节为4.0。
53.进一步地,所述鼠李糖乳杆菌菌剂的体积为混合液体积的0.5
‑
2%;
54.进一步地,所述发酵处理的温度为37
‑
40℃,发酵处理的时间为12
‑
24h;
55.优选地,所述发酵处理的时间为24h。
56.进一步地,所述灭菌处理为沸水浴15
‑
20min;
57.进一步地,所述浓缩至固形物的含量为15
‑
20wt%。
58.本发明提供一种由上述的制备方法制得的海藻多糖组合物与复合果汁混合发酵粉。
59.本发明提供的海藻多糖组合物与复合果汁混合发酵粉能够应用在制备糖尿病及其并发症的保健食品、食品及药品中。
60.与现有技术相比,本发明具有如下优点和有益效果:
61.(1)本发明提供的制备方法中,所涉及海藻多糖的提取过程,与常规热水浸提制备多糖的方法相比,在热水浸提前增加了浸泡打浆、反复冻融的步骤,同时在醇沉过程中利用分液漏斗控制了乙醇的添加速度,进而提高了多糖的得率。
62.(2)本发明通过将不同来源的海藻多糖进行复配,得到了多种比单一海藻多糖体外α
‑
葡萄糖苷酶抑制活性更显著的海藻多糖组合物,并通过工艺优化限定了最优的组合比例范围,保证了海藻多糖组合物与复合果汁混合发酵粉可通过减轻进食引起的血糖波动给患者带来的危害。
63.(3)本发明利用益生菌发酵海藻多糖组合物与复合果汁的混合物,在一定程度上掩盖或消除了单纯海藻多糖(或海藻多糖组合物)的腥味,风味和色泽均更容易被各类人群接受。
64.(4)在降血糖功效方面,本发明所提供的海藻多糖组合物与复合果汁混合发酵粉显著优于本发明中涉及的对照例。
附图说明
65.图1为实施例中各组实验小鼠第8周的空腹血糖结果图,图1中不同小写字母代表数据之间存在显著性差异(p<0.05)。
具体实施方式
66.以下结合实例对本发明的具体实施作进一步说明,但本发明的实施和保护不限于此。需指出的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所用试剂或仪器未注明生产厂商者,视为可以通过市售购买得到的常规产品。
67.α
‑
葡萄糖苷酶抑制率的分析方法
68.分别取不同浓度的受试样品溶液30μl,加入酶活力单位为0.2u/ml的α
‑
葡萄糖苷酶稀释液30μl,在37℃条件下保温10分钟,然后加入30μl对硝基苯基
‑
α
‑
d
‑
吡喃葡糖苷溶液反应15分钟,再加入100μl浓度为0.1mol/l的na2co3溶液终止反应,在405nm处测定吸光度,以阿卡波糖(acar)为阳性对照。根据公式1计算受试样品的α
‑
葡萄糖苷酶抑制率。
[0069][0070]
实施例1:海藻多糖的制备及其对α
‑
葡萄糖苷酶抑制的相互作用
[0071]
(1)海藻多糖细微粉的制备:
[0072]
海藻(海藻为泡叶藻、羊栖菜、墨角藻、马尾藻、裙带菜、巨藻中的一种)洗净晾干,然后浸泡在100%的酒精(无水乙醇)中,用100%的酒精(无水乙醇),升温进行回流提取处理,回流提取处理的时间为2h,回流提取处理的温度为80℃,过滤取滤渣,干燥得到乙醇处理后的海藻;
[0073]
将所述乙醇处理后的海藻浸泡在水(此处的水质量为乙醇处理后的海藻质量的6倍)中,浸泡4h,打浆至糊状,得到糊状物,然后往糊状物中加入水,得到混合液1,在所述混合液1中,乙醇处理后的海藻和水的质量比为1:20;置于
‑
80℃冻藏3h,取出于60℃融化,反复冻藏和融化3次;热水浸提4h,热水浸提的温度为90℃;过滤取滤液,离心,收集上清液,得到提取液s1;
[0074]
调节提取液s1的ph至6.0,添加1wt%木瓜蛋白酶,酶活力为200u/l,55℃的水浴摇床振荡60min,随后沸水浴10min以灭酶,冷却到25℃,离心取上清,浓缩固形物含量至6wt%,得到提取液s2。
[0075]
提取液s2经截留分子量为10kd的中空超滤膜分离,反复操作6次,收集分子量大于10kd的组分,得到提取液s3。提取液s3减压浓缩至固形物含量为10wt%,得到浓缩液,用分液漏斗加入浓缩液4倍体积的无水乙醇(控制分液漏斗滴加流速为4ml/min)于4℃静置16h,离心取沉淀,加水复溶,减压浓缩除去乙醇,冷冻干燥后,制备成粒度2μm的海藻多糖细微粉,分别记为:墨角藻细微粉(fvp)、羊栖菜细微粉(sfp)、裙带菜细微粉(usp)、马尾藻细微粉(scp)、泡叶藻细微粉(anp)和巨藻细微粉(mpp)。
[0076]
(2)海藻多糖对α
‑
葡萄糖苷酶抑制的相互作用分析:
[0077]
对于六种海藻多糖试样,根据受试样品浓度对抑制率的曲线方程计算各个受试样品对α
‑
葡萄糖苷酶抑制的半抑制浓度(ic
50
)值,并分别选择0.125倍的ic
50
,0.25倍的ic
50
,0.5倍的ic
50
,0.75倍的ic
50
,ic
50
,1.25倍的ic
50
以及1.5倍的ic
50
的浓度,两两分别按1:1混
合,得到一系列混合多糖的浓度梯度,按照α
‑
葡萄糖苷酶抑制活性的方法绘制多糖组合物浓度对抑制率的关系曲线,计算混合多糖中各个多糖的ic
50
值,并通过软件calcusyn计算联合指数ci值与减量指数dri值。并通过工艺优化限定多糖组合物的组合比例。
[0078]
ic
50
值是指拮抗剂在抑制酶活力以及细胞受体等生物过程的半数剂量浓度,ic
50
值越小,拮抗剂的拮抗能力越强。由表1可知,多糖组合使用后,对应的单个多糖的α
‑
葡萄糖苷酶抑制活性ic
50
明显减小。具体地,fvp与sfp、anp、mpp、scp、usp组合后,其ic
50
分别下降了42.86%、52.38%、38.10%、80.95%和42.86%;sfp与fvp、anp、mpp、scp组合后,其ic
50
分别下降了49.55%、65.10%、55.15%和56.24%;anp与fvp、sfp、mpp、scp、usp组合后,其ic
50
分别下降了62.77%、66.67%、63.48%、65.60%和20.21%;mpp与fvp、sfp、anp、scp、usp组合后,其ic
50
分别下降了46.66%、53.33%、59.92%、41.03%和71.90%;scp与fvp、sfp、anp、mpp、usp组合后,其ic
50
分别下降了86.48%、65.56%、71.43%、55.36%和78.06%;usp与fvp、anp、mpp、scp组合后,其ic
50
分别下降了和42.97%、31.85%、78.14%和77.51%。上述结果表明海藻多糖组合物具有α
‑
葡萄糖苷酶抑制活性,能够有效的防止进食引起的血糖波动。
[0079]
表1海藻多糖及组合物对α
‑
葡萄糖苷酶的抑制活性
[0080]
[0081][0082]
减量指数(dri)是指在一定的拮抗效果(比如酶活力的抑制率等)下,与单独拮抗剂剂量相比,所允许的剂量减少的倍数。一般地,dri值越大,表示协同效果越好。如表2所示,fvp
‑
sfp、fvp
‑
anp、sfp
‑
anp、sfp
‑
usp、anp
‑
mpp、anp
‑
usp、mpp
‑
scp和scp
‑
usp组合后,其单个多糖的dri值在随抑制率的升高而增大。其中,scp
‑
usp组合在抑制率为95%时,scp和usp的dri值分别为7.812以及12.573。
[0083]
表2α
‑
葡萄糖苷酶抑制率为50%、75%、90%以及95%的dri值
[0084]
[0085][0086]
协同指数(ci)是用来评价活性物质与活性物质之间是否具有协同增效作用的有力手段。由于ci值的模拟计算对物质剂量的设置没有严格要求,被广泛应用于动物实验、细胞实验以及酶抑制实验中。根据物质之间对某种化学或生物过程是否具有协同增效作用,ci值被分为三个区间段,即:ci值<0.9表示协同作用,且数值越小,协同作用越强;0.9<ci值<1.1表示作用效果具有叠加作用;ci>1.1表示作用效果具有拮抗作用,数值越大,拮抗作用越显著。由表3可知,anp
‑
sfp,fvp
‑
anp,scp
‑
usp,mpp
‑
usp,fvp
‑
scp,anp
‑
mpp,anp
‑
scp这七组组合物在实验涉及的浓度范围内具有显著的协同增效作用,且浓度越大,协同作用效果越显著。
[0087]
表3α
‑
葡萄糖苷酶抑制率为50%、75%、90%以及95%的ci值
[0088]
[0089][0090]
由表3可知,anp
‑
sfp,fvp
‑
anp,scp
‑
usp,mpp
‑
usp,fvp
‑
scp,anp
‑
mpp,anp
‑
scp这七组组合物在实验涉及的浓度范围内具有显著的协同增效作用,且浓度越大,协同作用效果越显著。通过对组合比例进行条件优化,得出以上七组组合物的配比为组合物中各单一多糖的ic50值之比的条件下,各组合物的协调增效作用最强。因此,本发明的七组海藻多糖组合物的配比如下:anp和sfp按质量比为1:1
‑
4混合得到海藻多糖组合物,记为anp
‑
sfp;fvp和anp按质量比为1:10
‑
12混合得到海藻多糖组合物,记为fvp
‑
anp;scp和usp按质量比为1:7
‑
8混合得到海藻多糖组合物,记为scp
‑
usp;mpp和usp按质量比为1:1
‑
2混合得到海藻多糖组合物,记为mpp
‑
usp;fvp和scp按质量比为1:10
‑
15混合得到海藻多糖组合物,记为fvp
‑
scp;anp和mpp按质量比为1:8
‑
10混合得到海藻多糖组合物,记为anp
‑
mpp;anp和scp按质量比为1:1
‑
2混合得到海藻多糖组合物,记为anp
‑
scp。海藻多糖组合物为上述的一种或几种组合。
[0091]
实施例2:果汁及复合果汁的制备及其α
‑
葡萄糖苷酶抑制活性分析
[0092]
将木瓜、猕猴桃、番石榴分别洗净,分别切成水果碎块,然后分别加入水,所述水果碎块与水的质量比均为1:10,打浆后,在摇床中升温至70℃提取6h,8000r/min离心15min,取上清液,过滤取滤液得到相应果汁(木瓜果汁、猕猴桃果汁、番石榴果汁);
[0093]
木瓜、猕猴桃、番石榴分别洗净,分别切成木瓜碎块、猕猴桃碎块、番石榴碎块,按木瓜碎块:猕猴桃碎块:番石榴碎块的质量比为5:2:6混合,得到混合物,加入混合物10倍质量的水,打浆,摇床70℃提取6h。8000r/min离心15min,取上清液,过滤取滤液得复合果汁。
[0094]
将木瓜果汁、猕猴桃果汁、番石榴果汁、复合果汁分别稀释10倍,进行α
‑
葡萄糖苷酶抑制率测定试验,结果如下:
[0095]
表4新鲜果蔬汁对α
‑
葡萄糖苷酶抑制活性
[0096][0097]
由表4可以得出,在试验条件下,番石榴果汁、蓝莓果汁、猕猴桃果汁以及复合果汁均表现出较强的α
‑
葡萄糖苷酶抑制活性。
[0098]
实施例3:anp
‑
sfp组合物与复合果汁混合发酵粉的制备
[0099]
本发明在具体实施中,可由以下步骤实现:
[0100]
分别将泡叶藻与羊栖菜洗净晾干,然后分别浸泡在100%的酒精(无水乙醇)中,分别升温进行回流提取处理,回流提取处理的时间为2h,回流提取处理的温度为80℃,分别过滤取滤渣,干燥得到乙醇处理后的海藻。
[0101]
将所述乙醇处理后的海藻浸泡在水(此处的水质量为乙醇处理后的海藻质量的6倍)中,浸泡4h,打浆至糊状,得到糊状物,然后往糊状物中加入水,得到混合液1,在所述混合液1中,乙醇处理后的海藻和水的质量比为1:20;置于
‑
80℃冻藏3h,取出于60℃融化,反复冻藏和融化3次;热水浸提4h;热水浸提的温度为90℃;过滤取滤液,离心,收集清液,得到提取液s1;
[0102]
调节提取液s1的ph至6.0,添加1wt%木瓜蛋白酶,酶活力为200u/l,55℃的水浴摇床振荡60min,随后沸水浴10min以灭酶,冷却到25℃,离心取上清,浓缩固形物含量至6wt%,得到提取液s2。
[0103]
提取液s2经截留分子量为10kd的中空超滤膜分离,反复操作6次,收集分子量大于10kd的组分,得到提取液s3。提取液s3减压浓缩至固形物含量为10wt%,得到浓缩液,用分液漏斗加入浓缩液4倍体积的无水乙醇(控制分液漏斗滴加流速为4ml/min)于4℃静置16h,离心取沉淀,加水复溶,减压浓缩除去乙醇,冷冻干燥后,制备成粒度2μm的海藻多糖细微粉,分别记为泡叶藻多糖(anp)、羊栖菜多糖(sfp)。将anp和sfp按质量比为1:2混合得到海藻多糖组合物,记为anp
‑
sfp。
[0104]
将木瓜、猕猴桃、番石榴分别洗净,分别切成木瓜碎块、猕猴桃碎块、番石榴碎块,按木瓜碎块:猕猴桃碎块:番石榴碎块的质量比为5:2:6混合,得到混合物,加入混合物10倍质量的水,打浆,摇床70℃提取6h。8000r/min离心15min,取上清液,过滤取滤液得复合果汁。
[0105]
将anp
‑
sfp加入到其60倍质量的复合果汁中,混匀,115℃条件下处理10s,得到混合液,调节所述混合液的ph至4.0。鼠李糖乳杆菌先接种于盛有新鲜牛乳中37℃下活化12h,接种量为0.1g/l。将活化好的鼠李糖乳杆菌菌剂按1%体积比加入海藻多糖与复合果汁混合液中,37℃时发酵24h。沸水浴15min以灭菌,浓缩至固形物含量为15wt%,干燥得到anp
‑
sfp组合物与复合果汁混合发酵粉。
[0106]
实施例4:scp
‑
usp组合物与复合果汁混合发酵粉的制备
[0107]
本发明在具体实施中,可由以下步骤实现:
[0108]
分别将马尾藻与裙带菜洗净晾干,然后分别浸泡在(无水乙醇)中,分别升温进行回流提取处理,回流提取处理的时间为2h,回流提取处理的温度为80℃,分别过滤取滤渣,干燥得到乙醇处理后的海藻;
[0109]
将所述乙醇处理后的海藻浸泡在水(此处的水质量为乙醇处理后的海藻质量的6倍)中,浸泡4h,打浆至糊状,得到糊状物,然后往糊状物中加入水,得到混合液1,在所述混合液1中,乙醇处理后的海藻和水的质量比为1:20;置于
‑
80℃冻藏3h,取出于60℃融化,反复冻藏和融化3次;热水浸提4h;热水浸提的温度为90℃;过滤取滤液,离心,收集清液,得到提取液s1。
[0110]
调节提取液s1的ph至6.0,添加1wt%木瓜蛋白酶,酶活力为200u/l,55℃的水浴摇床振荡60min,随后沸水浴10min以灭酶,冷却到25℃,离心取上清,浓缩固形物含量至6wt%,得到提取液s2;
[0111]
提取液s2经截留分子量为10kd的中空超滤膜分离,反复操作6次,收集分子量大于10kd的组分,得到提取液s3。提取液s3减压浓缩至固形物含量为10wt%,得到浓缩液,用分液漏斗加入浓缩液4倍体积的无水乙醇(控制分液漏斗滴加流速为4ml/min)于4℃静置16h,离心取沉淀,加水复溶,减压浓缩除去乙醇,冷冻干燥后,制备成粒度2μm的海藻多糖细微粉,分别记为马尾藻多糖(scp)、裙带菜多糖(usp)。将scp和usp按质量比为1:7混合得到海藻多糖组合物,记为scp
‑
usp。
[0112]
将木瓜、猕猴桃、番石榴分别洗净,分别切成木瓜碎块、猕猴桃碎块、番石榴碎块,按木瓜碎块:猕猴桃碎块:番石榴碎块的质量比为:2:6混合,得到混合物,加入混合物10倍质量的水打浆,摇床70℃提取6h。8000r/min离心15min,取上清液,过滤取滤液得复合果汁。
[0113]
将scp
‑
usp加入到其60倍质量的复合果汁中,混匀,115℃条件下处理10s,得到混合液,调节所述混合液的ph至4.0。鼠李糖乳杆菌先接种于盛有新鲜牛乳中37℃下活化12h,接种量为0.1g/l。将活化好的鼠李糖乳杆菌菌剂按1%体积比加入海藻多糖与复合果汁混合液中,37℃时发酵24h。沸水浴15min以灭菌,浓缩至固形物含量为15wt%,干燥得到scp
‑
usp组合物与复合果汁混合发酵粉。
[0114]
实施例5:anp
‑
mpp组合物
‑
复合果汁发酵物混合粉的制备
[0115]
本发明在具体实施中,可由以下步骤实现:
[0116]
分别将泡叶藻与巨藻洗净晾干,然后分别浸泡在(无水乙醇)中,分别升温进行回流提取处理,回流提取处理的时间为2h,回流提取处理的温度为80℃,分别过滤取滤渣,干燥得到乙醇处理后的海藻。
[0117]
加入所述乙醇处理后的海藻浸泡在水(此处的水质量为乙醇处理后的海藻质量的6倍)中,浸泡4h,打浆至糊状,得到糊状物,然后往糊状物中加入水,得到混合液1,在所述混合液1中,乙醇处理后的海藻和水的质量比为1:20;置于
‑
80℃冻藏3h,取出于60℃融化,反复冻藏和融化3次;热水浸提4h热水浸提的温度为90℃;过滤取滤液,离心,收集清液,得到提取液s1。
[0118]
调节提取液s1的ph至6.0,添加1wt%木瓜蛋白酶,酶活力为200u/l,55℃的水浴摇床振荡60min,随后沸水浴10min以灭酶,冷却到25℃,离心取上清,浓缩固形物含量至6wt%,得到提取液s2。
[0119]
提取液s2经截留分子量为10kd的中空超滤膜分离,反复操作6次,收集分子量大于
10kd的组分,得到提取液s3。提取液s3减压浓缩至固形物含量为10wt%,得到浓缩液,用分液漏斗加入浓缩液4倍体积的无水乙醇(控制分液漏斗滴加流速为4ml/min)于4℃静置16h,离心取沉淀,加水复溶,减压浓缩除去乙醇,冷冻干燥后,制备成粒度2μm的海藻多糖细微粉,分别记为泡叶藻多糖(anp)、巨藻多糖(mpp)。将anp和mpp按质量比为1:10混合得到海藻多糖组合物,记为anp
‑
mpp。
[0120]
将木瓜、猕猴桃、番石榴分别洗净,分别切成木瓜碎块、猕猴桃碎块、番石榴碎块,按木瓜碎块:猕猴桃碎块:番石榴碎块的质量比为5:2:6混合,得到混合物,加入混合物10倍质量的水打浆,摇床70℃提取6h。8000r/min离心15min,取上清液,过滤取滤液得复合果汁。
[0121]
将anp
‑
mpp加入到其60倍质量的复合果汁中,混匀,115℃条件下处理10s,得到混合液,调节所述混合液的ph至4.0。鼠李糖乳杆菌先接种于盛有新鲜牛乳中37℃下活化12h,接种量为0.1g/l。将活化好的鼠李糖乳杆菌菌剂按1%体积比加入海藻多糖与复合果汁混合液中,37℃时发酵24h。沸水浴15min以灭菌,浓缩至固形物含量为15wt%,干燥得到anp
‑
mpp组合物与复合果汁混合发酵粉。
[0122]
实施例6:海藻多糖及其组合物与复合果汁发酵物的降血糖动物实验
[0123]
本发明中涉及的受试样品的降血糖动物实验及其结果如下所示:
[0124]
实验中涉及到的96只spf级db/db糖尿病小鼠和8只同窝的spf级野生型db/m小鼠购自常州卡文斯实验动物有限公司,饲养于广州科学城的广州莱德盟生物科技有限公司。动物饲料(sfp级)由广州莱德盟生物科技有限公司提供,保存于4℃。饲养室的温度维持在25
±
1℃,相对湿度维持在55
±
5%,通过控制照明灯维持每天12h的照明和12h的黑暗。实验期间,不限制动物的摄食和饮水。所有动物经过7天的适应性喂养之后进行随机分组,每笼4只,每组2笼。8只spf级db/m小鼠被登记为nc组,实验期间,每天用1ml的生理盐水干预。96只db/db小鼠被随机的分成12组,每组8只,分别登记为dc组:实验期间,每天用1ml的生理盐水干预;met组:按照200mg/kg体重的干预剂量,实验期间,每天灌胃1ml二甲双胍溶液;sfp组:按照800mg/kg体重的干预剂量,实验期间,每天灌胃1ml羊栖菜多糖溶液;anp组:按照800mg/kg体重的干预剂量,实验期间,每天灌胃1ml泡叶藻多糖溶液;mpp组:按照800mg/kg体重的干预剂量,实验期间,每天灌胃1ml的巨藻多糖溶液;scp组:按照800mg/kg体重的干预剂量,实验期间,每天灌胃1ml的马尾藻多糖溶液;usp组:按照800mg/kg体重的干预剂量,实验期间,每天灌胃1ml裙带菜多糖溶液;fvcf组:按照800mg/kg体重的干预剂量,实验期间,每天灌胃1ml的果蔬复合发酵物溶液;anp
‑
sfp组:按照800mg/kg体重的干预剂量,实验期间,每天灌胃1ml的泡叶藻多糖和羊栖菜多糖组合物溶液;scp
‑
usp组:按照800mg/kg体重的干预剂量,实验期间,每天灌胃1ml的马尾藻多糖和裙带菜多糖组合物溶液;anp
‑
mpp组:按照800mg/kg体重的干预剂量,实验期间,每天灌胃1ml的泡叶藻多糖和巨藻多糖组合物溶液;asfm组:按照800mg/kg体重的干预剂量,实验期间,每天灌胃1ml的泡叶藻多糖和羊栖菜多糖组合物与复合果汁发酵物混合溶液;sufm组:按照800mg/kg体重的干预剂量,实验期间,每天灌胃1ml的马尾藻多糖和裙带菜多糖组合物与复合果汁发酵物混合溶液;amfm组:按照800mg/kg体重的干预剂量,实验期间,每天灌胃1ml的泡叶藻多糖和巨藻多糖组合物与复合果汁发酵物混合溶液。56天后,所有动物禁食12小时,通过拔眼球取血,脱颈处死动物后解剖取样,用于后续分析。利用欧姆龙血糖仪hgm
‑
114检测各小鼠的血糖并记录。
[0125]
各实验组糖尿病小鼠之间的初始血糖水平无显著差异(p<0.05)。经过8周的受试
样品干预,各组小鼠的血糖水平如图1所示,数据表明,各干预组的空腹血糖值均低于dc组,具有统计学差异(p<0.05)。此外,asfm、sufm、amfm组动物的血糖水平显著低于其他受试样品干预组(p<0.05)。具体地,与dc组相比,asfm组的空腹血糖水平下降了约60.78%,与met组相比,shfm组的空腹血糖水平下降了约33.38%;与dc组相比,sufm组的空腹血糖水平下降了约61.23%,与met组相比,sufm组的空腹血糖水平下降了约34.08%;与dc组相比,amfm组的空腹血糖水平下降了约59.20%,与met组相比,amfm组的空腹血糖水平下降了约30.62%。
[0126]
以上实施例仅为本发明较优的实施方式,仅用于解释本发明,而非限制本发明,本领域技术人员在未脱离本发明精神实质下所作的改变、替换、修饰等均应属于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。