1.本发明涉及乙型肝炎表面抗原(下文中简称为hbsag)的构象表位及与其特异性结合的抗体。
背景技术:
2.与自发愈合的患者相比,患有慢性乙型肝炎的患者没有或有非常差的t细胞应答。已报道,这是因为由于持续暴露于过量的病毒抗原,例如乙型肝炎表面抗原(hepatitis b surface antigen,hbsag),所以对hbv具有特异性的t细胞消失或无法正确发挥作用。
3.对于慢性乙型肝炎患者,血液中的病毒颗粒达到10
10
个颗粒/ml,并且hbsag甚至可达到100ug/ml的水平。这样的过量的病毒颗粒或hbsag抑制了人体的免疫功能,并因此被认为是慢性肝炎的重要原因。另外,已报道,hbv颗粒或hbsag可进入树突细胞以降低t细胞、b细胞和nk细胞的活化。另外,在使用从健康人血液中分离的树突细胞进行的实验中,观察到重组乙型肝炎表面抗原(recombinant hepatitis b surface antigen,rhbsag)进入树突细胞,并且这些树突细胞的活化标志物蛋白质表达降低。另外,当这些树突细胞与nk细胞和t细胞共培养时,这样的树突细胞活化细胞(例如nk细胞和t细胞)的能力也降低(woltman am,plos one,e15324,january 5,2011)。
4.这种其中发生免疫功能损失或免疫耐受诱导的现象在感染有腺相关病毒
‑
乙型肝炎病毒(adeno
‑
associated virus
‑
hepatitis b virus,aav
‑
hbv)的小鼠中也观察到。令人感兴趣地,在其中注射抗hbsag单克隆抗体以降低血液中hbsag浓度的情况下,已经显示免疫耐受现象逐渐降低以恢复b细胞和辅助t细胞的功能。
5.同时,已知通过常规乙型肝炎疫苗接种产生的大多数抗体识别“a”决定簇('a'determinant),其是hbsag的第124至147位氨基酸之间的位点。另外,已报道,虽然“a”决定簇用作hbv的主要中和表位,但在一些患者中出现的“a”决定簇内具有突变的某些突变体可逃逸由乙型肝炎疫苗接种产生的抗体。
6.因此,越来越需要开发用于预防和治疗乙型肝炎的新的抗体或疫苗,其可抵消针对现有疫苗或乙型肝炎免疫球蛋白(hepatitis bimmunoglobulin,hbig)产生的这样的逃逸突变体。特别地,为了产生和验证针对hbsag的有效抗体,需要鉴定抗原的确切表位。
技术实现要素:
7.技术问题
8.本发明的一个目的是提供乙型肝炎表面抗原的构象表位,以及与该表位特异性结合并对多种突变体hbsag具有优异结合能力的抗体或其片段。
9.问题的解决方案
10.为实现上述目的,在本发明的一个方面中,提供了乙型肝炎表面抗原(hbsag)的构象表位(conformational epitope),以及与该表位特异性结合的乙型肝炎病毒中和抗体或其片段。
11.有益效果
12.本文中提供的乙型肝炎表面抗原(hbsag)的构象表位包含对与乙型肝炎病毒中和抗体特异性结合而言重要的所有关键残基,并且维持允许表位对乙型肝炎病毒中和抗体显示出高亲和力的适当的三维结构。因此,本发明的表位基于其高免疫原性可用作优良的hbv疫苗组合物。另外,通过使用本发明的表位产生的hbv中和抗体可有效地清除血液中存在的hbsag,并且在感染有乙型肝炎病毒的个体中诱导免疫力的恢复,从而有效地治疗乙型肝炎。另外,该抗体可与多种hbsag变体有效地结合,从而有效地消除乙型肝炎病毒。
附图说明
13.图1示出了hbsag结构的示意图。
14.图2示出了通过在天然琼脂糖凝胶上分析hbsag病毒样颗粒(virus
‑
like particle,vlp)的特征而获得的结果。
15.图3示出了使用变性的hbsag vlp和hbsag vlp特异性抗体(gc
‑
100a)进行的分析方法。
16.图4示出了变性的hbsag vlp不与hbsag vlp特异性抗体(gc
‑
100a)结合。在此,n意指天然条件,以及d意指变性条件。
17.图5示出了在hbsag vlp的构象表位上的与hbsag vlp特异性抗体(gc
‑
100a)结合的结合位点的示意图。
18.图6至9示出了通过天然免疫印迹的hbsag vlp特异性抗体(gc
‑
100a)与涉及16个主要氨基酸残基的被称为疫苗逃逸突变体(vaccine escape mutant)的30个点突变hbsag之间的结合程度。
19.图10示出了gc
‑
100a和dako抗体与临床(“a”决定簇)变体hbsag的结合谱。
20.图11至14示出了通过在hbv短期表达小鼠模型中对野生型病毒和疫苗逃逸突变体(g145r)中的hbsag进行elisa获得的结果。特别地,图11示出了在感染有hbv的小鼠中与higg的结合反应。另外,图12示出了确定了hbsag vlp特异性抗体(gc
‑
100a)与在感染有hbv的小鼠中产生的hbsag vlp良好结合的结果。另外,图13示出了在感染有hbv疫苗逃逸突变体(g145r)的野生型小鼠中与higg的结合反应。另外,图14示出了确定了hbsag vlp特异性抗体(gc
‑
100a)与在感染有hbv疫苗逃逸突变体(g145r)的野生型小鼠中产生的hbsag vlp良好结合的结果。在此,y轴意指以iu/ml表示的血液中hbsag的浓度。x轴意指天数。在第1天,进行流体动力学注射(hydrodynamic injection)(注射dna);以及在第2天,进行igg(其为对照)或gc
‑
100a的施用。同一实验中的每条线表示每个个体。
21.图15至18示出了通过hbv dna的定量确定了在hbv短期表达小鼠模型中消除野生型病毒和疫苗逃逸突变体(g145r)的能力的结果。特别地,图15示出了确定了在感染有hbv的小鼠中通过higg未消除hbv的结果。另外,图16示出了确定了在感染有hbv的小鼠中通过gc
‑
100a有效消除了hbv的结果。另外,图17示出了确定了在感染有hbv疫苗逃逸突变体(g145r)的野生型小鼠中通过higg未消除hbv的结果。另外,图18示出了确定了在感染有hbv疫苗逃逸突变体(g145r)的野生型小鼠中通过gc
‑
100a有效消除了hbv的结果。在此,y轴意指以拷贝数/ml表示的血液中hbv dna的浓度。x轴意指天数。在第1天,进行流体动力学注射(注射dna);以及在第2天,进行igg(其为对照)或gc
‑
100a的施用。同一实验中的每条线表示
每个个体。
22.图19至21示出了对于每种基因型/血清型,通过对hbsag进行天然免疫印迹获得的结果。
23.图22示出了对于每种基因型/血清型,gc
‑
100a和dako抗体与hbsag的结合谱。
24.图23示出了表示每种hbv基因型的地理分布的图。
25.图24至26示出了对于每种基因型/血清型,通过对hbsag突变体进行天然免疫印迹获得的结果。
26.图27示出了对于每种基因型/血清型,gc
‑
100a和dako抗体与hbsag的结合谱。
27.图28至33示出了对乙型肝炎表面抗原的多种氨基酸序列的同源性比较分析的结果。横轴表示可存在于表面抗原中的氨基酸的分布。纵轴表示取决于表面抗原位置的代表性氨基酸。
具体实施方式
28.在下文中,将详细描述本发明。
29.在本发明的一个方面中,提供了乙型肝炎表面抗原(hbsag)的构象表位,其包含由通式1表示的肽,
30.通式1
31.thr
‑
(x1)
n1
‑
a1‑
a2‑
(x2)
n2
‑
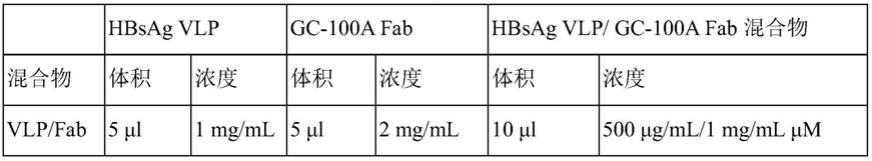
a3‑
(x3)
n3
‑
a4‑
(x4)
n4
‑
a5‑
(x5)
n5
‑
a632.在所述通式中,a1为lys或arg;a2为thr、ala、ile、asn或ser;a3为ser或leu;a4为arg或his;a5为ser或phe;并且a6为ser或asn;并且
33.x1至x5各自独立地为由n1至n5个相同或不同的氨基酸彼此键合形成的肽分子,其中n1为4至8的整数;n2为41至45的整数;n3为0至2的整数;n4为0至2的整数;并且n5为0至4的整数。
34.根据一个实施方案,n1可以为4、5、6、7或8的整数,并且可优选地为6的整数。n2可以为41、42、43、44或45的整数,并且可优选地为43的整数。n3可以为0、1或2的整数,并且可优选地为1。n4可以为0、1或2的整数,并且可优选地为1。n5可以为0、1、2、3或4,并且可优选地为2。
35.在此,x1至x5可各自独立地由选自以下的氨基酸构成:ala、arg、asn、asp、cys、glu、gly、his、ile、leu、lys、met、phe、pro、ser、thr、trp、tyr和val。
36.本发明人进行了鉴定在hbsag中显示出优异免疫原性的特定表位的研究。作为结果,本发明人发现在hbsag中由通式1表示的七个氨基酸残基(thr和a1至a6)在与乙型肝炎病毒中和抗体的特异性结合中发挥重要作用,以及包含7个氨基酸残基并维持适当三维结构的肽分子可用作优异的hbv疫苗组合物,从而完成了本发明。
37.本文中使用的术语“乙型肝炎病毒”是指属于嗜肝dna病毒(hepadnaviridae)科并且具有尺寸为约3.2kb的核苷酸双螺旋结构的dna病毒。乙型肝炎病毒具有四种基因,即pre
‑
core/core、pre
‑
s/s、p和x。这些基因编码hbeag/hbcag、hbsag、dna聚合酶和hbx蛋白。构成hbv的核苷酸序列根据区域和种族而广泛变化。依赖于这样的核苷酸序列变化,hbv血清型差异表达。对于这样的血清型,将血清型adw细分为亚型adw、adw2和adw4;并且血清型adr或ayw也以类似方式被进一步细分。发现在韩国的hbv为血清型adr。
38.本文中使用的术语“乙型肝炎表面抗原”是指存在于乙型肝炎病毒外壳上的蛋白质,并且也被命名为hbsag。在此,乙型肝炎表面抗原(hbsag)可以是由seq id no:1的氨基酸构成的蛋白质。所述抗原可含有具有一维结构的线性表位和具有三维结构的构象表位。通常,线性表位由连续的氨基酸构成。
39.根据本发明的一个实施方案,在通式1中,a1为lys或arg;a2为thr;a3为ser;a4为arg;a5为ser;并且a6为ser或asn。更具体地,a1为lys,并且a6为ser。
40.在这样的情况下,hbsag的构象表位可具有通式2至5的结构中的任一个:
41.通式2
42.thr
‑
(x1)
n1
‑
lys
‑
thr
‑
(x2)
n2
‑
ser
‑
(x3)
n3
‑
arg
‑
(x4)
n4
‑
ser
‑
(x5)
n5
‑
ser
43.通式3
44.thr
‑
(x1)
n1
‑
lys
‑
thr
‑
(x2)
n2
‑
ser
‑
(x3)
n3
‑
arg
‑
(x4)
n4
‑
ser
‑
(x5)
n5
‑
asn
45.通式4
46.thr
‑
(x1)
n1
‑
arg
‑
thr
‑
(x2)
n2
‑
ser
‑
(x3)
n3
‑
arg
‑
(x4)
n4
‑
ser
‑
(x5)
n5
‑
ser
47.通式5
48.thr
‑
(x1)
n1
‑
arg
‑
thr
‑
(x2)
n2
‑
ser
‑
(x3)
n3
‑
arg
‑
(x4)
n4
‑
ser
‑
(x5)
n5
‑
asn
49.根据本发明的一个具体实施方案,n1为6;n2为43;n3为1;n4为1;以及n5为2。在此,特别地,(x1)6可具有由seq id no:2表示的氨基酸序列。另外,(x2)
43
可具有由seq id no:3表示的氨基酸序列。另外,(x3)1可以为ser。另外,(x4)1可以为arg。另外,(x5)2可以为trp
‑
leu。
50.根据本发明的一个实施方案,本发明的hbsag构象表位可在选自hbsag氨基酸第115位、第122位、第123位、第167位、第169位、第171位和第174位的任一位置处。特别地,表位可包含所有七个氨基酸。特别地,乙型肝炎表面抗原(hbsag)的构象表位可以为hbsag构象表位,其由残基在乙型肝炎表面抗原(hbsag)的氨基酸第115至174位处的7
‑
mer
‑
至60
‑
mer寡聚物构成,并且hbsag构象表位可包含在第115位、第122位、第123位、第167位、第169位、第171位和第174位处的氨基酸残基。在此,乙型肝炎表面抗原(hbsag)可具有由seq id no:1表示的氨基酸序列。
51.在本发明的另一个方面中,提供了包含hbsag构象表位作为活性成分的hbv疫苗。在此,作为活性成分包含在hbv疫苗中的hbsag构象表位的特征在于是天然的。包含存在于上述位置处的氨基酸的表位可与载体组合使用以维持表位的三维结构或引起疫苗组合物中的效率提高。在此,对于根据本发明的载体,可使用任何载体,只要其是生物相容性的并且可在本发明中实现期望的作用即可。载体可选自但不限于血清白蛋白、肽、免疫球蛋白、血蓝蛋白、多糖等。
52.在本发明的另一个方面中,提供了与如上所述的本发明的乙型肝炎表面抗原(hbsag)的构象表位特异性结合的乙型肝炎病毒中和抗体或其片段。特别地,乙型肝炎病毒中和抗体或其片段可与hbsag氨基酸第115位、第122位、第123位、第167位、第169位、第171位和第174位处的上述hbsag构象表位特异性结合。
53.在此,中和抗体或其片段可对在疫苗逃逸突变体下的感染具有治疗性作用(参见图10)。
54.在此,抗体可以是单克隆抗体。另外,抗体可在登记号为kctc13760bp的细胞系中
产生。另外,在其中抗体与在上述保藏株中产生的抗体具有相同的表位(互补决定区(complementarity
‑
determining region,cdr))的情况下,可确定这样的抗体属于本发明中公开的抗体。另外,抗体片段可以是选自fab、sfv和f(ab’)2中的任一种,并且可以是双抗体(diabody)或嵌合抗体。然而,片段不限于此。
55.根据本发明的抗体或其片段可与基因型为a、b、c、d、e、f、g或h的乙型肝炎病毒结合,并因此针对这些具有中和活性。另外,所述抗体或其片段可与选自乙型肝炎表面抗原(hbsag)亚型adw、adr、ayw和ayr中的任一种或更多种结合,并因此针对乙型肝炎病毒具有中和活性(实验例3.3和图19至22)。
56.另外,根据本发明的抗体或其片段可与对市场上或正在开发中的针对乙型肝炎病毒的治疗药物具有抗性的乙型肝炎病毒结合,所述药物例如替比夫定(telbivudine)、替诺福韦(tenofovir)、拉米夫定(lamivudine)、阿德福韦(adefovir)、克拉夫定(clevudine)或恩替卡韦(entecavir),并因此针对所述病毒具有中和活性(实验例4和图24至27)。
57.另外,根据本发明的抗体或其片段可与在氨基酸第80位、第101位、第112位、第126位、第129位、第133位、第143位、第172位、第173位、第175位、第181位、第184位、第185位、第195位、第196位、第204位或第236位处具有突变的hbsag结合,并因此针对突变的乙型肝炎病毒具有中和活性。在本发明的一个实施方案中,突变的hbsag可以是在hbsag的第80位、第171位、第172位、第173位、第195位、第196位、第204位或第236位处具有突变的抗原。然而,抗原不限于此。
58.在本发明的又一个方面中,提供了用于治疗hbv感染的药物组合物,其包含乙型肝炎病毒中和抗体或其片段作为活性成分。
59.在此,药物组合物可还包含可药用载体。对于可药用载体,可使用任何载体,只要其是适合于递送至患者的无毒材料即可。载体的一些实例可包括蒸馏水、醇、脂肪、蜡和惰性固体。可药用佐剂(缓冲剂或分散剂)也可包含在药物组合物中。
60.特别地,除活性成分之外,本技术的药物组合物可包含可药用载体,并因此使用本领域中已知的任何常规方法依赖于施用途径将其制备成肠胃外制剂。在此,术语“可药用”是指不抑制活性成分的活性并且毒性不超出接受其的对象可适应的毒性的物质。
61.在其中将本技术的药物组合物制备成肠胃外制剂的情况下,其可根据本领域中已知的任何方法与合适的载体一起,以注射剂、用于经皮递送的药物、用于鼻吸入的药物或栓剂的形式配制。在其中将药物组合物配制为注射剂的情况下,所使用的合适载体可包括无菌水、乙醇、多元醇(例如甘油或丙二醇)或其任何混合物,并且可优选地包括林格液(ringer’ssolution)、注射用无菌水或包含三乙醇胺的磷酸缓冲盐水(phosphate buffered saline,pbs)、等张溶液例如5%右旋糖等。与药物组合物的配制相关的方法是本领域中已知的。
62.本技术的药物组合物的优选剂量可以为每天0.01ug/kg至10g/kg,或每天0.01mg/kg至1g/kg,这取决于患者的状况、体重、性别、年龄、疾病严重程度和施用途径。施用可每天一次进行或将施用分为数次。这样的剂量不应被解释为以任何方式限制本发明的范围。
63.可应用本技术组合物的对象包括哺乳动物和人,其中人是特别优选的。除活性成分之外,本技术的药物组合物还可包含已针对安全性进行验证并且已知对感染性疾病具有治疗性作用的任何化合物或天然提取物,以提高或增强其治疗活性。
64.在本发明的又一个方面中,提供了乙型肝炎病毒中和抗体或其片段用于制造用于治疗hbv感染的药物组合物的用途。
65.在本发明的又一个方面中,提供了用于治疗hbv感染的方法,其包括向个体施用有效量的药物组合物的步骤。
66.在本发明的又一个方面中,提供了用于产生与上述hbsag构象表位特异性结合的乙型肝炎病毒中和抗体或其片段的方法,其包括以下步骤:1)测量对hbv具有特异性的抗体与上述hbsag构象表位的结合能力;2)测量对hbv具有特异性的抗体与上述hbsag构象表位的经修饰形式的结合能力,所述经修饰形式通过将上述hbsag构象表位中选自通式1的thr、a1、a2、a3、a4、a5和a6中的任一个氨基酸残基替换为另外的残基来获得;以及3)选择这样的抗体,在步骤1)中测量的其与hbsag构象表位的结合能力与在步骤2)中测量的其与hbsag构象表位的经修饰形式的结合能力相比是强的。
67.在此,在步骤2)中提及的氨基酸残基替换中,a1可被除lys或arg之外的氨基酸替换。另外,a2可被除thr、ala、ile、asn或ser之外的氨基酸替换。另外,a3可被除ser或leu之外的氨基酸替换。另外,a4可被除arg或his之外的氨基酸替换,以及a5可被除ser或phe之外的氨基酸替换。另外,a6可被除ser或asn之外的氨基酸替换。
68.发明方式
69.在下文中,将通过以下实施例更详细地描述本发明。然而,以下实施例仅用于举例说明的目的,并且本发明的范围不限于此。
70.制备例1.与hbsag特异性结合的抗体的制备
71.在本发明中,对于与hbsag特异性结合的抗体,使用了通过登记号为kctc13760bp的株产生的单克隆抗体。另外,为方便起见,将通过该株产生的单克隆抗体命名为gc
‑
100a。
72.实验方法1.天然琼脂糖凝胶电泳(nage)
73.使用lipofectamine 3000用空(mock)载体或flag
‑
small hbsag表达质粒对huh
‑
7细胞进行转染。在2天之后,使用ripa缓冲液(thermo fisher,89901)将细胞裂解。在4℃和12,000rpm下进行离心15分钟,并随后将无沉淀的上清液转移至新eppendorf管。向其中添加6x载有染料的琼脂糖(50%甘油,0.1%bpb)至最终1x浓度,并将其充分混合。制备1.2%tbe琼脂糖凝胶,并在其上加载与载有染料的琼脂糖混合的样品。然后,在50v下进行凝胶电泳1小时。
74.在完成凝胶电泳之后,使用20x ssc缓冲液(3m nacl,0.3m柠檬酸钠,ph 7.2)在聚偏二氟乙烯膜(pvdf膜)上进行向上毛细管转移。将在其上完成物质转移的膜用5%脱脂乳溶液封闭30分钟,并使用1xtbst缓冲液(50mm tris、150mm nacl、0.1%吐温20)洗涤两次。随后,将gc
‑
100a或抗flag抗体(5ug)在10ml tbs封闭缓冲液(thermo fisher,37571)中稀释,并随后与膜一起在摇床上孵育2小时。在完成孵育之后,在摇床上进行用1x tbst缓冲液进行的洗涤,持续5分钟。将该过程重复4次。
75.将抗人抗体或抗小鼠抗体在10ml tbs封闭缓冲液中稀释,并随后与膜一起在摇床上孵育1小时。最后,如上所述,在摇床上进行用1x tbst缓冲液进行的洗涤,持续5分钟。将该过程重复4次。将在其上完成与一抗和二抗的反应的膜与ecl(ge healthcare,rpn2235)反应。然后,使用chemidoc mp系统(bio
‑
rad,1708280)获得图像。
76.实验方法2.变性免疫沉淀实验
77.使用lipofectamine 3000用空载体或flag
‑
small hbsag表达质粒对hek293t细胞进行转染。在2天之后,使用np40细胞裂解缓冲液(150mm nacl,50mm tris
‑
hcl,ph 7.5,1%np
‑
40)将细胞裂解。在4℃和12,000rpm下进行离心15分钟,并随后将无沉淀的上清液转移至新eppendorf管。
78.将细胞裂解物分成4份样品;并随后对其中2份进行天然ip,以及对另外2份进行变性(在100℃下加热10分钟,终浓度为1%sds,1%β
‑
巯基乙醇)。将4份样品中的每一份转移至15ml锥形管,并随后使用np40细胞裂解缓冲液将其稀释20倍。为了匹配在天然样品和变性样品中发生抗体结合的条件,向2份天然样品添加终浓度为0.05%的sds和0.05%的β
‑
巯基乙醇。向天然样品和变性样品中的每一份添加5ug的抗flag抗体,以及向剩余的非变性样品和变性样品中的每一份添加5ug的gc
‑
100a。然后,在4℃下于冷室中在摇动的情况下进行孵育过夜。
79.第二天,向其中添加蛋白a琼脂糖珠(ge healthcare,17
‑
0780
‑
01)各100ul,并将其在冷室中在摇动的情况下再次进行孵育5小时。对于每份样品,在完成反应之后,在4℃和2,000rpm下进行离心3分钟。将上清液弃去,并且使用np40细胞裂解缓冲液将剩余的珠转移至新的eppendorf管。在4℃和4,000rpm下再次进行离心3分钟。将上清液弃去,并使用500ul np40细胞裂解缓冲液再次进行洗涤。将该过程重复4次。将上清液完全丢弃。向其中添加50ul 1.5x样品缓冲液(通过将终浓度为4%的β
‑
巯基乙醇添加至np0007(thermo fisher)并以1.5x进行稀释而获得),并在100℃下进行煮沸。随后,在4℃和12,000rpm下进行离心3分钟,并随后将上清液转移至新的eppendorf管。
80.将以上样品中的每一份加载到12%bis
‑
tris蛋白凝胶(thermo fisher,np0342box)上,并且在110v下进行凝胶电泳2小时(直至染料电泳至凝胶末端)。在完成凝胶电泳之后,将物质转移至pvdf膜。将在其上完成物质转移的膜用5%脱脂乳溶液封闭30分钟,并使用1x tbst缓冲液(50mm tris、150mm nacl、0.1%吐温20)洗涤两次。随后,将gc
‑
100a或抗flag抗体(5ug)在10ml tbs封闭缓冲液(thermo fisher,37571)中稀释,并随后将其与膜一起在摇床上孵育2小时。
81.在完成孵育之后,在摇床上进行用1x tbst缓冲液进行的洗涤5分钟。将该过程重复4次。将抗人抗体或抗小鼠抗体在10ml tbs封闭缓冲液中稀释,并随后与膜一起在摇床上孵育1小时。最后,如上所述,在摇床上进行用1x tbst缓冲液进行的洗涤5分钟。将该过程重复4次。将在其上完成与一抗和二抗的反应的膜与ecl(ge healthcare,rpn2235)反应。然后,使用chemidoc mp系统(bio
‑
rad,1708280)获得图像。
82.实验方法3.hbsag与gc
‑
100a之间的表位定位
83.为了形成免疫复合体,将hbsag vlp与gc
‑
100a fab混合,如表1中所示。
84.[表1]
[0085][0086]
将1mg d0交联剂与1mg d12交联剂混合。再次,将混合物与1ml dmf混合以获得
2mg/ml的dss d0/d12溶液。将10ul先前制备的抗体/抗原混合物与1ul交联剂d0/d12溶液混合。对于交联反应,将该溶液在室温下孵育180分钟。
[0087]
实验例1.gc
‑
100a抗体的hbsag表位的鉴定
[0088]
实验例1.1.使用gc
‑
100a检测hbsag vlp的可能性的鉴定
[0089]
直到2016,elisa是使得用gc
‑
100a检测hbsag成为可能的唯一测试方法。另外,在使用sds
‑
page进行的western印迹分析中,不可能用被认为具有构象表位的gc
‑
100a检测hbsag。因此,设计了检测天然状态下的hbv衣壳的技术,并尝试使用在实验方法1中公开的nage来检测hbsag vlp(由100个单hbsag分子组成)。由于nage是在没有引起蛋白质变性的情况下鉴定大分子的方法,该方法使得用具有线性表位的抗flag抗体以及具有构象表位的gc
‑
100a检测hbsag vlp成为可能(图2)。
[0090]
通过gc
‑
100a和抗flag抗体检测到hbsag vlp模式之间存在差异。在每个较上条带中,可以说vlp处于本文中所期望的完整状态。在另一方面,在由抗flag抗体检测到的hbsag vlp的较下条带中,预计vlp将处于变性状态。其原因如下。在hbsag vlp中,脂质组分占约30%或更多;并且因此,预计在于nage中获得细胞裂解物的步骤中,vlp脂质将被作为ripa缓冲液中的洗涤剂的triton x
‑
100破坏以产生复合体。
[0091]
因此,由于具有构象表位的gc
‑
100a识别vlp结构,因此可仅检测其中vlp处于完整状态的较上条带。然而,在具有线性表位的抗flag抗体的情况下,可检测处于轻微破坏状态的vlp。总之,在hbsag vlp中未引起蛋白质变性的情况下使用nage的情况下,可用gc
‑
100a检测vlp(图2)。
[0092]
实验例1.2.对gc
‑
100a的结合位点是否为构象表位的鉴定
[0093]
为了鉴定gc
‑
100a的结合位点是否具有构象表位,进行了变性ip。根据实验例1.1.的结果,可用gc
‑
100a和抗flag抗体二者检测天然hbsag vlp。因此,gc
‑
100a与天然hbsag vlp结合;然而,在其中hbsag vlp变性的情况下,具有构象表位的gc
‑
100a不能与其结合。另外,在sds
‑
page中,gc
‑
100a未能检测hbsag。因此,最后一次检测旨在使用抗flag抗体进行。换言之,选择了其中用gc
‑
100a进行与天然或变性hbsag vlp的结合(ip)以及用抗flag抗体进行与gc
‑
100a结合的hbsag vlp的检测(ib)的方法。该实验的综述示出于图3中。
[0094]
当用gc
‑
100a进行免疫沉淀(ip)时,gc
‑
100a与天然hbsag vlp结合。然而,变性hbsag vlp未与gc
‑
100a结合(图4)。具有线性表位的抗flag抗体与变性的hbsag vlp以及天然hbsag vlp结合。通过用抗flag抗体进行变性ip获得的结果表明了显示出条件足以用于抗体与抗原结合的对照。然而,gc
‑
100a未与变性的hbsag vlp结合,并且该结果支持gc
‑
100a具有构象表位。
[0095]
另外,与其中用抗flag抗体进行免疫印迹(ib)的情况不同,在其中用gc
‑
100a进行ib的情况下未观察到条带;并且这成为与如上所述的结果独立的支持基础。因此,从通过进行变性ip实验获得的结果中,发现了gc
‑
100a与构象表位结合。
[0096]
实验例2.使用蛋白酶对本发明抗体的表位位置的鉴定
[0097]
该实验如下进行。允许两种蛋白质自然反应,并随后使用交联剂在彼此靠近的位点实现交联。然后使用蛋白酶将蛋白质切割为肽片段,以便找到交联位点。
[0098]
特别地,将1mg d0交联剂与1mg d12交联剂混合,并随后将混合物与1ml dmf混合以获得2mg/ml的dss d0/d12溶液。将1ul溶液与10ul gc
‑
100a/hbsag vlp复合体混合,并将
其在室温下孵育180分钟。
[0099]
然后,将与d0/d12交联的变性的gc
‑
100a/hbsag vlp复合体用切割赖氨酸或精氨酸残基的胰蛋白酶(roche diagnostic)进行消化,并随后通过nlc
‑
orbitrap ms/ms分析鉴定作为gc
‑
100a的片段的fab与hbsag vlp之间的9个交联肽。这些交联肽部分通过xquest和stavrox软件二者进行检测(表2)。
[0100]
[表2]
[0101][0102]
将通过如上所述的相同的制备方法制备的与d0/d12交联的变性的gc
‑
100a/hbsag vlp复合体用切割色氨酸、酪氨酸、苯丙氨酸、亮氨酸和甲硫氨酸残基的糜蛋白酶(roche diagnostic)进行消化。然后,通过nlc
‑
orbitrap ms/ms分析检测fab与hbsag vlp之间的一个交联肽。这些交联肽部分通过xquest和stavrox软件二者进行检测(表3)。
[0103]
[表3]
[0104][0105]
将通过如上所述的相同的制备方法制备的与d0/d12交联的变性的gc
‑
100a/hbsag vlp复合体用切割天冬氨酸和谷氨酸的asp
‑
n酶(roche diagnostic)进行消化。然后,进行nlc
‑
orbitrap ms/ms分析;然而,未检测到fab与hbsag vlp之间的交联肽。将gc
‑
100a/hbsag vlp复合体使用如上所述的相同的方法用切割丝氨酸的弹性蛋白酶(roche diagnostic)进行消化,并随后通过nlc
‑
orbitrap ms/ms分析检测fab与hbsag vlp之间的5个交联肽。这些交联肽部分通过xquest和stavrox软件二者进行检测(表4)。
[0106]
[表4]
[0107][0108][0109]
将gc
‑
100a/hbsag vlp复合体使用如上所述的相同的方法用切割疏水性氨基酸残基的嗜热菌蛋白酶(roche diagnostic)进行消化,并随后通过nlc
‑
orbitrap ms/ms分析检测fab与hbsag vlp之间的一个交联肽。这些交联肽部分通过xquest和stavrox软件二者进行检测(表5)。
[0110]
[表5]
[0111][0112]
特别地,蛋白质1是重链,并且蛋白质2是vlp;并且序列蛋白质1和2是与其结合的肽部分。末端处的naa1和naa2是通过交联剂连接的部分。迄今为止获得的数据用于推断gc
‑
100a的表位。作为结果,鉴定出该表位包含两部分,一部分位于hbsag的氨基酸残基第115位、第122位和第123位处,并且另一部分位于hbsag的氨基酸残基第167位、第169位、第171位和第174位处(图5)。
[0113]
实验例3.gc
‑
100a与hbsag突变体的结合能力的检查
[0114]
gc
‑
100a与hbsag的构象表位结合,并因此可对hbsag具有不同的结合能力,这取决于hbsag和其中突变的类型。因此,构建了数种类型的hbsag突变体,并检查了gc
‑
100a与其的结合能力。
[0115]
实验例3.1.gc
‑
100a与临床(“a”决定簇)变体的结合能力的检查
[0116]
在迄今为止报道的临床变体中(alavian sm,j clinical virol.57:201,2013),鉴于hbsag的膜分布结构(rezaee r.et al.,hepat mon.16:e39097,2016),其中重点放在“a”决定簇区域(氨基酸第120至150位),选择16个主要氨基酸位置的30个点突变体(例如被称为疫苗逃逸突变体的g145r)作为主要分析靶标。
[0117]
对于在实验方法1中通过nage获得的数据,用imagej软件测量条带强度以确定相对于抗ha的结合能力的每种抗hbsag抗体的结合程度。作为结果,鉴定出在抗体gc
‑
100a与dako(抗hbsag多克隆抗体)之间的抗原结合特性方面存在显著差异(图6至9)。下表6列出了hbsag的临床突变体。
[0118]
[表6]
[0119]
氨基酸位置野生型(ayw)突变体117sr/t120pe/s/t123tn124cr/y126ti/a/n/s129qh/l130gd/r133ml134yn/r141ke/i142ps/l144da/e
145gr/k146ns148ti149cr
[0120]
如图6至9中所举例说明的,hbsag突变体的条带在nage中具有不同的位置。在这种现象中,具有被碱性氨基酸进行的替换(例如s117r和g130r)的蛋白质较少迁移。相反,具有被酸性氨基酸进行的替换(例如p120e和g130d)的克隆较远迁移。从这些结果中发现,在以上nage中,蛋白质的电荷是重要的迁移因素。与wt相比,一些克隆(例如s117r和g130r)不表现出或表现出显著更低的抗原性蛋白水平。鉴于这样的事实:在用如上所述的抗ha抗体进行检查的情况下这样的克隆表现出不显著低于其他克隆的胞内蛋白质表达水平,确定了这些突变体在向细胞外分泌蛋白质中具有低效率,或者由其分泌的蛋白质具有低稳定性。gc
‑
100a对30种临床(“a”决定簇)变体显示出大致相似的结合能力。在另一方面,针对患者的血液源性hbsag抗原产生的dako抗体在抗原结合方面对k141e至t148i的所有10种突变体显示出极低的结合能力;并且该结果显著区别于gc
‑
100a的结果。
[0121]
由约10个氨基酸构成的部分在对应于“a”决定簇的第二环的位置处,并且看起来对dako抗体的结合非常重要。在另一方面,与大多数“a”决定簇依赖性抗hbsag抗体不同,确定了gc
‑
100a显示出与多种临床变体(包括疫苗逃逸突变体例如g145k或g145r)的相当一致的结合(图10)。特别地,看起来dako抗体的结合在第141至149位处减弱。这可表示疫苗逃逸突变体。相反,gc
‑
100a显示出在相同位置处的结合能力无差异,由此预测gc
‑
100a针对疫苗逃逸突变体将是有效的。在此,疫苗逃逸突变体意指在已接受hbv疫苗接种并产生抗体的对象中再次引起hbv感染的情况。
[0122]
实验例3.2.gc
‑
100a针对疫苗逃逸突变体g145r的效力的鉴定
[0123]
在小鼠中检查了针对疫苗逃逸突变体g145r的消除能力。对于野生型hbv或疫苗逃逸突变体g145r的短期表达小鼠模型,在用为阴性对照的higg处理的组中,鉴定出野生型病毒或疫苗回避突变体(g145r)的hbsag在血液中维持直至约第6天(图11和13)。相反,在用gc
‑
100a处理的组中,鉴定出野生型病毒或疫苗回避突变体(g145r)的hbsag在处理之后第1天急剧降低(图12和14)。
[0124]
进行qpcr以定量分析除病毒hbsag之外的感染性病毒颗粒(病毒体)。作为结果,在用gc
‑
100a处理的组中,鉴定出野生型病毒或疫苗回避突变体(g145r)的dna在处理之后第1天在血液中急剧降低。然而,在用为阴性对照的higg处理的组中,鉴定出野生型病毒或疫苗回避突变体(g145r)的dna在血液中维持直至第7天至第10天(图15至18)。综合以上结果,鉴定出gc
‑
100a可消除存在于小鼠血液中的hbsag和感染性病毒颗粒(病毒体),并且在疫苗逃逸突变体(g145r)以及野生型病毒中观察到这种作用。
[0125]
实验例3.3.gc
‑
100a针对基因型/血清型的结合能力的检查
[0126]
hbv由10种基因型(a、b、c、d、e、f、g、h、i和j)和4种血清型(ayw、ayr、adw和adr)组成。检查了gc
‑
100a与hbv的多种基因型和血清型的结合能力。
[0127]
对于表示各自基因型的氨基酸序列,对来源于患者样品的数个序列进行比较并选择共有序列。对于每种类型选择的共有序列的数目如下:a型2个;b型2个;c型2个;d型2个;e型2个;f型3个;g型2个;以及h型3个。由于i型和j型是最近分离的基因型,因此没有太多的
序列信息。因此,选择本发明人拥有的序列作为代表性序列。另外,由于血清型adw、adr和ayw存在于各个基因型的21个代表性序列中,因此添加了由本发明人拥有的血清型ayr的序列。因此,使用了总共22个序列来检查gc
‑
100a的结合能力。
[0128]
作为用以上方法进行鉴定的结果,显示了与dako抗体相比,gc
‑
100a对基因型c的应答有些强,并且对基因型f和h的应答有些弱(图19至22)。这些结果表明,gc
‑
100a能够与所有基因型/血清型的多种hbsag结合。另外,大部分的患者基因型为a、b、c和d;并且基因型f和h是仅在南美洲当地的代表性基因型(图23)。
[0129]
实验例4.gc
‑
100a与药物抗性变体的结合能力的检查
[0130]
目前,存在两种类型的经fda批准的针对慢性乙型肝炎病毒(chb)的抗病毒药物,即基于核苷酸/核苷(nucleot(s)ide)的类型和干扰素
‑
a相关类型。其中,核苷酸/核苷药物包括拉米夫定、替比夫定、阿德福韦、替诺福韦和恩替卡韦,并且具有作用于hbv聚合酶以阻止病毒复制的机制。然而,核苷酸/核苷药物的长期施用导致针对其的抗性突变体,并且因此尽管施用了药物,但是病毒滴度再次恢复。因此,进行了使用核苷酸/核苷药物的组合治疗。然而,由于这样的治疗引起了多药抗性,因此这种治疗成为了大问题。
[0131]
作用于聚合酶的药物与与hbsag结合的gc
‑
100a之间的关系如下。hbv具有3.2kb的小基因组,并因此聚合酶orf和hbsag orf在其中重叠。因此,在其中聚合酶中发生突变的情况下,hbsag也发生可影响gc
‑
100a结合的突变。因此,本发明人旨在检查gc
‑
100a与这些突变体的结合能力。
[0132]
对由拉米夫定、替比夫定、阿德福韦、替诺福韦、恩替卡韦和多药引起的聚合酶中的突变以及由此产生的hbsag中的突变进行了检查(表7)。
[0133]
[表7]
[0134][0135]
由5种rt抑制剂引起的聚合酶中的突变位点为聚合酶中的180l、181a、204m和236n,并且由此导致的hbsag中的突变发生在第172位、第173位、第195位或第196位。聚合酶突变体在其中发生双重突变的情况下变得更具抗性;然而,它们即使在其中两个序列之一中发生单突变的情况下也变得更具抗性。因此,考虑到其组合,创建了14种组合。下表8列出了药物抗性株。
[0136]
[表8]
[0137][0138]
使用nage检查gc
‑
100a与突变体的结合能力。对于所有14种构建体,gc
‑
100a显示出对其的结合能力与对wt的相似(图24至26)。因此,无论核苷酸/核苷抗性突变体如何,gc
‑
100a均显示出良好的结合,并因此可将其应用于由于产生抗性突变体而无法治愈的患者。
[0139]
该抗体于2018年12月5日以登记号kctc13760bp保藏在韩国生物科学与生物技术研究所。
[0140]
[保藏证明]
[0141]
专利程序的微生物保藏国际承认的布达佩斯条约
[0142]
国际表格
[0143]
原始保藏证明
[0144]
由国际保藏机构根据第7条第1款颁发
[0145]
在本页底部标识
[0146]
致:株式会社绿十字
[0147]
韩国京畿道龙仁市器兴区ihyeon
‑
ro30号街107号,16924
[0148][0149][0150]
表格bp/4(kctc表格17)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。