1.本发明涉及生物技术及免疫学技术领域,具体涉及一种抗新型冠状病毒的双特异性抗体及其制备方法与应用。
背景技术:
2.新型冠状病毒(2019
‑
ncov)表面的刺突蛋白(spike,s蛋白)在感染宿主的过程中结合宿主细胞受体血管紧张素转换酶2(ace2)分子,从而启动病毒膜与宿主细胞膜发生融合,导致宿主细胞感染病毒。s蛋白分为s1和s2两部分,已有研究证实s1的c端(ctd)的受体结合结构域(rbd)与ace2结合,介导膜融合过程。
3.迄今为止,中和抗体已被证明是治疗病毒性疾病的有效方法。目前已经上市的治疗和预防病毒感染的药物有预防小儿呼吸道合胞病毒(rsv)感染的帕利珠单抗(synagis),治疗hiv感染的艾巴利珠单抗(trogarzo),以及用于狂犬病毒暴露后预防的rabishield。此外,还有多种针对不同病毒的单抗处于临床研究的不同阶段(https://clinicaltrials.gov/)。抗体主要通过两方面起作用。一方面,具有中和活性的抗体可通过结合病毒囊膜蛋白,阻断病毒与细胞受体的结合,从而阻断病毒感染。另一方面,抗体依赖的细胞介导的细胞毒性作用(adcc)和补体依赖的细胞毒性作用(cdc)可募集巨噬细胞或是补体等免疫细胞和免疫分子,从而清除游离的病毒以及被感染的细胞。
4.双特异性抗体(bispecific antibody,bsab)是近年来在抗体药物研究领域的重点方向之一。双特异性抗体是含有两种能够特异性识别并结合不同抗原或不同抗原位点的人工抗体。如果这两种抗原位于不同的细胞表面,则这种双特异性抗体能在这两种抗原分子之间架起桥梁,从而形成细胞之间的交联,介导细胞产生导向性的效应功能。bsab在生物医学、特别是在肿瘤的免疫治疗中具有广阔的应用前景。用于免疫治疗的双特异性抗体(免疫双抗)是含有2种特异性细胞受体抗原结合位点的人工抗体,能在病变细胞(靶细胞)和功能细胞(免疫细胞)之间架起桥梁,激发具有导向性的免疫反应。通过bsab介导免疫细胞(如t细胞,nk细胞等)杀死肿瘤细胞是目前免疫治疗应用研究的热点,其作用机理是bsab能同时结合肿瘤相关抗原和免疫效应细胞上的靶分子,在活化免疫细胞的同时,直接导向免疫效应细胞对肿瘤细胞的特异性杀伤。目前,已经批准上市的双特异性抗体包括epcam/cd3和cd19/cd3两种,尚在临床研究阶段的双特性抗体超过一百种。对于传染性病原微生物,特别是容易发生变异的rna病毒,使用一个靶向单位点的抗体进行感染治疗,病毒容易在抗体的选择压力下发生突变,进而逃逸抗体的结合,产生对抗体治疗不敏感的抗体。而同时靶向病毒抗原的两个不同位点,能够大大降低病毒逃逸突变产生的概率。不仅如此,同时靶向不同位点能够显著提高病毒中和效果,降低抗体用量,提高治疗效果。例如,在对埃博拉病毒感染的临床治疗中,利用结合埃博拉病毒表面糖蛋白(gp)的三种不同抗体,能够显著降低病人死亡率,对埃博拉病毒感染具有显著的治疗效果。
5.双特异性抗体可通过多种途径获得,其制备方法主要有:化学偶联法、杂交
‑
杂交瘤法和基因工程抗体制备法。化学偶联法是将2个不同的单克隆抗体用化学偶联的方式连
接在一起,制备的双特异性单克隆抗体,这是最早的双特异性单克隆抗体。杂交
‑
杂交瘤法是通过细胞杂交法或者三元杂交瘤的方式产生双特异性单克隆抗体,这些细胞杂交瘤或者三元杂交瘤是通过建成的杂交瘤融合,或者建立的杂交瘤和从小鼠的淋巴细胞融合而得到的,只能用于生产鼠源的双特异性抗体,因此,其应用受到了极大的限制。而随着分子生物学技术的迅速发展,出现了基因工程人源化或全人源的双特异性抗体的多种构建模式,主要包括双特异性微抗体、双链抗体、单链双价抗体、多价双特异性抗体四类。目前,国际上已有数种基因工程双特异性抗体药物进入临床试验阶段,并显示有较好的应用前景。
6.与单克隆抗体相比,双特异性抗体的优势在于:双特异性抗体可以同时识别两种分子,提高了抗体的选择性和功能性,改善了药物的安全性和有效性。与两种单克隆抗体药物联合用药治疗相比,双特异性抗体药物减少了开发和临床试验成本。对于感染性病原而言,同时作用于病原的两个不同位点,使得在治疗过程中产生抗体耐药的可能性更低,且能够抑制广泛治疗中病毒逃逸突变的产生。因此,开发靶向新型冠状病毒不同位点的双特异性抗体,对于提高新冠肺炎治疗效果、降低逃逸突变的产生等都具有重要意义。
技术实现要素:
7.为解决现有技术中存在的技术问题,本发明的目的在于提供一种具有特异的靶向作用、对新冠病毒具有良好亲和力和显著病毒抑制活性的双特异性抗体及其应用。
8.为实现上述目的,在第一个方面,本发明提供一种双特异性抗体,其技术方案如下:本发明通过对现有技术公布的抗新冠肺炎单克隆抗体进行筛选和分析,创造性地发现,将单抗b38与单抗h4进行本发明所述的基因改造后,能够更好地保留原母源单抗的特异性结合能力,同时具有两个单克隆抗体的生物学功能,在病毒中和活性、安全性、稳定性等等方面较母源单抗具有明显的优势。
9.本发明中,所述单抗b38的重链可变区cdr1含有seq id no.9所示的氨基酸序列,cdr2含有seq id no.10所示的氨基酸序列,cdr3含有seq id no.11所示的氨基酸序列;所述单抗b38的轻链可变区cdr1含有seq id no.12所示的氨基酸序列,cdr2含有seq id no.13所示的氨基酸序列,cdr3含有seq id no.14所示的氨基酸序列。
10.所述单抗h4的重链可变区cdr1含有seq id no.15所示的氨基酸序列,cdr2含有seq id no.16所示的氨基酸序列,cdr3含有seq id no.17所示的氨基酸序列;所述单抗h4的轻链可变区cdr1含有seq id no.18所示的氨基酸序列,cdr2含有seq id no.19所示的氨基酸序列,cdr3含有seq id no.20所示的氨基酸序列。
11.与传统的单克隆抗体、多克隆抗体、单链抗体等的设计不同,双特异性抗体在设计时需要考虑的因素和面临的技术难度主要是:双特异性抗体为不同结构的抗体之间形成的融合蛋白,不同结构的抗体分别结合两种细胞的不同抗原或同一抗原的不同位点,发挥各自不同的功能。为使得双特异性抗体中各抗体充分发挥其各自的功能,在抗体设计时,应尽量减少各抗体在序列和结构上相互影响对各自功能发挥造成的不利影响。以及双特异性抗体在靶向不同抗原或不同位点时,若想最大程度地中和病毒滴度,双特异性抗体与不同抗原或同一抗原不同位点的结合亲和力需要相互平衡、匹配,而并不是简单地追求对两个靶点的高亲和力。
12.本发明发现在选择单抗b38与单抗h4进行基因改造构建双特异性抗体的过程中,
不同的改造方法获得的双特异性抗体的亲和力、中和活性、稳定性效果差异很大。经过反复筛选和探索,本发明提供了两个经基因工程方法改造得到的效果优异的双特异性抗体,为如下:
13.(1)双特异性抗体bs
‑
mab
‑
1,其轻链可变区序列为b38单抗的轻链可变区n端与h4单抗轻链可变区的c端通过连接肽连接;其重链可变区序列为b38单抗的重链可变区n端与h4单抗轻链可变区的c端通过连接肽连接;或
14.(2)双特异性抗体bs
‑
mab
‑
2,包括b38单克隆抗体单元和h4单链抗体单元,
15.所述h4单链抗体单元包括2个单链抗体,所述单链抗体是h4单抗的重链可变区的c端与h4单抗轻链可变区的n端通过连接肽连接组成融合肽;所述2个单链抗体的c端分别通过连接肽与所述b38单克隆抗体的2条重链的n端连接,或所述2个单链抗体的n端分别通过连接肽与所述单克隆抗体的2条重链的c端连接。
16.进一步地,连接肽的氨基酸序列为(ggggs)n,其中,n为1
‑
4的自然数。优选地,上述(1)中,连接肽的n为2;上述(2)中,所述融合肽中的连接肽的n为4,单链抗体与单克隆抗体重链的连接肽的n为1。
17.在一种实施方式中,本发明的双特异性抗体包含单抗b38的重链可变区、单抗b38的轻链可变区、单抗h4的重链可变区、单抗h4的轻链可变区,其中,
18.单抗b38的重链可变区包含:氨基酸序列如seq id no.9所示的cdr1、氨基酸序列如seq id no.10所示的cdr2、以及氨基酸序列如seq id no.11所示的cdr3;单抗b38的轻链可变区包含:氨基酸序列如seq id no.12所示的cdr1、氨基酸序列如seq id no.13所示的cdr2、以及氨基酸序列如seq id no.14所示的cdr3;
19.单抗h4的重链可变区包含:氨基酸序列如seq id no.15所示的cdr1、氨基酸序列如seq id no.16所示的cdr2、以及氨基酸序列如seq id no.17所示的cdr3;单抗h4的轻链可变区包含:氨基酸序列如seq id no.18所示的cdr1、氨基酸序列如seq id no.19所示的cdr2、以及氨基酸序列如seq id no.20所示的cdr3。
20.优选地,所述单抗b38的重链可变区的氨基酸序列如seq id no.32所示,单抗b38的轻链可变区的氨基酸序列如seq id no.33所示;所述单抗h4的重链可变区的氨基酸序列如seq id no.34所示,单抗h4的轻链可变区的氨基酸序列如seq id no.35所示。
21.进一步优选地,还包括单抗b38的恒定区和/或单抗h4的恒定区;所述恒定区可以是本领域已知的任何适用的恒定区。
22.在一种优选的实施方式中,所述双特异性抗体为bs
‑
mab
‑
1,其具有如下结构(从n端到c端):
23.重链:vh
h4
‑
vh
b38
‑
ch
b38
,
24.轻链:vl
h4
‑
vl
b38
‑
cl
b38
,
25.其中,vh
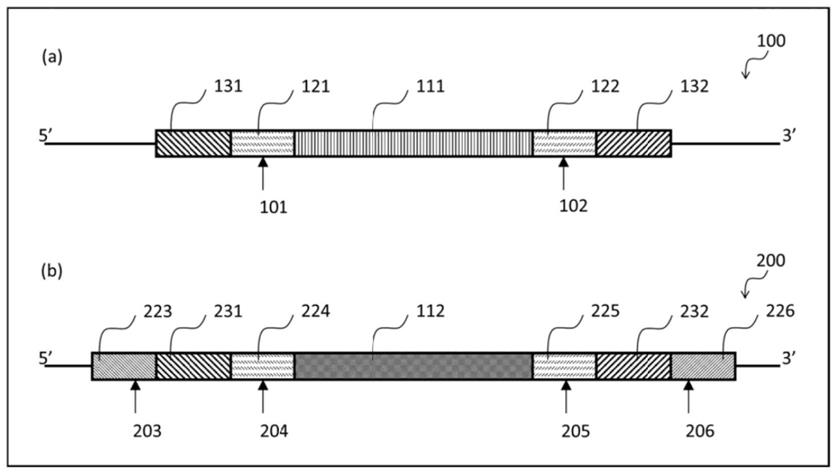
h4
与vh
b38
通过连接肽连接,vl
h4
与vl
b38
通过连接肽连接;
26.在另一种优选的实施方式中,所述双特异性抗体为bs
‑
mab
‑
2,其具有如下结构(从n端到c端):
27.重链:vh
b38
‑
ch
b38
‑
vh
h4
‑
vl
h4
,
28.轻链:vl
b38
‑
cl
b38
;
29.其中,vh
h4
与vl
h4
通过连接肽连接,组成单链抗体;ch
b38
与vh
h4
通过连接肽连接。
30.优选地,所述双特异性抗体包括两条相同的重链和两条相同的轻链。
31.其中,所述连接肽的氨基酸序列为(ggggs)n,其中,n为1
‑
4的自然数。优选地,在抗体bs
‑
mab
‑
1中,连接肽的n为2;在抗体bs
‑
mab
‑
2中,所述vh
h4
与vl
h4
之间的连接肽的n为4,ch
b38
与vh
h4
之间的连接肽的n为1。
32.在上述以及本技术其它地方的描述中,vh
b38
表示单抗b38的重链可变区,与(vh
‑
b38)同义;ch
b38
表示单抗b38的重链恒定区,包括ch1~ch3;vh
h4
表示单抗h4的重链可变区,与(vh
‑
h4)同义;vl
h4
表示单抗h4的轻链可变区,与(vl
‑
h4)同义;vl
b38
表示单抗b38的轻链可变区,与(vl
‑
b38)同义;cl
b38
表示单抗b38的轻链恒定区,简写为cl。在一些实施方式中,单抗b38的重链恒定区与单抗h4的重链恒定区具有相同序列;单抗b38的轻链恒定区与单抗h4的轻链恒定区具有相同序列。
33.优选地,所述双特异性抗体bs
‑
mab
‑
1,其轻链的氨基酸序列如seq id no.4所示或经一个或多个氨基酸的替换、缺失或插入得到的具有相同功能的蛋白的氨基酸序列,其重链的氨基酸序列如seq id no.2所示或经一个或多个氨基酸的替换、缺失或插入得到的具有相同功能的蛋白的氨基酸序列。
34.本发明采用融合肽的形式表达单链抗体,通过特定的抗体结构和序列设计,发现当单链抗体与单克隆抗体的连接方式不同时,分别采用特定的单链抗体融合肽序列能够更好地提升抗体结构的稳定性以及与靶点的结合。
35.优选地,所述双特异性抗体bs
‑
mab
‑
2中,所述单链抗体的氨基酸序列如seq id no.21所示;进一步优选地,所述双特异性抗体bs
‑
mab
‑
2,其轻链的氨基酸序列如seq id no.8所示或经一个或多个氨基酸的替换、缺失或插入得到的具有相同功能的蛋白的氨基酸序列,其重链的氨基酸序列如seq id no.6所示或经一个或多个氨基酸的替换、缺失或插入得到的具有相同功能的蛋白的氨基酸序列。
36.上述“经一个或多个氨基酸的替换、缺失或插入得到的具有相同功能的蛋白的氨基酸序列”是指在一个或多个氨基酸残基处不同于所示的序列但保留所得到的分子的生物学活性的序列,其可为“保守修饰的变体”或经“保守的氨基酸取代”改造得到的,“保守修饰的变体”或经“保守的氨基酸取代”是指本领域技术人员已知的氨基酸取代,进行这种取代通常不改变所得到的分子的生物学活性。一般而言,本领域技术人员公认在多肽非必需区的单个氨基酸取代基本上不改变生物学活性。示例性取代优选依照以下所示的取代进行:
37.表1例示性保守氨基酸取代表
38.原残基保守取代原残基保守取代原残基保守取代ala(a)gly,serpro(p)alagly(g)alaarg(r)lys,hisser(s)thrhis(h)asn glnasn(n)gln,histhr(t)serile(i)leu,valasp(d)glu,asntrp(w)tyr,phelys(k)arg,hiscys(c)ser,alatyr(y)trp,phemet(m)leu,ile,tyrgln(q)asnval(v)ile,leuphe(f)tyr,met,leuglu(e)asp,gln
ꢀꢀꢀꢀ
39.本发明中,所述双特异性抗体可以为鼠源抗体、人源化抗体、嵌合抗体或重组抗体。
40.所述人或人源化抗体包括igg1抗体、igg2抗体、igg3抗体、igg4抗体中的一种。
41.在第二个方面,在上述双特异性抗体氨基酸序列的基础上,本发明还提供编码所述双特异性抗体的基因。
42.根据密码子编码规则以及密码子的简并性和偏好性,本领域技术人员可以根据上述双特异性抗体的氨基酸序列设计编码基因。
43.作为本发明的一种优选实施方式,所述双特异性抗体轻链的核苷酸序列如seq id no.3所示,重链的核苷酸序列如seq id no.1所示;或
44.所述双特异性抗体轻链的核苷酸序列如seq id no.7所示,重链的核苷酸序列如seq id no.5所示。
45.进一步地,本发明还提供包含所述基因的生物材料。
46.本发明中,所述生物材料包括重组dna、表达盒、载体、宿主细胞、工程菌或细胞系。
47.在第三个方面,本发明还提供所述双特异性抗体的制备方法,包括:分别构建含有所述双特异性抗体bs
‑
mab
‑
1或bs
‑
mab
‑
2重链和轻链基因的重组表达载体;将重组表达载体导入宿主细胞,获得稳定表达所述双特异性抗体的宿主细胞;培养宿主细胞,经分离纯化获得所述双特异性抗体。
48.在制备所述双特异性抗体时,本领域技术人员可根据需要选择本领域常规的宿主细胞、表达载体、将表达载体导入宿主细胞的方法以及抗体的分离纯化方法。
49.在第四个方面,在上述双特异性抗体的基础上,本发明还提供一种药物组合物,其包含本发明所述双特异性抗体。
50.作为优选,所述药物组合物还包括药学领域允许的其它有效成分或辅料。
51.在第五个方面,本发明还提供一种诊断试剂或试剂盒,其包含本发明所述双特异性抗体。优选地,包含bs
‑
mab
‑
1和/或bs
‑
mab
‑
2。
52.在第六个方面,本发明提供所述双特异性抗体或所述双特异性抗体的编码基因或含有所述编码基因的生物材料或所述药物组合物或所述试剂盒的如下任一应用:
53.(1)在制备预防或治疗新型冠状病毒感染所引起疾病的药物中的应用;
54.(2)在制备新型冠状病毒诊断试剂或诊断试剂盒中的应用;
55.(3)在制备新型冠状病毒疫苗中的应用;
56.(4)在预防或治疗sars
‑
cov
‑
2冠状病毒引起疾病中的应用;
57.(5)在检测新型冠状病毒中的应用。
58.进一步地,本发明提供单剂量形式的药物组合物,其中该单剂量形式含有180mg
‑
6000mg的本发明所述的双特异性抗体;优选地,其中该单剂量形式含有180mg
‑
3000mg的本发明所述的双特异性抗体;更优选地,其中该单剂量形式含有500mg
‑
1800mg的本发明所述的双特异性抗体;进一步优选地,其中该单剂量形式含有900mg
‑
1800mg的本发明所述的双特异性抗体;更进一步优选地,其中该单剂量形式含有500mg
‑
1000mg的本发明所述的双特异性抗体。
59.本发明单剂量形式的药物组合物,其中该药物组合物被配制为适合静脉给药的形式。
60.进一步地,本发明提供一种预防或治疗新型冠状病毒感染所引起的疾病的方法,包括向需要的人施用180mg
‑
6000mg本发明的双特异性抗体;优选地,包括向需要的人施用
180mg
‑
3000mg本发明的双特异性抗体;更优选地,包括向需要的人施用500mg
‑
1800mg本发明的双特异性抗体;进一步优选地,包括向需要的人施用900mg
‑
1800mg本发明的双特异性抗体;更进一步优选地,包括向需要的人施用500mg
‑
1000mg本发明的双特异性抗体。
61.本发明提供一种预防或治疗新型冠状病毒感染所引起的疾病的方法,包括向有需要的受体施用本发明的双特异性抗体,每周给药1~2次,连续给药2
‑
4周;优选地,每周给药2次,连续给药4周。
62.进一步地,本发明提供一种诊断新型冠状病毒感染的方法,包括使用本发明的双特异性抗体、药物组合物或制剂与待测样本接触。
63.本发明中,所述新型冠状病毒为sars
‑
cov
‑
2冠状病毒。
64.本发明的有益效果如下:本发明利用基因工程和抗体工程方法构建包含单链抗体和完整单克隆抗体结构的抗新冠病毒双特异性抗体,该双特异性抗体融合蛋白保留了完整的单克隆抗体结构,而且具有高度稳定的对称结构,在进行宿主表达时,不会产生其它结构的蛋白异构体,从而大大降低了提取和纯化工艺的难度,具有制备简单、产量高的优势。本发明的双特异性抗体更好地保留了母源单抗b38与h4的生物学功能,实现了一个双特异性抗体分子同时具有两个单克隆抗体的生物学功能,同时识别新型冠状病毒s蛋白rbd的不同位点,对新冠病毒假病毒的中和活性远高于母源单抗,对新冠病毒活病毒的抑制活性也高于母源单抗,且毒性低、稳定性好。本发明的双特异性抗体提高了母源单抗的选择性和中和活性,改善了单抗药物的安全性和有效性,可作为制备诊断、预防、治疗新型冠状病毒引起疾病的潜在候选药物,市场价值巨大,应用前景良好。
附图说明
65.图1为本发明双特异抗体bs
‑
mab
‑
1(a)和bs
‑
mab
‑
2(b)的结构示意图。
66.图2为双特异性抗体bs
‑
mab
‑
1(a)和bs
‑
mab
‑
2(b)的分子筛层析结果与sds
‑
page检测结果图。其中,凝胶图上的
“‑”
表示没有添加dtt(非还原性sds
‑
page);“ ”表示添加了dtt(还原性sds
‑
page)。
67.图3为bs
‑
mab
‑
1(a)和bs
‑
mab
‑
2(b)与rbd结合的双位点结合特性检测示意图。其中,a图中,h4
‑
bs
‑
mab
‑
1表示先用过量的h4抗体饱和结合固定有rbd的探针,之后进行bs
‑
mab
‑
1抗体的结合,与h4
‑
h4结合曲线相比较,在加入bs
‑
mab
‑
1抗体后曲线有显著上升,表明其能够结合h4饱和的rbd。h4
‑
h4表示为第一阶段先流过h4抗体后,在第二阶段再次流过h4抗体;h4
‑
bs
‑
mab
‑
1表示为第一阶段先流过h4抗体后,在第二阶段后流过bs
‑
mab
‑
1抗体;b38
‑
bs
‑
mab
‑
1表示为第一阶段流过b38抗体后,在第二阶段后流过bs
‑
mab
‑
1抗体。b图中,图注解读参考a图。
68.图4为h4、b38、bs
‑
mab
‑
1及bs
‑
mab
‑
2抗体结合rbd蛋白的动力学曲线结果图。
69.图5为不同浓度的h4、b38、bs
‑
mab
‑
1及bs
‑
mab
‑
2抗体抗2019
‑
ncov假病毒的中和活性结果图。
70.图6为不同浓度的bs
‑
mab
‑
1及bs
‑
mab
‑
2抗体抗2019
‑
ncov活病毒的中和活性结果图。
71.图7为双抗1#、6#和12#抗体的sds
‑
page检测结果图。
72.图8为不同浓度的1#、6#和12#抗体抗2019
‑
ncov活病毒的中和活性结果图。
73.图9为实施例10的恒河猴咽拭子病毒载量检测结果示意图。
74.图10为实施例10的恒河猴鼻拭子病毒载量检测结果示意图。
75.图11为实施例10的恒河猴肛拭子病毒载量检测结果示意图。
具体实施方式
76.下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
77.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
78.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
79.实施例1双特异性抗体构建
80.双特异性抗体的构建中,两个抗体的可变区排布会对其与抗原的结合能力产生影响,而不同的构建可能导致抗病毒活性的差异。因此基于两个不同位点的抗体构建的双特异性抗体其双位点结合活性是否得以保留,以及抗病毒活性是否能够提高,仍存在较大不确定性。双特异性抗体为不同结构的抗体之间形成的融合蛋白,不同结构的抗体分别结合两种细胞的不同抗原或同一抗原的不同位点,发挥各自不同的功能。为使得双特异性抗体中各抗体充分发挥其各自的功能,本实施例在抗体设计时,设计了大量备选的双特异性抗体,以期尽量减少各抗体在序列和结构上相互影响对各自功能发挥造成的不利影响。
81.1.bs
‑
mab
‑
1构建
82.在bs
‑
mab
‑
1构建中,将b38和h4的v区以gs柔性铰链区为连接进行串联构建(图1a),由于抗原结合位点其相对距离最短,推测可能对于临近表位的结合具有一定优势,其构建特征为:
83.轻链序列为:(vl
‑
h4)
‑
(ggggs)2‑
(vl
‑
b38)
‑
cl;
84.重链序列为:(vh
‑
h4)
‑
(ggggs)2‑
(vh
‑
b38)
‑
ch1
‑
ch2
‑
ch3。
85.将轻链和重链dna序列(分别如seq id no:3和seq id no:1所示)分别克隆至表达载体pcaggs(购自addgene)中,从而得到分别编码抗体重链和轻链的重组表达载体。表达重链和轻链的构建体的构建方案如下:
86.重链编码序列(5
’‑3’
):cmv启动子
‑
ecor i酶切位点
‑
前导序列基因(序列为seq id no.22)(vh
‑
h4)
‑
(ggggs)2‑
(vh
‑
b38)
‑
ch1
‑
ch2
‑
ch3基因
‑
xho i酶切位点;
87.轻链(κ)编码序列(5
’‑3’
):cmv启动子
‑
sac i酶切位点
‑
前导序列基因(序列为seq id no.23)
‑
(vl
‑
h4)
‑
(ggggs)2‑
(vl
‑
b38)
‑
cl基因
‑
xho i酶切位点;
88.2.bs
‑
mab
‑
2构建
89.在bs
‑
mab
‑
2构建中,将h4抗体的vl和vh区以gs柔性铰链区进行连接,构建单链抗体(scfv),之后将h4
‑
scfv构建到b38抗体的重链c端,形成b38加h4
‑
scfv的双特异性抗体构建(图1b),其构建结构为:
90.轻链序列为:(vl
‑
b38)
‑
cl
91.重链序列为:(vh
‑
b38)
‑
ch1
‑
ch2
‑
ch3
‑
gggs
‑
(vh
‑
h4)
‑
(ggggs)4‑
(vl
‑
h4)
92.将轻链和重链dna序列(分别如seq id no:7和seq id no:5所示)分别克隆至表达载体pcaggs(购自addgene)中,从而得到分别编码抗体重链和轻链的重组表达载体。表达重
链和轻链的构建体的构建方案如下:
93.重链编码序列(5
’‑3’
):cmv启动子
‑
ecor i酶切位点
‑
前导序列基因(序列为seq id no.24)
‑
(vh
‑
b38)
‑
ch1
‑
ch2
‑
ch3
‑
gggs
‑
(vh
‑
h4)
‑
(ggggs)4‑
(vl
‑
h4)基因
‑
xho i酶切位点;
94.轻链(κ)编码序列(5
’‑3’
):cmv启动子
‑
sac i酶切位点
‑
前导序列基因(序列为seq id no.25)
‑
(vl
‑
b38)
‑
cl基因
‑
xho i酶切位点。
95.实施例2双特性抗体重组表达构建及蛋白表达纯化
96.在本实施例中,以h4和b38两种新冠病毒s抗原特异性抗体为基础,构建了两种不同的双特异性抗体,bs
‑
mab
‑
1和bs
‑
mab
‑
2,其重链氨基酸序列如seq id no.2和seq id no.6所示,其轻链氨基酸序列分别如seq id no.4和seq id no.8所示。
97.在含10%fbs的dmem中培养hek293t细胞(atcc crl
‑
3216)。用上述bs
‑
mab
‑
1和bs
‑
mab
‑
2双特性分别编码抗体重链和轻链的重组表达载体共转染hek 293t细胞。转染4
‑
6小时后,将细胞培养液更换成无血清的dmem,并且继续培养3天。收集上清,然后补加dmem,继续培养4天,然后再次收集上清。
98.将收集的上清以5000rpm离心30min,然后与含有20mm磷酸钠(ph 7.0)的缓冲液等体积混合,随后用0.22μm滤膜进行过滤,然后装载至与protein a预装柱(5ml,ge healthcare)。以10mm甘氨酸(ph 3.0)洗脱结合至预装柱的蛋白。将洗脱级分浓缩,然后通过分子筛层析法进行纯化。随后,通过sds
‑
page(还原性和非还原性)检测所纯化的目的蛋白。结果如图2所示。图2的结果显示,经纯化获得了经纯化的bs
‑
mab
‑
1和bs
‑
mab
‑
2抗体,在非还原条件sds
‑
page中抗体呈现单一条带,在还原条件下sds
‑
page中抗体的fc区二硫键被打开,从而显示为两个条带,且抗体纯度超过95%。
99.实施例3 bs
‑
mab
‑
1和bs
‑
mab
‑
2抗体与s蛋白rbd的双位点结合能力的评估
100.在本实施例中,利用fortebio octet red 96生物膜层表面干涉技术对所纯化抗体与s蛋白rbd进行结合分析,同时评价bs
‑
mab
‑
1和bs
‑
mab
‑
2抗体是否具有双位点结合能力。
101.将带有组氨酸标签的s蛋白rbd(science.2020jun 12;368(6496):1274
‑
1278)固定在探针(fortebio公司)上。为评价bs
‑
mab
‑
1抗体的双位点结合能力,首先将固定rbd蛋白的探针与h4抗体(science.2020jun 12;368(6496):1274
‑
1278)结合,并使之达到饱和。之后将bs
‑
mab
‑
1与等浓度的h4抗体混合物流经h4抗体饱和结合的探针。结果表明,与h4
‑
h4抗体与rbd的结合水平相比,h4抗体饱和结合的rbd仍能够结合bs
‑
mab
‑
1,表明其包含的与h4抗体非竞争性的bs38抗体发挥了结合作用(图3的a)。同样的,将固定rbd蛋白的探针首先与b38抗体结合,并使之达到饱和。之后将bs
‑
mab
‑
1与等浓度的b38抗体(science.2020jun 12;368(6496):1274
‑
1278)混合物流经b38抗体饱和结合的探针。结果表明,与b38
‑
b38抗体与rbd的结合水平相比,b38抗体饱和结合的rbd仍能够结合bs
‑
mab
‑
1,表明其包含的与b38抗体非竞争性的h4抗体发挥了结合作用(图3的a)。bs
‑
mab
‑
2抗体的双位点结合能力通过上述类似的实验进行了检测,结果表明,bs
‑
mab
‑
2抗体也具有双位点结合能力,表明其所包含的h4和b38抗体的scfv均发挥了抗原结合能力(图3的b)。
102.实施例4 bs
‑
mab
‑
1和bs
‑
mab
‑
2抗体与rbd结合能力的评估
103.首先,将抗人igg的抗体(购自ge healthcare公司)以氨基偶联的方式固定在cm5
芯片的通道(flow cell,fc)。固定量控制在8,000响应值(response units,ru)左右。然后,以抗体捕获的方式,分别结合纯化的b38、h4、bs
‑
mab
‑
1或bs
‑
mab
‑
2抗体。另外,以20mm hepes,150mm nacl,ph 7.4溶液连续倍比稀释rbd蛋白。然后,将连续稀释的rbd蛋白(6.25nm
–
100nm)依次通过各通道(从低浓度开始逐一上样)。记录各抗体结合rbd蛋白的动力学曲线,并利用biaevaluation software 8k(biacore,inc.)软件计算动力学常数(图4)。
104.图4的结果显示,h4抗体和b38抗体与rbd的亲和力分别为8.25nm和22.5nm,而双特异性抗体bs
‑
mab
‑
1和bs
‑
mab
‑
2与rbd的亲和力分别为4.14nm和21.7nm。这表明双特异性抗体与rbd的亲和力与b38和h4抗体维持在同一水平。
105.实施例5 bs
‑
mab
‑
1和bs
‑
mab
‑
2抗体中和2019
‑
ncov假病毒能力的评估
106.将hace2全长基因(unipro:q9byf1)构建到pcdna4.0表达质粒(购自invitrogen),顺转至hela细胞,并在2μg/ml嘌呤霉素(购自gibco公司)的选择压力下培养,并单细胞分选为单克隆细胞,制备稳定表达hace2基因的hela稳转细胞系(hela
‑
hace2)备用。
107.将纯化的b38、h4、bs
‑
mab
‑
1或bs
‑
mab
‑
2抗体从200μg/ml开始倍比稀释至第10个梯度,然后分别与表达新冠病毒s抗原的假病毒(野生型vsv
‑
sars
‑
cov
‑
2假毒)(获自中国食品药品检定研究院)在37℃混合孵育2小时。孵育后,将病毒加入到预先接种了表达人ace2的hela稳转细胞系(hela
‑
hace2)的96孔板中,并于37℃,5%co2培养箱中培养24小时,通过检测假病毒感染后所激活的荧光素酶底物反应水平,计算b38、h4、bs
‑
mab
‑
1或bs
‑
mab
‑
2抗体的中和滴度。结果如图5所示。图5显示了不同浓度的b38、h4、bs
‑
mab
‑
1或bs
‑
mab
‑
2抗体抗2019
‑
ncov假病毒的中和活性。结果显示,bs
‑
mab
‑
1抗体对2019
‑
ncov假病毒的中和滴度(半数中和浓度,nc
50
)为0.119μg/ml,相对于h4(nc
50
=0.718μg/ml)和b38(nc
50
=0.681μg/ml)抗体提高了6
‑
7倍。bs
‑
mab
‑
2抗体对2019
‑
ncov假病毒的中和滴度为0.048μg/ml,相对于h4和b38抗体提高了14
‑
15倍。因此,双特异性抗体bs
‑
mab
‑
1和bs
‑
mab
‑
2构建相对于h4和b38单克隆抗体具有更高的中和活性。
108.实施例6 bs
‑
mab
‑
1和bs
‑
mab
‑
2抗体中和2019
‑
ncov活病毒能力的评估
109.将实施例1纯化的bs
‑
mab
‑
1和bs
‑
mab
‑
2抗体从100μg/ml开始倍比稀释至第10个梯度,然后分别与半数组织培养感染剂量(tcid
50
)的betacov/shenzhen/szth
‑
003/2020病毒(gisaid号:epi_isl_406594)在37摄氏度混合孵育2小时。孵育后,将病毒加入到预先接种了vero细胞的96孔板中,并于37摄氏度,5%co2培养箱中培养4天,观察致细胞病变效应(cpe),并计算bs
‑
mab
‑
1和bs
‑
mab
‑
2抗体的中和滴度。结果如图6所示。图6显示了不同浓度的bs
‑
mab
‑
1和bs
‑
mab
‑
2抗体抗2019
‑
ncov活病毒的中和活性。结果显示,bs
‑
mab
‑
1抗体对2019
‑
ncov活病毒的中和滴度(半抑制浓度,ic50)为1.725μg/ml,bs
‑
mab
‑
2抗体对2019
‑
ncov活病毒的中和滴度(半抑制浓度,ic50)为0.656μg/ml,具有良好的中和活性。
110.实施例7其它双抗构建及验证
111.为证明双特异性抗体的可变区排布或者连接两个单抗部分的连接肽会对其与抗原的结合能力产生影响,申请人基于单抗b38和h4,还构建了其它的双特异性抗体进行验证。其它双特异性抗体为:1#、6#和12#,结构分别为:
112.1#:
113.轻链:(vl
‑
b38)
‑
gqpkaap
‑
(vl
‑
h4)
‑
(tkqps)
‑
cl,氨基酸序列如seq id no.26所
示;
114.重链:(vh
‑
h4)
‑
s
‑
(vh
‑
b38)
‑
rt
‑
ch1
‑
ch2
‑
ch3,氨基酸序列如seq id no.27所示;
115.6#:
116.轻链:(vl
‑
b38)
‑
(g)
10
‑
(vl
‑
h4)
‑
cl,氨基酸序列如seq id no.28所示;
117.重链:(vh
‑
h4)
‑
(g)7‑
(vh
‑
b38)
‑
s
‑
ch1
‑
ch2
‑
ch3,氨基酸序列如seq id no.29所示;
118.12#:
119.轻链序列为:(vl
‑
h4)
‑
(g)
10
‑
(vl
‑
b38)
‑
cl,氨基酸序列如seq id no.30所示;
120.重链序列为:(vh
‑
b38)
‑
(g)7‑
(vh
‑
h4)
‑
s
‑
ch1
‑
ch2
‑
ch3,氨基酸序列如seq id no.31所示。
121.(一)抗体构建
122.根据实施例1中bs
‑
mab
‑
1的构建方式制备这3种抗体,并根据实施例2的描述纯化抗体以及检验纯度。
123.图7的结果显示,获得了经纯化的1#、6#和12#抗体,在还原条件下sds
‑
page中抗体的fc区二硫键被打开,从而显示为两个条带,且抗体纯度超过95%。
124.(二)中和2019
‑
ncov活病毒能力评估
125.将上述纯化的1#、6#和12#抗体从100μg/ml开始倍比稀释至第10个梯度,然后分别与半数组织培养感染剂量(tcid
50
)的betacov/shenzhen/szth
‑
003/2020病毒(gisaid号:epi_isl_406594)在37摄氏度混合孵育2小时。孵育后,将病毒加入到预先接种了vero细胞的96孔板中,并于37摄氏度,5%co2培养箱中培养4天,观察致细胞病变效应(cpe),并计算1#、6#和12#抗体的中和滴度。结果如图8所示,显示了不同浓度的1#、6#和12#抗体抗2019
‑
ncov活病毒的中和活性。结果显示,1#抗体对2019
‑
ncov活病毒的中和滴度(半抑制浓度,ic50)为5004μg/ml,6#抗体对2019
‑
ncov活病毒的中和滴度(半抑制浓度,ic50)为54304μg/ml,12#抗体对2019
‑
ncov活病毒的中和滴度(半抑制浓度,ic50)为102.6μg/ml。
126.实施例8:双特异性抗体针对新冠病毒野生株/变异株假病毒体外中和活性实验
127.本实验验证实施例2构建的bs
‑
mab
‑
2抗体对40株新冠状病毒假病毒株的中和活性情况。
128.1)材料
129.huh7细胞(jcrb,cat#0403)、中检院sars
‑
cov
‑
2假病毒共31株、dmem高糖培养基、萤火虫荧光素酶检测试剂、无菌pbs(ph7.2)、胎牛血清、1%(m/v)双抗(青霉素/链霉素抗生素)、0.25%(m/v)胰酶
‑
edta。
130.31株中国食品药品研究院构建的新型冠状病毒假病毒具体如下表2所示。
131.表2:31株假病毒
132.133.[0134][0135]
2)稀释法:原液(30.7g/l)稀释30倍;继而如下表3所示,取96孔板,于第2列(cc:细胞对照,仅加细胞和培养基,见表3)加入dmem完全培养基(1%双抗,25mm hepes,10%fbs)150μl/孔,于第3列、第6列、第9列(第3列、第6列、第9列依次为假病毒对照vc1、vc2、vc3,下一96孔板编号以此类推;vc:假病毒对照,仅加入假病毒、细胞和培养基)加入dmem完全培养基100μl/孔,于c4
‑
g5、c7
‑
g8、c10
‑
g11孔中加入dmem完全培养基100μl/孔,于b4
‑
b5、b7
‑
b8、b10
‑
b11孔加入dmem完全培养基142.5μl/孔。
[0136]
加样:于b4
‑
b5、b7
‑
b8、b10
‑
b11孔加入待检抗体:7.5μl/孔(工作液30倍初始稀释)
……
以此类推。
[0137]
3)样品稀释:将多道移液器调至50μl,对b4
‑
b5、b7
‑
b8、b10
‑
b11孔中液体轻柔的反复吹吸6~8次充分混匀,然后转移50μl液体至对应的c4
‑
c5、c7
‑
c8、c10
‑
c11孔,轻柔的反复吹吸6~8次后转移至d4
‑
d5、d7
‑
d8、d10
‑
d11孔,以此类推,最后从g4
‑
g5、g7
‑
g8、g10
‑
g11中吸弃50μl液体,96孔细胞培养板加样位置参照表3。加样完成后将样品放回。
[0138]
4)用dmem完全培养基将各株假病毒稀释至1.3
×
104(1
×
104~2
×
104)tcid
50
/ml(按提供的稀释倍数稀释),于第3~5列加入假病毒1、第6~8列加入假病毒2、第9~11列加入假病毒3,以此类推,每孔加50μl,使假病毒的量为650(500
‑
1000)/孔。加完病毒后,将上述96孔板置于细胞培养箱中(37℃,5%co2)孵育1小时。
[0139]
表3:96孔板加样位置表
[0140][0141]
当孵育时间至半小时,取出培养箱中事先准备好的细胞(汇合率达80%~90%),吸弃瓶中的培养基,加入5ml pbs缓冲液清洗细胞,倾去pbs后,加入3ml 0.25%胰酶
‑
edta,使其浸没细胞消化1分钟,倾去胰酶,置于细胞培养箱中消化5分钟,轻轻拍打培养瓶侧壁使细胞脱落,加入10ml培养基中和胰酶,吹打几次后,细胞计数,用dmem完全培养基将细胞稀释至2
×
105个/ml。孵育至1小时,向96孔板中每孔加100μl细胞,使每孔细胞为2
×
104个。将96孔板前后左右轻轻晃动,使细胞在孔中分散均匀,将96孔板放入细胞培养箱中,37℃,5%co2培养20~28小时。从细胞培养箱中取出96孔板,用多道移液器从每个上样孔中吸弃150μl上清,然后加入100μl荧光素酶检测试剂,室温避光反应2min。反应结束后,用多道移液器将反应孔中的液体反复吹吸6~8次,使细胞充分裂解,从每孔中吸出150μl液体,加于对应
96孔化学发光检测板中,置于多功能微孔板检测仪中读取发光值。
[0142]
5)计算中和抑制率:抑制率=[1-(样品组的发光强度均值-空白对照cc均值)/(阴性组的发光强度均值-空白对照值cc均值)]
×
100%。根据中和抑制率结果,采用reed
‑
muench法计算ic
50
值。其中,阴性组为不含抗新冠病毒抗体的正常人血清 假病毒 细胞 培养基。
[0143]
重复试验:每个变异株检测按上述方法再重复两次,三次测定的抗体与假病毒变异株的ic
50
均值为抗体针对某个变异株的最终ic
50
值。
[0144]
6)结果
[0145]
将抗体浓度稀释至100μg/ml进行检测,检测结果见表4。
[0146]
表4:本发明抗体对不同病毒株的中和活性检测结果
[0147]
[0148][0149]
由此可见,本发明的抗体能够不同程度地体外中和抑制多种变异的假病毒毒株,说明本发明抗体针对新冠病毒及其多种变异株都有效果,使用范围广。其中,首次发现于印度的b.1.617
‑
1毒株即为德尔塔毒株,其是目前已知最具传染性呼吸道病毒之一,并且在世界各地迅速传播,本发明的抗体对其中和活性极高。
[0150]
实施例9:双特异性抗体的毒性实验
[0151]
(一)重复给药实验
[0152]
本实验评价bs
‑
mab
‑
2抗体重复静脉输注给予食蟹猴,每周给药2次,连续给药4周后可能出现的毒性反应、毒性靶器官、毒代动力学特性及免疫原性,以及末次药后4周毒性反应恢复情况或可能出现的延迟毒性反应。
[0153]
实验动物以及分组:共使用40只食蟹猴(20只/性别)(来源:广西雄森灵长类实验动物养殖开发有限公司;实验动物生产许可证号:scxk(桂)2016
‑
0003;实验动物质量合格证编号:0002914、0002923、0002931;生产许可证签发单位:广西壮族自治区科学技术厅;年龄:2.8
‑
4岁),随机分为4个组(5只/性别/组),第1组动物给予氯化钠注射液作为阴性对照品(0mg/kg),第2、3、4组动物分别给予25、50和150mg/kg的bs
‑
mab
‑
2抗体,为供试品低、中和高剂量组。每周给药2次,连续给药4周,共给药9次(d1、d5、d8、d12、d15、d19、d22、d26和
d29)。使用输注泵于食蟹猴后肢皮下静脉输注给药,给药容量为10ml/kg,给药速度约为0.5ml/kg/min。雄性和雌性首次给药当天分别定义为该性别动物的试验d1。
[0154]
检测指标:实验期间,对动物进行了临床观察,定期监测动物的体重、食量、体温、心电图(马甲遥测)、呼吸功能(马甲遥测)、心电图(肢体导联ii ecg)、血压、眼科检查、血细胞计数、凝血功能、血液生化和尿液分析。d1和d26给药前和给药后,以及d15、d19和d22药前进行血药浓度检测和毒代动力学分析。为评价免疫反应,周期性的检测淋巴细胞亚群(cd3
、cd3
cd4
、cd3
cd8
、cd20
、cd3
cd4
/cd3
cd8
)、细胞因子(tnf
‑
α、ifn
‑
γ、il
‑
2、il
‑
4、il
‑
5、il
‑
6)、免疫球蛋白(igg、igm、iga)、补体(c3、c4)和bs
‑
mab
‑
2抗体。给药期结束后,第1
‑
4组前3只/性别/组动物于4周药后(d30)按计划实施安乐死,第1
‑
4组剩余的2只/性别/组动物于4周恢复期结束(d57)按计划实施安乐死。第1
‑
4组动物进行系统解剖,对脏器重量、大体解剖及组织病理学等进行检查。
[0155]
结果:
[0156]
1)实验期间,1
‑
4组所有动物未见死亡或濒死情况。供试品25、50和150mg/kg剂量组动物的临床观察均未见与供试品相关的异常改变。
[0157]
2)实验期间,供试品25、50和150mg/kg剂量组动物的体重及体重增长、食量、体温、心电指标(马甲遥测)、呼吸功能(马甲遥测)、心电图(肢体导联ii ecg)、血压、眼科检查、血细胞计数、凝血功能、血液生化、尿液分析、淋巴细胞亚群、细胞因子、免疫球蛋白和补体均未见与供试品相关或具有毒理学意义的改变。
[0158]
3)bs
‑
mab
‑
2抗体以25、50和150mg/kg的剂量重复静脉输注给予食蟹猴后,50和150mg/kg剂量组各1只动物给药后第29天产生了抗药抗体(ada),ada滴度分别为1:160和1:1280,供试品组样品总阳性率为1.4%,个体总阳性率为6.7%。抗体产生的时间、发生率及滴度未见明显性别差异及给药剂量相关性;表明食蟹猴对bs
‑
mab
‑
2抗体的免疫原性较弱。
[0159]
4)供试品重复静脉输注给予食蟹猴后,各供试品组动物毒代动力学参数结果如表5所示:
[0160]
表5:抗体bs
‑
mab
‑
2的动物毒代动力学参数结果:
[0161]
[0162][0163]
备注:n为动物数;蓄积因子af=auc
last,8th
/auc
last,1st
[0164]
供试品重复静脉输注给予食蟹猴后,仅低剂量组d26的c
max
和auc
last
出现雌雄差异(p<0.05,但相差不大,雌/雄比值分别为1.24和1.37),其余各组雌雄动物的药代动力学参数均无统计学差异(p>0.05),表明各组动物不同性别间参数基本一致。第8次(d26)给药后,供试品组雌、雄动物蓄积因子(af=auc
last,8th
/auc
last,1st
)介于1.69
‑
2.28,均未见明显的药物蓄积。
[0165]
5)供试品bs
‑
mab
‑
2抗体在25~150mg/kg的剂量范围内重复静脉输注给予食蟹猴,各组不同性别动物间血清药物浓度时间变化趋势基本一致,血清药物峰浓度及血清药物暴露量均与给药剂量正相关。
[0166]
6)给药结束安乐死(d30)和观察期结束(d57)安乐死,供试品25、50和150mg/kg剂量组动物的脏器重量、大体解剖检查和组织病理学检查均未见与供试品相关的病理改变。
[0167]
7)供试品25、50和150mg/kg剂量组动物的给药局部(即注射局部)的肉眼观察、大体解剖检查和组织病理学检查均未见与供试品相关异常改变。
[0168]
结论:综上所述,在本实验条件下,bs
‑
mab
‑
2抗体以25、50和150mg/kg的剂量重复静脉输注给予食蟹猴,每周给药2次,连续给药4周(共9次给药),恢复期4周。各剂量组动物均未见全身毒性反应和毒性靶器官。本实验未观察到临床不良反应的剂量水平(noael)为150mg/kg。该剂量下第8次(d26)药后雄性动物的c
max
和auc
last
分别为4460ng/ml和234h
·
mg/ml,雌性动物的c
max
和auc
last
分别为4480ng/ml和218h
·
mg/ml。
[0169]
(二)单次给药实验
[0170]
本实验评价单次静脉输注bs
‑
mab
‑
2抗体后,食蟹猴可能出现的毒性反应、毒性靶器官和在体内的代谢特征,以及观察给药期结束后14天毒性反应情况。
[0171]
6只食蟹猴,随机分为3组(1只/性别/组),第1组为阴性对照组(氯化钠注射液,0mg/kg),第2
‑
3组分别给予50和300mg/kg的bs
‑
mab
‑
2抗体。动物于第1天(d1)单次给药,使用注射泵于动物后肢皮下静脉输注给药,给药容量为12ml/kg,给药速度约为0.5ml/kg/min。实验期间,给药后连续观察约4小时,并定期对动物的临床观察、体重、体温、心电图、血细胞计数、凝血功能、血液生化、t淋巴细胞亚群、细胞因子和毒代动力学指标进行检查。
[0172]
实验期间,各组动物均未见死亡或濒死现象。bs
‑
mab
‑
2抗体的50mg/kg剂量组和300mg/kg剂量组均未见供试品相关的临床异常现象,体重、体重增长、体温、心电图指标、血细胞计数、凝血功能、血液生化、t淋巴细胞亚群也均未见供试品相关的异常改变。观察期结束后(d15),bs
‑
mab
‑
2抗体50和300mg/kg剂量组动物的大体观察未见异常,未进行组织病理学检查。毒代试验结果显示,各组不同性别动物间血清药物浓度变化趋势基本一致,血清药物浓度与给药剂量正相关。
[0173]
综上所述,在本实验条件下,bs
‑
mab
‑
2抗体以50和300mg/kg剂量单次静脉输注给予食蟹猴后未见明确与bs
‑
mab
‑
2抗体相关的毒性反应,无可见有害作用水平(noel)为300mg/kg。
[0174]
实施例10:抗体治疗性实验
[0175]
本实施例以sars
‑
cov
‑
2病毒感染恒河猴模型,对bs
‑
mab
‑
2抗体在恒河猴内治疗效果进行评价。
[0176]
1)实验材料:
[0177]
(1)sars
‑
cov
‑
2毒株:来源于云南省昆明市covid
‑
19患者痰液临床样本(经云南省卫生健康委协调批准转移),该株病毒由中国医学科学院医学生物学研究所于bsl
‑
3实验室(实验室已通过国家cnas认可,并经国家卫生健康委批准可从事sars
‑
cov
‑
2研究)分离,经vero细胞适应后,完成毒种鉴定、测序和保存(sars
‑
cov
‑2‑
kms1/2020/genbank accession number:mt226610.1)。
[0178]
(2)细胞:非洲绿猴肾细胞系(vero)购自atcc(manassas,va,usa),使用含100u/ml青霉素、100μg/ml链霉素、10%新生牛血清的mem培养基于5%co2,37℃条件下培养。
[0179]
(3)实验动物:恒河猴,1.5
‑
1.7岁,体重1.5
‑
2.5kg,16只,雄性,由中国医学科学院医学生物学研究所灵长类实验动物中心提供(实验动物生产许可证号:scxk(滇)k2020
‑
0005)。所有实验动物的使用均根据云南省及本所实验动物管理委员会相关规定,并经中国医学科学院医学生物学研究所实验动物伦理委员会批准(批准号dwsp 202104010)。所有动物实验均在已通过中国合格评定国家认可委员会(china national accreditation service for conformity assessment,cnas)认证的生物安全防护三级实验室(absl
‑
3)条件下进行,从事sars
‑
cov
‑
2病毒的实验工作已得到国家卫生健康委的批准。
[0180]
2)病毒滴度检测
[0181]
半数细胞培养感染剂量法(50%cell culture infections does,ccid50):于测定前一天将vero细胞以1
×
104~5
×
104个细胞/孔的浓度加入96孔细胞培养板中,培养液为含10%新生牛血清的mem完全培养液,体积共100μl,次日将原培养液倒出,200μl pbs洗细胞一次,以去除剩余血清及死细胞。实验前,每孔加入含3%新生牛血清的mem完全培养液100μl,37℃培养细胞备用。同时,将待测病毒液从
‑
80℃取出,常温或37℃融化后旋涡混匀,利用不含血清的mem培养液将病毒液进行10倍稀释(10
‑1、10
‑2、10
‑3、
…
、10
‑8)。稀释病毒时吸
取病毒液的移液器枪头悬空将病毒液打入稀释液中(勿将枪头伸入稀释液中),充分漩涡混匀后,继续下一步稀释,每稀释一步更换移液器枪头一次。后将稀释好的病毒液依次加入96孔板的vero细胞中,每个稀释度8个平行孔,并设置病毒原液阳性对照孔及mem培养液的阴性对照孔。后将细胞置于37℃,5%co2环境中培养,培养至第6
‑
7天观察细胞病变(cytopathic effect,cpe)。结果利用karber法计算:lgccid50=(lg最低稀释倍数)
‑
(稀释组距)
×
(阳性病变孔比率总和
‑
0.5)ccid50=10lgccid50/0.1ml。
[0182]
3)sars
‑
cov
‑
2荧光pcr鉴定
[0183]
引物、探针与试剂:所有引物均为华大基因公司合成,经双蒸水溶解为10μmol/μl的工作液浓度后,于
‑
20℃保存备用。
[0184]
表6:sars
‑
cov
‑
2荧光pcr鉴定引物序列
[0185][0186]
4)实验设计
[0187]
实验用猴经常规检疫后,sars
‑
cov
‑
2抗体检测阴性入选本实验。设置对照组、低剂量组、高剂量组和预防给药组,每组4只。
[0188]
实验方案:
[0189]
(1)攻毒:各实验组攻毒剂量为5.0logccid50/只,100μl滴鼻感染;
[0190]
(2)分组:
[0191]
预防组:在攻毒前12小时注射抗体,50mg/kg体重,静脉注射;
[0192]
低剂量组:攻毒后12小时第一次注射抗体,25mg/kg体重,静脉注射;在第一次注射抗体后的72小时,进行第二次注射抗体,剂量同第一次。
[0193]
高剂量组:攻毒后12小时第一次注射抗体,50mg/kg体重,静脉注射;在第一次注射抗体后的72小时,进行第二次注射抗体,剂量同第一次。
[0194]
空白对照组:不做任何处理。
[0195]
(3)观察动物临床表现,测量体温、体重、每天采集鼻拭、咽拭、肛拭样品进行病毒qpcr检测,第1、3、5、7天进行鼻拭、咽拭、肛拭样品病毒qpcr、亚基因组rna和ccid50检测;第7天麻醉后处死实验动物,采集主要组织进行病理、病毒载量检测分析。
[0196]
检测内容:
[0197]
(1)感染后排毒及组织内病毒载量分析
[0198]
咽拭子、鼻拭子、肛拭子、组织提取样本rna后进行q
‑
pcr,利用标准曲线和ct值进行样本病毒载量计算。
[0199]
(2)组织病理学检查
[0200]
动物组织样本使用4%的甲醛溶液固定,石蜡包埋。
[0201]
(3)统计分析
[0202]
数据统计采用graphad prism8.0软件,结果以mean,或mean
±
sd表示(中和抗体以
gmt或gmt
±
sd)表示。
[0203]
5)实验结果:
[0204]
5.1)临床表现:
[0205]
(1)所有实验猴在1
‑
7天未出现精神、饮食明显变化;未出现动物死亡;对照组有1只实验猴从第2天起出现轻微腹泻情况,饮食未见明显变化。
[0206]
(2)体温:除对照组和预防组实验猴体温出现较为明显降低趋势外,所有实验猴在1
‑
7天未出现明显体温升高和降低的情况,所有实验猴的体温均处于正常参考范围值内。
[0207]
(3)体重:所有实验猴在1
‑
7天体重未见明显增加和减低情况。
[0208]
5.2)病毒检测
[0209]
攻毒试验使用病毒剂量为5.0log ccid50/只,以100μl滴鼻感染。第1
‑
7天采集咽、鼻、肛拭子,检测病毒拷贝数。咽拭子、鼻拭子和肛拭子病毒载量结果分别如下所示。(1)咽拭子结果
[0210]
对照组咽部从第3天起出现排毒,在4
‑
5天出现明显排毒情况,其中第4天最高,达4.98log(拷贝/100μl),第6天起未检测到;而预防组和bs
‑
mab
‑
2抗体治疗组除个别猴子在特定天数内检测到病毒载量外,其余实验猴在1
‑
7天检测均值处于检测阈值以下,详见图9所示。
[0211]
(2)鼻拭子结果
[0212]
鼻拭子病毒检测检测结果显示,对照组从第1天起持续到第7天均出现排毒情况,在4
‑
5天出现明显排毒高峰,其中第4天最高达5.52log(拷贝/100μl),而预防组、bs
‑
mab
‑
2抗体低剂量组和bs
‑
mab
‑
2抗体高剂量组均在在第1天出现排毒高峰分别为4.32log(拷贝/100μl)、5.07log(拷贝/100μl)和4.89log(拷贝/100μl),其中预防组和bs
‑
mab
‑
2抗体低剂量组第4
‑
7天与对照组比较,病毒载量下降大于2个log值;高剂量组与对照组比较,在第6
‑
7天病毒载量下降大于2个log值,详见图10所示。
[0213]
(3)肛拭子结果
[0214]
所有实验猴在第1
‑
7天均未检测到粪样排毒情况,详见图11所示。
[0215]
5.3)大体检测
[0216]
(1)大体结果
[0217]
大体病理观察结果显示,抗体预防组和高低剂量组实验猴肺脏体积大小基本正常,除肺脏颜色呈现不同程度灰红交错变化,肺脏表面散在出血点外,未出现严重的肺部出血或结节情况。
[0218]
(2)组织病毒载量结果
[0219]
组织病毒载量检测结果显示,预防组所有实验猴的鼻粘膜、气管和肺组织病毒载量检测值均低于检测阈值,颈部淋巴结、肺淋巴结中均未检测到病毒载量。bs
‑
mab
‑
2抗体低剂量组和高剂量组中除个别猴子肺、肺淋、颈淋、气管、和鼻粘膜组织中检测到少量病毒核酸外,其余组织中均未检测出sars
‑
cov
‑
2病毒。
[0220]
以上实验结果说明,恒河猴经预防性和治疗性给予bs
‑
mab
‑
2抗体后进行sars
‑
cov
‑
2病毒攻击,低剂量组、高剂量组和预防组的实验猴在早期和中期的病毒增殖与排毒情况能够得到一定程度抑制。
[0221]
根据以上实验可知,对恒河猴以剂量5.0log ccid50/只,100μl滴鼻感染,病毒感
染后12小时单次给药注射bs
‑
mab
‑
2 25mg/kg,与对照组相比有显著的降低鼻、咽拭子病毒基因拷贝及病毒感染能力的作用,则恒河猴起效剂量为25mg/kg。据nmpa颁布的《健康成年志愿者首次临床试验药物最大推荐起始剂量的估算指导原则》中“种属间不按mg/m2进行剂量换算的其他情况:分子量大于100000道尔顿的血管内给药的蛋白,应当按mg/kg换算”,推算出人等效剂量(hed)为8.6mg/kg。以成人体重60kg计,估算人体起效剂量约为:500mg。考虑安全性,选择该剂量的1/2~1/3作为首次人体给药剂量,则人起效剂量范围为180~250mg。
[0222]
根据单次静脉输注给予食蟹猴的剂量探索试验,无可见有害作用水平(noel)为300mg/kg,相应人体等效剂量(hed)为100mg/kg,按人体体重60kg计算,相应人体剂量为6000mg;根据食蟹猴重复给药4周毒理学研究结果,未观察到临床不良反应的剂量水平(noael)为150mg/kg,相应人体等效剂量(hed)为50mg/kg,按人体体重60kg计算,相应人体剂量为3000mg。目前临床前研究所支持的最大人体剂量为6000mg。单次给药剂量为180~6000mg,如180、250、500、900、1000、1800mg、3000mg或6000mg,或上述数值区间。给药方式为单/多次给药。
[0223]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。