sfv
‑
helper质粒、psfvcs
‑
lacz病毒样颗粒及其制备方法和应用
技术领域
1.本发明涉及生物工程领域,尤其涉及一种sfv
‑
helper质粒、psfvcs
‑
lacz 病毒样颗粒及其制备方法和应用。
背景技术:
2.糖香酶,亦称糖香水解酶,是一大类可水解糖香键的酶类的总称,可用于寡糖的合成,还可用于炫基糖香以及芳香基糖香的合成,在催化氨基酸、多肽、生物碱和抗生素等物质的糖基化方面也起到重要的作用,在医药和食品领域具有广泛的应用。β
‑
半乳糖香酶是一类重要的糖香酶,由lacz基因编码的β
‑
半乳糖苷酶广泛存在于微生物、动物和植物中。
3.rna复制子是衍生于rna病毒基因组并能自主复制的rna。最常用于开发复制子的病毒是披膜病毒科中的甲病毒(alphavirus),如辛德比斯病毒 (sindbis virus,sin)、塞姆利基森林病毒(semliki forest virus,sfv)以及委内瑞拉马脑炎病毒(venezuelan equine encephalitis virus,vee);除甲病毒外,还有黄病毒、小rna病毒、副粘病毒、杯状病毒等。被改造用于rna复制子的表达载体本文以甲病毒(塞姆利基森林病毒)载体为例,阐明rna复制子疫苗的基本原理和特点。甲病毒是一类正链rna病毒(75),基因组长约11
‑
12kb,5’端有帽子结构,3’有多聚腺苷酸结构,有两个开放阅读框,可以编码4个非结构蛋白(ns1,ns2,ns3,ns4)和5个结构蛋白(core,e3,e2,6k, e1)。甲病毒基因组中位于ns3和ns4间存在一个终止密码子,有时候密码子通读时会产生一个更大的多聚蛋白p1234。但是在某些甲病毒基因组中,如 sinv和o’n yong
‑
nyong virus(onnv),此终止密码子被arg或cys密码子替换,因此不能产生p123多聚蛋白。而这一现象很有可能是一种潜在的发病机制。多聚蛋白p1234在ns2蛋白的水解作用下,自切割产生p123和ns4 蛋白。同时,p123和ns4蛋白可以作为病毒复制酶,以基因组rna为模板合成负链rna。此后,负链rna亦可以作为模板合成正链的基因组rna和亚基因组rna(subgenomic rna)。随后,p123多聚蛋白被水解产生ns1和p23蛋白,导致负链rna合成减少,而正链基因组rna合成增多。p23多聚蛋白的半衰期极短,仅为数秒,而后被水解形成ns2和ns3蛋白。此时,以单体形式存在的ns1、ns2、ns3、ns4蛋白结合形成复制复合体,进一步促进病毒基因组和亚基因组rna的复制。
4.本发明以塞姆利基森林病毒(semliki forest virus,sfv)为载体,它包括两个独立的rna分子,一个rna分子是包含插入了rna复制子载体。另一个 rna分子是辅助rna。如何利用塞姆利基森林病毒(semliki forest virus,sfv) 为载体构建一种包装体系,使其能够高效表达β
‑
半乳糖苷酶,对β
‑
半乳糖香酶在食品领域的应用具有重大的意义。然而,如何利用塞姆利基森林病毒进行高效表达β
‑
半乳糖苷酶,目前尚未文献记载。
技术实现要素:
5.本发明所要解决的技术问题在于,其以塞姆利基森林病毒为载体,提供一种sfv
‑
helper质粒、psfvcs
‑
lacz病毒样颗粒及其制备方法,能高效表达β
‑
半乳糖苷酶。
6.本发明还要解决的技术问题还在于,提供sfv
‑
helper质粒、psfvcs
‑
lacz 病毒样颗粒的应用。
7.为了解决上述技术问题,本发明提供了一种psfvcs
‑
lacz病毒样颗粒的制备方法,包括:
8.(1)构建sfv
‑
helper质粒;
9.(2)将psfvcs
‑
lacz、sfv
‑
helper质粒体外转录成mrna,然后将mrna 共电转入bhk细胞中,得到psfvcs
‑
lacz病毒样颗粒;
10.其中,所述sfv
‑
helper质粒是通过构建如seq id no.1所示的重组载体,并合成如seq id no.2所示的插入片段基因,然后将所述插入片段基因克隆入所述重组载体而得。
11.作为上述技术方案的改进,步骤(1)包括:
12.(1.1)构建重组载体,构建得到的重组载体的序列为seq id no.1;
13.(1.2)合成插入片段基因,所述插入片段的序列为seq id no.2;
14.(1.3)将重组载体与插入片段进行同源重组,重组的产物转化dh5α感受态细菌,涂布平板,倒置培养,提取质粒,得到sfv
‑
helper质粒,其中,所述sfv
‑
helper质粒的序列为seq id no.3。
15.作为上述技术方案的改进,步骤(1.3)包括:
16.将重组载体与插入片段进行同源重组,重组的产物转化dh5α感受态细菌,涂布氨苄抗性的lb平板,35
‑
38℃倒置培养10
‑
20小时,将菌落pcr阳性的菌落进行小摇,保菌,提取质粒;
17.然后将提取的质粒酶切鉴定及测序。
18.作为上述技术方案的改进,步骤(1.1)包括:
19.设计与合成引物,所述引物包括第一段
‑
f、第一段
‑
r、及第二段
‑
f、第二段
ꢀ‑
r:
20.以psfvcs
‑
lacz为模板,分别以第一段
‑
f、第一段
‑
r为引物扩增片段1,以第二段
‑
f、第二段
‑
r为引物扩增片段2进行扩增,得到载体片段1和载体片段2;
21.将所述载体片段1和载体片段2同源重组,得到重组产物;
22.将重组产物加入到感受态细胞dh5α细胞,进行重组产物转化;
23.将转化后的重组产物进行重组产物鉴定;
24.将鉴定后的重组产物提取质粒;
25.对所述质粒进行酶切鉴定及测序。
26.作为上述技术方案的改进,所述引物的序列设计如下:
27.第一段
‑
f的序列为seq id no.4;
28.第一段
‑
r的序列为seq id no.5;
29.第二段
‑
f的序列为seq id no.6;
30.第二段
‑
r的序列为seq id no.7。
31.作为上述技术方案的改进,步骤(2)包括:
32.线性化所述psfvcs
‑
lacz和sfv
‑
helper;
33.将线性化后的psfvcs
‑
lacz及sfv
‑
heleper进行体外转录;
34.将psfvcs
‑
lacz及psfvcs
‑
heleper质粒体外转录的mrna共电转入bhk 细胞中,得到psfvcs
‑
lacz病毒样颗粒。
35.相应的,本发明还提供一种sfv
‑
helper质粒,所述sfv
‑
helper质粒是通过构建如seq id no.1所示的重组载体,并合成如seq id no.2所示的插入片段基因,然后将所述插入片段基因克隆入所述重组载体而得。
36.相应的,本发明还提供了一种psfvcs
‑
lacz病毒样颗粒,其由上述制备方法制成。
37.相应的,本发明还公开了一种sfv
‑
helper辅助质粒、psfvcs
‑
lacz病毒样颗粒以及psfvcs
‑
lacz病毒样颗粒的制备方法在β
‑
半乳糖苷酶的表达中的应用。
38.相应的,本发明还公开了一种sfv
‑
helper辅助质粒、psfvcs
‑
lacz病毒样颗粒以及psfvcs
‑
lacz病毒样颗粒的制备方法在食品、治疗药物、动物模型中的应用。
39.实施本发明,具有如下有益效果:
40.本发明通过构建辅助质粒sfv
‑
helper,然后将psfvcs
‑
lacz、sfv
‑
helper体外转录成mrna,再将mrna共电转入bhk细胞中,可以成功表达了β
‑
半乳糖苷酶。而且,所述psfvcs
‑
lacz病毒样颗粒由于缺乏编码病毒核衣壳的基因,为复制缺陷型病毒,具有较高的生物安全性。
附图说明
41.图1是扩增载体片段1、2的模板质粒psfvcs
‑
lacz图谱;
42.图2是载体片段1、2扩增结果示意图;
43.图3是重组产物鉴定结果示意图;
44.图4是sfv
‑
helper重组质粒图谱;
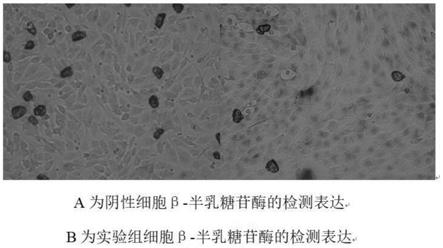
45.图5是重组质粒sfv
‑
helper ncol酶切鉴定结果示意图;
46.图6是spei酶切psfvcs
‑
lacz及sfv
‑
heleper示意图;
47.图7是线性化psfvcs
‑
lacz体外转录示意图;
48.图8是线性化sfv
‑
heleper体外转录示意图;
49.图9是β
‑
半乳糖苷酶的检测表达(
×
200)示意图。
具体实施方式
50.为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述。
51.本发明提供了一种psfvcs
‑
lacz病毒样颗粒的制备方法,包括:
52.(1)构建sfv
‑
helper质粒;
53.所述sfv
‑
helper质粒是通过构建如seq id no.1所示的重组载体,并合成如seq id no.2所示的插入片段基因,然后将所述插入片段基因克隆入所述重组载体而得。
54.具体的,步骤(1)包括:
55.(1.1)构建重组载体,构建得到的重组载体的序列为seq id no.1;
56.(1.2)合成插入片段基因,所述插入片段的序列为seq id no.2;
57.(1.3)将重组载体与插入片段进行同源重组,重组的产物转化dh5α感受态细菌,涂布平板,倒置培养,提取质粒,得到sfv
‑
helper质粒,其中,所述 sfv
‑
helper质粒的序列为seq id no.3。
58.优选的,步骤(1.1)包括:
59.设计与合成引物,所述引物包括第一段
‑
f、第一段
‑
r、及第二段
‑
f、第二段
ꢀ‑
r:所述引物的序列设计如下:第一段
‑
f的序列为seq id no.4;第一段
‑
r的序列为seq id no.5;第二段
‑
f的序列为seq id no.6;第二段
‑
r的序列为seqid no.7。
60.以psfvcs
‑
lacz为模板,分别以第一段
‑
f、第一段
‑
r为引物扩增片段1,以第二段
‑
f、第二段
‑
r为引物扩增片段2进行扩增,得到载体片段1和载体片段2;
61.将所述载体片段1和载体片段2同源重组,得到重组产物;
62.将重组产物加入到感受态细胞dh5α细胞,进行重组产物转化;
63.将转化后的重组产物进行重组产物鉴定;
64.将鉴定后的重组产物提取质粒;
65.对所述质粒进行酶切鉴定及测序。
66.优选的,步骤(1.3)包括:
67.将重组载体与插入片段进行同源重组,重组的产物转化dh5α感受态细菌,涂布氨苄抗性的lb平板,35
‑
38℃倒置培养10
‑
20小时,将菌落pcr阳性的菌落进行小摇,保菌,提取质粒;
68.然后将提取的质粒酶切鉴定及测序。
69.更佳的,步骤(1.3)包括:
70.将重组载体与插入片段进行同源重组,重组的产物转化dh5α感受态细菌,涂布氨苄抗性的lb平板,37℃倒置培养10
‑
20小时,将菌落pcr阳性的菌落进行小摇,保菌,提取质粒;然后将提取的质粒酶切鉴定及测序。
71.下面以优选的具体实施例进一步阐述步骤(1)
72.(1.1)构建重组载体:
73.(a)引物设计与合成
74.根据snapgene软件,采用同源重组技术设计引物第一段
‑
f、第一段
‑
r、及第二段
‑
f、第二段
‑
r,在金唯智科技有限公司(苏州)合成,设计引物如下表1:
75.表1扩增载体片段的引物
[0076][0077]
(b)载体片段的扩增
[0078]
以psfvcs
‑
lacz(#92076)购自addgene为模板,分别以第一段
‑
f,第一段
‑
r 为引物扩增片段1;以第二段
‑
f,第二段
‑
r为引物扩增片段2,pcr体系和条件分别如下:
[0079]
表2片段1扩增pcr体系
[0080][0081]
表3片段1扩增pcr程序
[0082][0083][0084]
表4片段2扩增pcr体系
[0085][0086]
表5片段2扩增pcr程序
[0087][0088]
pcr扩增结束后进行1%核酸凝胶电泳鉴定,分别在3042bp、1665bp左右出现明显目的条带,于紫外光线下将含有目的条带的凝胶切下,尽量使切下的凝胶大小恰好包含所有目的条带,不要过大,切胶时要快速,切完立刻关闭紫外线,防止目的片段受到紫外线过度照射而降解。将切好的凝胶转移到2ml的 ep管中,进行胶回收,并测定dna浓度。
[0089]
(c)载体片段1、2同源重组
[0090]
胶回收结束后将载体片段1、片段2按照合适的体积,于冰上配置以下反应体系,体系如下表6:
[0091]
表6同源重组体系
[0092][0093][0094]
轻轻摇匀后,在37℃水浴锅中孵育30min中,然后放置4℃或冰上冷却。
[0095]
(d)重组产物转化
[0096]
在冰上解冻克隆用的化学感受态细胞dh5α细胞,取10μl重组产物加入到 100μl感受态细胞中,轻弹管壁混匀(请勿振荡混匀),冰上静置30min。42℃水浴热激45sec后,立即置于冰上冷却2
‑
3min。加入900μl soc,37℃摇菌1h (转速200
‑
250rpm)。将相应含氯霉素抗性的lb平板固体培养基在37℃培养箱中预热。5,000rpm离心5min,弃掉900μl上清。用剩余培养基将菌体重悬,用无菌涂布棒涂在有含氯霉素抗性的平板上轻轻涂匀。37℃培养箱中倒置培养 12
‑
16h。
[0097]
(e)重组产物鉴定
[0098]
过夜培养后,查看平板的菌落并挑取其中菌落进行菌液鉴定,至于加有含氯霉素抗性的lp培养基的2ml ep管中,在37℃的摇床中培养约5个小时,然后进行菌液鉴定,鉴定片段为4691bp,鉴定pcr体系如下表7:
[0099]
表7菌液鉴定pcr体系
[0100][0101]
取鉴定阳性的菌液100ul于加有含氯霉素抗性的lp培养基的50ml离心管中进行大摇,过夜培养。
[0102]
(f)提取质粒
[0103]
柱平衡步骤:向吸附柱cp3中(吸附柱放入收集管中)加入500μl的平衡液bl,12,000rpm(~13,400
×
g)离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中。
[0104]
取15ml过夜培养的菌液,加入离心管中,使用常规台式离心机,12,000rpm (~13,400
×
g)离心1min,尽量吸除上清。
[0105]
向留有菌体沉淀的离心管中加入500μl溶液p1,使用移液器或涡旋振荡器彻底悬浮细菌沉淀。
[0106]
向离心管中加入500μl溶液p2,温和地上下翻转6
‑
8次使菌体充分裂解。注意:温和地混合,不要剧烈震荡,以免打断基因组dna,造成提取的质粒中混有基因组dna片断。此时菌液应变得清亮粘稠,所用时间不应超过5min,以免质粒受到破坏。如果未变得清亮,可能由于菌体过多,裂解不彻底,应减少菌体量。
[0107]
向离心管中加入700μl溶液p3,立即温和地上下翻转6
‑
8次,充分混匀,此时将出现白色絮状沉淀。12,000rpm(~13,400
×
g)离心10min。注意:p3加入后应立即混合,避免产生局部沉淀。如果上清中还有微小白色沉淀,可再次离心后取上清。
[0108]
将上一步收集的上清液用移液器转移到吸附柱cp3中12,000rpm (~13,400
×
g)离心30
‑
60sec,倒掉收集管中的废液,将吸附柱cp3放入收集管中。
[0109]
向吸附柱cp3中加入600μl漂洗液pw(请先检查是否已加入无水乙醇), 12,000rpm(~13,400
×
g)离心30
‑
60sec,倒掉收集管中的废液,将吸附柱cp3放入收集管中。
[0110]
重复操作步骤7。
[0111]
将吸附柱cp3放入收集管中,12,000rpm(~13,400
×
g)离心2min,目的是将吸附柱中残余的漂洗液去除。将吸附柱cp3开盖,置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。
[0112]
将吸附柱cp3置于一个干净的离心管中,向吸附膜的中间部位滴加50
‑
100 μl洗脱缓冲液eb,室温放置2min,12,000rpm(~13,400
×
g)离心2min将质粒溶液收集到离心管中。
[0113]
(g)重组载体测序
[0114]
提取的质粒进行酶切,经鉴定正确后,送去金唯智生物科技有限公司进行测序。
[0115]
(1.2)合成插入片段基因,
[0116]
需要插入的sfv
‑
heper基因的序列如seq id no.2所示,将其进行基因合成。
[0117]
(1.3)将重组载体与插入片段进行同源重组,
[0118]
(a)同源重组、转化及提取质粒
[0119]
将重组载体与插入片段进行同源重组。重组的产物转化dh5α感受态细菌,涂布氨苄抗性的lb平板,37℃倒置培养16小时。将菌落pcr阳性的菌落进行小摇,保菌,参照omega质粒小量提取试剂盒说明书提取质粒
[0120]
(b)质粒酶切鉴定及测序
[0121]
将提取的质粒酶切鉴定,1%琼脂糖凝胶电泳检测结果;将验证正确的结果送到金唯智生物科技有限公司进行测序。
[0122]
(2)将psfvcs
‑
lacz、sfv
‑
helper质粒体外转录成mrna,然后将mrna 共电转入bhk细胞中,得到psfvcs
‑
lacz病毒样颗粒;
[0123]
具体的,步骤(2)包括:
[0124]
(2.1)线性化所述psfvcs
‑
lacz和sfv
‑
helper;
[0125]
用spei分别酶切psfvcs
‑
lacz及sfv
‑
heleper,体系均为300ul,如下表8、 9。
[0126]
表8 spei酶切psfvcs
‑
lacz
[0127][0128]
表9 spei酶切复制质粒sfv
‑
heleper
[0129][0130]
(2.2)将线性化后的psfvcs
‑
lacz及sfv
‑
heleper进行体外转录;
[0131]
根据mmessage mmachine
tm
sp6转录试剂盒(am1340,购自赛默飞) 所述方法进行体外转录,体系如下:
[0132]
表10 psfvcs
‑
lacz体外转录体系
[0133]
[0134][0135]
表11 sfv
‑
heleper体外转录体系
[0136][0137]
上述体系配好后37℃转录40min,然后加入1ul gtp 37℃继续转录2h,随后再加入1ul turbo dnase37℃、15min。转录结束后分别吸取1ul转录产物,加入4ul的nuclease
‑
free water及6
×
loading buffer进行稀释,注意无菌操作及防止rna降解,然后在1%sds
‑
page中进行电泳实验,验证条带正确与否。
[0138]
(2.3)将psfvcs
‑
lacz及psfvcs
‑
heleper质粒体外转录的mrna共电转入bhk细胞中,得到psfvcs
‑
lacz病毒样颗粒。
[0139]
具体,可以按如下步骤操作:
[0140]
1.细胞提前传至t75方瓶中,当细胞汇合度达到80%时,进行实验;
[0141]
2.在冰上预冷1.5ml ep管和pbs。在
‑
20℃冰箱中预冷4mm比色杯(电极杯);
[0142]
3. 37℃预热6毫升培养基(含1%fbs dmem);
[0143]
4.胰蛋白酶消化t75方瓶中细胞并用5毫升完全培养基重新悬浮;
[0144]
5. 500g、4℃离心5分钟;
[0145]
6.弃去上清液,并用10ml冰冷pbs清洗细胞颗粒;
[0146]
7. 500g、4℃离心5分钟,再次重复pbs清洗;
[0147]
8.弃去上清液并完全去除残留的pbs,并用遇冷的520ul pbs重悬细胞,均分成二等份,每份含260ul的pbs细胞重悬液别置于预冷的1.5mlep管;
[0148]
9.第一份pbs细胞重悬液分别加入10ul的psfvcs
‑
sp6
‑
lacz及psfvcs
‑
heleper转录产物;第二份pbs细胞重悬液不加入任何物质,也放置冰上;
[0149]
10.将上述三种混合物分别转移到3个预冷的电极杯(4mm)中,设置电转仪条件同为100v,25ms,电击一次,电击后置于冰上1min;
[0150]
11.然后分别向电极杯中加入约400ul的含1%fbs dmem吹打混匀,随即转至t25方瓶中,并加入6ml含1%fbs dmem,放置37℃5%co2培养箱中进行培养;
[0151]
12.电穿孔后8h至36h后,用倒置荧光显微镜进行观测,待36h后收取上清液;
[0152]
1.3.3β
‑
半乳糖苷酶的检测表达;
[0153]
按照β
‑
半乳糖苷酶原位染色试剂盒(碧云天),将上述收取上清液后的细胞,进行原位β
‑
半乳糖苷酶的检测表达,阴性细胞去除上清液后作为对照。
[0154]
相应的,本发明还提供一种sfv
‑
helper质粒,所述sfv
‑
helper质粒是通过构建如seq id no.1所示的重组载体,并合成如seq id no.2所示的插入片段基因,然后将所述插入片段基因克隆入所述重组载体而得。所述sfv
‑
helper质粒的序列为seq id no.3。
[0155]
相应的,本发明还提供了一种psfvcs
‑
lacz病毒样颗粒,其由上述制备方法制成。所示psfvcs
‑
lacz病毒样颗粒可以成功表达了β
‑
半乳糖苷酶。而且,所述psfvcs
‑
lacz病毒样颗粒由于缺乏编码病毒核衣壳的基因,为复制缺陷型病毒,具有较高的生物安全性。
[0156]
相应的,本发明还公开了一种sfv
‑
helper辅助质粒、psfvcs
‑
lacz病毒样颗粒以及psfvcs
‑
lacz病毒样颗粒的制备方法在β
‑
半乳糖苷酶的表达中的应用。
[0157]
相应的,本发明还公开了一种sfv
‑
helper辅助质粒、psfvcs
‑
lacz病毒样颗粒以及psfvcs
‑
lacz病毒样颗粒的制备方法在食品、治疗药物、动物模型中的应用。
[0158]
实验结果:将上述sfv
‑
helper辅助质粒、psfvcs
‑
lacz病毒样颗粒进行实验结果校验,具体如下;
[0159]
一、sfv
‑
helper辅助质粒
[0160]
(1)载体片段1、2的扩增
[0161]
结合图1和图2,图1是扩增载体片段1、2的模板质粒psfvcs
‑
lacz图谱,图2是载体片段1、2扩增结果,如图2所示,扩增的载体片段1、2分别是3042bp、 1665bp,与理论值相符合。
[0162]
需要说明的是,图2中,m由上至下分别为8000、5000、3000、1500、1000、 500bp,1至5均是扩增的载体片段2,6至10均是扩增的载体片段1。
[0163]
(2)重组产物鉴定
[0164]
分别挑取10个菌落,进行鉴定,如图3的1
‑
10大小均为4691bp左右,与理论值大小相符合。
[0165]
需要说明的是,图3中,m由上至下分别为8000、5000、3000、1500、1000、 500bp,1至10分别是单菌落鉴定片段。
[0166]
(3)重组载体测序
[0167]
将鉴定正确的质粒送至金唯智生物科技有限公司进行测序,测序结果完全相同。
[0168]
(4)将基因合成的插入片段克隆入重组载体
[0169]
重组质粒ncol酶切后,进行1%核酸凝胶电泳鉴定。结合图4和图5,图4 是sfv
‑
helper重组质粒图谱,图5是重组质粒sfv
‑
helper ncol酶切鉴定图。由图5可知,目标条带分别在1407bp、6785bp左右与理论值完全符合,送至金唯智生物科技有限公司进行测序,测序结果与原序列完全相同。
[0170]
二、psfvcs
‑
lacz病毒样颗粒
[0171]
(1)线性化psfvcs
‑
lacz及sfv
‑
heleper
[0172]
用spei分别酶切psfvcs
‑
lacz及sfv
‑
heleper,结果如图6所示,其中, m1由上至下分别是:15000、10000、7500、5000、3000、1500、1000、500bp; m2由上至下分别是:8000、5000、3000、1500、1000、500bp,1是spei酶切 psfvcs
‑
lacz;2是spei酶切sfv
‑
heleper。线性
化后的目的条带大小与理论值相符。
[0173]
线性化后的psfvcs
‑
lacz及sfv
‑
heleper进行体外转录
[0174]
根据mmessage mmachine
tm
sp6转录试剂盒(am1340,购自赛默飞) 所述方法对psfvcs
‑
lacz和辅助质粒sfv
‑
heleper进行体外转录结果如图7、 8。图7中,m由上至下分别为:8000、5000、3000、1500、1000、500bp;1 为psfvcs
‑
lacz体外转录。图8中,m由上至下分别为:10000、7000、4000、2000、1000、500、200bp,2为sfv
‑
heleper体外转录。由7、8可知,体外转录后目的条带大小与理论值相符合。
[0175]
三、β
‑
半乳糖苷酶的检测表达
[0176]
按照β
‑
半乳糖苷酶原位染色试剂盒(碧云天),将上述电转培养36h收取上清液后的细胞,进行原位β
‑
半乳糖苷酶的检测表达,同时将去除上清液的阴性细胞作为对照,如图9:阴性细胞未见有深蓝色变化,而有大量实验组细胞变成深蓝色,证明实验组有大量β
‑
半乳糖苷酶的表达。同时证明psfvcs
‑
lacz 病毒样颗粒的制备成功。
[0177]
综上所述,本发明通过构建辅助质粒sfv
‑
helper,将psfvcs
‑
lacz、 sfv
‑
helper体外转录成mrna,然后将mrna共电转入bhk细胞中,36h收获上清及对β
‑
半乳糖苷酶原位检测表达,结果有大量细胞变成深蓝色,而阴性细胞未出现颜色变化。因此,本发明采用塞姆利基森林病毒(semliki forest virus, sfv)为载体构建了一种病毒包装体系,成功表达了β
‑
半乳糖苷酶。
[0178]
以上所述的仅为本发明一种较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属本发明所涵盖的范围。
[0179]
[0180]
[0181]
[0182]
[0183]
[0184]
[0185]
[0186]
[0187]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。