1.本发明属于微生物饲料添加剂技术领域,具体涉及利用纳米技术制备果胶/壳聚糖为壁材的合生元微胶囊制备方法。
背景技术:
2.抗生素的使用开启了一个新的时代,但是滥用和使用频繁,接踵而至的是细菌耐药性的增强、超级细菌的出现和动物机体免疫力下降等不良现象产生。2020年将全面进入无抗时代(饲料中禁用促生长抗生素),绿色健康养殖将会解决现状,引领养殖行业新发展。绿色养殖也是符合国际发展趋势,所以在国际趋势和实际生产“难养”的结合下,强调健康养殖首先要从动物自身健康出发,维护动物自身的免疫能力和生长发育。微生物制剂的研究应用克服了长期使用抗生素造成的种种弊端,对发展绿色养殖起到重要作用。因此,发展绿色饲料添加剂具有广阔的应用前景,已被农业部列为二十一世纪重点推广技术项目。
3.为了预防和治疗动物疾病为目的,使用疫苗,但是疫苗的作用是局部的、短暂的,长期口服益生菌保证肠道中有益菌的存活数,激活肠粘膜防疫能力,能够安全、长效地保护动物免受病原菌侵袭。
4.中国卫生部于2009年将菊粉确定为新资源食品,2015年12月欧盟发布法规认可菊粉有助于维持正常肠道的功效,并批准菊粉作为益生元应用。菊粉不能被胃和小肠吸收,但会被结肠中的双歧杆菌、乳酸菌发酵,促进肠道益生菌的数量和活性,改善宿主的健康。菊粉是细菌优先食物,使益生菌数量增加而成为优势菌群,抑制腐败菌。
5.自组装技术长期以来一直是纳米生物技术的研究热点之一。自组装(self
‑
assembly)是指无序分子之间在无需外力干预和控制下,能自发聚集、组织成有序结构的现象。小分子通过自组装可以成功构建为纳米结构材料。通过自组装形成的纳米结构材料具有独特的物理和化学性能,可应用于纳米药物与基因载体。自组装方法可以方便、灵活、快捷地将不同功能的生物材料整合到一体,通过分子识别分子之间相互能寻找出最安定、最接近的部位,并组装出超越单个分子性能的高次结构聚集体。菊粉是天然多糖,它的功能活性与糖链上所连接的化学基团有着直接关系。可以利用化学方法对菊粉结构中羟基等基团进行化学修饰引入一些基团(如硫酸基、羧甲基、烷基、辛烯基琥珀酸酐) 使菊粉活性得到增强或具有新的活性。
6.目前,聚合物纳米粒子开始应用于生物医学,因为它们可以将化学治疗剂、蛋白质、基因和造影剂靶向输送到所需的作用位点或响应特定的生物。最重要的是,由于聚合物纳米颗粒的内核中疏水基团的相互作用,通过疏水基团改性的亲水聚合物通过自组装技术形成聚合物纳米颗粒。最近研究表明,菊粉与醋酸反应生成菊粉醋酸酯聚合物 (inulinacetate,inac),之后利用自组装方法生成菊粉纳米粒子。
7.微生态制剂中益生菌以活菌的形式通过胃到达肠道定居,这对微生态制剂有效性起到了关键性作用。国内对微生态制剂的应用形式大体上分为:益生菌粉末、益生菌发酵制剂、液态益生菌制剂及益生菌微胶囊制剂。研究和应用较多的是粉末状和发酵制剂,使用过
程中得到了一定的效果。但是,储藏环境不当导致失活或动物体内胃酸环境下大部分也会失活,未能完全发挥益生菌的生理功效。
8.动物腹泻病为幼龄动物生产中的一大杀手,轻者影响对动物的营养吸收,重者导致死亡,给养殖业造成巨大的经济损失。沙门氏菌的感染是导致幼龄动物腹泻的主要病原菌,乳酸片球菌(野生型)对沙门氏菌有抑菌作用。因此,需要研究乳酸片球菌发挥最大的功效。
9.抗生素的负面影响广为人知,微生态制剂有效补充动物消化道肠道内有益微生物,改善消化道菌群平衡,增强机体抗病性、提高利用效率,将其作为抗生素的替代品。
10.目前微生态制剂的使用形式趋于多元化,大体分为菌种直接饲喂、负载于载体中制备成固态的产品、发酵中药等组分制备成液态的形式等使用。这些方式虽然得到了一定效果,但是在恶劣的胃肠道环境中益生菌生理活性降低,需要利用具有生物兼容性、生物降解性的天然壁材做以保护,保证益生菌生理活性。
技术实现要素:
11.针对现有技术存在的问题,本发明的目的在于设计提供一种含有菊粉纳米粒子和乳酸片球菌的果胶/壳聚糖微胶囊及其制备方法,本发明中提供的菊粉纳米粒子内化到乳酸片球菌体内,诱导乳酸片球菌分泌更多的天然抗菌素
‑
乳酸片球菌素,起到抑制肠道沙门氏菌的作用。
12.本发明的目的在于提供一种抗腹泻合生元微胶囊,其特征在于,芯材为含有菊粉纳米粒子的益生元;壁材为ph敏感性高分子化合物。
13.本发明所述的合生元微胶囊,其特征在于,所述ph敏感性高分子化合物为果胶或壳聚糖。
14.本发明所述的合生元微胶囊,其特征在于,所述菊粉纳米粒子为邻苯二甲酰菊糖聚合物,其粒径为200
‑
500nm范围。
15.本发明还提供一种合生元微胶囊的制备方法,其特征在于包括以下步骤:菊粉纳米粒子制备步骤、益生元制备步骤、微胶囊成囊步骤、透析冻干步骤。
16.本发明的第二方面所述的制备方法,其特征在于:所述菊粉纳米粒子制备步骤为,菊粉与邻苯二甲酸酐1∶1
‑
3的质量比例混合溶解于 n,n
‑
二甲基甲酰胺溶液;添加5%醋酸钠溶液,按每克菊粉添加 200
‑
300ul,充氮气搅拌24
‑
36小时生成邻苯二甲酰菊糖聚合物。
17.本发明的第二方面所述所述的制备方法,其特征在于:所述益生元制备步骤包括所述内载菊粉纳米粒子的益生菌溶液制备步骤:每毫升乳酸片球菌液添加66
‑
200mg菊粉纳米粒子,37℃、100
‑
150rpm振荡培养箱里培养5
‑
20分钟。
18.本发明的第二方面所述所述的制备方法,其特征在于:所述微胶囊成囊步骤为,益生菌选用乳酸片球菌,与菊粉纳米粒子一同包被于果胶/壳聚糖为壁材的微胶囊。
19.本发明进一步提供一种抗腹泻合生元微胶囊在幼龄动物抗腹泻药物组合物中的应用。
20.本发明制备的菊粉纳米为益生元的合生元微胶囊与游离态乳酸片球菌、单一包被乳酸片球菌的微胶囊、包被乳酸片球菌和菊粉的微胶囊相比,对胃肠道耐受性增强、抗菌效果增加,乳酸片球菌分泌乳酸片球菌素的分泌量显著提高2
‑
3倍,人工模拟肠道环境下微胶
囊迅速释放内载菊粉纳米的乳酸片球菌,从而提高对肠道沙门氏菌的抑菌效果。
附图说明
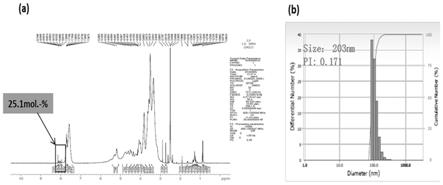
21.图1示出菊粉纳米粒子的特征,其中,图1(a)为菊粉纳米粒子nmr 光谱分析,图1(b)为菊粉纳米粒子dls分析;
22.图2示出sem观察菊粉纳米粒子形态;
23.图3示出不同实施例微胶囊的形态;
24.图4示出体外人工胃液中乳酸片球菌的存活率;
25.图5示出体外人工肠液中乳酸片球菌的存活率;
26.图6示出在体外人工肠液(ph 7.2,37℃)中微胶囊的释放率;
27.图7示出共培养体系中沙门氏菌数的测定来评定微胶囊的抑菌效果;
28.图8示出十二烷基硫酸钠
‑
聚丙烯酰胺凝胶电泳(sds
‑
page)分析结果。
具体实施方式
29.下面,将结合本发明实施例中的附图,对本发明实施例中的技术方案进行详细的描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
30.需要说明的是,在本文中,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
31.在本发明中,图1示出菊粉纳米粒子的特征,其中,图1(a)为菊粉纳米粒子nmr光谱分析,图1(b)为菊粉纳米粒子dls分析;图2示出sem观察菊粉纳米粒子形态;图3示出不同实施例微胶囊的形态;图4示出体外人工胃液中乳酸片球菌的存活率;图5示出体外人工肠液中乳酸片球菌的存活率;图6示出在体外人工肠液(ph 7.2,37℃)中微胶囊的释放率;图7示出共培养体系中沙门氏菌数的测定来评定微胶囊的抑菌效果;图8示出十二烷基硫酸钠
‑
聚丙烯酰胺凝胶电泳 (sds
‑
page)分析结果。
32.周知,益生菌在保存及使用过程中会受到外界逆境条件影响,导致其活性降低甚至死亡。微胶囊化技术将芯材包埋在微小封闭的微胶囊内的技术,能够达到芯材不受环境中各种严酷因子的压迫。饲用益生菌会受到来自外界环境与动物体内各种不利条件的影响,如氧气、高温、胃酸、胆汁盐和其他细菌等。以口服形式进入活体肠道内的益生菌必须经过恶劣的胃肠环境,在模拟胃液的处理过程中存活能力不断降低。本发明解决了益生菌制剂生产应用过程中的一项瓶颈问题,为了这一关键问题利用ph敏感性高分子化合物为壁材进行包被。
33.所述的含有菊粉纳米粒子和乳酸片球菌的果胶/壳聚糖微胶囊的制备方法,其特征包括以下工艺步骤:
34.(1)一种诱导乳酸片球菌分泌更多乳酸片球菌素的菊粉纳米粒子制备方法;
35.(2)将菊粉纳米粒子作为益生元,与乳酸片球菌一同包被于果胶/壳聚糖微胶囊制
备生成合生元微胶囊制剂。
36.所述菊粉纳米粒子制备方法包括以下步骤:菊粉与邻苯二甲酸酐1∶1
‑
3的质量比例混合溶解于n,n
‑
二甲基甲酰胺溶液。
37.进一步,添加5%醋酸钠溶液,按每克菊粉添加200
‑
300ul,充氮气搅拌24
‑
36小时生成邻苯二甲酰菊糖聚合物。
38.进一步,将把反应生成的邻苯二甲酰菊糖聚合物装入透析网,在蒸馏水中透析18
‑
24小时,反应生成菊粉纳米粒子。
39.本发明的另一目的在于提供一种所述幼龄动物饲用菊粉纳米粒子为益生元的合生元微生态制剂的制备方法,所述制备方法包括以下步骤:
40.幼龄动物饲用合生元微胶囊制剂的制备方法具体包括:
41.步骤一,益生菌选用乳酸片球菌,与菊粉纳米粒子一同包被于果胶/壳聚糖为壁材的微胶囊,具体实施过程如下:
42.(1)壳聚糖溶液的制备:制备3
‑
10wt%的果胶水溶液;
43.(2)乳酸片球菌在mrs液状培养基里培养12
‑
16h,离心2
‑
3次,0.85%生理盐水冲洗2
‑
3次,收集。进一步,添加0.85%氯化钠溶液使最终活菌数浓度达到2.5
‑
4.3
×
10
11
cfu/ml。
44.(3)内载菊粉纳米粒子的益生菌溶液制备:每毫升乳酸片球菌液添加66
‑
200mg菊粉纳米粒子,37℃、100
‑
150rpm振荡培养箱里培养5
‑
20分钟。
45.(4)利用挤压法将步骤(3)中所述混合液与步骤(1)中配置的果胶溶液,添加比例为1∶3
‑
1∶4,再取乳酸片球菌液体积比4∶3
‑
5∶3的甘油,进一步滴入到0.2
‑
0.5m氯化钙溶液中,发生凝胶化反应,温度为20
‑
30℃,静置时间为5
‑
30min,形成果胶钙微球;
46.(5)0.85%生理盐水冲洗步骤(4)里制成的果胶钙微球;
47.(6)壳聚糖溶液制备:制备0.5
‑
0.8wt%壳聚糖溶液。
48.(7)将步骤(4)中制成的微球倒入到壳聚糖溶液,反应5
‑
30min,0.85%生理盐水冲洗2
‑
3次。最后,冻干机冻干微胶囊。
49.实施例1菊粉纳米粒子的制备:
50.反应液的配置:
51.(1)菊粉溶液的制备:1.0g菊粉溶解于2mldmf,常温下充分混合;
52.(2)邻苯二甲酸酐溶液制备:邻苯二甲酸酐1.973g溶解于3mldmf,充分溶解;
53.(3)5%醋酸钠溶液的制备:0.5g醋酸钠溶解于10ml蒸馏水;反应过程:
54.(1)已配置的菊粉溶液放入100ml三口反应器,注入氮气10min;
55.(2)按每克菊粉放入200ul5%醋酸钠溶液比例,用注射器注入200ul醋酸钠溶液,冲入氮气搅拌20min;
56.(3)利用数显搅拌电热套在40℃下反应24h
57.透析、冻干过程:
58.(1)反应液装入透析袋,透析袋放入蒸馏水中,在4℃里透析24h
59.(2)透析物倒出离心管,放入
‑
80℃冰箱放置24h,利用真空冻干机冻干。
60.(3)第二次透析的时候每10mg菊粉放入1mldmf溶解后放入透析袋,透析袋放入蒸馏水,在4℃里透析24h。
61.(4)与(2)步骤相同。
62.按照实施例1中制备的菊粉纳米粒子形态特征如图1所示:通过 nmr光谱分析了菊粉纳米粒子中邻苯二甲酸酐导入率(图1a),通过 dls分析了菊粉纳米粒子分散性指数和大小(图1b)。
63.菊粉纳米粒子形态特征通过sem分析,如图2所示。
64.菊粉纳米粒子平均直径为203nm,分散性指数为0.171,邻苯二甲酸酐导入率达到25.1mol.
‑
%,形态为圆形。
65.实施例2菊粉纳米为益生元的合生元微胶囊制备
66.(1)果胶溶液的制备:制备8wt%果胶溶液;
67.(2)氯化钙溶液的制备:取11.99g二水氯化钙溶解于500ml蒸馏水;
68.(3)乳酸片球菌菌泥的制备:2.0
‑
3.5
×
109/ml乳酸片球菌原种液接种到mrs液体培养基进行12
‑
16h培养,离心制得4.8
×
10
11
/ml乳酸片球菌菌泥;
69.(4)诱导菊粉纳米粒子内化到乳酸片球菌体内:150ul蒸馏水溶解25mg菊粉纳米粒子,在37℃恒温培养箱培养20
‑
30min;
70.(5)内载菊粉纳米粒子乳酸片球菌溶液的制备:取500ul 8%果胶溶液与(4)溶液混合均匀;
71.(6)微胶囊成囊:将步骤(5)中所混合液滴入步骤(2)溶液中,发生凝胶化反应,温度为20℃,搅拌时间为5
‑
10min,形成果胶钙微球;
72.(7)二次包被:将步骤(6)中制备的微球放入0.8%壳聚糖溶液搅拌 2
‑
5min,0.85%生理盐水对微胶囊进行洗涤2次;
73.(8)冻干:步骤(7)中获得的微胶囊放入
‑
80℃冰箱放置12h,利用真空冻干机冻干,获得的微胶囊简称为pc(pin
‑
pa)mcs。
74.实施例3
75.(1)果胶溶液的制备:制备8wt%果胶溶液;
76.(2)氯化钙溶液的制备:取11.99g二水氯化钙溶解于500ml蒸馏水;
77.(3)乳酸片球菌菌泥的制备:2.0
‑
3.5
×
109/ml乳酸片球菌原种液接种到mrs液体培养基进行12
‑
16h培养,离心制得4.8
×
10
11
/ml乳酸片球菌菌泥;
78.(4)菊粉与乳酸片球菌:150ul蒸馏水溶解25mg菊粉,在37℃恒温培养箱培养20
‑
30min;
79.(5)含菊粉与乳酸片球菌溶液的制备:取500ul 8%果胶溶液与(4) 溶液混合均匀;
80.(6)微胶囊成囊:将步骤(5)中所混合液滴入步骤(2)溶液中,发生凝胶化反应,温度为20℃,搅拌时间为5
‑
10min,形成果胶钙微球;
81.(7)二次包被:将步骤(6)中制备的微球放入0.8%壳聚糖溶液搅拌 2
‑
5min,0.85%生理盐水对微胶囊进行洗涤2次;
82.(8)冻干:步骤(7)中获得的微胶囊放入
‑
80℃冰箱放置12h,利用真空冻干机冻干,获得的微胶囊简称为pc(i
‑
pa)mcs。
83.实施例4
84.(1)果胶溶液的制备:制备8wt%果胶溶液;
85.(2)氯化钙溶液的制备:取11.99g二水氯化钙溶解于500ml蒸馏水;
86.(3)乳酸片球菌菌泥的制备:2.0
‑
3.5
×
109/ml乳酸片球菌原种液接种到mrs液体培养基进行12
‑
16h培养,离心制得4.8
×
10
11
/ml乳酸片球菌菌泥;
87.(4)微胶囊成囊:将步骤(5)中所混合液滴入步骤(2)溶液中,发生凝胶化反应,温度为20℃,搅拌时间为5
‑
10min,形成果胶钙微球;
88.(5)二次包被:将步骤(6)中制备的微球放入0.8%壳聚糖溶液搅拌 2
‑
5min,0.85%生理盐水对微胶囊进行洗涤2次;
89.(6)冻干:步骤(7)中获得的微胶囊放入
‑
80℃冰箱放置12h,利用真空冻干机冻干,获得的微胶囊简称为pc(pa)mcs。
90.试验例
91.采用实施例2
‑
4中制备的微胶囊进行了体外试验,以确定其在体外人工模拟胃液和体外人工肠液及体外抑菌效果,具体过程如下:
92.1.微胶囊包被率及表观特征分析
93.微胶囊大小测定:通过光学显微镜观察冻干前后微胶囊的形态,随机取30粒微胶囊,分别用游标卡尺测量其粒径。
94.2.微胶囊包被率测定
95.包被率测定:包被率(%)=(n1‑
n2)/n1×
100%
96.其中,n1表示用于微胶囊包埋的总菌数,n2表示氯化钙溶液残留菌数,重复3次。
97.检测结果:
98.表1.不同实施例微胶囊的表观特征及包被率
[0099][0100]
3.微胶囊体外人工胃肠液耐受性评定
[0101]
(1)体外人工胃液制备:使用1m的hcl溶液将把pbs缓冲溶液调制成ph2.0,添加1000units/ml浓度胃蛋白酶;
[0102]
(2)体外人工肠液制备:使用40%的naoh溶液把pbs缓冲溶液调制成ph 7.2,添加1.2%w/v胆盐;
[0103]
取30粒微胶囊放入5ml体外人工胃液,分别在5、10、30、60、 120min随机捡出5粒分析微胶囊中乳酸片球菌的存活率。
[0104]
取30粒微胶囊放入10ml体外人工肠液,分别在0.5、1、2、4、 6h分析溶液中乳酸片球菌活菌数。
[0105]
4.体外共培养试验
[0106]
将2.0~3.7
×
108cfu/ml的pa与3.3
×
108cfu/ml的sg共培养。将1克的微胶囊放入50ml的mrs肉汤中,置于37℃的振荡培养箱中有氧条件下(100rpm)培养9h。共培养体系中沙门氏菌数的测定来评定微胶囊的抑菌效果。
[0107]
5.共培养试验中乳酸片球菌素浓度的测定
[0108]
代谢产物在25,000g下离心30min,纯化乳酸片球菌蛋白,利用 bradford方法和十
二烷基硫酸钠
‑
聚丙烯酰胺凝胶电泳(sds
‑
page)分析乳酸片球菌素浓度。
[0109]
(1)bradford方法分析结果
[0110][0111]
由此可见,本发明所提供的菊粉纳米粒子为益生元的合生元微胶囊,其包被率达到95%以上,胃酸里这种合生元微胶囊中乳酸片球菌存活率2小时达到70%,小肠液里这种合生元微胶囊释放出的乳酸片球菌存活率,6小时达到64%,小肠液中放置30分钟时,这种合生元微胶囊中乳酸片球菌的释放率达到70%以上,6小时释放率达到80%以上。另外,菊粉纳米粒子刺激乳酸片球菌分泌更多量的乳酸片球菌素,抑制动物肠道沙门氏菌活性约10倍,如图7所示,微胶囊抑菌试验结果中,沙门氏菌的存活数来说的,pc(pa)组的平均沙门氏菌存活数为1260000cfu/ml,pc(pin
‑
pa)组的平均沙门氏菌存活数为 113000cfu/ml,从而得出抑制沙门氏菌的活性约为10倍。从而达到降低幼龄动物腹泻率的目的。
[0112]
本发明中采用价格低廉、来源广泛的菊粉,与邻苯二甲酸酐一定条件下反应生成菊粉
‑
邻苯二甲酸酯,再利用自主装技术制备了菊粉纳米粒子。这种纳米粒子尺寸为200nm
‑
500nm,能够内化到乳酸片球菌体内,显著提高乳酸片球菌对动物腹泻致病菌
‑
沙门氏菌的抑菌效果,能够刺激乳酸片球菌分泌乳酸片球菌素,起到抑菌效果。
[0113]
本发明中采用果胶和壳聚糖作为壁材,胃肠道耐受性好,肠道释放率较好。
[0114]
本发明中采用菊粉纳米粒子作为新型益生元,采用“益生元 益生菌”口服传递方式,达到了合生元微生态制剂的效果。
[0115]
本发明制备菊粉纳米粒子作为一种新型益生元,与乳酸片球菌一同培养能够提高乳酸片球菌素分泌,提高乳酸片球菌的生理活性,尤其对动物肠道致病菌
‑
沙门氏菌有显著的抑菌效果。
[0116]
通过本发明,(1)选用的壁材为天然高分子物质,具有无毒、无副作用;(2)纳米粒子内化到乳酸片球菌体内,显著改善乳酸片球菌的抑菌性能;(3)果胶/壳聚糖壁材的微胶囊具有较好的靶向(小肠)传递功能; (4)“益生元 益生菌”=合生元方式口服传递益生菌,本发明采用“益生菌 益生元”的方式进行口服传递,有利于益生菌在肠道中利用益生元迅速获能,快速增殖并黏附肠粘膜,采用这种合生元口服传递战略攻克益生菌在肠道中失活的问题,对于推进我国微生态制剂研究开发有重要的意义。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。