1.本发明涉及一种检测铜离子和硫离子的方法,具体涉及一种以新鲜石楠绿叶为碳源的碳量子点的制备方法及铜离子和硫离子的检测方法。
背景技术:
2.铜是人体中第三种含量最高的过渡金属元素,是生命有机体中必不可少的元素之一,在调节人体的各种生理活动中起着至关重要的作用。细胞中铜离子的浓度与人体健康密切相关,铜离子水平异常可能会破坏体内许多物质的动态平衡,引起多种疾病,例如阿尔茨海默氏症、帕金森氏症、威尔逊氏病和病毒疾病。同时,铜离子作为重金属离子,可能对环境产生潜在的有毒污染物,并对全球可持续发展产生不可逆转的威胁。
3.硫离子(s2‑
)是一种有毒污染物,可在工业过程和生物系统中发现,大多数环境硫化物作为重要的环境指标广泛分布在工业释放的天然和废水中,硫离子质子化后,具有很高的毒性和令人不愉快的臭鸡蛋味,是环境中非常不希望的污染物。质子化形式氢硫化物和硫化氢比硫化物阴离子本身更具毒性和腐蚀性,还发现h2s是仅次于一氧化氮(no)和一氧化碳(co)的第三高气态递质,这些特殊的生理功能对于有效预防各种常见疾病具有重要意义,但是,长时间暴露于低浓度的h2s会导致慢性中毒,在较高浓度下,h2s会损害大脑,导致窒息或死亡。更重要的是,空气中的气态硫化氢也可以在适当的天气条件下转化为二氧化硫,可能导致严重的污染。因此,迫切需要开发一种简单可靠的方法,对环境和生物系统中的cu
2
和s2‑
进行检测。
4.碳点(cds)是近年来发展起来的一种新型荧光纳米材料。由于其优良的光稳定性、良好的生物相容性、高的化学稳定性和易于功能化等优点,近年来得到了广泛的研究,特别是在传感器、生物成像和基因传递等生物医学领域。
5.迄今为止,在cu
2
和s2‑
的检测中已采用了多种常规分析方法,例如离子色谱法、电化学法、比色法、和化学发光法。不幸的是,大多数现有的分析方法都受到复杂、费力的操作、昂贵的前体和专用设备的限制。基于荧光的方法具有操作简便,选择性和灵敏度高等优点,因此具有潜在的优势。然而,荧光探针的合成通常涉及费时的有机合成路线或有害化学物质,这极大地限制了它们的实际应用。因此,开发具有简单性,低毒性,高灵敏度和选择性的荧光硫化物测定法仍然具有挑战性。
技术实现要素:
6.本发明的目的之一在于提供一种以新鲜石楠绿叶为碳源的碳量子点及其制备方法,通过溶剂萃取和溶剂热法相结合,以石楠绿叶为原料制备出了一种发红色荧光的生物基碳量子点(cds),该碳量子点在410nm的激发光激发下其发射峰位于678nm,此处的的荧光强度可被铜离子淬灭。
7.本发明的目的之二在于提供所述碳量子点的在检测铜离子、和/或硫离子中的应用。
8.本发明的目的之三在于提供一种铜离子的检测方法,当cu
2
加入到cds和邻苯二胺(opd)复合体系中时,由于cu
2
可以将邻苯二胺(opd)氧化,原位生成2,3
‑
二氨基吩嗪(dap),dap在410nm的激发光激发下,在570nm处出现一个荧光发射峰。同时,由于cu
2
与cds表面羧基结合导致cds在678nm处的荧光猝灭。因此,570nm处和678nm处荧光强度的比值(i
570
/i
678
)可以作为比率荧光探针的信号输出,用于检测灵敏地检测cu
2
的浓度,其对cu
2
检测的线性范围为0.5
‑
10μm,检出限为15.2nm。
9.本发明的目的之四在于提供一种硫离子的检测方法,由于cu
2
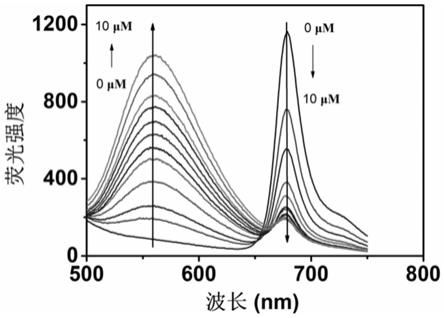
和s2‑
之间强大的结合能力,由cds/opd/cu
2
构建的比率荧光探针也可用于定量检测s2‑
。其对s2‑
检测的线性范围为1
‑
12μm,检出限24.7nm。
10.为实现上述目的,本发明采取的技术方案如下:
11.一种以新鲜石楠绿叶为碳源的碳量子点的制备方法,包括以下步骤:
12.(1)将新鲜石楠绿叶破碎后放入无水乙醇中进行提取,经过滤、离心后得到石楠绿叶提取液;
13.(2)将石楠绿叶提取液与纯水混合,于115~125℃水热反应4~6h,反应液冷却后离心,并将所得上清液透析后干燥,即可得到所述碳量子点。
14.步骤(1)中,所述提取的时间为10~14h,优选为12h。
15.步骤(1)中,所述新鲜石楠绿叶与无水乙醇的用量比为1g:4~8ml,优选为1g:6ml。
16.步骤(2)中,所述水热反应的条件优选为120℃水热反应4h。
17.步骤(2)中,所述石楠绿叶提取液与纯水的体积比为1:1~1.5,优选为1:1。
18.步骤(2)中,所述透析的条件为使用截留分子量为500da透析袋纯水透析4小时。
19.根据所述的制备方法制备得到的碳量子点,其粒径为10~15nm,可发出红色荧光,该碳量子点在410nm的激发光激发下其发射峰位于678nm,此处的的荧光强度可被铜离子淬灭。
20.本发明还提供了所述的碳量子点在检测铜离子、和/或硫离子中的应用,其可实现对于铜离子、和/或硫离子的定量检测。
21.本发明还提供了一种铜离子的检测方法,所述检测方法包括以下步骤:分别将不同浓度的cu
2
溶液与邻苯二胺溶液混合,再分别向各体系中加入所述碳量子点溶液、缓冲溶液,定容、孵育后,测试各体系在410nm的激发波长下的荧光发射光谱,用560nm、678nm波长处的荧光强度的比值i
560
/i
678
为横坐标,cu
2
溶液的浓度为横坐标作标准曲线,进而检测出待测液中的cu
2
浓度。
22.所述缓冲溶液为tris
‑
hcl缓冲溶液,其ph为7.9。
23.检测体系中,邻苯二胺、碳量子点、缓冲溶液的终浓度分别为90
‑
110μm、25
‑
35mg/l、0.02
‑
0.03m。
24.所述邻苯二胺、碳量子点、缓冲溶液的终浓度分别优选为100μm、30mg/l、0.025m。
25.所述孵育的条件为37℃孵育2h;所述cu
2
溶液的终浓度分别为0、0.5、1、2、3、4、5、6、7、8、9、10μm。
26.所述标准曲线的线性方程为:i
560
/i
678
=0.0129 0.5314c,相关系数r2为0.997,c为cu
2
的浓度,单位为μm。
27.本发明还提供了一种硫离子的检测方法,所述检测方法包括以下步骤:分别将不
同浓度的s2‑
溶液、cu
2
溶液与邻苯二胺溶液混合,再分别向各体系中加入所述的碳量子点溶液、缓冲溶液,定容、孵育后,测试各体系在410nm的激发波长下的荧光发射光谱,用560nm、678nm波长处的荧光强度的比值i
560
/i
678
为横坐标,s2‑
溶液的浓度为横坐标作标准曲线,进而检测出待测液中的s2‑
浓度。
28.所述缓冲溶液为tris
‑
hcl缓冲溶液,其ph为7.9。
29.检测体系中,cu
2
、邻苯二胺、碳量子点、缓冲溶液的终浓度分别为9.5
‑
10.5μm、90
‑
110μm、25
‑
35mg/l、0.02
‑
0.03m。
30.所述cu
2
、邻苯二胺、碳量子点、缓冲溶液的终浓度分别优选为10μm、100μm、30mg/l、0.025m。
31.所述孵育的条件为37℃孵育2h;所述s2‑
溶液的终浓度分别为0、1、2、3、4、5、6、7、8、9、10、11、12μm。
32.所述标准曲线的线性方程为:i
560
/i
678
=5.40
‑
0.41c0,相关系数r2为0.997,c0为s2‑
的浓度,单位为μm。
33.本发明提供的技术方案中,通过溶剂萃取和溶剂热法相结合,以石楠绿叶为原料制备出了一种发红色荧光的生物基碳量子点(cds),该碳量子点在410nm波长光的激发下,会在678nm处出现一个荧光发射峰,cu
2
与cds表面羧基结合会导致cds在678nm处的荧光猝灭。cu
2
可以将邻苯二胺(opd)氧化,原位生成2,3
‑
二氨基吩嗪(dap),dap在紫外线照射下显示橙黄色荧光,并在560nm处有荧光发射峰,基于cu
2
的这种特殊作用,本发明设计了一种比率型荧光探针,对cu
2
进行定量检测。又由于cu
2
和s2‑
会反应生成cus,该物质的溶解度常数低(k
sp
=6.3
×
10
‑
36
)。因此,如果在加入cu
2
同时加入s2,由于cu
2
和s2‑
之间强大的结合能力,678nm处发射不会被猝灭,而560nm处的不会生成,因此此探针也可以对s2‑
进行检测。
34.本发明用于检测铜离子和硫离子方法中设计的比率型荧光探针比单发射荧光探针相比,在检测cu
2
和s2‑
离子过程中选择性好,不受其他物质干扰,即使是谷胱甘肽(gsh)、l
‑
半胱氨酸(l
‑
cys)也不会干扰,该方法可用于检测水体中的cu
2
和s2‑
离子,其检测的灵敏度和选择性均较好,对cu
2
和s2‑
的检出限可分别低至15.2nm和24.7nm。
附图说明
35.图1为实施例1制备的cds的透射电镜图;
36.图2为实施例1制备的cds的红外光谱图;
37.图3为实施例1制备的cds、cds cu
2
的荧光发射光谱,其中,cds终浓度30mg/l、cu
2
终浓度10μm;
38.图4为opd和opd中加铜离子后生成dap的荧光发射光谱,其中,opd终浓度100μm、cu
2
终浓度10μm;
39.图5为cds opd、cds opd cu
2
、cds opd cu
2
s2‑
的荧光发射光谱;其中,opd终浓度100μm、cds终浓度30mg/l、cu
2
终浓度10μm、s2‑
终浓度10μm;
40.图6为实施例3中的cds/opd体系检测cu
2
离子的荧光光谱图,其中,opd终浓度100μm;cds终浓度30mg/l;cu
2
终浓度分别为0,0.5,1,2,3,4,5,6,7,8,9,10μm;
41.图7为实施例3中的荧光强度比i
560
/i
678
与cu
2
浓度在0至10μm之间的标准曲线,其中,opd终浓度100μm;cds终浓度30mg/l;cu
2
终浓度分别为0,0.5,1,2,3,4,5,6,7,8,9,10μ
m;
42.图8为实施例4中的cds/opd/cu
2
体系检测s2‑
离子的荧光光谱图;其中,opd终浓度100μm;cds终浓度30mg/l;cu
2
终浓度10μm;s2‑
终浓度分别为:0,1,2,3,4,5,6,7,8,9,10,11,12μm;
43.图9为实施例4中的荧光强度比i
560
/i
678
与s2‑
浓度在0至12μm之间的标准曲线;其中,opd终浓度100μm;cds终浓度30mg/l;cu
2
终浓度10μm;s2‑
终浓度分别为:0,1,2,3,4,5,6,7,8,9,10,11,12μm;
44.图10为ph对cds/opd体系检测cu
2
离子的体系荧光强度比值(i
560
/i
678
)的影响,其中,opd终浓度100μm、cds终浓度30mg/l、cu
2
终浓度6μm;
45.图11为反应时间对cds/opd体系检测cu
2
离子的体系荧光强度比值(i
560
/i
678
)的影响。,其中,opd终浓度100μm、cds终浓度30mg/l、cu
2
终浓度8μm;
46.图12为cds/opd体系检测cu
2
离子的选择性实验图,其中,cu
2
终浓度10μm、其他阳离子浓度为cu
2
终浓度的10倍、opd终浓度100μm、cds终浓度30mg/l;
47.图13为cds/opd/cu
2
体系检测s2‑
离子的选择性实验图,其中,s2‑
终浓度12μm;其他阴离子的浓度为s2‑
终浓度的10倍;谷胱甘肽(gsh)、l
‑
半胱氨酸(l
‑
cys)的浓度为s2‑
终浓度的5倍;opd终浓度100μm;cds终浓度30mg/l;cu
2
终浓度10μm。
具体实施方式
48.下面结合实施例对本发明进行详细说明。
49.实施例中cu
2
的来源为氯化铜;s2‑
的来源为硫化钠。
50.本发明中所有的溶液如无特殊说明均为各物质的水溶液。
51.实施例1
52.一种以新鲜石楠绿叶为碳源的碳量子点的制备方法,包括以下步骤:
53.(1)取5g新鲜石楠绿叶,洗净干燥并切碎,在室温下加入30ml无水乙醇浸泡,12h后将溶液过滤并离心,所得离心液即为石楠绿叶提取液;
54.(2)取15ml石楠绿叶提取液和15ml纯水加入入到聚四氟乙烯不锈钢高压釜中,并将混合物在120℃下加热4h,冷却至室温后,离心分离得到清液,再用截留分子量为500da的透析袋纯水透析4小时,将产物转移置于真空干燥箱中干燥,重新溶解成为300mg/l的碳点水溶液。
55.其透射电镜图如图1所示,从透射电子显微镜(tem)图像可以看出所制备的cds大多是球形的并且是单分散的,粒径平均在12nm。
56.其红外图如图2所示,图中3418cm
‑1附近的宽峰对应于o
‑
h和n
‑
h伸缩振动,而在2926cm
‑1处的峰是c
‑
h伸缩振动。1689cm
‑1和1033cm
‑1处分别为c=o和c
–
o
–
c振动吸收峰,1638cm
‑1处的峰是由多环芳烃的c=c和c=n键的伸缩振动产生的。1456cm
‑1附近的周围的峰属于c
‑
n的伸缩振动。傅里叶红外光谱显示cds表面含有丰富亲水基团,并表明合成的cds具有良好的水分散性。
57.实施例2
58.实施例1中制备得到的cds检测cu
2
、s2‑
的机理
59.实施例1制备的cds在410nm的激发波长下的荧光发射光谱如图3所示,当向其中加
入微量的cu
2
溶液后,cds在678nm处的发射峰被猝灭。
60.cu
2
可以将无色邻苯二胺(opd)溶液氧化成带黄色荧光的2,3
‑
二氨基吩嗪(dap)。dap在560nm处出现一个新的荧光发射峰,如图4所示。因此可以联合cds和邻苯二胺设计一种比率荧光探针来检测cu
2
。
61.如图5所示,当往cds/opd体系中加入cu
2
离子后,678nm处的荧光强度(i
678
)下降,而560nm处的荧光强度(i
560
)增强,可以用荧光强度的比值i
560
/i
678
作为输出信号用于检测cu
2
的浓度。又由于cu
2
和s2‑
之间强大的结合能力,会结合生成极其微溶的cus,因此在检测cu
2
的基础上,也可以对s2‑
进行定量检测。如图5所示,当往cds/opd/cu
2
体系中加入s2‑
离子后,678nm处的荧光强度(i
678
)恢复增强,而560nm处的荧光强度(i
560
)恢复下降,可以用荧光强度的比值i
560
/i
678
作为输出信号用于检测s2‑
的浓度。
62.实施例3
63.cu
2
的定量检测方法,包括以下步骤:将不同浓度的cu
2
溶液和100μl 10
‑3mol/l新制opd溶液混合后,再依次往体系中加入100μl 300mg/l cds、500μl0.05m ph为7.9的tris
‑
hcl缓冲溶液充分混合定容到1000μl,放置在37℃下孵育2h,然后在410nm的激发波长下测各体系的荧光发射光谱,如图6所示。以560nm、678nm波长处的荧光强度的比值i
560
/i
678
为横坐标,cu
2
溶液的浓度为横坐标作标准曲线,如图7所示,进而检测出待测液中的cu
2
浓度。各体系中cu
2
的终浓度分别为0、0.5、1、2、3、4、5、6、7、8、9、10μm。
64.从图6中可以看出,随着cu
2
浓度的增加,cds/opd体系560nm处的荧光强度逐渐增强,而678nm处的荧光逐渐减弱。
65.从图7中可以看出,如果以560nm处的荧光强度为识别信号,678nm处的为参比信号,则荧光强度的比值i
560
/i
678
与cu
2
的浓度呈现良好的线性关系,线性方程为i
560
/i
678
=0.0129 0.5314c,相关系数r2为0.997,其中c为cu
2
的浓度,单位为μm。此方法可以检测0
‑
10μm的cu
2
。使用方程c
lim
=3δ/k确定的检测限(c
lim
)为15.2nmol/l,其中,δ是5次空白试验结果的标准偏差,k是标准曲线的斜率。
66.实施例4
67.s2‑
的定量检测方法,包括以下步骤:取100μl 10
‑4mol/l cu
2
溶液、100μl10
‑3mol/l新制opd溶液和不同浓度s2‑
溶液混合,再依次往体系中加入100μl300mg/lcds、100μl 0.05m ph为7.9的tris
‑
hcl缓冲溶液充分混合定容到1000μl,放在37℃下孵育2h,然后在410nm的激发波长下测各体系的荧光发射光谱,如图8所示。以560nm、678nm波长处的荧光强度的比值i
560
/i
678
为横坐标,s2‑
溶液的浓度为横坐标作标准曲线,如图9所示,进而检测出待测液中的s2‑
浓度。各体系中s2‑
的终浓度分别为0、1、2、3、4、5、6、7、8、9、10、11、12μm。
68.从图8中可以看出,当往cds/opd/cu
2
体系中加入s2‑
后,随着s2‑
浓度的增加,560nm处的荧光发射峰越来越弱,而678nm处的发射逐渐增强。这是由于cu
2
与s2‑
结合生成了溶解度极小的cus,体系中游离的cu
2
逐渐减少,生成的dap也会越来越少,与cds螯合的cu
2
也会相应减少。
69.从图9中可以看出,以荧光强度比i
560
/i
678
对s2‑
的浓度作图,发现荧光强度比随着s2浓度的增加逐渐降低,并且在1
‑
12μm范围内,荧光强度比i
560
/i
678
与s2‑
呈负相关,相关系数r2为0.997,该线性方程为i
560
/i
678
=5.40
‑
0.41c0,c0为s2‑
的浓度,单位为μm。使用方程c
lim
=3δ/k确定的检测限(c
lim
)为24.7nmol/l。
70.实验例5
71.tris
‑
hcl缓冲溶液的ph对检测体系的灵敏度的影响
72.将cu
2
溶液和新制opd溶液混合,再往体系中加入cds溶液、500μl不同ph的tris
‑
hcl缓冲溶液充分混合定容到1000μl,放在37℃下孵育2h,然后在410nm的激发波长下测各体系的荧光发射光谱,以tris
‑
hcl缓冲溶液的ph为横坐标,i
560
/i
678
为纵坐标作图,如图10所示。检测体系中,cu
2
溶液、新制opd溶液混合、cds溶液的终浓度分别为6μm、100μm、30mg/l。
73.从图中可见检测体系所使用的tris
‑
hcl缓冲溶液的ph的大小会影响比率荧光探针的灵敏度,所使用的tris
‑
hcl缓冲溶液的ph在7.9时,荧光强度比值(i
560
/i
678
)达到最大。因此在进行cu
2
和s2‑
检测时,选择ph=7.9的tris
‑
hcl缓冲溶液。
74.实验例6
75.孵育时间对检测体系的灵敏度的影响
76.将cu
2
溶液和新制opd溶液混合,再往体系中加入cds溶液、500μl ph为7.9的tris
‑
hcl缓冲溶液充分混合定容到1000μl,放在37℃下孵育不同的时间,然后在410nm的激发波长下测各体系的荧光发射光谱,以孵育时间为横坐标,i
560
/i
678
为纵坐标作图,如图11所示。检测体系中,cu
2
溶液、新制opd溶液混合、cds溶液的终浓度分别为8μm、100μm、30mg/l。
77.由图11可知,体系i
560
/i
678
随孵育时间的增加而增加,然后随反应时间的进一步增长逐渐保持稳定,为了反应更彻底,因此选择最佳反应时间为120分钟。
78.实施例7
79.选择性实验
80.一个性能优良的荧光探针,必须具有良好的选择性和抗干扰能力。首先设计实验研究了cds/opd比率荧光探针对cu
2
的选择性,在相同的实验条件下,分别选择了10μmol/l cu
2
、10倍浓度的其他阳离子(fe
2
、fe
3
、pb
2
、ni
2
、hg
2
、zn
2
、mg
2
、ca
2
、na
、al
3
、cd
2
、cr
3
、ce
4
、ag
)与cds/opd体系一起在37℃下孵育2h后,测定荧光强度计算i
560
/i
678
。如图12实验结果表明,除了cu
2
能使荧光强度比i
560
/i
678
明显增大以外,其它离子对此探针的影响几乎可以忽略。值得注意的是,fe
3
、hg
2
、ce
4
、ag
也可以氧化opd,但是它们对cds的荧光无猝灭作用,因此,不会干扰cu
2
的检测。
81.还评估了cds/opd/cu
2
体系对s2‑
检测过程的选择性,选择了12μmol/l s2‑
和10倍浓度的f
‑
、cl
‑
、br
‑
、clo
‑
、no2‑
、no3‑
、co
32
‑
、hco3‑
、so
32
‑
、po
43
‑
和5倍浓度的谷胱甘肽(gsh)、l
‑
半胱氨酸(l
‑
cys)作为潜在干扰物质,结果如图13所示,实验结果发现,此探针对s2的选择性远高于高倍浓度的其它离子或生物分子。因此,认为本发明所设计的比率型荧光探针具有良好的选择性和抗干扰能力。
82.实施例8
83.实际样品中cu
2
和s2‑
的测定
84.为了验证本发明所提供的检测方法的实用性,本发明通过标准加入法检测了实验室自来水中cu
2
和s2‑
浓度,结果列于表1和表2。
85.在实验室自来水中,没有检测到cu
2
和s2‑
的存在,本发明又加入了两种不同浓度用于回收实验,发现此方法的回收率在96.25
‑
103.8%之间,平均相对标准偏差控制在4%以内。这项数据表明此方法是实用且可靠的。
86.表1 自来水中cu
2
浓度的测定
[0087][0088]
表2 自来水中s2‑
浓度的测定
[0089][0090][0091]
上述参照实施例对一种以新鲜石楠绿叶为碳源的碳量子点的制备方法及铜离子和硫离子的检测方法进行的详细描述,是说明性的而不是限定性的,可按照所限定范围列举出若干个实施例,因此在不脱离本发明总体构思下的变化和修改,应属本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。