1.本发明涉及免疫治疗技术领域,尤其涉及一种基于淋巴细胞的同源靶向性人工抗原呈递细胞及其构建和应用。
背景技术:
2.肿瘤是威胁人类生存的一种恶性疾病。随着世界人口的老龄化以及生活环境和生活习惯的变化,因肿瘤死亡的人数每年都在急剧增加。目前,化疗和放疗是临床上除手术切外进行肿瘤治疗的主要方法,但是其具有很强的毒副作用。癌症免疫治疗是近年来的研究热点。抗原特异性cd8阳性t细胞活化在肿瘤免疫治疗中起重要作用。在此过程中,抗原呈递细胞(apc)通过i类主要组织相容性复合体(mhc
‑
i)向t细胞呈递肿瘤特异性抗原是关键步骤。之前的研究表明,由树突状细胞(dc)等专职apc摄取的肿瘤抗原需要通过交叉呈递,才能以抗原肽
‑
i类主要组织相容性复合体(pmhc
‑
i)的形式呈递到细胞表面。然而,自发抗原交叉呈递的效率是有限的,因此,已开发出dc细胞疫苗来激活患者体内肿瘤抗原特异性cd8阳性t细胞。dc细胞疫苗的制备,首先通过诱导自体干细胞分化获得dc细胞,然后通过人工干预增强体外肿瘤特异性抗原的交叉呈递。这是一个昂贵且劳动密集型的过程,且此类dc疫苗通过人工诱导交叉呈递,很难确保产品批次的稳定性。
3.人工抗原呈递细胞(aapc)是天然apc的模拟物,用于体外t细胞扩增,在过继免疫疗法中发挥重要作用。aapcs是通过化学手段将t细胞激活配体,包括pmhc(t细胞受体激活配体)和共刺激分子,修饰到生物相容性材料表面的来构建的。然而,之前报道的大多数aapcs都是用人工合成的纳米或微米级颗粒作为基质材料构建的,这些aapcs上的配体分布与天然apcs上的配体分布有很大不同。zhuang liu等(dna
‑
edited ligand positioning on red blood cells to enable optimized t cell activation for adoptive immunotherapy.angew.chem.int.ed.2020,59,14842
–
14853.)使用脂质功能化dna诱导的自组装技术,利用红细胞(rbc)构建了aapc。然而,这些aapcs都不能特异性迁移到有利于t细胞增殖的外周淋巴组织中的t细胞富集区域,因此无法在活体内实现最佳的自体抗原特异性t细胞活化效果。
技术实现要素:
4.为解决上述技术问题,本发明提供了一种基于淋巴细胞的同源靶向性人工抗原呈递细胞,能够在体内特异性迁移到外周淋巴器官,从而激活机体自身的抗原特异性cd8阳性t细胞,进而杀伤肿瘤细胞,抑制肿瘤生长,延长生存期。
5.本发明的一种基于淋巴细胞的同源靶向性人工抗原呈递细胞,以淋巴细胞为载体,还包括偶联在淋巴细胞表面的复合物和共刺激分子,其中,复合物由肿瘤抗原肽和主要组织相容性复合体i形成。
6.传统的基于合成材料的aapc和基于rbc的aapc都不能特异性迁移到外周淋巴组织
中的t细胞富集区域,这些区域是t细胞扩增的有利位置。本发明以淋巴细胞为载体构建的人工抗原呈递细胞,可以通过淋巴细胞表面的归巢受体靶向迁移到外周淋巴器官,包括脾脏和淋巴结,从而与外周淋巴器官中的t细胞发生紧密接触,进而有效激活机体自身的抗原特异性cd8阳性t细胞。
7.进一步地,基于淋巴细胞的同源靶向性人工抗原呈递细胞中,淋巴细胞与复合物通过双链dna连接,其中,淋巴细胞与双链dna通过脂质连接,复合物与双链dna通过非共价作用结合;
8.淋巴细胞与共刺激分子通过完全互补的双链dna连接,其中,淋巴细胞与双链dna的一条链通过脂质连接,共刺激分子与双链dna的另一条链连接。
9.进一步地,复合物与双链dna通过生物素和亲和素连接。dna和主要组织相容性复合体i的连接方式还可以是共价的,如dna一端修饰巯基,通过常用小分子双功能交联剂(smcc、sulfo
‑
smcc、spdp等)与蛋白表面氨基进行偶联。但是为了实现模拟天然apc表面主要组织相容性复合体的分布,在组装主要组织相容性复合体i时选用生物素
‑
亲和素连接。如果利用dna对主要组织相容性复合体i先进行共价修饰,再组装到细胞上,则无法模拟天然apc表面主要组织相容性复合体的分布。
10.进一步地,共刺激分子可与dna的另一条链共价结合或非共价结合,优选地,共刺激分子与dna的另一条链通过亲和素和生物素进行连接。
11.进一步地,淋巴细胞的表面分别修饰有单链dna1和单链dna2,其中,单链dna1由脂质和生物素双修饰且连接一个与其完全互补的单链cdna1,单链dna2由脂质修饰且连接一个与其完全互补的单链cdna2,单链cdna2由生物素修饰,复合物由生物素修饰,共刺激分子由生物素修饰;单链dna1与复合物通过亲和素特异性结合;单链cdna2与共刺激分子通过亲和素特异性结合。
12.现有技术中,采用一般化学偶联的方法将t细胞激活配体修饰在淋巴细胞表面会影响淋巴细胞表面受体蛋白的功能,尤其是归巢受体的功能。此外,在活细胞表面利用一般化学方法偶联t细胞激活配体也无法调控t细胞激活配体的分布,从而无法模拟天然抗原呈递细胞表面t细胞激活配体的分布形貌。本发明中,由肿瘤抗原肽和主要组织相容性复合体i形成的复合物以及共刺激分子通过dna、脂质、亲和素和生物素组装在淋巴细胞表面,其表面t细胞活化配体的分布形貌更加贴近于天然抗原呈递细胞,能够通过模拟天然apcs来精确控制aapcs上活化配体的空间分布,从而实现t细胞活化的优化。
13.进一步地,脂质包括固醇类和磷脂,如胆固醇、鞘磷脂、神经节苷脂或长链烷烃等。
14.进一步地,生物素为可与氨基反应的生物素,如n
‑
羟基琥珀酰亚胺生物素(主要组织相容性复合体i和共刺激分子上的氨基与n
‑
羟基琥珀酰亚胺生物素上的n
‑
羟基琥珀酰亚胺形成共价键)或羧基功能化的生物素(利用edc介导主要组织相容性复合体i和共刺激分子上的氨基和羧基偶联)。
15.进一步地,单链dna1中,脂质修饰在dna1的5’端,生物素修饰在dna1的3’端;单链cdna2中,生物素修饰在cdna2的5’端;单链dna2中,脂质修饰在dna2的5’端。
16.进一步地,淋巴细胞来源于自身外周血。外周血淋巴细胞主要包括t细胞和b细胞,取自身外周血目的是减轻排异反应。
17.进一步地,共刺激分子选自cd28抗体、cd40抗体、ox4o抗体、cd27抗体、cd137抗体
和gitr抗体中的一种或几种,优选为cd28抗体。
18.进一步地,肿瘤抗原肽选自肿瘤相关的抗原的肽、自身抗原的肽、同种异型抗原的肽和传染剂抗原的肽中的一种或几种,如ova
257
‑
264
,mc38肿瘤抗原肽。
19.进一步地,单链dna2和单链dna1的序列长度为15
‑
60碱基,优选为20
‑
30碱基,保证dna杂交的稳定性。
20.本发明要求保护上述基于淋巴细胞的同源靶向性人工抗原呈递细胞在制备肿瘤免疫治疗药物中的应用。
21.进一步地,当上述基于淋巴细胞的同源靶向性人工抗原呈递细胞应用在制备肿瘤免疫治疗药物中时,肿瘤抗原肽为从肿瘤中筛选出的抗原肽或同类型肿瘤中普遍存在的抗原肽。
22.本发明的一种肿瘤治疗制剂,包括上述基于淋巴细胞的同源靶向性人工抗原呈递细胞。
23.进一步地,肿瘤治疗制剂还包括pd1抗体。
24.进一步地,肿瘤治疗分多次进行,多次免疫可激发更强的免疫反应。
25.进一步地,上述肿瘤治疗制剂的给药方式为静脉注射。
26.进一步地,上述肿瘤治疗制剂可用于治疗结肠癌、黑色素瘤、乳腺癌、肺癌、头颈部肿瘤、胃癌、膀胱癌、骨癌、喉癌、肝癌、胰腺癌或鼻咽癌。
27.本发明上述人工抗原呈递细胞的构建方法,包括以下步骤:
28.(1)将主要组织相容性复合体i与生物素在缓冲液中反应,得到生物素修饰的主要组织相容性复合体i,将其与肿瘤抗原肽孵育结合,得到由肿瘤抗原肽和主要组织相容性复合体i形成的复合物;
29.将共刺激分子与生物素在缓冲液中反应,得到生物素修饰的共刺激分子,将其与亲和素孵育结合,得到亲和素修饰的共刺激分子,将其与生物素修饰的单链cdna2孵育结合,得到cdna2修饰的共刺激分子;
30.将淋巴细胞与脂质和生物素双修饰的单链dna1、cdna1在缓冲液中孵育结合,得到dna修饰的淋巴细胞,将dna修饰的淋巴细胞与亲和素在缓冲液中孵育结合,得到亲和素修饰的淋巴细胞;
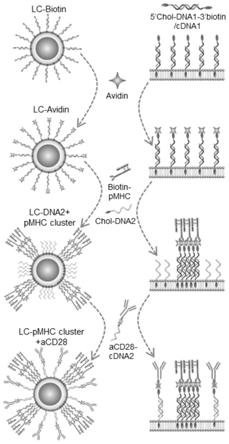
31.(2)将亲和素修饰的淋巴细胞、由肿瘤抗原肽和主要组织相容性复合体i形成的复合物、脂质修饰的单链dna2在缓冲液中孵育结合,得到复合物和dna2双修饰的淋巴细胞;
32.(3)将复合物和dna2双修饰的淋巴细胞与cdna2修饰的共刺激分子在缓冲液中孵育结合,得到基于淋巴细胞的同源靶向性人工抗原呈递细胞。构建流程示意图如图1所示。
33.进一步地,在步骤(1)中,主要组织相容性复合体i与生物素的摩尔比为1:20
‑
40,优选为1:20。
34.进一步地,在步骤(1)中,共刺激分子与生物素的摩尔比为1:10
‑
20。优选为1:10。
35.进一步地,在步骤(1)中,生物素修饰的共刺激分子与亲和素的摩尔比为1:3
‑
5,优选为1:3。
36.进一步地,在步骤(1)中,亲和素修饰的共刺激分子与生物素修饰的单链cdna2的摩尔比为1:6
‑
10,优选为1:6。
37.进一步地,在步骤(1)中,淋巴细胞与脂质和生物素双修饰的单链dna1的摩尔比为
1:1
×
107‑3×
107,优选为1:1
×
107。
38.进一步地,在步骤(1)中,淋巴细胞与cdna1的摩尔比为1:2
×
107‑6×
107,优选为1:2
×
107。
39.进一步地,在步骤(1)中,dna修饰的淋巴细胞与亲和素的摩尔比为1:5
×
107‑
1.5
×
108,优选为1:5
×
107。
40.进一步地,在步骤(2)中,亲和素修饰的淋巴细胞、由肿瘤抗原肽和主要组织相容性复合体i形成的复合物、脂质修饰的单链dna2的摩尔比为1:1
×
104‑5×
106:5
×
106‑1×
107。优选为1:1
×
104:5
×
106。
41.进一步地,在步骤(3)中,复合物和dna2双修饰的淋巴细胞、cdna2修饰的共刺激分子的摩尔比为1:1
×
104‑1×
106。
42.本发明的dna工程化的基于淋巴细胞的同源靶向性人工抗原呈递细胞制备过程中,通过主要组织相容性复合体i和共刺激分子上的氨基与生物素形成共价键对主要组织相容性复合体i和共刺激分子进行生物素修饰。通过脂质和细胞膜的自发结合,对淋巴细胞进行dna修饰。通过亲和素
‑
生物素特异性结合对共刺激分子进行dna修饰。共刺激分子通过dna特异性杂交偶联到淋巴细胞表面。由肿瘤抗原肽和主要组织相容性复合体i形成的复合物通过亲和素
‑
生物素特异性结合偶联到淋巴细胞表面,并由于多重亲和素
‑
生物素特异性结合而发生聚集,从而模拟天然抗原呈递细胞表面主要组织相容性复合体i的分布形貌。
43.借由上述方案,本发明至少具有以下优点:
44.(1)本发明提供了一种基于淋巴细胞的同源靶向性人工抗原呈递细胞,其可以在活体内靶向迁移到外周淋巴器官,与外周淋巴器官中的t细胞紧密接触,从而更有利于抗原特异性t细胞活化。
45.(2)本发明的基于淋巴细胞的同源靶向性人工抗原呈递细胞,相较于基于天然抗原呈递细胞的疫苗技术,更易控制其表面t细胞激活配体的数量,从而制备出批次间质量稳定的产品。此外,相较于基于天然抗原呈递细胞的疫苗技术,本发明无需细胞培养和诱导抗原交叉等过程,因此成本更低,同时可以在更短的时间内对病人施加治疗。
46.上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合详细附图说明如后。
附图说明
47.为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明。
48.图1为本发明基于淋巴细胞的同源靶向性人工抗原呈递细胞的构建流程示意图;
49.图2为实施例1在淋巴细胞表面组装pmhc
‑
i和cd28抗体激光共聚焦扫描显微镜成像图;
50.图3为实施例2中基于淋巴细胞的同源靶向性人工抗原呈递细胞用于体外抗原特异性t细胞扩增的结果图;
51.图4为实施例3中基于淋巴细胞的同源靶向性人工抗原呈递细胞用于活体外周淋巴器官靶向结果图;
52.图5为实施例4中基于淋巴细胞的同源靶向性人工抗原呈递细胞用于在活体刺激
外源性抗原特异性t细胞活化的结果图;
53.图6为实施例5中基于淋巴细胞的同源靶向性人工抗原呈递细胞用于在活体刺激内源性抗原特异性t细胞活化的结果图;
54.图7为实施例6中基于淋巴细胞的同源靶向性人工抗原呈递细胞联合免疫检查点抑制剂用于小鼠b16
‑
ova黑色素瘤模型个性化免疫治疗结果图;
55.图8为实施例7中基于淋巴细胞的同源靶向性人工抗原呈递细胞联合免疫检查点抑制剂用于小鼠mc38结肠癌皮下瘤模型化疗增敏中治愈小鼠的免疫记忆功能评价结果图。
具体实施方式
56.下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
57.实施例1
58.一种用于小鼠b16
‑
ova肿瘤模型治疗的基于淋巴细胞的同源靶向性人工抗原呈递细胞的制备和表征
59.(1)将20倍过量的n
‑
羟基琥珀酰亚胺atto488和n
‑
羟基琥珀酰亚胺生物素依次加入50μl 0.5mg/ml主要组织相容性复合体i(mhc
‑
i)中。在4℃下孵育1小时后,用100kda超滤管通过两次超滤去除过量的atto488和生物素。然后通过bca定量试剂盒检测修饰后的mhc
‑
i的浓度。一个mhc
‑
i上atto488的平均数量是通过紫外
‑
可见吸收来检测的。估计一个mhc
‑
i上生物素的平均数量与atto488相同。为了制备抗原肽和mhc
‑
i形成的复合物(pmhc
‑
i),将生物素和atto488标记的mhc
‑
i与ova
257
‑
264
肽在4℃下孵育8小时。然后,用100kda超滤管通过两次超滤去除多余的肽。pmhc
‑
i的浓度是通过bca蛋白定量试剂盒来测量的。
60.(2)将10倍过量的n
‑
羟基琥珀酰亚胺alexa647和n
‑
羟基琥珀酰亚胺生物素加入50μl 1mg/ml cd28抗体(acd28)。修饰后acd28的纯化按照与上述纯化修饰后pmhc
‑
i相同的方法进行。通过bca测定修饰后的acd28的浓度。通过紫外
‑
可见吸收检测一个acd28上alexa647的平均数量。估计一个cd28抗体上生物素的平均数量与alexa647相同。为了将dna连接到acd28上,首先将acd28
‑
alexa647
‑
生物素与4倍过量的亲和素在4℃下孵育30分钟。之后,将生物素标记的dna2(5'biotin
‑
cdna2)加入与抗生物素蛋白等摩尔量的抗体溶液中,然后孵育30分钟。
61.(3)使用毛细管从小鼠眼眶收集外周血,使用小鼠外周血白细胞分离试剂盒,按照厂商说明书进行密度梯度离心,获得淋巴细胞。细胞计数仪计数后,淋巴细胞(1
×
107)首先与5'胆固醇和3'生物素修饰的dna1(5'chol
‑
dna1
‑
3'生物素)(2μl,100μm)和cdna1(dna1与cdna1的摩尔比1:2)在4℃孵育15min。通过离心去除多余的dna后,将淋巴细胞重新悬浮在pbs中并进行计数。
62.(4)将细胞与5倍过量的亲和素在4℃下孵育30分钟。通过两次离心(1300rpm 3min)去除过量的亲和素后,将淋巴细胞重悬于pbs中并通过细胞计数器计数。
63.(5)将亲和素标记的淋巴细胞与atto488和生物素标记的pmhc
‑
i以及5'chol
‑
dna2分别以1:5
×
105和1:5
×
106的摩尔比混合,4℃孵育30分钟后,加入过量的生物素封闭亲和素上未结合的位点。随后,通过离心(1300rpm3min)去除多余的pmhc
‑
i和5'chol
‑
dna2。
64.(6)将淋巴细胞重悬于pbs缓冲液中,与5'biotin
‑
cdna2修饰的acd28按照摩尔比
1:5
×
105进行混合,4℃孵育1小时。过量的acd28通过两次离心(1300rpm 3min)去除。
65.(7)利用激光共聚焦扫描显微镜成像证明淋巴细胞表面是否成功偶联了pmhc
‑
i和acd28,并观察pmhc
‑
i的分布。
66.其中,dna1、cdna1、dna2和cdna2的序列信息如表1所示。
67.表1序列信息
[0068][0069]
结果如图2所示,激光共聚焦扫描显微镜对基于淋巴细胞的同源靶向性人工抗原呈递细胞的成像结果显示pmhc
‑
i和acd28成功偶联到了淋巴细胞表面,且pmhc
‑
i的分布呈聚集状态,模拟了天然抗原呈递细胞表面pmhc
‑
i的分布状态。
[0070]
实施例2
[0071]
一种基于淋巴细胞的同源靶向性人工抗原呈递细胞用于体外抗原特异性t细胞扩增
[0072]
(1)处死一只转基因的ot
‑
i小鼠,然后取出脾放入培养皿中并加入预冷的pbs。用注射器柄将脾脏磨碎,然后将组织破碎液收集到离心管中,以1300rpm离心,收集离沉淀,加入3ml红细胞裂解液。3min之后,加入3ml pbs终止裂解。离心后,用pbs重悬,通过400目无菌纱布进行过滤。离心后获得脾细胞(1300rpm 3)重悬于2ml pbs,并用细胞计数器进行计数。将2
×
107个脾细胞悬浮在10ml含有1μl 8mm cfse的pbs中。然后将细胞悬液在37℃细胞培养箱中培养15分钟。随后通过离心(1300rpm5min)收集cfse染色的细胞并重悬1640培养基中。
[0073]
(2)将2
×
105cfse染色的ot
‑
i小鼠脾细胞悬浮于250μl 1640培养基中,与实施例1所述步骤构建的基于淋巴细胞的同源靶向性人工抗原呈递细胞在圆底96孔板中以1:1的细胞比例孵育。作为对照,将2
×
105cfse染色的ot
‑
i小鼠脾细胞悬浮于250μl 1640培养基中,分别与游离的pmhc
‑
i和acd28,仅偶联了pmhc
‑
i的淋巴细胞,以及仅偶联了acd28的淋巴细胞进行孵育培养。孵育3天后,离心收集细胞(1300rpm 3min),上清液保存于
‑
20℃用于细胞因子检测。根据供应商的说明手册,使用elisa试剂盒检测ifnγ和tnfα。
[0074]
(3)通过流式细胞术检测cd8阳性t细胞增殖。将脾细胞重新悬浮在缓冲液中,并用pe标记的cd3抗体、percp标记的cd8抗体标记cd8阳性t细胞。pe和percp双阳性细胞被门控为cd8 t细胞。通过cfse荧光稀释程度来分析细胞增殖。
[0075]
结果如图3所示(a为流式结果图,b为流式结果统计图,c为培养上清细胞因子浓度测试结果统计图),可见基于淋巴细胞的同源靶向性人工抗原呈递细胞可以高效的刺激抗原特异性cd8阳性t细胞。
[0076]
实施例3
[0077]
基于淋巴细胞的同源靶向性人工抗原呈递细胞用于活体外周淋巴器官靶向
[0078]
(1)按照实施例1所述步骤制备的基于淋巴细胞的同源靶向性人工抗原呈递细胞,利用细胞膜染料did(λex/λem=644/663nm)进行染色。
[0079]
(2)以每只1
×
107个的数量通过尾静脉注射到小鼠体内。3天后处死小鼠,取脾脏和淋巴结制备细胞悬液。然后,将细胞用fitc标记的cd3抗体(acd3
‑
fitc)和pe标记的cd19抗体(acd19
‑
pe)染色,用于流式细胞仪分析。
[0080]
结果如图4所示(a
‑
b为流式结果显示基于淋巴细胞的同源靶向性人工抗原呈递细胞在脾脏中富集,c对应于a
‑
b的统计结果,d
‑
e为流式结果显示基于淋巴细胞的同源靶向性人工抗原呈递细胞在淋巴结中富集,f对应于d
‑
e的统计结果),表明dna工程化的基于淋巴细胞的同源靶向性人工抗原呈递细胞可以有效地迁移到外周淋巴器官,包括脾脏和淋巴结。
[0081]
实施例4
[0082]
基于淋巴细胞的同源靶向性人工抗原呈递细胞用于在活体刺激外源性抗原特异性t细胞活化
[0083]
(1)2
×
107个cfse染色的ot
‑
i小鼠的脾细胞通过尾静脉注射到c57小鼠体内,一天后,将5
×
106个按照实施例1制备的dna工程化的基于淋巴细胞的同源靶向性人工抗原呈递细胞也通过尾静脉注射到小鼠体内,以游离的pmhc
‑
i和acd28作为对照。
[0084]
(2)6天后取c57小鼠脾脏和淋巴结,制备脾细胞和淋巴结细胞悬液。然后用pe标记的cd3抗体和percp标记的cd8抗体对2
×
106个脾细胞或淋巴结细胞悬液进行染色。然后在除去过量抗体后通过流式细胞术分析。pe阳性细胞群被划为t细胞,percp和cfse双阳性细胞用于以检测cfse稀释程度。
[0085]
结果如图5(a为不同处理下脾脏中外源性抗原特异性t细胞增殖流式结果图,b对应于图a结果的统计结果,c为不同处理下淋巴结中外源性抗原特异性t细胞增殖流式结果图,d对应于图c结果的统计结果),相比对照组,基于淋巴细胞的同源靶向性人工抗原呈递细胞可以有效地刺激ot
‑
i小鼠来源的抗原特异性cd8阳性t细胞的活化。
[0086]
实施例5
[0087]
基于淋巴细胞的同源靶向性人工抗原呈递细胞用于在活体刺激内源性抗原特异性t细胞活化
[0088]
(1)将5
×
106个按照实施例1制备的基于淋巴细胞的同源靶向性人工抗原呈递细胞通过尾静脉直接注射到c57小鼠中。
[0089]
(2)3天后取c57小鼠脾脏制备脾细胞。cfse染色后,2
×
105个脾细胞重悬于250μl 1640培养基中,37℃培养于圆底96孔板中。然后加入或不加入ova
257
‑
264
肽(1μg/孔)。培养3天后,收集细胞,用pe标记的cd3抗体和percp标记的cd8抗体对cd8阳性t细胞进行标记。然后在除去过量抗体后通过流式细胞术分析
[0090]
结果如图6显示(a为未注射人工抗原呈递细胞的小鼠脾脏细胞加与不加抗原肽刺激后cd8阳性t细胞增殖流式结果图,b为注射人工抗原呈递细胞的小鼠脾脏细胞加与不加抗原肽刺激后cd8阳性t细胞增殖流式结果图,c对应于图a和b的统计结果图),相比对照组,基于淋巴细胞的同源靶向性人工抗原呈递细胞可以有效地内源性抗原特异性cd8阳性t细胞的活化。
[0091]
实施例6
[0092]
基于淋巴细胞的同源靶向性人工抗原呈递细胞联合免疫检查点抑制剂用于小鼠b16
‑
ova黑色素瘤模型个性化免疫治疗
[0093]
通过在雌性c57小鼠的背部皮下注射1
×
106(悬浮于50μl pbs中)个b16
‑
ova细胞来接种小鼠b16
‑
ova黑色素瘤模型。接种肿瘤10天后,将小鼠分为4组进行治疗:1.不治疗;2.pd1抗体治疗;3.按照实施例1制备的基于淋巴细胞的同源靶向性人工抗原呈递细胞治疗;4.按照实施例1制备的基于淋巴细胞的同源靶向性人工抗原呈递细胞联合pd1抗体治疗。人工抗原呈递细胞的第一次输入在肿瘤接种后第10天进行,第二次输入在第16天进行。在第12天、第15天和第18天,以每只小鼠15μg的剂量静脉注射pd1抗体。期间密切监测不同组小鼠的肿瘤体积和存活率。
[0094]
结果如图7(a为治疗流程图,b为不同处理组小鼠肿瘤生长曲线,c为不同处理组小鼠生存曲线),按照实施例1制备的基于淋巴细胞的同源靶向性人工抗原呈递细胞联合pd1抗体治疗可以有效抑制肿瘤生长,延长小鼠生存期。
[0095]
实施例7
[0096]
基于淋巴细胞的同源靶向性人工抗原呈递细胞联合免疫检查点抑制剂用于小鼠mc38模型免疫治疗
[0097]
(1)基于淋巴细胞的同源靶向性人工抗原呈递细胞的制备按照实施例1所述步骤进行,只是将ova
257
‑
264
肽替换为mc38新抗原肽,序列为siivfnll(从氮末端到碳末端)。
[0098]
(2)通过在雌性c57小鼠的背部皮下注射1
×
106(悬浮于50μl pbs中)个mc38肿瘤细胞来接种小鼠mc38结肠癌模型。接种肿瘤5天后,将小鼠分为4组进行治疗:1.不治疗;2.pd1抗体治疗;3.dna工程化的基于淋巴细胞的同源靶向性人工抗原呈递细胞治疗;4.dna工程化的基于淋巴细胞的同源靶向性人工抗原呈递细胞联合pd1抗体治疗。人工抗原呈递细胞的第一次回输在肿瘤接种后第5天进行,第二次回输在第11天进行。在第7天、第10天和第13天,以每只小鼠15μg的剂量静脉注射pd1抗体。期间密切监测不同组小鼠的肿瘤体积和存活率。
[0099]
结果如图8(a为治疗流程图,b为不同处理组小鼠肿瘤生长曲线,c为不同处理组小鼠生存曲线),可见基于淋巴细胞的同源靶向性人工抗原呈递细胞联合pd1抗体治疗可以有效抑制肿瘤生长,延长小鼠生存期。
[0100]
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
[0101]
[0102]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

