1.本技术涉及生物技术领域,特别是涉及一种噬菌体制剂的制备方法、药物组合物以及应用。
背景技术:
2.在制备噬菌体的原始液中由于细菌的裂解,含有大量的毒副产物,如内毒素、肽聚糖、细菌染色体和其他不明物质等杂质,这些杂质在进入人体后会引起机体严重的炎症反应甚至败血症性休克。这限制了噬菌体在临床的大规模应用。
3.本技术发明人在长期研发过程中,发现已有多种方法可去除噬菌体原始液中的杂质,在各大实验室常用的有:使用聚乙二醇富集噬菌体,随后再用氯仿去除引入的聚乙二醇;直接使用正辛醇萃取内毒素;或者使用层析(阴离子交换柱)柱纯化噬菌体等方法。但这些方法引入了有机溶剂,对人体健康是有潜在风险的,并且这些方法也存在噬菌体浓度不稳定,内毒素去除效果不佳等问题。
技术实现要素:
4.本技术实施例提供了一种噬菌体制剂的制备方法、药物组合物以及应用,以快速、低成本、高效地去除噬菌体制剂中的内毒素。
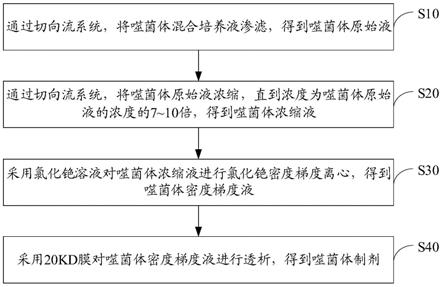
5.为解决上述技术问题,本技术采用的一个技术方案是:提供一种噬菌体制剂的制备方法,该方法包括:通过切向流系统,将噬菌体混合培养液渗滤,得到噬菌体原始液;通过切向流系统,将噬菌体原始液浓缩,直到浓度为噬菌体原始液的浓度的7~10倍,得到噬菌体浓缩液;采用氯化铯溶液对噬菌体浓缩液进行氯化铯密度梯度离心,得到噬菌体密度梯度液;采用20kd膜对噬菌体密度梯度液进行透析,得到噬菌体制剂。
6.为解决上述技术问题,本技术采用的另一个技术方案是:提供一种药物组合物,该药物组合物包括:如前述的方法制备得到的噬菌体制剂;药学上可接受的载体、赋形剂或稀释剂中的至少一种。
7.为解决上述技术问题,本技术采用的又一个技术方案是:提供一种如前述的方法制备肺炎克雷伯菌噬菌体制剂、鲍曼不动杆菌噬菌体制剂、铜绿假单胞菌噬菌体制剂中的应用。
8.本技术的有益效果是:区别于现有技术的情况,本技术能够快速、低成本、高效地去除噬菌体制剂中的内毒素,其中,切向流系统具有高通量、可反复使用的优点,采用切向流系统过滤结合切向流系统浓缩,可以实现快速、高效、低成本的噬菌体混合培养液的渗滤和噬菌体原始液的浓缩;此外,通过氯化铯密度梯度离心结合透析去除氯化铯,可高效、快速地获得高纯度的噬菌体制剂。
附图说明
9.为了更清楚地说明本技术实施例中的技术方案,下面将对实施例描述中所需要使
用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。其中:
10.图1为本技术噬菌体制剂的制备方法一实施例的流程示意图;
11.图2为图1中步骤s10的流程示意图;
12.图3为图1中步骤s20的流程示意图;
13.图4为图1中步骤s30的流程示意图;
14.图5为图1中步骤s40的流程示意图;
15.图6为本技术噬菌体制剂的制备方法另一实施例的流程示意图;
16.图7为本技术噬菌体制剂的制备方法又一实施例的流程示意图;
17.图8a是实施例3中首剂后1小时、6小时、24小时、72小时检测小鼠血液中炎性指标tnf
‑
α的结果;
18.图8b是实施例3中首剂后1小时、6小时、24小时、72小时检测小鼠血液中炎性指标kc/gro的结果;
19.图8c是实施例3中首剂后1小时、6小时、24小时、72小时检测小鼠血液中炎性指标il
‑
6的结果;
20.图8d是实施例3中首剂后1小时、6小时、24小时、72小时检测小鼠血液中炎性指标il
‑
10的结果;
21.图8e是实施例3中首剂后1小时、6小时、24小时、72小时检测小鼠血液中炎性指标il
‑
4的检测结果;
22.图8f是实施例3中首剂后1小时、6小时、24小时、72小时检测小鼠血液中炎性指标il
‑
2的结果;
23.图8g是实施例3中首剂后1小时、6小时、24小时、72小时检测小鼠血液中炎性指标il
‑
1β的结果;
24.图8h是实施例3中首剂后1小时、6小时、24小时、72小时检测小鼠血液中炎性指标ifn
‑
γ的结果;
25.图8i是实施例3中首剂后1小时、6小时、24小时、72小时检测小鼠血液中炎性指标il
‑
5的结果;
26.图9a是实施例3中第二剂后24小时检测小鼠血液中白细胞计数的结果;
27.图9b是实施例3中第二剂后24小时检测小鼠血液中红细胞计数的结果;
28.图9c是实施例3中第二剂后24小时检测小鼠血液中血小板计数的结果;
29.图9d是实施例3中第二剂后24小时检测小鼠血液中血红蛋白量的结果;
30.图9e是实施例3中第二剂后24小时检测小鼠血液中淋巴细胞计数的结果;
31.图10是实施例3中第二剂后24小时,小鼠脾脏病理切片的苏木精
‑
伊红染色结果。
具体实施方式
32.下面将结合本技术实施例中的附图,对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性的劳动前提下所获得的所有其他
实施例,都属于本技术保护的范围。
33.本技术提供一种噬菌体制剂的制备方法,如图1所示,图1为本技术噬菌体制剂的制备方法一实施例的流程示意图。该方法包括以下步骤:
34.s10:通过切向流系统,将噬菌体混合培养液渗滤,得到噬菌体原始液。
35.s20:通过切向流系统,将噬菌体原始液浓缩,直到浓度为噬菌体原始液的浓度的7~10倍,得到噬菌体浓缩液。
36.s30:采用氯化铯溶液对噬菌体浓缩液进行氯化铯密度梯度离心,得到噬菌体密度梯度液。
37.s40:采用20kd膜对噬菌体密度梯度液进行透析,得到噬菌体制剂。
38.区别于现有技术的情况,本技术能够快速、低成本、高效地去除噬菌体制剂中的内毒素,其中,切向流系统具有高通量、可反复使用的优点,采用切向流系统过滤结合切向流系统浓缩,可以实现快速、高效、低成本的噬菌体混合培养液的渗滤和噬菌体原始液的浓缩;此外,通过氯化铯密度梯度离心结合透析去除氯化铯,可高效、快速地获得高纯度的噬菌体制剂。
39.在一实施例中,上述实施例中的切向流系统至少包括:第一储罐、进样管、回流管、滤出管、蠕动泵、膜包装置、第二储罐,蠕动泵包括滚轮,进样管夹在滚轮之间以蠕动进样管中的液体,其中,进样管的一端和回流管的一端置于第一储罐中,滤出管单独放入第二储罐内。
40.如图2所示,图2为图1中步骤s10的流程示意图。该步骤s10包括以下步骤:
41.s11:待噬菌体混合培养液中的宿主菌裂解完全,高速离心噬菌体混合培养液,得到上清液。
42.s12:通过切向流系统过滤上清液,其中,将第一储罐内的上清液从进样管进入膜包装置,从回流管流出的液体回流到第一储罐中,滤出液从滤出管流出至第二储罐内,得到噬菌体原始液。
43.s13:使用lb液体培养基梯度稀释噬菌体原始液,通过双层琼脂平板法对噬菌体原始液的噬菌体浓度进行计数。
44.在一实施例中,上述实施例中的切向流系统包括:第一储罐、进样管、回流管、滤出管、蠕动泵、膜包装置、第二储罐、第三储罐,蠕动泵包括滚轮,进样管夹在滚轮之间以蠕动进样管中的液体,其中,进样管的一端和回流管的一端置于第一储罐中,滤出管单独放入第二储罐内。
45.如图3所示,图3为图1中步骤s20的流程示意图。该步骤s20包括以下步骤:
46.s21:将第一储罐内的噬菌体原始液从进样管进入膜包装置,从回流管流出的液体回流到第一储罐中,第一滤出液从滤出管流出至第二储罐内,直至第一储罐内剩余第一预设体积量的噬菌体原始液。
47.s22:在第三储罐内加入指定体积量的lb液体培养基,将第三储罐内的lb液体培养基从进样管进入膜包装置,从回流管流出的液体回流到第三储罐中,第二滤出液从滤出管流出至第二储罐内,直至所述第三储罐内剩余第二预设体积量的噬菌体第二浓缩液。
48.s23:合并第一储罐内剩余的噬菌体原始液和第三储罐内剩余的噬菌体第二浓缩液,得到噬菌体浓缩液。
49.s24:使用lb液体培养基梯度稀释噬菌体浓缩液,通过双层琼脂平板法对噬菌体浓缩液的噬菌体浓度进行计数。
50.如图4所示,图4为图1中步骤s30的流程示意图。该步骤s30包括以下步骤:
51.s31:提供一离心管,其中,离心管内的底部为第一浓度的cscl溶液,离心管内的中部为第二浓度的cscl溶液,离心管内的上部为第三浓度的cscl溶液,第一浓度大于第二浓度,第二浓度大于第三浓度。
52.s32:将一部分噬菌体浓缩液加入离心管,向离心管的底部依次注入第三浓度的cscl溶液、第二浓度的cscl溶液、第一浓度的cscl溶液。
53.s33:对离心管内的各个分层进行离心处理,抽吸出噬菌体密度梯度液。
54.如图5所示,图5为图1中步骤s40的流程示意图。该步骤s40包括以下步骤:
55.s41:以噬菌体保存缓冲液为透析液,采用20kd膜对噬菌体密度梯度液进行多次透析,得到纯化后的噬菌体制剂。
56.s42:通过双层琼脂平板法对噬菌体制剂的噬菌体浓度进行计数。
57.本技术提供一种噬菌体制剂的制备方法,如图6所示,图6为本技术噬菌体制剂的制备方法另一实施例的流程示意图。
58.s50:复苏宿主菌。
59.s60:按预设比例将噬菌体加入包含宿主菌的培养基中,复苏噬菌体。
60.s70:扩大培养噬菌体,得到噬菌体混合培养液。
61.s10:通过切向流系统,将噬菌体混合培养液渗滤,得到噬菌体原始液。
62.s20:通过切向流系统,将噬菌体原始液浓缩,直到浓度为噬菌体原始液的浓度的7~10倍,得到噬菌体浓缩液。
63.s30:采用氯化铯溶液对噬菌体浓缩液进行氯化铯密度梯度离心,得到噬菌体密度梯度液。
64.s40:采用20kd膜对噬菌体密度梯度液进行透析,得到噬菌体制剂。
65.在一实施例中,上述预设比例为:噬菌体数量与宿主菌数量之间的比值为:1:10。
66.本技术提供一种噬菌体制剂的制备方法,如图7所示,图7为本技术噬菌体制剂的制备方法又一实施例的流程示意图。该方法包括以下步骤:
67.s10:通过切向流系统,将噬菌体混合培养液渗滤,得到噬菌体原始液。
68.s20:通过切向流系统,将噬菌体原始液浓缩,直到浓度为噬菌体原始液的浓度的7~10倍,得到噬菌体浓缩液。
69.s30:采用氯化铯溶液对噬菌体浓缩液进行氯化铯密度梯度离心,得到噬菌体密度梯度液。
70.s40:采用20kd膜对噬菌体密度梯度液进行透析,得到噬菌体制剂。
71.s80:使用内毒素检测鲎试剂盒检测噬菌体制剂的内毒素浓度。
72.本技术提供一种药物组合物,药物组合物包括:噬菌体制剂、以及药学上可接受的载体、赋形剂或稀释剂中的至少一种。
73.其中,噬菌体制剂为上述实施例的制备方法制备得到的噬菌体制剂。
74.本技术提供的方法上述实施例的制备方法制备得到的肺炎克雷伯菌噬菌体制剂、鲍曼不动杆菌噬菌体制剂、铜绿假单胞菌噬菌体制剂中的应用。
75.为了可以更好地理解本技术,记载以下实施例。这些实施例仅用于说明的目的,并且不应被解释为以任何方式限制本技术的范围。
76.实施例1
77.以铜绿假单胞菌噬菌体pa39为例,介绍本技术的噬菌体制剂的制备方法。
78.步骤1:复苏宿主菌。
79.具体如下:取出
‑
80℃保存铜绿假单胞菌pao1菌株,lb无抗平板划线,8小时后,挑单菌落到10ml lb培养基,隔夜培养(摇床37℃,摇床转速150rpm))。
80.步骤2:复苏噬菌体。
81.具体如下:取0.5ml菌液加入20ml lb培养基,培养2小时(摇床37℃,摇床转速150转/分钟(revolutions per minute,rpm)后,从噬菌体库中取样噬菌体pa39,加入噬菌体与宿主菌数量的比值为1:10,继续培养(摇床37℃,摇床转速150rpm)。待宿主菌裂解完全,约4小时后,高速离心混合培养液(8000rpm,10min),取上清液通过0.22μm滤膜过滤,过滤液即时复苏后的噬菌体。使用lb液体培养基梯度对原始液进行倍比稀释至10
‑8,通过双层琼脂平板法对噬菌体浓度进行计数。详细操作如下:向灭菌八连管中(最大250μl体积)加入90μl lb液体培养基,共8个稀释度,分别编号10
‑1、10
‑2、10
‑3、10
‑4、10
‑5、10
‑6、10
‑7和10
‑8。取10μl噬菌体原液,注入10
‑1的管中,使用100μl移液枪反复吹打3~5次,从10
‑1管中吸10μl加入10
‑2管中,混匀,余类推,稀释至10
‑
8管。准备好lb琼脂平板,熔化lb软琼脂(琼脂浓度0.75%)培养基,并在50度下保温;将铜绿假单胞杆菌pao1的过夜培养液摇匀,取菌液0.5ml加入含有15ml的lb软琼脂培养基的试管中,轻晃混匀。将该培养基迅速倒入底层琼脂平板上,放在台面上摇匀,使上层培养基铺满平板;凝固后,取稀释好的不同浓度的噬菌体样品10μl,点于该平板上,待液体晾干后,置37℃过夜培养。观察平板中的噬菌斑,将每一稀释度的噬菌斑形成单位记录于实验报告表格内,并选取10~50个pfu数的平板计算每毫升未稀释的原液的噬菌体浓度;噬菌体浓度=噬菌斑形成数(pfu)
×
稀释倍数
×
100,其中,噬菌体浓度为4
×
109pfu/ml。
82.步骤3:复苏宿主菌。
83.具体如下:重新挑取单菌落到100ml lb培养基,隔夜培养(摇床37℃,摇床转速150rpm)。
84.步骤4:2l体系扩培噬菌体。
85.具体如下:取50ml菌液加入2l lb培养基,培养(摇床37℃,摇床转速150rpm))2小时后,加入复苏后的噬菌体pa39,噬菌体与宿主菌数量的比值为1:10(不同噬菌体该比值可不同),继续培养(摇床37℃,摇床转速150rpm),得到噬菌体混合培养液。
86.步骤5:通过切向流系统渗滤噬菌体混合培养液。
87.具体如下:待宿主菌裂解完全,约4小时后,离心噬菌体混合培养液(其中,离心转速8000rpm,10min),取上清液通过切向流系统过滤(切向流系统的过滤膜包孔径为0.22μm)。先将进样管通过蠕动泵,随后将进样管和回流管置于储罐内的上清液中,将滤出管单独放入无菌的1l空瓶内;储罐内的上清液从进样管进入切向流系统,滤出液从切向流系统中的侧后方的滤出管流出,即为噬菌体原始液;而从切向流系统的回流管流出的液体回流到储罐内,直到储罐内的所有上清液均从滤出管滤出,过滤结束。
88.使用lb液体培养基梯度对噬菌体原始液进行倍比稀释至10
‑8,通过双层琼脂平板
法对噬菌体原始液的噬菌体浓度进行计数,其中,噬菌体浓度为4
×
109pfu/ml。
89.步骤6:通过切向流系统浓缩噬菌体原始液。
90.具体如下:将噬菌体原始液通过切向流系统(超滤膜包的孔径为100kda)进行浓缩。先将进样管通过蠕动泵,随后将进样管和回流管置于储罐内的噬菌体原始液中,将滤出管单独放入无菌的1l空瓶内;滤出液从滤出管流出;回流管中流出的液体回流到储罐中;该系统不断的滤出液体,直到储罐内的噬菌体原始液仅剩约50ml时,暂停该切向流系统的工作。储罐内剩余的噬菌体原始液即为第一浓缩液。然后加入400ml lb液体培养基到另一储罐中,以它作为样品,再次通过切向流系统,获得约50ml的第二浓缩液。将第一浓缩液和第二浓缩液结合,最终获得约100ml噬菌体浓缩液。
91.使用lb液体培养基梯度对噬菌体浓缩液进行倍比稀释至10
‑8,通过双层琼脂平板法对噬菌体浓缩液的噬菌体浓度进行计数,计数方法同上,其中,噬菌体浓度为3
×
10
10
pfu/ml。
92.步骤7:将噬菌体浓缩液通过氯化铯密度梯度离心进行纯化。
93.具体如下:将20ml噬菌体浓缩液加入离心管(最大体积40ml),离心管内的底部为第一浓度(1.7g/l)的cscl溶液,离心管内的中部为第二浓度(1.5g/l)的cscl溶液,离心管内的上部为第三浓度(1.3g/l)cscl溶液。构建浓度梯度时,先加20ml噬菌体浓缩液,随后在巴斯德吸管中吸入4ml第三浓度(1.3g/l)的cscl溶液,将其头部触碰到离心管底部,缓慢注入,可见明显的页面分层;随后在离心管底部注入4ml第二浓度(1.5g/l)的cscl溶液,最后离心管底部注入4ml第二浓度(1.7g/l)的cscl溶液。
94.步骤8:离心处理。
95.具体如下:使用himac超速离心机离心2小时(4℃,24000rpm)。离心完成后,在不同浓度的cscl溶液之间可见一层白褐色分层(如见多个分层,需将各个分层分别取样),用注射器针头在噬菌体平面以下2mm左右的位置进针抽吸出所有白褐色分层,一个离心管可抽吸出约3ml的噬菌体密度梯度液。
96.步骤9:以噬菌体保存缓冲液为透析液,采用20kda透析膜对噬菌体密度梯度液进行多次透析,得到纯化后的噬菌体制剂。
97.具体如下:以噬菌体保存缓冲液(sm buffer)为透析液,采用20kda透析膜对噬菌体密度梯度液进行多次透析,去除噬菌体样品中的氯化铯,每次透析使用5l透析液,每隔4小时更换一次透析液,至少透析3次,最终得到约15ml纯化后的噬菌体制剂。
98.使用双层琼脂平板法检测噬菌体制剂的噬菌体浓度,其中,噬菌体浓度为2
×
10
11
pfu/ml。
99.步骤10:使用内毒素检测鲎试剂盒检测噬菌体制剂的内毒素浓度。
100.具体如下:使用内毒素检测鲎试剂盒(试管定量显色基质法,厦门鲎试剂生物科技有限公司,ec80545)检测噬菌体制剂的内毒素浓度。该检测试剂盒是利用人工合成的显色基质配套的偶氮化试剂使鲎试剂产生的玫瑰红显色反应定量检测内毒素。该试剂盒检测范围为0.1
‑
1eu/ml。严格按照操作手册进行实验,测得上述步骤5制得的噬菌体原始液的内毒素浓度约为10000eu/ml,测得上述步骤9制得的噬菌体制剂的内毒素含量为500eu/ml。将上述步骤9制得的噬菌体制剂进行倍比稀释至噬菌体浓度为109pfu/ml后,测得每毫升稀释后的噬菌体制剂的内毒素含量为2.5eu。
101.实施例2
102.采用本技术噬菌体制剂的制备方法制备铜绿假单胞菌噬菌体pa39、鲍曼不动杆菌噬菌体ab6、鲍曼不动杆菌噬菌体ab_sz3以及肺炎克雷伯菌噬菌体kph,其中,制作步骤可参考上述噬菌体制剂的制备方法的实施例。
103.检测上述实施例2中各噬菌体原始液的内毒素浓度、各噬菌体制剂的噬菌体浓度、各噬菌体制剂的内毒素浓度、以及将噬菌体制剂进行倍比稀释至噬菌体浓度为109pfu/ml后每毫升稀释后的噬菌体制剂的内毒素含量(以下简称为:109pfu单位剂量的内毒素含量)。检测结果如下表1所示。
104.表1各噬菌体制剂的噬菌体浓度、内毒素浓度以及噬菌体原始液的内毒素浓度
105.[0106][0107]
美国食品药品管理局((food and drug administration,fda)规定规定内毒素入血的标准为小于5eu/kg
×
h,以成人(50kg)单次给药为例,即在1小时内可接受的内毒素含量最大为250eu,而在临床上应用时,一般推荐噬菌体的单次使用剂量为109pfu。如表1所示,将本技术噬菌体制剂进行倍比稀释至噬菌体浓度为109pfu/ml后,每毫升稀释后的噬菌体制剂的内毒素含量均低于250eu,可直接应用于临床治疗,适用于各种应用场景包括雾化、静脉注射、肌肉注射、外敷、冲洗等。
[0108]
实施例3
[0109]
本技术研究了实施例1制得的铜绿假单胞菌噬菌体pa39制剂在静脉注射时对小鼠机体的影响。
[0110]
本实施例将小鼠分为四组,每组6例,分别是溶媒对照组、低剂量组(2
×
108pfu/kg/)、中剂量组(2
×
10
10
pfu/kg)、高剂量组(2
×
10
11
pfu/kg),将不同浓度铜绿假单胞菌噬菌体pa39制剂经尾静脉注入小鼠体内,分两次给药,首剂后3天再给第二剂。
[0111]
结果表明经实施例1制得的铜绿假单胞菌噬菌体pa39制剂在静脉注射到小鼠体内后不会对其机体产生明显毒副作用。详细结果如下:
[0112]
如图8a~8i所示,在首剂后1小时、6小时、24小时、72小时检测小鼠血液中炎症指标。在中剂量组、高剂量组中,1小时后小鼠部分炎性指标升高,在24小时后,炎性指标基本回落到正常水平,在低剂量组中未见明显炎症指标变化。
[0113]
在第二剂后24小时,采集小鼠血液,分析血常规及各项生化指标。如图9a~9e所示,显示各组各项指标均在正常范围内波动。
[0114]
同时在第二剂后,解剖小鼠。低、中、高剂量组皮肤、被毛、嘴唇及口腔、心、肝、脾、肺、胸腺、肾、肾上腺、胰腺、胃肠道、睾丸和附睾、子宫和卵巢等未见肉眼形态学改变。在高剂量组中,有3例的脾脏出现相关的组织病理学改变,表现为白髓淋巴细胞增多(如图10所示),该结果提示铜绿假单胞菌噬菌体pa39制剂可引起机体免疫反应;理论上如果后期继续观察该组,随着噬菌体的清除,脾脏可恢复正常,有待进一步实验验证。其他受检心脏、肝脏、肺、脑、十二指肠、及给药部位等组织未见明显组织病理学变化。
[0115]
以上所述仅为本技术的实施方式,并非因此限制本技术的专利范围,凡是利用本技术说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本技术的专利保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

