heck串联反应合成吲哚萜类似物的方法
技术领域
1.本发明涉及heck串联反应合成吲哚萜类似物的方法,属于有机化学中的不对称合成技术领域。
背景技术:
2.吲哚萜类化合物是一类重要的天然产物,具有广泛的生物活性。目前,化学合成吲哚萜类化合物的策略主要有两大类:一是环萜化合物与吲哚的偶联策略。例如李昂采用手性原料与吲哚格氏试剂进行羰基加成得到中间体,再经分子内环化、脱保护得到天然产物xiamycin a(式a);sarpong通过吲哚锂试剂与手性化合物加成合成了天然产物xiamycin a(式b);dethe报道了环萜与吲哚偶联策略合成mycoleptodiscin a(式c)。
[0003][0004]
二是在合成环萜化合物上构筑吲哚环的策略。例如李昂以乙酸金合欢酯为原料,经金属铱催化的不对称环化、氧化等得到苯并倍半萜中间体,然后经羰基还原、氰基化、氨甲基化、n
‑
h芳基化等步骤分子内构筑吲哚环,从而合成mycoleptodiscin a(式e);高栓虎利用自开发分子内光致烯醇化/[4 2]环加成反应,以香紫苏内酯为原料,经开环、分子内环加成等步骤同样得到中间体,再根据文献方法构筑吲哚环合成mycoleptodiscin a(式f)。另外,indolototarol的合成中也属于该策略(式g)。
[0005][0006]
以heck环化反应构筑吲哚骨架,以不对称去芳构化反应构筑手性环萜骨架,一步实现手性吲哚萜类骨架的构筑策略尚未见报道。
技术实现要素:
[0007]
为了解决上述技术问题,本发明首先提供了一种结构新型的吲哚萜类似物,结构如下:
[0008][0009]
其中,r选自ts、ns、4
‑
t
bu
‑
c6h4so2、4
‑
meo
‑
c6h4so2、3,5
‑
me2‑
c6h3so2、2,4,6
‑
me3‑
c6h2so2、c6h5so2、boc、ac、cbz;r1选自me、et、bn、allyl;r2选自me、et、bn、allyl、ph、h、br、cl;r3选自meo、oh、ph、h;r4选自me、h;r5选自me、cf3、meo、f、cl、br、co2me;
[0010]
采用取代的2
‑
萘酚1和n
‑
苯基联烯胺2作为原料,在钯催化剂、手性亚磷酰胺配体和碱存在下,通过heck/去芳构化串联反应,得到吲哚萜类似物3。该方法为吲哚萜类似物的合成提供了一种温和、简便、高效的途径。
[0011]
本发明还提供了heck串联反应合成吲哚萜类似物的方法,包括如下操作:以取代2
‑
萘酚1和n
‑
取代苯基联烯胺2为原料,在钯催化剂、手性亚磷酰胺配体和碱存在下,反应得到吲哚萜类似物3;反应方程式如下:
[0012]
[0013]
其中:r选自ts、ns、c6h5so2、4
‑
t
bu
‑
c6h4so2、4
‑
meo
‑
c6h4so2、3,5
‑
me2‑
c6h3so2、2,4,6
‑
me3‑
c6h2so2、boc、ac、cbz;r1选自me、et、bn、allyl;r2选自me、et、bn、allyl、ph、h、br、cl;r3选自meo、oh、ph、h;r4选自me、h;r5选自me、cf3、meo、f、cl、br、co2me;lg选自cl、br、i、otf。
[0014]
进一步地,在上述技术方案中,所述手性亚磷酰胺配体选自l1
‑
l23,优选配体为l5、l7、l11、l12。配体对应结构如下:
[0015][0016][0017]
进一步地,在上述技术方案中,钯催化剂选自[pd(c3h5)cl]2、pd2(dba)3、pd(oac)2、pd(pph3)4、pdcl2,碱选自k2co3、cs2co3、dipea、dbu、naoh、koh。
[0018]
进一步地,在上述技术方案中,所述反应在溶剂中进行,溶剂选自1,2
‑
二氯乙烷、二氯甲烷、氯仿、甲苯、乙醚、丙酮、thf、乙酸乙酯、乙腈、氯苯、二噁烷、二甲苯、三甲苯中的一种或多种。优选溶剂为甲苯。
[0019]
进一步地,在上述技术方案中,取代2
‑
萘酚1、n
‑
取代苯基联烯胺2、钯催化剂、有机膦配体与碱摩尔比为1:1.2:0.01
‑
0.05:0.01
‑
0.1:1.5。
[0020]
进一步地,在上述技术方案中,反应温度选自
‑
20℃至25℃。优选温度为0℃。
[0021]
进一步地,在上述技术方案中,整个反应过程需要惰性气体保护下操作,惰性气体优选氮气。
[0022]
进一步地,得到吲哚萜类似物3可以进一步衍生以得到不同类型的衍生产物,采用还原剂进行还原,通过控制不同的反应温度得到具有烯丙醇5,烯丙基叔醇6,烯丙基叔醇7,环己酮8和环己醇9。
[0023]
例如:产物5的转化采用硼氢化钠和甲醇,产物6的转化采用甲基格氏试剂和四氢呋喃,产物7的转化采用tmsch2li和四氢呋喃。产物8和9的转化采用pd/c催化剂、氢气和甲醇。化合物5
‑
9结构如下:
[0024][0025]
进一步地,在上述技术方案中,采用硼氢化钠和甲醇进行羰基还原生成化合物5,采用pd/c还原生成化合物8和化合物9均选自20
‑
25℃,采用甲基格氏试剂加成生成化合物6和采用tmsch2li试剂转变生成化合物7均选自0℃。
[0026]
发明有益效果:
[0027]
1、本发明以取代2
‑
萘酚1和n
‑
苯基联烯胺2为原料,通过heck/去芳构化串联反应后,一步即可得到吲哚萜类似物3,同时具有手性季碳中心,结构新颖,未见公开资料报道。
[0028]
2、反应原料易得,产物对映选择性高,反应收率和对映选择性最高分别可达92%和>99%ee。产物经过还原后衍生,得到不同类型吲哚萜类似物5
‑
9。
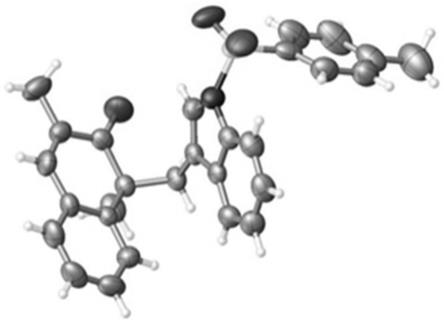
附图说明
[0029]
图1为实施例1中化合物3aa单晶x衍射谱图;
[0030]
图2为实施例6中化合物3ga单晶x衍射谱图。
具体实施方式
[0031]
实施例1
[0032]
以1,3
‑
二甲基
‑2‑
萘酚1a和n
‑2‑
碘苯基
‑
n
‑
ts
‑
联烯胺2a生成3aa为例,进行反应条件优化,反应方程式如下:
[0033][0034][0035][0036]
a
除非特别说明,反应的步骤如下:1a(0.1mmol),2a(0.12mmol),[pd(c3h5)cl]2(x mol%),配体(y mol%),碱(1.5equiv),1.0ml溶剂,在n2保护下t℃反应12小时。
b
分离收率,
c
手性高效液相色谱法测定。
d
重结晶后分离得到的3aa产率和ee值。
[0037]
在反应条件筛选过程中,首先考察了配体对反应的影响(entries1
‑
5)。同时考察
492.1604,found m/z 492.1598.
[0042]
实施例3:
[0043][0044]
氮气保护下,在配有磁子schlenk管,依次加入1
‑
甲基
‑3‑
烯丙基
‑
β
‑
萘酚(0.1mmol)、n
‑2‑
碘苯基
‑
n
‑
ts
‑
联烯胺(0.11mmol)、[pd(c3h5)cl]2(1mol%)、l5(1mol%)和cs2co3(0.15mmol,1.5当量),橡胶塞密封。注射器将1.0ml干燥的甲苯打入反应管中。将反应管放在0℃,搅拌过夜。反应液快速通过短硅胶柱,二氯甲烷/甲醇=15/1洗脱,溶液经真空浓缩后,得到粗品。接着硅胶柱色谱纯化,得到黄色油状物3ca,收率91%,92%ee。1h nmr(400mhz,cdcl3)δ7.82(d,j=8.0hz,1h),7.51
‑
7.45(m,2h),7.43(d,j=7.6hz,1h),7.37(td,j=7.2,1.2hz,1h),7.30(td,j=7.6,1.6hz,1h),7.25
‑
7.17(m,2h),7.18
‑
7.12(m,3h),7.10(td,j=7.6,1.1hz,1h),6.82(s,1h),6.43(s,1h),5.55
‑
5.20(m,1h),4.95
‑
4.72(m,2h),3.49(d,j=14.0hz,1h),3.07(d,j=14.4hz,1h),2.98
‑
2.79(m,1h),2.82
‑
2.64(m,1h),2.34(s,3h),1.62(s,3h).
13
c nmr(100mhz,cdcl3)δ202.8,144.9,144.7,141.5,135.4,135.0,134.9,134.5,131.0,130.5,129.8,129.3,129.0,127.2,126.8,126.7,124.5,124.0,123.0,119.9,118.0,117.0,113.3,51.8,38.8,33.0,26.9,21.7.hrms(esi):calcd for c
30
h
27
nnao3s[m na]
requires m/z 504.1604,found m/z 504.1601.
[0045]
实施例4:
[0046][0047]
氮气保护下,在配有磁子schlenk管,依次加入1
‑
甲基
‑3‑
苯基
‑
β
‑
萘酚(0.1mmol)、n
‑2‑
碘苯基
‑
n
‑
ts
‑
联烯胺(0.11mmol)、[pd(c3h5)cl]2(1mol%)、l5(1mol%)和cs2co3(0.15mmol),橡胶塞密封。注射器将1.0ml干燥甲苯打入反应管中。将反应管放在0℃,搅拌过夜。反应液快速通过短硅胶柱,二氯甲烷/甲醇=15/1洗脱,溶液经真空浓缩后,得到粗品。接着硅胶柱色谱纯化,得到黄色油状物3da,收率81%,90%ee。1h nmr(600mhz,cdcl3)δ7.85(d,j=8.4hz,1h),7.50
‑
7.40(m,4h),7.35(td,j=7.4,1.3hz,1h),7.27
‑
7.23(m,5h),7.21
‑
7.16(m,1h),7.10
‑
7.04(m,2h),7.03
‑
6.97(m,4h),6.49(s,1h),3.58(d,j=13.8hz,1h),3.15(d,j=14.4hz,1h),2.26(s,3h),1.69(s,3h).
13
c nmr(150mhz,cdcl3)δ201.5,145.2,144.6,142.7,135.7,135.6,135.3,134.5,131.0,130.4,129.8,129.63,129.59,128.6,127.9,127.8,127.3,126.8,126.5,124.5,123.8,123.0,119.8,118.1,113.3,52.3,38.5,29.7,27.0,21.5;hrms(esi):calcd for c
33
h
27
nna o3s[m na]
requires m/z 540.1604,found m/z 540.1598.
[0048]
实施例5:
[0049][0050]
氮气保护下,在配有磁子schlenk管,依次加入1
‑
甲基
‑3‑
苄基
‑
β
‑
萘酚(0.1mmol)、n
‑2‑
碘苯基
‑
n
‑
ts
‑
联烯胺(0.11mmol)、[pd(c3h5)cl]2(1mol%)、l5(1mol%)和cs2co3(0.15mmol),橡胶塞密封。注射器将1.0ml干燥甲苯打入反应管中。将反应管放在0℃,搅拌过夜。反应液快速通过短硅胶柱,二氯甲烷/甲醇=15/1洗脱,溶液经真空浓缩后,得到粗品。接着硅胶柱色谱纯化,得到黄色油状物3ea,收率62%,85%ee。1h nmr(600mhz,cdcl3)δ7.86(d,j=8.2hz,1h),7.46
‑
7.39(m,3h),7.36(td,j=7.6,1.4hz,1h),7.29(d,j=7.9hz,1h),7.26
‑
7.22(m,2h),7.16
‑
7.09(m,4h),7.05(d,j=8.1hz,2h),6.93(dd,j=7.8hz,1h),6.66
‑
6.60(m,2h),6.44(s,1h),6.37(s,1h),3.50(d,j=14.4hz,1h),3.45(d,j=16.2hz,1h),3.27(d,j=16.8hz,1h),3.05(d,j=13.8hz,1h),2.28(s,3h),1.65(s,3h).
13
c nmr(150mhz,cdcl3)δ202.8,144.7,144.5,141.8,138.6,136.5,135.4,134.4,130.5,129.6,129.3,129.2,128.9,128.4,127.0,126.6,126.5,126.0,124.5,124.0,123.0,119.8,117.6,113.2,51.8,39.3,34.8,26.4,21.6;hrms(esi):calcd for c
34
h
29
nnao3s[m na]
requires m/z 554.1760,found m/z 554.1755.
[0051]
实施例6:
[0052][0053]
氮气保护下,在配有磁子schlenk管,依次加入1
‑
甲基
‑3‑
氯
‑
β
‑
萘酚(0.1mmol)、n
‑2‑
碘苯基
‑
n
‑
ts
‑
联烯胺(0.11mmol)、[pd(c3h5)cl]2(1mol%)、l5(1mol%)和cs2co3(0.15mmol),橡胶塞密封。注射器将1.0ml干燥甲苯打入反应管中。将反应管放在0℃,搅拌过夜。反应液快速通过短硅胶柱,二氯甲烷/甲醇=15/1洗脱,溶液经真空浓缩后,得到粗品。接着硅胶柱色谱纯化,得到黄色固体3ga,收率82%,24%ee。1h nmr(600mhz,cdcl3)δ7.83(d,j=7.8hz,1h),7.51(d,j=8.4hz,2h),7.48
‑
7.39(m,2h),7.31(td,j=7.8,1.8hz,1h),7.27(s,1h),7.22
‑
7.15(m,3h),7.15
‑
7.06(m,3h),6.56(s,1h),3.53(d,j=14.4hz,1h),3.14(d,j=13.8hz,1h),2.35(s,3h),1.68(s,3h).
13
c nmr(150mhz,cdcl3)δ196.4,144.8,144.5,142.5,135.4,134.5,130.8,130.4,130.2,129.9,129.5,129.3,127.7,127.1,124.7,124.3,123.2,119.8,117.6,113.4,54.1,39.1,27.3,21.7.hrms(esi):calcd for c
27
h
22
clnnao3s[m na]
requires m/z 498.0901,found m/z 498.0901.
[0054]
实施例7:
[0055][0056]
氮气保护下,在配有磁子schlenk管,依次加入1
‑
甲基
‑
β
‑
萘酚(0.1mmol)、n
‑2‑
碘苯基
‑
n
‑
ts
‑
联烯胺(0.11mmol)、[pd(c3h5)cl]2(1mol%)、l5(1mol%)和cs2co3(0.15mmol),橡胶塞密封。注射器将1.0ml干燥甲苯打入反应管中。将反应管放在0℃,搅拌过夜。反应液快速通过短硅胶柱,二氯甲烷/甲醇=15/1洗脱,溶液经真空浓缩后,得到粗产品。接着硅胶柱色谱纯化,得到黄色固体3fa,收率79%,82%ee。1h nmr(400mhz,cdcl3)δ7.81(d,j=8.0hz,1h),7.49
‑
7.36(m,4h),7.31(td,j=7.6,1.6hz,1h),7.24
‑
7.05(m,7h),6.55(s,1h),5.92(d,j=9.6hz,1h),3.52(d,j=14.0,1h),3.12(d,j=14.4,1h),2.33(s,3h),1.61(s,3h).
13
c nmr(150mhz,cdcl3)δ203.5,145.5,144.9,144.6,135.2,134.4,130.1,129.9,129.7,129.5,127.1,126.9,126.7,125.4,124.4,124.2,123.0,119.7,118.2,113.3,51.9,37.8,27.2,21.6.hrms(esi):calcd for c
27
h
23
nnao3s[m na]
requires m/z 464.1291,found m/z 464.1289.
[0057]
实施例8:
[0058][0059]
氮气保护下,在配有磁子schlenk管,依次加入1,5
‑
二甲基
‑6‑
甲氧基
‑
β
‑
萘酚(0.1mmol)、n
‑2‑
碘苯基
‑
n
‑
ts
‑
联烯胺(0.11mmol)、[pd(c3h5)cl]2(1mol%)、l5(1mol%)和cs2co3(0.15mmol),橡胶塞密封。注射器将1.0ml干燥甲苯打入反应管中。将反应管放在0℃,搅拌过夜。反应液快速通过短硅胶柱,二氯甲烷/甲醇=15/1洗脱,溶液经真空浓缩后,得到粗产品。接着硅胶柱色谱纯化,得到42.9mg黄色油状物3ka,收率86%,91%ee。1h nmr(600mhz,cdcl3)δ7.81(d,j=8.4hz,1h),7.56(d,j=10.2hz,1h),7.46(d,j=8.4hz,2h),7.24
‑
7.15(m,3h),7.15
‑
7.06(m,3h),6.87(d,j=8.4hz,1h),6.65(s,1h),5.99(d,j=10.2hz,1h),3.85(s,3h),3.50(d,j=14.4hz,1h),3.10(d,j=14.4hz,1h),2.32(s,3h),2.26(s,3h),1.55(s,3h).
13
c nmr(151mhz,cdcl3)δ203.9,156.4,144.6,141.1,137.7,135.3,134.6,131.3,129.7,129.0,126.7,125.3,125.2,124.9,124.4,124.4,123.0,119.9,118.7,113.4,112.0,55.9,51.6,37.6,28.0,21.7,10.8.hrms(esi):calcd for c
29
h
27
n nao4s[m na]
requires m/z 508.1553,found m/z 508.1547.
[0060]
实施例9:
m/z 514.1452.
[0066]
实施例11:
[0067][0068]
氮气保护下,在配有磁子schlenk管,依次加入1,3
‑
二甲基
‑
β
‑
萘酚(0.1mmol)、n
‑2‑
碘苯基
‑
n
‑
cbz
‑
联烯胺(0.11mmol)、[pd(c3h5)cl]2(1mol%)、l5(1mol%)和cs2co3(0.15mmol),胶塞密封。注射器将1.0ml干燥甲苯打入反应管中。将反应管放在0℃,搅拌过夜。反应液快速通过短硅胶柱,二氯甲烷/甲醇=15/1洗脱,溶液经真空浓缩后,得到粗品。接着硅胶柱色谱纯化,得到黄色油状物3ak,收率50%,70%ee。1h nmr(600mhz,cdcl3)δ8.02(s,1h),7.46(d,j=7.8hz,1h),7.42
‑
7.35(m,5h),7.33(td,j=7.8,1.2hz,1h),7.23
‑
7.17(m,3h),7.14
‑
7.04(m,2h),6.96(s,1h),6.58(s,1h),5.34(d,j=12.0hz,1h),5.28(d,j=12.6hz,1h),3.49(d,j=14.4hz,1h),3.09(d,j=14.4hz,1h),1.72(s,3h),1.64(s,3h).
13
c nmr(100mhz,cdcl3)δ203.8,145.1,141.6,135.2,132.8,130.7,130.6,128.8,128.7,128.6,128.5,128.2,126.9,126.6,124.3,123.2,122.6,119.3,117.0,114.7,68.3,51.6,39.0,26.6,15.7.hrms(esi):calcd for c
29
h
25
nnao3[m na]
req uires m/z 458.1727,found m/z 458.1730.
[0069]
实施例12:
[0070][0071]
在反应瓶中,加入3fa(44.1mg,0.1mmol)和meoh(5ml),完全溶解后,加入nabh4(10mg,0.25mmol),室温下搅拌反应。tlc监测反应完全,水和乙酸乙酯萃取,饱和食盐水洗,无水硫酸镁干燥,减压浓缩,柱色谱法纯化得到5(95%yield,96%ee)。1h nmr(400mhz,cdcl3)δ7.93(d,j=8.4hz,1h),7.72(d,j=8.4hz,2h),7.19
‑
7.20(m,3h),7.17
‑
7.03(m,4h),6.99(s,1h),6.88(td,j=7.6,1.6hz,1h),6.77(d,j=7.6hz,1h),6.48(dd,j=9.6,1.6hz,1h),5.96(dd,j=9.6,3.2hz,1h),4.43
‑
4.31(m,1h),3.21(d,j=13.6hz,1h),3.03(d,j=13.6hz,1h),2.35(s,3h),1.24(s,3h).
13
c nmr(101mhz,cdcl3)δ144.8,140.7,135.5,132.6,132.4,131.0,129.8,128.3,127.5,127.2,127.1,127.0,126.3,125.6,124.2,122.9,119.9,119.5,113.6,74.0,43.6,29.9,26.9,22.7,21.7;hrms calcd for c
27
h
25
nnao3s(m na)
requires m/z 466.1447,found m/z 466.1455.
[0072]
实施例13:
[0073][0074]
氮气保护下,在配有磁子schlenk管,加入3fa(44.1mg,0.1m mol)和thf(1ml)。降温至0℃,加入ch3mgbr(0.3mmol),反应2小时。采用碳酸氢钠水溶液淬灭,乙酸乙酯萃取,无水硫酸钠干燥,减压浓缩,柱色谱纯化得到6(90%yield,93%ee)。1h nmr(600mhz,cdcl3)δ7.87(d,j=8.4hz,1h),7.70
‑
7.62(m,2h),7.21(d,j=8.4hz,2h),7.18
‑
7.14(m,1h),7.08
‑
7.01(m,2h),7.00
‑
6.96(m,1h),6.85(d,j=7.8hz,1h),6.63(td,j=7.8,1.8hz,1h),6.55(s,1h),6.42(d,j=9.6hz,1h),6.34(d,j=7.8hz 1h),5.89(d,j=9.6hz,1h),3.28(d,j=13.8hz,1h),2.96(d,j=13.8hz,1h),2.34(s,3h),1.73(s,1h),1.26(s,3h),1.23(s,3h).
13
c nmr(150mhz,cdcl3)δ144.8,140.8,137.5,135.5,134.6,132.7,132.0,129.8,127.0,126.9,126.9,126.8,126.7,126.1,125.2,124.0,122.8,120.2,119.7,113.4,47.0,28.3,23.5,21.7,16.4.hrms(esi):calcd for c
28
h
27 nnao
3 s(m na)
requires m/z 480.1604,found m/z 480.1614.
[0075]
实施例14:
[0076][0077]
氮气保护下,在配有磁子schlenk管,加入3fa(44.1mg,0.1m mol)和thf(1ml)。降温至0℃,加入三甲基硅甲基锂(0.3mmol)反应2小时。采用碳酸氢钠水溶液淬灭,乙酸乙酯萃取,无水硫酸钠干燥,减压浓缩,柱色谱纯化得到7(86%yield,95%ee)。1h nmr(400mhz,cdcl3)δ7.88(d,j=8.0hz,1h),7.68(d,j=8.4hz,2h),7.25
‑
7.12(m,3h),7.11
‑
6.95(m,3h),6.89(d,j=8.0hz,1h),6.66(td,j=7.7,2.0hz,1h),6.53(s,1h),6.42(d,j=9.6hz,1h),6.34(d,j=7.6hz,1h),6.01(d,j=9.6hz,1h),3.32(d,j=13.6hz,1h),2.93(d,j=13.8hz,1h),2.35(s,3h),1.70(s,1h),1.26(s,3h),1.03(s,2h),0.06(s,9h).
13
c nmr(101mhz,cdcl3)δ144.8,141.1,137.7,135.5,134.6,132.6,132.3,129.8,126.99,126.95,126.8,126.7,126.6,126.0,125.1,124.0,122.8,120.6,119.7,113.4,79.6,48.8,28.0,25.0,21.7,16.3,0.9;hrms(esi):calcd for c
31
h
35
nnao3ssi(m na)
requires m/z 552.1999,found m/z 552.1992.
[0078]
实施例15:
[0079][0080]
在配有磁子schlenk管中,加入3fa(0.44g,1mmol)和pd/c(10mol%),然后加入
etoh(20ml)。抽真空,置换3次后,在氢气氛围下(1atm)室温反应3小时。反应完成后,混合物硅藻土过滤,水和乙酸乙酯萃取分层。有机相饱和食盐水洗涤,无水硫酸镁干燥,减压浓缩,柱色谱纯化得到8(52%yield,96%ee)和9(39%yield,96%ee)。产品8:1h nmr(600mhz,cdcl3)δ7.86(d,j=8.4hz,1h),7.54(d,j=7.8hz,2h),7.36(d,j=7.8hz,1h),7.29(t,j=7.8hz,1h),7.22
‑
7.14(m,4h),7.10
‑
7.04(m,4h),6.99(d,j=7.8hz,1h),6.62(s,1h),3.49(d,j=13.8hz,1h),2.93(d,j=13.8hz,1h),2.68
‑
2.56(m,1h),2.51
‑
2.40(m,1h),2.33(s,3h),2.22
‑
2.06(m,2h),1.57(s,3h).
13
c nmr(150mhz,cdcl3)δ214.4,144.8,141.4,136.5,135.4,134.5,131.2,129.8,128.1,127.2,126.8,125.0,124.5,123.1,120.0,118.8,113.4,52.6,38.5,36.4,27.8,27.3,21.7;hrms calcd for c
27
h
25
nnao3s[m na]
466.1447,found m/z 466.1448.产品9:1h nmr(600mhz,cdcl3)δ7.96(d,j=8.4hz,1h),7.70(d,j=8.4hz,2h),7.25
‑
7.22(m,2h),7.20(d,j=7.8hz,2h),7.14
‑
7.07(m,3h),7.05(s,1h),7.00
‑
6.93(m,2h),3.80(dd,j=9.0,3.6hz,1h),3.10(d,j=14.0hz,1h),3.05(d,j=14.0hz,1h),2.97
‑
2.80(m,2h),2.33(s,3h),1.95
‑
1.80(m,2h),1.67(s,1h),1.30(s,3h).
13
c nmr(150mhz,cdcl3)δ144.8,142.1,135.5,135.0,134.9,132.6,129.8,129.0,127.5,126.9,126.2,125.9,125.5,124.3,123.0,120.2,119.8,113.7,73.9,42.7,31.3,26.8,26.7,26.6,21.7;hrms(esi):calcd for c
27
h
27
nnao3s(m na)
requires m/z 468.1604,found m/z 468.1602.
[0081]
以上实施例描述了本发明的基本原理、主要特征及优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明原理的范围下,本发明还会有各种变化和改进,这些变化和改进均落入本发明保护的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

