一种非传统肽kq
‑
11及其应用
技术领域
1.本发明涉及一种非传统肽,具体涉及一种对病原真菌具有抗菌活性的非传统肽。
背景技术:
2.真菌性植物病原体是一类重要的微生物,给世界各地农业生产造成重大的经济损失。几十年来,通常使用化学农药来控制真菌病原体的生长和传播。然而,农药的使用既污染环境又危害人类身体健康,而且农药作用范围有限。因此,迫切需要寻找一种绿色、环保、安全的新型杀菌剂来代替目前正在使用的化学农药。
3.肽通常由2~100个氨基酸残基组成,是生物体中具有重要作用的生物小分子。按其所发挥的功能,小肽可分为两大类:一类叫营养性小肽,是指不具有特殊生理调节功能,只为蛋白质合成提供氮架的小肽;一类叫功能性小肽(生物活性肽),是由20种编码氨基酸以不同组成和排列方式构成的从二肽到复杂的线性、环形结构的不同肽类的总称,该类型的小肽能够参与调节生物体的某些生理活动或具有某些特殊作用的小肽;按其来源,我们可以将肽分为两类:传统肽和非传统肽。传统肽是来源于传统orfs的内源肽,非传统肽是来源于传统认为不翻译区域的内源肽,例如utrs区,基因间区,内含子区以及不同类型的跨基因元件区域。
4.过去几十年的研究主要集中在来源于传统orfs的传统肽,已有研究表明一些传统肽具有显著的抗真菌活性,如防御素、硫蛋白、脂质转移蛋白等。由于肽来源于天然资源,也能有效抵抗真菌感染,因此对环境和人类健康相对更加安全。因此,抗真菌肽作为一种新型杀菌剂,有望成为对抗植物病原微生物日益增加的抗生素耐药性方面的一种理想的替代品。
5.近年来,一类从先前未被注释的非编码区中得到的新型多肽——非传统肽,作为植物中重要的功能性内源肽受到了广泛关注。研究表明,非传统肽在各种生物过程中发挥着重要作用,如翻译调控、植物发育及应激反应。
技术实现要素:
6.本发明要解决的技术问题是提供一种抑制植物病原真菌活性的非传统肽。
7.本发明的技术方案是:一种非传统肽kq
‑
11的氨基酸序列为kqrkkilgcty。
8.所述的非传统肽kq
‑
11来源于基因间区,分子量为1393.79da,等电点为10.03。
9.所述的非传统肽kq
‑
11在抑制植物病原真菌活性中应用。
10.所述植物病原真菌为玉米生平脐蠕孢菌、新月弯孢菌、禾谷镰刀菌或玉蜀黍平脐蠕孢菌。
11.本发明的有益效果是:非传统肽肽kq
‑
11的广谱抗真菌活性实验表明,kq
‑
11主要是通过菌丝聚集从而达到对真菌的抑制作用。肽kq
‑
11对玉米生平脐蠕孢菌、新月弯孢菌、禾谷镰刀菌和玉蜀黍平脐蠕孢菌的最高抑制率分别为60.4%、61.9%、45.1%和39.9%。
附图说明
12.图1为菌丝生长速率法的方法示意图;
13.图2为合成的非传统肽kq
‑
11的质谱图;
14.图3为合成的非传统肽kq
‑
11的高效液相色谱图;
15.图4为肽kq
‑
11对玉米生平脐蠕孢菌的表型鉴定,每处理三个重复,选取其中一个作为代表,标尺为1cm;
16.图5为肽kq
‑
11对玉米生平脐蠕孢菌的生长抑制率。生长抑制率计算公式:i%=[(c
‑
d)
‑
(t
‑
d)]/(c
‑
d)
×
100%;
[0017]
图6为肽kq
‑
11在36hpi对玉米生平脐蠕孢菌菌丝形态的影响,标尺为20μm。
[0018]
图7为肽kq
‑
11对新月弯孢菌的表型鉴定,每处理三个重复,选取其中一个作为代表,标尺为1cm;
[0019]
图8为肽kq
‑
11对新月弯孢菌的生长抑制率。生长抑制率计算公式:i%=[(c
‑
d)
‑
(t
‑
d)]/(c
‑
d)
×
100%;
[0020]
图9为肽kq
‑
11在36hpi对新月弯孢菌菌丝形态的影响,标尺为20μm;
[0021]
图10为肽kq
‑
11对禾谷镰刀菌的表型鉴定,每处理三个重复,选取其中一个作为代表,标尺为1cm;
[0022]
图11为肽kq
‑
11对禾谷镰刀菌的生长抑制率。生长抑制率计算公式:i%=[(c
‑
d)
‑
(t
‑
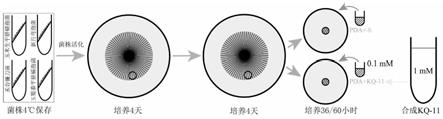
d)]/(c
‑
d)
×
100%;
[0023]
图12为肽kq
‑
11在36hpi对禾谷镰刀菌菌丝形态的影响,标尺为20μm;
[0024]
图13为肽kq
‑
11对玉蜀黍平脐蠕孢菌的表型鉴定,每处理三个重复,选取其中一个作为代表,标尺为1cm
[0025]
图14为肽kq
‑
11对玉蜀黍平脐蠕孢菌的生长抑制率。生长抑制率计算公式:i%=[(c
‑
d)
‑
(t
‑
d)]/(c
‑
d)
×
100%;
[0026]
图15为肽kq
‑
11在36hpi对玉蜀黍平脐蠕孢菌菌丝形态的影响,标尺为20μm。
具体实施方式
[0027]
本发明前期通过建立的植物多肽基因组学的方法,鉴定到了非传统肽kq
‑
11。进行了抗真菌(玉米生平脐蠕孢菌、新月弯孢菌、禾谷镰刀菌和玉蜀黍平脐蠕孢菌)的活性研究。这些病原真菌可引起的主要真菌病害,包括:圆斑病、炭腐穗腐病(黑腐病)、弯孢叶斑病、镰孢种腐病、镰孢苗枯病、镰孢根腐病、赤霉穗腐病(赤霉病)、赤霉茎腐病(青枯病)以及小斑病。
[0028]
具体实验过程
[0029]
1材料与方法
[0030]
1.1实验材料
[0031]
1.1.1病原菌
[0032]
玉米生平脐蠕孢菌、新月弯孢菌、禾谷镰刀菌和玉蜀黍平脐蠕孢菌均由本实验室保存。
[0033]
1.1.2培养基
[0034]
本研究所用到的培养基均为马铃薯葡萄糖琼脂培养基(pda),配置如下:
[0035]
(1)新鲜马铃薯200g,去皮后切块放入1000ml蒸馏水中。
[0036]
(2)沸水煮20min后,用纱布过滤。
[0037]
(3)在滤液中加入20g蔗糖,20g琼脂粉,加入蒸馏水定容至1000ml。
[0038]
(4)121℃高压灭菌21min后,倒平板备用。
[0039]
1.2实验方法
[0040]
1.2.1非传统肽的合成
[0041]
通过fmoc(9
‑
芴基甲氧基羰基)多肽固相合成的方法进行合成,顺序为从c端(羧基端)向n端(氨基端)合成。首先,将有fmoc保护的氨基酸连接在树脂上,用20%哌啶/dmf溶液将树脂中的fmoc保护基脱去,使其露出活泼的nh2基,第二个fmoc保护的氨基酸通过hbtu法被连接上,直到整条肽链连接完毕。用dmf溶剂将肽链从树脂上洗脱下来得到粗品。具体实验方法如下:
[0042]
(1)树脂合成
[0043]
a.fmoc
‑
aa
‑
王树脂
[0044]
通过fmoc
‑
aa
‑
oh上的羧基与王树脂上的
‑
oh脱去1分子h2o反应得到。反应如下:
[0045][0046]
具体合成步骤如下:
[0047]
在圆底烧瓶中加入称好的王树脂,加入适量干燥dmf溶胀,用磁子搅拌,加入1.5eq的fmoc
‑
aa
‑
oh,再加6eq的吡啶,直到fmoc
‑
aa
‑
oh溶解后用滴管缓慢的滴加3eq的2,6
‑
二氯苯甲酰氯,加完后用橡皮塞盖紧,震荡反应3h以上。用砂芯漏斗抽滤除去溶液后,用dmf(3次)、meoh(1次)、dcm(3次)和meoh(2次)洗涤树脂。再转入收集管中,在真空干燥器中过夜抽干。
[0048]
b.fmoc
‑
aa
‑2‑
cl trt树脂的合成
[0049]
通过fmoc
‑
aa
‑
oh上的羧基与2
‑
cl trt树脂上的
‑
cl脱去1分子hcl反应得到fmoc
‑
aa
‑2‑
cl trt resin,主要用于c端是pro,cys,his这三种氨基酸的合成。反应如下:
[0050][0051]
具体合成步骤如下:
[0052]
在圆底烧瓶中加入称量好的2
‑
cl trt树脂和2eq的fmoc
‑
aa
‑
oh,加入适量干燥的dcm溶胀树脂和溶解氨基酸,再加入6eq的dipea。用塞子盖紧,在室温下搅拌反应2
‑
3h。再加入hplc级meoh(1g树脂加10ml)搅拌30min。用砂芯漏斗抽滤除去溶液后,用dmf(3次)、meoh(1次)、dcm(3次)和meoh(2次)洗涤树脂。再转入收集管中,在真空干燥器中过夜抽干。
[0053]
c.rink amide mbha树脂合成
[0054]
通过linker amide基团与mbha树脂连接反应得到。具体步骤如下:
[0055]
将mbha树脂加入反应器中,加入2eq hb活化rink amide,加入6倍量nmm。反应3
‑
4h。封端,将树脂移入砂芯漏斗分别用dmf洗涤3次、meoh洗涤1次、dcm洗涤3次、meoh洗涤3次。树脂移入真空抽干。
[0056]
(2)树脂用量的称量及溶胀
[0057]
根据要合成肽的摩尔数及树脂的取代度(树脂量=要合成肽的摩尔数/树脂的取代度),计算出所需的树脂量,然后称出树脂,放入贴有相应编号的反应器中。将上述加有树脂的反应器在架子上放置好,加入3
‑
5倍树脂床层体积的dmf,浸胀30min。
[0058]
(3)脱保护及其洗涤
[0059]
加入约3倍树脂床层体积的20%哌啶/dmf溶液,通氮气反应5min后,将其抽去,再加入约3倍树脂床层体积的20%哌啶/dmf溶液,通氮气反应15min。
[0060]
(4)脱保护后茚三酮检测
[0061]
取少量的树脂于检测小试管中,加入茚三酮,110
‑
120℃温度下反应3min,然后观察其显色。不同的氨基酸会显出不同的颜色,大多数的氨基酸树脂会呈现深蓝色或蓝色,而pro、asn、asp、gln、glu、his和cys多数显红色或红褐色。但是由于合成时肽的序列不同,所以氨基酸显示出的颜色也不是完全符合上述说的情形,有时会受到前面氨基酸的影响而显示其他颜色。但是,只要脱保护后进行的茚三酮检测反应,树脂显示出的颜色和连接时有明显区别,则说明脱保护反应进行完全。
[0062]
(5)连接反应
[0063]
溶剂:
[0064]
dmf(n,n
‑
二甲基甲酰氨),dcm(二氯甲烷)
[0065]
原料配比:
[0066]
aa:hbtu:nmm=3:2.85:6(摩尔比)
[0067]
将氨基酸加入反应器中,加入能使氨基酸溶解的最少量的dmf,再加入hbtu,再加入nmm,反应60min。
[0068]
注:
①
加dmf溶解前要先开氮气,防止氨基酸漏掉。
[0069]
②
一定要等氨基酸完全溶解后再加入hbtu。
[0070]
③
反应时dmf溶剂的加入量以全部浸没树脂为准。
[0071]
④
氮气搅拌的气流要适当。
[0072]
(6)连接后nt检测
[0073]
用滴管取少量树脂于检测试管中,先用dmf和meoh各清洗树脂一遍,后面步骤同脱保护检测。连接完全后树脂一般是无色透明,少数情况下会显淡黄色。跟前面脱保护所显颜色比较区别很明显,则表示连接完全。
[0074]
(7)封端
[0075]
配比:5%
‑
10%乙酸酐/dmf nmm(乙酸酐:nmm=1:1)
[0076]
加入树脂层3倍体积的封端溶液,通氮气搅拌30min,然后抽掉溶液,先用dcm冲洗反应器口,再用dmf洗涤5遍,将封端液洗净。
[0077]
(8)连接后的洗涤
[0078]
连接后的洗涤与脱保护后的洗涤方法相同,只是连接后洗涤三次即可。
[0079]
重复前面的步骤,直到一条肽链完成
[0080]
(9)树脂转移
[0081]
用dmf溶剂将脱保护洗涤后的树脂转移到砂芯漏斗中,用甲醇洗一次,dcm溶剂洗三次,再用甲醇洗两次。最后一次洗涤用甲醇尽量使树脂聚集在砂芯漏斗的中心,抽干,转
移至小收集管中,贴好标签,置于真空干燥器内抽干,以备切割。
[0082]
(10)切割
[0083]
a.切割液的配制
[0084]
a液:tfa:茴香硫醚:苯酚:edt:水=87.5:5:2.5:2.5:2.5
[0085]
b液:tfa:tis:水=95:3:2
[0086]
b.切割液的选择和用量
[0087]
一般含有cys,met和侧链未保护的trp的肽链选用a液,其它肽都用b液。1g树脂一般加10
‑
15ml切割液。
[0088]
c.切割时间
[0089]
指向树脂中加入切割液开始,到用乙醚沉淀滤液为止这段时间。对于短肽(如五、六肽)切2h,10个以上的切2.5h,对于30个以上的肽来说,适当延长时间。
[0090]
加入适量的切割液,放入摇床上反应,减压抽滤,收集滤液,将滤液用乙醚冲洗在离心管中。在离心机中离心沉淀(转速在4000rad/min左右),倒掉上清液,用玻璃棒将沉淀捣碎,用乙醚冲洗,再离心沉淀。按以上方法重复清洗三遍。
[0091]
将粗品放入真空干燥器内抽干,然后利用hplc进行纯化,得到纯度>90%的纯品,并进行质谱鉴定。
[0092]
1.2.2肽溶液的配置
[0093]
将合成好的肽溶解于无菌水中,然后用无菌水配置成肽浓度为1mm的母液,将配置好的肽溶液分装至2ml ep管中,
‑
20℃保存。后期使用时用pda培养基将母液稀释至100μμ。
[0094]
1.2.3实验菌株的制备
[0095]
(1)4℃保存的菌株用打孔器在培养基上打菌饼。
[0096]
(2)将菌饼接种在新的pda培养基上。
[0097]
(3)28℃、黑暗条件下培养4天用于活化。
[0098]
(4)活化好的菌株用打孔器在培养基上打菌饼。
[0099]
(5)将打好的菌饼接种在另一个新的pda培养基上。
[0100]
(6)28℃、黑暗条件下培养4天,用于后续实验。
[0101]
1.2.4生长抑制试验
[0102]
(1)pda培养基121℃,高压灭菌21min后,冷却至60℃。
[0103]
(2)然后与肽溶液混合配置成肽终浓度为100μμ的混合液,用无菌水代替肽溶液作为对照。
[0104]
(3)充分混匀后倒入直径为30mm的无菌培养皿中。
[0105]
(4)待培养基凝固后,从培养四天的真菌菌落外缘取一个5mm的菌饼,菌丝面朝下,接种在培养基的中央。
[0106]
(5)培养基在黑暗,28℃条件下培养。
[0107]
(6)每隔3h或6h拍照记录并测量菌落直径(图1)。
[0108]
1.2.5生长抑制率的计算
[0109]
(1)pda培养基121℃,高压灭菌21min后,冷却至60℃。
[0110]
(2)然后与肽溶液混合配置成肽终浓度为100μm的混合液,用无菌水代替肽溶液作为对照。
[0111]
(3)充分混匀后倒入30mm的无菌培养皿中。
[0112]
(4)待培养基凝固后,从培养四天的真菌菌落外缘取一个5mm的菌饼,菌丝面朝下,接种在培养基的中央。
[0113]
(5)培养基在黑暗,28℃条件下培养。
[0114]
(6)每隔3h或6h拍照记录并测量菌落直径。
[0115]
(7)根据直径的测量结果计算生长抑制率。生长抑制率计算公式如下:i%=[(c
‑
d)
‑
(t
‑
d)]/(c
‑
d)
×
100%,其中,c为对照菌落的直径。d为菌饼直径(5mm),t为非传统肽处理的菌落直径。
[0116]
1.2.6菌丝形态的研究
[0117]
(1)pda培养基121℃,高压灭菌21min后,冷却至60℃。
[0118]
(2)然后与肽溶液混合配置成肽终浓度为100μm的混合液,用无菌水代替肽溶液作为对照。
[0119]
(3)充分混匀后倒入30mm的无菌培养皿中。
[0120]
(4)待培养基凝固后,从培养四天的真菌菌落外缘取一个5mm的菌饼,菌丝面朝下,接种在培养基的中央。
[0121]
(5)培养基在黑暗,28℃条件下培养。
[0122]
(6)接种后36h用普通光学显微镜观察菌丝形态。
[0123]
2结果分析
[0124]
2.1玉米非传统肽的合成与质谱鉴定
[0125]
玉米非传统肽kq
‑
11,通过质谱分析发现非传统肽的结构和分子量都与预期一致(图2),进一步利用高效液相色谱对合成的玉米非传统肽进行纯度分析发现,合成的肽的纯度>90%(图3),满足要求,可以用于后续实验。
[0126]
2.2肽kq
‑
11的广谱抗真菌活性
[0127]
肽kq
‑
11对玉米生平脐蠕孢菌、新月弯孢菌、禾谷镰刀菌和玉蜀黍平脐蠕孢菌均具有抗菌活性。
[0128]
2.2.1肽kq
‑
11对玉米生平脐蠕孢菌的抗性
[0129]
玉米生平脐蠕孢菌分别在含肽kq
‑
11的培养基上和对照培养基(不含肽)上生长,在0hpi,6hpi,9hpi,12hpi,15hpi,18hpi,21hpi,24hpi,27hpi,30hpi,33hpi,36hpi对菌落进行观察,发现随着时间的推移,虽然菌落都在扩展生长,但是在肽kq
‑
11培养基上的扩展速度明显小于对照(图4)。
[0130]
进一步观察生长抑制率发现,其抑制率在21.6%~60.4%之间,呈s型增长,在33hpi抑制率最高(图5)。这些结果表明,肽kq
‑
11对玉米生平脐蠕孢菌具有显著的抗菌活性。
[0131]
最后,为了研究肽kq
‑
11的抗菌活性作用方式,在肽kq
‑
11处理36h后,用普通光学显微镜观察玉米生平脐蠕孢菌的菌丝,发现对照菌丝稀疏,肽kq
‑
11处理后可引起玉米生平脐蠕孢菌菌丝聚集,表明肽kq
‑
11通过引起菌丝聚集抑制菌丝生长和向外扩展(图6)。
[0132]
2.2.2肽kq
‑
11对新月弯孢菌的抗性
[0133]
新月弯孢菌分别在在含肽kq
‑
11的培养基上和对照培养基(不含肽)上生长,在0hpi,9hpi,12hpi,15hpi,18hpi,21hpi,24hpi,27hpi,30hpi,33hpi,36hpi对菌落进行观
察,虽然菌落都在随时间扩展生长,但是在肽kq
‑
11培养基上的扩展速度明显小于对照(图7)。
[0134]
进一步观察生长抑制率发现,其抑制率在44.5%~61.9%之间,在18hpi达到最高抑制率(图8)。这些结果表明,肽kq
‑
11对新月弯孢菌具有抗菌活性。
[0135]
最后,为了研究肽kq
‑
11的抗菌活性作用方式,在肽kq
‑
11处理36h后,用普通光学显微镜观察新月弯孢菌菌丝,发现对照菌丝稀疏,肽kq
‑
11处理后可引起新月弯孢菌菌丝聚集,表明肽kq
‑
11通过引起菌丝聚集抑制菌丝生长和向外扩展(图9)。
[0136]
2.2.3肽kq
‑
11对禾谷镰刀菌的抗性
[0137]
禾谷镰刀菌分别在含肽kq
‑
11和对照培养基(不含肽)上生长,在0hpi,6hpi,12hpi,18hpi,24hpi,30hpi,36hpi,42hpi,48hpi,54hpi,60hpi对菌落进行观察,虽然菌落都在随时间扩展生长,但是菌落在肽kq
‑
11培养基上的生长速度明显小于对照(图10)。
[0138]
进一步观察生长抑制率发现,其抑制率在28.1%~45.1%之间,且呈现出先升高后降低的趋势,在18hpi达到最高抑制率(图11)。这些结果表明,肽kq
‑
11对禾谷镰刀菌具有抗菌活性。
[0139]
最后,为了研究肽kq
‑
11的抗菌活性作用方式,在肽kq
‑
11处理36h后,用普通光学显微镜观察禾谷镰刀菌菌丝,发现对照菌丝稀疏,肽kq
‑
11处理后可引起禾谷镰刀菌菌丝聚集,表明肽kq
‑
11通过引起菌丝聚集抑制菌丝生长和向外扩展(图12)。
[0140]
2.2.4肽kq
‑
11对玉蜀黍平脐蠕孢菌的抗性
[0141]
玉蜀黍平脐蠕孢菌在含肽kq
‑
11的培养基上和对照培养基(不含肽)上生长,在0hpi,6hpi,12hpi,18hpi,24hpi,30hpi,36hpi,42hpi,48hpi,54hpi,60hpi对菌落进行观察,虽然菌落都在随时间扩展生长,但是菌落在肽kq
‑
11培养基上的生长速度明显小于对照(图13)。
[0142]
进一步观察生长抑制率发现,其抑制率在17.6%~39.9%之间,在6hpi达到最高抑制率(图14)。这些结果表明,肽kq
‑
11对玉蜀黍平脐蠕孢菌具有抗菌活性。
[0143]
最后,为了研究肽kq
‑
11的抗菌活性作用方式,在肽kq
‑
11处理36h后,用普通光学显微镜观察玉蜀黍平脐蠕孢菌菌丝,发现对照菌丝稀疏,肽kq
‑
11处理后可引起玉蜀黍平脐蠕孢菌菌丝聚集,表明肽kq
‑
11抑制了菌丝生长和向外扩展(图15)。
[0144]
上述肽kq
‑
11的广谱抗真菌活性实验表明,非传统肽kq
‑
11主要是通过菌丝聚集从而达到对真菌的抑制作用。
[0145]
按照kq
‑
11体外抗菌实验的浓度,取kq
‑
11溶解到水中,配置成摩尔浓度为100μm的肽溶液。利用pda培养基培养新月弯孢菌,用水冲洗孢子配置成浓度为1
×
106的孢子悬浮液,对玉米叶片进行喷涂,24小时后在叶片喷洒肽溶液,同时以等量的无菌水为对照组,进行同样的喷涂。每天观察玉米叶片的发病情况,发现肽处理后玉米叶片的病斑面积显著小于对照叶片的病斑面积。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。