微胶囊组合物及方法
本技术是申请日为2013年08月13日、申请号为201380053555.6、发明名称为“微胶囊组合物及方法”的中国专利申请(其对应pct申请的申请日为2013年08月13日、申请号为pct/us2013/054797)的分案申请。交叉引用
1.本技术要求2012年8月14日提交的美国临时专利申请号61/683,192、2012年12月14日提交的美国临时专利申请号61/737,374、2013年2月8日提交的美国临时专利申请号61/762,435、2013年3月15日提交的美国临时专利申请号61/800,223、2013年6月27日提交的美国临时专利申请号61/840,403和2013年7月10日提交的美国临时专利申请号61/844,804的权益,所述临时专利申请为所有目的在此通过引用整体并入本文。发明背景
2.分析物的检测和量化对于分子生物学和医学应用如诊断至关重要。遗传检测对于许多诊断方法特别有用。例如,用dna序列信息可以检测或更准确地表征由突变引起的病症如癌症。
3.在进行分子反应如测序反应之前,常常需要适当的样品制备。起始样品可以是生物样品,诸如细胞、组织或核酸的集合。当起始材料是细胞或组织时,样品可能需要裂解或以其它方式进行操作,以允许分子如dna的提取。样品制备还可以包括对分子进行片段化、分离分子和/或将独特标识符(identifier)附接至分子的特定片段,以及其它操作。本领域中存在对用于在下游应用之前制备样品的改进方法和装置的需要。
技术实现要素:
4.本公开内容提供了用于微胶囊阵列装置的组合物和方法。
5.本公开内容的一个方面提供了包含第一微胶囊的组合物,其中:当向第一微胶囊施加刺激时,第一微胶囊是可降解的;并且第一微胶囊包含寡核苷酸条形码。在一些情况下,第一微胶囊可包含化学交联体。该化学交联体例如可以是二硫键。在一些情况下,该组合物可包含聚合物凝胶,例如,聚丙烯酰胺凝胶。第一微胶囊可包含珠粒。在一些情况下,该珠粒可以是凝胶珠粒。
6.此外,所述刺激可以选自生物刺激、化学刺激、热刺激、电刺激、磁刺激或光刺激及其组合。在一些情况下,化学刺激可以选自ph的变化、离子浓度的变化和还原剂。该还原剂可以是,例如,二硫苏糖醇(dtt)或三(2
‑
羧乙基)膦(tcep)。
7.第二微胶囊可包含第一微胶囊。而且,第二微胶囊可以是微滴。在一些情况下,该组合物还可以包含含有寡核苷酸条形码的核酸,其中该核酸包含脱氧尿苷三磷酸(dutp)。在一些情况下,该组合物可包含不能接受脱氧尿苷三磷酸(dutp)的聚合酶。而且,该组合物可包含靶分析物,例如核酸。该核酸可以选自dna、rna、dntp、ddntp、扩增子、合成核苷酸、合成多核苷酸、多核苷酸、寡核苷酸、肽核酸、cdna、dsdna、ssdna、质粒dna、粘粒dna、高分子量(mw)dna、染色体dna、基因组dna、病毒dna、细菌dna、mtdna(线粒体dna)、mrna、rrna、trna、nrna、sirna、snrna、snorna、scarna、microrna、dsrna、核酶、核糖开关(riboswitch)和病毒
rna。在一些情况下,该核酸可以是基因组dna(gdna)。
8.此外,寡核苷酸条形码的密度可以是至少约1,000,000个寡核苷酸条形码/第一胶囊。该寡核苷酸条形码可以通过化学交联体(例如二硫键)偶联至微胶囊。
9.本公开内容的另一方面包括包含多个分区(partitions)的装置,其中:所述多个分区中的至少一个分区包含含有寡核苷酸条形码的微胶囊;并且当向微胶囊施加刺激时,该微胶囊是可降解的。该分区例如可以是孔(well)或微滴。在一些情况下,微胶囊包含化学交联体,例如二硫键。而且,该微胶囊可包含聚合物凝胶,例如聚丙烯酰胺凝胶。另外,该微胶囊可以包含珠粒。在一些情况下,该珠粒可以是凝胶珠粒。
10.所述刺激可以选自生物刺激、化学刺激、热刺激、电刺激、磁刺激或光刺激及其组合。在一些情况下,化学刺激可以选自ph的变化、离子浓度的变化和还原剂。该还原剂例如可以是二硫苏糖醇(dtt)或三(2
‑
羧乙基)膦(tcep)。
11.此外,核酸可以包含寡核苷酸条形码且该核酸可包含脱氧尿苷三磷酸(dutp)。在一些情况下,所述分区可以包含不能接受脱氧尿苷三磷酸(dutp)的聚合酶。另外,该分区可以包含靶分析物,例如核酸。该核酸可以选自dna、rna、dntp、ddntp、扩增子、合成核苷酸、合成多核苷酸、多核苷酸、寡核苷酸、肽核酸、cdna、dsdna、ssdna、质粒dna、粘粒dna、高分子量(mw)dna、染色体dna、基因组dna、病毒dna、细菌dna、mtdna(线粒体dna)、mrna、rrna、trna、nrna、sirna、snrna、snorna、scarna、microrna、dsrna、核酶、核糖开关和病毒rna。在一些情况下,该核酸可以是基因组dna(gdna)。该寡核苷酸条形码可以通过化学交联体偶联至微胶囊。在一些情况下,该化学交联体可以是二硫键。
12.本公开内容的又一方面提供了用于样品制备的方法,该方法包括将包含寡核苷酸条形码和靶分析物的微胶囊合并至分区中,其中当向微胶囊施加刺激时,该微胶囊是可降解的;以及向微胶囊施加刺激,以将寡核苷酸条形码释放至靶分析物。该分区可以是,例如,孔或微滴。在一些情况下,微胶囊可包含聚合物凝胶,例如聚丙烯酰胺。另外,该微胶囊可包含珠粒。在一些情况下,该珠粒可以是凝胶珠粒。此外,该微胶囊可包含化学交联体,例如二硫键。
13.所述刺激可以选自生物刺激、化学刺激、热刺激、电刺激、磁刺激或光刺激及其组合。在一些情况下,该化学刺激可以选自ph的变化、离子浓度的变化和还原剂。该还原剂可以是,例如,二硫苏糖醇(dtt)或三(2
‑
羧乙基)膦(tcep)。
14.此外,核酸可以包含寡核苷酸条形码且该核酸可包含脱氧尿苷三磷酸(dutp)。在一些情况下,所述分区可以包含不能接受脱氧尿苷三磷酸(dutp)的聚合酶。而且,该方法还可以包括将寡核苷酸条形码附接至靶分析物。该附接可以通过例如核酸扩增反应来完成。此外,分析物可以是核酸。在一些情况下,该核酸可以选自dna、rna、dntp、ddntp、扩增子、合成核苷酸、合成多核苷酸、多核苷酸、寡核苷酸、肽核酸、cdna、dsdna、ssdna、质粒dna、粘粒dna、高分子量(mw)dna、染色体dna、基因组dna、病毒dna、细菌dna、mtdna(线粒体dna)、mrna、rrna、trna、nrna、sirna、snrna、snorna、scarna、microrna、dsrna、核酶、核糖开关和病毒rna。在一些情况下,该核酸可以是基因组dna(gdna)。而且,寡核苷酸条形码可通过化学交联体偶联至微胶囊。在一些情况下,该化学交联体可以是二硫键。
15.本公开内容的又一方面提供了包含可降解凝胶珠粒的组合物,其中该凝胶珠粒包含至少约1,000,000个寡核苷酸条形码。在一些情况下,这1,000,000个寡核苷酸条形码是
相同的。援引并入
16.在本说明书中提到的所有出版物、专利和专利申请均为所有目的通过引用而全文并入本文,且其程度等同于具体地和单独地指出各个单独的出版物、专利或专利申请通过引用并入本文。
附图说明
17.本公开内容的装置的新颖特征在所附的权利要求中具体阐述。通过参考以下对其中利用了本发明装置的原理的说明性实施方案加以阐述的详细描述和附图,将会获得对本公开内容的特征和优点的更好理解,附图中:
18.图1a是微胶囊或内部试剂微滴的示意图。
19.图1b是包含多个内部试剂微滴的微胶囊的示意图。
20.图2a是示例性微胶囊阵列的俯视图的图示。
21.图2b是微胶囊阵列的示例性侧视图的图示。
22.图3是在96孔板支持物上的多微胶囊阵列配置的示意图。
23.图4a是在微孔胶囊阵列的一个微孔中的反应顺序的示意流程图。
24.图4b类似于图4a,不同之处在于其中注释有可以在每个步骤中进行的方法的实例。发明详述
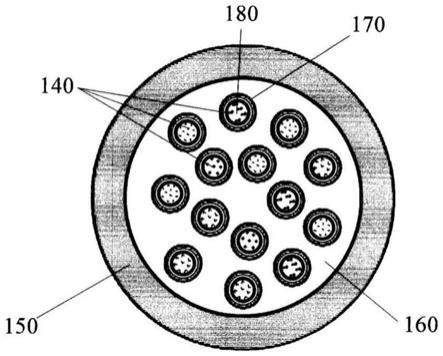
25.虽然本文已显示并描述了本发明的多种实施方案,但是对本领域技术人员来说显而易见的是,这些实施方案仅作为实例来提供。本领域技术人员在不脱离本发明的情况下可想到许多变化、改变和替换。应当理解,可以采用本文所述的本发明实施方案的各种替代方案。i.总体概述
26.本公开内容提供了微孔或其它分区胶囊阵列装置以及使用这类装置的方法。通常,该装置是分区(例如,微孔,微滴)的组装体,该分区加载有微胶囊,通常以特定的微胶囊/分区的浓度加载。
27.所述装置可特别适用于执行样品制备操作。在一些情况下,装置将样品(例如,核酸的不均匀混合物,细胞的混合物,等等)细分成多个分区,使得仅样品的一部分存在于各个分区中。例如,可以对包含核酸混合物的核酸样品进行分割(partition),使得在各个分区中存在不超过核酸的一条链(或一个分子)。在其它实例中,可以对细胞样品进行分割,使得在各个分区中存在不超过一个细胞。
28.分割步骤之后,可以在装置内对细分的样品进行许多不同操作中的任何操作。分区可以包含含有一种或多种试剂(例如,酶、独特标识符(例如,条形码)、抗体等)的一个或多个胶囊。在一些情况下,所述装置、配套装置或用户提供触发(trigger),该触发使微胶囊将一种或多种试剂释放至相应的分区中。试剂的释放可以使试剂能够与细分的样品接触。例如,如果该试剂是独特标识符,例如条形码,则该样品可以用独特标识符标记。标记后的样品随后可以用于下游应用,如测序反应。
29.在本文公开的装置内可进行多种不同的反应和/或操作,包括但不限于:样品分
割、样品分离、结合反应、片段化(例如,在分割之前或分割之后)、连接反应和其它酶反应。该装置还可以用于多种不同的分子生物学应用,包括但不限于:核酸测序、蛋白质测序、核酸量化、测序优化、检测基因表达、量化基因表达以及基因组标记物或表达的标记物的单细胞分析。此外,该装置具有许多医学应用。例如,它可用于包括癌症在内的多种遗传性和非遗传性疾病和病症的鉴定、检测、诊断、治疗、分期或风险预测。ii.微胶囊
30.图1a是示例性微胶囊的示意图,该微胶囊包含被第二层130包封的内部隔室120,第二层130被固体的或半渗透性的壳或膜110封装。通常,该壳将内部隔室与它们的直接环境(例如,微孔的内部)隔开。内部隔室,例如120、130,可包含材料,例如试剂。如图1a所示,试剂100可以存在于内部隔室120中。然而,在一些情况下,试剂位于包封层130中或位于这两个隔室中。通常,在引入特定触发之后,微胶囊可以释放内部材料或其一部分。该触发可导致壳层110和/或内部包封层130的破坏,从而使内部隔室100、120与外部环境如微孔的空腔接触。
31.该微胶囊可包含若干流体相并且可以包含乳液(例如,油包水乳液、水包油乳液)。微胶囊可包含与包封内层的第二层130不混溶的内层120。例如,内层120可以包含水性流体,而包封层130可以是非水性流体,如油。相反地,内层120可以包含非水性流体(例如,油)而包封层130可以包含水性流体。在一些情况下,微胶囊不包含第二包封层。通常,微胶囊被壳层110进一步封装,壳层110可以包含聚合物材料。在一些情况下,微胶囊可包含微滴。在一些情况下,微胶囊可以是微滴。
32.微滴和微滴生成方法例如在第re41,780号美国专利中描述,该专利为所有目的通过引用而全文并入本文。该装置还可以包含微流体元件,该微流体元件能够使样品和/或微胶囊穿过该装置流动并使样品和/或微胶囊在分区内分布。
33.该微胶囊可包含多个隔室。该微胶囊可包含至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、50、100、500、1000、1500、2000、2500、3000、3500、4000、4500、5000、5500、6000、6500、7000、7500、8000、8500、9000、9500、10000或50000个隔室。在其它情况下,该微胶囊包含少于3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、50、100、500、1000、1500、2000、2500、3000、3500、4000、4500、5000、5500、6000、6500、7000、7500、8000、8500、9000、9500、10000或50000个隔室。类似地,各个隔室或其子集也可以细分成多个额外的隔室。在一些情况下,各个隔室或其子集细分成至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、50、100、500、1000、1500、2000、2500、3000、3500、4000、4500、5000、5500、6000、6500、7000、7500、8000、8500、9000、9500、10000或50000个隔室。在其它情况下,各个隔室或者其子集进一步细分成少于3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、50、100、500、1000、1500、2000、2500、3000、3500、4000、4500、5000、5500、6000、6500、7000、7500、8000、8500、9000、9500、10000或50000个隔室。
34.在多个隔室中存在试剂的多种可能的分布。例如,各个隔室(或隔室总数的某一百分比)可包含相同的试剂或相同的试剂组合。在一些情况下,各个隔室(或隔室总数的某一百分比)包含不同的试剂或不同的试剂组合。
35.隔室可以以多种方式配置。在一些情况下,微胶囊可包含通常被不混溶层隔开的多个同心隔室(包含前面的隔室的隔室的重复单元)。在这样的微胶囊中,试剂可以存在于
交替的隔室中、每第三个隔室中或每第四个隔室中。
36.在一些情况下,大多数具有微胶囊的隔室不是同心的;相反,它们在微胶囊内作为单独的、自包含的实体存在。图1b示出了包含多个较小微胶囊140的微胶囊的实例,各个较小微胶囊140包含试剂。如同本文所述的许多其它微胶囊,微胶囊可以被外壳封装,该外壳通常包含聚合物材料150。在较大的微胶囊内封装的多个较小微胶囊可以被不混溶流体160在物理上分隔,从而在施加刺激并将试剂释放至溶液中之前防止试剂的混合。在一些情况下,该不混溶流体加载有额外的材料或试剂。在一些情况下,多个较小微胶囊被一层不混溶流体(例如,170)包围,该不混溶流体层进一步被与微胶囊的内部流体混溶的流体160包围。例如,内部微胶囊180可包含被不混溶(例如,油)层包封的水性内部,该不混溶层进一步被水性层160包围。可混溶隔室(例如,160和180)可各自包含试剂。它们可包含相同的试剂(或相同的试剂组合)或不同的试剂(或不同的试剂组合)。或者,这些可混溶隔室中的一个或一些可以不包含试剂。
37.微胶囊可包含一个聚合物壳(见,例如图1和图2)或多个聚合物壳。例如,微胶囊可包含层叠在彼此之上的多个聚合物壳。在其它情况下,在微胶囊内的单个隔室包含聚合物壳,或者一部分隔室可以包含聚合物壳。例如,在图1b中的全部或部分较小隔室140可包含聚合物壳,该聚合物壳将它们与流体内部160隔开。可以将该微胶囊设计成使得特定的试剂包含于具有聚合壳的隔室内,而不同的试剂位于仅是由不混溶性液体包封的隔室内。例如,期望在热触发时释放的试剂可以包含于具有热敏性或可热活化的聚合壳的隔室内,而设计成在不同触发时释放的试剂可以存在于不同类型的隔室内。在另一个实例中,可将顺磁性颗粒掺入胶囊壳壁内。然后可以使用磁场或电场将胶囊定位至期望的位置。在一些情况下,可向这样的胶囊施加磁场(例如,高频交变磁场);然后掺入的顺磁性颗粒可将磁场的能量转化成热,从而触发胶囊的破裂。
38.本公开内容的装置的微胶囊组分可以提供试剂的受控和/或定时释放以用于分析物的样品制备。微胶囊特别可用于不同类型的化学物质、成分、药品、香料等的受控释放和转运,这些尤其包括敏感性试剂,诸如酶和蛋白质(参见,例如,d.d.lewis,"biodegradable polymers and drug delivery systems",m.chasin和r.langer编(marcel decker,new york,1990);j.p.mcgee等人,j.control.release 34(1995),77)。
39.微胶囊也可以提供以离散且可限定的量递送试剂的手段(means)。微胶囊通过将试剂与样品分离可用于防止试剂与样品的过早混合。微胶囊也可使得方便处理特别敏感的试剂如酶、核酸和在样品制备中使用的其它化学物质并限制与之接触。a.微胶囊的制备
40.本公开内容的装置的微胶囊可以通过多种方法和过程来制备。制备技术可以包括:锅包衣、喷雾干燥、离心挤出、基于乳剂的方法和/或微流体技术。通常,基于所期望的微胶囊的特性来选择制备方法。例如,当选择方法时,可以考虑壳壁厚度、通透性、壳壁的化学组成、壳壁的机械完整性和胶囊大小。制备方法的选择还可以基于将特定材料引入至胶囊中的能力,诸如芯材料(例如,流体、试剂等)是否为水性的、有机的或无机的。另外,制备方法可以影响微胶囊的形状和大小。例如,胶囊的形状(例如,球形、椭圆形等)可取决于前体液体中的微滴的形状,该微滴的形状可以取决于芯液体的粘度和表面张力、乳液的流动方向、在微滴稳定化中使用的表面活性剂的选择以及物理限制,例如在具有特定尺寸(例如,
要求微胶囊变形以便微胶囊适合于微通道或毛细管中的尺寸)的微通道或毛细管中进行的制备。
41.微胶囊可以通过乳化聚合来制备,乳化聚合是这样一种方法:其中单体单元在乳液中的水/有机界面处聚合以形成壳。试剂与双相混合物的水相混合。该混合物的剧烈摇动或超声处理产生了包含试剂的微滴,该微滴被聚合物壳包围。
42.在一些情况下,微胶囊可以通过逐层组装来制备,逐层组装是这样一种方法:其中带有负和正电荷的聚电解质沉积到颗粒如金属氧化物芯上。聚电解质间的静电相互作用在芯周围产生聚合物壳。随后,该芯可以通过酸的加入来移除,从而产生可以加载有多种试剂的半透性中空球体。
43.在又进一步的情况下,微胶囊可以通过凝聚来制备,凝聚是这样一种方法:其中在水溶液中带有两种相反电荷的聚合物缠结以形成中和的聚合物壳壁。一种聚合物可包含于油相内,而另一种具有相反电荷的聚合物包含于水相中。这种水相可包含待封装的试剂。一种聚合物对另一种聚合物的吸引会导致凝聚体的形成。在一些实施方案中,明胶和阿拉伯胶是这种制备方法的成分。
44.微胶囊也可以通过内相分离来制备,内相分离是这样一种方法:其中聚合物溶解于含有挥发性和非挥发性溶剂的溶剂混合物中。所得溶液的微滴悬浮在水层中,该水层通过连续搅拌和使用表面活性剂来稳定化。该相可以含有待封装的试剂。当挥发性溶剂蒸发时,聚合物聚结以形成壳壁。在一些情况下,使用诸如聚苯乙烯、聚(甲基丙烯酸甲酯)和聚(四氢呋喃)等的聚合物来形成壳壁。
45.微胶囊也可以通过流动聚焦法(flow focusing methods)来制备,流动聚焦法是这样一种方法:其中使用微毛细管装置来生成包含被包围在中间流体中的单个内部微滴的双乳液,然后该中间流体分散至外部流体。内部微滴可含有待封装的试剂。中间流体变为壳壁,该壳壁可通过交联反应而形成。b.微胶囊组成
46.微胶囊可包含具有广泛的化学特性的多种材料。通常,微胶囊包含具有形成所需形状和大小的微胶囊的能力的材料,并且该材料与将要在微胶囊中储存的试剂相容。
47.微胶囊可以包含广泛的不同聚合物,包括但不限于:聚合物、热敏性聚合物、光敏性聚合物、磁性聚合物、ph敏感性聚合物、盐敏感性聚合物、化学敏感性聚合物、聚电解质、多糖、肽、蛋白质和/或塑料。聚合物可以包括但不限于诸如以下的材料:聚(n
‑
异丙基丙烯酰胺)(pnipaam)、聚(苯乙烯磺酸酯)(pss)、聚(烯丙基胺)(paam)、聚(丙烯酸)(paa)、聚(乙烯亚胺)(pei)、聚(二烯丙基二甲基
‑
氯化铵)(pdadmac)、聚(吡咯)(poly(pyrolle))(ppy)、聚(乙烯吡咯烷酮)(pvpon)、聚(乙烯基吡啶)(pvp)、聚(甲基丙烯酸)(pmaa)、聚(甲基丙烯酸甲酯)(pmma)、聚苯乙烯(ps)、聚(四氢呋喃)(pthf)、聚邻苯二甲醛(poly(phthaladehyde))(pthf)、聚(己基紫精)(phv)、聚(l
‑
赖氨酸)(pll)、聚(l
‑
精氨酸)(parg)、聚(乳酸
‑
乙醇酸)共聚物(plga)。
48.通常,用于微胶囊的材料,尤其是微胶囊的壳的材料,可使微胶囊能够在施加的刺激下破裂。例如,微胶囊可以由热敏性聚合物制备和/或可包含一个或多个含有这样的热敏性聚合物的壳。热敏性聚合物在用于储存或加载的条件下可以是稳定的。当暴露于热时,热敏性聚合物组分可经历解聚,从而导致壳完整性的破坏并将微胶囊(和/或内部微胶囊)的
内部材料释放至外部环境(例如,微孔的内部)。示例性热敏性聚合物可以包括但不限于nipaam或pnipam水凝胶。微胶囊还可以包含一种或多种类型的油。示例性油包括但不限于烃油、氟化油、氟碳油、硅油、矿物油、植物油和任何其它合适的油。
49.微胶囊还可以包含表面活性剂,诸如乳化表面活性剂。示例性表面活性剂包括但不限于阳离子型表面活性剂、非离子型表面活性剂、阴离子型表面活性剂、烃表面活性剂或含氟表面活性剂。表面活性剂可提高微胶囊的一种或多种组分如包含油的内部隔室的稳定性。
50.另外,微胶囊可包含与胶囊外部的材料混溶的内部材料。例如,该内部材料可以是水性流体并且微孔内的样品也可以在水性流体中。在其它实例中,微胶囊可以包含与水性流体混溶的粉末或纳米颗粒。例如,微胶囊可以在内部隔室内包含这样的粉末或纳米颗粒。当微胶囊破裂时,这样的粉末或纳米颗粒释放至外部环境(例如,微孔的内部)并且可以与水性流体(例如,水性样品流体)混合。
51.另外,微胶囊可以包含与周围环境(例如,微孔的内部,样品流体)不混溶的材料。在这样的情况下,当内部乳液释放至周围环境时,内部组分与外部组分之间的相分离可以促进混合,诸如内部组分与周围流体的混合。在一些情况下,当触发微胶囊以释放其内容物时,压力或力也得到释放,其促进内部组分与外部组分的混合。
52.微胶囊还可以在胶囊内部中包含聚合物。在一些情况下,这种聚合物可以是可捕获试剂或试剂组合的多孔聚合物珠粒。在其它情况下,此聚合物可以是先前已溶胀以形成凝胶的珠粒。可以用作胶囊的内部乳液的、基于聚合物的凝胶的实例可包括但不限于用寡核苷酸条形码等溶胀的海藻酸钠凝胶或聚丙烯酰胺凝胶。
53.在一些情况下,微胶囊可以是包含本文所述的任何基于聚合物的凝胶的凝胶珠粒。例如,凝胶珠粒微胶囊可以通过将一种或多种聚合物前体封装在微滴中而形成。当聚合物前体暴露于促进剂(例如,四甲基乙二胺(temed))时,可产生凝胶珠粒。
54.分析物和/或试剂,诸如寡核苷酸条形码,例如,可偶联/固定至凝胶珠粒的内表面(例如,通过寡核苷酸条形码和/或用于生成寡核苷酸条形码的材料的扩散可到达的内部)和/或凝胶珠粒或本文所述的任何其它微胶囊的外表面。偶联/固定可通过任何形式的化学键合(例如,共价键、离子键)或物理现象(例如,范德华力、偶极
‑
偶极相互作用等)进行。在一些情况下,试剂向凝胶珠粒或本文所述的任何其它微胶囊上的偶联/固定可以是可逆的,例如,通过不稳定的部分(例如,通过化学交联体,包括本文所述的化学交联体)。在施加刺激时,不稳定的部分可以裂解并且使固定化的试剂得到释放。在一些情况下,不稳定的部分是二硫键。例如,在寡核苷酸条形码通过二硫键固定至凝胶珠粒的情况下,使二硫键暴露于还原剂可以裂解该二硫键并从珠粒上释放寡核苷酸条形码。不稳定的部分可以作为凝胶珠粒或微胶囊的一部分、作为将试剂或分析物连接至凝胶珠粒或微胶囊的化学连接体的一部分和/或作为试剂或分析物的一部分而包含在内。
55.本文所述的凝胶珠粒或任何其它类型的微胶囊可包含不同数量的试剂。每个微胶囊的试剂密度可根据所使用的具体微胶囊和具体试剂而不同。例如,微胶囊或凝胶珠粒可包含至少约1、10、100、1,000、10,000、100,000、1,000,000、5,000,000、10,000,000、50,000,000、100,000,000、500,000,000或1,000,000,000个寡核苷酸条形码/微胶囊或凝胶珠粒。凝胶珠粒可包含相同的寡核苷酸条形码或者可包含不同的寡核苷酸条形码。
56.在其它实例中,微胶囊可以包含在胶囊的外壳壁上产生净中性的、负的或正的电荷的一种或多种材料。在一些情况下,胶囊的电荷可以有助于防止或促进颗粒的聚集或成簇,或者向装置的部分上的附着或对该部分的排斥。
57.此外,微胶囊可包含致使胶囊的外壳壁成为亲水性或疏水性的一种或多种材料。可用于胶囊外壳壁的亲水性材料可以是聚(n
‑
异丙基丙烯酰胺)。可用于胶囊外壳壁的疏水性材料可以是聚苯乙烯。在某些情况下,亲水性壳壁可有助于胶囊向包含水性流体的孔中的芯吸。c.微胶囊的大小和形状
58.微胶囊可以具有许多大小或形状中的任何大小或形状。在一些情况下,微胶囊的形状可以是球形、椭圆体、圆柱形、六边形或任何其它对称或非对称的形状。微胶囊的任何横截面也可以具有任何适当的形状,包括但不限于:圆形、椭圆形、正方形、矩形、六边形或其它对称或非对称的形状。在一些情况下,微胶囊可以具有与装置的开口(例如,微孔的表面)互补的特定形状。例如,微胶囊可以是球形且装置的微孔的开口可以是圆形。
59.微胶囊可以具有均匀的大小(例如,所有的微胶囊都具有相同的大小)或不均匀的大小(例如,一些微胶囊具有不同的大小)。微胶囊的尺寸(例如,直径、横截面、边等)可为至少约0.001μm、0.01μm、0.1μm、0.5μm、1μm、5μm、10μm、50μm、100μm、200μm、300μm、400μm、500μm、600μm、700μm、800μm、900μm或1nm。在一些情况下,微胶囊包含至多为约0.001μm、0.01μm、0.1μm、0.5μm、1μm、5μm、10μm、50μm、100μm、200μm、300μm、400μm、500μm、600μm、700μm、800μm、900μm或1nm的微孔。
60.在一些情况下,微胶囊具有一定的大小和/或形状,以使有限数目的微胶囊沉积在微胶囊阵列的单个分区(例如,微孔、微滴)中。微胶囊可具有特定的大小和/或形状,使得恰好或不超过1、2、3、4、5、6、7、8、9或10个胶囊适配至单个微孔中;在一些情况下,平均1、2、3、4、5、6、7、8、9或10个胶囊适配至单个微孔中。在又进一步的情况下,至少1、2、3、4、5、6、7、8、9、10、100、500或1000个胶囊适配至单个微孔中。d.试剂和试剂加载
61.本文提供的装置可包含游离的试剂和/或封装在微胶囊中的试剂。所述试剂可以是适合于分析物的样品制备反应的各种分子、化学物质、颗粒和元素。例如,在用于靶标的dna测序的样品制备反应中使用的微胶囊可以包含一种或多种下列试剂:酶、限制酶(例如,多重切割酶(multiple cutters))、连接酶、聚合酶(例如,识别及不识别dutp和/或尿嘧啶的聚合酶)、荧光团、寡核苷酸条形码、缓冲液、脱氧核苷酸三磷酸(dntp)(例如,脱氧腺苷三磷酸(datp)、脱氧胞苷三磷酸(dctp)、脱氧鸟苷三磷酸(dgtp)、脱氧胸苷三磷酸(dttp)、脱氧尿苷三磷酸(dutp))、脱氧核苷酸三磷酸(ddntp)等。在另一实例中,在用于单细胞分析的样品制备反应中使用的微胶囊可以包含试剂,诸如下列一种或多种试剂:裂解缓冲液、去污剂、荧光团、寡核苷酸条形码、连接酶、蛋白酶、可热活化的蛋白酶、蛋白酶或核酸酶抑制剂、缓冲液、酶、抗体、纳米颗粒等。
62.示例性试剂包括但不限于:缓冲液、酸性溶液、碱性溶液、温度敏感性酶、ph敏感性酶、光敏性酶、金属、金属离子、氯化镁、氯化钠、锰、水性缓冲液、温和缓冲液、离子缓冲液、抑制剂、酶、蛋白质、核酸、抗体、糖类、脂质、油、盐、离子、去污剂、离子型去污剂、非离子型去污剂、寡核苷酸、核苷酸、dntp、ddntp、脱氧核糖核酸(dna)、核糖核酸(rna)、肽核酸、环状
dna(cdna)、双链dna(dsdna)、单链dna(ssdna)、质粒dna、粘粒dna、染色体dna、基因组dna(gdna)、病毒dna、细菌dna、mtdna(线粒体dna)、信使rna(mrna)、核糖体rna(rrna)、转运rna(trna)、nrna、短干扰rna(sirna)、小核rna(snrna)、小核仁rna(snorna)、小cajul体特异性rna(scarna)、microrna、双链rna(dsrna)、核酶、核糖开关和病毒rna、聚合酶(例如,识别及不识别dutp和/或尿嘧啶的聚合酶)、连接酶、限制酶、蛋白酶、核酸酶、蛋白酶抑制剂、核酸酶抑制剂、螯合剂、还原剂(例如,二硫苏糖醇(dtt)、2
‑
三(2
‑
羧乙基)膦(tcep))、氧化剂,荧光团、探针、发色团、染料、有机物、乳化剂、表面活性剂、稳定剂、聚合物、水、小分子、药物、放射性分子、防腐剂、抗生素、适体和药学上的药物化合物。
63.在一些情况下,微胶囊包含一组具有相似属性的试剂(例如,一组酶、一组矿物质、一组寡核苷酸、不同条形码的混合物、相同条形码的混合物)。在其它情况下,微胶囊包含试剂的不均匀混合物。在一些情况下,试剂的不均匀混合物包含进行反应所必需的所有组分。在一些情况下,除了进行反应所必需的1、2、3、4、5种或更多种组分外,这样的混合物包含进行反应所必需的所有组分。在一些情况下,这样的附加组分包含于不同的微胶囊内或装置的分区(例如,微孔)内的溶液内。
64.试剂可以预加载到装置中(例如,在引入分析物之前)或后加载到装置中。它们可以直接加载到装置中;或者,在一些情况下,试剂被封装入加载到装置中的微胶囊内。在一些情况下,仅引入包含试剂的微胶囊。在其它情况下,游离的试剂和封装在微胶囊中的试剂顺次或同时地均被加载至装置中。在一些情况下,试剂在特定步骤之前或之后引入到装置。例如,可在将细胞样品分割到装置内的多个分区(例如,微孔、微滴)中之后向该装置中引入裂解缓冲液试剂。在一些情况下,顺次引入试剂和/或包含试剂的微胶囊,使得在不同的步骤发生不同的反应或操作。试剂(或微胶囊)也可以在穿插有反应或操作步骤的步骤中进行加载。例如,可将包含用于对分子(例如核酸)进行片段化的试剂的微胶囊加载至装置中,随后是片段化步骤,其后可加载包含用于连接条形码(或其它独特标识符,例如抗体)的试剂的微胶囊,随后将条形码连接至片段化的分子上。在本文的其它部分进一步描述了加载试剂的其它方法。e.分子“条形码”65.可能需要在样品制备之后或期间保留鉴别和追踪单个分子或分析物的选择。在一些情况下,一个或多个独特分子标识符(在本领域中有时被称为“分子条形码”)用作样品制备试剂。这些分子可包含多种不同的形式,诸如寡核苷酸条形码、抗体或抗体片段、荧光团、纳米颗粒和其它元件或它们的组合。根据具体应用,分子条形码可以可逆地或不可逆地与靶分析物结合,并允许在样品制备后在从装置中回收后鉴别和/或量化单个分析物。
66.本公开内容的装置可以适用于核酸测序、蛋白质检测、单分子分析和其它方法,该方法需要:a)精确测量特定分析物的存在和量,b)多重反应,其中将多个分析物合并以用于分析。本公开内容的装置可采用微孔阵列的微孔或其它类型的分区(例如,微滴),以在物理上分割靶分析物。这种物理分割允许单个分析物获得一个或多个分子条形码。样品制备后,可将单个分析物合并或组合并从装置中提取以用于多重分析。对于大多数应用,多重分析大大降低了分析成本并增加了过程的通量,例如在核酸测序的情况下。即使在合并多个分析物后,分子条形码也可以允许对单个分子的鉴别和量化。例如,对于核酸测序而言,即使在合并多个不同的核酸后,分子条形码也可以允许对单个核酸的测序。
67.在一些情况下,寡核苷酸条形码可能特别适用于核酸测序。一般而言,寡核苷酸条形码可以包含独特序列(例如,条形码序列),该独特序列使该寡核苷酸条形码具有其鉴别功能。该独特序列可以是随机的或非随机的。条形码序列与感兴趣的核酸的附接可将条形码序列与感兴趣的核酸关联起来。条形码然后可用于在测序期间鉴别感兴趣的核酸,即使当存在其它感兴趣的核酸(例如,包含不同的条形码)时。在测序前对感兴趣的核酸进行片段化的情况下,附接的条形码可用来在测序过程中将片段鉴别为属于感兴趣的核酸。
68.寡核苷酸条形码可以仅由独特条形码序列组成,或者可以作为较长序列长度的寡核苷酸的一部分而包含在内。这样的寡核苷酸可以是特定测序化学和/或方法所需要的衔接子(adaptor)。例如,除寡核苷酸条形码外,这样的衔接子还可包括:将衔接子固定(例如,通过杂交)至固体表面(例如,在测序仪流动池通道中的固体表面)所需的固定化序列区域;测序引物的结合所需的序列区域;和/或例如可用于随机扩增方案的随机序列(例如,随机n
‑
mer)。例如,通过扩增、连接或本文所述的任何其它方法,可将衔接子附接至待测序的核酸。
69.此外,寡核苷酸条形码和/或包含寡核苷酸条形码的较大寡核苷酸可以包含天然核酸碱基和/或可以包含非天然碱基。例如,在寡核苷酸条形码或包含寡核苷酸条形码的较大寡核苷酸是dna的情况下,该寡核苷酸可以包含天然dna碱基腺嘌呤、鸟嘌呤、胞嘧啶和胸腺嘧啶,和/或可以包含非天然碱基,如尿嘧啶。f.用于微孔加载的微胶囊制备物
70.制备后,可使用多种方法将加载有试剂的微胶囊加载至装置中。在一些情况下,微胶囊可作为“干胶囊”进行加载。制备后,可使用多种技术将胶囊从液相中分离,该技术包括但不限于差速离心、液相蒸发、色谱法、过滤等。“干胶囊”可作为粉末或微粒物质被收集,然后沉积到微孔阵列的微孔内。在“湿胶囊”的加载导致加载低效,例如空孔和微胶囊在整个微孔阵列上分布较差的情况下,加载“干胶囊”可能是优选的方法。
71.当微胶囊处于液相内时,还可将加载有试剂的微胶囊加载到装置中,并由此作为“湿胶囊”进行加载。在一些情况下,微胶囊可以悬浮在挥发性油中,使得该油可以被除去或蒸发掉,在孔中仅留下干胶囊。在干胶囊的加载导致加载低效,例如微胶囊成簇、聚集和微胶囊在整个微孔阵列上分布较差的一些情况下,加载“湿胶囊”可能是优选的方法。加载试剂和微胶囊的其它方法在本公开内容的其它部分进行了描述。
72.微胶囊也可具有特定的密度。在一些情况下,微胶囊比水性流体(例如,水)密度低;在一些情况下,微胶囊比水性流体(例如,水)密度大。在一些情况下,微胶囊比非水性流体(例如,油)密度低;在一些情况下,微胶囊比非水性流体(例如,油)密度大。微胶囊可具有至少约0.05g/cm3、0.1cm3、0.2g/cm3、0.3g/cm3、0.4g/cm3、0.5g/cm3、0.6g/cm3、0.7g/cm3、0.8g/cm3、0.81g/cm3、0.82g/cm3、0.83g/cm3、0.84g/cm3、0.85g/cm3、0.86g/cm3、0.87g/cm3、0.88g/cm3、0.89g/cm3、0.90g/cm3、0.91g/cm3、0.92g/cm3、0.93g/cm3、0.94g/cm3、0.95g/cm3、0.96g/cm3、0.97g/cm3、0.98g/cm3、0.99g/cm3、1.00g/cm3、1.05g/cm3、1.1g/cm3、1.2g/cm3、1.3g/cm3、1.4g/cm3、1.5g/cm3、1.6g/cm3、1.7g/cm3、1.8g/cm3、1.9g/cm3、2.0g/cm3、2.1g/cm3、2.2g/cm3、2.3g/cm3、2.4g/cm3或2.5g/cm3的密度。在其它情况下,微胶囊的密度可以为至多约0.7g/cm3、0.8g/cm3、0.81g/cm3、0.82g/cm3、0.83g/cm3、0.84g/cm3、0.85g/cm3、0.86g/cm3、0.87g/cm3、0.88g/cm3、0.89g/cm3、0.90g/cm3、0.91g/cm3、0.92g/cm3、0.93g/cm3、
0.94g/cm3、0.95g/cm3、0.96g/cm3、0.97g/cm3、0.98g/cm3、0.99g/cm3、1.00g/cm3、1.05g/cm3、1.1g/cm3、1.2g/cm3、1.3g/cm3、1.4g/cm3、1.5g/cm3、1.6g/cm3、1.7g/cm3、1.8g/cm3、1.9g/cm3、2.0g/cm3、2.1g/cm3、2.2g/cm3、2.3g/cm3、2.4g/cm3或2.5g/cm3。这样的密度可以反映微胶囊在任何特定流体(例如,水性的、水、油等)中的密度。iii.微孔阵列a.结构/特征
73.本公开内容的装置可以是包含固体板的微孔阵列,该固体板包含其内沉积有微胶囊和/或分析物的多个孔洞、空腔或微孔。通常,将流体样品(或分析物)引入装置中(例如,通过入口),然后穿过将样品分布至多个微孔中的流动通道行进。在一些情况下,还将额外的流体引入装置中。当引入样品时,微孔可以包含微胶囊;或者,在一些情况下,在引入样品后,将微胶囊引入微孔中。
74.图2a示出了微孔阵列的原型;图2b示出了侧视图。该微孔阵列可包含板220,该板220可以由在化学实验室中常用的任何合适的材料制成,该材料包括熔融石英、钠钙玻璃(soda lima glass)、硼硅玻璃、pmma、蓝宝石、硅、锗、环烯烃共聚物和环状聚合物、聚乙烯、聚丙烯、聚丙烯酸酯、聚碳酸酯、塑料、topas以及其它本领域已知的合适的底物。板220最初可以是平的固体板,其包含微孔270的规则图案。微孔可通过钻孔或化学溶解或任何其它合适的机械加工方法来形成;然而,具有所需孔洞图案的板优选地被模塑,例如通过注塑成型、压纹或使用合适的聚合物如环烯烃共聚物。
75.微孔阵列可包含入口(200和240)和/或出口(210和260);在一些情况下,微孔阵列包含多个入口和/或出口。样品(或分析物)或微胶囊可经由入口被引入装置中。含有分析物、试剂和/或微胶囊的溶液可以通过移液管被手动加至入口端口200和240(或加至与入口端口附接的导管)。在一些情况下,使用液体处理装置将分析物、试剂和/或微胶囊引入装置中。示例性液体处理装置可以依赖于移液机器人、毛细管作用或向流体中的浸入。在一些情况下,入口端口连接至包含微胶囊或分析物的储器。入口端口可以连接到流动通道250,流动通道250允许将分析物、样品或微胶囊分配至装置中的微孔。在一些情况下,入口端口可以用来向装置中引入不含微胶囊或分析物的流体(例如,油,水性的),诸如载体流体。载体流体可在分析物和/或微胶囊引入之前、期间或之后经由入口端口引入。在装置具有多个入口的情况下,可以经由所述多个入口引入相同的样品,或者每个入口可以传送不同的样品。在一些情况下,一个入口可以将样品或分析物传送至微孔,而不同的入口将游离的试剂和/或封装在微胶囊中的试剂传送至装置。该装置可具有至少1、2、3、4、5、6、7、8、9或10个入口和/或出口。
76.在一些情况下,包含微胶囊和/或分析物的溶液可以经由附接至出口端口210和260的真空歧管而被牵拉过该装置。这样的歧管可向装置施加负压。在其它情况下,使用正压来移动样品、分析物和/或微胶囊穿过该装置。根据本公开内容的230表面的面积、长度和宽度可以根据将要进行的测定的要求而不同。考虑因素可包括:例如,处理的简单程度、形成表面的材料的限制、检测或处理系统的要求、沉积系统(例如,微流体系统)的要求等。厚度可包括至少约0.001mm、0.005mm、0.01mm、0.05mm、0.1mm、0.2mm、0.3mm、0.4mm、0.5mm、0.6mm、0.7mm、0.8mm、0.9mm、1.0mm、2.0mm、3.0mm、4.0mm、5.0mm、6.0mm、7.0mm、8.0mm、9.0mm、10.0mm、11mm、12mm、13mm、14mm或15mm的厚度。在其它情况下,微胶囊的厚度可以是
至多0.001mm、0.005mm、0.01mm、0.05mm、0.1mm、0.2mm、0.3mm、0.4mm、0.5mm、0.6mm、0.7mm、0.8mm、0.9mm、1.0mm、2.0mm、3.0mm、4.0mm、5.0mm、6.0mm、7.0mm、8.0mm、9.0mm、10.0mm、11mm、12mm、13mm、14mm或15mm。
77.微孔270可具有适于进行测定的任何形状和大小。微孔的横截面可以具有圆形、矩形、正方形、六边形或其它对称或非对称形状的横截面尺寸。在一些情况下,微孔的形状可以是圆柱形、立方体、圆锥形、截头圆锥形、六边形或其它对称或非对称的形状。微孔270的直径可由所需的孔大小和板本身的可用表面积来决定。示例性微孔包括至少0.01μm、0.1μm、0.2μm、0.3μm、0.4μm、0.5μm、1μm、10μm、25μm、50μm、75μm、100μm、200μm、300μm、400μm、500μm、600μm、700μm、800μm、900μm、1.0mm的直径。在其它情况下,微孔直径可包括至多0.01μm、0.1μm、0.2μm、0.3μm、0.4μm、0.5μm、1μm、10μm、25μm、50μm、75μm、100μm、200μm、300μm、400μm、500μm、600μm、700μm、800μm、900μm或1.0mm。
78.各个孔的容量(或容积)可以是孔高度(板的厚度)和各个孔的有效直径的量度。单个孔的容量可以选自众多的容积。在一些情况下,该装置可包含容量至少为0.001fl、0.01fl、0.1fl、0.5fl、1fl、5fl、10fl、50fl、100fl、200fl、300fl、400fl、500fl、600fl、700fl、800fl、900fl、1pl、5pl、10pl、50pl、100pl、200pl、300pl、400pl、500pl、600pl、700pl、800pl、900pl、1nl、5nl、10nl、50nl、100nl、200nl、300nl、400nl、500nl、1ul、50ul或100ul的孔(或微孔)。在其它情况下,微胶囊包含小于0.001fl、0.01fl、0.1fl、0.5l、5fl、10fl、50fl、100fl、200fl、300fl、400fl、500fl、600fl、700fl、800fl、900fl、1pl、5pl、10pl、50pl、100pl、200pl、300pl、400pl、500pl、600pl、700pl、800pl、900pl、1nl、5nl、10nl、50nl、100nl、200nl、300nl、400nl、500nl、1ul、50ul或100ul的微孔。
79.在阵列中的不同微孔中的流体体积可存在可变性。更具体地,不同微孔的容积可以在一组微孔中变化至少(或至多) 或
‑
1%、2%、3%、4%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、200%、300%、400%、500%或1000%。例如,微孔可以包含占第二微孔内的流体体积的至多80%的流体体积。
80.基于单个微孔的尺寸和板的大小,所述微孔阵列可包括一系列的孔密度。在一些实例中,多个微孔可具有至少约2,500个孔/cm2、至少约1,000个孔/cm2的密度。在一些情况下,多个孔可以具有至少10个孔/cm2的密度。在其它情况下,孔密度可以包括至少10个孔/cm2、50个孔/cm2、100个孔/cm2、500个孔/cm2、1000个孔/cm2、5000个孔/cm2、10000个孔/cm2、50000个孔/cm2或100000个孔/cm2。在其它情况下,孔密度可以小于100000个孔/cm2、10000个孔/cm2、5000个孔/cm2、1000个孔/cm2、500个孔/cm2或100个孔/cm2。
81.在一些情况下,微孔的内表面包含优选容纳水性样品的亲水性材料;在一些情况下,微孔间的区域由可优先吸引本文所述的疏水性密封流体的疏水性材料构成。
82.多个微孔阵列,例如图2b,可以布置在单个装置内。图3,300。例如,离散的微孔阵列载片可以平行地排列在板支持物上。在一些情况下,至少1、2、3、4、5、6、7、8、9、10、25、50或100个微孔阵列平行排列。在其它情况下,至多100、50、25、10、9、8、7、6、5、4、3、2或1个装置平行排列。在共同装置中的微孔阵列可以同时或顺次地操作。例如,排列好的装置可以同时或顺次地加载样品或胶囊。b.微孔阵列流体
83.微孔阵列可包含任何数目的不同流体,包括水性、非水性、油和有机溶剂,如醇。在一些情况下,该流体用于将诸如试剂、微胶囊或分析物的组分携带到目标位置,如微孔、出口端口等。在其它情况下,该流体用于冲洗系统。在另一些情况下,该流体可用来密封微孔。
84.可以使用与在装置中使用的分析物(例如,细胞、分子)或试剂在生理学上相容的任何流体或缓冲液。在一些情况下,该流体是水性的(缓冲的或非缓冲的)。例如,可将包含悬浮于缓冲的水性溶液中的细胞群体的样品引入微孔阵列中,使之流过该装置并分布至微孔。在其它情况下,流过该装置的流体是非水性的(例如,油)。示例性的非水性流体包括但不限于:油、非极性溶剂、烃油、癸烷(例如,十四烷或十六烷)、氟碳油、氟化油、硅油、矿物油或其它油。
85.通常,微胶囊悬浮于与微胶囊的壳的组分相容的流体中。包括但不限于水、醇、烃油或氟碳油的流体是用于将微胶囊悬浮并流动通过微阵列装置的特别有用的流体。c.进一步的分割和密封
86.将分析物、游离的试剂和/或微胶囊加载至装置中并分布至微孔后,可使用密封流体将它们在微孔内进一步分割或分离。密封流体也可用于密封单个孔。可以通过用于引入分析物、试剂和/或微胶囊的相同入口端口来引入密封流体。但在一些情况下,通过一个单独的入口端口或通过多个单独的入口端口来将密封流体引入装置中。
87.通常,密封流体是非水性流体(例如,油)。当密封流体流动通过微孔阵列装置时,它可从单个微孔置换过量的水性溶液(例如,包含分析物、游离试剂和/或微胶囊的溶液),从而潜在地移除相邻微孔之间的水性桥联。本文所述的孔本身可包含能够使水性流体(例如,样品流体、微胶囊流体)芯吸入单个孔中的亲水性材料。在一些情况下,位于孔外部的区域包含疏水性材料,同样是用于促进水性流体定位至微孔的内部。
88.密封流体可以保留在装置中或者被移除。密封流体可以例如通过流动通过出口端口而被移除。在其它情况下,密封油可包含挥发性油,该挥发性油可通过施加热而被除去。一旦移除密封流体,分析物、游离试剂和/或微胶囊可以在微孔中彼此在物理上分割。
89.可以选择流体,使得其密度等于、大于或小于微胶囊的密度。例如,微胶囊的密度可以大于密封油和/或样品和试剂的水性流体,从而使得当密封油流过该装置时微胶囊能够保留在微孔中。在另一实例中,胶囊的密度可以小于本文所述的样品的水性流体或悬浮有微胶囊的流体的密度,从而促进胶囊在装置的多个微孔中的移动和分布。
90.在包含顺磁性材料的微胶囊的情况下,可以利用磁场来加载或引导胶囊进入微孔。磁场也可用于在向孔填充样品、试剂和/或密封流体的同时将这样的微胶囊保留在孔内。磁场也可用于从孔中移除胶囊壳,特别是在胶囊破裂后。
91.在一些情况下,当在微孔内进行操作或反应时,密封流体可保留在其中。密封流体的存在可用来进一步分割、分离或密封单个微孔。在其它情况下,密封流体可充当微胶囊的载体。例如,可将包含微胶囊的密封流体引入装置,以促进微胶囊向单个微孔的分布。对于这样的应用,密封流体可以比微胶囊的密度大,以促进微胶囊更均匀地分布至微孔中。在施加刺激时,密封流体内的微胶囊可以将试剂释放至微孔。在一些情况下,密封流体可以包含能够从密封流体行进至孔(例如,通过浸出或其它机制)并触发胶囊破裂的化学或其它试剂,其中胶囊存在于微孔内或密封流体内。
92.除了涉及密封流体的方法外的方法也可用于在加载分析物、游离试剂和/或微胶
囊后密封微孔。例如,微孔可以用层合件、带材、塑料盖、油、蜡或其它合适的材料来密封,以产生封闭的反应室。本文所述的密封剂可防止微孔的内容物蒸发或防止反应或操作的其它意外后果。当向装置施加热时,例如,当施加热以刺激微胶囊释放时,可能特别需要防止蒸发。
93.在一些情况下,层合件密封也可以允许从单个孔中回收内容物。在这种情况下,所关注的一个孔在给定的时间可以解除密封(例如,通过去除层合件密封),以便能够进一步分析分析物,例如通过maldi质谱法。这样的应用可用于许多设置,包括高通量药物筛选。iv.加载步骤
94.如本文所述,可以将分析物、游离试剂和/或微胶囊按任何适当的方式或顺序加载至本发明的装置中。加载可以是随机或非随机的。在一些情况下,将精确数目的分析物和/或微胶囊加载至各个单个微孔中。在一些情况下,将精确数目的分析物和/或微胶囊加载至板中的微孔的特定部分中。在又一些其它情况下,将平均数目的分析物和/或微胶囊加载至各个单个微孔中。此外,如本文所述,在一些情况下,将“干”微胶囊加载至该装置中,而在其它情况下,将“湿”微胶囊加载至该装置中。在一些情况下,将“干”和“湿”微胶囊和/或试剂的组合同时或顺次地加载至该装置中。
95.如本文中所提到的,装置的加载可以按任何顺序进行并且可以分多个阶段进行。在一些情况下,在加载分析物之前,将微胶囊预加载到该装置中。在另一些情况下,同时加载微胶囊和分析物。在再另一些情况下,在加载微胶囊之前加载分析物。
96.微胶囊和/或分析物可以分多个阶段或多次加载。例如,在将分析物加载至装置之前和之后,都可将微胶囊加载至装置中。预加载(例如,在引入分析物之前加载)的微胶囊可包含与在引入分析物之后加载的微胶囊相同的试剂。在其它情况下,预加载的微胶囊包含与在引入分析物后加载的微胶囊内的试剂不同的试剂。在一些情况下,将至少1、2、3、4、5、6、7、8、9、10、15或20个不同组的微胶囊加载至装置上。在一些情况下,不同组的微胶囊是顺次加载的;或者,不同组的微胶囊也可以同时加载。类似地,可以将多组分析物加载至装置中。在一些情况下,将至少1、2、3、4、5、6、7、8、9、10、15或20个不同组的分析物加载至装置上。在一些情况下,不同组的分析物是顺次加载的;或者,不同组的分析物也可以同时加载。
97.本公开内容提供了每个孔包含加载的一定数目的微胶囊和/或分析物的装置。在一些情况下,将至多1、2、3、4、5、6、7、8、9、10、15、20、30、40、50、75或100个微胶囊和/或分析物加载至各个单个微孔中。在一些情况下,将至少1、2、3、4、5、6、7、8、9、10、15、20、30、40、50、75或100个微胶囊和/或分析物加载至各个单个微孔中。在一些情况下,平均而言,将至多1、2、3、4、5、6、7、8、9、10、15、20、30、40、50、75或100个微胶囊和/或分析物加载至各个单个微孔。在其它情况下,平均而言,将至少1、2、3、4、5、6、7、8、9、10、15、20、30、40、50、75或100个微胶囊和/或分析物加载至各个单个微孔中。在一些情况下,将约1、2、3、4、5、6、7、8、9、10、15、20、30、40、50、75或100个微胶囊和/或分析物加载至各个单个微孔中。
98.分析物和/或微胶囊可以以允许所需数目的分析物沉积至单个微孔中的量来施加。例如,分析物(诸如细胞)的最终稀释度可以实现每一个微孔加载一个细胞或每个微孔加载任何所需数目的分析物。在一些情况下,利用泊松分布来指导或预测每个孔中的分析物或微胶囊的最终浓度。
99.微胶囊可以以特定模式加载至微阵列装置中。例如,该装置的某些部分可包含含
有特定试剂(例如,独特条形码、酶、抗体、抗体亚类等)的微胶囊,而该装置的其它部分可以包含含有不同试剂(例如,不同条形码、不同酶、不同抗体、不同抗体亚类等)的微胶囊。在一些情况下,在阵列的一部分中的微胶囊可以含有对照试剂。例如,它们可以含有阳性对照,该阳性对照包含对照分析物和用于反应的必要材料。或者,在一些情况下,微胶囊含有阴性对照试剂,诸如灭活的酶或对片段化具有抗性的合成寡核苷酸序列。在一些情况下,阴性对照试剂可以控制样品制备反应的特异性等。在其它情况下,阴性对照微胶囊可包含存在于其它微胶囊中的相同试剂,不同之处在于该阴性对照微胶囊可能缺乏某些试剂(例如,裂解缓冲液、聚合酶等)。
100.分析物/样品也可以以特定模式加载至微阵列装置中。例如,该装置的某些部分可以包含特定分析物,诸如对照分析物或源自特定来源的分析物。这可以与条形码向已知孔位置的特定加载组合使用。这个特征可以允许将阵列上的特定位置定位(mapping)至测序数据,从而减少将要用于标记反应的条形码的数目。
101.在分区为微滴的情况下,分析物与试剂可在微流体装置的帮助下在微滴内组合。例如,可以生成微滴,其包含凝胶珠粒(例如,包含寡核苷酸条形码的凝胶珠粒)、核酸分析物和任何其它所需的试剂。凝胶珠粒、核酸分析物和在水相中的试剂可在微流体装置的两个或更多个通道的交叉点处组合。在微流体装置的两个或更多个通道的第二交叉点处,可通过试剂、凝胶珠粒和核酸分析物的水性混合物与油连续相接触而生成包含所得混合物的微滴。v.微胶囊刺激
102.多种不同的刺激可用于触发试剂从微胶囊中释放或从其中的内部隔室中释放。在一些情况下,微胶囊是可降解的。通常,触发可导致包围微胶囊的壳或膜的破裂或降解、微胶囊内部的破裂或降解和/或将试剂固定至微胶囊的任何化学键的断裂或降解。示例性的触发包括但不限于:化学触发、主体变化(bulk changes)、生物触发、光触发、热触发、磁触发及其任意组合。参见,例如,esser
‑
kahn等人(2011)macromolecules 44:5539
‑
5553;wang等人(2009)chemphys chem10:2405
‑
2409。a.化学刺激和主体变化
103.许多化学触发可用于触发微胶囊的破裂或降解。这些化学变化的实例可以包括但不限于对壳壁的ph介导的变化、通过交联键的化学裂解的壳壁的崩解、触发的壳壁的解聚以及壳壁切换反应(shell wall switching reactions)。主体变化也可用于触发微胶囊的破裂。
104.溶液ph值的变化,特别是ph的下降,可通过许多不同的机制触发破裂。酸的加入可通过多种机制引起壳壁的降解或分解。质子的加入可以分解壳壁中的聚合物的交联,破坏壳壁中的离子键或氢键,或在壳壁中产生纳米孔以允许内部内容物渗透通过至外部。在一些实例中,微胶囊包含酸可降解的化学交联体,例如缩酮。ph的降低,特别是降至低于5的ph,可诱发缩酮转化成酮和两种醇并促进微胶囊的破裂。在其它实例中,微胶囊可以包含一种或多种ph敏感的聚电解质(例如,paa、paam、pss等)。ph的降低可破坏这样的微胶囊的离子键或氢键键合相互作用,或在其中产生纳米孔。在一些情况下,包含聚电解质的微胶囊含有当ph变化时扩张和收缩的带电荷的、基于凝胶的芯。
105.在微胶囊内的交联体(例如二硫键)的除去也可以通过多种机制来完成。在一些实
例中,多种化学物质可以加入到微胶囊的溶液中,该溶液诱导壳壁的聚合物组分的氧化、还原或其它化学变化。在一些情况下,加入还原剂,诸如β
‑
巯基乙醇、二硫苏糖醇(dtt)或2
‑
三(2
‑
羧乙基)膦(tcep),使得微胶囊壳壁中的二硫键破裂。另外,可以加入酶,以裂解微胶囊内的肽键,从而导致壳壁交联体的裂解。
106.解聚也可以用于破裂微胶囊。可加入化学触发,以促进保护头基的移除。例如,触发可导致聚合物内的碳酸酯或氨基甲酸酯的头基的移除,而这又引起解聚和试剂从胶囊内部的释放。
107.壳壁切换反应可能是由于壳壁孔隙率的任何结构变化所致。壳壁的孔隙率可以被修饰,例如通过加入偶氮染料或紫精衍生物。能量(例如,电、光)的加入也可用于刺激孔隙率的变化。
108.在又一个例子中,化学触发可包括渗透触发,从而微胶囊溶液的离子或溶质浓度的变化诱发胶囊的溶胀。溶胀可引起内压的积聚,使得胶囊破裂,以释放其内容物。
109.本领域中还已知,通过多种刺激导致的微胶囊的主体或物理变化还在设计胶囊以释放试剂方面提供了许多优势。主体或物理变化在宏观规模上发生,其中胶囊破裂是由刺激诱发的机械
‑
物理力的结果。这些方法可包括但不限于压力诱发的破裂、壳壁熔化或壳壁孔隙率的变化。b.生物刺激
110.生物刺激也可用于触发微胶囊的破裂或降解。通常,生物触发类似于化学触发,但许多实例使用生物分子或在生命系统中通常发现的分子,如酶、肽、糖类、脂肪酸、核酸等。例如,微胶囊可包含具有肽交联的聚合物,该肽交联对由特异性蛋白酶引起的裂解是敏感的。更具体地,一个实例可以包括包含gflgk肽交联的微胶囊。在加入生物触发如蛋白酶组织蛋白酶b时,壳壁的肽交联被裂解并释放胶囊的内容物。在其它情况下,蛋白酶可以被热活化。在另一实例中,微胶囊包含含有纤维素的壳壁。水解酶壳聚糖的加入用作对纤维素键的裂解、壳壁的解聚以及其内部内容物的释放的生物触发。c.热刺激
111.当施加热刺激时,也可以诱导微胶囊释放其内容物。温度的变化可引起微胶囊的多种变化。热的变化可导致微胶囊的熔化,使得壳壁崩解。在其它情况下,热可增加胶囊的内部组分的内压,使得胶囊破裂或爆破。在另一些情况下,热可将胶囊转变成皱缩的脱水状态。热也可以作用于微胶囊的壳中的热敏性聚合物,以引起微胶囊的破裂。
112.在一个实例中,微胶囊包含封装一个或多个乳化的试剂颗粒的热敏性水凝胶壳。在施加热时,如高于35℃时,外壳壁的水凝胶材料收缩。壳的突然收缩使胶囊破裂并使胶囊内部的试剂喷射在微孔的样品制备溶液中。
113.在一些情况下,壳壁可以包含二嵌段聚合物或具有不同热敏性的两种聚合物的混合物。一种聚合物可能在施加热后特别可能收缩,而另一种则是更加热稳定的。当向这样的壳壁施加热时,热敏性聚合物可以收缩,而另一种则保持完整,从而引起孔隙的形成。在另一些情况下,壳壁可以包含磁性纳米颗粒。暴露于磁场可导致热的产生,从而导致微胶囊的破裂。d.磁刺激
114.微胶囊的壳壁包含磁性纳米颗粒可以允许胶囊的触发破裂以及引导阵列中的颗
粒。本公开内容的装置可包含用于任一目的的磁性颗粒。在一个实例中,将fe3o4纳米颗粒引入含有聚电解质的胶囊中在振荡磁场刺激的存在下触发破裂。e.电和光刺激
115.微胶囊也可由于电刺激而破解或降解。类似于前一节中描述的磁性颗粒,电敏感性颗粒可以允许胶囊的触发破裂以及其它功能,如在电场中的对齐、电导性或氧化还原反应。在一个实例中,含有电敏感性材料的微胶囊在电场中对齐,使得可以控制内部试剂的释放。在其它实例中,电场可在壳壁自身内诱发氧化还原反应,这可增加孔隙率。
116.光刺激也可以用于破裂微胶囊。许多光触发是可能的,并可包括使用多种分子(如纳米颗粒和能够吸收特定范围波长的光子的发色团)的系统。例如,金属氧化物涂层可用作胶囊触发。对涂覆有sio2/tio2的聚电解质胶囊的紫外线照射可导致胶囊壁的崩解。在又一实例中,可以在壳壁中引入光开关材料(photo switchable materials),如偶氮苯基团。在施加紫外线或可见光时,诸如这些的化学物质在光子吸收时经历可逆的顺式至反式异构化。在这方面,光开关的引入形成在施加光触发时可崩解或变为更多孔的壳壁。f.刺激的施加
117.本公开内容的装置可与提供这样的触发或刺激的任何设备或装置组合使用。例如,如果刺激是热刺激,则装置可以与加热的或热控制的板组合使用,这允许微孔的加热并可诱发胶囊的破裂。对于热刺激可以使用诸多热传递中的任何热传递,包括但不限于通过辐射传热、对流传热或传导传热施加热。在其它情况下,如果刺激是生物酶,该酶可以注入到装置中,使得它沉积至各个微孔中。在另一方面,如果刺激是磁场或电场,装置可与磁板或电板组合使用。
118.化学刺激可加入至分区并可在化学刺激与微胶囊接触之后在不同时间发挥其功能。化学刺激发挥其作用的速度可根据例如与微胶囊接触的化学刺激的量/浓度和/或使用的具体化学刺激而不同。例如,微滴可以包含可降解的凝胶珠粒(例如,包含化学交联体如二硫键的凝胶珠粒)。在微滴形成时,化学刺激(例如,还原剂)可包含于具有凝胶珠粒的微滴中。化学刺激在与凝胶珠粒接触时立即、在与凝胶珠粒接触后不久(例如,约0、0.5、1、2、3、4、5、6、7、8、9或10min)或者在更迟的时间时,可降解凝胶珠粒。在一些情况下,凝胶珠粒的降解可在进一步的处理步骤,例如本文所述的热循环步骤之前、期间或之后发生。vi.样品制备、反应和回收
119.在施加刺激、胶囊破裂及试剂释放后,样品制备反应可以在装置中进行。装置内的反应可以根据样品反应中使用的试剂来温育不同的时间段。装置还可以与帮助样品制备反应的其他装置组合使用。例如,如果需要pcr扩增,则装置可以与pcr热循环仪组合使用。在一些情况下,热循环仪可以包含多个孔。在分区为微滴的情况下,微滴可进入热循环仪的孔中。在一些情况下,每个孔可包含多个微滴,使得当开始热循环时,多个微滴在每个孔中进行热循环。在另一个实例中,如果反应需要搅拌,则装置可与振摇设备组合使用。
120.在完成样品制备反应后,可以回收样品反应的分析物和产物。在一些情况下,装置可采用包括施加液体或气体来冲洗出单个微孔的内容物的方法。在一个实例中,液体包含优先润湿微孔阵列材料的不混溶载体流体。它也可以与水不混溶,以将反应产物从孔中冲洗出。在另一实例中,液体可以是可用于将样品从孔中冲洗出的水性流体。在冲洗微孔的内容物后,合并微孔的内容物以用于多种下游分析和应用。
vii.应用
121.图4a提供了本公开内容的多种方法的一般流程;图4b提供了4a的概括注释版本。包含试剂410的一个或多个微胶囊可预加载至微孔中,然后加入分析物,在此具体的图中,该分析物是核酸分析物420。然后可通过任何方法,例如通过施加密封流体来密封430微孔。入口和出口端口也可被密封,例如,以防止蒸发。这些步骤之后,可将刺激(例如,热、化学、生物刺激等)施加至微孔,以破裂微胶囊460并触发试剂450向微孔内部的释放。随后,可发生温育步骤440,以使该试剂能够执行特定的功能,诸如细胞的裂解、蛋白质的消化、高分子量核酸的片段化或寡核苷酸条形码的连接。温育步骤(这是任选的)后,微孔的内容物可以单独或批量地回收。a.分析物
122.本公开内容的装置可广泛应用于分析物的操作、制备、鉴别和/或量化。在一些情况下,该分析物是细胞或细胞群体。该细胞群体可以是均质的(例如,来自相同细胞类型的细胞系、来自相同类型的组织、来自相同器官等)或不均质的(不同类型的细胞的混合物)。该细胞可以是原代细胞、细胞系、重组细胞、原代细胞、封装的细胞、游离细胞等。
123.该分析物还可以是分子,包括但不限于:多肽、蛋白质、抗体、酶、核酸、糖类、小分子、药物等。核酸的实例包括但不限于:dna、rna、dntp、ddntp、扩增子、合成核苷酸、合成多核苷酸、多核苷酸、寡核苷酸、肽核酸、cdna、dsdna、ssdna、质粒dna、粘粒dna、高分子量(mw)dna、染色体dna、基因组dna、病毒dna、细菌dna、mtdna(线粒体dna)、mrna、rrna、trna、nrna、sirna、snrna、snorna、scarna、microrna、dsrna、核酶、核糖开关和病毒rna(例如,逆转录病毒rna)。
124.在一些情况下,分析物在加载至装置内之前与一种或多种额外的材料如一种或多种试剂(例如,连接酶、蛋白酶、聚合酶)预混合。在一些情况下,分析物在加载至装置上之前与包含一种或多种试剂的微胶囊预混合。
125.样品可源自多种来源,包括人、哺乳动物、非人哺乳动物、猿、猴、黑猩猩、植物、爬虫类动物、两栖类动物、禽类、真菌、病毒或细菌来源。诸如细胞、核酸和蛋白质等样品也可以从诸如活组织检查、抽吸物、抽血、尿液样品、福尔马林固定的包埋的组织等多种临床来源获得。
126.本公开内容的装置还可以使分析物能够被标记或追踪,以允许随后对分析物来源的鉴别。这一特征与使用合并的或多重反应并且只将测量或分析提供为多个样品的平均值的其它方法形成对比。在此,独特标识符向单个分析物的物理分割和分配允许从单个样品中获取数据并且不限于样品的平均值。
127.在一些实例中,来源于单细胞的核酸或其它分子可共有共同的标签或标识符,并因此可在稍后被鉴别为源自该细胞。类似地,来自核酸的一条链的所有片段可以用相同的标识符或标签来标记,由此允许随后鉴别在相同链上具有相似定相或连接的片段。在其它情况下,可以对来自单个细胞的基因表达产物(例如,mrna、蛋白质)进行标记,以量化表达。在另一些情况下,该装置可作为pcr扩增对照来使用。在这样的情况下,来自pcr反应的多个扩增产物可以用相同的标签或标识符标记。如果随后对产物进行测序并证明有序列差异,则具有相同标识符的产物之间的差异可以归因于pcr错误。
128.在加载微胶囊和/或游离试剂之前、之后或期间,可以将分析物加载至装置上。在
一些情况下,在加载至微胶囊阵列内之前,将分析物封装至微胶囊内。例如,可以将核酸分析物封装至微胶囊中,然后将微胶囊加载至装置上并稍后触发以将分析物释放至合适的微孔中。
129.任何分析物,如dna或细胞,可以在溶液中或作为封装在胶囊中的分析物来加载。在一些情况下,将分子(例如,核酸,蛋白质等)的均质或不均质群体封装到微胶囊中并加载至装置上。在一些情况下,将细胞的均质或不均质群体封装至微胶囊中并加载至装置上。微胶囊可包含随机或特定数目的细胞和/或分子。例如,微胶囊可包含不超过1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、500、1000、5000或10000个细胞和/或分子/微胶囊。在其它实例中,微胶囊包含至少1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、500、1000、5000或10000个细胞和/或分子/微胶囊。流体技术和任何其它技术可用于将细胞和/或分子封装至微胶囊中。
130.通常,本文提供的方法和组合物可用于在下游应用如测序反应之前制备分析物。通常,测序方法是经典的sanger测序。测序方法可以包括但不限于:高通量测序、焦磷酸测序、合成测序、单分子测序、纳米孔测序、连接测序、杂交测序、rna测序(illumina)、数字基因表达(helicos)、下一代测序、单分子合成测序(smss)(helicos)、大规模平行测序、克隆单分子阵列(solexa)、鸟枪法测序、maxim
‑
gilbert测序、引物步移法以及本领域中已知的任何其它测序方法。
131.可以代替测序反应或与测序反应一起进行的应用存在许多实例,包括但不限于:生化分析、蛋白质组学、免疫测定、特定细胞类型的剖析(profiling)/指纹分析、药物筛选、诱饵
‑
捕获实验、蛋白质
‑
蛋白质相互作用筛选等。b.独特标识符向分析物的分配
132.本文所公开的装置可在涉及将独特标识符或分子条形码分配至分析物的应用中使用。通常,独特标识符是用于标记分析物的条形码寡核苷酸;但是,在一些情况下,使用不同的独特标识符。例如,在一些情况下,独特标识符是抗体,在这种情况下,附接可包括抗体与分析物(例如,抗体与细胞、抗体与蛋白质、抗体与核酸)之间的结合反应。在其它情况下,独特标识符是染料,在这种情况下,附接可包括染料嵌入到分析物分子(例如嵌入到dna或rna)中或与染料标记的探针结合。在另一些情况下,独特标识符可以是核酸探针,在这种情况下,附接至分析物可以包括核酸与分析物之间的杂交反应。在一些情况下,该反应可包括标识符与分析物之间的化学连接。在其它情况下,该反应可包括将金属同位素直接添加至分析物或通过标记有同位素的探针添加。
133.通常,所述方法包括通过酶促反应如连接反应将寡核苷酸条形码附接至核酸分析物。例如,连接酶可将dna条形码共价附接至片段化的dna(例如,高分子量dna)。条形码附接后,可对该分子进行测序反应。然而,还可以使用其它反应。例如,包含条形码序列的寡核苷酸引物可用于dna模板分析物的扩增反应(例如,pcr、qpcr、逆转录酶pcr、数字pcr等),从而产生标记的分析物。条形码分配至单个分析物之后,单个微孔的内容物可经由装置中的出口端口回收,以用于进一步分析。
134.可以将独特标识符(例如,寡核苷酸条形码、抗体、探针等)随机地或非随机地引入到装置。在一些情况下,它们以独特标识符与微孔之间的预期的比例而引入。例如,可以加
载独特标识符,以使得每个微孔加载多于约1、2、3、4、5、6、7、8、9、10、20、50、100、500、1000、5000、10000或200000个独特标识符。在一些情况下,可以加载独特标识符,以使得每个微孔加载少于约1、2、3、4、5、6、7、8、9、10、20、50、100、500、1000、5000、10000或200000个独特标识符。在一些情况下,每个微孔加载的独特标识符的平均数小于或大于约0.0001、0.001、0.01、0.1、1、2、3、4、5、6、7、8、9、10、20、50、100、500、1000、5000、10000或200000个独特标识符/微孔。
135.还可以加载独特标识符,以便将一组一个或多个相同标识符引入特定孔中。还可以加载这样的组,使得各个微孔包含不同组的标识符。例如,可制备微胶囊群体,使得该群体中的第一微胶囊包含相同独特标识符(例如,核酸条形码等)的多个拷贝且该群体中的第二微胶囊包含与第一微胶囊中不同的独特标识符的多个拷贝。在一些情况下,微胶囊群体可以包含多个微胶囊(例如,多于2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、100、500、1000、5000、10000、100000、1000000、10000000、100000000或1000000000个微胶囊),各自包含与其它微胶囊中所含的不同的独特标识符的多个拷贝。在一些情况下,该群体可以包含多于2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、100、500、1000、5000、10000、100000、1000000、10000000、100000000或1000000000个具有相同组的独特标识符的微胶囊。在一些情况下,该群体可以包含多于2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、100、500、1000、5000、10000、100000、1000000、10000000、100000000或1000000000个微胶囊,其中微胶囊各自包含独特标识符的不同组合。例如,在一些情况下,不同的组合重叠,使得第一微胶囊可包含例如独特标识符a、b和c,而第二微胶囊可包含独特标识符a、b和d。在另一实例中,不同的组合不重叠,使得第一微胶囊可包含例如独特标识符a、b和c,而第二微胶囊可包含独特标识符d、e和f。
136.独特标识符可以以预期或预测的独特标识符/分析物(例如,核酸链、核酸片段、蛋白质、细胞等)比例加载至装置中。在一些情况下,将独特标识符加载至微孔中,使得微孔中的每个单个分析物加载多于约1、2、3、4、5、6、7、8、9、10、20、50、100、500、1000、5000、10000或200000个独特标识符。在一些情况下,将独特标识符加载至微孔中,使得微孔中的每个单个分析物加载少于约1、2、3、4、5、6、7、8、9、10、20、50、100、500、1000、5000、10000或200000个独特标识符。在一些情况下,每个分析物加载的独特标识符的平均数目小于或大于约0.0001、0.001、0.01、0.1、1、2、3、4、5、6、7、8、9、10、20、50、100、500、1000、5000、10000或200000个独特标识符/分析物。当每个分析物存在多于一个标识符时,这样的标识符可以是相同标识符或多个不同标识符的拷贝。例如,可将附接过程设计成将多个相同的标识符附接至单个分析物,或将多个不同的标识符附接至分析物。
137.独特标识符可以用于标记众多的分析物,包括细胞或分子。例如,独特标识符(例如,条形码寡核苷酸)可以附接至核酸的整条链或附接至核酸的片段(例如,片段化的基因组dna、片段化的rna)。独特标识符(例如,抗体、寡核苷酸)也可结合至细胞,包括细胞的外表面、在细胞上表达的标记物或细胞内的组分,诸如细胞器、基因表达产物、基因组dna、线粒体dna、rna、mrna或蛋白质。独特标识符也可以设计成结合或杂交通透化细胞中存在的核酸(例如,dna,rna),该核酸否则可以是或者可以不是完整的。
138.独特标识符可以单独地或与其它元件(例如,试剂、分析物)组合地加载到装置上。在一些情况下,游离的独特标识符与分析物合并,并将混合物加载到装置中。在一些情况
下,封装在微胶囊中的独特标识符与分析物合并,之后将混合物加载到装置上。在另一些情况下,在加载分析物之前、期间(例如,通过单独的入口端口)或之后,将游离的独特标识符加载至微孔中。在另一些情况下,在加载分析物之前、同时(例如,通过单独的入口端口)或之后,将封装在微胶囊中的独特标识符加载至微孔中。
139.在许多应用中,确定单个分析物是否各自接收不同的独特标识符(例如,寡核苷酸条形码)可能是重要的。如果引入至装置中的独特标识符的群体不是显著多样性的,则不同的分析物可能用相同的标识符标记。本文所公开的装置可使得能够检测用相同标识符标记的分析物。在一些情况下,可以与引入装置中的分析物群体一起包括参考分析物。参考分析物可以是,例如,具有已知序列和已知量的核酸。在分析物群体加载至装置并在装置中分割后,如本文所述,独特标识符可附接至分析物。如果独特标识符是寡核苷酸条形码并且分析物是核酸,则随后可以对标记的分析物进行测序和量化。这些方法可以指示一个或多个片段和/或分析物是否可能已经分配了相同的条形码。
140.本文所公开的方法可以包括向装置中加载对于将条形码分配给分析物而言所必需的试剂。在连接反应的情况下,可以将包括但不限于连接酶、缓冲液、衔接子寡核苷酸、多个独特标识符dna条形码等的试剂加载到装置中。在富集的情况下,可以将包括但不限于多个pcr引物、包含独特标识序列或条形码序列的寡核苷酸、dna聚合酶、dntp和缓冲液等的试剂加载到装置中。该试剂可作为游离的试剂或作为封装在微胶囊中的试剂来加载。c.核酸测序
141.核酸测序可以开始于以特定的密度(例如,约1个分析物/微孔或本文所述的其它密度)将样品分析物物理分配至微孔内。当将核酸条形码分配给单个分析物时,随后可能在后续步骤如后续扩增和/或测序步骤期间追踪单个分子,即使分析物后来合并在一起并被一同处理。a.核酸定相
142.本文提供的装置可以用来以使得随后能够获得定相或连接信息的方式制备分析物(例如,核酸分析物)。这样的信息可以允许检测序列中的连锁遗传变异,包括被长核酸段隔开的遗传变异(例如,snp、突变、插入缺失、拷贝数变异、颠换、易位、倒位等)。这些变异可能以顺式或反式关系存在。在顺式关系中,两个或更多个遗传变异可能存在于同一多核酸分子或链中。在反式关系中,两个或更多个遗传变异可能存在于多个核酸分子或链上。
143.确定核酸定相的方法可以包括:将核酸样品(例如,跨越一个或多个给定基因座的核酸样品)加载至本文公开的装置中,分配该样品使得每个微孔中存在至多一个分子的核酸,以及对微孔中的样品进行片段化。该方法可进一步包括:将独特标识符(例如,条形码)附接至本文所述的片段化的核酸,批量回收核酸,以及对样品进行后续测序反应,以检测遗传变异,例如两个不同的遗传变异。检测到用两个不同条形码标记的遗传变异可以指示这两个遗传变异源自dna的两条单独的链,反映出反式关系。相反地,检测到用相同条形码标记的两个不同的遗传变异可以指示这两个遗传变异来自dna的同一条链,反映出顺式关系。
144.相信息对分析物的表征可能至关重要,尤其是当分析物源自患有或疑似患有特定疾病或病症(例如,遗传性隐性疾病,如囊性纤维化、癌症等)或处于其风险中的受试者时。该信息可能够区分以下可能性:(1)两个遗传变异位于dna的同一条链上的同一基因内,以及(2)两个遗传变异位于同一基因内但位于dna的单独的链上。可能性(1)可以指示该基因
的一个拷贝是正常的并且该个体没有该疾病,而可能性(2)可以指示该个体具有或将发展成该疾病,尤其是当这两个遗传变异在存在于同一基因拷贝内时损害基因的功能时。类似地,相信息也可能够区分以下可能性:(1)两个遗传变异,各自位于dna的同一条链上的不同基因内,以及(2)两个遗传变异,各自位于不同基因内但位于dna的单独的链上。b.细胞特异性信息
145.本文提供的装置可以用来以使得随后能够获得细胞特异性信息的方式制备细胞分析物。这样的信息可以允许逐个细胞地检测遗传变异(例如,snp、突变、插入缺失、拷贝数变异、颠换、易位、倒位等),由此使得能够确定该遗传变异是存在于同一细胞中还是存在于两个不同的细胞中。
146.确定核酸细胞特异性信息的方法可包括:将细胞样品(例如,来自受试者的细胞样品)加载至本文所公开的装置中,分配样品使得每个微孔存在至多一个细胞,裂解细胞,然后使用本文所述的方法用独特标识符标记细胞内的核酸。在一些情况下,以每个细胞与不同微胶囊接触的方式将包含独特标识符的微胶囊加载至微孔阵列装置中(在细胞分析物加载之前、期间或之后)。然后可以将所得的标记的核酸合并、测序并用于追踪核酸的来源。可以确定具有相同独特标识符的核酸起源于相同的细胞,同时可以确定具有不同独特标识符的核酸起源于不同细胞。
147.在一个更具体的实例中,本文的方法可以用于检测致癌突变在整个癌症肿瘤细胞群体中的分布。在此实例中,一些细胞可以在dna的两条链上具有癌基因(例如,her2、braf、egfr、kras)的突变或扩增(纯合的),而另一些细胞对该突变而言可以是杂合的,而又一些细胞可以是野生型并且在癌基因中不包含突变或其它变异。本文所述的方法可以能够检测这些差异,并且还可以使得能够量化纯合、杂合和野生型细胞的相对数目。这样的信息可用于对特定癌症进行分期或用于监测癌症随时间的进展。
148.在一些实例中,本公开内容提供了鉴别两个不同癌基因(例如,kras和egfr)中的突变的方法。如果相同细胞包含具有两个突变的基因,这可以指示癌症的更具攻击性的形式。与此相反,如果突变位于两个不同的细胞中,这可以指示该癌症是更加良性的或晚期程度较低的。
149.下面是细胞特异性序列测定的另一具体实例。在本实例中,将多个细胞(诸如来自肿瘤活检的)加载至装置中。来自样品的单个细胞沉积到单个孔中并用dna条形码进行标记。
150.细胞向装置中的加载可以通过非随机加载来实现。使用下述干涉函数可以理解用于分析物如细胞的非随机加载的参数,使得:其中,p=特定细胞将尝试但不能适配至孔中的概率(干扰的量度)n=孔的数目l=标记=条形码的数目c=细胞的数目。
151.作为样品制备反应的一部分,可以将细胞裂解并且可以进行许多后续反应,包括rna扩增、dna扩增或针对单独细胞中的不同靶蛋白质和基因的抗体筛选。反应后,可以将细
胞的内容物合并在一起并可以进一步分析,例如通过dna测序。由于各个细胞分配有独特条形码,进一步的分析是可能的,包括但不限于不同基因水平的量化或单独细胞的核酸测序。在本实例中,可以确定肿瘤是否包含具有不同遗传背景的细胞(例如,癌克隆和亚克隆)。也可以计算出各个细胞类型的相对数目。c.扩增控制
152.如本文所公开的,该装置可用于控制扩增错误如pcr错误的目的。例如,可以将核酸样品分配至该装置的微孔中。分配后,样品可以在微孔内经历pcr扩增反应。使用本文所述的方法,可用相同的独特标识符标记微孔内的pcr产物。如果产物稍后进行测序并显示序列差异,则具有相同标识符的产物之间的差异可归因于pcr错误。d.基因表达产物的分析
153.在其它应用中,装置可用于检测(通常逐个细胞地)样品中的基因产物(例如,蛋白质、mrna)表达水平。样品可以包含单个细胞、从细胞中提取的mrna提取物的合并物或基因产物的其它集合。在一些情况下,可将单个细胞加载至微孔中。在其它情况下,可加载mrna或其它基因产物的合并物,使得将所需量的mrna分子加载至单个微孔中。
154.本文提供的方法可特别适用于rna分析。例如,使用本文提供的方法,可将独特标识符直接分配给mrna分析物或分配给对mrna分析物进行的逆转录反应的cdna产物。加载分析物之后,可在装置的微孔内进行逆转录反应。用于该反应的试剂可包括但不限于逆转录酶、dna聚合酶、缓冲液、dntp、寡核苷酸引物、包含条形码序列的寡核苷酸引物等。可以将一种或多种试剂加载至微胶囊中或在溶液中游离地加载至装置中,或它们的组合。然后可以进行样品制备,例如通过对cdna进行片段化并将独特标识符附接至该片段。样品制备并回收后,可进一步分析该反应的核酸产物,例如通过测序。
155.此外,类似于流式细胞仪,装置可用于表征多个细胞标记物。可以表征任何细胞标记物,包括细胞表面标记物(例如,细胞外蛋白质、跨膜标记物)和位于细胞内部的标记物(例如,rna、mrna、microrna、基因的多个拷贝、蛋白质、可变剪接产物等)。例如,如本文所述,细胞可在装置内进行分割,使得在微孔内存在至多一个细胞。细胞标记物如核酸(例如,rna)可以在用独特标识符(例如,分子条形码)标记之前进行提取和/或片段化。或者,备选地,核酸可以用独特标识符标记,而无需提取或片段化。核酸然后可以经历进一步的分析,例如设计用于检测多种基因表达产物的测序反应。这样的分析可用于多个领域。例如,如果起始细胞是免疫细胞(例如,t细胞、b细胞、巨噬细胞等),该分析可以例如通过鉴别细胞的不同cd标记物(例如,cd3、cd4、cd8、cd19、cd20、cd56等)来提供关于多个表达的标记物的信息并使得能够对细胞进行免疫表型分析。这样的标记物可以提供对细胞的功能、性质、类别或相对成熟度的深入了解。这样的标记物也可以与不一定是免疫表型分析标记物的标记物如病原性感染的标记物(例如,病毒或细菌蛋白质、dna或rna)结合使用。在一些情况下,该装置可用于在单细胞基础上鉴别至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、500、700、1000、5000、10000、50000或100000种不同的基因表达产物或其它形式的细胞标记物。通常,这样的方法不包括使用染料或探针(例如,荧光探针或染料)。
156.基因表达产物分析可用于许多领域,包括免疫学、癌症生物学(例如,用以表征癌组织的存在、类型、阶段、攻击性或其它特性)、干细胞生物学(例如,以便表征干细胞的分化
状态、干细胞的效力、干细胞的细胞类型或干细胞的其它特征)、微生物学等。基因表达分析也可以用于药物筛选应用中,例如用以评估特定药物或试剂对特定细胞的基因表达谱的影响。viii.术语
157.本文所用的术语仅用于描述具体实施方案,而并非旨在限制本公开内容的装置。如本文所使用的,单数形式“一个”、“一种”和“该”也意图包括复数形式,除非上下文明确指出不是这样。此外,就术语“包含”、“包括”、“具有”、“有”、“带有”或其变化形式在详细描述和/或权利要求中的使用来说,这些术语旨在以类似于术语“含有”的方式为包含性的。
158.本公开内容的装置的多个方面在上文参照用于说明的示例应用进行了描述。应当理解,对许多具体的细节、关系和方法进行阐述是为了提供对装置的全面了解。然而,相关领域的普通技术人员将会容易地认识到:装置可以在没有一个或多个这些具体细节的情况下或用其它方法来实施。本公开内容不受动作或事件的所示顺序的限制,因为一些动作可以按不同的顺序发生和/或与其它动作或事件同时发生。此外,并不是所有示出的动作或事件都是实施根据本公开内容的方法所需的。
159.范围在本文中可以表示为从“约”一个特定值和/或到“约”另一个特定值。当表示这样的范围时,另一个实施方案包括从一个特定值和/或到另一个特定值。类似地,当数值通过使用先行词“约”来表示为近似值时,应当理解,该特定值构成另一个实施方案。应当进一步理解,每个范围的端点与另一端点相关地以及与另一端点独立地都是有意义的。如本文所用的术语“约”是指在特定应用的背景中指定数值
±
15%的范围。例如,约10将包括从8.5到11.5的范围。
160.如本文所用的术语微孔阵列一般是指微孔的预定的空间布置。包含微胶囊的微孔阵列装置也可以被称作“微孔胶囊阵列”。此外,术语“阵列”在本文中可以用来指在表面上布置的多个阵列,诸如表面具有阵列的多个拷贝的情况。这样的承载多个阵列的表面也可被称作“多个阵列”或“重复阵列”。本发明提供了包括但不限于以下实施方案:1.一种包含第一微胶囊的组合物,其中:a.当向所述第一微胶囊施加刺激时,所述微胶囊是可降解的;且b.所述第一微胶囊包含寡核苷酸条形码。2.如实施方案1所述的组合物,其中所述第一微胶囊包含化学交联体。3.如实施方案2所述的组合物,其中所述化学交联体是二硫键。4.如实施方案1所述的组合物,其还包含聚合物凝胶。5.如实施方案4所述的组合物,其中所述聚合物凝胶是聚丙烯酰胺凝胶。6.如实施方案1所述的组合物,其中所述第一微胶囊包含珠粒。7.如实施方案6所述的组合物,其中所述珠粒是凝胶珠粒。8.如实施方案1所述的组合物,其中所述刺激选自生物刺激、化学刺激、热刺激、电刺激、磁刺激或光刺激及其组合。9.如实施方案1所述的组合物,其中所述化学刺激选自ph的变化、离子浓度的变化和还原剂。10.如实施方案9所述的组合物,其中所述还原剂是二硫苏糖醇(dtt)或三(2
‑
羧乙
基)膦(tcep)。11.如实施方案1所述的组合物,其中第二微胶囊包含所述第一微胶囊。12.如实施方案11所述的组合物,其中所述第二微胶囊是微滴。13.如实施方案1所述的组合物,其还包含含有所述寡核苷酸条形码的核酸,其中所述核酸包含脱氧尿苷三磷酸(dutp)。14.如实施方案1所述的组合物,其还包含不能接受脱氧尿苷三磷酸(dutp)的聚合酶。15.如实施方案1所述的组合物,其还包含靶分析物。16.如实施方案15所述的组合物,其中所述靶分析物是核酸。17.如实施方案16所述的组合物,其中所述核酸选自dna、rna、dntp、ddntp、扩增子、合成核苷酸、合成多核苷酸、多核苷酸、寡核苷酸,肽核酸、cdna、dsdna、ssdna、质粒dna、粘粒dna、高分子量(mw)dna、染色体dna、基因组dna、病毒dna、细菌dna、mtdna(线粒体dna)、mrna、rrna、trna、nrna、sirna、snrna、snorna、scarna、microrna、dsrna、核酶、核糖开关和病毒rna。18.如实施方案16所述的组合物,其中所述核酸是基因组dna(gdna)。19.如实施方案1所述的组合物,其中所述寡核苷酸条形码的密度是至少大约1,000,000个寡核苷酸条形码/所述第一微胶囊。20.如实施方案1所述的组合物,其中所述寡核苷酸条形码通过化学交联体偶联至所述微胶囊。21.如实施方案20所述的组合物,其中所述化学交联体是二硫键。22.一种包含多个分区的装置,其中:a.所述多个分区中的至少一个分区包含含有寡核苷酸条形码的微胶囊;且b.当向所述微胶囊施加刺激时,所述微胶囊是可降解的。23.如实施方案22所述的装置,其中所述分区是孔。24.如实施方案22所述的装置,其中所述分区是微滴。25.如实施方案22所述的装置,其中所述微胶囊包含化学交联体。26.如实施方案25所述的装置,其中所述化学交联体是二硫键。27.如实施方案22所述的装置,其中所述微胶囊还包含聚合物凝胶。28.如实施方案27所述的装置,其中所述聚合物凝胶是聚丙烯酰胺凝胶。29.如实施方案22所述的装置,其中所述微胶囊包含珠粒。30.如实施方案29所述的装置,其中所述珠粒是凝胶珠粒。31.如实施方案22所述的装置,其中所述刺激选自生物刺激、化学刺激、热刺激、电刺激、磁刺激或光刺激及其组合。32.如实施方案31所述的装置,其中所述化学刺激选自ph的变化、离子浓度的变化和还原剂。33.如实施方案32所述的装置,其中所述还原剂是二硫苏糖醇(dtt)或三(2
‑
羧乙基)膦(tcep)。34.如实施方案22所述的装置,其中核酸包含所述寡核苷酸条形码,并且其中所述核酸包含脱氧尿苷三磷酸(dutp)。
35.如实施方案22所述的装置,其中所述分区包含不能接受脱氧尿苷三磷酸(dutp)的聚合酶。36.如实施方案22所述的装置,其中所述分区包含靶分析物。37.如实施方案36所述的装置,其中所述靶分析物是核酸。38.如实施方案37所述的装置,其中所述核酸选自dna、rna、dntp、ddntp、扩增子、合成核苷酸、合成多核苷酸、多核苷酸、寡核苷酸,肽核酸、cdna、dsdna、ssdna、质粒dna、粘粒dna、高分子量(mw)dna、染色体dna、基因组dna、病毒dna、细菌dna、mtdna(线粒体dna)、mrna、rrna、trna、nrna、sirna、snrna、snorna、scarna、microrna、dsrna、核酶、核糖开关和病毒rna。39.如实施方案37所述的装置,其中所述核酸是基因组dna(gdna)。40.如实施方案22所述的装置,其中所述寡核苷酸条形码通过化学交联体偶联至所述微胶囊。41.如实施方案40所述的装置,其中所述化学交联体是二硫键。42.一种用于样品制备的方法,该方法包括:a.将包含寡核苷酸条形码的微胶囊和靶分析物合并到分区中,其中当向所述微胶囊施加刺激时,所述微胶囊是可降解的;和b.向所述微胶囊施加所述刺激以将所述寡核苷酸条形码释放至所述靶分析物。43.如实施方案42所述的方法,其中所述分区是孔。44.如实施方案42所述的方法,其中所述分区是微滴。45.如实施方案42所述的方法,其中所述微胶囊包含聚合物凝胶。46.如实施方案45所述的方法,其中所述聚合物凝胶是聚丙烯酰胺。47.如实施方案42所述的方法,其中所述微胶囊包含珠粒。48.如实施方案47所述的方法,其中所述珠粒是凝胶珠粒。49.如实施方案42所述的方法,其中所述微胶囊包含化学交联体。50.如实施方案49所述的方法,其中所述化学交联体是二硫键。51.如实施方案42所述的方法,其中所述刺激选自生物刺激、化学刺激、热刺激、电刺激、磁刺激或光刺激及其组合。52.如实施方案51所述的方法,其中所述化学刺激选自ph的变化、离子浓度的变化和还原剂。53.如实施方案52所述的方法,其中所述还原剂是二硫苏糖醇(dtt)或三(2
‑
羧乙基)膦(tcep)。54.如实施方案42所述的方法,其中核酸包含所述寡核苷酸条形码,并且其中所述核酸包含脱氧尿苷三磷酸(dutp)。55.如实施方案42所述的方法,其中所述分区包含不能接受脱氧尿苷三磷酸(dutp)的聚合酶。56.如实施方案42所述的方法,其还包括将所述寡核苷酸条形码附接至所述靶分析物。57.如实施方案56所述的方法,其中所述附接利用核酸扩增反应完成。58.如实施方案42所述的方法,其中所述靶分析物是核酸。
59.如实施方案58所述的方法,其中所述核酸选自dna、rna、dntp、ddntp、扩增子、合成核苷酸、合成多核苷酸、多核苷酸、寡核苷酸,肽核酸、cdna、dsdna、ssdna、质粒dna、粘粒dna、高分子量(mw)dna、染色体dna、基因组dna、病毒dna、细菌dna、mtdna(线粒体dna)、mrna、rrna、trna、nrna、sirna、snrna、snorna、scarna、microrna、dsrna、核酶、核糖开关和病毒rna。60.如实施方案58所述的方法,其中所述核酸是基因组dna(gdna)。61.如实施方案42所述的方法,其中所述寡核苷酸条形码通过化学交联体偶联至所述微胶囊。62.如实施方案61所述的方法,其中所述化学交联体是二硫键。63.一种包含可降解凝胶珠粒的组合物,其中所述可降解凝胶珠粒包含至少约1,000,000个寡核苷酸条形码。64.如实施方案63所述的组合物,其中所述1,000,000个寡核苷酸条形码是相同的。实施例1
‑
单细胞dna测序
161.制备微孔胶囊阵列,以对从血液样品中获得的单个人b细胞进行核酸测序。收获大约15,000个细胞并用于加载至装置中。使用本公开内容的且含有150,000个微孔的装置。各个孔是直径为125μm且高度为125μm的圆柱形形状,这允许每个孔加载至多1个胶囊。产生通过乳液聚合制成的具有pnipam水凝胶壳壁的微胶囊,使得该微胶囊具有100μm的直径以供加载至装置中。产生微胶囊,使得pnipam壳含有磁性铁颗粒。然后使壳的外表面化学偶联至对b细胞外部上的跨膜b细胞受体具有特异性的抗体。
162.在胶囊的制备过程中,将试剂同时加载至胶囊中。向胶囊中加载对细胞裂解和用dna条形码标记细胞的单个dna链而言所必需的试剂。用于细胞裂解的试剂包括温和的非离子型去污剂、缓冲液和盐。向胶囊中加载用于将dna条形码添加至基因组dna的试剂,包括限制酶、连接酶和>10,000,000个独特dna寡核苷酸。胶囊被设计成在高于65℃时对破裂敏感。
163.制备胶囊,以便施加至微胶囊阵列。该阵列放置在磁温控热板上。将微胶囊加到b细胞的样品中,使得一个b细胞能够与一个胶囊结合。胶囊
‑
细胞偶联物以超过孔的相对数目的量在水性载体溶液中被施加。将胶囊
‑
细胞轻柔地移液到入口端口,随后向出口端口施加真空歧管而在整个装置中分配胶囊。穿过该板来施加磁场。经由通过出口端口移液来移除过量的胶囊
‑
细胞溶液。通过磁场捕获各个胶囊
‑
细胞偶联物并将其定位于单个孔中。
164.将细胞和胶囊加载至装置后,将载体油(或密封流体)施加到该装置,以除去桥接相邻微孔的任何过量的水性溶液。载体油施加到入口,并且过量的油在出口处用真空歧管回收。在施加载体油后,用带材密封入口和出口端口。
165.然后通过磁温控热板将装置加热到70℃的温度保持10分钟,以使胶囊破裂和细胞裂解。然后将热板切换至37℃,用于限制消化和连接,保持最长达1小时。
166.样品制备反应完成后,回收孔中的内容物。解除装置的入口和出口端口的密封,并且将氮气施加到该装置,以冲洗出微孔的单独组分。在出口端口处经移液管批量地收集样品,同时磁场将已破裂的胶囊壳保留在单个微孔中。
167.然后使用本领域中已知的多重测序策略对样品进行测序。单个细胞的条形码编码允许对单个细胞获得测序信息,而非作为多个细胞的平均。基于测序的细胞和分配的条形
码的数目,获得snp细胞特异性信息。此外,可以对单个条形码的读取数目进行计数,以提供对具有不同遗传背景的不同细胞类型在b细胞原始群体中的分布的深入了解。实施例2
‑
dna单链测序
168.制备微孔胶囊阵列,以对从人皮肤细胞群体中分离的dna的单独链进行核酸测序。使用去污剂裂解细胞并加热,且通过氯仿/乙醇提取使二倍体dna的大约15,000个拷贝沉淀。将dna的重悬浮液加载至装置中,其具有单倍体dna的大约10,000个拷贝。使用具有300,000个微孔的本公开内容的装置。各个孔是直径为125μm且高度为125μm的圆柱形形状,这允许每个孔加载至多1个胶囊。将通过乳液聚合制成的具有pnipam水凝胶壳壁的微胶囊制成直径为100μm的球体的规格,以供加载至装置中。
169.在微胶囊的制备过程中,将试剂同时加载至胶囊中。所述试剂包括对用dna条形码标记单个dna链而言所必需的试剂,包括限制酶、连接酶和>10,000,000个独特dna寡核苷酸。设计成在高于65℃时对破裂敏感的胶囊用于封装。
170.相对于孔的相对数目过量地施加水性载体溶液中胶囊。将胶囊轻柔地移液到入口中、随后向出口施加真空歧管以在整个装置中分布胶囊。移除过量的胶囊溶液后,以类似于胶囊的方式将dna在缓冲液中的重悬浮液施加至装置。
171.将dna链和胶囊加载至装置后,将载体油施加到该装置,以除去桥接相邻微孔的任何过量的水性溶液。载体油施加到入口端口,并且在出口端口处用真空歧管回收过量的油。在施加载体油后,用带材密封入口和出口端口。
172.该装置然后放置在温控热板上,并加热至70℃的温度保持10分钟,以使胶囊破裂。试剂释放至样品制备反应中。然后将热板切换至37℃,用于限制消化和连接,保持最长达1小时。
173.样品制备反应完成后,解除该装置的入口和出口端口的密封,并且将氮气施加到该装置,以冲洗出微孔的单个组分。在出口端口处经移液管批量地收集样品产物。
174.然后使用本领域中已知的多重测序策略以充分的覆盖度(例如,500)对样品进行测序。单个dna链的条形码编码允许从单个链获得测序信息,而非作为dna的整个样品的平均。基于测序的dna链和分配的条形码的数目,获得snp定相/单体型分析信息,并且可以解析dna的许多重复区域。另外,通过弃除相对于单体型随机出现的突变可以获得精确度的大幅提升,因为那些可能是测序错误。
175.根据上文应当理解,虽然已示出和描述了特定实施方式,但可以对其进行各种修改,并且这些修改是本发明所设想到的。本说明书中提供的具体实施例并非意图限制本发明。虽然已参照上述说明书对本发明进行了描述,但此处的优选实施方案的说明和图示并不意味着以限制性的意义来解释。此外,应当理解,本发明的所有方面均不限于本文阐述的具体描述、构造或相对比例,这些取决于各种条件和变量。对本发明实施方案的形式和细节的各种修改对本领域技术人员来说将是显而易见的。因此可以预期,本发明也应涵盖任何这样的修改、变化和等同物。意图以所附权利要求限定本发明的范围,并且由此涵盖这些权利要求的范围内的方法和结构及其等同物。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

