一种tb
‑
gmp/ceo2复合材料及其制备方法和检测福美锌的方法
技术领域
1.本发明属于农药检测技术领域,尤其涉及一种tb
‑
gmp/ceo2复合材料及其制备方法和检测福美锌的方法。
背景技术:
2.福美锌是一种广泛使用的二硫代氨基甲酸酯类杀菌剂,可用于预防种子和农作物中的真菌病害。目前,我国农产品中福美锌残留的标准检测方法为气相色谱法。在气相色谱法测定福美锌过程中,需要将福美锌在强酸性条件下高温加热,转化为二硫化碳,然后通过气相色谱法测定二硫化碳实现福美锌含量的间接测定。这种间接测定福美锌的方法过程繁琐、耗时,且需要使用强酸,不符合绿色化学减少使用危险品的原则。此外,该方法可能会受到农产品基质中含硫物质的干扰从而导致错误结果,且不适用于检测经二硫化碳熏蒸处理过的农产品。而且色谱分析只能在实验室中进行,难以满足现场、实时、快速检测福美锌残留的需求。因此,有必要针对现场、实时、快速检测福美锌残留的需求,开发合适的福美锌残留快速检测分析方法。福美锌抑制酪氨酸酶活性,因此可开发酪氨酸酶生物传感器用于检测福美锌。
3.镧系金属配位聚合物是一类新型镧系金属
‑
配体复合物。将某些至少具有两个镧系金属离子结合位点的分子作为配体,通过“金属离子
‑
配体
‑
金属离子
‑
配体”的重复配位作用,组装生成纳米尺寸的镧系金属配位聚合物。核苷酸是由碱基(嘌呤或嘧啶)、核糖(或脱氧核糖)与磷酸基团组成的化合物,含多个带有孤对电子的原子,可与镧系金属离子通过配位键结合,因此可作为配体分子。核苷酸分子中。由于核苷酸分子中同时存在碱基部分与磷酸基团部分,且磷酸基团中存在多个氧原子,镧系金属离子与核苷酸可通过配位作用形成配位聚合物。由于tb
3
、eu
3
与ce
3
的激发态与碱基分子的三重态有重叠,使核苷酸可将吸收的光能转移到镧系金属离子,实现配体敏化发光。其中,tb
3
与5
’‑
鸟苷酸二钠(gmp)配位组装生成的聚合物tb
‑
gmp,gmp可将吸收的光能直接转移到tb
3
,从而增强tb
3
的荧光强度。tb
‑
gmp及其复合材料已作为荧光探针应用于荧光光谱法检测农药残留。但是现有技术中并未有关于如何使用tb
‑
gmp复合材料来检测福美锌的报道。
4.纳米ceo2参与氧化还原反应时,其结构中的ce
3
与ce
4
可较简单地发生互相转化,因此纳米ceo2可作为氧化还原反应的催化剂。目前,纳米ceo2已被报道具有多种类似于催化氧化还原反应的酶的催化能力,包括氧化酶、过氧化物酶、过氧化氢酶、超氧化物歧化酶等。纳米ceo2通过催化某些色原试剂发生氧化显色反应,可用于吸收光谱法分析检测。纳米ceo2已作为荧光探针应用于吸收光谱法检测农药残留。但是现有技术中并未有关于如何使用纳米ceo2来检测福美锌的报道。
技术实现要素:
5.有鉴于此,本发明的目的在于提供一种tb
‑
gmp/ceo2复合材料及其制备方法和检测福美锌的方法,采用本发明提供的tb
‑
gmp/ceo2复合材料能够检测样品中的福美锌。
6.为了实现上述发明目的,本发明提供了以下技术方案:
7.本发明提供了一种tb
‑
gmp/ceo2复合材料,所述tb
‑
gmp/ceo2复合材料的结构物性参数为:球形结构,尺寸为10~50nm;x射线光电子能谱的物性参数为:铽(3d
3/2
):1277.1ev、铽(3d
5/2
):1242.5ev、铈(3d
3/2
):904.4ev、铈(3d
5/2
):886.1ev、氧1s:531.3ev、磷2p:133.8ev。
8.本发明还提供了上述技术方案所述的tb
‑
gmp/ceo2复合材料的制备方法,包括以下步骤:
9.1)将5
′‑
鸟苷酸二钠溶液与ceo2溶液混合后进行第一次搅拌,得到第一搅拌物;所述第一次搅拌的时间为20min;
10.2)将所述步骤1)得到的第一搅拌物与氯化铽溶液混合后进行第二次搅拌,得到第二搅拌物;所述第二次搅拌的时间为30min;
11.3)将所述步骤2)得到的第二搅拌物离心,得到的沉淀物为tb
‑
gmp/ceo2复合材料。
12.所述步骤1)5
′‑
鸟苷酸二钠溶液与ceo2溶液的体积比为1:0.15;
13.所述5
′‑
鸟苷酸二钠溶液的浓度为4.07mg/ml;
14.所述ceo2溶液的浓度为2.5mg/ml;
15.所述ceo2溶液中的ceo2为纳米级ceo2;
16.所述步骤2)氯化铽溶液与5
′‑
鸟苷酸二钠溶液的体积比为1:1;
17.所述氯化铽溶液的浓度为3.74mg/ml;
18.所述步骤3)离心的条件包括:离心的转速为12000rpm,离心的时间为10min。
19.本发明还提供了一种利用上述技术方案所述的tb
‑
gmp/ceo2复合材料检测福美锌的方法,包括以下步骤:
20.a、将酪氨酸酶溶液与样品混合、静置,得到静置液;
21.b、将所述步骤a得到的静置液与酪氨酸溶液、tris
‑
hcl缓冲液混合后进行反应,得到反应液;
22.c、将所述步骤b得到的反应液与上述技术方案所述的tb
‑
gmp/ceo2复合材料、3,3’,5,5
’‑
四甲基联苯胺溶液、柠檬酸
‑
磷酸氢二钠缓冲液混合、振荡,得到振荡液,测定所述振荡液的吸收光谱,得到最大吸光度,将所述最大吸光度转化为酶抑制率;
23.所述酶抑制率=(a
z
‑
a0)/(a
‑
a0)
×
100,a
z
代表存在福美锌时,吸收光谱中的最大吸光强度,a0代表不存在福美锌时,吸收光谱中的最大吸光强度,a代表吸收光谱中的最大吸光强度;
24.d、将所述步骤c得到的酶抑制率代入线性方程,得到样品中福美锌的浓度;
25.所述线性方程为:酶抑制率=16.32
×
c 0.37,c的单位为μg/l。
26.本发明还提供了一种利用上述技术方案所述的tb
‑
gmp/ceo2复合材料检测福美锌的方法,包括以下步骤:
27.(1)将酪氨酸酶溶液与样品混合、静置,得到静置液;
28.(2)将所述步骤(1)得到的静置液与酪氨酸溶液、tris
‑
hcl缓冲液混合后进行反应,得到反应液;
29.(3)将所述步骤(2)得到的反应液与上述技术方案所述的tb
‑
gmp/ceo2复合材料、3,3’,5,5
’‑
四甲基联苯胺溶液、柠檬酸
‑
磷酸氢二钠缓冲液混合、振荡,得到振荡液,使用智
能手机对振荡液拍照,读取照片中的rgb值,将所述rgb值转化为s值,将所述s值代入线性方程中,得到样品中福美锌的浓度;
30.所述线性方程为:s=0.0779
×
c 0.0487,c的单位为μg/l。
31.优选的,所述步骤a或(1)中酪氨酸酶溶液与样品的体积比为1:1;
32.所述酪氨酸酶溶液的浓度为175u/ml;
33.所述静置的条件包括:静置的时间为5min,静置的环境温度为37℃。
34.优选的,所述步骤b或(2)中酪氨酸溶液与tris
‑
hcl缓冲液、样品的体积比为10:8:1;
35.所述酪氨酸溶液的浓度为2.5mm;
36.所述tris
‑
hcl缓冲液的浓度为10mm,ph值为7.4;
37.所述反应的条件包括:反应的环境温度为37℃,反应的时间为30min。
38.优选的,所述步骤c或(3)中tb
‑
gmp/ceo2复合材料以tb
‑
gmp/ceo2溶液与原料混合,所述tb
‑
gmp/ceo2溶液与3,3’,5,5
’‑
四甲基联苯胺溶液、柠檬酸
‑
磷酸氢二钠缓冲液的体积比为100:75:225;
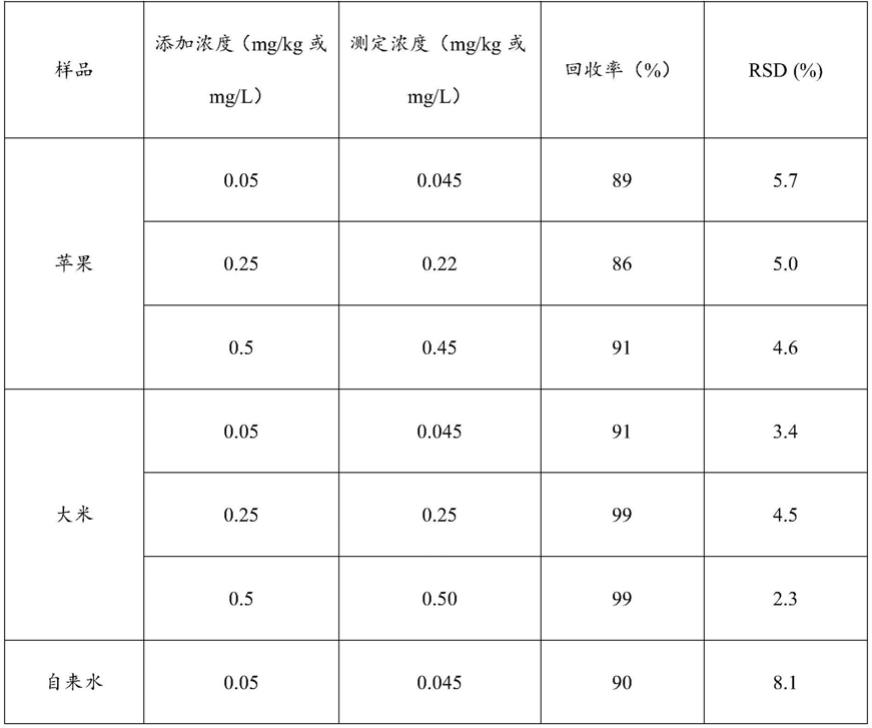
39.所述tb
‑
gmp/ceo2溶液的浓度为2mg/ml;
40.所述3,3’,5,5
’‑
四甲基联苯胺溶液的浓度为10mm;
41.所述柠檬酸
‑
磷酸氢二钠缓冲液的浓度为0.2m,ph值为3.0;
42.所述振荡的条件包括:振荡的转速为500rpm,振荡的时间为10min;
43.所述步骤c中振荡液在500~750nm下测定最大吸光度。
44.本发明还提供了一种利用上述技术方案所述的tb
‑
gmp/ceo2复合材料检测福美锌的方法,包括以下步骤:
45.a、将酪氨酸酶溶液与样品混合、静置,得到静置液;
46.b、将所述步骤a得到的静置液与酪氨酸溶液、tris
‑
hcl缓冲液混合后进行反应,得到反应液;
47.c、将所述步骤b得到的反应液与上述技术方案所述的tb
‑
gmp/ceo2复合材料、超纯水混合、振荡,得到振荡液,测定所述振荡液的荧光发射光谱,得到最大荧光强度,将所述最大荧光强度转化为酶抑制率;
48.所述酶抑制率=(fd
‑
f0)/(f
‑
f0)
×
100,fd代表存在福美锌时,荧光发射光谱中的最大荧光强度,f0代表不存在福美锌时,荧光发射光谱中的最大荧光强度,f代表荧光发射光谱中的最大荧光强度;
49.d、将所述步骤c得到的酶抑制率代入线性方程,得到样品中福美锌的浓度;
50.所述线性方程为:酶抑制率=33.21
×
log
10
c 15.96,c的单位为μg/l。
51.优选的,所述步骤a中酪氨酸酶溶液与样品的体积比为1:1;
52.所述酪氨酸酶溶液的浓度为80u/ml;
53.所述静置的条件包括:静置的时间为15min,静置的环境温度为37℃;
54.所述步骤b中酪氨酸溶液与tris
‑
hcl缓冲液、样品的体积比为10:8:1;
55.所述酪氨酸溶液的浓度为2.5mm;
56.所述tris
‑
hcl缓冲液的浓度为10mm,ph值为7.4;
57.所述反应的条件包括:反应的环境温度为37℃,反应的时间为30min;
58.所述步骤c中tb
‑
gmp/ceo2复合材料以tb
‑
gmp/ceo2溶液与原料混合,所述tb
‑
gmp/ceo2溶液与超纯水的体积比为1:79;
59.测定振荡液的荧光发射光谱的荧光激发波长为286nm。
60.本发明提供了一种tb
‑
gmp/ceo2复合材料及其制备方法和利用检测福美锌的方法,本发明利用tb
‑
gmp/ceo2复合材料检测福美锌的机理是:在tb
‑
gmp/ceo2、酪氨酸与酪氨酸酶的混合体系中,酪氨酸酶催化酪氨酸(单酚)发生羟基化反应生成多巴(双酚),而双酚与tb
‑
gmp/ceo2的结合能力相比单酚更强,因此,tb
‑
gmp/ceo2与多巴的结合能力更强,导致其荧光发射性能(机理为多巴对tb
‑
gmp/ceo2的荧光内滤效应)与催化活性(机理为材料与多巴结合后更难与tmb接触进行催化反应)均降低。而福美锌对酪氨酸酶活性有抑制作用,因此福美锌存在时,酪氨酸酶催化活性减弱,多巴的生成减少,从而相比无福美锌时,tb
‑
gmp/ceo2的荧光发射性能与催化活性发生变化。测定荧光强度、吸光度或颜色,建立福美锌的荧光光谱、吸收光谱、智能手机检测方法。
附图说明
61.图1为tb
‑
gmp/ceo2的扫描电子显微镜(sem)图像;
62.图2为tb
‑
gmp/ceo2的sem与对应的元素分布图像;
63.图3为tb
‑
gmp/ceo2的xps全谱分析;
64.图4为tb
‑
gmp/ceo2的荧光激发与发射光谱;
65.图5为tb
‑
gmp/ceo2的吸收光谱;
66.图6为tb
‑
gmp/ceo2与纳米ceo2催化tmb氧化的吸收光谱;
67.图7为不同浓度福美锌存在时tb
‑
gmp/ceo2‑
酪氨酸酶
‑
酪氨酸体系催化下tmbox的吸收光谱;
68.图8为福美锌浓度与ie之间的线性方程(吸收光谱法);
69.图9为不同浓度福美锌存在时tb
‑
gmp/ceo2‑
酪氨酸酶
‑
酪氨酸体系的荧光发射光谱;
70.图10为福美锌浓度对数与ie之间的线性方程(荧光光谱法);
71.图11为不同浓度福美锌对酪氨酸酶
‑
tb
‑
gmp/ceo2体系颜色的影响;
72.图12为福美锌浓度对数与ie之间的线性方程(智能手机法);
73.图13为吸收光谱法检测福美锌的条件优化实验:溶液ph值(a);酪氨酸酶浓度(b);酪氨酸酶与酪氨酸的反应时间(c);反应温度(d)与酪氨酸与福美锌的混合时间(e)
74.图14为荧光光谱法检测福美锌的条件优化实验:tb
‑
gmp/ceo2与酪氨酸酶催化体系混合反应的时间(a);酪氨酸酶浓度(b);酪氨酸酶与酪氨酸的反应时间(c);反应温度(d)与酪氨酸与福美锌的混合时间(e)
75.图15为吸收光谱法检测福美锌的选择性;图中1
‑
10分别为福美锌、钠离子、钙离子、锌离子、维生素c、葡萄糖、甘氨酸、甲霜灵、戊唑醇、嘧菌酯
76.图16为荧光光谱法检测福美锌的选择性;图中1
‑
10分别为福美锌、钠离子、钙离子、锌离子、维生素c、葡萄糖、甘氨酸、甲霜灵、戊唑醇、嘧菌酯
77.图17为rgb值转化为s值的公式。
具体实施方式
78.本发明提供了一种tb
‑
gmp/ceo2复合材料,所述tb
‑
gmp/ceo2复合材料的结构物性参数为:球形结构,尺寸为10~50nm;x射线光电子能谱的物性参数为:铽(3d
3/2
):1277.1ev、铽(3d
5/2
):1242.5ev、铈(3d
3/2
):904.4ev、铈(3d
5/2
):886.1ev、氧1s:531.3ev、磷2p:133.8ev。在本发明中,所述tb
‑
gmp/ceo2复合材料的粒径为10~50nm,为球状型纳米粒子。在本发明中,所述tb
‑
gmp/ceo2复合材料的荧光光谱:最大激发波长:286nm,最大发射波长:545nm。吸收光谱:吸收峰约245nm。
79.本发明还提供了上述技术方案所述的tb
‑
gmp/ceo2复合材料的制备方法,包括以下步骤:
80.1)将5
′‑
鸟苷酸二钠溶液与ceo2溶液混合后进行第一次搅拌,得到第一搅拌物;所述第一搅拌的时间为20min;
81.2)将所述步骤1)得到的第一搅拌物与氯化铽溶液混合后进行第二次搅拌,得到第二搅拌物;所述第二搅拌的时间为30min;
82.3)将所述步骤2)得到的第二搅拌物离心,得到的沉淀物为tb
‑
gmp/ceo2复合材料。
83.本发明将5
′‑
鸟苷酸二钠溶液与ceo2溶液混合后进行第一搅拌,得到第一搅拌物;所述第一搅拌的时间为20min。
84.在本发明中,所述5
′‑
鸟苷酸二钠溶液与ceo2溶液的体积比优选为1:0.15。在本发明中,所述5
′‑
鸟苷酸二钠溶液的浓度优选为4.07mg/ml。在本发明中,所述ceo2溶液的浓度优选为2.5mg/ml。在本发明中,所述ceo2溶液中的ceo2优选为纳米级ceo2。
85.本发明对所述纳米级ceo2的制备方法没有特殊限定,采用本领域技术人员常规制备纳米级ceo2的制备方法即可,在本发明具体实施方式中,所述纳米级ceo2的制备方法优选包括以下步骤:
86.将硝酸铈与乙二醇溶液混合,得到混合物;
87.将所述混合物与氨水混合、搅拌,得到搅拌物;
88.将所述搅拌物离心,得到的沉淀为纳米级ceo2。
89.在本发明中,所述硝酸铈优选为硝酸铈六水合物。在本发明中,所述硝酸铈的质量与乙二醇溶液的体积比优选为2.52g:100ml。在本发明中,所述乙二醇溶液的溶剂为水,所述乙二醇与水的体积比优选为1:1。
90.在本发明中,所述混合物优选加热到60℃时与氨水混合、搅拌,所述搅拌的时间优选为3h。在本发明中,所述搅拌优选为剧烈搅拌。
91.在本发明中,所述离心的条件优选包括:所述离心的转速优选为12000rpm,离心的时间优选为10min。
92.得到纳米级ceo2后优选与柠檬酸钠溶液混合、超声,将得到的超声物与乙醇混合,得到沉淀,将所述沉淀使用乙醇进行洗涤、干燥后为制备tb
‑
gmp/ceo2复合材料的原料。在本发明中,所述柠檬酸钠溶液的浓度优选为30g/l。在本发明中,所述柠檬酸钠防止氧化铈团聚使尺寸变大;所述乙醇使氧化铈析出。在本发明中,所述超声的时间优选为30min,本发明对所述超声的频率没有特殊限定。本发明优选通过离心方式得到收集沉淀,所述离心的转速优选为12000rpm,所述离心的时间优选为10min。在本发明中,所述乙醇洗涤的次数优选为3次。
93.本发明将得到的第一搅拌物与氯化铽溶液混合后进行第二搅拌,得到第二搅拌物;所述第二搅拌的时间为30min。在本发明中,所述氯化铽溶液与5
′‑
鸟苷酸二钠溶液的体积比优选为1:1。在本发明中,所述氯化铽溶液的浓度优选为3.74mg/ml。
94.本发明将得到的第二搅拌物离心,得到的沉淀物为tb
‑
gmp/ceo2复合材料。在本发明中,所述离心的条件优选包括:离心的转速优选为12000rpm,离心的时间优选为10min。
95.本发明还提供了一种利用上述技术方案所述的tb
‑
gmp/ceo2复合材料检测福美锌的方法,包括以下步骤:
96.a、将酪氨酸酶溶液与样品混合、静置,得到静置液;
97.b、将所述步骤a得到的静置液与酪氨酸溶液、tris
‑
hcl缓冲液混合后进行反应,得到反应液;
98.c、将所述步骤b得到的反应液与上述技术方案所述的tb
‑
gmp/ceo2复合材料、3,3’,5,5
’‑
四甲基联苯胺溶液、柠檬酸
‑
磷酸氢二钠缓冲液混合、振荡,得到振荡液,测定所述振荡液的吸收光谱,得到最大吸光度,将所述最大吸光度转化为酶抑制率;
99.所述酶抑制率=(a
z
‑
a0)/(a
‑
a0)
×
100,a
z
代表存在福美锌时,吸收光谱中的最大吸光强度,a0代表不存在福美锌时,吸收光谱中的最大吸光强度,a代表吸收光谱中的最大吸光强度;
100.d、将所述步骤c得到的酶抑制率代入线性方程,得到样品中福美锌的浓度;
101.所述线性方程为:酶抑制率=16.32
×
c 0.37,c的单位为μg/l。
102.本发明将酪氨酸酶溶液与样品混合、静置,得到静置液。
103.在本发明中,所述样品优选包括水果和农产品,所述水果优选包括苹果,所述农产品优选包括大米。在本发明中,所述酪氨酸酶溶液与样品的体积比优选为1:1。在本发明中,所述酪氨酸酶溶液的浓度优选为175u/ml,本发明优选以tris
‑
hcl缓冲液(浓度:10mm,ph=7.4)为溶剂配制酪氨酸酶溶液。在本发明中,所述静置的条件优选包括:静置的时间优选为5min,静置的环境温度优选为37℃。
104.本发明将得到的静置液与酪氨酸溶液、tris
‑
hcl缓冲液混合后进行反应,得到反应液。在本发明中,所述酪氨酸溶液与tris
‑
hcl缓冲液、样品的体积比优选为10:8:1。在本发明中,所述酪氨酸溶液的浓度优选为2.5mm。在本发明中,所述tris
‑
hcl缓冲液的浓度为10mm,ph值为7.4。在本发明中,所述反应的条件优选包括:反应的环境温度优选为37℃,反应的时间优选为30min。
105.本发明将得到的反应液与上述技术方案所述的tb
‑
gmp/ceo2复合材料、3,3’,5,5
’‑
四甲基联苯胺溶液、柠檬酸
‑
磷酸氢二钠缓冲液混合、振荡,得到振荡液,测定所述振荡液的吸收光谱,得到最大吸光度,将所述最大吸光度转化为酶抑制率;所述酶抑制率=(a
z
‑
a0)/(a
‑
a0)
×
100,a
z
代表存在福美锌时,吸收光谱中的最大吸光强度,a0代表不存在福美锌时,吸收光谱中的最大吸光强度,a代表吸收光谱中的最大吸光强度,其中a=0.7,a0=0.095,a和a0为固定值。
106.在本发明中,所述tb
‑
gmp/ceo2复合材料优选以tb
‑
gmp/ceo2溶液与原料混合,所述tb
‑
gmp/ceo2溶液与3,3’,5,5
’‑
四甲基联苯胺溶液、柠檬酸
‑
磷酸氢二钠缓冲液的体积比优选为100:75:225。在本发明中,所述tb
‑
gmp/ceo2溶液的浓度优选为2mg/ml。在本发明中,所述3,3’,5,5
’‑
四甲基联苯胺溶液的浓度优选为10mm。在本发明中,所述柠檬酸
‑
磷酸氢二钠
缓冲液的浓度优选为0.2m,ph值为3.0。在本发明中,所述振荡的条件优选包括:振荡的转速优选为500rpm,振荡的时间优选为10min。在本发明中,所述振荡液优选在500~750nm下检测最大吸光度。
107.本发明将得到的酶抑制率代入线性方程,得到样品中福美锌的浓度;所述线性方程为:酶抑制率=16.32
×
c 0.37,c的单位为μg/l。
108.在本发明中,所述线性方程的获取优选包括:将样品替换为一系列浓度的福美锌溶液,其余步骤同上在此不再赘述。本发明优选使用乙腈配制不同浓度的福美锌溶液,浓度分别为:10μg/l、50μg/l、100μg/l、250μg/l、400μg/l、500μg/l。在本发明中,所述线性方程检测福美锌的线性范围:0.1
‑
5μg/l,检测限为0.035μg/l。
109.本发明还提供了一种利用上述技术方案所述的tb
‑
gmp/ceo2复合材料检测福美锌的方法,其特征在于,包括以下步骤:
110.(1)将酪氨酸酶溶液与样品混合、静置,得到静置液;
111.(2)将所述步骤(1)得到的静置液与酪氨酸溶液、tris
‑
hcl缓冲液混合后进行反应,得到反应液;
112.(3)将所述步骤(2)得到的反应液与权利要求1所述的tb
‑
gmp/ceo2复合材料、3,3’,5,5
’‑
四甲基联苯胺溶液、柠檬酸
‑
磷酸氢二钠缓冲液混合、振荡,得到振荡液,使用智能手机对振荡液拍照,读取照片中的rgb值,将所述rgb值转化为s值,将所述s值代入线性方程中,得到样品中福美锌的浓度;
113.所述线性方程为:s=0.0779
×
c 0.0487,c的单位为μg/l。
114.在本发明中,步骤(1)~(3)得到振荡液与上述技术方案相同,在此不再赘述。得到振荡液后用智能手机对振荡液拍照,读取照片中的rgb值,将所述rgb值转化为s值(转化公式见图17),将所述s值代入线性方程中,得到样品中福美锌的浓度;所述线性方程为:s=0.0779
×
c 0.0487,c的单位为μg/l。本发明优选使用具有读取照片软件(如imagej)得到照片中的rgb值。
115.本发明还提供了一种利用上述技术方案所述的tb
‑
gmp/ceo2复合材料检测福美锌的方法,包括以下步骤:
116.a、将酪氨酸酶溶液与样品混合、静置,得到静置液;
117.b、将所述步骤a得到的静置液与酪氨酸溶液、tris
‑
hcl缓冲液混合后进行反应,得到反应液;
118.c、将所述步骤b得到的反应液与权利要求1所述的tb
‑
gmp/ceo2复合材料、超纯水混合、振荡,得到振荡液,测定所述振荡液的荧光发射光谱,得到最大荧光强度,将所述最大荧光强度转化为酶抑制率;
119.所述酶抑制率=(fd
‑
f0)/(f
‑
f0)
×
100,fd代表存在福美锌时,荧光发射光谱中的最大荧光强度,f0代表不存在福美锌时,荧光发射光谱中的最大荧光强度,f代表荧光发射光谱中的最大荧光强度;
120.d、将所述步骤c得到的酶抑制率代入线性方程,得到样品中福美锌的浓度;
121.所述线性方程为:酶抑制率=33.21
×
log
10
c 15.96,c的单位为μg/l。
122.本发明将酪氨酸酶溶液与样品混合、静置,得到静置液。在本发明中,所述酪氨酸酶溶液与样品的体积比优选为1:1。在本发明中,所述样品优选包括水果、自来水和农产品,
所述水果优选包括苹果,所述农产品优选包括大米和大豆。在本发明中,所述酪氨酸酶溶液的浓度优选为80u/ml;本发明优选以tris
‑
hcl缓冲液(浓度:10mm,ph=7.4)为溶剂,来配制酪氨酸酶溶液。在本发明中,所述静置的条件优选包括:静置的时间优选为15min,静置的环境温度优选为37℃。
123.本发明将得到的静置液与酪氨酸溶液、tris
‑
hcl缓冲液混合后进行反应,得到反应液。在本发明中,所述酪氨酸溶液与tris
‑
hcl缓冲液、样品的体积比优选为10:8:1。在本发明中,所述酪氨酸溶液的浓度优选为2.5mm。在本发明中,所述tris
‑
hcl缓冲液的浓度优选为10mm,ph值优选为7.4。在本发明中,所述反应的条件优选包括:反应的环境温度优选为37℃,反应的时间优选为30min。
124.本发明将得到的反应液与上述技术方案所述的tb
‑
gmp/ceo2复合材料、超纯水混合、振荡,得到振荡液,测定所述振荡液的荧光发射光谱,得到最大荧光强度,将所述最大荧光强度转化为酶抑制率;所述酶抑制率=(fd
‑
f0)/(f
‑
f0)
×
100,fd代表存在福美锌时,荧光发射光谱中的最大荧光强度,f0代表不存在福美锌时,荧光发射光谱中的最大荧光强度,f代表荧光发射光谱中的最大荧光强度,f=1561.6,f0=137.6,f和f0均为固定值。
125.在本发明中,所述tb
‑
gmp/ceo2复合材料优选以tb
‑
gmp/ceo2溶液与原料混合,所述tb
‑
gmp/ceo2溶液与超纯水的体积比优选为1:79。在本发明中,测定振荡液的荧光发射光谱的荧光激发波长优选为286nm。
126.本发明将得到的酶抑制率代入线性方程,得到样品中福美锌的浓度;所述线性方程为:酶抑制率=33.21
×
log
10
c 15.96,c的单位为μg/l。
127.在本发明中,所述线性方程的获取方式优选包括:将样品替换为一系列浓度的福美锌溶液,其余步骤同上在此不再赘述。本发明优选使用乙腈配制不同浓度的福美锌溶液,浓度分别为:50μg/l、100μg/l、250μg/l、500μg/l、1000μg/l、5000μg/l和10000μg/l。在本发明中,所述线性方程检测福美锌的线性范围:0.5
‑
100μg/l,检测限为0.046μg/l。
128.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
129.实施例1
130.tb
‑
gmp/ceo2复合材料的制备:
131.采用两步法合成tb
‑
gmp/ceo2。首先,沉淀法合成纳米ceo2,具体合成步骤如下:称取2.52g硝酸铈六水合物于200ml烧杯中,溶于100ml水
‑
乙二醇混合液(体积比为1:1)中。加热溶液达到60℃后,迅速加入20ml氨水,剧烈搅拌3h。将混合液冷却后,12000rpm离心10min得到黄色纳米ceo2沉淀。使用乙醇与超纯水多次洗涤纳米ceo2至洗涤液呈中性。将洗涤后的纳米ceo2与100ml柠檬酸钠溶液(浓度为30g/l)混合,超声30min后,持续加入乙醇直到没有沉淀生成。混合液12000rpm离心10min后弃去上清液,使用乙醇洗涤沉淀三次。将洗涤后的沉淀冷冻干燥,得到纳米ceo2。
132.采用搅拌法合成tb
‑
gmp/ceo2,具体步骤如下:使用超纯水作为溶剂,配制浓度为2.5mg/ml的纳米ceo2溶液,以及浓度为3.74mg/ml的氯化铽六水合物溶液。使用hepes缓冲液(浓度:0.1m,ph=7.4)配制浓度为4.07mg/ml的gmp溶液。取1ml gmp溶液于10ml塑料离心管中,加入0.15ml纳米ceo2溶液,混合搅拌20min。之后快速加入1ml氯化铽六水合物溶液,继续搅拌30min。反应结束后,混合液12000rpm离心10min后弃去上清液,沉淀用超纯水洗涤
三遍后冷冻干燥,得到tb
‑
gmp/ceo2。向tb
‑
gmp/ceo2中加入2ml超纯水,涡旋并超声至分散均匀后待用。
133.tb
‑
gmp/ceo2复合材料的x射线光电子能谱的物性参数为:铽(3d3/2)1277.1ev、铽(3d5/2)1242.5ev、铈(3d3/2)904.4ev、铈(3d5/2)886.1ev、氧1s 531.3ev、磷2p 133.8ev(图3)。
134.tb
‑
gmp/ceo2复合材料为球状纳米粒子(图1),粒径25
‑
50nm,x射线能谱分析显示含铽、铈、磷元素(图2),荧光光谱:最大激发波长:286nm,最大发射波长:545nm(图4)。吸收光谱:吸收峰约245nm(图5);tb
‑
gmp/ceo2复合材料可催化3,3’,5,5
’‑
四甲基联苯胺氧化,产物的吸收光谱在652nm处有吸收峰(图6)。
135.实施例2
136.实施例1制备的tb
‑
gmp/ceo2复合材料检测福美锌
137.首先以tris
‑
hcl缓冲液(浓度:10mm,ph=7.4)为溶剂,配制浓度为175u/ml的酪氨酸酶溶液。以乙腈为溶剂配制一系列浓度(10μg/l、50μg/l、100μg/l、250μg/l、400μg/l、500μg/l)的福美锌溶液,用于建立标准曲线法定量检测福美锌。
138.取5μl酪氨酸酶溶液于2ml塑料离心管中,再向离心管中加入5μl福美锌溶液并将两者充分混合,37℃静置5min。之后,向离心管中加入50μl浓度为2.5mm的酪氨酸溶液,并加入40μl浓度为10mm的tris
‑
hcl缓冲液(ph=7.4),混合均匀后静置于37℃环境中反应30min。反应完毕后,向离心管中加入100μl tb
‑
gmp/ceo2水溶液(浓度为2mg/ml)、75μl tmb(3,3’,5,5
’‑
四甲基联苯胺)溶液,以及225μl柠檬酸
‑
磷酸氢二钠缓冲液(ph=3)。将混合溶液室温500rpm振荡10分钟后,装入比色皿中放入紫外
‑
可见光分光光度计,测定吸收光谱,并记录最大吸光度。实验结果表明福美锌浓度越大,溶液的最大吸光度值就越大(图7),将不同浓度福美锌存在时溶液的吸光度转化为酶抑制率(ie,%),ie=(a
z
‑
a0)/(a
‑
a0)
×
100(式中,az和a0分别代表存在或不存在福美锌时,tb
‑
gmp/ceo2‑
酪氨酸酶
‑
酪氨酸体系催化下tmb氧化物的最大吸光度。a代表tb
‑
gmp/ceo2‑
酪氨酸催化下tmb氧化物的最大吸光度,其中a=0.7,a0=0.095,a和a0为固定值),建立ie与福美锌浓度对数间的线性方程,即可通过标准曲线法实现福美锌的定量检测(图8)。
139.线性方程为:酶抑制率=16.32
×
c 0.37,c的单位为μg/l。
140.在线性范围:0.1
‑
5μg/l,检测限为0.035μg/l。
141.实施例3
142.实施例1制备的tb
‑
gmp/ceo2复合材料检测福美锌
143.首先以tris
‑
hcl缓冲液(浓度:10mm,ph=7.4)为溶剂,配制浓度为80u/ml的酪氨酸酶溶液。以乙腈为溶剂配制一系列浓度(50μg/l、100μg/l、250μg/l、500μg/l、1000μg/l、5000μg/l、10000μg/l)的福美锌溶液,用于建立标准曲线法定量检测福美锌。
144.取5μl酪氨酸酶溶液于2ml塑料离心管中,再向离心管中加入5μl福美锌溶液并将两者充分混合,37℃静置15min。之后,向离心管中加入50μl浓度为2.5mm的酪氨酸溶液,并加入40μl浓度为10mm的tris
‑
hcl缓冲液(ph=7.4),混合均匀后静置于37℃环境中反应30min。反应完毕后,向离心管中加入5μl tb
‑
gmp/ceo2水溶液(浓度为2mg/ml)、以及395μl超纯水。将混合溶液室温500rpm振荡15分钟后,装入比色皿中放入荧光光谱仪测定荧光发射光谱(荧光激发波长:286nm),并记录最大荧光强度。实验结果表明福美锌浓度越大,溶液
的最大荧光强度值就越大(图9),将不同浓度福美锌存在时溶液的最大荧光强度转化为酶抑制率(ie,%),ie=(f
z
‑
f0)/(f
‑
f0)
×
100(式中,fz和f0分别代表存在或不存在福美锌时,tb
‑
gmp/ceo2‑
酪氨酸酶
‑
酪氨酸体系荧光发射光谱中的最大荧光强度。f代表tb
‑
gmp/ceo2‑
酪氨酸荧光发射光谱中的最大荧光强度。其中,f=1561.6,f0=137.6,f和f0均为固定值),建立ie与福美锌浓度对数间的线性方程,即可通过标准曲线法实现福美锌的定量检测(图10)。
145.线性方程为:酶抑制率=33.21
×
log
10
c 15.96,c的单位为μg/l。
146.线性范围:0.5
‑
100μg/l,检测限为0.046μg/l。
147.实施例4
148.实施例1制备的tb
‑
gmp/ceo2复合材料检测福美锌
149.检测方法同实施例2不同之处为最后使用智能手机对装有混合溶液的比色皿拍照而非使用紫外
‑
可见光分光光度计进行测定。实验结果表明福美锌浓度越大,溶液的颜色逐渐发生变化(图11)使用imagej软件读取照片中混合溶液区域的rgb值,并将rgb值转化为s值,建立s值与福美锌浓度间的线性方程,即可通过标准曲线法实现福美锌的定量检测(图12)。
150.线性方程:s=0.0779
×
c 0.0487,c的单位为μg/l。
151.线性范围:0.1
‑
5μg/l。
152.实施例5
153.采用实施例2相同的方法检测样品中检测福美锌:
154.进行添加回收实验以验证方法检测实际样品(自来水、大豆与苹果)中福美锌残留的能力。自来水取自中国农业大学理学院内,过0.22μm滤膜后稀释福美锌标准溶液,分别配制含不同浓度福美锌(0.05、0.25或0.5mg/l)的水样。检测步骤与检测标准溶液中福美锌的步骤相同。大米与苹果样品购买自本地超市,农产品样品中福美锌残留的提取方法如下:准确称取5g捣碎的样品于50ml塑料离心管中,加入25μl福美锌溶液(浓度分别为10、50或100mg/l),静置30min。向离心管中加入10ml pbs(ph=8,含10mm edta)与乙腈的混合提取液(体积比为1:1),混合涡旋10min。之后使用0.22μm滤膜过滤提取液。检测时,取10μl提取液,其余检测步骤与检测标准溶液中福美锌的步骤相同。
155.实验结果:吸收光谱法
156.回收率(%)=测定浓度/添加浓度
×
100
157.相对标准偏差(rsd):指三次平行实验回收率的相对标准偏差。
158.表1检测实际样品中福美锌残留的回收率与rsd
[0159][0160][0161]
注:苹果与大米样品中福美锌添加浓度与测定浓度为mg/kg,自来水样品中福美锌添加浓度与测定浓度为mg/l。
[0162]
从表1中可以得出,该方法检测实际样品中福美锌的回收率与rsd均良好,可以满足国家相关标准(gb2763
‑
2019)。
[0163]
实施例6
[0164]
采用实施例4相同的方法检测样品中检测福美锌:
[0165]
进行添加回收实验以验证方法检测实际样品(自来水、大豆与苹果)中福美锌残留的能力。自来水取自中国农业大学理学院内,过0.22μm滤膜后稀释福美锌标准溶液,分别配制含不同浓度福美锌(0.05mg/l、0.25mg/l或0.5mg/l)的水样。检测步骤与检测标准溶液中福美锌的步骤相同。大米与苹果样品购买自本地超市,农产品样品中福美锌残留的提取方法如下:准确称取5g捣碎的样品于50ml塑料离心管中,加入25μl福美锌溶液(浓度分别为10mg/l、50mg/l或100mg/l),静置30min。向离心管中加入10ml pbs(ph=8,含10mm edta)与乙腈的混合提取液(体积比为1:1),混合涡旋10min。之后使用0.22μm滤膜过滤提取液。检测时,取10μl提取液,其余检测步骤与检测标准溶液中福美锌的步骤相同。
[0166]
实验结果:智能手机法:
[0167]
表2实际样品中福美锌残留的回收率与rsd
[0168][0169][0170]
注:苹果与大米样品中福美锌添加浓度与测定浓度为mg/kg,自来水样品中福美锌添加浓度与测定浓度为mg/l。
[0171]
从表2中可以得出,该方法检测实际样品中福美锌的回收率与rsd均良好,可以满足国家相关标准(gb2763
‑
2019)。
[0172]
实施例7
[0173]
采用与实施例的2相同的方法检测,即荧光光谱检测:自来水取自中国农业大学理学院内,过0.22μm滤膜后,稀释福美锌标准溶液,分别配制含不同浓度福美锌(0.1mg/l、0.5mg/l或5mg/l)的水样。检测步骤与检测标准溶液中福美锌的步骤相同。大米与苹果样品购买自本地超市,农产品样品中福美锌残留的提取方法如下:准确称取5g捣碎的样品于50ml塑料离心管中,加入25μl福美锌溶液(浓度分别为20mg/l、100mg/l或1000mg/l),静置30min。向离心管中加入10ml pbs(ph=8,含10mm edta)与乙腈的混合提取液(体积比为1:1),混合涡旋10min。之后使用0.22μm滤膜过滤提取液。检测时,取10μl提取液,其余检测步
骤与检测标准溶液中福美锌的步骤相同。
[0174]
实验结果:
[0175]
表3检测实际样品中福美锌残留的回收率与rsd
[0176][0177][0178]
注:苹果与大米样品中福美锌添加浓度与测定浓度为mg/kg,自来水样品中福美锌添加浓度与测定浓度为mg/l。
[0179]
从表3中可以得出,该方法检测实际样品中福美锌的回收率与rsd均良好,可以满足国家相关标准(gb2763
‑
2019)。
[0180]
实施例8
[0181]
采用与实施例2相同的方法检测福美锌,即采用吸收光谱法检测福美锌,考察ph值、酪氨酸酶浓度、酪氨酸酶与酪氨酸混合反应的时间与温度、福美锌与酪氨酸酶混合反应的时间对检测结果的影响,结果如下:
[0182]
从图13中的a和表4可以看出,当溶液的ph=3时,tmb氧化产物的吸光度值最大,因此tb
‑
gmp/ceo2催化tmb氧化时溶液的ph值确定为3。
[0183]
从图13中的b和表5可以看出,当酪氨酸酶浓度达到1.75u/ml时,继续提高酪氨酸
酶浓度,tmb氧化产物的吸光度变化较小,表明酪氨酸酶浓度可能已经过量。因此,考虑尽量降低酪氨酸酶浓度以提高福美锌检测的灵敏度,选择1.75u/ml为酪氨酸酶浓度。酪氨酸酶与酪氨酸混合反应时间的优化实验表明,反应30min后,tmb氧化产物的吸光度变化较小(图13中的c和表6)。因此,选择30min为酪氨酸酶与酪氨酸混合反应的时间。温度为37℃时,tmb氧化产物的吸光度达到最大值(图13中的d和表7)。因此,选择37℃为反应温度。
[0184]
从图13中的e和表8可以看出,福美锌与酪氨酸酶混合反应的时间达到5min后,tmb氧化产物的吸光度基本不再变化。因此,选择5min为福美锌与酪氨酸酶混合反应的时间。
[0185]
表4 ph值影响结果
[0186][0187]
表5酪氨酸酶浓度影响的结果
[0188][0189]
表6酪氨酸酶与酪氨酸混合反应时间影响的结果
[0190][0191]
表7反应温度的影响
[0192][0193][0194]
表8福美锌与酪氨酸酶混合反应的时间影响的结果
[0195][0196]
实施例9
[0197]
采用与实施例3相同的方法检测,即荧光光谱法检测,考察反应时间、酪氨酸酶的浓度,以及酪氨酸酶与酪氨酸混合反应的时间与温度、福美锌与酪氨酸酶混合反应的时间对检测结果的影响,结果如下:
[0198]
从图14中的a和表9可以看出,当tb
‑
gmp/ceo2与酪氨酸酶催化体系混合反应的时间为15min时,tb
‑
gmp/ceo2的荧光强度达到最低水平,表明酶催化产物与tb
‑
gmp/ceo2的结合作用基本完全,因此tb
‑
gmp/ceo2与酪氨酸酶催化体系混合反应的时间确定为15min。
[0199]
从图14中的b和表10可以看出,当酪氨酸酶浓度达到0.8u/ml时,继续提高酪氨酸酶浓度,tb
‑
gmp/ceo2的荧光强度变化较小,表明酪氨酸酶浓度可能已经过量。因此,考虑尽量降低酪氨酸酶浓度以提高福美锌检测的灵敏度,选择0.8u/ml为酪氨酸酶浓度。酪氨酸酶与酪氨酸混合反应时间的优化实验表明,反应30min后,tb
‑
gmp/ceo2的荧光强度变化较小(图14中的c和表11)。因此,选择30min为酪氨酸酶与酪氨酸混合反应的时间。反应温度为37℃时,tb
‑
gmp/ceo2的荧光强度达到最低水平(图14中的d和表12)。因此,选择37℃为反应温度。
[0200]
从图14中的e和表13可以看出,福美锌与酪氨酸酶混合反应的时间达到15min后,tb
‑
gmp/ceo2的荧光强度基本不再变化。因此,选择15min为福美锌与酪氨酸酶混合反应的时间。
[0201]
表9 tb
‑
gmp/ceo2与酪氨酸酶催化体系混合反应的时间影响的结果
[0202][0203][0204]
表10酪氨酸酶浓度影响的结果
[0205][0206]
表11酪氨酸酶与酪氨酸混合反应时间影响的结果
[0207][0208]
表12反应温度
[0209][0210]
表13福美锌与酪氨酸酶混合反应的时间影响的结果
[0211][0212][0213]
实施例10
[0214]
检测方法的选择性:
[0215]
吸收光谱法:选取几种金属离子(钠离子、钙离子、锌离子)、生化物质(维生素c、葡萄糖、甘氨酸)与使用量较大的杀菌剂(甲霜灵、戊唑醇、嘧菌酯),以同样的操作步骤测定每种物质对tb
‑
gmp/ceo2‑
tmb
‑
酪氨酸酶
‑
酪氨酸显色反应体系吸光度的影响。所有非目标物的浓度为25μg/l。结果见图15。
[0216]
从图15中可以得出,可见相比于福美锌(浓度为2.5μg/l),其他非目标物质在高浓
度下(25μg/l)仍然不会对酪氨酸酶有明显的抑制现象,表明该方法检测福美锌的特异性较好。
[0217]
实施例11
[0218]
采用与实施例3的检测方法,即荧光光谱法:
[0219]
选取几种金属离子(钠离子、钙离子、锌离子)、生化物质(维生素c、葡萄糖、甘氨酸)与使用量较大的杀菌剂(甲霜灵、戊唑醇、嘧菌酯),以同样的操作步骤测定每种物质对tb
‑
gmp/ceo2‑
酪氨酸酶
‑
酪氨酸体系最大荧光强度的影响。所有非目标物的浓度为50μg/l,结果见图16。
[0220]
实验结果:可见相比于福美锌(浓度为5μg/l),其他非目标物质在高浓度下(50μg/l)仍然不会对酪氨酸酶有明显的抑制现象,表明该方法检测福美锌的选择性同样较好。
[0221]
由以上实施例可以得出,采用本技术提供的tb
‑
gmp/ceo2复合材料能快速检测出样品中的福美锌。
[0222]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

