使用基因组特异性探针的循环肿瘤和肿瘤干细胞检测
1.本技术是申请号为201580075104.1的发明名称为“使用基因组特异性探针的循环肿瘤和肿瘤干细胞检测”的中国专利申请的分案申请,原申请是2015年12月10日提交的pct国际申请pct/us2015/065057于2017年07月31日进入中国国家阶段的申请。
2.本技术要求于2014年12月10日提交的美国临时申请序列号62/090,167的优先权权益,其全部内容在此通过引用并入。
技术领域
3.本公开内容涉及肿瘤学、遗传学和分子生物学领域。更特别地,本公开内容涉及使用针对高度预测赘生物形成(neoplasia)的发生和赘生性事件的进展的区域的探针。利用本公开内容,可以使用极少量的血液(例如,手指针刺物)来筛选对象的例如肺癌。
背景技术:
4.相关技术说明
5.据估计2005年在美国肺癌占新癌症病例的13%,并且是癌症死亡的主要原因。不幸的是,尽管在治疗上取得了进展,但是总体5年存活率仍保持低于15%。明显地,需要开发用于治疗肺癌的新策略,并且同时开发可以用于监测对新治疗的早期应答的灵敏性替代生物标志物。构成肿瘤亚群的一小部分但确是关键部分的循环癌细胞(circulating cancer cell,ctc)或肿瘤干细胞的存在现在被认为是用于检测和根除患者应答和存活的“圣杯”。
6.cristofanilli等(2004)在患有转移性乳腺癌的患者的前瞻研究中表明,在基线处ctc高于5个/7.5ml血液的患者与显著更短的无进展存活和更短的总体存活二者均相关。pierga等类似地报道了患有乳腺癌的患者的外周血中细胞角蛋白阳性ctc的存在与阶段和预后相对应(pierga等,2004)。一些研究者已着眼于与原发性肿瘤相比转移细胞中的基因组标签,并且已经发现原发性肿瘤中预测转移和不良临床结果的基因表达标签(gangnus等,2004;ramaswamy等,2003;muller和pantel,2004)。另一些研究者使用pcr在非小细胞肺癌(non
‑
small cell lung cancer,nsclc)病例中的外周血中鉴定与ctc有关的基因,并且已经表明不良的治疗应答与治疗后的ctc检测有关(sher等,2005)。
7.一种共识正在形成:癌发生(carcinogenesis)的关键早期事件是基因组不稳定性表型的诱导,这使得初始细胞能够通过得到更大的增殖能力而演变成癌细胞(fenech等,2002)。众所周知,癌症由可通过染色体改变介导的多个遗传变化的累积引起,并且由此具有在细胞遗传学上可检测的潜力(solomon等,1991)。已经假定,外周血淋巴细胞中遗传损伤的水平反映了导致靶组织中癌发生过程的前体细胞损伤的量(hagmar等,1998)。最近来自组群和巢式病例
‑
对照研究的结果已经有力地证实了细胞遗传生物标志物与癌症风险呈正相关的证据,其显示染色体畸变是作为癌症风险的标志物(liou等,1999;bonassi等,2000;bonassi等,2004;smerhovsky等,2001;tucker和preston,1996),这反映致癌原的遗传毒性效应和个体癌症易感性是用于测量dna损伤的常用方法,因为评价微核(mn)比染色体畸变相对地更容易(fenech等,2002)。mn起源于未能接合有丝分裂纺锤体并且因此在细
胞分裂时滞后的染色体片段或整个染色体。相比于其他细胞遗传测定,量化mn提供了数个优点,包括分析的速度和方便、无需中期细胞以及可靠地鉴定已经完成仅一次核分裂的细胞,这防止了由细胞分裂动力学的差异所引起的混淆影响,因为mn、npb或nbud的表达依赖于核分裂的完成(fenech,2000)。由于细胞阻滞于双核阶段,故还可以测量起源于不对称的染色体重排和/或端粒末端融合的核质桥(nucleoplasmic bridge,npb)(umegaki等,2000;stewenius等,2005)。当在后期双着丝粒染色体或染色单体的着丝粒被拉至细胞的相对极时,npb出现。在cbmn测定中,容易观察到具有npb的双核细胞,因为胞质分裂被抑制,从而阻止npb所来源的后期桥断裂并且由此在npb周围形成核膜。在暴露于dna断裂剂的细胞中mn和npb均出现(stewenius等,2005;fenech和crott,2002)。除mn和npb之外,cbmn测定还允许检测核芽(nuclear bud,nbud),其代表细胞移除扩增的dna的机制,并且因此被认为是可能的基因扩增的标志物(fenech(2002)综述)。cbmn测试正在缓慢地替代在淋巴细胞中的染色体畸变分析,因为mn、npb和nbud易于识别和评分,并且可以在较短时间内获得结果(fenech,2002)。
8.在肺癌患者中预测临床结果的因素包括疾病或肿瘤负荷的程度。循环肿瘤细胞(ctc)可以作为肿瘤负荷的量度,并且还可以是更准确地分期患者的方法。先前基于以下测定来从全血中分离ctc,所述测定采用包被有抗细胞角蛋白抗体的磁珠(阳性选择),或用针对上皮细胞的角蛋白的抗体(epicam)消耗cd45淋巴样细胞或消耗cd45细胞。oncoquick系统涉及梯度分离的细胞和免疫组织化学以及随后的图像分析。用于获得ctc的其他方法包括介电电泳(dielectrophoresis,dep)阵列法,其中通过电极阵列将包含经荧光标记的ctc的经富集细胞样品注射到盒中,这产生介电场。这将每个细胞诱捕到dep虚拟笼中,在此之后,可基于荧光模式来选择目的细胞并将其分派用于进一步研究。然而,为了发现哪些目的细胞可能是ctc,操作者必需预先知晓ctc的免疫表型。
9.先前检测ctc的方法还包括pcr测定。然而,这些方法不能量化肿瘤细胞的数目或观察形态。基于先前为抗原依赖性并且需要ctc表达血流中仅少数ctc表达的上皮抗原epcam的方法,发现循环癌细胞的产率低到不存在,尤其是在肺癌和三阴性乳腺癌中。因此,需要开发用于检测样品中ctc并确定其中ctc水平的更灵敏且与抗原无关的方法。实现这一点的最有前途方式之一依赖于考虑在正常外周血单个核细胞(peripheral blood mononuclear cell,pbmnc)中从未发现的染色体异常的测试,所述染色体异常限定非整倍体细胞并且可以通过间期荧光原位杂交(inter
‑
phase fluorescence
‑
in
‑
situ hybridization)或fish量化。
技术实现要素:
10.提供了在含血细胞样品中检测循环肿瘤细胞(ctc)的方法,其包括:(a)通过评估核面积和/或圆度来从含血细胞样品中选择ctc;(b)使选择的细胞与针对3p22.1、10q22.3、10号染色体着丝粒(chromosome 10centromeric,cep10)和3号染色体着丝粒(chromosome 3centromeric,cep3)的经标记核酸探针杂交;(c)通过检测来自细胞的荧光原位杂交来评价选择的细胞的信号模式;以及(d)基于所有4种经标记核酸探针与所选择的细胞杂交的模式来检测ctc。所述方法还可以包括获得所述样品。步骤(d)可以包括评估所有异常或仅增益。所述方法可以包括四个探针组中两个或更多个的异常。所述方法还可以采用通过例如
使用免疫组织化学检测表面活性蛋白(例如sp
‑
a、sp
‑
b和/或sp
‑
c)来进行ctc检测。
11.通常来说,例如使用dapi(4’,6
‑
二脒基
‑2‑
苯基吲哚)来对核染色以允许评估/分选。在某些实施方案中,从细胞中获得核并使其自行分选。可以使用标准的细胞裂解方案来裂解细胞。通常以彩色或单色ccd相机对细胞制备物上存在的全部有核细胞成像并分类。分类的细胞的数目由操作者预先设定,但是通常针对以下扫描数千个细胞:
12.1)基于dapi染色的以像素计的核面积,其表示为任意单位,因此,如果为5000,则意指细胞面积为5000像素;
13.2)核直径;以及
14.3)圆度因子(circularity factor,cf),其通过改变伸长率(细胞的高度和宽度之间的比例)来计算,其中完美圆的值为1(淋巴细胞的cf接近1,异常细胞由于其核周长的不规则性而有很多cf>>1)。
15.如在dapi染色(核染色)上测量的,异常细胞(恶性ctc)的核面积以核所占据的像素的数目(如通过fish多体性(polysomy)>2所限定的)为基础,并且以任意单位表示。在其中ctc的绝对数目具有诊断性的一些实施方案中,4个或更多个ctc的发现将指示患者具有癌症。
16.所述方法还可以包括在步骤(b)之前过滤所述血液样品,例如通过使用真空装置和穿孔有7.5μm孔的膜来过滤所述血液样品;并且进一步地,所述血液样品是外周血单个核细胞的梯度分离样品。血液样品可以是通过ficoll
‑
hypaque梯度从血液中分离的血沉棕黄层(buffy coat layer),例如通过基于cd3和/或cd45珠的纯化进一步纯化以除去白细胞的血沉棕黄层。ctc的选择可以通过评估核面积来实现,评估核面积包括通过确定核直径或通过dapi浓度及其标准差来确定每个ctc的像素尺寸并施加预定阈值进行排除。
17.患者可以是已知或怀疑患有癌症的,所述癌症例如引起血源性转移的癌症形式,包括但不限于肺、头和颈、乳腺、结肠、前列腺、胰腺、食管、肾、胃肠肿瘤、泌尿生殖肿瘤、肾、黑素瘤、内分泌肿瘤(甲状腺,包括乳头状甲状腺癌;肾上腺皮质或髓质)或肉瘤的癌症。染色还可以包括使样品与经标记的cd45抗体、经标记的snail1抗体和/或经标记的抗glut1抗体接触,例如其中标记为荧光标记或生色原(chromagen)标记。检测信号可以包括使用自动化荧光扫描仪。
18.所述方法还可以包括在步骤(b)至(d)中使用并检测一种或更多种另外的探针,例如urovysion dna探针组;lavysion dna探针组;着丝粒7/7p12表皮生长因子(egfr)探针;cep7/7p22.1、cep17和9p21.3探针;egfr/cep和10/cep10q探针;pten、cep10和cep10q探针;和/或eml4
‑
alk探针组。
19.在另一个实施方案中,提供了如下确定来自患者的含血细胞样品中循环肿瘤细胞(ctc)的水平的方法:(a)通过评估核尺寸和/或圆度来从血液样品中选择ctc;(b)使选择的细胞与针对3p22.1、10q22.3、10号染色体着丝粒(cep10)和3号染色体着丝粒(cep3)的经标记核酸探针接触;(c)检测来自细胞的荧光原位杂交;以及(d)基于与所有4种经标记核酸探针的杂交来量化ctc。步骤(d)可以包括评估所有异常或仅增益。所述方法可以包括四个探针组中的两个或更多个的异常。所述方法还可以采用通过例如使用免疫组织化学检测表面活性蛋白(例如sp
‑
a、sp
‑
b和/或sp
‑
c)来进行ctc检测。
20.在又一个实施方案中,提供了在患者中检测癌症的方法,其包括通过上述任一种
方法来确定来自患者的含血细胞样品中循环肿瘤细胞(ctc)的水平,其中样品中存在等于4个或更多个ctc指示癌症,例如其中样品为分离的血沉棕黄层的5ml样品。
21.在又一个实施方案中,提供了在患者中检测癌症的方法,其包括通过上述任一种方法来确定来自患者的含血细胞生物样品中ctc的水平,其中在肺中存在大于3mm的不确定结节的情况下,血液样品中存在ctc指示癌症。
22.在又一个实施方案中,提供了在处于高肺癌风险的患者中筛选肺癌的方法,其包括通过上述任一种方法来确定来自患者的含血细胞样品中循环肿瘤细胞(ctc)的水平,其中血液样品中ctc的存在指示肺癌。高风险可以基于年龄>55岁、当前或曾经为吸烟者的历史、暴露于二手香烟烟雾或者具有癌症家族史。所述方法还可以包括当观察到ctc存在时进行螺旋ct扫描。所述方法还可以包括在第二时间点重复所述方法以确定ctc水平的增加。
23.在又一个实施方案中,提供了在患者中评价癌症的方法,其包括通过上述任一种方法来确定来自患者的含血细胞样品中循环肿瘤细胞(ctc)的水平,其中与对照或来自非侵袭性癌症形式的预定ctc数目相比,样品中ctc的水平较高指示侵袭性癌症形式和/或癌症预后差。
24.对照可以是非癌性样品。所述方法还可以包括获得患者样品,报告ctc水平,和/或基于ctc水平是否高来治疗癌症,例如用化学治疗、放射治疗、外科手术、基因治疗、免疫治疗、靶向治疗或激素治疗来治疗癌症。
25.在另一个实施方案中,提供了在患者中监测癌症的治疗的方法,其包括:(a)通过上述任一种方法来确定来自患者的第一样品中ctc的水平;(b)通过上述任一种方法来确定来自实施治疗后的患者的第二样品中ctc的水平;以及(c)将第一样品中ctc的水平与第二样品中ctc的水平进行比较以评估变化,从而监测治疗。
26.所述方法还可以包括如果与步骤(a)相比步骤(b)中ctc水平降低,则继续治疗。所述治疗可以是化学治疗、放射治疗、外科手术、基因治疗、免疫治疗、靶向治疗或激素治疗。所述方法还可以包括如果与步骤(a)相比步骤(b)中ctc水平未降低,则停止治疗。所述方法还可以包括获得所述第一和/或第二患者样品。
27.另一个实施方案包括在患者中分期癌症的方法,其包括通过上述任一种方法来确定来自患者的含血细胞样品中的循环肿瘤细胞(ctc),其中与给定期的预定对照相比,样品中ctc的水平较高指示较晚期的癌症,以及与给定期的对照相比,样品中ctc的水平较低指示较不晚期的癌症。
28.对照可以是肺癌0期样品、肺癌i期样品、肺癌1a期样品、肺癌1b期样品、肺癌ii期样品、肺癌iii期样品、肺癌iv期样品、和/或肺非癌性样品。所述方法还可以包括获得患者样品,报告ctc水平,和/或如果ctc水平指示较晚期的癌症,则治疗癌症。所述治疗可以是化学治疗、放射治疗、外科手术、基因治疗、免疫治疗、靶向治疗或激素治疗。所述方法可用于在治疗开始之后细化癌症分期。
29.在一些具体实施方案中,与对照样品中的水平相比,ctc水平高至少50%。在另一些实施方案中,ctc水平是对照样品的水平的至少约或至多约2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25倍大,或可从中推出的任何范围。在一些具体实施方案中,ctc水平是对照样品的水平的至少2倍大。
30.对于前述任一种方法,还可以检测一种或更多种癌症基因标记的表达水平从常规
的变化。这些可以促进所述方法的诊断、分期或预后。
31.可以考虑,本说明书中讨论的任何实施方案可以根据本公开内容的任何方法或组合物来实施,反之亦然。此外,本公开内容的组合物可以用于实现本公开内容的方法。
32.权利要求书和/或说明书中没有数量词修饰的名词的使用可以意指“一个/种”,但是其还与“一个/种或更多个/种”、“至少一个/种”和“一个/种或多于一个/种”的含义一致。
33.如见于权利要求书和/或说明书中的短语“一个/种或更多个/种”被限定为1、2、3、4、5、6、7、8、9、10个/种或更多个/种。
34.在本技术通篇,术语“约/大约”和“近似”表示值包括装置、用于确定值的方法的固有误差变化,或研究对象间存在的变化。在一个非限制性实施方案中,该术语被限定为在10%内,优选在5%内,更优选在1%内,并且最优选在0.5%内。
35.除非明确地指出仅指替代方案或者替代方案相互排斥,否则权利要求书中术语“或/或者”的使用用于意指“和/或”,但是本公开内容支持指仅替代方案和“和/或”的定义。
36.如本说明书和权利要求书中使用的,词语“包含”(及其任何变化形式)、“具有”(及其任何变化形式)、“包括”(及其任何变化形式)或“含有”(及其任何变化形式)是包括式或开放式的,并且不排除另外的未记载要素或方法步骤。
37.通过以下详细描述,本公开内容的其他目的、特征和优点将变得显而易见。然而,应理解,详细描述和具体实例尽管说明本公开内容的一些具体实施方案但是仅以示例的方式给出,因为通过该详细描述,在本公开内容的精神和范围内的多种变化方案和修改方案将对本领域技术人员变得显而易见。
附图说明
38.通过参照这些附图中的一幅或更多幅并结合本文中所示具体实施方案的详细描述,本公开内容可以更好地被理解。
39.图1:数据流。
40.图2a至2d:74个样品的3d散点图。图2a(左上)、图2b(右上)、图2c(左下)和图2d(右下)
‑
74个样品的3d散点图。
41.图3:数据中检测到的聚簇(cluster)的估计数目。
42.图4:使用平均连接之簇聚方法的聚簇样品。
43.图5:euclideand(y
‑
轴)相对于聚簇(x
‑
轴)。2个红色菱形(病例)在对照组中,并且聚簇2中的3个空心圆为对照样品。红色箭头指向具有相同euclideand=859的两个不明确样品(参见表13)。
44.图6:外周血单个核细胞中的遗传异常,其评价所有细胞中染色体的增加和丢失。500个外周血细胞中病例和对照之间所有遗传异常、缺失和增加之间的比较指出,在25的阈值下,我们有2个假阳性但100%灵敏,如果与另一种增益测试组合,则获得几乎完全完美的灵敏性和特异性。y轴=异常数,x轴=对象数。
45.图7:循环肿瘤细胞的非整倍性,其限定为在4
‑
基因fish探针分析中任何基因增加2个或更多个的细胞。使用>4个异常细胞的阈值,本发明人可以预测患有癌症的21/23病例的癌症状况;注意到使用该阈值,本发明人观察到100%的特异性。x轴=患者数,y轴=异常细胞的#。
具体实施方式
46.患有肺癌的患者中的循环肿瘤细胞(ctc)会显示出与原发性肺癌中可见的类似的遗传异常。其他研究者已经使用免疫磁性捕获或密度梯度离心与免疫组织化学和fish来检测ctc的非整倍性。然而,所有的研究尽管证明了与原发性肿瘤的那些类似的遗传异常但是仍受到低细胞回收率和不能够在ctc<10/7.5ml血液的患者中检测染色体异常的限制。
47.与原发性肿瘤包含相同遗传异常的遗传异常单个核细胞(或循环肿瘤细胞)存在于肺癌患者的外周血中,与肿瘤阶段和肿瘤负荷有关,并且相对于高阶段疾病在患有低阶段疾病的患者中以较低水平出现。在基线时和治疗后随访时通过组合的免疫组织化学和荧光原位杂交(fish)监测外周血中的这些细胞提供了针对治疗的应答的灵敏分子标志,即使携带这些染色体或遗传异常疾病的细胞的数目降低。在一些情况下,本发明人已经表明ctc水平可以在肺癌的外科手术切除后3至6周达到峰值,并且远远高于在外科手术之前在基线时采集的初始血液样品。本发明人将该第二峰归因于ctc从隔离位点(例如骨髓)移动到外周血中,并且在12周后采集的第三随访血液可以落回到低于基线水平。该发现与更长的存活有关。类似地,具有这些缺失的细胞的数目的持续或增加会指示稳定或进行性疾病。例如,在早期肺赘生物形成的发病机制中同时并且非常早地出现染色体3p21.3和3p22.1的缺失。与肺癌赘生物形成高度相关的大量肿瘤抑制基因位于基因组的这一部分中(barkan等,2004;goeze等,2002)。类似地,染色体10q22
‑
23的缺失已经被频繁地报道存在于原发性肺癌以及转移性肺癌(二者均用于小细胞和非小细胞肺癌(nscl))中。此外,10q22
‑
23的缺失与侵袭性临床过程有关,其中高水平的缺失与预后不良紧密相关jiang等,2005;goeze等,2002;gough等,2002)。
48.因此,本公开内容提供了这样的方法,其使用核尺寸排阻方法、使用已验证的核酸探针组的fish分析从外周血中分离肿瘤细胞用于检测癌症、治疗后随访以及用于纵向监测疾病状态和对不同治疗的应答。已经表明,与先前的方法相比,通过本公开内容的方法可以以远远更高的水平在外周血中发现具有克隆遗传异常的细胞。
49.该方法具有以下益处:(1)与其他方法先前所描述的相比,能够分离数目远远更高的异常细胞,从而允许使用较小的样品体积;(2)能够使用与免疫荧光染色组合在单个样品上的多种分子dna探针来进行多色fish以获得ctc的表型并证明克隆形成能力;以及(3)能够通过检测具有合适核尺寸的细胞来富集异常表型。与其他方法相比,灵敏性和准确性方面得到显著提高。
50.应注意,本技术中所述的方法可以适用于从引起血源性转移的任何其他类型癌症中分离循环肿瘤细胞。这包括肺、乳腺、结肠、前列腺、胰腺、食管、全部胃肠肿瘤、泌尿生殖肿瘤、肾癌、黑素瘤、内分泌肿瘤、肉瘤等的癌症。特别地,基于已公开的基因组数据或基于如下产生的基因组数据每组肿瘤可推导出在特定癌症亚型中异常的一组基因组标记:用比较基因组杂交(comparative genomic hybridizatiom,cgh)或单核苷酸多态性(single nucleotide polymorphism,snps)测试不同的肿瘤并进行生物信息学以确定不同基因的过表达或表达不足。在待测试异常分子区域的最优选择之后,可以合成最佳的荧光标记探针。
51.i.癌症
52.本公开内容设想了使用测定来检测癌症并结合癌症治疗来预测癌症进展。在其中患者怀疑处于癌症风险之中的一些情况下,可以采用预防性治疗。在另一些癌症对象中,诊
断可以允许早期的治疗干预。在又一些情况下,本文中所述的测定的结果可以提供关于重复治疗需要的有用信息,例如,当存在转移性疾病、复发性疾病或残余疾病的可能性时。最后,本公开内容证明可以用于表明哪些治疗向和不向特定患者提供益处。
53.此外,本技术中所述的方法能够被转化成用于从引起血源性转移的任何其他类型癌症中分离循环肿瘤细胞的方法。这包括肺、乳腺、结肠、前列腺、胰腺、食管、全部胃肠肿瘤、泌尿生殖肿瘤、肾癌、黑素瘤、内分泌肿瘤、肉瘤等的癌症。
54.a.肿瘤发生
55.本领域中已经充分研究了肿瘤组织中不同基因的缺失。然而,仍然需要显著用于检测癌症发生中的早期分子事件以及使患者易发生癌症的分子事件的探针。用于癌症分期的探针也是感兴趣的。所提出的导致肿瘤发生的顺序包括如通过染色体丢失或增加所表明的在细胞或亚微观水平的遗传不稳定性,其由于赋予选择性增殖优势的因子的理论获得而导致过度增殖状态。此外,在遗传水平上,涉及细胞周期抑制剂和肿瘤抑制基因(tsg)的功能丧失或者驱动细胞增殖的癌基因扩增。
56.在增生之后,基于组织学识别发育不良、原位癌和最终肿瘤侵入的进行性程度顺序。在这些组织学变化之前以及同时发生遗传损伤的进行性累积。在染色体水平上,遗传不稳定性通过伴随标记染色体演变的染色体丢失或增加以及结构染色体改变(例如染色体的易位和倒位)来显现。另外,细胞可以经历多倍体化。赘生性细胞的单个或多个克隆可以演变成在许多情况下以非整倍体细胞群为特征。这些可以通过例如流式细胞术或图像分析的技术相对于患者的正常细胞测量dna含量或倍性来量化。
57.b.预后因素和分期
58.诊断时癌症的阶段是癌症扩散程度的指示,并且可以是关于患者存活的最重要预后因素之一。对于每种类型的癌症,分期系统是特定的。例如,现在关于患有非小细胞型肺癌之患者的存活的最重要预后因素是诊断时疾病的阶段。例如,关于患有非小细胞型肺癌之患者的存活的最重要预后因素是诊断时疾病的阶段。反之,小细胞癌症的存在通常伴随着广泛扩散传播,因此分期系统不太适用。分期系统是基于癌症的解剖程度而设计的,并且现在已知的为基于解剖尺寸以及在肺和邻近结构、区域淋巴结内的扩散以及远端转移的tnm(肿瘤、结节、转移)系统。目前当疾病处于限制于起始器官的低阶段时,治愈方法的唯一希望是肿瘤的可手术性,其只能被切除。
59.c.肿瘤分级
60.肺癌的组织学类型和级别在疾病的阶段内具有一定的预后影响,其中i期腺癌被报道具有最佳预后,其中对于支气管
‑
肺泡和乳头状亚型,5年存活率为50%,1年存活率为65%和59%(naruke等,1988;travis等,1995;carriaga等,1995)。对于鳞状细胞癌和大细胞癌,5年存活率为大约35%。小细胞癌症具有最差的预后,其中对于患有局部疾病的患者,5年存活率为仅12%(carcy等,1980;hirsh,1983;vallmer等,1985)。对于具有远端转移的患者,无论组织学亚型,5年存活率均为仅1%至2%(naruke等,1988)。除组织学亚型之外,已经表明在亚型内癌的组织学分级具有预后价值,其中分化良好的肿瘤比分化差的赘生物具有更长的总体存活。与患有差分化腺癌的患者的仅34%存活率相比,分化良好的局部腺癌的总体存活率为69%(hirsh,1983)。患有局部鳞状癌的患者的5年存活率从37%(对于分化良好的赘生物)至25%(对于分化差的鳞状癌)而不同(ihde,1991)。
61.用于确定肺肿瘤亚型的组织学标准如下:鳞状细胞癌由具有角蛋白形成、角化珠形成和/或细胞间桥的肿瘤组成。腺癌由实体瘤中具有明确腺形成或黏蛋白产生的肿瘤组成。小细胞癌由由具有卵形或梭形核、点状染色质和不明显核的小细胞构成的肿瘤组成。大细胞未分化癌由由具有泡状核和明显核仁而没有鳞状或腺分化迹象的大细胞构成的肿瘤组成。分化差的癌包括含有鳞状和腺分化二者的区域的肿瘤。
62.d.癌的发生
63.肺的癌的演变最有可能代表由整个呼吸消化系统(aero
‑
digestive system)遭受长期致癌损害引起的区域性癌变效应(field cancerization effect),所述致癌损害例如苄基芘、石棉沉着病、空气污染、以及化学品、其他香烟烟雾中的致癌物质、或者其他环境致癌原。该概念首先由slaughter等(1953)提出。区域性效应的存在的证据是多种同时或异时第二原发性肿瘤(spt)的共同发生,这可发生在口咽、上食管、或者同侧或对侧肺中的整个呼吸消化道。
64.伴随这些分子缺陷的是组织学异常上皮变化的频繁显现,所述变化包括增生、化生、发育异常和原位癌。在吸烟者中已经证明,邻近的正常支气管上皮以及赘生物形成前组织学病变二者都可能包含遗传改变细胞的克隆(wistuba等,2000)
65.licciardello等(1989)发现大部分在患有最早期原发性肿瘤spt的患者中,上和下呼吸消化道中异时肿瘤的10%至40%发生率和同时spt的9%至14%发生率可比来自原始原发性肿瘤的复发承受更高的风险并且可以证明是在成功治疗早期原发性头、颈或肺肿瘤之后长期存活的最主要威胁。因此,仔细追踪这些患者在新恶性肿瘤高风险部位(特别在呼吸消化系统中)的新spt的迹象至关重要。
66.除微观水平上的染色体改变之外,多次盲法支气管活组织检查可以证明在邻近肺癌区域的部位存在不同程度的上皮内赘生物形成。另一些研究者已经表明,在大部分轻型和重型吸烟者以及已经手术切除癌症的全部肺中存在从纤毛损失和基底细胞增生到cis的上皮变化(auerbach等,1961)。voravud等(1993)通过使用针对7号和17号染色体的染色体特异性探针的原位杂交(ish)研究证明了,30%至40%邻近肿瘤的组织学正常上皮显示出这些染色体的多体性。此外,与来自没有癌迹象的患者的正常对照口腔上皮相比,在离癌最近的组织中多体性的频率进行性增加。离肿瘤区域较近增加的基因型异常的发现支持区域性癌变的概念。有趣的是,在邻近染色体测量处的feuigen染色切片中dna含量没有增加,如在正常出现的黏膜中测量的,这可能反映为了改变dna指数而已经获得了不足的dna。有趣的是,在靠近癌症的发育异常区域中和在癌性区域中都观察到dna含量非常类似的增加,这表明在邻近肺癌的发育异常上皮中已经建立克隆的复杂核型异常。另一些研究者也表明在离癌症区域最近的发育异常病变中显示p53突变的细胞的数目增加,所述癌症区域也不变地是p53突变的。最近已经在吸烟者的肿瘤和发育异常上皮中证明的其他染色体异常包括3p、17p、9p和5q的缺失(feder等,1998;yanagisawa等,1996;thiberville等,1995)。
67.e.肺癌中的染色体缺失
68.小细胞肺癌(sclc)和非小细胞肺癌通常显示在3号染色体的短臂上具有细胞遗传学上可见的缺失(hirano等,1994;valdivieso等,1994;cheon等,1993;pence等,1993)。与这种3p缺失出现在那些非吸烟患者中相比,其更经常出现在吸烟患者的肺肿瘤组织中(rice等,1993)。由于大约85%的肺癌患者为重型吸烟者(mrkve等,1993),故3p可能包含与
暴露于烟草致癌原相关的特定dna基因座。还已经报道了,3p缺失发生在肺癌发生的早期阶段,例如支气管发育异常(pantel等,1993)。除细胞遗传学可见缺失之外,杂合性丢失(loss of heterozygosity,loh)研究也将3
‑
21.3限定为单独或组合地经历丢失的独特区域之一(fontanini等,1992;liewald等,1992)。数个其他组已经在肺癌中发现3p21.3处的大纯合性缺失(macchiarini等,1992;miyamoto等,1991;ichinose等,1991;yamaoka等,1990)。将来自3
‑
21.3
‑
3p21.2的dna片段转移到肺肿瘤细胞系中可以抑制肿瘤发生(sahin等,1990;volm等,1989)。这些发现有力地表明在该特定染色体区域中存在至少一种其丢失将引发肺癌发生的肿瘤抑制基因。
69.肺癌的细胞遗传学观察已经表明染色体3p的缺失率异常地一致。事实上,小细胞肺癌(sclc)在染色体3p的某些区域内显示100%的缺失率。非小细胞肺癌(nsclc)显示70%的缺失率(mitsudomi等,1996;shiseki等,1996)。杂合性丢失和比较基因组杂交分析已经表明在3p14.2和3p21.3之间的缺失是在肺癌中最常见的发现,并且被假定为肺肿瘤发生的最关键变化(wu等,1998)。已经假定,带3p21.3是肺癌肿瘤抑制基因的位置。该假定得到3号染色体转移研究的支持,所述研究降低肺腺癌的致瘤性。
70.关于非小细胞肺癌的等位基因型研究表明在27%的病例中染色体10q上的遗传物质丢失。10号染色体等位基因丢失的研究已经表明在小细胞肺癌中存在非常高的loh发生率,高达91%(alberola等,1995;ayabe等,1994)。与在仅14%病例中观察到loh的非转移性scc相比,在转移性鳞状细胞癌(scc)中在56%病例中注观察到10q上等位基因的统计学显著性loh(ayabe等,1994)。在nsclc的其他亚型中没有观察到loh。另外,使用微卫星多态性分析,表明在d10s677和d10s1223之间存在高发生率的丢失。该区域跨越在带q21至q24处的10号染色体的长臂,并且与晚期高级膀胱癌研究中缺失的区域重叠,所述研究证明在10q22.3至10q23.1处的2.5cm区域内等位基因丢失的频率较高(kim等,1996)。
71.ii.通过核尺寸的分选和选择
72.在一个方面中,本公开内容提供了根据核尺寸或核质比来分离和/或分类ctc。这些方法可以涉及物理分选,例如通过facs或其他核分选手段,使用计算机驱动的尺寸分析的光学数据分析,或通过细胞核的人工询问,例如通过使用标准光学显微术。通常,例如用dapi(4’,6
‑
二脒基
‑2‑
苯基吲哚)将核染色以允许评估/分选。在某些实施方案中,从细胞中获得核并使其自行分选。可以使用标准的细胞裂解方案来裂解细胞。
73.a.bioview系统和软件
74.bioview duet
tm
(rehovot,israel)系统使用彩色或单色ccd相机,其通常对细胞制备物上存在的所有有核细胞成像并分类。分类的细胞的数目由操作者预先设定,但是通常扫描几千个细胞。存在“研究”模式或开放的软件系统,其然后对每个细胞记录以下:
75.1)基于dapi染色的以像素计的核面积,其表示为任意单位,因此,如果为5000,则意指细胞面积为5000像素;
76.2)核直径;以及
77.3)圆度因子(cf),通过改变伸长率(细胞的高度和宽度之间的比例)来计算,其中完美圆的值为1(淋巴细胞的cf接近1,异常细胞由于其核周长的不规则性而具有很多cf>>1)。
78.为了提高ctc的产率,本发明人进行以下测量,并随后调节软件以提高异常细胞的
产率并减少正常淋巴细胞的数目。
79.如在dapi染色(核染色)上测量的,异常细胞(恶性ctc)的核面积是基于核所占像素的数目(如通过fish多体性>2所限定的)并且表示为任意单位。
80.淋巴细胞的核面积为由血液中淋巴细胞(其通过fish为二倍体)所占像素的数目,其中圆度因子接近1。推导出测量结果的方式是通过观察来自大量恶性样品的淋巴细胞(“内部”对照淋巴细胞)的平均核像素面积以及记录对照样品中的淋巴细胞或“外部”对照淋巴细胞的平均核像素面积,所述对照样品或“外部”对照淋巴细胞来自已知是健康的并且没有前恶性肿瘤史或者在其血流中没有恶性细胞的患者。类似地,记录了来自患有已知肺癌之患者的大量“异常”细胞(循环肿瘤细胞)的核面积的观察结果,所述“异常细胞”限定为具有2个或更多个多体性(额外染色体)的细胞。本发明人表明ctc的核面积远远超过任意阈值,如下文讨论的。
81.在其中ctc的绝对数目具有诊断性的一些实施方案中,4个或更多个ctc的发现将指示患者患有癌症。本发明人注意到缓解数年的患者可以显示很少的ctc(最低残余疾病;如本文中限定的少于4个ctc),这可能代表休眠的ctc。ctc的半衰期被认为为约4至8小时,因此存在不间断补充源。现在这是一个具有重大生物相关性的现象,因为在数年的明显“缓解”之后,患者可复发并死亡,很可能涉及这些休眠的ctc。
82.b.阈值
83.在来自患有肺癌的患者的血液中,基于cf接近1的淋巴细胞的平均像素面积,选择阈值为78。该阈值显著低于对异常细胞(通过fish多体性>2所限定的)观察到的平均像素。
84.c.分类
85.创建了带有排除的重复任务,使得系统仅开始对ficoll纯化样本中大于78的细胞分类。因此,排除了小于78(包括淋巴细胞的平均核面积)的所有细胞,仅将满足推导标准(阈值>78)的细胞分类,并呈给操作者进行交互式评价。此外,bioview系统创建了显示二倍体细胞、非整倍体细胞(单增益或丢失)和异常细胞(如通过fish探针限定的至少2个或更多个基因(3cen、3p、10cen和10q)的多体性)的饼形图。
86.仪器任务被设置为扫描几千个细胞,使得可以从几千个图像中选择至少500个具有推导标准(阈值>78)的完整且不重叠的细胞,将其呈给操作者进行额外信号(增益)或信号丢失(缺失)的交互式评价。
87.当评价扫描的细胞时,操作者首先根据饼形图检查不同类别的细胞,从限定为至少2个具有额外拷贝的染色体的“异常”细胞开始,然后是单增益和丢失类别,并且最后是对剩余的细胞进行交互式分析,直到500个细胞被评分。
88.iii.基因探针
89.本公开内容包括使选择的细胞与经标记的核酸探针接触,并通过荧光原位杂交检测杂交的细胞。这些探针可以对ctc中最频繁扩增或缺失的任何遗传标记具有特异性。特别地,探针可以是3p22.1探针,其是与着丝粒3组合的靶向rpl14、cd39l3、pmgm或gc20的核酸探针;与着丝粒10组合的10q22
‑
23探针(包括表面活性蛋白a1和a2);或pi3激酶探针。其他遗传标记可以包括但不限于:着丝粒3、7、17;9p21;5p15.2;egfr;c
‑
myc8q22;和6p22
‑
22。关于基因探针的进一步讨论,参见美国公开号2007/0218480,其通过引用整体并入本文。
90.a.3p22.1探针
91.3p22.1探针是与着丝粒3组合的靶向rpl14、cd39l3、pmgm或gc20的核酸探针。人核糖体l14(rpl14)基因(genbank登录号nm_003973)和基因cd39l3(genbank登录号aac39884和af039917)、pmgm(genbank登录号p15259和j05073)和gc20(genbank登录号nm_005875)分离自bac(genbank登录号ac104186,其通过引用并入本文)并且位于不同肺肿瘤的最小缺失重叠区域中的3p22.1带中。rpl14基因序列包含具有高多态性的三核苷酸(ctg)重复阵列,其编码可变长度的多聚丙氨酸束。多聚丙氨酸束见于发育显著性的基因产物中,其与dna结合或调节转录。例如,果蝇(drosophila)蛋白engraled、kruppel和even
‑
skipped全部都包含用作转录阻遏物的多聚丙氨酸束。应理解,多聚丙氨酸束在无义介导的mrna衰减途径中起关键作用,其使细胞摆脱畸变蛋白质和转录物。rpl14的基因型分析显示与nsclc细胞系中的25%相比,在正常群体中该基因座是68%杂合的。由正常支气管上皮获得的细胞培养物显示65%的杂合性水平,反映正常群体的杂合性水平。另参见rp11
‑
391m1/ac104186。
92.具有调节功能的基因例如rpl14基因以及基因cd39l3、pmgm和gc20及其类似物是用于诊断肿瘤发生事件的良好候选物。已经假设rpl14蛋白的功能变化可以通过编码该蛋白质的三核苷酸重复的dna缺失机制而发生。这种缺失机制使rpl14基因成为可以用作肺癌风险研究的标志物的有吸引力序列(shriver等,1998)。此外,rpl14基因显示在种族特定群体中等位基因频率分布具有显著差异,使该序列成为用于研究种族调整性肺癌的有用标志物(shriver等,1998)。因此,该基因可用于肺癌的早期检测,并且可在化学预防研究中用作中间生物标志物。
93.b.10q22探针
94.在另一些实施方案中,探针可以是与着丝粒10组合的10q22
‑
23探针,其包括表面活性蛋白a1和a2。10q22bac(46b12)为200kb,邻近pten/mmac1(genbank登录号af067844)并且是到pten/mmac1的着丝粒,其在10q22
‑
23处并且可以通过research genetics(huntsville,al)购买(图3)。10q22
‑
25的改变已经与多种肿瘤(包括肺、前列腺、肾、和子宫内膜癌、黑素瘤以及脑膜瘤)关联,表明在该区域中存在影响数种癌症的可能抑制基因座。编码双特异性磷酸酶的pten/mmac1基因位于该区域中,并且已被分离为肿瘤抑制基因,其在数种类型的人肿瘤(包括脑、膀胱、乳腺和前列腺的癌症)中被改变。pten/mmac1突变已经在一些癌细胞系、异种移植物和激素顽固性癌症组织样品中被发现。由于本发明人的10q22bac dna序列与该区域邻近,故bac 10q22中的dna序列可能涉及人肺癌的发生和/或进展。另参见rp11
‑
506m13/ac068139.6。
95.肺相关的表面活性蛋白a1(sp
‑
a)位于10q22.3处。表面活性蛋白a
‑
磷脂
‑
蛋白质复合物降低肺的肺泡中的表面张力,并且在肺中的宿主防御中起主要作用。表面活性蛋白a1还存在于被认为是肺的推定干细胞的肺泡2型细胞中。已知2型细胞参与肺泡受损后的修复和再生。因此,2型细胞可能表达端粒酶和c
‑
myc,其导致表面活性蛋白的损失和非小细胞肺癌的发生(图4)。10q22探针可用于进一步开发用于早期检测赘生物形成事件、用于风险评估和监测化学预防治疗的效力的临床生物标志物。
96.c.商业探针组
97.任何商业探针或探针组也可用于本公开内容。例如,可以使用urovysion dna探针组(vysis/abbott molecular,des plaines,il),其包括针对着丝粒3、着丝粒7、着丝粒17、9p21.3的探针。已经确定urovysion探针检测肺癌的早期变化。在另一些实施方案中,可以
使用lavysion dna探针组(vysis/abbott molecular,des plaines,il),其包括针对以下的探针:7p12(表皮生长因子受体)、8q24.12
‑
q24.13(myc)、6p11.1
‑
q11(染色体计数(探针cep 6))和5p15.2(包括sema5a基因)。已经注意到lavysion探针组检测较高期或较晚期的肺癌。此外,本公开内容还可以使用针对着丝粒7/7p12(表皮生长因子受体)的单探针组。
98.iv.用于评估基因结构的方法
99.根据本公开内容,将利用多种探针来检查来自患者样品的基因组dna的结构。广泛多种方法可以用于检测不同染色体区域的结构的变化。以下是这样的方法的非限制性讨论。
100.a.荧光原位杂交和显色原位杂交
101.荧光原位杂交(fish)可以用于分子研究。fish用于使用荧光显微术来检测已经与染色体杂交的高度特异性dna探针。dna探针是经荧光或非荧光分子标记的,然后其通过荧光抗体被检测。探针与靶染色体上的一个或更多个特异性区域结合。然后,使用对比色将染色体染色,并使用荧光显微镜来观察细胞。
102.每种fish探针对染色体的一个区域是特异性的,并且在其整个长度上经荧光分子标记。每个显微镜载玻片包含许多中期物。每个中期物由完整的染色体组组成,每个探针寻找染色体的一小片段并自身与其结合。中期扩散(metaphase spread)可用于可视化特异性染色体和与探针结合的确切区域。第一步骤是分开(变性)探针dna和染色体dna二者中的dna双链,这样其可以彼此结合。这通过将dna在高温(70℃至75℃)下在甲酰胺溶液中加热来完成。接下来,将探针置于载玻片上,并将载玻片置于37℃培养箱中过夜,以使探针与靶染色体杂交。过夜,探针dna寻找其在特异性染色体上的靶序列并与其结合。然后,使链缓慢地再退火。在盐/洗涤剂溶液中洗涤载玻片以除去未与染色体结合的任何探针,并向载玻片中添加不同着色的荧光染料以将全部染色体染色,使得其随后可以使用荧光显微镜观察到。可以同时混合并使用经不同荧光标签标记的两种或更多种不同的探针。然后,用第三色将染色体染色以进行对比。这提供具有三种或更多种颜色的中期或间期细胞,这可以用于同时检测不同染色体,或者用于在其他靶序列之一缺失并且探针不能与染色体结合的情况下提供对照探针。该技术允许例如基因的定位以及遗传缺陷的直接形态学检测。
103.相比于微卫星不稳定性,使用fish探针来测试等位基因杂合性丢失的优点是:
104.(a)fish容易且迅速地在目的细胞上进行,并且可以用于石蜡包埋的或新鲜的或冷冻的组织上,从而允许使用显微解剖;
105.(b)可以联系着丝粒探针以细胞为基础在细胞上分析特定基因变化,使得可以评价dna序列的真纯合性相对于杂合性(针对微卫星不稳定性使用pcr
tm
可能由于纯合性缺失的区域中被正常细胞污染而允许扩增周围的正常dna序列,从而提供目的等位基因没有缺失的假阳性印象);
106.(c)pcr不能鉴定基因的扩增;以及
107.(d)使用细菌人工染色体(bac)的fish允许使用特异性引物对来容易地在特定染色体上检测和定位已经分离的目的基因。
108.显色原位杂交(cish)能够使用组织学实验室中已存在的方法来在组织形态学背景下获得遗传信息。cish允许在明视场显微镜下在福尔马林固定的石蜡包埋(ffpe)组织上使用常规酶促反应来检测基因扩增、染色体易位和染色体数目。美国公开号2009/0137412,
其通过引用并入本文。可以例如在具有荧光能力的自动扫描仪(bioview system,rehovot,israel)上进行扫描。
109.b.模板依赖性扩增方法
110.许多模板依赖性方法可用于扩增存在于给定模板样品中的标志物序列。最众所周知的扩增方法之一是聚合酶链反应(被称为pcr
tm
),其在美国专利4,683,195、4,683,202和4,800,159中以及在innis等,1990中详细地被描述,其各自通过引用整体并入本文。
111.简言之,在pcr
tm
中,制备与标志物序列的相对互补链上的区域互补的两种引物序列。将过量的脱氧核苷三磷酸与dna聚合酶(例如taq聚合酶)一起添加到反应混合物中。如果样品中存在标志物序列,则引物将与标志物结合并且聚合酶将通过添加核苷酸来促使引物沿着标志物序列延伸。通过升高和降低反应混合物的温度,延伸的引物将从标志物解离形成反应产物,过量的引物将与标志物和反应产物结合,并且重复该过程。
112.可以进行逆转录酶pcr
tm
扩增程序以量化扩增的mrna的量。将rna逆转录成cdna的方法是众所周知的并且在sambrook等(1989)中已描述。用于逆转录的替代方法利用热稳定的rna依赖性dna聚合酶。在于1990年12月21日提交的wo 90/07641中描述了这些方法。聚合酶链反应方法是本领域众所周知的。
113.另一种用于扩增的方法是连接酶链反应(ligase chain reaction,“lcr”),其在通过引用整体并入本文的epo号320308中公开。在lcr中,制备两个互补探针对,并且在靶序列存在下,每对将与靶标的相对互补链结合,使得其邻接。在连接酶存在下,两个探针对将连接形成单个单元。通过如在pcr
tm
中的温度循环,结合的连接单元从靶标上解离,并随后用作用于连接过量探针对的“靶序列”。美国专利4,883,750描述了与用于使探针对与靶序列结合的与lcr类似的方法。
114.pct申请号pct/us87/00880中描述的qβ复制酶也可以用作本公开内容中的另一种扩增方法。在该方法中,在rna聚合酶存在下,向样品中添加具有与靶标互补的区域的rna的复制序列。聚合酶将拷贝复制序列,其然后可以被检测。
115.等温扩增法也可以用于本公开内容中的核酸扩增,其中使用限制性内切核酸酶和连接酶来实现靶分子的扩增,所述靶分子在限制性位点的一条链中包含核苷酸5
′‑
[α
‑
硫代]三磷酸(walker等,1992)。
[0116]
链置换扩增(strand displacement amplification,sda)是进行核酸等温扩增的另一种方法,其涉及多轮的链置换和合成,即切口平移。称为修复链反应(repiar chain reaction,rcr)的类似方法涉及在整个靶向扩增的区域中使数种探针退火,然后进行其中仅存在四种碱基中的两种碱基的修复反应。另外两种碱基可以作为生物素化衍生物添加,以便于检测。类似的方法用于sda。还可以使用循环探针反应(cyclic probe reaction,cpr)来检测靶标特异性序列。在cpr中,将具有非特异性dna的3
′
和5
′
序列以及特异性rna的中间序列的探针与存在于样品中的dna杂交。在杂交之后,使用rna酶h处理反应,探针的产物被鉴定为消化后释放的独特产物。使初始模板与另一循环探针退火,并重复反应。
[0117]
根据本公开内容,可以使用在gb申请号2 202 328和pct申请号pct/us89/01025中描述的又一种扩增方法,所述申请各自通过引用整体并入本文。在前一申请中,“经修饰的”引物用于类似于pcr的模板和酶依赖性合成。引物可以通过用捕获部分(例如,生物素)和/或检测部分(例如,酶)标记而被修饰。在后一申请中,向样品中添加过量的经标记探针。在
靶序列存在下,探针结合并被催化切割。在切割之后,靶序列被完整地释放并被过量探针结合。经标记探针的切割预示靶序列的存在。
[0118]
其他核酸扩增方法包括基于转录的扩增系统(transcription
‑
based amplification system,tas),其包括基于核酸序列的扩增(nucleic acid sequence based amplification,nasba)和3sr(kwoh等,1989;gingeras等,pct申请wo 88/10315,其通过引用整体并入本文)。在nasba中,可以通过标准苯酚/氯仿提取、临床样品的热变性、用裂解缓冲液处理以及用于分离dna和rna的微型旋转柱(minispin column)或者rna的氯化胍提取来制备核酸以进行扩增。这些扩增技术涉及使具有靶标特异性序列的引物退火。在聚合之后,用rna酶h消化dna/rna杂交体,同时再次将双链dna分子热变性。在任一种情况下,单链dna通过添加第二靶标特异性引物,然后聚合来完全双链化。然后,双链dna分子通过rna聚合酶(例如t7或sp6)多重转录。在等温循环反应中,将rna逆转录成单链dna,然后将其转化为双链dna,然后再次用rna聚合酶(例如t7或sp6)转录。所得产物无论是截短还是完整的都指示靶标特异性序列。
[0119]
davey等,epo号329822(其通过引用整体并入本文)公开了一种涉及循环合成单链rna(“ssrna”)、ssdna和双链dna(dsdna)的核酸扩增方法,其可以根据本公开内容使用。ssrna为第一引物寡核苷酸的模板,其通过逆转录酶(rna依赖性dna聚合酶)延伸。然后,通过核糖核酸酶h(rna酶h,一种对与dna或rna的双链体中的rna具有特异性的rna酶)的作用从所得dna:rna双链体中除去rna。所得ssdna是第二引物的模板,所述第二引物还包括在其与模板的同源区5’的rna聚合酶启动子(以t7rna聚合酶为例)的序列。该引物然后通过dna聚合酶(以大肠杆菌(e.coli)dna聚合酶i的大“klenow”片断为例)延伸,产生双链dna(“dsdna”)分子,所述分子具有与在引物之间的原始rna的序列相同的序列,并且另外地在一端具有启动子序列。该启动子序列通过合适的rna聚合酶可以用于制备dna的许多rna拷贝。这些拷贝随后再进入循环导致非常迅速的扩增。在酶的适当选择下,该扩增可以等温完成而无需在每个循环中添加酶。由于该方法的循环性能,起始序列可以选择是dna或rna的形式。
[0120]
miller等,pct申请wo 89/06700(其通过引用整体并入本文)公开了一种核酸序列扩增方案,其基于使启动子/引物序列与靶单链dna(“ssdna”)杂交,随后转录该序列的许多rna拷贝。该方案不是循环性的,即新的模板不是由所得rna转录物产生。其他扩增方法包括“race”和“单侧pcr”(frohman,1990;ohara等,1989;其各自通过引用整体并入本文)。
[0121]
以下方法也可以用于本公开内容的扩增步骤中,所述方法基于在具有所得“二寡核苷酸”序列的核酸存在下连接两个(或更多个)寡核苷酸,从而扩增二寡核苷酸(wu等,1989,其通过引用整体并入本文)。
[0122]
c.southern/northern印迹
[0123]
印迹技术是本领域技术人员众所周知的。southern印迹涉及使用dna作为靶标,然而northern印迹涉及使用rna作为靶标。各自提供不同类型的信息,但是cdna印迹在许多方面类似于rna物质的印迹。
[0124]
简言之,使用探针来靶向已固定在合适基质(通常为硝化纤维素的滤纸)上的dna或rna物质。不同物质应当在空间上分离开以便于分析。这通常通过核酸物质的凝胶电泳并随后在滤纸上“印迹”来完成。
[0125]
随后,将印迹的靶标与探针(通常是经标记的)在促进变性和再杂交的条件下孵育。由于探针被设计成与靶标碱基配对,因此在复性条件下探针将与靶序列的一部分结合。然后,除去未结合的探针,并如上所述完成检测。
[0126]
d.分离方法
[0127]
通常希望在一个或另一个阶段使扩增产物与模板和过量引物分离以确定是否已经发生特异性扩增。在一个实施方案中,可以采用标准的方法通过琼脂糖、琼脂糖
‑
丙烯酰胺或聚丙烯酰胺凝胶电泳来分离扩增产物。参见sambrook等,1989。
[0128]
或者,可以采用色谱技术进行分离。在本公开内容中可以使用许多类型的色谱:吸附、分配、离子交换和分子筛,以及用于其使用的许多专门技术,包括柱、纸、薄层和气相色谱(freifelder,1982)。
[0129]
e.检测方法
[0130]
可以使产物可视化以便确定标志物序列的扩增。一种典型的可视化方法涉及用溴化乙锭染色凝胶并在uv光下可视化。或者,如果用经放射性或荧光剂量术标记的核苷酸整合标志物扩增产物,则然后在分离之后可以使扩增产物暴露于x
‑
射线胶片或在合适的刺激光谱下可视化。
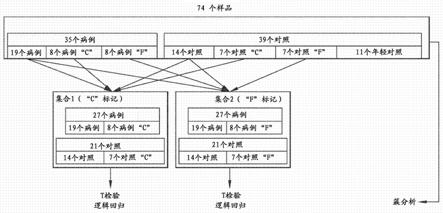
[0131]
在一个实施方案中,间接实现可视化。在扩增产物分离之后,使经标记的核酸探针与扩增的标志物序列接触。该探针优选地与一种生色团缀合,但是可以被放射性标记。在另一个实施方案中,使探针与结合配偶体例如抗体或生物素缀合,并且结合对的另一成员携带可检测的部分。
[0132]
在一个实施方案中,通过经标记的探针进行检测。涉及的技术是本领域技术人员众所周知的,并且可以在许多关于分子方案的标准书中找到。参见sambrook等(1989)。例如,生色团或者放射标记的探针或引物在扩增期间或之后鉴定靶标。
[0133]
上述方案的一个实例在通过引用并入本文的美国专利5,279,721中已描述,其公开了用于核酸的自动化电泳和转移的装置和方法。该装置允许无需凝胶的外部操作即可进行电泳和印迹,并且理想地适于进行根据本公开内容的方法。
[0134]
此外,可以使用标准序列分析技术来对上述扩增产物进行序列分析以鉴定特定种类的变化。在某些方法中,使用设计用于最佳测序的引物组通过序列分析进行详尽的基因分析(pignon等,1994)。本公开内容提供了通过其可以使用任何或所有这些类型分析的方法。
[0135]
f.试剂盒组分
[0136]
上述用于检测染色体区域的变化所需的所有必需材料和试剂都可以一起组装在试剂盒中。这通常包括预先选择的引物和探针。还可以包括适用于扩增核酸的酶,包括各种聚合酶(rt、taq、sequenase
tm
等);提供扩增所必需的反应混合物的脱氧核苷酸和缓冲液;以及任选地标记剂,例如fish中使用的那些。这样的试剂盒通常以适当的方式包括用于每种单独试剂和酶以及用于每种引物或探针的不同容器。
[0137]
g.芯片技术
[0138]
本发明人特别考虑的是基于芯片的dna技术,例如hacia等(1996)和shoemaker等(1996)描述的那些。这些技术涉及用于快速且精确地分析大量基因的定量方法。通过用寡核苷酸标记基因或使用固定的探针阵列,可以采用例如高密度阵列的芯片技术分离靶分子
并使用例如荧光、电导、质谱、放射性标记、光学扫描或电泳的方法筛选这些分子。另参见pease等(1994);fodor等(1991)。
[0139]
可以将生物活性dna探针直接或间接地固定在表面上,以确保最佳接触和最大检测。当固定在基底上时,使基因探针稳定并由此可以重复使用。一般来说,在固定的核酸靶标上进行杂交,或者将探针分子连接到固体表面(例如硝化纤维素、尼龙膜或玻璃)。可以使用许多其他的基质材料,包括增强硝酸纤维素膜、活化石英、活化玻璃、聚偏二氟乙烯(pvdf)膜、聚苯乙烯基底、基于聚丙烯酰胺的基底、其他聚合物(例如聚(氯乙烯)、聚(甲基丙烯酸甲酯)、聚(二甲基硅氧烷))、光聚合物(其包含光反应性物质,例如能够与靶分子形成共价连接的氮宾、卡宾和羰游基基团)(saiki等,1994)。
[0140]
基因探针的固定可以通过多种方法来实现,所述方法涉及在包含可锚定部分的固定的dna和锚定物之间的非共价或共价相互作用。dna通常通过首先使玻璃表面硅烷化,然后用碳二亚胺或戊二醛活化来与玻璃结合。替代方法可以使用试剂(例如3
‑
环氧丙氧基丙基三甲氧基硅烷(gop)或氨基丙基三甲氧基硅烷(apts)),其中dna通过在dna合成期间在分子的3
′
或5
′
端并入的氨基接头而连接。可以使用紫外辐射使基因探针直接与膜结合。对于硝化纤维素膜,将探针点到膜上。使用uv光源来照射斑点并诱导交联。用于交联的替代方法包括将有斑点的膜在真空中在80℃下烘烤2小时。
[0141]
固定可以由用链霉抗生物素蛋白或抗生物素蛋白非共价涂覆固相和随后固定生物素化的多核苷酸组成(holmstrom,1993)。还可以使用以下来将探针固定到表面上:用聚
‑
l
‑
lys或聚l
‑
lys、phe预先涂覆聚苯乙烯或玻璃固相,然后使用双功能交联试剂共价连接氨基或巯基修饰的多核苷酸(running,1990;newton,1993)。
[0142]
固定也可以通过将短的5
′‑
磷酸化引物直接共价连接到化学修饰的聚苯乙烯板(“covalink”板,nunc)上来发生rasmussen(1991)。经修饰的寡核苷酸与固相表面之间的共价键通过与水溶性碳二亚胺缩合来引入。该方法有利于主要地寡核苷酸通过其5
′‑
磷酸的5
′‑
连接。
[0143]
nikiforov等(美国专利5,610,287)描述了一种将核酸分子在盐或阳离子洗涤剂存在下非共价固定在包含
‑‑
oh、
‑‑
c=o或
‑‑
cooh亲水性基团的亲水性聚苯乙烯固体支持物上或在玻璃固体支持物上。使支持物与包含合成核酸和阳离子洗涤剂或盐的ph为约6至约8的溶液接触。可以使用包含非离子洗涤剂的水溶液洗涤包含固定的核酸的支持物而不去除连接的分子。
[0144]
基于芯片的dna技术存在两种常见的变型,其涉及具有已知序列同一性的dna微阵列。对于一种变型,使用机器人点样将探针cdna(500至5000个碱基长)固定在例如玻璃的固体表面上,并暴露于单独地或在混合物中的一组靶标。该方法(“传统上”被称为dna微阵列)广泛地被认为是在斯坦福大学开发的。ekins和chu(1999)的最近一篇文章提供了一些相关细节。另一种变型包括:原位(在芯片上)合成寡核苷酸(20至25聚体寡聚物)或肽核酸(pna)探针的阵列,或者通过常规合成来合成,然后固定在芯片上。使阵列暴露于经标记的样品dna,杂交并确定互补序列的同一性/丰度。该方法(“历史上”被称为dna芯片)是affymetrix,inc.开发的,该公司以商标销售其产品。
[0145]
v.核酸
[0146]
本发明人提供了一种方法,其包括使选择的细胞与经标记的核酸探针接触形成杂
交细胞的步骤,其中经标记的核酸的杂交指示ctc。然而,本公开内容不限于本文中公开的特定核酸片段的使用。而是,可以采用靶向相同区域/多态性的多种替代探针。
[0147]
a.探针和引物
[0148]
自然地,本公开内容包括与靶序列互补或基本上互补的dna片段。“互补”的核酸序列是能够根据标准watson
‑
crick互补规则进行碱基配对的那些。如本文中使用的,术语“互补序列”意指基本上互补的核酸序列,如可以通过以上所述的相同核苷酸比较来评估,或如限定为能够在相对严格的条件下(例如本文中所述的那些)与靶核酸片段杂交。这些探针可以横跨几百或几千个碱基对。
[0149]
或者,杂交片段可以是较短的寡核苷酸。17个碱基长的序列应该在人基因组中仅出现一次,并且由此足以指定独特的靶序列。虽然较短的寡聚物更易于制备并且增加体内可及性,但是在确定杂交的特异性中涉及许多其他因素。寡核苷酸对其互补靶标的结合亲和力和序列特异性二者随着长度的增加而增加。可以考虑,使用约8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、250、500、700、722、900、992、1000、1500、2000、2500、2800、3000、3500、3800、4000、5000或更多个碱基对的示例性寡核苷酸,但是其他寡核苷酸也在考虑之内。如上文提到的,考虑编码10,000、50,000、100,000、150,000、200,000、250,000、300,000和500,000个碱基的更长多核苷酸。这样的寡核苷酸和多核苷酸可用作例如fish、southern和northern印迹中的探针,以及在扩增反应中用作引物。
[0150]
应理解,本公开内容不限于本文中公开的特定探针,并且特别地旨在至少包括可与所公开序列杂交的核酸序列或为这些序列的功能性序列类似物的核酸序列。例如,可以使用部分序列来鉴定结构相关基因或者其来源于的全长基因组或cdna克隆。本领域技术人员清楚地知晓用于产生可以用作上述探针的靶标的cdna和基因组文库的方法(sambrook等,1989)。
[0151]
对于其中将本公开内容的核酸片段并入载体(例如质粒、黏粒或病毒)中的应用,这些片段可以与其他dna序列组合使得其总长度可以显著变化,所述其他dna序列例如启动子、多聚腺苷酸化信号、限制性酶位点、多克隆位点、其他编码片段等。可以考虑,可以使用几乎任意长度的核酸片段,其中总长度优选地受制备的难易度和在期望重组dna方案中使用的限制。
[0152]
可以将编码特定基因的dna片段引入到重组宿主细胞中,并用于表达特定的结构或调节蛋白。或者,通过应用遗传工程技术,可以采用所选择基因的子部分或衍生物。可以分离包含调控区域(例如启动子区域)的上游区域,并随后用于表达所选择的基因。
[0153]
b.探针的标记
[0154]
在某些实施方案中,有利地采用与用于确定杂交的合适工具(例如标志物)组合的本公开内容的核酸序列。广泛的多种合适的指示工具是本领域中已知的,包括能够被检测的荧光标签、放射性标签、化学发光标签、电致发光标签、酶标签或其他配体,例如抗生物素蛋白/生物素、抗体、亲和标记等。在一些优选实施方案中,可以期望使用荧光标记,例如地高辛配基、光谱橙、荧光素(fluorosein)、曙红、吖啶染料、罗丹明、alexa350、alexa 430、amca、bodipy 630/650、bodipy 650/665、bodipy
‑
fl、bodipy
‑
r6g、bodipy
‑
tmr、bodipy
‑
trx、瀑布蓝(cascade blue)、cy2、cy3、cy5、6
‑
fam、hex、6
‑
joe、oregon绿488、oregon绿500、
oregon绿514、太平洋蓝(pacific blue)、reg、rox、tamra、tet、或德克萨斯红。
[0155]
在酶标签(例如脲酶碱性磷酸酶或过氧化物酶)的情况下,可以用于提供人眼或通过分光光度法可见以鉴定与包含互补核酸的样品的特异性杂交的检测方式的比色指示物质是已知的。亲和标记的实例包括但不限于以下:抗体、抗体片段、受体蛋白、激素、生物素、dnp或与亲和标记结合并且可以用于分离扩增的基因的任何多肽/蛋白质分子。
[0156]
指示工具可以直接连接至探针,或者其可以通过抗原结合来连接。在一些优选实施方案中,在变性之前将地高辛配基连接至探针,并在杂交之后添加荧光团标记的抗地高辛配基fab片段。
[0157]
c.杂交条件
[0158]
合适的杂交条件是本领域技术人员众所周知的。条件可以通过增加盐浓度和降低温度变得较不严格。例如,中等严格条件可以通过在约37℃至约55℃的温度下约0.1至0.25m nacl提供,而低严格条件可以通过在约20℃至约55℃的温度下约0.15m至约0.9m的盐提供。因此,杂交条件可以容易地操纵,并且因此一般是基于期望结果选择的方法。
[0159]
在另一些实施方案中,杂交可以在例如以下条件下实现:在约20℃至约37℃的温度下50mm tris
‑
hcl(ph 8.3)、75mm kcl、3mm mgcl2、10mm二硫苏糖醇。使用的其他杂交条件可以包括在约40℃至约72℃的温度下约10mm tris
‑
hcl(ph 8.3)、50mm kcl、1.5μm mgcl2。还可以使用甲酰胺和sds来改变杂交条件。
[0160]
vi.生物标志物及其他风险因子
[0161]
多种具有预后显著性的生物标志物可以与以上讨论的特异性核酸探针联合使用。这些生物标志物可以帮助预测低期癌症的存活和从赘生物形成前病变到侵入性肺癌的进展。这些标志可以包括如通过ki
‑
67(mib1)所测量的增殖活性、如使用cd34通过vegf和微血管表达量化的血管生成、如通过erb b2所测量的癌基因表达、和如通过p53表达所测量的肿瘤抑制基因丢失。
[0162]
多种生物标志物候选物已经参与赘生性肺病变的演变。已经研究的生物标志物包括一般性基因组标志,包括染色体改变;特异性基因组标志,例如原癌基因(例如k
‑
ras、erbβ1/egfr、细胞周期调节蛋白d)的改变;增殖标志物,例如ki67或pcna;鳞状分化标志;以及核类视黄醇受体(papadimitrakopoulou等,1996)。后者特别感兴趣,因为其可以通过特定化学预防药物(例如13
‑
顺式
‑
视黄酸或4hpr)调节,并且在正常分化黏膜的恢复下以缺陷型细胞的凋亡而告终(zou等,1998)。
[0163]
a.通过微血管计数的肿瘤血管生成
[0164]
肿瘤血管生成可以通过微血管密度来量化,并且是1期nsclc的可行预后因子。肿瘤微血管密度显示是1期nsclc的存活的良好预测因子。
[0165]
b.血管内皮生长因子(vegf)
[0166]
vegf(3,6
‑
8ch 4),一种内皮细胞特异性促分裂原,是肿瘤血管生成的重要调节因子,其表达与淋巴结转移很好地相关,并且是肿瘤血管生成的良好间接指示。在nsclc中,vegf进而通过p53蛋白积累而上调。
[0167]
c.p53
[0168]
p53突变在预测患有nsclc的患者的进展和存活中的作用受到广泛争议。尽管很少研究暗示微不足道的作用,但是大多数研究提供了关于p53作为nsclc中预后因子之一的作
用的强有力证据。p53在nsclc生物学中的重要作用已经成为晚期nsclc患者中腺病毒介导的p53基因转移的基础(carcy等,1980)。此外,还已经表明p53是nsclc的化学治疗应答的独立预测因子。在最近的研究(vallmer等,1985)中,研究了p53积累在肺癌患者和未发展成癌症的那些的侵入前支气管病变中的重要性。证明了与p53阴性病变相比,赘生物形成前病变中的p53积累发展成侵入的速率更高。
[0169]
d.c
‑
erb
‑
b2
[0170]
与p53类似,还已经表明c
‑
erg
‑
b2(her2/neu)表达是转移倾向的良好标志并且是这些肿瘤的存活的指示。
[0171]
e.ki
‑
67增殖标志物
[0172]
除了上述标志之外,如通过标记肿瘤细胞的ki
‑
67的程度所测量的肿瘤增殖指数与1期nsclc的临床结果显著相关,ki
‑
67是一种在整个细胞周期中表达的核抗原(feinstein等,1970)。肿瘤增殖指数越高,无疾病存活越差。标记指数提供了显著互补性,即使不是1期nsclc的独立预后信息,并且有助于鉴定可能需要更积极治疗的1期nsclc患者的子群。
[0173]
已知3p21.3和10q22基因座的改变与许多癌症有关。更具体地,与3p21.3和10q22基因座相关的点突变、缺失、插入或调节扰动可能引发癌症或促进癌症发生、引起或促进在原发部位处的肿瘤发展、和/或引起或促进转移。在3p21.3和10q22基因座处的其他现象包括血管生成和组织侵入。因此,本发明人已经证明,在3p21.3和10q22处的缺失不仅可以用作癌症的诊断或预后指示,而且还用于预测癌症发生、发展和治疗中的特定事件。
[0174]
在此方面考虑多种不同的测定,包括但不限于荧光原位杂交(fish)、直接dna测序、pfge分析、southern或northern印迹、单链构象分析(ssca)、rna酶保护测定、等位基因特异性寡核苷酸(aso)、斑点印迹分析、变性梯度凝胶电泳、rflp和pcr
‑
sscp。
[0175]
多种类型的缺陷是待鉴定的。因此,“改变”应被理解为包括缺失、插入、点突变和重复。点突变导致终止密码子、移码突变或氨基酸替换。体细胞突变是发生于非胚系组织中的那些。胚系组织可以存在于任何组织中并遗传获得。
[0176]
f.表面活性蛋白a和b
[0177]
存在四种主要的表面活性蛋白:sp
‑
a、b、c和d。sp
‑
a和d是亲水性的,而sp
‑
b和c是疏水性的。蛋白质对实验条件(温度、ph、浓度、例如钙的物质,等等)非常敏感。此外,其作用倾向于重叠,并且因此难以指出各蛋白质的特异性作用。
[0178]
1.sp
‑
a
[0179]
sp
‑
a是待鉴定的第一表面活性蛋白,并且也是最丰富的(ingenito等,1999)。其分子量为从26至38kda而不等(p
é
rez
‑
gil等,1998)。该蛋白具有六个三聚体的“花束”结构(haagsman和diemel,2001),并且根据存在于系统中的其他物质可以被发现呈开放或闭合的形式。钙离子导致闭合的花束形式(palaniyar等,1998)。
[0180]
sp
‑
a在免疫防御中起作用。其还参与表面活性剂转运/吸附(与其他蛋白质一起)。sp
‑
a是产生管状髓磷脂所必需的,管状髓磷脂是肺特有的一种脂质转运结构。管状髓磷脂由内衬有蛋白质的脂质的方形管状物组成(palaniyar等,2001)。遗传工程化成缺乏sp
‑
a的小鼠具有正常的肺结构和表面活性剂功能,并且sp
‑
a的有益表面活性剂特性可能仅仅在应激情况下是明显(korfhagen等,1996)。
[0181]
2.sp
‑
b
[0182]
乳头状甲状腺癌(ptc)在临床上是异质性的。除与电离辐射相关之外,ptc的病因学和分子生物学知之甚少。使用基于寡聚物的dna阵列来研究8个匹配对的正常甲状腺和ptc组织的表达谱,免疫组织化学分析在39/52ptc中检测到sftpb,但是在滤泡性甲状腺癌和正常甲状腺组织中未检测到huang等,2001)。
[0183]
g.患者面谈及其他风险因子
[0184]
除分析多态性的存在或不存在之外,如以上讨论的,还可以期望评价患者的另外因子。例如,患者面谈与诊断/预后高度相关,患者面谈可包括吸烟史(吸烟年数、包/天等)。此外,可以使用痰细胞中形态变化的存在或不存在(鳞状化生、发育异常等),以及遗传不稳定性评分(遗传不稳定性=由来自痰中的上皮细胞和嗜中性粒细胞和/或外周血细胞或者从血液或骨髓分离的骨髓细胞或干细胞的多种组合的异常之和构成)。
[0185]
vii.获得和纯化样品
[0186]
根据本公开内容,将获得包含血细胞的生物样品。在一些实施方案中,评价样品的ctc水平的实体不直接从患者获得样品。因此,本公开内容的方法包括间接或直接从患者获得样品。为了达到这些方法,医生、医疗人员或其工作人员可以获得用于评价的生物样品。样品可以由医疗人员或其工作人员分析,或者可以将其送到外面或独立实验室。医疗人员可以认识到测试是否提供了关于ctc的定量水平的信息。
[0187]
在任何这些情况下,医疗人员可以了解相关信息,这些相关信息将使其基于ctc水平来确定患者是否可以诊断为患有侵袭性形式的癌症和/或癌症预后差。例如,可以考虑,实验室进行测试以确定ctc的水平。实验室人员可以向医疗人员报告进行的测试的具体结果。
[0188]
通常,样品是使用标准技术(例如jones(1963)公开的,其通过引用并入本文)从取自个体的生物样品(血液样品或组织样品)中分离的。样品的收集可以通过任何合适的方法进行,但是在某些方面中,通过针、导管、注射器、刮削等来收集。
[0189]
样品可以用本领域技术人员已知的任何方式来制备。例如,可以在进行ficoll
‑
hypaque梯度分离从而允许富集单个核细胞(淋巴细胞和上皮细胞)之后,从血沉棕黄层中分离来自外周血的循环上皮细胞。还可以使用本领域技术人员已知的其他方法来制备样品。
[0190]
可以根据标准方法从生物样品中包含的细胞中分离核酸(sambrook等,1989)。核酸可以是基因组dna或者经分级的rna或全细胞rna。在使用rna的情况下,可以期望将rna转化成互补dna。根据形式,直接使用扩增或用第二已知核酸然后扩增来在样品中鉴定特定的目的核酸。
[0191]
在检测之后,可以将在给定样品中观察到的结果与具有统计学显著性的参考组样品进行比较,所述参考组样品来自正常患者和具有或缺乏不同染色体基因座和对照区域的改变的患者。通过这种方式,然后使检测到的改变的量或种类与多种临床状态和治疗选择相关联。
[0192]
viii.癌症治疗
[0193]
在一些实施方案中,本公开内容提供了用于诊断和治疗乳腺癌的组合物和方法。在一个实施方案中,本公开内容提供了一种基于与对照相比ctc水平是否高来确定癌症的
治疗的方法。治疗可以是常规的癌症治疗。本领域技术人员知晓可以与本公开内容的方法组合的许多治疗,其中一些而不是全部在下文进行描述。
[0194]
a.用于向患者施用的制剂和途径
[0195]
在考虑临床应用的情况下,有必要制备适合于期望应用的形式的药物组合物。通常,这将必需制备基本上不含热原以及可能对人或动物有害的其他杂质的组合物。
[0196]
一般期望使用合适的盐和缓冲剂来使递送载体稳定并允许被靶细胞摄取。当向患者中引入重组细胞时也会使用缓冲剂。本公开内容的水性组合物包含有效量的细胞载体与细胞,其溶解或分散在可药用载体或水性介质中。这样的组合物也称为接种剂(inocula)。短语“可药用的或药理学上可接受的”是指当施用于动物或人时不产生不利反应、变应性反应或其他不良反应的分子实体和组合物。如本文中使用的,“可药用载体”包括任何和所有的溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等张剂和吸收延迟剂,等等。这样的介质和试剂用于药物活性物质的用途是本领域众所周知的。除非任何常规介质或试剂与本公开内容的载体或细胞不相容,否则其在治疗组合物中的使用均在考虑之中。补充活性成分也可以并入到组合物中。
[0197]
本公开内容的活性组合物可以包括典型的药物制剂。根据本公开内容的这些组合物的施用可通过任何常用途径,只要靶组织通过该途径是可获得的即可。这包括经口、经鼻、经颊、经直肠、经阴道或局部。或者,施用可以通过皮内、皮下、肌内、腹膜内或静脉内注射来进行。这样的组合物通常会作为可药用组合物施用。特别感兴趣的是直接肿瘤内施用、肿瘤灌注、或者向肿瘤局部或区域性施用,例如在局部或区域脉管系统或淋巴系统中、或者在切除的肿瘤床中施用(例如术后导管)。对于几乎任何肿瘤,也考虑全身递送。这证明对攻击微观或转移性癌症尤其重要。
[0198]
活性化合物也可以作为游离碱或药理学上可接受的盐施用,其可以在与表面活性剂(例如羟丙基纤维素)适当混合的水中制备。还可以在甘油、液体聚乙二醇、及其混合物中或者在油中制备分散体。在普通储存和使用条件下,这些制剂包含防腐剂以防止微生物生长。
[0199]
适用于可注射使用的药物形式包括无菌水溶液或分散体和用于临时制备无菌可注射溶液或分散体的无菌粉末。在所有情况下,形式必须是无菌的并且必须是达到存在易注射性的程度的流体。其在制备和储存条件下必须是稳定的,并且必须被保护以免于微生物(例如细菌和真菌)的污染行为。载体可以为包含以下的溶剂或分散介质:例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇,等等)、其合适混合物、以及植物油。可以维持适当的流动性,例如通过使用包衣(例如卵磷脂)、在分散体的情况下通过维持所需的颗粒尺寸和通过使用表面活性剂来维持。微生物作用的防止可以通过多种抗细菌剂和抗真菌剂(例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸、硫柳汞等)来产生。在许多情况下,可优选地,包括等张剂,例如糖或氯化钠。可注射组合物的延长吸收可以通过在组合物中使用延迟吸收剂(例如单硬脂酸铝和明胶)来产生。
[0200]
无菌可注射溶液通过根据需要将所需量的活性化合物与以上列举的多种其他成分一起并入到合适的溶剂中,然后过滤灭菌来制备。通常,分散体通过将多种经灭菌的活性成分并入无菌载剂中来制备,所述无菌载剂包含基本分散介质和来自上述列举的那些的所需其他成分。在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法为真空干
燥和冷冻干燥技术,其由经预先无菌过滤的溶液产生活性成分以及任何另外期望成分的粉末。
[0201]
如本文中使用的,“可药用载体”包括任何和所有的溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等张剂和吸收延迟剂,等等。这样的介质和试剂用于药物活性物质的用途是本领域众所周知的。除非任何常规介质或试剂与活性成分不相容,否则其在治疗组合物中的使用均在考虑之中。补充活性成分也可以并入到组合物中。
[0202]
本公开内容的组合物可以以中性或盐形式配制。可药用盐包括酸加成盐(与蛋白质的游离氨基形成的)以及与例如如盐酸或磷酸的无机酸或者例如乙酸、草酸、酒石酸、扁桃酸等的有机酸形成的。与游离羧基形成的盐也可以衍生自例如如钠、钾、铵、钙或铁的氢氧化物的无机碱,以及例如异丙胺、三甲胺、组氨酸、普鲁卡因等的有机碱。
[0203]
在配制之后,将溶液以与剂量制剂相容的方式并以例如治疗有效的量施用。向患者或对象施用的本公开内容组合物的实际剂量可以由物理和生理因素来确定,所述因素例如体重、病症的严重程度、所治疗疾病的类型、先前或同时治疗干预、患者的特发病和施用途径。在任何事件下,负责施用的医疗人员将确定组合物中活性成分的浓度和个体对象的合适剂量。
[0204]“治疗”是指为了获得疾病或健康相关病症的治疗益处而向对象施用或施加治疗剂或者对对象施行某种操作或方式。
[0205]
在本技术通篇使用的术语“治疗益处”或“治疗有效的”是指关于该病症的药物治疗促进或增强对象的健康的任何情况。这包括但不限于疾病的体征或症状的频率或严重程度的降低。
[0206]“疾病”可以是由任何原因(例如感染、遗传缺陷和/或环境应激)引起的身体部分(器官)或系统的任何病理性病症。
[0207]“预防”根据其普通和平常的含义使用,意指“在
…
之前行动”或这样的行为。在特定疾病的情况下,这些术语是指为了阻断疾病或健康相关病症发生而向对象施用或施加药剂、药物或治疗,或者对对象施行某种操作或方式。
[0208]
对象可以是在相关预防剂被施用时已知或怀疑未患特定疾病或健康相关病症的对象。例如,对象可以是未患已知疾病或健康相关病症的对象(即健康对象)。
[0209]
在本公开内容的另一些实施方案中,方法包括鉴定需要治疗的患者。例如,可以基于获得患者历史或基于临床检查的发现来鉴定患者。
[0210]
b.治疗
[0211]
在一些实施方案中,所述方法还包括用常规癌症治疗来治疗患有乳腺癌的患者。目前癌症研究的一个目标是找到提高化学治疗和放射治疗的效力的方式,例如通过将传统治疗与其他抗癌治疗组合。在本公开内容的情况下,考虑该治疗可以是但不限于化学治疗、放射、细胞凋亡的多肽诱导剂、新的靶向治疗(例如酪氨酸激酶抑制剂或抗vegf抗体)、或其他治疗干预。还可以想到,期望多于一次地施用治疗。
[0212]
1.化学治疗
[0213]
根据本公开内容可以使用广泛多种化学治疗剂。术语“化学治疗”是指使用药物来治疗癌症。“化学治疗剂”用于意指在癌症治疗中施用的化合物或组合物。这些药剂或药物通过其在细胞内的活性模式,例如,其是否影响细胞周期或在什么阶段影响细胞周期进行
分类。或者,可以基于药剂直接交联dna、插入dna或通过影响核酸合成来诱导染色体和有丝分裂畸变的能力来对其进行表征。大多数化学治疗剂落入以下类别:烷化剂、抗代谢物、抗肿瘤抗生素、有丝分裂抑制剂和亚硝基脲。
[0214]
化学治疗剂的实例包括烷化剂,例如噻替派和环磷酰胺;烷基磺酸酯,例如白消安、英丙舒凡和哌泊舒凡;氮丙啶类,例如苯并多巴(benzodopa)、卡波醌、麦曲多巴(meturedopa)和尤利多巴(uredopa);亚乙基亚胺和甲基蜜胺(methylamelamine),包括六甲蜜胺、三亚乙基蜜胺、三亚乙基磷酰胺、三亚乙基硫代磷酰胺和三羟甲基蜜胺;己酸配质(acetogenin)(尤其是布拉它辛(bullatacin)和布拉它辛酮(bullatacinone));喜树碱(包括合成类似物拓扑替康);苔藓抑素;callystatin;cc
‑
1065(包括其阿多来新、卡折来新和比折来新合成类似物);隐藻素(cryptophycin)(特别是隐藻素1和隐藻素8);多拉司它汀;倍癌霉素(duocarmycin)(包括合成类似物kw
‑
2189和cb1
‑
tm1);艾榴塞洛素(eleutherobin);水鬼蕉碱(pancratistatin);沙考地汀(sarcodictyin);海绵抑素(spongistatin);氮芥,例如苯丁酸氮芥、萘氮芥、氯膦酰胺、雌莫司汀、异环磷酰胺、双氯乙基甲胺(mechlorethamine)、盐酸氧氮芥、美法仑、新恩比兴、苯芥胆甾醇、泼尼莫司汀、曲磷胺、尿嘧啶氮芥;亚硝基脲(nitrosurea),例如卡莫司汀、氯脲菌素、福莫司汀、洛莫司汀、尼莫司汀和雷莫司汀(ranimnustine);抗生素,例如烯二炔类抗生素(enediyne antibiotic)(例如,加利车霉素(calicheamicin),尤其是加利车霉素γ1i和加利车霉素ωi1;达内霉素(dynemicin),包括达内霉素a;二膦酸盐,例如氯屈膦酸盐(clodronate);埃斯波霉素(esperamicin);以及新制癌菌素生色团及相关的色蛋白烯二炔类抗生素生色团、阿克拉霉素(aclacinomysin)、放线菌素、氨茴霉素(authrarnycin)、重氮丝氨酸、博来霉素、放线菌素c、卡柔比星(carabicin)、洋红霉素、嗜癌素、色霉素(chromomycinis)、放线菌素d、柔红霉素、地托比星、6
‑
重氮
‑5‑
氧代
‑
l
‑
正亮氨酸、多柔比星(包括吗啉代
‑
多柔比星、氰基吗啉代
‑
多柔比星、2
‑
吡咯啉基
‑
多柔比星和脱氧多柔比星)、表柔比星、伊索比星、伊达比星、麻西罗霉素(marcellomycin)、丝裂霉素(例如丝裂霉素c)、霉酚酸、诺加霉素(nogalarnycin)、橄榄霉素、培洛霉素、泊非霉素(potfimromycin)、嘌呤霉素、三铁阿霉素、罗多比星、链黑菌素、链佐星、杀结核菌素、乌苯美司、净司他丁、佐柔比星;抗代谢物,例如甲氨蝶呤和5
‑
氟尿嘧啶(5
‑
fu);叶酸类似物,例如二甲叶酸、甲氨蝶呤、蝶罗呤、三甲曲沙(trimetrexate);嘌呤类似物,例如氟达拉滨、6
‑
巯基嘌呤、硫咪嘌呤(thiamiprine)、硫鸟嘌呤;嘧啶类似物,例如安西他滨、阿扎胞苷、6
‑
氮尿苷、卡莫氟、阿糖胞苷、二脱氧尿苷、脱氧氟尿苷、依诺他滨、氟尿苷;雄激素,例如卡鲁睾酮、丙酸屈他雄酮、环硫雄醇、美雄烷、睾内酯;抗肾上腺,例如氨鲁米特、米托坦、曲洛司坦;叶酸补充剂,例如亚叶酸(frolinic acid);醋葡醛内酯;醛磷酰胺糖苷;氨基乙酰丙酸;恩尿嘧啶;安吖啶;bestrabucil;比生群(bisantrene);依达曲沙(edatraxate);地磷酰胺(defofamine);地美可辛;地吖醌(diaziquone);依氟鸟氨酸(elformithine);醋酸羟吡咔唑(elliptinium acetate);埃博霉素(epothilone);依托格鲁(etoglucid);硝酸镓;羟基脲;香菇多糖(1entinan);氯尼达明(lonidainine);美登素类(maytansinoid),例如美登素和安丝菌素;米托胍腙;米托蒽醌;莫哌达醇(mopidanmol);尼曲吖啶(nitraerine);喷司他丁;蛋氨氮芥(phenamet);吡柔比星;洛索蒽醌;鬼臼酸(podophyllinic acid);2
‑
乙基酰肼;丙卡巴肼;psk多糖复合物);雷佐生(razoxane);根毒素;西索菲兰(sizofiran);螺旋锗;细交链孢菌酮酸;三亚胺醌
(triaziquone);2,2
′
,2
″‑
三氯三乙胺;单端孢霉烯类(尤其是t
‑
2毒素、疣孢菌素a(verracurin a)、杆孢菌素a和蛇形菌素(anguidine));乌拉坦(urethan);长春地辛;达卡巴嗪;甘露氮芥;二溴甘露醇;二溴卫矛醇;哌泊溴烷(pipobroman);甲托辛(gacytosine);阿糖胞苷(“ara
‑
c”);环磷酰胺;噻替派;紫杉烷类,例如紫杉醇和多西他赛(doxetaxel);苯丁酸氮芥;吉西他滨;6
‑
硫鸟嘌呤;巯基嘌呤;甲氨蝶呤;铂配位络合物,例如顺铂、奥沙利铂和卡铂;长春碱;铂剂;依托泊苷(vp
‑
16);异环磷酰胺;米托蒽醌;长春新碱;长春瑞滨;诺肖灵(novantrone);替尼泊苷;依达曲沙(edatrexate);柔红霉素;氨基蝶呤;希罗达(xeloda);伊班膦酸盐(ibandronate);伊立替康(例如,cpt
‑
11);拓扑异构酶抑制剂rfs 2000;二氟甲基鸟氨酸(dmfo);类视黄醇a,例如视黄酸;卡培他滨;顺铂(cddp)、卡铂、丙卡巴肼、双氯乙基甲胺、环磷酰胺、喜树碱、异环磷酰胺、美法仑、苯丁酸氮芥、白消安、亚硝基脲、放线霉素d、柔红霉素、多柔比星、博来霉素、普卡霉素(plicomycin)、丝裂霉素、依托泊苷(vp16)、他莫昔芬、雷洛昔芬、雌激素受体结合剂、紫杉酚、紫杉醇、多西他赛、吉西他滨、诺维本(navelbine)、法呢基蛋白转移酶抑制剂、反式铂剂(transplatinum)、5
‑
氟尿嘧啶、长春新碱、长春碱和氨甲蝶呤;以及上述任一种的可药用盐、酸或衍生物。
[0215]
该定义中还包括用于调节或抑制对肿瘤的激素作用的抗激素剂,例如抗雌激素和选择性雌激素受体调节剂(serm),包括例如他莫昔芬、雷洛昔芬、屈洛昔芬、4
‑
羟基他莫昔芬、曲沃昔芬、盐酸雷洛昔芬(keoxifene)、ly117018、奥那司酮(onapristone)和托瑞米芬;抑制调节肾上腺中雌激素产生的酶芳香酶的芳香酶抑制剂,例如如4(5)
‑
咪唑、氨鲁米特、乙酸甲地孕酮、依西美坦、福美坦(formestanie)、法倔唑、伏氯唑、来曲唑和阿那曲唑;以及抗雄激素,例如氟他胺、尼鲁米特、比卡鲁胺、亮脯利特和戈舍瑞林;以及曲沙他滨(troxacitabine)(1,3
‑
二氧戊环核苷胞嘧啶类似物);反义寡核苷酸,特别是抑制信号传导途径中参与异常细胞增殖的基因表达的那些,所述基因例如如pkc
‑
α、ralf和h
‑
ras;核酶,例如vegf表达抑制剂和her2表达抑制剂;疫苗,例如基因治疗疫苗;以及上述任一种的可药用盐、酸或衍生物。
[0216]
2.放射治疗
[0217]
放射治疗(也称为放射性治疗)是使用电离辐射来治疗癌症和其他疾病。电离辐射沉积能量,其通过损害遗传物质来损伤或破坏所治疗区域中的细胞,使这些细胞不能够继续生长。尽管辐射同时损害癌症细胞和正常细胞,但是后者能够自身修复并适当地作用。
[0218]
根据本公开内容使用的放射治疗可以包括但不限于使用γ射线、x射线和/或向肿瘤细胞定向递送放射性同位素。其他形式的dna损伤因素也在考虑之中,例如微波和uv照射。所有这些因素最有可能对dna、dna前体、dna的复制和修复、以及染色体的组装和维持产生大范围的损害。x射线的剂量范围为长时间(3至4周)50至200伦琴的每日剂量至2000至6000伦琴的单剂量。放射性同位素的剂量范围广泛变化,并且取决于同位素的半衰期、发出的辐射的强度和类型、以及被赘生性细胞的摄取。
[0219]
放射治疗可以包括使用经放射性标记的抗体来向癌症部位直接递送辐射剂量(放射免疫治疗)。抗体是由机体响应于抗原(被免疫系统识别为外源的物质)的存在而产生的高度特异性蛋白质。一些肿瘤细胞包含触发产生肿瘤特异性抗体的特异性抗原。大量的这些抗体可以在实验室中制成并连接到放射性物质(称为放射性标记的方法)。一旦注射到体内,抗体主动地寻找癌细胞,癌细胞通过辐射的细胞杀伤(细胞毒性)作用而被破坏。该方法
可以使对健康细胞的辐射损害的风险最小化。
[0220]
适形放射治疗使用相同的放射治疗机(线性加速器)作为正常的放射治疗性治疗,但是将金属块放置在x射线束的路径中改变其形状以匹配癌症的形状。这确保给予肿瘤较高的辐射剂量。健康的周围细胞和附近结构接受较低剂量的辐射,因此副作用的可能性降低。已经开发了一种被称为多叶准直器的装置,并且其可以用作金属块的替代物。多叶准直器由固定在线性加速器上的多个金属片组成。可以调整各层,使得放射治疗束无需金属块即可根据治疗区域成形。放射治疗机的精确定位对于适形放射治疗性治疗是非常重要的,并且可以在每次治疗开始时使用专用扫描机来检查内部器官的位置。
[0221]
高分辨率强度调制放射治疗也使用多叶准直器。在这种治疗期间,在正给予治疗的同时移动多叶准直器的层。该方法可能实现治疗束的甚至更精确成形,并允许放射治疗剂量在整个治疗区域恒定。
[0222]
尽管研究已经表明适形放射治疗和强度调制放射治疗可以降低放射治疗性治疗的副作用,但是如此精确地根据治疗区域成形可能会停止恰好在所破坏治疗区域之外的微观癌细胞。这意味着,使用这些特化的放射治疗技术,将来癌症复发的风险可能会更高。
[0223]
科学家们也在寻找提高放射治疗的有效性的方式。正在研究两种类型的研究药物对正进行辐射的细胞的作用。放射增敏剂使肿瘤细胞更可能被损害,放射防护剂保护正常组织免受辐射的影响。还正在研究使用热的热疗(hyperthermia)在使组织对辐射致敏方面的有效性。
[0224]
3.免疫治疗
[0225]
在癌症治疗的背景下,免疫治疗通常依赖于使用免疫效应细胞和分子来靶向和破坏癌细胞。曲妥珠单抗(herceptin
tm
)是这样的一个实例。免疫效应物可以是例如对肿瘤细胞表面上的一些标志物具有特异性的抗体。抗体单独可以用作治疗的效应物,或者其可以募集其他细胞来实际影响细胞杀伤。抗体还可以与药物或毒素(化学治疗剂、放射性核素、蓖麻毒素a链、霍乱毒素、百日咳毒素等)缀合,并且仅用作靶向剂。或者,效应物可以是携带与肿瘤细胞靶标直接或间接相互作用的表面分子的淋巴细胞。多种效应细胞包括细胞毒性t细胞和nk细胞。治疗方式的组合,即直接细胞毒活性和erbb2的抑制或减少,可在治疗erbb2过表达癌症中提供治疗益处。
[0226]
还可以使用另一种免疫治疗作为与上述基因沉默治疗的组合治疗的一部分。在免疫治疗的一个方面中,肿瘤细胞必须携带适合靶向,即不存在于大多数其他细胞上的一些标志物。在本公开内容的背景下,存在许多肿瘤标志物,并且任何这些都可以适合于靶向。常见的肿瘤标志物包括癌胚抗原、前列腺特异性抗原、泌尿肿瘤相关抗原、胎儿抗原、酪氨酸酶(p97)、gp68、tag
‑
72、hmfg、sialyl lewis抗原、muca、mucb、plap、雌激素受体、层粘连蛋白受体、erb b和p155。免疫治疗的一个替代方面是将抗癌作用与免疫刺激作用组合。还存在免疫刺激分子,其包括:细胞因子,例如il
‑
2、il
‑
4、il
‑
12、gm
‑
csf、γ
‑
ifn;趋化因子,例如mip
‑
1、mcp
‑
1、il
‑
8;以及生长因子,例如flt3配体。已经表明,将免疫刺激分子作为蛋白质或使用基因递送与肿瘤抑制剂组合增强抗肿瘤作用(ju等,2000)。此外,可以使用针对任何这些化合物的抗体来靶向本文中讨论的抗癌剂。
[0227]
目前正在研究或正在使用的免疫治疗的实例是免疫佐剂,例如牛型分枝杆菌(mycobacterium bovis)、恶性疟原虫(plasmodium falciparum)、二硝基氯苯和芳族化合
物(美国专利5,801,005和5,739,169;hui和hashimoto,1998;christodoulides等,1998);细胞因子治疗,例如干扰素α、β和γ,il
‑
1,gm
‑
csf,和tnf(bukowski等,1998;davidson等,1998;hellstrand等,1998);基因治疗,例如tnf、il
‑
1、il
‑
2、p53(qin等,1998;austin
‑
ward和villaseca,1998;美国专利5,830,880和5,846,945);以及单克隆抗体,例如抗神经节苷脂gm2、抗her
‑
2、抗p185(pietras等,1998;hanibuchi等,1998;美国专利5,824,311)。可以考虑,可以将一种或更多种抗癌治疗与本文中所述的基因沉默治疗一起使用。
[0228]
在主动免疫治疗中,施用抗原性肽、多肽或蛋白质,或者自体或同种异体肿瘤细胞组合物或“疫苗”,通常与不同的细菌佐剂一起(ravindranath和morton,1991;morton等,1992;mitchell等,1990;mitchell等,1993)。
[0229]
在过继性免疫治疗中,体外分离患者的循环淋巴细胞或肿瘤浸润的淋巴细胞,通过淋巴因子(例如il
‑
2)激活或用肿瘤坏死基因转导,并重新施用(rosenberg等,1988;1989)。
[0230]
4.外科手术
[0231]
大约60%患有癌症的人将经历某种类型的外科手术,其包括预防性、诊断性或分期性、治疗性和姑息性外科手术。治疗性外科手术是可以与其他治疗联合使用的癌症治疗,所述其他治疗例如本公开内容的治疗、化学治疗、放射治疗、激素治疗、基因治疗、免疫治疗和/或替代治疗。
[0232]
治疗性外科手术包括在其中全部或部分癌性组织被物理去除、切除和/或破坏的切除术。肿瘤切除术是指至少部分肿瘤的物理去除。除肿瘤切除术外,通过外科手术的治疗还包括激光外科手术、冷冻外科手术、电外科手术和通过显微镜控制的外科手术(mohs外科手术)。还可以考虑,本公开内容可以与除去浅表性癌症、前期癌或附带量的正常组织联合使用。
[0233]
在切除部分或全部癌性细胞、组织或肿瘤之后,可以在体内形成腔。治疗可以通过用另外的抗癌治疗灌注、直接注射或局部施加部位来实现。这样的治疗可以重复,例如每1、2、3、4、5、6或7天,或者每1、2、3、4和5周,或者每1、2、3、4、5、6、7、8、9、10、11或12个月。这些治疗也可以具有不同的剂量。
[0234]
5.基因治疗
[0235]
在又一个实施方案中,二次治疗为基因治疗,其中在施用h2a.z靶向剂之前、之后或同时施用治疗性多核苷酸。h2a.z靶向剂与编码以下基因产物之一的载体联合递送可以对靶组织具有组合的抗过度增殖作用。多种蛋白质包括在本公开内容中,其中一些蛋白质在下文中描述。
[0236]
a.细胞增殖的诱导因子
[0237]
根据功能,诱导细胞增殖的蛋白质进一步落入多个类别。所有这些蛋白质的共同性是其调节细胞增殖的能力。例如,pdgf的一种形式sis癌基因是分泌的生长因子。癌基因很少由编码生长因子的基因产生,而目前,sis是唯一已知的天然存在癌基因生长因子。在本公开内容的一个实施方案中,可以考虑,使用针对特定细胞增殖诱导因子的反义mrna或sirna来阻止细胞增殖诱导因子的表达。
[0238]
fms和erba蛋白为生长因子受体。这些受体的突变导致可调节功能的丧失。例如,影响neu受体蛋白的跨膜结构域的点突变导致neu癌基因。erba癌基因来源于甲状腺激素的
细胞内受体。经修饰的癌基因erba受体被认为与内源性甲状腺激素受体竞争,导致不受控制的生长。
[0239]
癌基因的最大类别包括信号转导蛋白(例如src、abl和ras)。src蛋白是细胞质蛋白酪氨酸激酶,并且在某些情况下通过在酪氨酸残基527处的突变导致其从原癌基因转变成癌基因。相比之下,在一个实例中,通过序列中氨基酸12从缬氨酸到甘氨酸的突变导致gtp酶蛋白ras从原癌基因转变成癌基因,降低了ras gtp酶活性。
[0240]
jun、fos和myc蛋白是作为转录因子直接发挥其对核功能的作用的蛋白质。
[0241]
b.细胞增殖的抑制因子
[0242]
肿瘤抑制癌基因的作用是抑制过度的细胞增殖。这些基因的失活破坏其抑制活性,导致不受调节的增殖。可以使用肿瘤抑制因子p53、mda
‑
7、fhit、p16和c
‑
cam。
[0243]
除p53外,另一种细胞增殖抑制因子是p16。真核细胞周期的主要过渡是由细胞周期蛋白依赖性激酶或cdk引发的。一种cdk细胞周期蛋白依赖性激酶4(cdk4)通过g1调节进展。该酶的活性可能是在晚期g1磷酸化rb。cdk4的活性受活化亚基(d型细胞周期蛋白)以及抑制亚基的控制,p16
ink4
已被生物化学表征为特异性结合并抑制cdk4的蛋白质,并且因此可调节rb磷酸化(serrano等,1993;serrano等,1995)。由于p16
ink4
蛋白是一种cdk4抑制因子(serrano,1993),故该基因的缺失可增加cdk4的活性,导致rb蛋白的过度磷酸化。还已知p16调节cdk6的功能。
[0244]
p16
ink4
属于cdk抑制蛋白的一类,其还包括p16
b
、p19、p21
waf1
和p27
kip1
。p16
ink4
基因图谱绘制于9p21,其是在许多肿瘤类型中经常缺失的染色体区域。p16
ink4
基因的纯合性缺失和突变在人肿瘤细胞系中较为频繁。该证据表明p16
ink4
基因是肿瘤抑制基因。然而,这一解释由于以下观察结果而已经受到挑战:p16
ink4
基因改变的频率在原代未培养的肿瘤中比在培养的细胞系中低得多(caldas等,1994;cheng等,1994;hussussian等,1994;kamb等,1994;kamb等,1994;mori等,1994;okamoto等,1994;nobori等,1995;orlow等,1994;arap等,1995)。通过用质粒表达载体转染来恢复野生型p16
ink4
功能降低某些人癌细胞系的集落形成(okamoto,1994;arap,1995)。
[0245]
根据本公开内容可以使用的其他基因包括rb、apc、dcc、nf
‑
1、nf
‑
2、wt
‑
1、men
‑
i、men
‑
ii、zac1、p73、vhl、mmac1/h2a.z、dbccr
‑
1、fcc、rsk
‑
3、p27、p27/p16融合体、p21/p27融合体、抗血栓形成基因(例如cox
‑
1、tfpi)、pgs、dp、e2f、ras、myc、neu、raf、erb、fms、trk、ret、gsp、hst、abl、e1a、p300、参与血管生成的基因(例如vegf、fgf、血小板反应蛋白(thrombospondin)、bai
‑
1、gdaif、或其受体)和mcc。
[0246]
c.程序性细胞死亡的调节因子
[0247]
细胞凋亡或程序性细胞死亡是正常胚胎发育、维持成体组织内的稳态和抑制癌发生的必需过程(kerr等,1972)。已经证明了bcl
‑
2蛋白家族和ice样蛋白酶二者都是其他系统中细胞凋亡的重要调节因子和效应因子。发现与滤泡性淋巴瘤有关的bcl
‑
2蛋白在响应于各种细胞凋亡刺激来控制细胞凋亡和增强细胞存活中发挥突出作用(bakhshi等,1985;cleary和sklar,1985;cleary等,1986;tsujimoto等,1985;tsujimoto和croce,1986)。现在认识到演变上保守的bcl
‑
2蛋白是可归类为死亡激动剂或死亡拮抗剂的相关蛋白的家族的成员。
[0248]
在bcl
‑
2的发现之后,已经表明bcl
‑
2起抑制由多种刺激触发的细胞死亡的作用。
此外,现在显而易见的是,存在共有共同结构和序列同源性的bcl
‑
2细胞死亡调节蛋白的家族。已经表明这些不同的家族成员具有与bcl
‑
2类似的功能(例如bcl
xl
、bcl
w
、bcl
s
、mcl
‑
1、a1、bfl
‑
1)或者抵消bcl
‑
2功能并促进细胞死亡(例如bax、bak、bik、bim、bid、bad、harakiri)。
[0249]
d.rna干扰(rnai)
[0250]
在某些实施方案中,h2a.z抑制剂是针对h2a.z.的mrna的双链rna(dsrna)。
[0251]
rna干扰(也称为“rna介导的干扰”或rnai)是通过其可以降低或消除基因表达的机制。已经观察到双链rna(dsrna)介导降低,这是一个多步骤过程。dsrna激活转录后基因表达监督机制,其显示起防御细胞免受病毒感染和转座子活性的作用(fire等,1998;grishok等,2000;ketting等,1999;lin和avery等,1999;montgomery等,1998;sharp和zamore,2000;tabara等,1999)。这些机制的激活靶向成熟的dsrna互补mrna进行破坏。rnai为基因功能的研究提供了重要的实验优点。这些优点包括非常高的特异性、易于移动穿过细胞膜和所靶向基因长时间下调(fire等,1998;grishok等,2000;ketting等,1999;lin和avery等,1999;montgomery等,1998;sharp等,1999;sharp和zamore,2000;tabara等,1999)。普遍接受的是rnai转录后起作用,靶向rna转录物进行降解。显示可以靶向细胞核和细胞质rna二者(bosher和labouesse,2000)。
[0252]
e.sirna
[0253]
sirna必须被设计成使得其在抑制目的基因的表达方面具有特异性和有效性。选择靶序列,即一个或更多个目的基因中存在的针对其sirna指导降解机制的那些序列的方法,涉及避免可干扰sirna指导功能的序列,同时包括对该一个或更多个基因特异性的序列。通常,长度为约21至23个核苷酸的sirna靶序列是最有效的。该长度反映了如上所述由加工远远更长rna产生的消化产物的长度(montgomery等,1998)。sirna是本领域众所周知的。例如,美国专利6,506,559和6,573,099中以及美国专利申请2003/0051263、2003/0055020、2004/0265839、2002/0168707、2003/0159161和2004/0064842中已经描述了sirna和双链rna,所述专利全部通过引用整体并入本文。
[0254]
已经提出了数种对sirna序列的进一步修饰以改变其稳定性或提高其有效性。已提出,具有二核苷酸突出端的合成互补21聚体rna(即,19个互补核苷酸 3’非互补二聚体)可以提供最大水平的抑制。这些方案主要使用两个(2
’‑
脱氧)胸苷核苷酸的序列作为二核苷酸突出端。这些二核苷酸突出端通常被写为dtdt以将其与并入rna的普通核苷酸区分。文献已经表明,dt突出端的使用主要是以降低化学合成rna的成本的需要为动机。还提出,dtdt突出端可能比uu突出端更稳定,但是可用数据表明与具有uu突出端的sirna相比,dtdt突出端仅略微(<20%)提高。
[0255]
f.抑制性核酸的产生
[0256]
dsrna可以使用充分描述的方法来合成(fire等,1998)。简言之,使用t7聚合酶(megascript,ambion)由dna模板合成有义和反义rna。在合成完成之后,用dna酶i消化dna模板,并通过苯酚/氯仿提取和异丙醇沉淀来纯化rna。在变性琼脂糖凝胶上测定rna的尺寸、纯度和完整性。在柠檬酸钾缓冲液中稀释有义和反义rna并将其在80℃下退火3分钟以形成dsrna。与构建dna模板文库一样,可以使用一些操作来帮助该时间密集性操作。个体dsrna种类的总和被称为“dsrna文库”。
[0257]
sirna的制备主要通过直接化学合成、通过经由暴露于果蝇胚胎裂解物来加工较长的双链rna、或者通过从s2细胞获得的体外系统。细胞裂解物或体外处理的使用还可以涉及随后从裂解物分离短的21至23个核苷酸的sirna,等等,导致该过程有些麻烦且昂贵。化学合成通过制备两种单链rna寡聚物,然后使两种单链寡聚物退火成双链rna来进行。化学合成方法多种多样。美国专利5,889,136、4,415,723和4,458,066(其明确通过引用并入本文)中以及wincott等(1995)中提供了一些非限制性实例。
[0258]
wo 99/32619和wo 01/68836提出,用于sirna的rna可以化学合成或酶促合成。这两篇文本都通过引用整体并入本文。这些参考文献中考虑的酶促合成是通过细胞rna聚合酶或噬菌体rna聚合酶(例如,t3、t7、sp6)经由使用和产生表达构建体来进行,如本领域中已知的。例如,参见美国专利5,795,715。所考虑的构建体提供产生rna的包含与靶基因之一部分相同的核苷酸序列的模板。由这些参考文献提供的相同序列的长度为至少25个碱基,并且长度可以多至400个或更多个碱基。该参考文献的一个重要方面是作者考虑使用在体内将长dsrna转化成sirna的内源性核酸酶复合物来将较长的dsrna消化到21至25聚体的长度。他们没有描述或提供用于合成和使用体外转录的21至25聚体dsrna的数据。化学或酶促合成dsrna在其用于rna干扰的预期特性之间没有区别。
[0259]
类似地,wo 00/44914(通过引用并入本文)提出可以酶促或通过部分/全有机合成来产生rna单链。优选地,由dna模板,优选克隆的cdna模板的pcr产物酶促合成单链rna,并且rna产物是cdna的完整转录物,其可以包含数百个核苷酸。wo 01/36646(通过引用并入本文)在合成sirna的方式上没有设置限制,只要可以使用人工和/或自动化操作在体外或体内合成rna即可。该参考文献还提供了体外合成可以是化学的或酶促的,例如使用克隆的rna聚合酶(例如,t3、t7、sp6)来转录内源性dna(或cdna)模板或二者的混合物。再次,化学或酶促合成的sirna之间在用于rna干扰的期望特性上没有区别。
[0260]
美国专利5,795,715报道了在单反应混合物中同时转录两种互补dna序列链,其中使两种转录物立即杂交。使用的模板优选地具有40至100个碱基对,并且其在每个末端配置有启动子序列。模板优选地连接到固体表面。在用rna聚合酶转录之后,所得dsrna片段可以用于检测和/或测定核酸靶序列。
[0261]
数个团队已经开发了在稳定转染的哺乳动物细胞中持续表达sirna的表达载体(brummelkamp等,2002;lee等,2002;paul等,2002;sui等,2002;yu等,2002)。这些质粒中的一些被工程化成表达缺乏聚(a)尾的shrna(brummelkamp等,2002;paul等,2002;yu等,2002)。shrna的转录起始于聚合酶iii(pol iii)启动子,并且被认为终止于4至5个胸腺嘧啶的转录终止位点的第2位。shrna被认为折叠成具有3’uu
‑
突出端的茎环结构。随后,加工这些shrna的末端,将shrna转化为约21nt的sirna样分子(brummelkamp等,2002)。sirna样分子进而可以在转染的哺乳动物细胞中产生基因特异性沉默。
[0262]
g.其他药剂
[0263]
可以考虑,可以将其他药剂与本公开内容一起使用。这些另外的药剂包括免疫调节剂、影响细胞表面受体和间隙连接上调的药剂、细胞抑制剂和分化剂、细胞黏附抑制剂、增加过度增殖细胞对凋亡诱导剂的敏感性的药剂、或其他生物剂。免疫调节剂包括肿瘤坏死因子;干扰素α、β和γ;il
‑
2及其他细胞因子;f42k及其他细胞因子类似物;或者mip
‑
1、mip
‑
1β、mcp
‑
1、rantes,以及其他趋化因子。还可以考虑,细胞表面受体或其配体(例如fas/
fas配体、dr4或dr5/trail(apo
‑
2配体))的上调可通过建立对过度增殖细胞的自分泌或旁分泌作用来增强本公开内容的细胞凋亡诱导能力。通过升高间隙连接数来增加细胞间信号可增加对邻近过度增殖细胞群的抗过度增殖作用。在另一些实施方案中,可以将细胞抑制剂或分化剂与本公开内容组合使用以提高治疗的抗过度增殖效力。可以考虑细胞黏附抑制剂以提高本公开内容的效力。细胞黏附抑制剂的实例是黏着斑激酶(fak)抑制剂和洛伐他汀。还考虑,可以将其他增加过度增殖细胞对细胞凋亡的敏感性的药剂(例如抗体c225)与本公开内容组合使用以提高治疗效力。
[0264]
在引入细胞毒性化学治疗药物之后,在癌症的治疗上已经取得许多进展。然而,化学治疗的结果之一是出现/获得抗药性表型并且发生多重抗药性。抗药性的出现仍然是治疗这样的肿瘤的主要障碍,并且因此,显然需要替代方法,例如基因治疗。
[0265]
与化学治疗、放射治疗或生物治疗联合使用的另一种治疗形式包括热疗,其是其中使患者的组织暴露于高温(高达106
°
f)的方法。局部、区域性或全身热疗的施加可以涉及外部或内部加热装置。局部热疗包括向小区域(例如肿瘤)施加热。热在外部可以从体外装置用靶向肿瘤的高频波来产生。内部热可以涉及无菌探针,包括薄的经加热导线或用温水填充的中空管、植入的微波天线或射频电极。
[0266]
加热患者的器官或肢体进行区域性治疗,这使用产生高能量的装置(例如磁体)来实现。或者,可以移出患者的一些血液并在灌注到将内部加热的区域之前进行加热。在癌症已遍及全身的情况下,还可以实施全身加热。为了此目的,可以使用温水毯、热蜡、感应线圈和热室。
[0267]
激素治疗也可以与本公开内容联合使用或者与先前描述的任何其他癌症治疗组合使用。激素的使用可以用于治疗某些癌症(例如乳腺癌、前列腺癌、卵巢癌或宫颈癌)以降低某些激素(例如睾酮或雌激素)的水平或阻断其作用。这种治疗通常作为一个治疗选择或为降低转移风险而与至少一种其他癌症治疗组合使用。
[0268]
5.剂量
[0269]
本文所述组合物中包括的或所述方法中施加的治疗剂的量将是在药学上有效的任何量,并且将取决于许多因素,包括所选治疗剂的身份和效力。本领域普通技术人员熟悉涉及确定特定药剂的治疗有效剂量的因素。因此,在该方面中,本文所述组合物中治疗剂的浓度可以为任意浓度。在一些具体实施方案中,药物的总浓度小于10%。在一些更具体的实施方案中,药物的浓度小于5%。治疗剂可以施加一次或多于一次。在一些非限制性实例中,治疗剂每天一次、每天两次、每天三次、每天四次、每天六次、在清醒时每两小时、每四小时、每隔一天、每周一次地施加,等等。治疗可以持续任何持续时间,如本领域普通技术人员所确定的。
[0270]
ix.实施例
[0271]
包括以下实施例来说明本公开内容的某些非限制性方面。本领域技术人员应理解,在以下实施例中公开的技术代表本发明人发现在本公开内容的实施中发挥良好作用的技术。然而,根据本公开内容,本领域技术人员应理解,在不脱离本公开内容的精神和范围下,可以在所公开的特定实施方案中进行许多变化并且仍然获得相似或类似的结果。
[0272]
实施例1
‑
材料和方法
[0273]
数据.总共有74个样品:35个病例(27个独特的个体病例)和39个对照(31个独特的
个体对照)。在39个对照中,11个为新增的年轻对照。年轻对照与randa对照不同,因此,这些对照从分析中排除。
[0274]
在剩余的63个样品(35个病例和28个对照)中,有15对,“c”与“f”(8对为病例和7对为对照)。根据“c”和“f”标记,将病例和对照的数据分成两个集合。每个集合包含27个病例和21个对照。在8对病例中,7对属于“早期”并且1对属于“晚期”。该“晚期”样品根据组织学属于“肉瘤样”,并且因此不包括在“鳞状病例相对于对照”分析中。在7对“早期”样品中,6对具有“腺”并且1对为“鳞状”。
[0275]
表1.包含“c”或“f”标记的15对样品
[0276]
[0277][0278]
数据分为两个集合,每个集合包含19个常见病例和14个常见对照加具有“c”标记的8个病例和7个对照(对于集合1),或者具有“f”标记的8个病例和7个对照(对于集合2)。参见图1。
[0279]
变量.检测三个独立变量,变量“异常细胞(>2个异常)的#”被编码为v1,变量“总异常(缺失 增益 异常)的#”被编码为v2,变量“仅具有增益的异常细胞的#”被编码为v3。
[0280]
统计学分析.对病例和对照(全部、早期与对照、晚期与对照、腺与对照和鳞状与对照)进行t
‑
检验(包括使用wilcoxon和kruskal
‑
wallis检验的非参数方法)、单变量精确逻辑回归和多变量精确逻辑回归(所有三个变量)。
[0281]
表2.不同组中病例和对照的描述统计学
[0282][0283]
注意:在“期”中,0=对照,1=早期,2=晚期。在组织学中,0=对照,1=腺,2=鳞状,其他为遗漏。
[0284]
实施例2
‑
结果
[0285]
在三个变量(v1、v2和v3)方面,病例与对照显著不同。无论使用等方差(当f检验不显著时)或不等方差方法,还是使用非参数方法(例如wilcoxon检验和kruskal
‑
wallis检验),t检验的结果全部均显示在病例和对照之间具有显著性差异。这在具有“c”标记的样品的集合中与在具有“f”标记的样品的集合中是相同的。然而,在具有“f”标记的集合(下表3的底部)中在病例和对照之间在方差检验(即f检验)中观察到主要差异。这可以表明在包含“f”样品的病例和对照之间具有较大的异质性。
[0286]
表3.f检验和t检验的结果
[0287][0288]
f检验中的显著性结果表明在病例和对照之间检测到的方差的不等。因此,应当考虑不等方差的t检验。包含“f”标记的样品的集合(8个病例和7个对照)显示在病例和对照之间的方差差异的强烈趋势。参照上表1,这样的差异效应似乎主要来自属于“早期”和“腺”组的样品。由于极小的样品尺寸,即仅3个病例,“晚期”组中的结果可能不可靠,参见上表2。
[0289]
精确逻辑回归。使用五组病例相对于对照进行单变量精确逻辑回归。结果显示在包含“c”标记或“f”标记的两个集合中在所有组之间具有统计学显著性。优势比(odds ratio,or)全部均大于1,意味着所有三个变量的风险因子。比较两个集合(即“c”和“f”集合)之间的or标度,其在各组中是相似的,例如,在“全部病例相对于对照”组中,or=2.8(包含“c”的v1)相对于or=2.7(包含“f”的v1),1.4(包含“c”的v2)相对于1.26(包含“f”的v2),和5.78(包含“c”的v3)相对于4.7(包含“f”的v3)。在包含“c”标记或“f”标记的两个集合中“晚期病例相对于对照”和“腺病例相对于对照”的组在变量v3的精确逻辑回归期间未能获得最大似然估计导致没有获得可靠的结果(同样v2,在“c”标记中)。
[0290]
表4.精确逻辑回归(单变量)的结果
[0291][0292]
使用以下模型尝试多变量精确逻辑回归:
[0293]
logit(状态
病例/对照
)=β0 β1v1 β2v2 β3v3。
[0294]
然而,该将三个变量组合在一起的多变量模型是有问题的,因为甚至当v1至v3值中的一个遗漏时,程序丢弃一个个体。对于小样品,其导致不稳定的评估。重要的是,在单变量分析中,在所有不同的子集(例如早期、晚期、腺和鳞状)中v1至v3都是显著性的。
[0295]
实施例2
‑
结果
[0296]
数据.使用所有74个样品,包括标记为“c”和“f”的15对和11个年轻对照。对三个变量v1、v2和v3进行簇聚。
[0297]
探究.从散点图(图2a至图2d),11个年轻对照(
□
)与所有病例(
·
)区分分开,狭窄地散布在角落处。但是,三个变量各自中均存在少数年长对照(o)与病例交结。这会对簇聚分析构成挑战。
[0298]
簇聚分析.使用sas proc cluster,将11种簇聚方法中的8种用于数据。并且以下结果使用平均连接方法由最佳方法获取,所述最佳方法由来自其他centroid方法和gower中值方法的结果支持。
[0299]
检测三个主要统计量以估计聚簇的数目,但是数据集本身被限定在病例(使用值3)和对照(年轻组使用值2和年长组使用值1)的组中。三个统计量为立方簇聚准则(ccc)、伪f(psf)和t2(pst2)。
[0300]
·
ccc值大于2或3的峰意指有效聚簇。大的负ccc值指向异常值。
[0301]
·
psf的数大意指良好的聚簇数目。
[0302]
·
pst2在此可以作为支持结果整合以上两者来判断聚簇的数目。在pstsq图表(对该pst2值绘制图表)中,pump(向右)后的数目可以指示良好聚簇的数目。
[0303]
表6.根据aff(病例/对照的疾病状态)的聚簇
[0304][0305]
聚簇数目的峰估计为3,并且在数据中表明总共11个聚簇。基于3聚簇的结果的检测显示:aff=1(年轻对照)、2(年长对照)和3(病例)。三个对照被分类到大多数为病例(20个aff=3)的聚簇2,并且2个病例被分组大部分对照所在的聚簇1。这些是在簇聚中的不明确样品。
[0306]
表7.聚簇中的不明确样品
[0307][0308]
在三个主要聚簇中,大多数病例被分组到聚簇1中并且大部分病例被分组到聚簇2和3中。表8和表9分别列出了对照和病例的成功分类。成功鉴定出v2不大于23且v3不大于2的对照。对于病例,v2不低于27。
[0309]
表8.成功分类的对照
[0310][0311]
注意:“aff”代表病例和对照的疾病状态。值2代表年轻对照。左侧的表通过id分类,并且右侧的表通过v2、v1和v3分类。
[0312]
表9.成功分类的病例
[0313][0314]
左侧的表通过id分类,并且右侧的表通过v2、v1和v3分类。
[0315]
表10.由于遗漏值的丢弃样品
[0316][0317]
距原点的欧几里得距离.尝试另一种简单测量使用以下公式来计算每个样品到原点的平方欧几里得距离,“euclideand”:euclideand=(v1)2 (v2)2 (v3)2,例如,如在具有v1=6、v2=20和v3=2的样品id=vs13
‑
105的情况下,其euclideand=62 202 22=36 400 4=440。
[0318]
euclideand列出在表11(成功分类的对照)、表12(成功分类的病例)和表13(错误分类的病例/对照)中。对于euclideand<=537的对照或euclideand>=779的病例,分类显示是成功的。
[0319]
在表13中,有一个对照样品id=vs13
‑
101被分组到聚簇2中。该样品具有
euclideand=859,与病例样品id=vs13
‑
137(同样在聚簇2中)完全相同的值。两个样品享有完全相同的值v1(=3)、v2(=29)和v3(=3)。平均连接簇聚法将其二者都分组到聚簇2中,但是一个被鉴定为对照,并且由此被认为是错误分类。
[0320]
表11.成功分类的对照的euclideand
[0321][0322]
表12.成功分类的病例的euclideand
[0323][0324]
表13错误分类的病例和对照
[0325][0326]
使用该系统,本发明人能够将异常细胞的数目富集在患者(9)和对照(5)的亚组中,使用该新的阈值在bioview系统上再分析其血液样品以富集恶性细胞群)。在如此测量的9个癌症病例(大部分患有早期肺癌)中,5/9显示出异常细胞的增加(被限定为在同一细胞内2个染色体基因座的多体性或增益)。在初始被评分为恶性肿瘤阴性(基于4或>异常细
胞的阳性阈值)的早期腺癌的一个病例中,使用新软件重新分类将异常细胞数目从3升高到5(病例v13
‑
109;参见以下),因此使我们能够将该病例分类为阳性,并且提高测试的灵敏性和特异性。
[0327]
拍摄全屏幕快照,其显示在软件优化之前和之后的循环肿瘤细胞(ctc)富集。肿瘤细胞或循环肿瘤细胞(ctc)被限定为2或>染色体增益或多体性/细胞的任何细胞。该方法产生10fish信号/细胞的最小值,阳性病例被限定为具有4或>ctc的血液样品。以下讨论了三个代表性病例。
[0328]
vs13
‑
109.45岁的女性,曾经的吸烟者,患有ib期鳞状细胞肺癌,在软件优化之前使用四色fish面板在duet(bioview ltd.)上显示3个异常细胞。在优化之后,使用四色fish面板从相同病例中观察到异常细胞(异常细胞检测提高66%)。
[0329]
vs13
‑
121.82岁的男性,当前的吸烟者,被诊断患有肺的iib期腺癌,在软件优化之前,使用四色fish面板在duet(bioview ltd.)上显示6个fish
‑
异常细胞。在优化之后,使用四色fish面板观察到10个fish
‑
异常细胞(异常细胞检测提高66%)。
[0330]
vs13
‑
124.40岁男性,曾经的吸烟者,被诊断患有iia期鳞状细胞肺癌,在软件优化之前,使用四色fish面板在duet(bioview ltd.)上显示6个异常细胞。在软件优化之后,使用四色fish面板异常细胞产率增加到8个异常细胞(提高33%)。
[0331]
表14总结了这5个患有肺癌的患者的数据,随着新软件改进,所述患者的异常(恶性)循环肿瘤细胞数目增加(旧的数目在括号中)。
[0332]
表14
[0333][0334]
在对照病例中,异常细胞的数目增加多于1个细胞,然而仍远远低于阈值4,其为恶性肿瘤的阈值。
[0335]
甲状腺癌.当基于无法捕获正经历上皮间充质转化的ctc的epcam测定时,乳头状甲状腺癌(ptc)患者中循环肿瘤细胞(ctc)的计数一直没有成功。为了克服这一点,本发明人设计了使用dna探针的基于抗原依赖性fish的测定,所述dna探针先前已经用于检测肺癌ctc。本发明人假定以上讨论的这些相同探针可以检测ptc中的ctc,因为肺和甲状腺均源自前肠内胚层,并且与nkx2
‑
1/ttf1(一种谱系存活癌基因)有关,nkx2
‑
1/ttf1控制与肺和甲状腺祖细胞分化有关的基因(例如表面活性蛋白(sfpt))的表达。此外,通过rnaseq已经证明大多数ptc过表达表面活性蛋白a、b和c rna。
[0336]
为了评价患有转移性ptc(ptcm)的患者的外周血中ctc的存在,本发明人测试了患有ptcm的患者和对照,试图建立疾病进展和对治疗的应答的新预后/替代标志。还试图了解肺癌探针组是否可以准确地检测ptc的ctc。招募了12位ptcm患者(年龄62
±
15.7岁)以及8
位具有ptc历史、成功甲状腺切除术和超过5年无疾病迹象(ned)的对照患者(年龄46.9
±
12.1岁)。30位健康对象(年龄62.7
±
7.8岁)作为第二对照组包括在内。分离外周血单个核细胞(pbmc),并使其与4种dna探针(2种基因座特异性探针(在10q22(sftpa1、2)和3p22处)和2种内部着丝粒探针(cep10和cep3))的多色混合物杂交。扫描系统对500细胞/样品以每个细胞为基础评分荧光信号。信号模式通过2个读出器分析为以下类别:异常细胞(ac)或ctc(2或>探针的增益);缺失或增益(单探针的丢失或增益),和正常细胞。
[0337]
与具有ned的患者(0.18
±
0.18)或健康对照(0.18
±
0.23)相比,患有ptcm的患者具有较高的%ac(0.9
±
0.3,p<0.001和99.9%功率)。0.6%ac(3/500细胞)的截断值在ptcm和来自两组的对照之间区分。与健康对照相比,患有ptcm的患者具有较高的cep 3缺失百分比(0.80
±
0.85相对于0.19
±
0.53,p=0.006)、cep10缺失百分比(1.43
±
1.37相对于0.45
±
0.67,p=0.002)、cep10增益百分比(0.45
±
0.34相对于0.23
±
0.28,p=0.03)、以及10q22.3增益百分比(0.77
±
0.60相对于0.13
±
0.17,p<0.001)、总缺失和增益百分比(5.68
±
1.91相对于2.47
±
1.27,p<0.001)以及降低的正常细胞%(94.33
±
1.88相对于97.52
±
1.24)(p<0.00001)。
[0338]
ptcm证明了以非整倍性为特征的ctc,其中与对照相比ctc的水平较高。设计用于肺癌的探针成功地检测ptc患者的ctc的遗传畸变,可能是由于肺和甲状腺恶性祖细胞中控制基因表达的共同谱系特异性转录因子。需要更大组群的研究来证明ctc在ptcm的预后中的显著性。
[0339]
*************
[0340]
根据本公开内容,本文中公开和要求保护的所有组合物和方法可以在没有过度实验的情况下进行和执行。尽管根据优选实施方案已经对本公开内容的组合物和方法进行描述,但是对本领域技术人员显而易见的是,在不脱离本公开内容的概念、精神和范围的情况下可以改变本文中所述的组合物和方法以及方法的步骤或步骤顺序。更具体地,显而易见的是,化学和生理相关的某些试剂可以代替本文中所述的试剂,同时获得相同或类似的结果。对于本领域技术人员显而易见的所有这样的类似替代和修改被认为在由所附权利要求书限定的本公开内容的精神、范围和概念内。
[0341]
参考文献
[0342]
以下参考文献在其提供补充本文中所述的那些的示例性操作细节或其他细节的程度上特别地通过引用并入本文。
[0343]
美国专利4,415,723
[0344]
美国专利4,458,066
[0345]
美国专利4,683,195
[0346]
美国专利4,683,202
[0347]
美国专利4,800,159
[0348]
美国专利4,883,750
[0349]
美国专利5,279,721
[0350]
美国专利5,610,287
[0351]
美国专利5,739,169
[0352]
美国专利5,795,715
[0353]
美国专利5,801,005
[0354]
美国专利5,824,311
[0355]
美国专利5,830,880
[0356]
美国专利5,846,945
[0357]
美国专利5,889,136
[0358]
美国专利6,506,559
[0359]
美国专利6,573,099
[0360]
美国专利6,797,471
[0361]
美国专利公开2002/0168707
[0362]
美国专利公开2003/0051263
[0363]
美国专利公开2003/0055020
[0364]
美国专利公开2003/0159161
[0365]
美国专利公开2004/0064842
[0366]
美国专利公开2004/0265839
[0367]
美国专利公开2007/0218480
[0368]
美国专利公开2009/0137412
[0369]
alberola et al.,proc.ann.mt.am.soc.clin.oncol.,14:a1094,1995.
[0370]
allard et al.,clin.cancer res.,10:6897
‑
6904,2004.
[0371]
arap et al.,cancer res.,55(6):1351
‑
1354,1995.
[0372]
auerbach et al.,n.engl j.med.,265:253
‑
267,1961.
[0373]
austin
‑
ward and villaseca,revista medica de chile,126(7):838
‑
845,1998.
[0374]
ayabe et al.,lung cancer,11(3
‑
4):201
‑
208,1994.
[0375]
bakhshi et al.,cell,41(3):899
‑
906,1985.
[0376]
barkan et al.,cancer,105:35
‑
43,2004.
[0377]
barkan et al.,cancer,105:35
‑
43,2005.
[0378]
bonassi et al.,cancer res.,60:1619
‑
1625,2000.
[0379]
bonassi et al.,genome res.,104(1
‑
4):376
‑
382,2004.
[0380]
bosher and labouesse,nat.cell.biol.,2(2):e31
‑
e36,2000.
[0381]
brummelkamp et al.,cancer cell,2:243
‑
247,2002.
[0382]
bubendoff et al.,am.j.clin.pathol.,123516
‑
123523,2005.
[0383]
bukowski et al.,clinical cancer res.,4(10):2337
‑
2347,1998.
[0384]
caldas et al.,cancer res.,54:3568
‑
3573,1994.
[0385]
carcy et al.,jnci,65:1225
‑
1230,1980.
[0386]
carriaga et al.,cancer,75:406
‑
421,1995.
[0387]
cheng et al.,cancer res.,54(21):5547
‑
5551,1994.
[0388]
cheon et al.,yonsei med.j.,34(4):365
‑
370,1993.
[0389]
christodoulides et al.,microbiology,144(pt 11):3027
‑
3037,1998.
[0390]
cleary and sklar,proc.natl.acad.sci.usa,82(21):7439
‑
7443,1985.
[0391]
cleary et al.,j.exp.med.,164(1):315
‑
320,1986.
[0392]
cristofanilli et al.,n.engl.j.med.,351:781
‑
791,2004.
[0393]
daniely et al.,urology,66:1354
‑
1359,2005.
[0394]
davidson et al.,j.immunother.,21(5):389
‑
398,1998.
[0395]
ekins and chu,trends in biotechnology,17:217
‑
218,1999.
[0396]
epo appln.320 308
[0397]
epo appln.329 822
[0398]
feder et al.,cancer genet.cytogenet.,102:25
‑
31,1998.
[0399]
feinstein et al.,am.rev.repir.dis.,101:671
‑
684,1970.
[0400]
fenech and crott,mutat.res.,504:131
‑
136,2002.
[0401]
fenech,drug discov.today,7∶1128
‑
1137,2002.
[0402]
fenech,mutat.res.,455:81
‑
95,2000.
[0403]
fenech,toxicology,181
‑
182:411
‑
416,2002.
[0404]
fire et al.,nature,391(6669):806
‑
811,1998.
[0405]
fodor et al.,biochemistry,30(33):8102
‑
8108,1991.
[0406]
fontanini et al.,cancer,70(6):1520
‑
7,1992.
[0407]
freifelder,in:physical biochemistry applications to biochemistry and molecular biology,2nd ed.wm.freeman and co.,ny,1982.
[0408]
frohman,in:pcr protocols:a guide to methods and applications,academic press,n.y.,1990.
[0409]
gangnus et al,clin.cancer res.,10:3457
‑
3464,2004.
[0410]
gb appln.2 202 328
[0411]
goeze et al.,j.pathol.,196:8
‑
16,2002.
[0412]
gough et al.,biomed.central,4:9:1471
‑
2164,2003.
[0413]
grishok et al.,science,287:2494
‑
2497,2000.
[0414]
haagsman and diemel,comp.biochem.physiol.mol.integr.physiol.,129(1):91
‑
108,2001.
[0415]
hacia et al.,nature genet.,14:441
‑
449,1996.
[0416]
hagmar et al.,cancer res.,58:4117
‑
4121,1998.
[0417]
hanibuchi et al.,int.j.cancer,78(4):480
‑
485,1998.
[0418]
hellstrand et al.,acta oncologica,37(4):347
‑
353,1998.
[0419]
hirano et al.,american j.path.,144(2):296
‑
302,1994.
[0420]
hirsh,manksgaard,1
‑
78,1983.
[0421]
holmstrom et al.,anal.biochem.209:278
‑
283,1993.
[0422]
huang et al.,proc.nat’l acad.sci.usa 98:15044
‑
15049,2001.
[0423]
hui and hashimoto,infection imun.,66(11):5329
‑
5336,1998.
[0424]
hussussian et al.,nat.genet.,8(1):15
‑
21,1994.
[0425]
ichinose et al.,cancer res.,51(19):5392
‑
5397,1991.
[0426]
ihde,curr.prob.cancer,15:65,1991.
[0427]
ingenito et al.,j.appl.physiol.,86(5):1702
‑
1714,1999.
[0428]
lnnis,et al.,in:pcr protocols.a guide to methods and application,academic press,inc.san diego,1990.
[0429]
jiang and katz,diagn.mol.pathol.,11:47
‑
57,2002.
[0430]
jiang et al.,clin.cancer res.,115417
‑
115424,2005.
[0431]
jiang et al.,neoplasia,6:623
‑
635,2004.
[0432]
jones,nature,199:280
‑
282,1963.
[0433]
ju et al.,gene ther.,7(19):1672
‑
1679,2000.
[0434]
kamb et al.,nat.genet.,8(1):23
‑
26,1994.
[0435]
kamb et al.,science,2674:436
‑
440,1994.
[0436]
katz et al.,mod. pathol.,21:950
‑
960,2008.
[0437]
kerr et al.,br.j.cancer,26(4):239
‑
257,1972.
[0438]
ketting et al.,cell,99(2):133
‑
141,1999.
[0439]
kim et al.,cell,87:343
‑
355,1996.
[0440]
korfhagen et al.,proc.natl.acad.sci.usa,93(18):9594
‑
9599,1996.
[0441]
kwoh et al.,proc.natl.acad.sci.usa,86:1173,1989.
[0442]
lee et al.,biochim.biophys.acta,1582:175
‑
177,2002.
[0443]
leversha et al.,clin.cancer res.,15(6):2091
‑
7,2009.
[0444]
li et al.,lab.invest.,86(6):619
‑
627,2006.
[0445]
licciardello et al.,int.j.radiat.oncol.biol.phys.,17(3):467
‑
476,1989.
[0446]
liewald et al.,chirurg.,63(3):205
‑
10,1992.
[0447]
lin and avery,nature,402:128
‑
129,1999.
[0448]
liou et al.,cancer res.,59:1481
‑
1484,1999.
[0449]
macchiarini et al.,proc annu mt.am.soc.clin.oncol.,11:a995,1992.
[0450]
mitchell et al.,ann.ny acad.sci.,690:153
‑
166,1993.
[0451]
mitchell et al.,j,clin.oncol.,8(5):856
‑
869,1990.
[0452]
mitsudomi et al.,clin.cancer res.,2(7):1185
‑
9,1996.
[0453]
miyamoto et al.,cancer res.,51(23pt1)6346
‑
50,1991.
[0454]
montgomery et al.,proc.natl.acad.sci.usa,95:15502
‑
15507,1998.
[0455]
mori et al.,cancer res.,54(13):3396
‑
3397,1994.
[0456]
morton et al.,arch.surg.,127:392
‑
399,1992.
[0457]
mrkve et al.,anticancer research,13(3):571
‑
8,1993.
[0458]
muller and pantel,breast cancer res.,6:258
‑
261,2004.
[0459]
naruke et al.,j.thorac.cardiovas surg.,96:400,1988.
[0460]
newton et al.,nucl.acids res.21:1155
‑
1162,1993.
[0461]
nobori et al.,nature(london),368:753
‑
756,1995.
[0462]
ohara et al.,proc.natl.acad.sti.usa,86:5673
‑
5677,1989.
[0463]
okamoto et al,proc.natl.acad.sci.usa,91(23):11045
‑
11049,1994.
[0464]
orlow et al,cancer res,54(11):2848
‑
2851,1994.
[0465]
orlow et al.,int.j.oncol.,15(1):17
‑
24,1994.
[0466]
palaniyar et al.,biochem.biophys.res.commun.,250(1):131
‑
136,1998.
[0467]
palaniyar et al.,comp.biochem.physiol.a mol.integr.physiol.,129(1):109
‑
127,2001.
[0468]
pantel et al.,proc.annu mt.am.soc.clin.oncol.,12:a941,1993.
[0469]
papadimitrakopoulou et al.,cancer and metastasis reviews,15:53
‑
76,1996.
[0470]
paul et al.,nature biotechnol.,20:505
‑
508,2002.
[0471]
pct appln.wo 00/44914
[0472]
pct appln.wo 01/36646
[0473]
pct appln.wo 01/68836
[0474]
pct appln.wo 88/10315
[0475]
pct appln.wo 89/06700
[0476]
pct appln.wo 90/07641
[0477]
pct appln.wo 99/32619
[0478]
pct publn.pct/us87/00880
[0479]
pct publn.pct/us89/01025
[0480]
pease et al.,proc.natl.acad.sci,usa,91:5022
‑
5026,1994.
[0481]
pence et al.,achives of surgety,128(12):1382
‑
1390,1993.
[0482]
p
é
rez
‑
gil et al.,biochim.biophys.acta.,1408(2
‑
3):203
‑
217,1998.
[0483]
pierga et al.,clin.cancer res.,10:1392
‑
1400,2004.
[0484]
pietras et al.,oncogene,17(17):2235
‑
2249,1998.
[0485]
pignon et al.,hum.mutat.,3:126
‑
132,1994.
[0486]
qin et al.,proc.natl.acad.sci.usa,95(24):14411
‑
14416,1998.
[0487]
ramaswamy et al.,nat.genet,33:49
‑
54,2003.
[0488]
rasmussen et al.,anal.biochem,198:138
‑
142,1991.
[0489]
ravindranath and morton,intern.rev.inmunol.,7:303
‑
329,1991.
[0490]
rice et al.,j.thoracic cardio.surgery,106(2):201
‑
217,1993.
[0491]
rosenberg et al.,ann.surg.210(4):474
‑
548,1989.
[0492]
rosenberg et al.,n.engl.j.med.,319:1676,1988.
[0493]
running et al.,biotechniques 8:276
‑
277,1990.
[0494]
sahin et al.,cancer,65(3):530
‑
7,1990.
[0495]
saiki et al.,j.biochem.,116(6):1208
‑
1211,1994.
[0496]
sambrook et al.,in:molecular cloning:a laboratory manual,2
nd
ed.,cold spring harbor laboratory press,cold spring harbor,ny,1989.
[0497]
serrano et al.,nature,366:704
‑
707,1993.
[0498]
serrano et al,science,267(5195):249
‑
252,1995.
[0499]
sharp and zamore,science,287:2431
‑
2433,2000.
[0500]
sharp,genes dev.,13:139
‑
141,1999.
[0501]
sher et al.,clin.cancer res.,11:173
‑
179,2005.
[0502]
shiseki et al.,genes chromosomes cancer,17(2):71
‑
7,1996.
[0503]
shoemaker et al.,nature genetics,14:450
‑
456,1996.
[0504]
shriver et al.,mutat.res.406(1):9
‑
23,1998.
[0505]
sieuwerts et al.,j.natl.cancer inst.,101:61
‑
66,2009.
[0506]
slaughter et al.,cancer,6:963
‑
968,1953.
[0507]
smerhovsky et al.,environ.health perspect.,109:41
‑
45,2001.
[0508]
solomon et al.,science,254:1153
‑
1160,1991.
[0509]
stewenius et al.,proc.natl.acad.sci.usa,102(15):5541
‑
5546,2005.
[0510]
sui et al.,proc.natlacad.sci.usa,99(8):5515
‑
5520,2002.
[0511]
swennenhuis et al.,cytometry a,75(6):520
‑
7,2009.
[0512]
tabara et al.,cell,99(2):123
‑
132,1999.
[0513]
thiberville et al.,cancer research,55:5133
‑
5139,1995a.
[0514]
thiberville et al.,int.j.cancer,64:371,1995b.
[0515]
travis et al.,cancer.75:191
‑
202,1995.
[0516]
tsujimoto and croce,proc.natl.acad.sci.usa,83(14):5214
‑
5218,1986.
[0517]
tsujimoto et al.,nature,315:340
‑
343,1985.
[0518]
tsujimoto et al.,science,228(4706):1440
‑
1443,1985.
[0519]
tucker and preston,mutat.res.,365:147
‑
159,1996.
[0520]
umegaki et al.,mutagenesis,15:261
‑
269,2000.
[0521]
valdivieso et al.,proc.annu.mt.am.soc.clin.oncol.,13:a1121,1994.
[0522]
vallmer et al.,hum.pathol.,16:247
‑
252,1985.
[0523]
volm et al.,versicherungsmedizin,41(1):2
‑
5,1989.
[0524]
voravud,et al.,cancer research,53:2874
‑
2883,1993.
[0525]
walker et al.,nucleic acids res.,20(7):1691
‑
1696,1992.
[0526]
wincott et al.,nucleic acids res.,23(14):2677
‑
2684,1995.
[0527]
wistuba et al.,cancer res.,60(7):1949
‑
60,2000.
[0528]
wu et al.,anal.chen.,70:456a,1998.
[0529]
wu et al.,cancer res.,58(8):1605
‑
8,1998.
[0530]
wu et al.,j,thorac oncol.,4:30
‑
36,2009.
[0531]
yamaoka et al.,j.japan surgical soc.,91(10):1608
‑
1616,1990.
[0532]
yanagisawa et al.,cancer research,56:5579
‑
5582,1996.
[0533]
yendamuri et al.,j.thorac oncol.,3:979
‑
984,2008.
[0534]
yu et al.,j.am.chem.soc.,124(23):6576
‑
6583,2002.
[0535]
zou et al.,clinical cancer research 4:1345
‑
1355,1998.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

