1.本发明属于生物技术领域,具体涉及一种针对中华绒螯蟹螺原体的特异性卵黄抗体及其制备方法和应用。
背景技术:
2.中华绒螯蟹俗称河蟹,是中国水产养殖业中的重要养殖品种之一,随着国际和国内市场需求的迅速增加,其产业也迅速发展,以满足市场的需要。随着中华绒螯蟹产业的集约化发展,各种细菌、病毒、寄生虫或者理化因素导致的疾病暴发对其产业的可持续发展造成了严重的制约,其中由中华绒螯蟹螺原体(spiroplasma eriocheiris)引起的颤抖病是对中华绒螯蟹养殖产业最具破坏性的疾病,目前对于该疾病的致病机理、检测和防治工作已经取得了一系列的研究成果。目前该疾病的治疗还是主要依靠土霉素等抗生素的使用,但是,抗生素等化学药物的滥用可能会导致药物残留、耐药菌产生、环境污染以及水生动物免疫系统损伤等一系列问题。而耐药菌的传播会大大减少可用防治措施的选择,并增加治愈难度和导致感染引起的死亡,因此,迫切需要有效且无污染的抗生素替代品。
3.目前,还没有关于在中华绒螯蟹中使用特异性igy对抗s.eriocheiris感染的研究。
技术实现要素:
4.针对现有技术的不足,本发明的目的是验证igy在中华绒螯蟹防治s.eriocheiris感染中的作用,以预期用特异性抗s.eriocheiris igy防治中华绒螯蟹颤抖病,进而增加中华绒螯蟹在感染s.eriocheiris过程中的存活率,以提高中华绒螯蟹的产量和渔民收入。因此,本发明提供了一种针对中华绒螯蟹螺原体的特异性卵黄抗体及其制备方法和应用。
5.本发明是通过以下技术方案实现的:
6.一种针对中华绒螯蟹螺原体的特异性卵黄抗体,所述抗体为抗s.eriocheiris的特异性igy抗体,是由破碎后的螺原体注射进母鸡体内,从鸡蛋的卵黄中分离并纯化得到的特异性抗体。
7.一种针对中华绒螯蟹螺原体的特异性卵黄抗体的制备方法,包括以下步骤:
8.步骤1)将s.eriocheiris在r2培养基中培养24h后离心去上清,并用pbs重悬;
9.步骤2)将经步骤1)重悬后的s.eriocheiris进行超声破碎,并于20℃保存备用;
10.步骤3)对母鸡进行肌肉注射,注射1ml 200~400μg/ml经步骤2)破碎后的s.eriocheiris,生产特异性抗体igy;
11.步骤4)对母鸡进行3次注射,间隔2周,每天收集鸡蛋,直至第九周,提取鸡蛋卵黄,从卵黄中分离出igy并纯化,即得。
12.一种针对中华绒螯蟹螺原体的特异性卵黄抗体在抑制s.eriocheiris生长方面的应用。
13.一种针对中华绒螯蟹螺原体的特异性卵黄抗体在抑制s.eriocheiris生长方面的应用,包括以下步骤:
14.步骤a)从注射了200~400μg/ml的s.eriocheiris的鸡卵黄中分离出igy并纯化;
15.步骤b)将步骤a)得到的igy以滴度为1:1~30000的比例进行稀释,得到特异性igy;
16.步骤c)在r2培养基中接种s.eriocheiris并添加步骤b)得到的特异性igy,其中igy与培养基按照1:4~100的比率混合,培养0~48h后观察s.eriocheiris的生长情况。
17.优选地,步骤a)所述鸡卵黄中,注射的s.eriocheiris的浓度为400μg/ml;步骤b)所述滴度为1:10000;步骤c)所述igy与培养基的比率为1:4。
18.一种针对中华绒螯蟹螺原体的特异性卵黄抗体在中华绒螯蟹抵抗s.eriocheiris感染中的应用。
19.一种针对中华绒螯蟹螺原体的特异性卵黄抗体在中华绒螯蟹抵抗s.eriocheiris感染中的应用,包括以下步骤:
20.步骤a)从注射了400μg/ml的s.eriocheiris的鸡卵黄中分离出igy并纯化;将分离纯化的igy以滴度为1:10000的比例进行稀释,得到特异性igy;
21.步骤b
‑
1)将步骤a)制得的特异性igy与饲料混合,混合质量比为1:4,并用蛋清作为粘合剂,制得混合饲料;
22.步骤c
‑
1)将步骤b
‑
1)制得的混合饲料在阳光下暴晒直至干燥,对中华绒螯蟹进行喂食,喂食率为每天1%,饲养15天后观察结果。
23.一种针对中华绒螯蟹螺原体的特异性卵黄抗体在中华绒螯蟹抵抗s.eriocheiris感染中的应用,包括以下步骤:
24.步骤a)从注射了400μg/ml的s.eriocheiris的鸡卵黄中分离出igy并纯化;将分离纯化的igy以滴度为1:10000的比例进行稀释,得到特异性igy;
25.步骤b
‑
2)将步骤a)制得的特异性igy与pbs按体积比为1:4进行混合,制得注射物;
26.步骤c
‑
2)将步骤b
‑
2)制得的注射物对中华绒螯蟹进行注射,15天后观察结果。
27.一种针对中华绒螯蟹螺原体的特异性卵黄抗体在水产养殖中的应用。
28.本发明的有益效果如下:
29.igy用作预防和疾病控制在成本效益、便利性、产量以及对环境无污染等方面都具有一定的优势,igy被动免疫方法也已被广泛应用到控制水生动物疾病中。因此,从预免疫蛋鸡的蛋黄中提取到的抗s.eriocheirisigy抗体是治疗中华绒螯蟹颤抖病的一种有前途的替代方法。本发明成功地证明了抗s.eriocheiris特异性igy在中华绒螯蟹抵抗s.eriocheiris感染过程中的潜在作用,并可以应用于水产养殖中以提高中华绒螯蟹的产量和渔民的收入,促进中华绒螯蟹养殖产业的发展。
附图说明
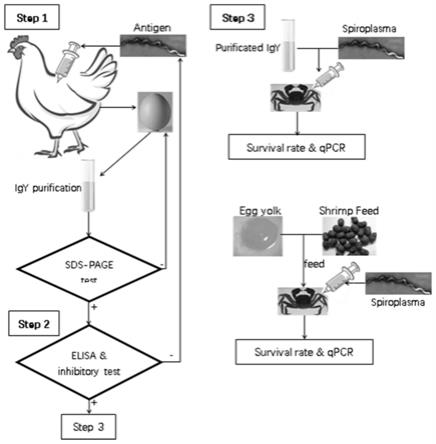
30.图1为本发明的流程示意图;
31.图2为注射了400μg/ml抗原产生的igy的抗体滴度为1:10,000在450nm下测定elisa板孔的光密度(od);
32.图3为饲喂含有igy的饲料后中华绒螯蟹的存活率;
33.图3中:a为中华绒螯蟹注射pbs后饲喂商品饲料组;b为中华绒螯蟹注射s.eriocheiris后饲喂商品饲料组;c为中华绒螯蟹注射s.eriocheiris后饲喂含有普通igy饲料组;d为中华绒螯蟹注射s.eriocheiris后饲喂含有特异性igy饲料组;
34.图4为注射igy后中华绒螯蟹的存活率;
35.图4中:e为中华绒螯蟹注射pbs;f为中华绒螯蟹注射s.eriocheiri;g为中华绒螯蟹注射s.eriocheiris 普通igy;h为中华绒螯蟹注射s.eriocheiris 特异性igy。
36.图5为饲喂含有igy的饲料后中华绒螯蟹血淋巴细胞内s.eriocheiris的拷贝数;
37.图6为注射igy后中华绒螯蟹血淋巴细胞内s.eriocheiris的拷贝数;
38.图7为饲喂含有igy的饲料后中华绒螯蟹血淋巴细胞内s.eriocheiris的形态变化;
39.图8为注射igy后中华绒螯蟹血淋巴细胞内s.eriocheiris的形态变化。
具体实施方式
40.下面结合附图与具体实施例对本发明做进一步详细说明。
41.实施例1
42.一种针对中华绒螯蟹螺原体的特异性卵黄抗体,所述抗体为抗s.eriocheiris的特异性igy抗体,是由破碎后的螺原体注射进母鸡体内,从鸡蛋的卵黄中分离并纯化得到的特异性抗体。
43.一种针对中华绒螯蟹螺原体的特异性卵黄抗体的制备方法,具体步骤如下:
44.(1)将s.eriocheiris在r2培养基中培养24h后离心去上清,并用pbs重悬。
45.(2)将重悬后的s.eriocheiris进行超声破碎(500w,6min,超声破碎5s,间隔9s),并置于20℃冰箱中保存备用。
46.(3)将8只母鸡分成4组,进行肌肉注射,如图1所示,具体如下:
47.a组:注射1ml pbs作为对照组,产生非特异性igy/正常igy;
48.b组:注射1ml 200μg/ml破碎后的s.eriocheiris,生产特异性抗体igy;
49.c组:注射1ml 300μg/ml破碎后的s.eriocheiris,生产特异性抗体igy;
50.d组:注射1ml 400μg/ml破碎后的s.eriocheiris,生产特异性抗体igy。
51.(4)每只鸡进行3次注射,间隔2周,每天收集鸡蛋,直至第九周;提取鸡蛋卵黄,从卵黄中分离出igy,并用硫酸铵对其进行纯化,即得。
52.实施例2最适抗原浓度以及最佳稀释度的选择
53.将从注射了200μg/ml、300μg/ml以及400μg/ml的s.eriocheiris的鸡卵黄中分离纯化后的特异性igy(1:1)以及三种igy稀释液(1:30,000、1:20,000和1:10,000)进行elisa试验,如图1所示。稀释液为pbst 5%胎牛血清(pbst=pbs(ph 7.4,0.01m) 0.05%tween
‑
20.)。使用酶标仪在450/630nm下测定elisa板孔的光密度(od),检测特异性igy的效价。结果显示获得的最佳特异性igy为注射了400μg/ml抗原产生的igy,其滴度为1:10,000。
54.如图2所示为注射了400μg/ml抗原产生的igy的抗体滴度为1:10,000。其中每个组重复3次(n=3)。将注射了400μg/ml抗原产生的特异性igy进行1:10,000稀释后,用抗原浓度分别为100、50、20g/ml进行elisa实验,结果表明注射了400μg/ml抗原产生的igy在抗原浓度分别为100、50、20g/ml时,450/630nm处od值在第四周即可达到0.8,且igy的最低抗原
浓度为20g/ml。以上结果表明注射了400μg/ml抗原产生并稀释10,000后的特异性igy,是与抗原反应最快的igy,在第一次免疫后第四周,即使抗原浓度只有20g/ml,od值也能够达到0.8。
55.实施例3s.eriocheiris的生长抑制实验
56.采用生长抑制法检测了特异性igy抑制s.eriocheiris生长的效果。r2培养基中接种s.eriocheiris并添加纯化得到的igy,igy与培养基按照三种不同比率混合:1:100、1:10和1:4,培养0h、12h、24h和48h后观察s.eriocheiris的生长情况。实验共分为四组,即阴性对照组、阳性对照组、普通igy组和s.eriocheiris特异性igy组。通过比较各组之间r2培养基的颜色变化来确定s.eriocheiris生长抑制效果,颜色变化与阳性对照一致的样品是不能抑制s.eriocheiris生长的igy浓度,而显示出与阴性对照相似颜色的样品是最佳地抑制s.eriocheiris生长的igy浓度。结果显示1:4的比例最适合用于s.eriocheiris特异性igy的应用。
57.实施例4感染实验与igy应用
58.igy中和实验和应用是证明特异性igy在中华绒螯蟹在抵抗s.eriocheiris感染中的作用。抗s.eriocheiris igy因其对s.eriocheiris的特异性和敏感性而有望对s.eriocheiris感染过程中的中华绒螯蟹存活率产生影响,并确定注射或喂食特异性igy的最佳浓度。
59.购入中华绒螯蟹(50
±
3)g,实验前在10l的具有循环水功能、紫外线杀菌和水温控制系统的水箱中养殖1周,每个水箱饲养10只中华绒螯蟹,pcr检测和电子显微镜负染观察证实了实验中使用的中华绒螯蟹为s.eriocheiris阴性。
60.1、饲料中的应用
61.用于口服的igy饲料是与普通igy或特异性igy混合的商品饲料,并且用蛋清作为粘合剂,如图1所示。igy与饲料混合的比例为1:4(w/w),将饲料在阳光下暴晒直至干燥,喂食率为每天1%,饲养时间为15天。实验分4组进行:以不感染螺原体且饲喂商品饲料的中华绒螯蟹作为阴性对照(a);注射s.eriocheiris且每天饲喂商品饲料的中华绒螯蟹作为阳性对照(b);注射s.eriocheiris、每天饲喂含普通igy的饲料为对照组(c);注射s.eriocheiris、每天饲喂含特异性igy的饲料为实验组(d)。
62.如图3所示,15天后实验结束时四组中中华绒螯蟹的生存率分别为57%(a)、3%(b)、3%(c)和43%(d)。结果表明,特异性igy在螺原体感染中华绒螯蟹的过程中对存活率有显著影响。抗s.eriocheiris的特异性igy可以帮助中华绒螯蟹更好地生存,其效果比饲喂商品饲料或使用普通igy喂养的发病河蟹的成活率更高。
63.2、注射剂中的应用
64.对另外4组不同的中华绒螯蟹进行了igy注射,如图1所示。分组如下:注射pbs的中华绒螯蟹为阴性对照(e);注射s.eriocheiris的中华绒螯蟹为阳性对照(f);注射s.eriocheiris和普通igy混合物的中华绒螯蟹为对照组(g);注射s.eriocheiris与抗s.eriocheiris特异性igy混合物的中华绒螯蟹为实验组(h)。注射物是由igy和pbs的混合物制成,混合体积比为1:4。
65.如图4所示,饲养15天后结果显示四组的生存率分别为70%(e)、5%(f)、15%(g)和50%(h)。实验结果表明特异性igy注射的中华绒螯蟹存活率要高于未注射igy组和注射
普通igy的中华绒螯蟹。
66.3、结果及机制研究
67.上述1和2的实验结果显示,使用注射或饲喂方法添加抗s.eriocheiris特异性igy的中华绒螯蟹在s.eriocheiris感染过程中的存活率显著升高。
68.使用引物se
‑
qf(如seq id no.1所示)和se
‑
qr(如seq id no.2所示)通过dna提取和实时pcr测定螺原体感染后不同时间点中华绒螯蟹血细胞中的s.eriocheiris拷贝数,如图5、图6所示。结果显示饲喂(图5)或注射(图6)抗s.eriocheiris特异性igy后,中华绒螯蟹血淋巴内的螺原体拷贝数与饲喂或注射pbs以及普通igy的对照组相比,螺原体的拷贝数显著降低,表明无论是饲喂还是注射抗s.eriocheiris特异性igy,均可以有效地抑制中华绒螯蟹中s.eriocheiris的数量,该结果与中华绒螯蟹存活率结果相一致。
69.表1人工引物序列表
[0070][0071]
为了探讨抗s.eriocheiris特异性igy对s.eriocheiris的抑制机制,特异性igy处理s.eriocheiris后进行负染色并使用透射电镜观察了抗s.eriocheiris特异性igy对s.eriocheiris形态结构的影响,如图7、图8所示。图7(group a)和图8(group d)为注射了螺原体后对中华绒螯蟹进行正常饲料饲喂以及注射pbs后中华绒螯蟹血淋巴细胞内正常的螺原体,从图中可以看出其细胞膜完整、形态规则。图7(group b)和图8(group e)为注射了螺原体后对中华绒螯蟹进行饲喂含有普通igy以及注射普通igy后中华绒螯蟹血淋巴细胞内的螺原体,从图中可以看出螺原体的结构与正常的螺原体相比略有不同且不规则,具体如图7(group b)、图8(group e)中的箭头所示。图7(group c)和图8(group f)为注射了螺原体后对中华绒螯蟹进行饲喂含有特异性igy以及注射特异性igy后中华绒螯蟹血淋巴细胞内正常的螺原体,如图7(group c)、图8(group f)所示,抗s.eriocheiris特异性igy处理后的s.eriocheiris形态结构发生改变,呈现不规则的、成团的、裂开的或膜溶解的形态。因此特异性igy处理对s.eriocheiris的形态结构造成很大的破坏,进而影响了s.eriocheiris的生长繁殖和感染。
[0072]
综上所述,与现有的治疗中华绒螯蟹颤抖病的方法相比,本发明的方法对环境无污染、针对性强、效果显著。与pbs或者非特异性的igy相比,本发明的抗s.eriocheiris的特异性igy能够显著提高中华绒螯蟹的存活率,降低s.eriocheiris的拷贝数,并使s.eriocheiris的形态结构发生变化,使其膜裂开或溶解。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

