一种sirna及其应用
技术领域
1.本发明属于分子生物学和基因工程技术领域,具体涉及一种sirna及其应用。
背景技术:
2.鸡的匍匐性状是一些鸡品种中存在的一种特有的矮小表型,是鸡中特有的肢体异常 表型。匍匐性状是遗传学中的一个经典性状,个体表现为胫短身矮、翅膀短小、体躯匀 称、骨骼发育异常,尤其是胫软骨发育不良。匍匐性状是由常染色体上显性纯合致死基 因cp所控制(landauer w,et al.,1930),但国际上对其性状及基因的研究仍有待深入。
3.印度hedgehog基因(ihh)编码信号因子hedgehog家族的一员,最初在早期软骨骨 骼元素的软骨细胞中表达(bitgood mj,et al.,1995)。ihh是最早发现的hh家族重要 成员,ihh主要表达于软骨组织和肠道中,参与软骨细胞的增殖、分化和造骨细胞分化 过程。研究发现在出生后来源于软骨细胞的ihh对于维持生长板、软骨表面及骨小梁的 形态是必不可少的。已有研究通过高通量测序定位了ihh是影响鸡匍匐性状的关键基 因,ihh基因的缺失是导致匍匐性状的突变原因(jin et al.,2016)。据研究报道,鸡ihh 基因位于7号染色体上,由3个外显子与2个内含子组成,主要表达于软骨组织,在软 骨发育过程中起着重要作用(bren
‑
mattison y,et al.,2011)。ihh主要由前肥大软骨细 胞合成和分泌,调节生长板软骨细胞的肥大化和软骨内成骨的过程(st
‑
jacques b,et al., 1999)。此外,ihh是调控机体骨骼发育的重要因子,ihh信号通路是一个经典的生物 发育信号通路,在骨骼发育过程中起非常重要的作用,尤其与软骨细胞增殖和分化密切 相关。软骨细胞是成熟软骨组织内唯一的细胞类型,其主要起到维持关节软骨组织内环 境稳态的作用。在参与协调软骨细胞增殖、分化和造骨细胞的分化过程中ihh信号起到 关键调控作用,进而可通过调控ihh基因信号通路来改善鸡的匍匐性状。
4.基于上述内容,提出一种sirna及其应用。
技术实现要素:
5.本发明的目的在于克服现有技术的不足,提供了一种sirna及其应用,通过sirna 影响ihh基因功能及信号通路基因的表达水平来影响鸡的匍匐性状,有助于我们更加 深入地理解鸡匍匐性状形成的分子机理和调控机制,进一步开展匍匐鸡的保种和改良工 作,对畜禽重要经济性状的分子育种和生产具有重要作用。
6.本发明通过以下技术方案来实现上述目的:
7.本发明提供了一种sirna,其抑制ihh基因表达,所述ihh基因具有如seq id no:1 所示的核苷酸序列,所述sirna为双链,其核酸序列为:
8.正义链:5’ccgacaucaucuucaaggatt 3’;
9.反义链:5’uccuugaagaugaugucggtt 3’。
10.本发明还提供了一种上述sirna在鸡匍匐性状形成的分子机理和调控机制中的应 用。
染,转染方法为脂质体转染(lipofectamine
tm
2000transfection reagent),方法按照产 品说明,转染试剂与sirna的转染比例为5:1(μl/μg)。
34.将sirna1、sirna2、sirna3、sirna阴性对照(nc)及sirna荧光对照 (sirna
‑
fam)转染生长状态良好的鸡软骨细胞,利用fam标记的sirna进行转染效 率的评估。在荧光显微镜下观察,通过荧光判断转染效率,转染效率可达到80%,结果 见图1。
35.sirna阴性对照(nc):正义链为5’uucuccgaacgugucacgutt 3’,反义 链为5’acgugacacguucggagaatt 3’。
36.sirna荧光对照(sirna
‑
fam):正义链为5’uucuccgaacgugucacgutt 3’, 反义链为5’acgugacacguucggagaatt 3’。
37.2.2.2qpcr检测
38.转染48h后,收取细胞,pbs洗涤后,离心去上清,采用trizol方法提取细胞总 rna,保存于
‑
80℃,用于cdna的合成。逆转录后进行pcr反应,具体如下:
39.提取总rna:使用trizol法提取sirna转染后的软骨细胞总rna,步骤如下:
40.(1)样品中加入trizol reagent后反复吹打几次,使样本充分裂解。室温放置5min, 使蛋白核酸复合物完全分离;
41.(2)以每1ml trizol reagent加入200μl氯仿的比例加入氯仿,盖好管盖,剧烈 振荡15s,室温放置2min;
42.(3)4℃12000rpm离心10min,rna水相转移至新离心管中,加入等体积的70% 乙醇(无rnase水配制),颠倒混匀;
43.(4)将上步所得溶液全部加入到已装入收集管的吸附柱(spin columns rm)中。 若一次不能加完溶液,可分多次转入。12000rpm离心20s,倒掉收集管中的废液,将 吸附柱重新放回收集管中;
44.(5)向吸附柱中加入350μl buffer rw1,12000rpm离心20s,倒掉收集管中的 废液,将吸附柱重新放回收集管中;
45.(6)配制dnase i混合液,向吸附柱中直接加入80μl dnase i混合液,20
‑
30℃ 孵育15min;
46.(7)向吸附柱中加入350μl buffer rw1,12000rpm离心1min,弃废液,将吸附 柱重新放回收集管中;
47.(8)向吸附柱中加入500μl buffer rw2(使用前检查是否已加入无水乙醇),12000 rpm离心20s,倒掉收集管中的废液,将吸附柱重新放回收集管中,重复此步骤1次;
48.(9)12000rpm离心2min,倒掉收集管中废液,将吸附柱置于室温晾干后放于一 个新的无rnase离心管中,向吸附柱的中间部位加入30
‑
50μl rnase
‑
freewater,室温 放置1min,12000rpm离心1min,收集rna溶液,
‑
80℃保存rna。
49.逆转录:使用transgen反转录试剂盒操作。利用提取的总rna反转录cdna,反 转录的cdna保存于
‑
20℃。
50.表1 cdna合成体系
[0051][0052]
cdna合成反应程序:42℃1h,95℃3min。
[0053]
pcr条件:采用sybr green i法实时荧光定量pcr(相对定量)进行qpcr检测, 反应体系为20μl,每体系检测2μl cdna模板。
[0054]
表2 qpcr反应体系
[0055][0056]
反应程序为:(1)94℃,30s,(2)94℃,5s,(3)61℃,35s,(4)65℃, 60s,(2)
‑
(4)40个循环。同时以gapdh为内参,结果如图3所示,使用的qpcr 引物如表3所示:
[0057]
表3 qpcr引物序列
[0058][0059]
2.2.3结论
[0060]
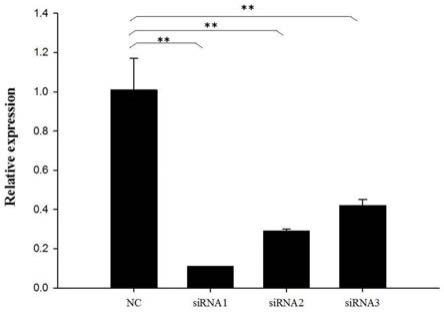
如图2所示,经sirna转染的软骨细胞中,ihh基因的mrna表达水平与未转染 sirna的软骨细胞相比显著下降(p<0.01),且sirna1干扰序列下调最为显著,因此 以sirna1为最佳干扰序列进行ihh基因功能及下游基因的检测。
[0061]
2.3sirna干扰ihh基因的下游实验
[0062]
2.3.1细胞周期检测
[0063]
将鸡软骨细胞以1
×
106个/孔的密度接种于6孔培养板中,待细胞融合度为80%时 进行转染(步骤参照2.2),转染48h后收集细胞。细胞消化后用pbs洗涤一次,离心 1500rpm,5min,去上清,加入1ml 75%乙醇固定于
‑
20℃;取固定的细胞离心8000 g,4min,用pbs洗涤一次8000g,4min;加入100μg/ml的rnase a 100μl重悬细 胞,37℃,30min。加入400μl pi
(50μg/ml)染色液混匀,置4℃,避光孵育30min, 上机检测。
[0064]
检测结果如图3所示,转染48h后,sirna组s期细胞占比为3.83%,相较于nc 组s期细胞占比为8.98%,sirna组s期细胞占比明显降低,干扰ihh基因表达,细胞 增殖减少。结果表明利用sirna干扰ihh基因表达,细胞增殖减少。
[0065]
2.3.2细胞凋亡检测
[0066]
将鸡软骨细胞以1
×
106个/孔的密度接种于6孔培养板中,待细胞融合度为80%时 进行转染(步骤参照2.2),转染48h后收集细胞。将细胞培养液吸出至一离心管内, pbs洗涤贴壁细胞一次,用不含edta的胰酶消化细胞;细胞消化下来后,加入刚收集 至离心管中的细胞培养液,稍混匀,转移到离心管内,1000g离心5min,弃上清,收 集细胞,用pbs轻轻重悬细胞并计数;取1~5
×
105重悬的细胞,1000g离心5min, 弃上清,加入500μl结合液轻轻重悬细胞;然后加入5μl annexin v
‑
fitc,轻轻混 匀后再加入5μl碘化丙啶,轻轻混匀;室温避光孵育10min;直接进行流式细胞仪检测。
[0067]
检测结果如图4所示,转染48h后,nc组细胞凋亡率为13.66%,sirna组为37.95%, ihh基因干扰后细胞凋亡增加。结果表明sirna干扰ihh基因表达,导致细胞数量减 少。
[0068]
2.3.3下游基因的qpcr检测
[0069]
将软骨细胞以1
×
106个/孔的密度接种于6孔板中,待细胞融合度为80%时进行转 染,转染方法为脂质体转染(lipofectamine
tm
2000transfection reagent),方法按照产 品说明,转染试剂与sirna的转染比例为5:1(μl/μg)。
[0070]
qpcr检测:转染48h后,收取细胞提rna,逆转录后进行pcr反应,具体如下: 提取总rna:使用trizol法提取sirna转染后的软骨细胞的总rna。
[0071]
逆转录:使用transgen反转录试剂盒操作。
[0072]
pcr条件:采用sybr green i法实时荧光定量pcr(相对定量)进行qpcr检测, 反应体系为20μl,每体系检测2μl cdna模板。反应程序为:(1)94℃,30s,(2) 94℃,5s,(3)61℃,35s,(4)65℃,60s,(2)
‑
(4)40个循环。同时以gapdh 为内参,使用的qpcr引物如表4所示:
[0073]
表4下游基因qpcr引物序列
[0074]
[0075][0076]
如图5所示,本发明的sirna干扰ihh基因后,与对照组相比,alp、col
ⅹ
、tgf
‑
β1、 wnt5a、wnt11、pthrp、jak2、bmp6的表达量均下调,其中pthrp的表达量下调显 著(p<0.05),alp、col
ⅹ
、tgf
‑
β1、wnt11、jak2的下调极显著(p<0.01);col
ꢀⅱ
的表达量上调极显著(p<0.01);wnt5a、bmp6基因表达量虽然下调,但与对照组 相比没有显著性差异(p>0.05)。
[0077]
以上实施例中细胞周期、细胞凋亡及通路基因mrna表达量结果表明:本发明的 sirna能够显著抑制软骨细胞的增殖,增加细胞的凋亡,通过影响ihh信号通路基因的 表达水平来影响鸡的匍匐性状,有助于我们更加深入地理解鸡匍匐性状形成的分子机理 和调控机制,进一步开展匍匐鸡的保种和改良工作,对畜禽重要经济性状的分子育种和 生产具有重要作用。
[0078]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并 不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人 员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发 明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

