一种提高植物抵抗逆境胁迫能力的孤基因ppdro及应用
技术领域
1.本发明属于基因工程技术领域,具体涉及一种提高植物抵抗逆境胁迫能力的孤基因ppdro及应用。
背景技术:
2.苔藓植物是陆地生境的重要组成部分,为最早登陆的绿色高等植物,是植物从水生过渡到陆生的代表。苔藓植物在植物的进化树上处于一个非常特殊的位置,它既有水生藻类旺盛的繁殖再生能力,又进化出高等植物适应陆地生存的抗逆反应机制,能经历长期干旱后迅速恢复再生,对于揭示植物抗逆形成机制和进化意义非常有价值。
3.孤基因是指在其他生物谱系中没有同源基因的基因,几乎所有生物的基因组中都存在孤基因,但是目前对植物中孤基因的功能研究还很少。
技术实现要素:
4.有鉴于此,本发明的目的在于提供一种提高植物抵抗逆境胁迫能力的孤基因ppdro(dehydrationresponse orphan gene)及应用,可通过在植物中异源表达孤基因ppdro来提高植物抗旱性。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.本发明提供了一种提高植物抵抗逆境胁迫能力的孤基因ppdro,所述孤基因ppdro的核苷酸序列包括seq idno.1所示的序列。
7.优选的,所述逆境胁迫包括干旱、nacl和aba造成的非生物胁迫。
8.本发明还提供了一种包含上述孤基因ppdro的重组表达载体。
9.优选的,所述重组表达载体包括质粒或植物表达载体。
10.本发明还提供了上述孤基因ppdro或上述重组表达载体在提高植物耐旱性中的应用。
11.本发明还提供了一种提高植物耐旱性的方法,使上述孤基因ppdro在植物基因组内表达。
12.本发明提供了一种提高植物抵抗逆境胁迫能力的孤基因ppdro,所述孤基因ppdro的核苷酸序列包括seq idno.1所示的序列。本发明所述孤基因ppdro来源于小立碗藓基因组,在小立碗藓的不同发育阶段的表达情况不同;且ppdro的表达具有发育依赖性,在配子体期表达最强;在一个光周期内,ppdro在12:00表达量最高。本发明实施例证实,在脱水复水、nacl和aba处理的小立碗藓配子体中,ppdro表达增强,而ppdro基因敲除突变体表现出耐旱性降低,提供外源aba后可以恢复ppdro基因敲除突变体的抗旱性。同时,本发明实施例还构建了拟南芥ppdro异源表达突变体,所述拟南芥ppdro异源表达突变体对aba更敏感,表现为根长受到抑制,ppdro的表达量增加,抗旱能力增强。
附图说明
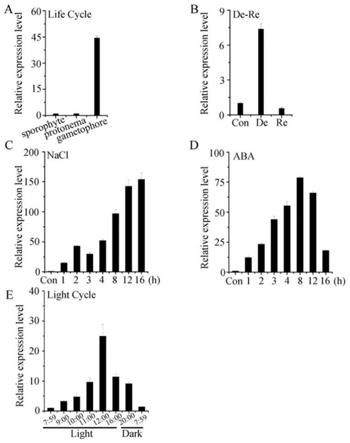
13.图1为小立碗藓ppdro表达模式,其中a:小立碗藓生命周期不同发育时期ppdro的表达模式;b:ppdro对脱水(de)和复水(re)处理响应表达模式;c:nacl处理条件下ppdro表达模式;d:aba处理条件下ppdro表达模式;e:一个光照周期内ppdro的表达模式;
14.图2为ppdro
‑
ko对脱水复水响应表型,其中a和b分别表示在正常生长条件下,ppdro
‑
ko和wt脱水复水后的复苏率(a)和脱水前后的aba含量(b);c和d分别表示aba预处理生长条件下,ppdro
‑
ko和wt脱水复水后的复苏率(c)和脱水前后的aba含量(d);图中#35和#84是ppdro
‑
ko的两个株系;
15.图3为拟南芥异源表达ppdro植株对aba的敏感性;图中col
‑
0:野生型拟南芥;35s::ppg3#11和#13:拟南芥异源表达ppdro阳性材料;a和b分别表示正常生长(a)和aba处理条件下(b)植株根长统计;
16.图4为正常生长和aba处理条件下拟南芥异源表达ppdro植株在干旱复水后ppdro的表达模式;图中ppg3为ppdro;col
‑
0:野生型拟南芥;35s::ppg3#11和#13:拟南芥异源表达ppdro阳性材料;
17.图5为ppdro正调控拟南芥的干旱响应;图中col
‑
0:野生型拟南芥,35s::ppg3#11和#13:拟南芥异源表达ppdro阳性材料;
18.图6为ppdro敲除突变体构建与鉴定图;其中a:ppdro敲除突变体(ppdro
‑
ko)构建示意图;b:在dna水平与rna水平检测ppdro
‑
ko突变体;图中g3表示dor;ppg3
‑
ko为ppdro
‑
ko突变体;
19.图7为拟南芥异源表达ppdro材料构建与鉴定图;其中a:拟南芥异源表达ppdro材料构建示意图;b和c:在dna水平与rna水平检测ppdro在拟南芥中的表达情况;图中ppg3为ppdro;col
‑
0:野生型拟南芥;35s::ppg3#11、#12和#13:拟南芥异源表达ppdro阳性材料。
具体实施方式
20.本发明提供了一种提高植物抵抗逆境胁迫能力的孤基因ppdro,所述孤基因ppdro的核苷酸序列包括seq id no.1所示的序列。本发明实施例中以来源于小立碗藓的seq id no.1所示的核苷酸序列为例,对所述孤基因ppdro的功能进行说明。本发明所述孤基因ppdro的表达具有发育依赖性,在小立碗藓的配子体期表达最强;在一个光周期内,ppdro在12:00表达量最高;而且在脱水复水、nacl和aba的小立碗藓配子体中,ppdro表达增强,因此所述孤基因可受逆境胁迫如干旱、nacl和aba造成的非生物胁迫的影响而高表达,表现出抵抗逆境胁迫的能力。
21.本发明还提供了一种包含上述孤基因ppdro的重组表达载体。
22.本发明对所述重组表达载体的构建方法并没有特殊限定,利用本领域的常规方法进行构建即可,且所述重组表达载体优选包括质粒或植物表达载体。在本发明实施例中,优选通过双酶切的方法获得所述重组表达载体,且所述重组表达载体的基础载体包括pcang
‑
gfp(南京诺唯赞生物科技股份有限公司)。
23.本发明还提供了上述孤基因ppdro或上述重组表达载体在提高植物耐旱性中的应用。
24.本发明还提供了一种提高植物耐旱性的方法,使上述孤基因ppdro在植物基因组
内表达。本发明优选利用上述孤基因ppdro构建重组表达载体pcang
‑
ppdro
‑
gfp,并将所述重组表达载体转化入植物内。本发明对所述转化方法并没有特殊限定,优选利用本领域的常规转化方法即可。
25.下面结合实施例对本发明提供的一种提高植物抵抗逆境胁迫能力的孤基因ppdro及应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
26.实施例1
27.(1)苔藓的培养方法
28.使用bcdat培养基(南京诺唯赞生物科技股份有限公司)培养苔藓,bcdat培养基配方为:b母液10ml/l,c母液10ml/l,d母液10ml/l,tes母液1ml/l,酒石酸铵5mm/l,琼脂9g/l,其中b母液配方:mgso4·
7h2o25g/l;c母液配方:kh2po425 g/l,用4m koh调节ph至6.5;d母液配方kno3101 g/l,feso4·
7h2o 1.25g/l;tes母液:cuso4·
5h2o 55mg/l,h3bo3614 mg/l,cocl2·
6h2o 55mg/l,na2moo4·
2h2o 25mg/l,znso4·
7h2o 55mg/l,mncl2·
4h2o 389mg/l,ki 28mg/l。从培养5~6天的原丝体材料打磨继代后于14h光照/10h黑暗的光周期,500μmol m
‑2s
‑1的光照强度,25℃条件下培养40天,进入均一的配子体世代。
29.(2)用于ptn182缺失突变体创建的载体构建
30.根据图6所示流程构建ppdro敲除突变体载体:ctab法提取小立碗藓总dna(下同);使用南京诺唯赞公司的高保真聚合酶:phata master(p505)进行pcr扩增,体系(50μl):f(10μm)1μl,r(10μm)1μl,phata master1μl,2*buffer 25μl,dntp 1μl,h2o 1μl。使用伯乐t100pcr仪,程序:95℃预变性5min;95℃变性20s,59℃退火30s,72℃延伸1min(扩增效率1kb/min),35个循环;72℃延伸5min,4℃保存,下同。
31.使用引物对up
‑
f(seq id no.2):gtcgacagggcggatgggataga,up
‑
r(seq id no.3):aagcttctgttgctgaggaagatggta,和
32.down
‑
f(seq id no.4):cccgggacggggactgacaacctct,down
‑
r(seq id no.5):ggatccccttggatgctagtcctctga做pcr扩增,分别获取构建缺失突变体的上游同源重组片段和下游同源重组片段。并将目的片段pcr产物纯化与回收;同源重组上游片段连接至ptn182载体sali/hindiii酶切位置处。转化同源重组产物至top10感受态细胞涂lb kana平板,37℃培养过夜,使用引物对up
‑
f和up
‑
r对菌落进行pcr检测,取阳性菌落,摇菌,提质粒,测序;将测序阳性样质粒用smai/bamhi进行双酶切,回收目的载体片段;同源重组下游同源重组片段至ptn182载体上,转化同源重组产物至top10感受态细胞涂lb kana平板,37℃培养过夜,pcr检测长的菌落,取阳性菌落,摇菌,提质粒,测序,测序阳性为构建成功的ppdro敲除突变体载体。
33.(3)小立碗藓ptn182
‑
ppdro
‑
缺失突变体的获得
34.选用聚乙二醇(peg)介导的dna引入原生质体的方法(参考日本nibb实验室,http://moss.nibb.ac.jp/protocol.html),将ppdro敲除突变体载体转化到小立碗藓的原生质体中。
35.(4)pcang
‑
ppdro
‑
gfp表达载体构建
36.根据图7所示流程构建拟南芥异源表达ppdro材料:trizol法提取小立碗藓总rna,利用invitrogen的反转录试剂盒反转录合成cdna。
37.使用引物进行pcr扩增(体系20μl:f(10μm)0.4μl,r(10μm)0.4μl,sbyr10μl,
template(cdna/dna)2μl,ddh2o 7.2μl。使用伯乐t100pcr仪,程序:95℃预变性5min;95℃变性10s,60℃退火15s,72℃延伸15s,40个循环;72℃延伸5min,4℃保存。下同),获得ppdro的cds片段;ppdro cds目的片段纯化与回收;使用xbai/kpni双酶切pcang
‑
gfp质粒,回收目的载体片段;同源重组ppdro cds片段至pcang
‑
gfp载体上,转化同源重组产物至top10感受态细胞涂lb kana平板,37℃培养过夜,pcr检测长的菌落,取阳性菌落,摇菌,提质粒,测序,测序阳性样为构建成功的pcang
‑
ppdro
‑
gfp表达载体。
38.引物:pp3c3
‑
gf(seq id no.6):atgaagaaatcgaaagagttggtc;
39.pp3c3
‑
gr(seq id no.7):tgaatcaccgattctaggactc
40.(5)异源表达ppdro拟南芥植株的获得
41.用5%的蔗糖溶液100ml加5μl的silwet l
‑
77配置重悬液,重悬pcang
‑
ppdro
‑
gfp表达载体,制备菌体重悬液。把拟南芥花絮浸入菌体重悬液中0.5~1min。将侵染后的拟南芥平放,避光过夜。24小时后将拟南芥竖起,正常培养至收种。播种收获的种子,取生长起来的拟南芥叶片,提取dna进行pcr鉴定,另一部分提取rna进行qrt
‑
pcr鉴定。阳性样收种,培养收获的种子,获得异源表达ppdro的拟南芥。
42.(6)野生型脱水复水、nacl或aba处理用于检测ppdro表达的方法
43.用正常培养25℃,16h光照/8h黑暗的光周期下生长约三周的野生型配子体材料进行胁迫处理。
44.脱水复水:将配子体材料从培养基上拔出来,去除根上的培养基,放在新的空培养皿上,置于培养配子体的培养箱中,脱水2h,取一半样品为脱水样品(de),同时取未处理样做对照(ck);剩余一半样品中加入无菌水,进行复水处理2h,吸干水份取样为复水样品(re),用于提取rna。
45.nacl处理:将配子体材料从培养基上拔出来,去除根上的培养基,放入浓度为0.5m的nacl溶液中处理,分别取处理0h、1h、2h、3h、4h、8h、12h、16h的样品,用于提取rna。
46.aba处理:将配子体材料从培养基上拔出来,去除根上的培养基,放入浓度为0.1m的aba溶液中处理,分别取处理0h、1h、2h、3h、4h、8h、12h、16h的样品,用于提取rna。
47.光周期样品:取对应于nacl和aba处理0h、1h、2h、3h、4h、8h、12h、16h时间点的未处理样品,用于提取rna。
48.(7)野生型和ppdro敲除突变体(ppdro
‑
ko)脱水复水处理用于表型统计
49.将野生型和ppdro敲除突变体配子体材料从培养基上拔出来,去除根上的培养基,分别放在新的空培养皿上,置于灭菌超净台中,脱水2h,复水处理2h,吸干水份取样为复水样品,移栽至新的bcdat培养基中,放培养箱培养,观察统计表型。
50.(8)小立碗藓aba含量测定
51.取新鲜小立碗藓配子体材料,液氮研磨,加入1ml预冷的乙酸乙酯,乙酸乙酯中加入aba内标样品,震荡混匀,4℃,12000rmp离心15min;吸取上清于新的1.5ml ep管,冻干;向每个冻干样中加入100μl的70%甲醇溶液,溶解沉淀;吸取溶解液至干净的测定管中,待测定;利用hplc
‑
ms/ms法测定aba含量。
52.小立碗藓ppdro表达模式如图1所示,对生长3周的配子体材料进行脱水(de)、复水(re)、0.5m nacl或0.1maba处理;在测定时以内参基因,采用qrt
‑
pcr检测ppdro在不同条件下的相对表达量。可见ppdro的表达具有发育依赖性,在配子体期表达最强;在一个光周期
内,ppdro在12:00表达量最高;在脱水复水、nacl和aba处理的小立碗藓配子体中,ppdro表达增强。
53.内参:pube2
‑
rt
‑
f(seq id no.8):tacggaccctaatccagatgac;
54.pube2
‑
rt
‑
r(seq id no.9):caacccattgcatacttctgag。
55.在无菌条件下,将在bcdat培养基上生长3周的配子体材料从培养基上拔出,放在玻璃皿中脱水2h,然后复水2h,吸去多余水份后,移植至新的bcdat培养基中生长,观察表型。结果如图2所示,正常生长条件下的配子体经过脱水复水处理后,ppdro
‑
ko的复苏率较野生型(wt)植株明显降低。在脱水处理前,ppdro
‑
ko#35和#84中aba的含量为0.420ng/g和0.369ng/g,wt中aba含量为1.084ng/g。在脱水处理后,ppdro
‑
ko#35和#84中aba的含量为4.199ng/g和3.845ng/g,wt中aba含量为6.312ng/g。ppdro
‑
ko与wt中aba含量在脱水处理前后都比较低,而且在两种材料中aba含量没有显著差异。aba预处理生长条件下的配子体在脱水复水处理后,ppdro
‑
ko和wt的复苏率都达100%。aba预处理条件下,脱水处理前,ppdro
‑
ko#35和#84中aba的含量为109.735ng/g和101.176ng/g,wt中aba含量为131.046ng/g。在脱水处理后,ppdro
‑
ko#35和#84中aba的含量为203.466ng/g和239.891ng/g,wt中aba含量为322.136ng/g。aba预处理可显著提高ppdro
‑
ko和wt配子体中aba含量;与野生型相比,ppdro
‑
ko突变体的aba含量略低,但这并不影响其脱水复水后的复苏率。复苏率统计时,每个样用100株配子体,三次重复,#35和#84是ppdor
‑
ko的两个株系。
56.拟南芥异源表达ppdro植株对aba的敏感性如图3所示,在对照处理中,对照组的根长约为10.067cm,拟南芥异源表达ppdro植株#11和#13的根长都是9.850cm。经过aba处理后,野生型拟南芥的根长7.867cm,拟南芥异源表达ppdro植株#11根长为3.00cm,#13根长2.833cm。与野生型相比,异源表达ppdro的拟南芥根长受到抑制,对aba更敏感。
57.正常生长和aba处理条件下拟南芥植株中ppdro的表达如图4所示。野生型拟南芥在空白处理下和aba处理下ppdro的相对表达量在1左右。拟南芥异源表达ppdro植株中,正常生长条件下ppdro的相对表达量低于aba处理下的相对表达量。
58.经干旱复水处理后,拟南芥存活如图5所示,存活率统计经过三次重复实验,每次实验有12个小盆,分别有36株材料,正常拟南芥存活率为16.67
±
2.48%,而拟南芥异源表达ppdro植株#11的存活率为44.40
±
2.42%,拟南芥异源表达ppdro植株#13的存活率为48.13
±
0.81%。
59.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

