stxbp1突变动物模型的构建及其应用
技术领域
1.本发明属于生物医药领域,具体地,本发明涉及stxbp1突变动物模型的构建及其应用。
背景技术:
2.早期婴儿癫痫性脑病(eiee)又被称为大田原综合征,是一种剧烈的儿童癫痫病,通常伴随有stxbp1基因的突变。它的特征是肌肉痉挛,顽固性癫痫发作,脑电图(eeg)波抑制爆发型,严重精神病和运动障碍。迄今为止,在eiee 患者中已鉴定出数百种stxbp1杂合突变。小鼠stxbp1编码突触前蛋白munc18-1,该蛋白与其“关闭”状态的伴侣蛋白syntaxin-1结合以相互促进稳定,并与“打开”状态的syntaxin-1蛋白和snare复合物相互作用,以加快snare介导的递质释放和突触小泡的膜融合的速率。然而,携带stxbp1突变的小鼠表现出相对轻微的表型,例如焦虑和肌肉痉挛,并没有观察到严重的癫痫发作和在婴儿患者中出现的典型的爆发抑制脑电模式。
3.crispr/cas9编辑方法已用于多种神经疾病(例如睡眠障碍,自闭症谱系障碍和帕金森氏病)非人灵长类模型的构建。crispr/cas9可介导dna序列的插入或缺失(indels),但许多遗传疾病携带的是点突变而不是indel。
4.因此,本领域迫切需要开发一种能够表现出eiee的行为和eeg表型的非人类灵长类动物模型,该模型可用于研究其发病机理和开发治疗方法。
技术实现要素:
5.本发明的目的是提供一种能够表现出eiee的行为和eeg表型的非人类灵长类动物模型,该模型可用于研究其发病机理和开发治疗方法。
6.本发明另一目的在于提供了一种获得癫痫灵长类模型的sgrna和编辑编辑器的载体组合;提供了构建好的非人灵长类癫痫模型,该模型可被用于临床药物开发。
7.本发明第一方面提供了一种非人哺乳动物的早期婴儿癫痫性脑病动物模型的制备方法,所述方法包括以下步骤:
8.(a)提供非人哺乳动物的细胞,对所述细胞中的stxbp1基因进行点突变,从而得到stxbp1基因点突变的细胞;
9.(b)利用步骤(a)中得到的stxbp1基因点突变的细胞,制备具有stxbp1基因点突变的动物模型;
10.其中,在所述的动物模型中,stxbp1基因点突变是杂合型。
11.在另一优选例中,所述的stxbp1基因点突变包括:将stxbp1蛋白的第292 位的氨基酸r突变为选自下组的一种或多种氨基酸所形成的点突变:his(h)、 lys(k)。
12.在另一优选例中,所述的stxbp1基因点突变包括:将stxbp1蛋白的第292 位的氨基酸r突变为h。
13.在另一优选例中,所述stxbp1基因点突变是将stxbp1蛋白的292位的氨基酸r突变
为h。
14.在另一优选例中,所述stxbp1基因点突变是将seq id no.:1中的第292位 r突变为h。
15.在另一优选例中,所述stxbp1蛋白来源于非人灵长类动物,较佳地,来源于猴或黑猩猩,更佳地,来源于食蟹猴。
16.在另一优选例中,所述非人哺乳动物包括非人灵长类动物。
17.在另一优选例中,所述非人灵长类动物包括猴、黑猩猩。
18.在另一优选例中,在步骤(a)中,将含有碱基编辑器(如胞嘧啶碱基编辑器)的编码序列和grna的载体注射入所述细胞,从而对所述细胞中的内源stxbp1基因进行定点突变。
19.在另一优选例中,所述步骤(b)中得到的非人哺乳动物模型中,与野生型对照动物相比,具有以下一个或或多个特征:
20.(a)表现出了癫痫行为和eiee的典型eeg表型;
21.(b)出现了痉挛的早期发作;
22.(c)显示典型的爆发-抑制模式,以及发作间期癫痫样放电;
23.(d)a1脑电谱中低频振荡的频率明显更高;
24.(e)降低脑中syntaxin-1和munc18-1的表达水平。
25.本发明第二方面提供了一种本发明第一方面所述方法制备的非人哺乳动物模型的用途,将该模型被用作研究早期婴儿癫痫性脑病的动物模型。
26.本发明第三方面提供了一种本发明第一方面所述方法制备的非人哺乳动物模型的用途,将该模型被用于筛选或鉴定可减轻或治疗早期婴儿癫痫性脑病的物质 (治疗剂)。
27.本发明第四方面提供了一种筛选或鉴定治疗或缓解早期婴儿癫痫性脑病的潜在治疗剂的方法,包括以下步骤:
28.(a)在测试组中,在测试化合物的存在下,将测试化合物施用于本发明第一方面所述方法制备的非人哺乳动物模型,对测试组的所述动物模型的表型进行分析;并且在不施用所述测试化合物且其他条件相同的对照组中,对对照组的所述动物模型的表型进行分析;
29.(b)对测试组和对照组动物模型的行为进行比较,其中,与对照组相比,如果施用了测试化合物的动物模型中表征早期婴儿癫痫性脑病的表型得到改善,则表明该测试化合物可作为早期婴儿癫痫性脑病的潜在治疗剂。
30.在另一优选例中,所述早期婴儿癫痫性脑病的表型选自下组:脑电症状、 syntaxin-1和munc18-1的表达水平、snare复合物的表达水平、或其组合。
31.在另一优选例中,所述脑电症状包括:痉挛的早期发作、典型的爆发-抑制模式、发作间期癫痫样放电、尖峰发作源的转移、低频振荡的频率。
32.在另一优选例中,所述发作间期癫痫样放电包括偶发性尖峰,双峰尖峰波,检票口尖峰,聚尖峰,重复性有节奏的尖峰和缓慢的尖峰。
33.在另一优选例中,所述尖峰发作源的转移包括发作源在额,颞和枕骨区域之间的转移。
34.在另一优选例中,所述表型得到改善包括:脑电症状的减轻、和/或抽搐症状的减轻。
35.在另一优选例中,所述脑电症状减轻包括:低频振荡的频率明显降低、痉挛的早期发作消失、典型的爆发-抑制模式消失、发作间期癫痫样放电消失、尖峰发作源的转移消失。
36.在另一优选例中,所述的方法是非诊断性和非治疗性的。
37.在另一优选例中,所述方法包括步骤(c),将步骤(b)筛选或鉴定的潜在治疗剂施用于本发明第一方面所述方法制备的非人哺乳动物模型,从而测定其对所述动物模型的表型的影响。
38.在另一优选例中,所述改善是在统计学上具有显著性意义的改善。
39.本发明第五方面提供了一种非人哺乳动物模型,用本发明第一方面所述方法制备。
40.在另一优选例中,对于stxbp1基因点突变而言,所述的非人哺乳动物模型是杂合型的。
41.本发明第六方面提供了一种细胞的用途,其特征在于,所述细胞中的stxbp1 基因发生点突变,用于制备构建非人哺乳动物的早期婴儿癫痫性脑病动物模型的生物制剂。
42.在另一优选例中,所述点突变为杂合型。
43.在另一优选例中,所述生物制剂为液态制剂。
44.在另一优选例中,所述的stxbp1基因的点突变包括:将stxbp1蛋白的第292 位的氨基酸r突变为选自下组的一种或多种氨基酸所形成的点突变:his(h)、 lys(k)。
45.在另一优选例中,所述的stxbp1基因的点突变包括:将stxbp1蛋白的第292 位的氨基酸r突变为h。
46.在另一优选例中,所述stxbp1基因的点突变是将stxbp1蛋白的292位的氨基酸r突变为h。
47.在另一优选例中,所述stxbp1基因的点突变是将seq id no.:1中的第292 位r突变为h。
48.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例) 中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
49.图1显示了碱基编辑器在胚胎中的编辑结果。(a)sgrna和stxbp1基因示意图(上),cos7细胞系的sanger测序结果(中)和胚胎的sanger测序结果(下); (b)t7en1酶切结果;(c)胚胎深度测序结果;(d)胚胎深度测序结果显示indel 水平;(e)logo图展示两只出生猴的碱基转换比例;(f)耳朵,脐带和胎盘中出生猴的编辑效率;(g)耳朵,脐带和胎盘中出生猴的indel水平;(h)a2猴各个组织中的编辑效率和indel水平。
50.图2显示了eeg结果。(a)a1猴和野生猴eeg结果和地形图;(b)a1猴和野生猴频谱图;(c)频谱图展示说明癫痫猴低频脑电能量高于野生猴;(d)带脑电帽猴子的照片展示。
51.图3显示了癫痫猴突触相关蛋白水平的变化。(a)免疫印迹展示癫痫猴突触相关蛋白水平降低;(b)sanp25免疫印迹展示癫痫猴突触复合体水平降低;(c) 定量结果展示。
52.图4显示了出生猴嵌合体分析结果。
53.图5显示了碱基编辑器在流产猴中的编辑结果。(a)b1流产猴各个组织的编辑效率
和indel水平;(b)b2流产猴各个组织的编辑效率和indel水平;(c) b3流产猴各个组织的编辑效率和indel水平。
54.图6显示了显示了癫痫样波和大脑状态。(a)癫痫波波幅和计数;(b)癫痫波计数;(c)野生猴眨眼时eeg波形图;(d)野生猴眨眼时eeg地形图;(e) a1猴睁眼和闭眼的波形图。
55.图7显示了r292h突变影响蛋白结合。(a)免疫共沉淀载体示意图;(d) 免疫共沉淀结果;(c)免疫共沉淀定量结果。
56.图8显示了免疫印迹结果表明癫痫猴突触复合体水平降低。(a)syntaxin-1a 免疫印迹展示癫痫猴突触复合体水平降低;(b)定量结果展示。
57.图9显示了流产猴snp分析。(a)新生snp比例分析;(b)新生snp统计; (c)logo图展示snp位点序列偏好性;(d)父母猴和新生猴snp比例分析;(e) snp统计。
58.图10显示了脱靶位点igv的展示。
59.图11显示了测序验证脱靶位点。
具体实施方式
60.本发明人经过广泛而深入地研究,利用crispr-cas系统构建stxbp1基因 r292h靶向单碱基突变质粒,继而得到stxbp1-r292h点突变的哺乳动物细胞,通过将体外合成的sgrna和碱基编辑器mrna注射入猴胚胎中,从而获得 stxbp1-r292h点突变的杂合猴。本发明成功建立的stxbp1-r292h点突变杂合猴,能表现出早期婴儿癫痫性脑病的癫痫行为和eiee的典型eeg表型,在此基础上完成了本发明。
61.术语
62.如本文所用,术语“本发明的模型动物”、“本发明的早期婴儿癫痫性脑病模型”等可互换使用,指出具有stxbp1的定点突变(尤其是r292h点突变)的杂合的非人灵长类动物(如猴、黑猩猩)。
63.如本文所用,术语“点突变r292h”、“点突变292位r
→
h”等可互换使用,指在stxbp1蛋白在对应于seq id no.:1中所示的氨基酸序列的第292位发生了从r(arg)向h(his)的突变。在基因水平,该突变是在stxbp1基因上第875位g 突变为a(g875a)。
64.stxbp1基因及其蛋白
65.如本文所用,术语“stxbp1”、“突触前syntaxin结合蛋白1”、“syntaxinbinding protein 1”可互换使用,均代指stxbp1基因或编码蛋白。
66.突触前syntaxin结合蛋白1(stxbp1)是神经递质释放所必需的基因,是 syntaxin蛋白的结合蛋白,通过和“打开”和“关闭”状态下的syntaxin蛋白结合可以介导突触囊泡和细胞膜的融合,进而介导神经递质的释放。
67.在本发明中,碱基编辑了体外受精胚胎,产生了携带stxbp1(r292h)突变的食蟹猴。这些stxbp1编辑的猴子表现出了癫痫行为和eiee的典型eeg表型,而这些表型在stxbp1缺失小鼠模型中没有观察到。本发明对这些猴子的脑活检样品的蛋白质印迹分析发现,stxbp1(r292h)突变可导致snare复合物形成不足。因此,碱基编辑的stxbp1突变猴可作为eiee良好的动物模型,而碱基编辑方法可用于获得人类遗传疾病的非人类灵长类动物模型。
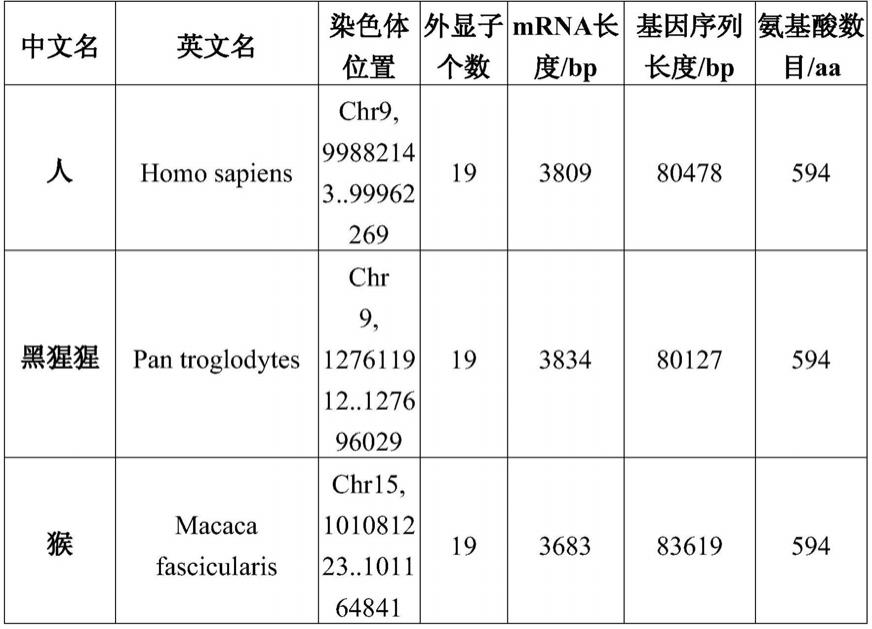
68.stxbp1存在于许多不同的物种,尤其在哺乳动物中是高度同源的,长度也基本上
为594个氨基酸(表a,和表b)。人stxbp1基因(登录号为nc_000009.12) 位于人类基因组chr9:99882143-99962269上,全长80478bp。
69.表a stxbp1基因和蛋白
[0070][0071]
表b stxbp1蛋白的同源性
[0072] 人黑猩猩猴人100%100%100%黑猩猩100%100%100%猴100%100%100%
[0073]
猴、黑猩猩、人的stxbp1的氨基酸序列相同,均如seq id no.:1所示。
[0074]
早期婴儿癫痫性脑病(eiee)
[0075]
早期婴儿癫痫性脑病(eiee)又被称为大田原综合征,是一种剧烈的儿童癫痫性脑病。癫痫性脑病(ee)是一类复杂的并难以准确定义的疾病,ee的病因和严重程度千差万别。广义上,ee是大脑神经元突发性异常放电,导致短暂的大脑功能障碍的一种慢性疾病。eiee是特指发病早,在婴儿期就能被观察到的 ee,它的特征是肌肉痉挛,顽固性癫痫发作,脑电图(eeg)波抑制爆发型,严重精神病和运动障碍,难治性。eiee已经被证明与很多基因的突变有关。
[0076]
动物模型
[0077]
人类疾病的动物模型(animal model of human disease)是指各种医学科学研究中建立的具有人类疾病模拟表现的动物,按产生原因分类自发性动物模型和诱发性或实验性动物模型。
[0078]
自发性动物模型(spontaneous animal models)是指实验动物未经任何有意识的人工处置,在自然情况下所发生的疾病。包括突变系的遗传疾病和近交系的肿瘤疾病模型。
利用这类动物疾病模型来研究人类疾病的最大优点,在于疾病的发生、发展与人类相应的疾病很相似,均是在自然条件下发生的疾病,具有更高的应用价值,但是这类模型来源较困难。
[0079]
在本领域中,通过crispr-cas9技术而使靶基因定点突变的技术是已知的,这些常规技术都可用于本发明。
[0080]
在本发明中,提供了一种能够不需要药物造模的非人哺乳动物模型,该动物模型可以在早期尤其是猴子出生后2周内就开始自发出现早期婴儿癫痫性脑病 (eiee),比如痉挛的早期发作,并且在猴子出生后3至7个月内a1的头皮脑电图记录显示典型的爆发-抑制模式,以及发作间期癫痫样放电,包括偶发性尖峰,双峰尖峰波,检票口尖峰,聚尖峰,重复性有节奏的尖峰和缓慢的尖峰。
[0081]
在本发明中,非人哺乳动物的例子包括(但并不限于):猴、黑猩猩等,更佳地是猴。
[0082]
在本发明中,可以通过定点突变方法,在“stxbp1”中引入r292h定点突变,从而获得含stxbp1r292h定点突变的杂合猴(如食蟹猴)。
[0083]
在本发明的一个优选实施例中,本发明进行了胚胎移植,来获得基因编辑的猴子。本发明总共将45个注射的胚胎转移到16个代孕母亲中。妊娠和着床率分别为31%(5/16代孕)和16%(7/45个胚胎)(表1)。本发明获得了两个活猴(一个雄性a1和一个雌性a2),以及五个流产的胎儿(b1至b5),其中三个被收集到用于分析(表1)。用来自活产猴a1和a2的耳朵,脐带和胎盘组织来进行深度测序进而检测基因型。结果表明,这两只猴子在所有被用来检测的组织中都具有r292h突变,频率约为(图1e,f),并且未检测到indel(图1g)。
[0084]
表1
[0085]
移植胚胎数怀孕数/受体数胎儿数流产数出生数455/16(31%)752编号性别是否收集到组织流产或出生编辑效率a1雄是出生~55%a2雌是出生~55%b1雄是85天流产~99%b2雄是112天流产~96%b3雄是143天流产~96%b4-否112天流产-b5-否112天流产-[0086]
动物模型的构建
[0087]
在本发明一个优选例中,利用crispr-cas系统构建stxbp1基因r292h靶向定点突变质粒,继而得到stxbp1-r292h点突变细胞,从而获得stxbp1-r292h点突变杂合型猴。
[0088]
在一个优选例中,本发明提供了一种猴子stxbp1基因靶向突变的sgrna序列: tgtggcgcagtgctatccac(seq id no.:2)。
[0089]
本发明的主要优点包括:
[0090]
(a)本发明的早期婴儿癫痫性脑病(eiee)非人灵长类动物模型,通过对stxbp1基因的r292h点突变,繁育获得了杂合型stxbp1基因点突变猴。
[0091]
(b)本发明的早期婴儿癫痫性脑病(eiee)非人灵长类动物模型可表现出 eiee的
行为和eeg表型,而这些表型在先前的小鼠模型中没有被观察到。
[0092]
(c)本发明的动物模型可以在早期尤其是猴子出生后2周内就开始自发出现早期婴儿癫痫性脑病(eiee),比如痉挛的早期发作,并且在猴子出生后3至7个月内a1的头皮脑电图记录显示典型的爆发-抑制模式,以及发作间期癫痫样放电,包括偶发性尖峰,双峰尖峰波,检票口尖峰,聚尖峰,重复性有节奏的尖峰和缓慢的尖峰。
[0093]
(d)本发明的动物模型的组织中都具有r292h突变,频率约为并且未检测到indel。
[0094]
(e)本发明的动物模型的脑中syntaxin-1a和synatixin 1b的水平显着降低。
[0095]
(f)本发明的动物模型可用于研究其发病机理和开发治疗方法。
[0096]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(new york:coldspring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。本发明中所涉及的实验材料和试剂如无特殊说明均可从市售渠道获得。
[0097]
实施例1通过碱基编辑在细胞和猴胚胎中产生致病性突变
[0098]
本发明选择10号外显子中的r292h突变(c.875g>a,p.arg292his)作为靶向位点,因为它可被胞嘧啶碱基编辑器(cbe)编辑。首先构建了针对stxbp1 的875g位点的sgrna,共转表达碱基编辑器a3a(ha3a-be3-y103f)和sgrna (sgr292h)的质粒到cos-7细胞中,进而测试了cbe对stxbp1的编辑效率(图 1a)。
[0099]
将碱基编辑器a3a和靶向stxbp1(875g)的sgrna注入1细胞胚胎,并通过t7en1酶切和深度测序对13个囊胚期胚胎进行基因分型(图1a,b)。发现所检测的13个胚胎中有12个显示出预期的stxbp1单碱基编辑效果(图1c),其中一个有13.2%indel水平(图1d)。这些结果与在cos-7细胞中的结果一致。因此,a3a介导的碱基编辑能有效编辑猴胚胎。
[0100]
实施例2通过碱基编辑获得突变猴
[0101]
然后进行了胚胎移植,来获得基因编辑的猴子。总共将45个注射的胚胎转移到16个代孕母亲中。妊娠和着床率分别为31%(5/16代孕)和16%(7/45 个胚胎)(表1)。我们获得了两个活猴(一个雄性a1和一个雌性a2),以及五个流产的胎儿(b1至b5),其中三个被收集到用于分析(表1)。用来自活产猴a1和a2的耳朵,脐带和胎盘组织来进行深度测序进而检测基因型。结果表明,这两只猴子在所有被用来检测的组织中都具有r292h突变,频率约为(图1e,f),并且未检测到indel(图1g)。
[0102]
由于严重的癫痫样痉挛,基于动物伦理和福利方面的考虑在出生后5天对猴子a2实施了安乐死。来自该猴子(包括大脑)的多个组织的基因型鉴定结果显示具有高频率(55%)的r292h突变(图1h)。对单细胞成纤维细胞的克隆的镶嵌分析表明,杂合的r292h突变占据了a1和a2的主要基因型(分别为 96.7%和85.7%)(图4)。
[0103]
还收集了来自三个流产胎儿(b1,b2和b3)的多个组织(脑,心脏,肝,肺,肠,皮肤,肌肉和性腺)来进行基于扩增自测序的stxbp1突变的深度测序分析。我们发现,这些胎儿组织的r292h突变率(在所有组织中平均为99 %,b1;96%,b2;96%,b3,均高于活猴组织)(图5a,b和c)。
[0104]
b2还包含一个平均效率为7%的indel(图5b),这结果与在胚胎中的碱基编辑结果
一致。我们的结果与以下发现相符,eiee患者携带杂合的突变,而纯合的stxbp1突变会导致人类和小鼠模型的致死性。这些结果表明,本发明可以在猴胚胎中实现有效的a3a编辑,并且stxbp1的完全纯合突变可能导致致命阶段的致死性。
[0105]
实施例3碱基编辑的猴子模拟了核心的脑电症状
[0106]
eiee患者表现出典型的爆发-抑制脑电模式,称为去同步波,这种现象通常在eiee婴儿的强直性痉挛发作期间观察到。但是,这种癫痫样脑电图在小鼠模型中找不到。在碱基编辑的猴子中,两个出生猴在产后两周内出现了痉挛的早期发作。产后3至7个月内a1的头皮脑电图记录显示典型的爆发-抑制模式(图2,a和d,图6e),以及发作间期癫痫样放电,包括偶发性尖峰,双峰尖峰波,检票口尖峰,聚尖峰,重复性有节奏的尖峰和缓慢的尖峰。因此,经过碱基编辑的猴子a1模拟了eiee的核心eeg模式。为了检查癫痫的发病进展,我们在产后3到5个月内每两周记录一次a1的头皮脑电图(图6a和b)。使用高密度头皮脑电图的地形图(topomaps)分析了a1大脑中可能的癫痫发作源(图 2a,图6c和d)。有趣的是,我们发现潜在的发作源在不同的监测日或同一天的数十分钟内在额,颞和枕骨区域之间转移(图2a,图6a,b,c和d)。在人类癫痫患者中也观察到了尖峰发作源的转移,但是在癫痫的小鼠模型中却没有。除了变化的尖峰信号源外,我们发现与年龄匹配的未编辑野生型猴子相比,stxbp1编辑的猴子a1脑电谱中低频振荡的频率明显更高(图2,b和c)。
[0107]
实施例4 r292h突变降低syntaxin-1和munc18-1的表达水平
[0108]
为了进一步探索eiee中stxbp1r292h突变蛋白的潜在机制,本发明使用 hek293细胞,通过转染表达stxbp1蛋白,stxbp1(r292h)蛋白和syntaxin-1a 蛋白的载体的方法,进行了免疫共沉淀实验(图7a),发现这种临床致病突变破坏了syntaxin-1a与munc18-1的相互作用(图7b和c)。此外发现与年龄匹配的野生型流产猴相比,来自a2(编辑效率)和b3(编辑效率)的脑样本中syntaxin-1a和synatixin 1b的水平显着降低,而其他突触小泡相关蛋白的水平保持不变(图3,a和c)。与syntaxin-1a和syntaxin-1b 表达的减少相一致,a2和b3中的munc18-1水平也显着降低,支持了stxbp1 在稳定syntaxin-1/munc18-1复合物和稳定syntaxin-1/munc18-1中起作用的观点。值得注意的是,r292h突变对syntaxin-1和munc18-1水平的影响在杂合a2中可检测到,但在stxbp1 /-小鼠中未检测到。由于eiee患者携带杂合突变,因此syntaxin-1的异常表达可能在eiee患者中起关键作用。事实上,使用具有杂合stxbp1突变的诱导多能干细胞进行的研究表明了 syntaxin-1和muc18-1的表达降低了。所以,stxbp1突变的作用是特异性的,因为其他突触小泡相关蛋白(如vamp2和snap25)不受影(图3,a和c)。
[0109]
syntaxin-1是snare复合物的核心成分,进一步的蛋白质印迹结果表明, snare复合物的水平受到stxbp1的r292h突变的严重影响(图3,b和c,图 8)。与stxbp1突变的啮齿类动物不同,b3脑的裂解物中没有明显的snare复合物(图3,b和c,图8,a和b)。这些结果支持这样的观点,即猴子中stxbp1 的杂合r292h突变通过降低syntaxin-1的水平来减少snare复合物,从而导致eiee样表型。
[0110]
实施例5 a3a碱基编辑器诱导产生随机突变
[0111]
最近的研究报告了动植物中cbe诱导的脱靶突变的频率很高。为了检查这种脱靶效应,本发明对来自两个流产的胎儿b1和b2及其父母的样本进行了平均深度约为50倍的基因组测序(wgs)(表2)。总体而言,在b1和b2(图 9b和表3)中检测到了9,714和8,716新生snp
(不包括从其父母那里继承的 snp),其中c/g至t/a突变的比例分别为57%和59%的(图9a和b)。后者的频率显着高于其父母所观察到的频率(平均为36%,n=4,图9d和e)。此外,c/g-to-t/a的新生snp及其相邻序列显示出对tc序列的偏好(图9c),这与脱靶编辑是胞嘧啶脱氨酶依赖性的发现相符。对于所有新生snp和 7257 sgrna预测的脱靶位点(表4),本发明分别鉴定并测序了三个提前终止的密码子和三个脱靶突变(图10a,图10b和图11)。但是发现所有这6个突变都位于基因间(2),内含子(1)或外显子(3)区域中,这些区域以前与癫痫表型无关。因此,猴胚胎的cbe编辑确实产生了大量的脱靶突变,但是这些脱靶效应不可能与本发明中发现的eiee表型有关。
[0112]
表2全基因组测序汇总
[0113][0114]
表3猴子snp汇总
[0115][0116]
表4脱靶位点预测分析
[0117][0118]
讨论
[0119]
本发明使用碱基编辑方法在食蟹猴胚胎中引入了stxbp1基因的特定突变,并产生了两只活体猴,它们的表型类似于与难治性婴儿癫痫性eeee相关的症状,包括癫痫发作和典型脑电图模式。本发明发现所有自然流产的stxbp1编辑的猴子胎儿都在目标位点发生了纯合突变,并且两只活产猴子均发生了杂合突变,这与eiee患者都携带杂合突变的发现相符。相反,携带杂合突变的小鼠没有显示典型的eiee表型。stxbp1基因编辑的猴子的脑组织的蛋白质印迹分析证实stxbp1,syntaxin-1和snare复合物的水平降低。由于目前没有有效的药物可用于治疗eiee,因此,显示出清晰的eiee样症状的这类非人类灵长类动物模型的产生对于开发这种顽固性疾病的治疗方法可能是有用的。
[0120]
本发明的发现表明,下一代的eiee猴子模型应产生具有确定杂合突变。在这项研究中,本发明获得了具有杂合突变的活产,比例约为28%(2/7胎儿)。通过进一步完善cbe剂量或开发用于单等位基因碱基编辑的新方法(例如将已编辑的原核转移至未编辑的半去核合子),可以增加这种可能性。尽管该研究中的a3a基础编辑具有大量的脱靶作用,例如有高
比例c/g-to-t/a新生 snp,但确定的3个外显子突变似乎均未位于与癫痫相关的基因座上。
[0121]
eiee猴子模型为研究灵长类动物癫痫的发展提供了独特的机会。值得注意的是,突变猴a1中的spike源随时间动态变化模拟了癫痫患者中主要发作发作区的动态变化。这种动态变化可能导致手术失败,该手术只能去除已确定的发作部位,因为其他位点在手术后可能会占优势。使用特定大脑区域内的硬脑膜下脑电图电极或立体脑电图电极对猴子模型中的脑电图动力学进行进一步研究,可能有助于定义脑电图动力学的规律性,并更准确地识别可能与癫痫发作区不同的真正的致癫痫的症状区。此外,癫痫的猴子模型可能对使用闭环电刺激开发癫痫治疗有用和其他神经调节方法。癫痫患者通常在许多认知功能方面表现出严重的下降,例如精神迟钝,记忆力和注意力缺陷。皮质慢波可能影响突触可塑性,众所周知,它是许多认知过程的基础。由于stxbp1突变的猴子显示出增强的慢波活动,因此它为研究慢波异常在影响认知功能发展中的潜在作用提供了机会。此外,由于目前对于由于基因突变引起的难治性癫痫尚无有效的治疗手段,临床上通常利用抗癫痫药物进行治疗。实际上,不同药物在不同病人上的治疗效果差异大,缺乏针对特定基因引发的难治性癫痫的药物临床前药物评价,而本发明的stxbp1突变癫痫猴的出现可以对不同临床抗癫痫药,例如左乙拉西坦和大麻二酚,以及各种临床前药物进行测试,作为一个药物研发平台将有助于新药的开发。
[0122]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

