1.本发明涉及生物技术领域,特别涉及一种内生真菌及其在防治腐烂病的方法中的应用。
背景技术:
2.腐烂病又称烂皮病、臭皮病等,是一种真菌病害,可以危害苹果、梨等重要果树,当前在世界各地均有发生。发病植株树皮皮层腐烂,发病严重时引起树主干皮层坏死,甚至整株枯死。当前,化学防治仍是防治果树腐烂病菌危害最有效的手段之一。但大量的使用农药,不仅增加环境对病原菌的选择压力,还会造成严重的环境污染,严重破坏生态环境。随着人们生活水平的不断提高,人们对环境及水果的质量要求越来越高。因此,寻找防治病害的低残留、无污染、易降解的生物农药一直是研究热点。
3.植物内生真菌是指其生活史的某一阶段或整个阶段生活在健康的植物组织或细胞内,不会引起宿主植物产生明显病害症状的一类真菌。已有研究表明,植物内生真菌可作为潜在的生防因子,通过与病原菌争夺营养物质和空间来抑制病原菌的生长,或通过产生抗生素类、水解酶类或次级代谢产物等物质抑制病原菌的正常生长,最终导致其死亡。植物内生真菌也可能通过自身的活性物质促进寄主植物生长,进而增强其抗病的能力。因此,内生菌以其独特的优势,已成为植物病害生物防治的潜在资源菌。目前,已有内生真菌用于作物病害防治的报道,如哈茨木霉防治玉米锈病、小斑病和大斑病等病害。
技术实现要素:
4.本发明所要解决的技术问题是如何防治腐烂病或如何对植物腐烂病进行生物防治。
5.为了解决上述技术问题,本发明首先提供了一种橘青霉。所述橘青霉为橘青霉(penicillium citrinum),其菌株号为zz1,其在中国微生物菌种保藏管理委员会普通微生物中心的登记入册编号为cgmcc no.22436。
6.所述橘青霉的18s rdna的核苷酸序列含有序列表中序列1所示的dna分子。所述橘青霉的微管蛋白的编码序列含有序列表中序列2所示的dna分子。
7.为了解决上述技术问题,本发明还提供了上文所述的橘青霉的培养物。所述培养物是将上文所述的橘青霉在微生物培养基中培养得到的物质(即发酵产物,如含有橘青霉菌株zz1和分泌到液体培养基内的物质即发酵液,或如含有橘青霉菌株zz1和分泌到固体培养基内的物质即固体发酵物)。
8.为解决上述技术问题,本发明还提供了菌剂。
9.本发明所提供的菌剂的活性成分可为上文所述橘青霉和/或上文所述橘青霉的代谢物和/或上文所述的培养物。
10.上文中,所述橘青霉菌株zz1的代谢物可为橘青霉菌株zz1的发酵液。橘青霉菌株zz1的发酵液可按照如下方法制备:在液体发酵培养基中培养橘青霉菌株zz1,收集发酵液
(含有橘青霉菌株zz1和分泌到液体培养基内的物质),该发酵液即为橘青霉菌株zz1的代谢物。
11.上述菌剂中,所述菌剂还可包括载体。所述载体可为固体载体或液体载体。
12.上述菌剂中,所述菌剂的剂型可为多种剂型,包括但不限于液剂、乳剂、悬浮剂、粉剂、颗粒剂、可湿性粉剂或水分散粒剂等。
13.上文所述菌剂可具有下述至少一种特性:
14.a1)抑制植物腐烂病菌;
15.a2)抑制植物腐烂病;
16.a3)防治植物腐烂病。
17.为了解决上述技术问题,本发明还提供了上文所述橘青霉的下述任一种应用:
18.a)上文所述的橘青霉在制备植物腐烂病菌抑制剂中的应用;
19.b)上文所述的橘青霉在抑制植物腐烂病菌中的应用;
20.c)上文所述的橘青霉在制备植物腐烂病抑制剂中的应用;
21.d)上文所述的橘青霉在抑制植物腐烂病中的应用;
22.e)上文所述的橘青霉在防治植物腐烂病中的应用。
23.上文所述的培养物的下述任一种应用也属于本发明的保护范围:
24.a)上文所述的培养物在制备植物腐烂病菌抑制剂中的应用;
25.b)上文所述的培养物在抑制植物腐烂病菌中的应用;
26.c)上文所述的培养物在制备植物腐烂病抑制剂中的应用;
27.d)上文所述的培养物在抑制植物腐烂病中的应用;
28.e)上文所述的培养物在防治植物腐烂病中的应用。
29.为了解决上述技术问题,本发明还提供了上文所述的菌剂的下述任一种应用:
30.a)上文所述的菌剂在制备植物腐烂病菌抑制剂中的应用;
31.b)上文所述的菌剂在抑制植物腐烂病菌中的应用;
32.c)上文所述的菌剂在制备植物腐烂病抑制剂中的应用;
33.d)上文所述的菌剂在抑制植物腐烂病中的应用;
34.e)上文所述的菌剂在防治植物腐烂病中的应用。
35.上文所述植物腐烂病菌可为苹果腐烂病菌或梨腐烂病菌。上文所述植物腐烂病可为苹果腐烂病或梨腐烂病。
36.上文所述植物腐烂病菌还可为其它植物腐烂病菌。上文所述植物腐烂病还可为其它植物腐烂病。
37.为了解决上述技术问题,本发明还提供了培养上文所述橘青霉的方法,包括将上文所述的橘青霉在微生物培养基中培养的步骤。
38.本发明从梨树枝干中分离内生真菌,其中一个菌株经形态学和分子生物学鉴定为橘青霉penicillium citrinum,命名为zz1。实验证明,菌株zz1对梨树树腐烂病菌和苹果树腐烂病菌生长均具有很好抑制效果,抑制率均达到90%以上。同样,菌株zz1过滤液也可以显著抑制苹果树腐烂病菌和梨树腐烂病菌生长。进一步利用菌株zz1过滤液处理梨果实和枝条,腐烂病的发病程度显著降低。这些结果表明,菌株zz1作为生防真菌资源,在防治腐烂病中具有很好的应用前景,利用其与腐烂病菌的拮抗作用,可对梨树腐烂病和苹果腐烂病
害进行安全、有效和环保的生物防治。
39.保藏说明
40.菌种名称:橘青霉
41.拉丁名:penicillium citrinum
42.菌株编号:zz1
43.保藏机构:中国微生物菌种保藏管理委员会普通微生物中心
44.保藏机构简称:cgmcc
45.地址:北京市朝阳区北辰西路1号院3号
46.保藏日期:2021年05月26日
47.保藏中心登记入册编号:cgmcc no.22436
附图说明
48.图1为橘青霉zz1对腐烂病菌的抑制情况。(a)橘青霉zz1对苹果树腐烂病菌的抑制情况,左图为对照培养基平板,右图为添加橘青霉zz1的培养基平板;(b)橘青霉zz1对梨树腐烂病菌的抑制情况,左图为对照培养基平板,右图为添加橘青霉zz1的培养基平板。
49.图2为在梨果实上橘青霉zz1滤液能显著抑制梨树腐烂病的发病程度的实验结果展示。ck代表对照组。标尺为1cm。
50.图3为在梨枝条上橘青霉zz1滤液能显著抑制梨树腐烂病的发病程度的实验结果展示。ck代表对照组。标尺为1cm。
具体实施方式
51.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
52.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
53.下述实施例中,马铃薯葡萄糖琼脂培养基(pda):马铃薯去皮,200g切成小块,加水煮沸30min,4层纱布过滤,加20g葡萄糖,琼脂17g,蒸馏水定容到1000ml,煮沸混匀,121℃条件下灭菌20min,得到pda培养基。
54.下述实施例中,马铃薯葡萄糖液体培养基(pdb):马铃薯去皮,200g切成小块,加水煮沸30min,4层纱布过滤,加20g葡萄糖,蒸馏水定容到1000ml,煮沸混匀,121℃条件下灭菌20min,得到pdb培养基。
55.下述实施例中的苹果腐烂病病原菌(valsa mali)为本实验室保存,相关文献:wang l,hou h,zhou z,tu h,yuan h.identification and detection of botryosphaeria dothidea from kiwifruit(actinidia chinensis)in china.plants(basel).2021feb20;10(2):401.doi:10.3390/plants10020401.pmid:33672451;pmcid:pmc7923295.梨树腐烂病菌(valsa pyri)为本实验室保存,相关文献:袁洪波,侯珲,周增强,王丽,涂洪涛.梨树腐烂病拮抗真菌jk2的分离和鉴定.果树学报.https://doi.org/
10.13925/j.cnki.gsxb.20200141。
56.本发明实例中的实验均设置三个重复。
57.实施例一、zz1菌株的分离和功能鉴定
58.1.zz1菌株的分离
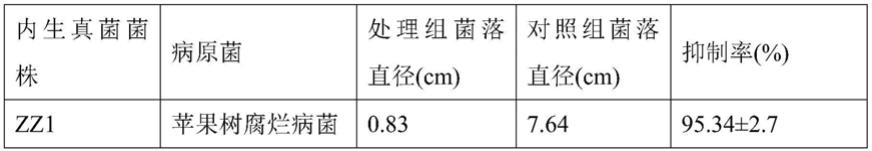
59.本发明从梨树枝干韧皮部中分离内生真菌,其中一个菌株经形态学和分子生物学鉴定为橘青霉(penicillium citrinum),命名为zz1。其分离方法如下:将梨树枝干韧皮部剥离,剪成0.5cm
×
0.5cm左右的组织块,用75%乙醇消毒1min,再用1%naclo进行表面消毒5min,随后用无菌水清洗3次,用灭菌滤纸将组织块表面的水吸干,将组织块放在pda培养基上(含100mg/l硫酸卡那霉素),于25℃的培养箱内恒温培养,每24h观察一次。待菌落形成后,挑取不同菌落形态的菌株接种至新的pda培养基上,并分离纯化得到纯菌株,其中一株菌株命名为zz1。
60.挑取菌株zz1单菌落,加入pdb液体培养基中进行培养,得到zz1的新鲜培养菌液。取1ml新鲜培养菌液4℃、8000rpm离心5min,收集菌体于2ml离心管中,采用dna提取试剂盒提取dna。电泳检测后,采用引物its1(5
’‑
tccgtaggtgaacctgcgg
‑3’
)和its4(5
’‑
tcctccgcttattgatatgc
‑3’
)扩增菌株zz1的18s rdna序列,获得长度为484bp的片段(序列表中序列1);以及使用引物bt2a(5
′‑
ggtaaccaaatcggtgctgctttc
‑3′
)和bt2b(5
′‑
accctcagtgtagtgacccttggc
‑3′
)扩增菌株zz1的微管蛋白(tublin)的部分编码序列,获得长度为418bp的片段(序列表中序列2)。
61.将该菌株zz1的18s rdna序列在ncbi网站进行序列相似性比对,经过比对该基因序列与青霉属具有相似性(其中与橘青霉penicillium citrinum相似性最高为99.79%),微管蛋白基因序列比对结果也显示与橘青霉相似性最高为99%。这表明该菌株zz1属于青霉属橘青霉。菌株zz1菌落为圆形,有褶皱,呈灰绿色,有同心圆轮廓,背面淡黄色。菌丝致密,产孢量大,分生孢子椭圆,表面光滑。根据《真菌鉴定手册》等方法初步鉴定该菌株为青霉属,利用分子生物学技术对其18s rdna和tublin序列进行扩增测序以及序列比对后,将菌株zz1鉴定为橘青霉(penicillium citrinum),以下简称菌株zz1。
62.橘青霉菌株zz1已于2021年05月26日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号),保藏编号为cgmcc no.22436。
63.2.菌株zz1对腐烂病病原菌的抑制功能检测
64.2.1利用平皿对峙实验,检测分离纯化的真菌菌株对苹果树腐烂病和梨树腐烂病菌的抑制情况。
65.将苹果腐烂病病菌(valsa mali)接种于pda平板上,在25℃下培养4天,用直径5mm的打孔器打取菌落生长一致的菌块,接种于9cm pda平板中央,25℃培养2天。处理组在病原菌的上下左右各2cm处接种橘青霉zz1;同时以只接病原菌不接种橘青霉zz1的pda平板为对照组,每个处理组接种10个平皿,于25℃恒温培养。待对照组的病原菌长满整个培养皿后,统计抑菌率。抑菌率(%)=(对照菌落直径-处理菌落直径)/(对照平板菌落直径
‑
0.5)
×
100%。利用同样的方法检测zz1对梨树腐烂病菌(valsa pyri)的抑制情况。结果显示,菌株zz1对苹果树腐烂病和梨树腐烂病菌均具有很好的抑制作用(表1,图1),抑制率均达到90%以上。
66.表1、菌株zz1对苹果树和梨树腐烂病菌的抑制率
[0067][0068][0069]
2.2菌株zz1的代谢物对苹果树腐烂病和梨树腐烂病菌的抑制情况。
[0070]
2.2.1制备无菌滤液
[0071]
将菌株zz1接种pda平板上,在25℃下培养7d后,平板上产生大量的分生孢子。用无菌水将孢子洗脱后,用血球计数板统计浓度,并将其调整为108cfu/ml的菌株zz1孢子悬液。接种1ml菌株zz1孢子悬液于50ml pdb培养基中,于25℃、180r/min振荡培养7d,获得的发酵液经10000rpm离心20min后,取上清液用0.22μm微孔滤膜过滤,即得无菌滤液,该无菌滤液即为橘青霉zz1的代谢物。
[0072]
2.2.2制备带毒平板
[0073]
取5ml步骤2.2.1的无菌滤液与20ml冷却到50℃的pda培养基混合倒入平板,制成带毒平板,以无菌水代替无菌滤液与pda培养基混合制成不带毒平板,作为空白对照ck。
[0074]
2.2.3无菌滤液对苹果树腐烂病和梨树腐烂病菌的抑制
[0075]
分别将上述苹果腐烂病病原菌和上述梨腐烂病病原菌接种于pda平板上,在25℃下培养4天,用直径5mm的打孔器分别打取菌落生长一致的苹果腐烂病病原菌和梨腐烂病病原菌菌块,分别接种于带毒pda平板中央,分别作为苹果腐烂病病原菌和梨腐烂病病原菌无菌滤液处理组;同时分别将苹果腐烂病病原菌和梨腐烂病病原菌菌块接种于不带毒ck平板分别作为苹果腐烂病病原菌和梨腐烂病病原菌对照组。每个处理组和对照组平均接种10个平板,于25℃恒温培养。待对照组的病原菌长满整个培养皿后,统计直径并计算其抑菌率。结果显示,相对于对照组,无菌滤液处理组中的带毒pda平板对苹果树腐烂病和梨树腐烂病菌均具有显著的的抑制作用(表2)。
[0076]
表2、zz1滤液对苹果树和梨树腐烂病菌的抑制率(平均值
±
标准差)
[0077]
腐烂病菌病原菌滤液对苹果树和梨树腐烂病菌的抑制率(%)苹果树腐烂病菌60.66
±
2.3梨树腐烂病菌71.25
±
2.5
[0078]
3.菌株zz1无菌滤液对梨树腐烂病发病情况的抑制
[0079]
3.1果实处理实验
[0080]
将步骤2.2.1中得到的无菌滤液50ml和0.015ml tween20溶液混匀后,均匀喷施处理梨果实作为处理组梨果实(无菌滤液处理);将50ml无菌pdb培养基和0.015ml tween20溶液混匀后喷施处理梨果实处理作为对照组梨果实(ck)。在喷施后,用直径5mm的打孔器从pda平皿上生长4d的上述梨树腐烂病菌边缘打取菌块,分别接种处理组和对照组梨果实,每个果实接种2个病斑,处理组和对照组各接种10个梨果实。接种后4d,调查病斑直径。结果显示,菌株zz1无菌滤液处理能显著抑制梨树腐烂病菌发病程度(表3,图2),处理组梨果实(图2中“处理”所示)的腐烂病菌发病程度显著低于对照组梨果实(图2中“ck”所示)。
[0081]
表3、菌株zz1滤液对梨树腐烂病发病程度的影响
[0082] 病斑直径(cm)ck3.2
±
0.14无菌滤液处理2.4
±
0.16
[0083]
3.2枝条处理实验
[0084]
同时,利用步骤2.2.1中得到的无菌滤液50ml和0.015ml tween20溶液混匀后,均匀喷施处理梨树一年生枝条作为处理组梨枝条(无菌滤液处理);将50ml无菌pdb培养基和0.015ml tween20溶液混匀后喷施处理梨一年生枝条处理作为对照组梨枝条(ck)。在喷施后,用直径5mm的打孔器从pda平皿上生长4d的上述步骤2.2.3梨树腐烂病菌边缘打取菌块,分别接种处理组和对照组梨枝条,处理组和对照组各接种10个梨树枝条。接种后7d,调查病斑直径。结果显示,zz1无菌滤液处理能显著抑制梨树腐烂病菌发病程度(表4,图3),处理组梨枝条(图3中“处理”所示)的腐烂病病斑直径显著小于对照组(p<0.01)(图3中“ck”所示),因此,处理组梨枝条腐烂病菌发病程度显著低于对照组梨枝条。
[0085]
表4、菌株zz1滤液对梨树腐烂病发病程度的影响(平均值
±
标准差)
[0086] 病斑直径(cm)ck3.87
±
0.55无菌滤液处理1.80
±
0.31
[0087]
以上结果表明,菌株zz1及其无菌滤液能用于植物腐烂病的生物防治,菌株zz1作为生防真菌资源,在防治腐烂病中具有很好的应用前景。
[0088]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

