1.本发明属于有机合成领域,涉及一类新型苯并三氮唑水溶性超分子杯化合物、其制备方法以及分子识别性能的应用。
背景技术:
2.苯并三氮唑超分子杯指四个上边沿通过邻苯二胺与亚硝酸钠的类重氮化反应而得到的一类超分子杯化合物,其合成过程如图1所示。它相较于雷锁酚杯芳烃而言,结构上具有一定的柔性,相较于雷锁酚杯芳烃而言又具有相对较高深的空腔。因此,它是一类具有弱缺电子基团的新型超分子杯化合物,在分子的识别方面受到了广泛的关注,具有潜在的应用前景。
3.对超分子杯进行修饰主要有两个位点。一个是在大环的上边缘邻苯二胺进行衍生化,如图1所示,另一个是在脚部的取代基部位进行衍生化。制备具有邻苯二胺基团的超分子杯的技术路线较为成熟,通常采用醛和间苯二酚为原料,路易斯酸为催化剂,而后采用双卤代芳环衍生物取代后可以获得非常高的收率。对邻苯二胺盐酸盐母体进行衍生化的技术路线有较多文献报道,但是通过类重氮化反应制备上边缘为苯并三氮唑基团的超分子杯尚未见有任何报道,如图1所示。
4.苯并三氮唑超分子杯在水相中可以借助结构中的氧桥键进行构象的转变,产生空穴,进而对客体分子进行识别,这方面已经有非常多的报道。但在结构中引入水分子参与氢键,使杯超分子杯在水的协助下稳定其“花瓶”构象的还未见报道。
技术实现要素:
5.为了解决现有技术问题,本发明的目的在于克服已有技术存在的不足,提供一种水溶性苯并三氮唑超分子杯化合物、其制备方法及其应用,该化合物在水相中通过水分子参与环状氢键的形成进而展示出较好的分子识别性能。本发明在超分子杯结构中引入弱缺电子的苯并三氮唑基团,并通过水分子作用调整主体构型,就可实现分子内氢键稳定主客体络合物,从而表现出较好的分子识别性能。有希望将该主体运用于药物分子的运输。
6.为达到上述目的,本发明采用如下技术方案:
7.一种水溶性苯并三氮唑超分子杯化合物,该化合物中苯并三氮唑基团存在弱缺电子效应,进而能在水相中产生了稳定的环状氢键阵列,在分子识别的过程中形成稳定的主客体络合物。
8.优选地,水溶性苯并三氮唑超分子杯化合物结构中的苯并三氮唑基团存在活泼氢,杯芳烃呈现不同的四种活泼氢位置,当所有的活泼氢在空间指向相同时,则水相中水分子与主体在上边缘的活泼氢形成环状的氢键阵列,进而稳定水相中主客体络合物。
9.优选地,水溶性苯并三氮唑超分子杯化合物结构式如下:
[0010][0011]
一种本发明水溶性苯并三氮唑超分子杯化合物的制备方法,包括以下合成步骤:
[0012]
a.在不高于0℃的低温下,将八氨基盐酸盐前体溶解在乙酸和水的混合溶剂中,将亚硝酸钠分两批缓慢加入到上述混合反应液中;然后将该反应混合物在冰水浴下反应至少30分钟;然后撤去冰浴,使反应混合物达到室温,并搅拌至少反应16小时,有浅橙色固体析出;在反应结束后,向产物混合液中加入至少50ml水,静置、过滤,并收集滤饼,然后用体积比为1:1的水和乙醇混合溶液充分洗涤,得到浅黄色产物;
[0013]
b.将在所述步骤a中制备的黄色固体产物溶于甲醇中,溶解完毕后,将其过滤以除去不溶物并收集滤液,将滤液旋转蒸发得到氯丙基苯并三氮唑超分子杯;
[0014]
c.在反应瓶中,将100mg在所述步骤b中制备的氯丙基苯并三氮唑超分子杯溶于至少10ml的n
‑
甲基咪唑中,在氮气保护下,在不高于110℃温度下进行加热过夜;在反应结束后,将产物冷却到室温,向产物中加入丙酮,搅拌,静置后过滤,然后用丙酮洗涤,收集固体产物;然后将固体进行后处理,得到苯并三氮唑超分子杯化合物。
[0015]
优选地,在所述步骤a中,将0.5mmol八氨基盐酸盐前体溶解在至少100ml的乙酸和水的混合溶剂中,所述乙酸和水的混合溶剂中含水的质量分数不大于20%。
[0016]
优选地,在所述步骤c中,在进行后处理时,将收集的固体产物溶解在甲醇中,进行减压真空浓缩,过滤以除去痕量固体,蒸发滤液再次得到固体;然后回收固体并将其悬浮在丙酮中,在不低于60℃下加热回流至少4h,得到悬浮液;然后将悬浮液冷却至室温,过滤,用丙酮充分洗涤固体,并进行真空干燥,得到苯并三氮唑超分子杯化合物。
[0017]
优选地,在进行真空浓缩时,温度不高于45℃,真空度为0.09~0.1mpa。
[0018]
优选地,后处理操作包括加入大量水,甲醇溶解后过滤,减压浓缩以及水溶液的分子识别性质测定。
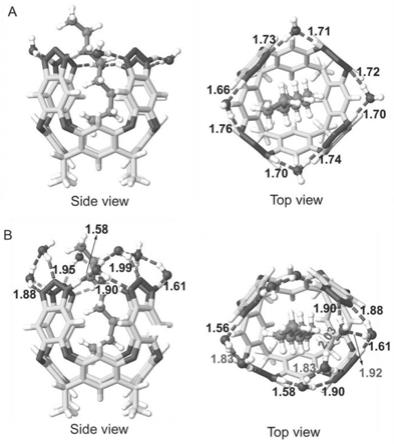
[0019]
优选地,在所述步骤c中,将得到苯并三氮唑超分子杯化合物与d2o混合,震荡后制得清澈的高稀水溶液进行保存。优选取15.8mg的水溶性苯并三氮唑超分子杯化合物于至少10ml的d2o中。
[0020]
一种本发明水溶性苯并三氮唑超分子杯化合物的应用,在水相中进行构象的转变,产生空穴,进而对客体分子进行识别,所述客体分子为直链烷烃、环烷烃、环烷醇、环羧酸、环酮、烷基醇、烷基羧酸、烷基二醇、烷基二羧酸、布洛芬药物中的至少一种。
[0021]
优选地,所述水溶性苯并三氮唑超分子杯化合物在水相中与水相中的客体分子形成1:1的主客体络合物。
[0022]
本发明苯并三氮唑超分子杯结构中引入水分子参与氢键,使杯超分子杯在水的协
助下稳定其“花瓶”构象,产生氢键作用是最常见的主体自组装作用力。在超分子杯结构中引入弱缺电子的苯并三氮唑基团,并通过水分子作用调整主体构型,就可实现分子内氢键稳定主客体络合物,从而表现出较好的分子识别性能。
[0023]
本发明与现有技术相比较,具有如下显而易见的突出实质性特点和显著优点:
[0024]
1.本发明苯并三氮唑超分子杯化合物结构新颖,体现出活泼氢的特征,可作为环状氢键的供体,在分子识别领域具有潜在的应用前景;
[0025]
2.本发明合成路线工艺简便,原料易得、反应条件温和,产率高,重复性好,为合成具有对称特征的杯芳烃类主体化合物分子提供了参考;
[0026]
3.本发明超分子杯在水相中可与水相中多种类型的客体形成主客体络合物。主体上边缘活泼氢的存在可与水分子互补形成环状的氢键,氢键作用进而稳定主客体络合物的稳定。
附图说明
[0027]
图1为水溶性苯并三氮唑超分子杯1的合成路线图。
[0028]
图2
‑
9为水溶性苯并三氮唑超分子杯1的核磁谱图及高分辨质谱图。其中,图2为四
‑
氯丙基八氨基盐酸盐前体核磁氢谱;图3为四
‑
氯丙基苯并三氮唑超分子杯核磁氢谱;图4为四
‑
氯丙基苯并三氮唑超分子杯核磁碳谱;图5为四
‑
氯丙基苯并三氮唑超分子杯高分辨质谱[m na]
;图6为水溶性苯并三氮唑超分子杯核磁氢谱;图7为水溶性苯并三氮唑超分子杯核磁氢谱;图8为水溶性苯并三氮唑超分子杯高分辨质谱[m
‑
2cl]
2
;图9为水溶性苯并三氮唑超分子杯高分辨质谱[m
‑
3cl]
3
。
[0029]
图10
‑
13为超分子杯1络合直链烷烃氢谱及客体构象图。其中,图10为水溶性苯并三氮唑超分子杯识别直链烷烃核磁氢谱;图11为水分子参与形成环状氢键的计算模型示意图(正辛烷客体);图12为直链烷烃与主体1络合核磁氢谱图,其中黑星为游离客体,灰星为络和后两种构象;图13为水溶性超分子杯1和不同长度的烷烃客体络合构象示意图。
[0030]
图14
‑
15为超分子杯1络合环烷烃及其取代物氢谱图。其中,图14为环烷烃与主体1络合核磁氢谱图,黑星为游离客体;灰星为络和客体;图15为环烷烃取代物与主体1络合核磁氢谱图。
[0031]
图16
‑
17为超分子杯1络合烷基醇、烷基羧酸氢谱及客体构象图。图16为烷基羧酸与主体1络合核磁氢谱图,黑星为游离客体;图17为烷基醇与烷基羧酸在主体1中的构象示意图。
[0032]
图18
‑
19为超分子杯1络合烷基二醇、二羧酸氢谱及客体构象图。图18为烷基二醇、烷基二羧酸与主体1络合核磁氢谱图。图19为烷基二醇、烷基二羧酸在主体1中的构象示意图。
[0033]
图20为超分子杯1络合布洛芬药物分子核磁氢谱图及客体构象图。
具体实施方式
[0034]
以下结合具体的实施例子对上述方案做进一步说明,本发明的优选实施例详述如下:
[0035]
实施例一:
[0036]
在本实施例中,一种水溶性苯并三氮唑超分子杯化合物,该化合物中苯并三氮唑基团存在弱缺电子效应,进而能在水相中产生了稳定的环状氢键阵列,在分子识别的过程中形成稳定的主客体络合物。
[0037]
在本实施例中,一种水溶性苯并三氮唑超分子杯化合物的制备方法,包括以下合成步骤:
[0038]
a.在0℃的低温下,在250ml圆底烧瓶中,将0.5mmol八氨基盐酸盐前体溶解在100ml乙酸和水的混合溶剂中,所述乙酸和水的混合溶剂中含水的质量分数为20%,将亚硝酸钠(160mg,4.4equiv)分两批缓慢加入到上述混合反应液中;然后将该反应混合物在冰水浴下反应30分钟;然后撤去冰浴,使反应混合物达到室温,并搅拌反应16小时,有浅橙色固体析出;在反应结束后,向产物混合液中加入50ml水,静置、过滤,并收集滤饼,然后用体积比为1:1的水和乙醇混合溶液充分洗涤,得到浅黄色产物564mg且足够纯并用于下一步反应,产率≥90%;
[0039]
b.将在所述步骤a中制备的黄色固体产物溶于甲醇中,溶解完毕后,将其过滤以除去不溶物并收集滤液,将滤液旋转蒸发得到氯丙基苯并三氮唑超分子杯;
[0040]
c.在反应瓶中,将100mg在所述步骤b中制备的氯丙基苯并三氮唑超分子杯溶于10ml的n
‑
甲基咪唑中,在氮气保护下,在100℃温度下进行加热过夜;在反应结束后,将产物冷却到室温,向产物中加入50ml丙酮,搅拌2小时,静置后过滤沉淀的棕色固体,然后用20ml丙酮洗涤,收集固体产物;然后将固体进行后处理,将收集的固体产物溶解在20ml甲醇中,进行减压真空浓缩,过滤以除去痕量固体,蒸发滤液再次得到固体;然后回收固体并将其悬浮在30ml丙酮中,在60℃下加热回流4h,得到悬浮液;然后将悬浮液冷却至室温,过滤,用丙酮充分洗涤固体,并进行真空干燥,回收得到90mg(84%)的浅棕色固体产物,即得到苯并三氮唑超分子杯化合物。
[0041]
取500μl本实施例主体水溶液,约2μl客体共同加入核磁管中,超声处理30分钟后检测核磁氢谱。
[0042]
本实施例制备的中间产物,即黄色固体产物的表征:检测1h nmr,
13
c nmr,hr
‑
ms等谱图详见附录。1h nmr(600mhz,chloroform
‑
d)δ7.91(d,j=9.8hz,8h),7.65
‑
7.48(m,4h),7.35
‑
7.18(m,4h),5.75(dt,j=11.3,7.9hz,4h),3.72(q,j=5.9hz,8h),2.46(q,j=8.8hz,8h),1.88(dt,j=11.2,5.2hz,8h).
13
c nmr(150mhz,chloroform
‑
d)δ155.6,153.7,151.4,140.4,135.0,130.4,123.3,116.5,111.6,105.1,44.9,33.0,31.0,29.3.hr
‑
ms(esi):calcd.for chemical formula c
64
h
48
cl4n
12
o8:1252.2472,found:1275.2356[m na]
.
[0043]
本实施例制备的最终产物的表征:检测1hnmr,
13
c nmr,hr
‑
ms等谱图详见附录。1h nmr(600mhz,methanol
‑
d4)δ9.17(s,4h),8.17(s,4h),8.05(s,4h),7.83(s,8h),7.64(s,4h),5.67(t,j=8.5hz,4h),4.50(t,j=6.8hz,8h),3.98(s,12h),2.81(q,j=8.4hz,8h),1.99(dt,j=13.9,7.0hz,8h).
13
c nmr(150mhz,methanol
‑
d4)δ155.7,136.6,135.1,135.1,125.5,123.7,123.7,122.5,122.5,116.1,49.6,35.2,33.6,28.9,28.2.hr
‑
ms(esi):calcd.for chemical formula c
80
h
72
n
20
o8·
4cl:1580.4596,found:755.2593[m
‑
2cl]
2
,491.8505[m
‑
3cl]
3
.
[0044]
本实施例化合物的核磁共振氢谱如图3
‑
9所示,化合物的苯并三氮唑基团存在活泼氢且活泼氢的位置不固定。主体在有机相和水相中均以c
4v
的对称构型存在。本实施例超
分子杯在水相中可与水相中多种类型的客体形成1:1的主客体络合物。主体上边缘活泼氢的存在可与水分子互补形成环状的氢键,氢键作用进而稳定主客体络合物的稳定。
[0045]
实施例二:
[0046]
本实施例与实施例一基本相同,特别之处在于:
[0047]
在本实施例中,取直链烷烃溶液加入到水溶性超分子杯1(500μl,1mm in d2o)的溶液中,当量比分别为过量(2μl)和客体:主体=1:2,混合溶液超声1小时后检测核磁共振氢谱。分析核磁共振氢谱,同时验证主体是否存在自组装行为。通过对它们高场特征信号的分析,小到中型的直链烷烃(c5
‑
c10)与1形成了1:1的主
‑
客体络合物,0.8
‑
1.2ppm区间段出现了游离的客体信号峰。从正戊烷到正庚烷,客体分子完全在主体空腔内,高场区可以观察到宽阔的核磁信号,说明这些客体在主体内快速旋转、翻滚。对于正辛烷到正癸烷,客体信号峰变得很清晰,由于客体的快速运动,所得到的化学位移是一个平均值,所有氢在空腔中占据几乎相同的磁环境。对于c9
‑
c11直链烷烃,甲基信号出现在最高场,这说明客体在空腔中快速翻滚的螺旋构象,参见图10
‑
13。三氮唑基团与水分子形成环状氢键稳定主客体络合物的稳定性。较长的12<nc<15的烷烃则在高场区显示了分散的亚甲基信号,它们甲基的化学位移值为
‑
4.2ppm,表明它们很接近空腔的基底。通过计算客体的最大核磁屏蔽值δδ≈
‑
5ppm,直链烷烃在1中位置比在脲基主体中络合位置更深、更有利,这表明此主体的空腔更靠近客体而出现较强的屏蔽效应,参见图12
‑
13。
[0048]
实施例三:
[0049]
本实施例与前述实施例基本相同,特别之处在于:
[0050]
在本实施例中,疏水类化合物环烷烃(2μl)溶液作为客体加入到苯并三氮唑超分子杯1(500μl,1mm in d2o)的溶液中,混合溶液超声1小时后检测核磁共振氢谱。分析对比所得核磁共振氢谱进而分析主客体识别行为,参见图14。客体分子在空腔内自由旋转、翻滚,所有的氢处于相同的化学环境,因此高场区显示单信号峰。随着环状客体分子尺寸的增大,
△
δ分布逐渐减小,表明较小的客体在腔内占据较深的位置。客体分子的最深位移值
△
δ=
‑
4.5ppm,表明主体1与客体形成的主
‑
客体络合物比脲基超分子杯更稳定。
[0051]
实施例四:
[0052]
本实施例与前述实施例基本相同,特别之处在于:
[0053]
在本实施例中,官能化的环状烷烃(环烷基羧酸、环酮或环醇)是两亲性化合物,能否形成主客体络合物取决于它们的环尺寸的疏水性和官能团的亲水性,它们占据了1的空腔并形成了稳定的1:1主客体络合物,参见图15。亲水性酸、酮或醇官能团在主体空腔口处朝向大量水溶剂。较大的环十二酮也可以与主体络合,刚性较大的金刚烷也能与主体络和,水溶性良好的较小环烷基羧酸也可以与1络合。亲水基团的存在导致客体分子不能在空腔内自由的翻滚,因此在高场区显示出分散的亚甲基信号。
[0054]
实施例五:
[0055]
本实施例与前述实施例基本相同,特别之处在于:
[0056]
在本实施例中,直链烷基醇与烷基羧酸类客体也可以与1形成稳定的络合物,参见图16。这些客体分子的亲水性羟基和羧基倾向于水中,而烷基长链则直插入主体1的疏水空腔中,甲基处于空腔最深处(δδ=
‑
4.9ppm),亚甲基峰逐个分布在空腔内直至开口。对于正十二醇与正十二酸,二者的烷基链长相等且二者亲水性相近,二者在高场区均出现了宽的
信号峰,这是由于主体与d2o溶液中的客体进行了快速交换造成的。正十三醇与正十三酸则显示尖锐的信号峰,对比二者络合物氢谱图,其主客体识别行为极为相近,δδ相差仅有0.1ppm,说明这两类取代基不同的客体并没有影响主客体结合深度,其构象如图17所示。通过研究一系列的烷基醇与烷基羧酸的络合行为,我们发现烷基链长短并不影响客体直插入主体空腔内,烷基部分并没有弯曲以适应主体,此现象与之前报道的脲基以及八甲基脲基主体的识别行为存在较大的创新。
[0057]
实施例六:
[0058]
本实施例与前述实施例基本相同,特别之处在于:
[0059]
在本实施例中,两亲性双取代基化合物如长链脂肪二酸或二醇的主客体络合行为注定是亲水基团朝向超分子杯1的开口处,烷基部分因疏水作用进入空腔内,参见图18。但是不同长链α,ω
‑
二醇或二酸络和后的深度也是存在差异的。它们的最高场信号为
‑
3.1ppm,δδ=
‑
4.4ppm,表现为一个折叠链,在空腔的底部附近固定有一个
‑
ch2‑
,这与八甲基脲基主体的识别行为存在相似之处壬二醇和壬二酸因烷基链较短导致主客体交换过快,高场不能清晰地观察到络和后的信号,多达11个亚甲基的双官能化的客体疏水碳链适应了空穴内部磁屏蔽的环境,亚甲基对称性地占据了空腔,在空腔内折叠成“u”形构象,参见图19。
[0060]
实施例七:
[0061]
本实施例与前述实施例基本相同,特别之处在于:
[0062]
在本实施例中,为了验证该主体是否存在自组装行为,我们选用不同长度的直链烷烃和芳基乙烯类客体分子进行了分子识别研究。分析长链烷烃与主体络合的核磁氢谱图,参见图12可知:正十一烷时在主体内是螺旋翻滚的构象;当客体为正十二烷时,高场出现了两种类型的信号峰(灰星表示),其中一组信号最高场区
‑
4.2ppm处且强度较强,此时的最大屏蔽值δδ≈
‑
5ppm,可能为分子胶囊;当客体分子为正十四烷时,最深也是出现在
‑
4.2ppm处,但是它们的亚甲基出峰位置却是一致的,这与之前报道的分子胶囊存在差异,不同的直链烷烃分子被封装在胶囊内时甲基出峰一致,但是亚甲基位置是不一致的。因此该主体可能没有形成分子胶囊,较长链的客体分子也一直是烷基直插入主体空腔,并没有发生弯曲,其构象如图13所示,金属未参与配位的情况下烷烃类化合物不折叠不弯曲的情况极为罕见。
[0063]
实施例八:
[0064]
本实施例与前述实施例基本相同,特别之处在于:
[0065]
在本实施例中,为了验证该超分子杯1是否能够运载药物分子,我们选用布洛芬药物分子与超分子杯1进行络合,核磁氢谱显示布洛芬药物分子被超分子杯1捕获,其中甲基组信号在最高场
‑
4.05ppm处且强度较强,此时的最大屏蔽值δδ≈
‑
4.9ppm,表明布洛芬药物分子被牢牢捕获,甲基指向了超分子杯的杯底,参见图20。有望未来能够将超分子杯运用于药物的运输与释放。
[0066]
综上所述,上述实施例水溶性苯并三氮唑超分子杯的制备方法与应用。以间苯二酚、2,3
‑
二氢呋喃为起始原料,通过呋喃开环、亚甲基桥连环化得到雷锁酚杯芳烃,再通过亲电取代反应、sncl2还原得到四氯丙基八氨基盐酸盐中间体,后通过类重氮化反应构筑苯并三氮唑超分子杯。该制备方法路线工艺简便,原料易得,反应条件温和,产率高,重复性
好。本发明公开的苯并三氮唑水溶性超分子杯结构中的苯并三氮唑基团存在活泼质子氢,进而在水分子辅助下形成了环状氢键阵列,主体具有很强的主客体识别性能,在水相中表现出很好的主客体络合行为。
[0067]
上面结合附图对本发明实施例进行了说明,但本发明不限于上述实施例,还可以根据本发明的发明创造的目的做出多种变化,凡依据本发明技术方案的精神实质和原理下做的改变、修饰、替代、组合或简化,均应为等效的置换方式,只要符合本发明的发明目的,只要不背离本发明的技术原理和发明构思,都属于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

