1.本发明涉及一种试剂盒及其应用,具体涉及一种用于制备人体多巴胺神经元的试剂盒及其应用,属于生物制药领域。
背景技术:
2.帕金森氏病(parkinson’s disease,pd)是继老年性痴呆症后的第二大神经退行性疾病,多发于老年人,并且随着年龄增长发病率不断增高。患者以静止性震颤、肌强直、运动减少和姿态步态异常为主要表现,主要是由中脑黑质致密部的多巴胺能神经元退行性病变引起的。
3.目前帕金森氏病的临床治疗方法多限于药物治疗及神经外科手术,仅能延缓病情的发展。成熟神经元具有不可再生性,使得受损的神经细胞很难得到有效补充,因此移植外源神经细胞替代治疗成为潜在治疗途径之一。移植实验结果显示细胞移植帕金森氏病动物模型或者帕金森氏病病人后,可以改善动物模型和病人的运动障碍,但目前细胞移植治疗帕金森氏病应用的胎脑神经干细胞,胚胎干细胞存在来源不足、免疫排斥及伦理学障碍等问题。而通过自体皮肤成纤维细胞重编程成熟的诱导多能干细胞(induced pluripotent stem cells,ipsc)避开了以上问题,可直接由ips细胞分化为多巴胺神经元,移植治疗研究。但是目前诱导多能干细胞残留导致的潜在致瘤风险,仍未能完美解决。而通过慢病毒作为基因载体,导入成纤维细胞进行直接重编程产生多巴胺神经元的方法较好地解决了ips技术潜在的致瘤风险,但慢病毒方式同样会引入外源基因插入的风险,在未来的临床转化中,外源基因插入引起不可控的基因组突变因素会严重限制ips以及慢病毒介导的重编程的应用价值。
4.日本massimiliano caiazzo教授的“direct generation of functional dopaminergic neurons from mouse and human fibroblasts”公开了直接重编程产生神经细胞的技术。澳大利亚bronwen connor教授的“conversion of adult human fibroblasts into neural precursor cells using chemically modified mrna.”公开了化学修饰rna直接重编程技术。但caiazzo教授该技术利用不同的转录因子组合通过慢病毒转染方式将pd病人成纤维细胞诱导为多巴胺能神经细胞,其缺陷在于多巴胺神经元产生的稳定性和生产效率较低,另外还会在宿主细胞整合进入外源基因。由于慢病毒导入基因还会整合到染色体上,插入外源基因具有不确定性。connor教授利用转录因子基因合成化学修饰rna,其缺陷在利用诱导培养体系产生的多巴胺神经元的效率有待进一步提升。
技术实现要素:
5.有鉴于此,本发明利用化学修饰mrna(cmrna)产生cmrna
‑
aslc1、cmrna
‑
lmx1a和cmrna
‑
nurr1组合将人成纤维细胞直接重编程为多巴胺神经细胞,利用化学修饰mrna(cmrna)消除了dna方法所固有的基因组整合和插入诱变的风险,不会残留转基因示踪剂,且本发明利用小分子组合优化了诱导培养体系,提高多巴胺神经元的产生效率以及成熟
度。
6.具体采用如下技术方案:
7.一种用于制备人体多巴胺神经元的试剂盒,包括:
8.(1)成纤维细胞高效分离培养液:73%dmem、10%fbs、1%neaa、1%ps、1%lg、10
‑
100μg/ml bfgf,5
‑
100μm y27632;
9.(2)化学修饰mrna;
10.(3)诱导培养液:dmemf12、camp 100μm、1%neaa、1%lg、1%ps;
11.(4)小分子化合物诱导组合1:sb43154210μm、i
‑
bet1510.5μm、ldn1931890.5μm、foskolin2μm、noggin 100ng/ml;
12.(5)促进成熟存活的诱导组合2:y276325mm、foskolin 2μm、db
‑
camp50μm。
13.进一步,化学修饰mrna为cmrna
‑
ascl1、cmrna
‑
lmx1a、cmrna
‑
nurr1的混合。
14.进一步,化学修饰mrna的操作为由人源ascl1、lmx1a、nurr1基因序列,获得转录因子的rna转录序列,合成转录因子的rna,以核糖核苷共混物混合孵育,再利用柱层析法纯化,调整cmrna浓度至100ng/ml。
15.进一步,核糖核苷共混物为3'
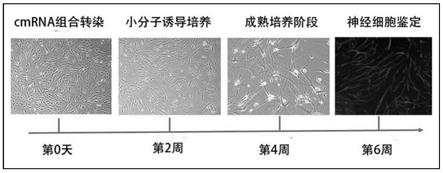
‑0‑
me
‑
m7g(5')ppp(5')g arca帽类似物6mm5
‑
10mm,三磷酸腺苷7.52.55
‑
10mm和三磷酸鸟苷1.52.55
‑
10mm,5
‑
甲基胞苷三磷酸7.55
‑
10mm和假尿苷三磷酸酯7.52.5
‑
10mm的混合物。
16.进一步,孵育为在37℃孵育3
‑
6h。
17.进一步,调整cmrna浓度为以ph值为7.0的tris
‑
edta调整cmrna浓度。
18.本发明还提供了上述试剂盒在将帕金森氏病人皮肤成纤维细胞重编程产生多巴胺神经元中的应用。
19.本发明中试剂盒所涉及的皮肤成纤维细胞转染实验,步骤如下:
20.1.获得成纤维细胞:采集组织在无菌条件下切成组织碎片,培养获得初代细胞株。
21.2.化学修饰mrna合成:查找人源的ascl1、lmx1a、nurr1基因序列,获得ascl1等转录因子的rna转录序列,利用商品试剂盒合成化学修饰的4个转录因子的rna
22.3.cmrna的细胞转染:
23.1)以汇合度75%时传代细胞,使细胞在转染前出于对数生长期,24h后进行mrna转染;
24.2)提前将孔板中的培养液更换为无血清的dmem培养基,放入细胞培养箱待用;
25.3)取适量合成好的cmrna
‑
ascl1、cmrna
‑
lmx1a、cmrna
‑
nurr1组合,利用无血清opti
‑
mem进行混匀稀释至固定体积,室温孵育30min,待转录复合物形成;
26.4)将转录混合液滴加至步骤2中的孔板中,进行“8”字混匀后,置于培养箱37℃,5%co2中正常培养;
27.5)正常培养6h,给细胞换新鲜的成纤维细胞培养液(含10%fbs即可)。
28.4.小分子化合物诱导成纤维细胞的直接重编程多巴胺前体细胞诱导阶段:将转染后的成纤维细胞培养在mef培养基中培养1天后,用含有小分子化合物组合1的诱导培养液代替成纤维细胞培养液14天,每3天换液1次。
29.5.在14天后,利用小分子化合物组合2进行促进诱导多巴胺神经元成熟阶段,诱导培养2周左右。
30.6.诱导多巴胺神经元成熟诱导阶段结束后,将细胞利用4%pfa进行固定,然后进行免疫荧光染色鉴定。
31.本发明的试剂盒基于转录因子ascl1、lmx1a、nurr1的化学修饰结合小分子化合物重编程产生多巴胺神经元,有益效果如下:
32.1.本试剂盒中的化学修饰rna是建议使用者利用脂质体转染方式转导ascl1、lmx1a、nurr1基因至目的细胞,这样避免了整个过程对于病毒载体的使用,减少了使用者的病毒生产实验成本,降低了病毒对实验员的人身伤害风险,降低所需外源性基因插入风险,利用化学修饰mrna避免基因整合,降低基因改变为后续临床应用带来的影响。
33.2.通过整合重编程过程中所需的试剂种类,确保试剂成分稳定且符合试剂盒使用要求。使实验过程中的试剂配置步骤简化,降低了因各个实验室试剂来源不同导致的实验结果的差异。
34.3.将小分子化合物通过提前进行准确浓度的稀释,使用者仅需按照说明说直接加入培养基中即可。降低了实验过程中的由于操作者操作水平不一致,导致的小分子组合浓度比例不相符导致污染或者实验效果不佳的风险。
35.4.本试剂盒中的原代细胞培养液新添加了生长因子bfgf以及y27632,相比传统的分离液可以快速获得原代细胞,缩短从病人身上获取皮肤组织到产生神经细胞整个实验时间,并利用小分子组合进一步提高了多巴胺神经元制备过程的效率。
附图说明
36.图1为本发明实施例1pd病人原代皮肤成纤维细胞胞分离培养结果图;
37.图2为本发明实施例1因子组与对照组的细胞分离效率结果图;
38.图3为本发明实施例1诱导培养结果图;
39.图4为本发明实施例1中免疫荧光鉴定多巴胺神经细胞的鉴定结果图。
具体实施方式
40.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
41.在以下实施例中,所使用的试剂盒包括:
42.(1)成纤维细胞高效分离培养液:73%dmem、10%fbs、1%neaa、1%ps、1%lg、10
‑
100μg/ml bfgf,5
‑
100μm y27632;
43.(2)化学修饰mrna:cmrna
‑
ascl1、cmrna
‑
lmx1a、cmrna
‑
nurr1;
44.(3)诱导培养液:dmemf12、camp 100μm、1%neaa、1%lg、1%ps;
45.(4)小分子化合物诱导组合1:sb43154210μm、i
‑
bet1510.5μm、ldn1931890.5μm、foskolin2μm、noggin 100ng/ml;
46.(5)促进成熟存活的诱导组合2:y276325mm、foskolin 2μm、db
‑
camp50μm。
47.化学修饰mrna由以下方法制备得到:由人源ascl1、lmx1a、nurr1基因序列,获得转录因子的rna转录序列,合成转录因子的rna,以3'
‑0‑
me
‑
m7g(5')ppp(5')g arca帽类似物
5
‑
10mm,三磷酸腺苷2.5
‑
10mm和三磷酸鸟苷2.55
‑
10mm,5
‑
甲基胞苷三磷酸7.5
‑
10mm和假尿苷三磷酸酯2.5
‑
10mm的混合物,在37℃混合孵育3
‑
6h,再利用柱层析法纯化,以ph值为7.0的tris
‑
edta调整cmrna浓度至100ng/ml。
48.实施例1
49.皮肤成纤维细胞转染实验步骤:
50.1.收集皮肤组织,获得成纤维细胞:
51.1)签订皮肤捐献者知情同意书,在局部麻醉的条件下采集皮肤组织(厚2
‑
3mm,直径6mm);
52.2)采集组织先在无菌条件下利用10ml无菌pbs(含1%的双抗p/s)洗涤3次;
53.3)将利用无菌眼科剪将组织块切成组织碎片,时间不要超过10min;
54.4)吸取5ml细胞培养液a将组织碎片重悬;
55.5)按照1ml细胞悬液分别加入至每个35mm细胞培养皿,然后补充1ml细胞培养液a。前3天尽量不进行换液,待细胞组织块贴壁后进行全换液;
56.6)待细胞汇合度达到85%后,进行传代,冻存。
57.pd病人原代皮肤成纤维细胞胞分离培养结果图,其中因子组中使用了本试剂盒中的成纤维细胞高效分离培养液,而对照组使用了普通成纤维细胞培养液(不含bfgf和y27632)如图1,因子组与对照组的细胞相同的培养时间中,因子组原代细胞爬出的时间少于对照组,而因子组的组织块爬出率要高于对照组,分离效率结果图如图2。
58.2.将试剂盒中的质粒液进行分装,保存于
‑
20℃,使用前将分装的cmrna
‑
ascl1、cmrna
‑
lmx1a、cmrna
‑
nurr1放置于冰上化开。
59.3.化学修饰rna脂质体转染:
60.1)以汇合度75%时传代细胞,使细胞在转染前出于对数生长期,举例为6孔板,按照细胞数量为0.9x105/孔进行细胞铺板,24h后进行mrna转染。
61.2)提前将孔板中的培养液更换为无血清的dmem培养基,放入细胞培养箱待用。
62.3)按照cmrna
‑
ascl1、cmrna
‑
lmx1a、cmrna
‑
nurr1各自浓度,吸取相应体积得到终量为10ug合成好的cmrna组合,利用500ul无血清的opti
‑
mem进行混匀稀释至固定体积,室温孵育30min,待转录复合物形成。
63.4)将转录混合液滴加至步骤2中的孔板中,进行“8”字混匀后,置于培养箱37℃,5%co2中正常培养。
64.5)正常培养6h,给细胞换新鲜的成纤维细胞培养液(含10%fbs即可)。
65.4.小分子化合物诱导成纤维细胞的直接重编程:
66.1)将转染6h后的成纤维细胞,在成纤维细胞培养液37℃培养24h;
67.2)用含有小分子化合物组合1的诱导培养液代替成纤维细胞培养液14天,每3天换液1次。
68.5)在14天的诱导培养后,更新为促进成熟存活的诱导组合2结合购自于gibco品牌的神经基础培养基neurobasal并补充因子gdnf以及bdnf,进行促进第一阶段产生的多巴胺前体细胞向诱导多巴胺神经元成熟阶段继续培养14天。结果图如图3。在4周后进行免疫荧光鉴定多巴胺神经细胞的鉴定,结果如图4,其中,图4.a中的免疫荧光结果显示,诱导神经细胞表达多巴胺神经元有关的特异性标志物tuj1,map2,neun,th等;图4.b中的ca离子成像
也显示细胞具有神经电生理活性情况;图4.c中的rt
‑
pcr也显示诱导细胞表达神经相关基因。
69.上述结果说明该试剂盒可以成功将皮肤成纤维细胞直接重编程转化为多巴胺神经元。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

