富含次生代谢物的植物组织中dna的提取方法
技术领域
1.本发明涉及生物技术领域,具体而言,涉及一种富含次生代谢物的植物组织中dna的提取方法。
背景技术:
2.近些年,随着生物测序技术的迅猛发展,无论是科研人员还是普通广大民众都开始享受该技术带来的一系列红利。尤其是随着新型冠状病毒的爆发,生物测序技术在医学及病毒检测防疫的应用中起到举足轻重的作用,让人民看到了生物测序技术的强大作用。不仅如此,在动植物研究及生产上该技术更是应用广泛。
3.在测序技术中,能够得到高质量dna对于后期建库测序和数据分析乃至后期应用都起到关键作用。很多植物组织富含多糖多酚等次生代谢产物影响着提取dna的质量和产量,阻碍了后续应用进展。目前dna提取方法众多,如ctab(cetyl
‑
trimethyl
‑
ammonium bromide,十六烷基三甲基溴化铵)法、高盐低ph法、sds(sodium dodecyl sulfate,十二烷基硫酸钠)法、苯酚法和提取试剂盒的使用等。但是,对于含有大量多糖多酚等次生代谢产物的植物,采用常规的方法很难提取出高质量的dna。
4.ctab是一种高效的阳离子去污剂,可破碎细胞壁和细胞膜,具有从低离子强度溶液中沉淀核酸与酸性多聚糖的特性。在高离子强度的溶液中(>0.7mol/l nacl),ctab与蛋白质和多聚糖形成复合物,只是不能沉淀核酸,通过有机溶剂抽提,去除蛋白、多糖、酚类等杂质后加入乙醇沉淀即可使核酸分离出来。ctab法是目前应用最广泛发展较成熟的方法,最大优点就是除去多糖。可是常规ctab提取法去除杂质效果有限,往往达不到我们所需要的dna质量要求,因而需要针对现有的常规ctab提取法进行改良,达到提取出高质量dna的目的。
技术实现要素:
5.本发明旨在提供一种富含次生代谢物的植物组织中dna的提取方法,从而实现快速高效的提取出高质量dna。
6.为了实现上述目的,根据本发明的一个方面,提供了一种富含次生代谢物的植物组织中dna的提取方法。该提取方法包括干扰物处理、组织细胞裂解、盐析、dna沉淀和清洗步骤,其中,干扰物处理步骤包括:将植物组织同交联聚乙烯吡咯烷酮一起研磨;以及加入漂洗液对研磨后的植物组织进行干扰物漂洗处理;其中,漂洗液包括:100~500mm tris
‑
hcl ph=4.8、0.35~0.5m山梨醇、5~10mm edta ph=4.8、1~5%pvp和0.5~2%巯基乙醇。
7.进一步地,盐析包括:在组织细胞裂解后加入裂解液体积1/5
‑
1/2的3m醋酸钾溶液ph=4.8进行盐析处理。
8.进一步地,提取方法具体包括以下步骤:s1,将植物组织在预冷的研磨管中利用研磨器研磨成粉末状,研磨前研磨管中加入有交联聚乙烯吡咯烷酮粉末;s2,加入漂洗液对研
磨后的植物组织进行干扰物漂洗处理,混匀离心弃上清液;s3,向研磨管中加入2~5%ctab裂解液,混匀,使植物组织悬浮,水浴,取出后,室温静置,离心取上清;s4,向s3中得到的上清中加入3m醋酸钾溶液ph=4.8,醋酸钾的加入量是上清液体积的1/5~1/2,离心取上清;s5,向s4中得到的上清中加入等体积苯酚/氯仿/异戊醇抽提后取上清、然后加入等体积氯仿/异戊醇抽提后取上清;s6,向s5中得到的上清中加入异丙醇进行dna沉淀,弃上清;s7,利用75%乙醇清洗dna沉淀;s8,dna沉淀干燥后加入洗脱缓冲液溶解dna沉淀,加入rnase a酶消化rna。
9.进一步地,s2中的离心力为2500g~3000g,离心时间为10~15min,s2重复2次或2次以上。
10.进一步地,s3中,ctab裂解液为预热至65℃的ctab裂解液,水浴的温度为65℃,水浴的时间为30~60min。
11.进一步地,s4中,向s3中得到的上清中加入醋酸钾溶液后,
‑
20~
‑
15℃放置10~20min,离心后取上清。
12.进一步地,s5中,苯酚/氯仿/异戊醇中苯酚、氯仿与异戊醇的体积比为25:24:1;氯仿/异戊醇中氯仿与异戊醇的体积比为24:1。
13.进一步地,s6中,异丙醇为预冷后的异丙醇,加入体积为上清液体积的0.8倍,然后在
‑
20℃中放置30min,进行dna沉淀。
14.进一步地,提取方法包括以下步骤:s1,将植物组织转移到已放入陶瓷研磨珠且预冷后的2ml研磨管中,随后加入样植物组织重量1/10
‑
1/2的交联聚乙烯吡咯烷酮粉末,用研磨器将植物组织研磨成粉末状;s2,向研磨管中加入漂洗液,混匀后,2500g~3000g离心10~15min,弃上清液;重复漂洗3~5次;s3,向研磨管中加入65℃预热的2~5%ctab裂解液,混匀,使植物组织悬浮,65℃水浴30~60min;取出后,室温静置1min,离心后转移上清到新管;s4,向s3中得到的上清中加入上清液体积1/5
‑
1/2的3m醋酸钾溶液ph=4.8,混匀,
‑
20~
‑
15℃放置10~20min,离心后取上清;s5,向s4中得到的上清中加入等体积苯酚/氯仿/异戊醇抽提后取上清、然后加入等体积氯仿/异戊醇抽提后取上清;s6,向s5中得到的上清中加入上清液0.8倍体积的异丙醇,混匀,
‑
20℃放置30min进行dna沉淀,离心后弃上清;s7,利用75%乙醇清洗dna沉淀两次;s8,dna沉淀干燥后加入洗脱缓冲液溶溶解dna沉淀,加入10mg/ml rnase a酶放置在37℃金属浴上消化rna。
15.进一步地,提取方法包括以下步骤:s1,将0.05g植物组织加入到已放入陶瓷研磨珠且预冷后的2ml研磨管中,加入0.025g的交联聚乙烯吡咯烷酮粉末,用研磨器将植物组织研磨成粉末状;s2,向研磨管中加入1ml漂洗液,混匀后,4℃下2500g离心10min,弃上清液;重复漂洗3次;s3,向研磨管中加入800μl 65℃预热的5%ctab裂解液、20μl 20mg/ml蛋白酶k和20μl巯基乙醇,混匀,使植物组织悬浮,65℃水浴360min;取出后,室温静置1min,在4℃下12000rpm离心8min,取600μl上清液至新的2.0ml无菌离心管中;s4,向s3中得到的上清中加入300μl 3m醋酸钾溶液ph=4.8,混匀,
‑
20℃放置15min,4℃下12000rpm离心8min,取上清至新的2ml无菌离心管中;s5,向s4中得到的上清中加入800μl苯酚/氯仿/异戊醇上下颠倒混匀,4℃下12000rpm离心8min,取上清至新的2ml无菌离心管中;然后加入800μl氯仿/异戊醇上下颠倒混匀,4℃下12000rpm离心8min,取上清至新的2ml无菌离心管中;s6,向s5中得到的上清中加入上清液0.8倍体积的异丙醇,混匀,
‑
20℃放置30min进行dna沉淀,4℃下
12000rpm离心8min,弃上清,瞬时离心,吸弃残留液体;s7,利用75%乙醇清洗dna沉淀两次,4℃下12000rpm离心2min,弃上清;瞬时离心,吸弃残留液体,室温干燥至dna沉淀呈半透明状;s8,dna沉淀干燥后加入洗脱缓冲液溶解dna沉淀,加入10mg/ml rnase a酶放置在37℃金属浴上消化rna;s9,根据dna沉淀量加入适量洗脱缓冲液溶,然后加入1μl 10mg/ml rnase a酶消化rna,37℃孵育15min。
16.应用本发明的技术方案,将植物组织研磨时加入pvpp(交联聚乙烯基吡咯烷酮),并且研磨后利用漂洗液进行漂洗,去除大部分次生代谢物。随后利用裂解液进行裂解,释放dna,然后进行盐析进一步去除多糖等次生代谢物,并且通过酚氯仿抽提去除蛋白质等杂质。最后利用异丙醇析出dna,75%乙醇漂洗dna沉淀,加入洗脱缓冲液溶解dna,形成dna溶液,从而实现快速高效的提取出高质量dna。
附图说明
17.构成本技术的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
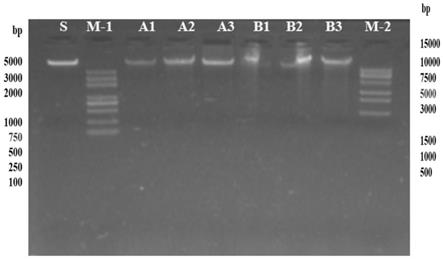
18.图1示出了实施例1和对比例1所提取的基因组dna进行1.0%琼脂糖凝胶电泳检测的结果图(1%琼脂糖胶图:图中m
‑
1为trans 2k plus,上样2μl,m
‑
2为trans 15k plus,上样2μl,s为标准品上样5μl(10ng/μl),a1
‑
a3,b1
‑
b3上样量都为50ng);
19.图2a和图2b示出了实施例2和对比例2所提取的基因组dna进行1.0%琼脂糖凝胶电泳及0.8%琼脂糖脉冲凝胶电泳检测的结果图(图2a:1%琼脂糖胶图:图中m
‑
1为trans 2k plus,上样2μl,m
‑
2为trans 15k plus,上样2μl,s为标准品上样5μl(10ng/μl),1、2上样量都为50ng;图2b:0.8%琼脂糖脉冲图:图中m为48kb dna extension ladder,上样8μl,图中对应图2a中样品1、2为原液上样100ng);
20.图3a和图3b示出了实施例3和对比例3所提取的基因组dna进行1.0%琼脂糖凝胶电泳及0.8%琼脂糖脉冲凝胶电泳检测的结果图(图3a:1%琼脂糖胶图:图中m
‑
1为trans 2k plus,上样2μl,m
‑
2为trans 15k plus,上样2μl,s为标准品上样5μl(10ng/μl),d1
‑
d3、c1
‑
c3上样量都为50ng;图3b:0.8%琼脂糖脉冲图:图中m为48kb dna extension ladder,上样8μl,图中对应图3a中样品d1
‑
d3、c1
‑
c3为原液上样100ng);以及
21.图4示出了实施例4所提取的基因组dna进行1.0%琼脂糖凝胶电泳检测的结果图(1%琼脂糖胶图:图中m
‑
1为trans 2k plus,上样2μl,m
‑
2为trans 15k plus,上样2μl,s为标准品上样5μl(10ng/μl),a4
‑
a6上样量都为50ng)。
具体实施方式
22.需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。下面将参考附图并结合实施例来详细说明本发明。
23.根据本发明一种典型的实施方式,提供一种富含次生代谢物的植物组织中dna的提取方法。该提取方法包括干扰物处理、组织细胞裂解、盐析、dna沉淀和清洗步骤,其中,干扰物处理步骤包括:将植物组织同交联聚乙烯吡咯烷酮一起研磨;以及加入漂洗液对研磨后的植物组织进行干扰物漂洗处理;其中,漂洗液包括:100~500mm tris
‑
hcl ph=4.8、0.35~0.5m山梨醇、5~10mm edta ph=4.8、1~5%pvp(m/v)和0.5~2%巯基乙醇(v/v)。
24.本发明中增加了研磨样品组织时加入固体pvpp(交联聚乙烯吡咯烷酮)粉末,pvpp可以通过羰基与花色苷、黄酮类多羟基衍生物等多酚类物质可形成氢键络合物而沉淀下来,达到去除多酚和一部分多糖的效果;增加了样品组织研磨后用漂洗液的漂洗步骤,该步骤能够去除组织细胞匀浆中大部分多糖多酚等次生代谢物。
25.优选的,盐析包括:在组织细胞裂解后加入裂解液体积1/5
‑
1/2的3m醋酸钾溶液ph=4.8进行盐析处理,该步骤能够有效去除部分色素、多糖、蛋白等杂质。
26.在本发明一种典型的实施方式中,提取方法具体包括以下步骤:s1,将植物组织在预冷的研磨管中利用研磨器研磨成粉末状,研磨前研磨管中加入有交联聚乙烯吡咯烷酮粉末;s2,加入漂洗液对研磨后的植物组织进行干扰物漂洗处理,混匀离心弃上清液;s3,向研磨管中加入2~5%ctab裂解液,混匀,使植物组织悬浮,水浴,取出后,室温静置,离心取上清;s4,向s3中得到的上清中加入3m醋酸钾溶液ph=4.8,醋酸钾的加入量是上清液体积的1/5~1/2,离心取上清;s5,向s4中得到的上清中加入等体积苯酚/氯仿/异戊醇抽提后取上清、然后加入等体积氯仿/异戊醇抽提后取上清;s6,向s5中得到的上清中加入异丙醇进行dna沉淀,弃上清;s7,利用75%乙醇清洗dna沉淀;s8,dna沉淀干燥后加入洗脱缓冲液溶解dna沉淀,加入rnase a酶消化rna。将常规2%ctab裂解液优化为5%ctab裂解液,使裂解过程更加充分。
27.在本发明一优选的实施例中,s2中的离心力为2500g~3000g,离心时间为10~15min,s2重复2次或2次以上。在本发明一优选的实施例中,s3中,ctab裂解液为预热至65℃的ctab裂解液,水浴的温度为65℃,水浴的时间为30~60min。在本发明一优选的实施例中,s4中,向s3中得到的上清中加入醋酸钾溶液后,
‑
20~
‑
15℃放置10~20min,离心后取上清。在本发明一优选的实施例中,s5中,苯酚/氯仿/异戊醇中苯酚、氯仿与异戊醇的体积比为25:24:1;氯仿/异戊醇中氯仿与异戊醇的体积比为24:1。在本发明一优选的实施例中,s6中,异丙醇为预冷后的异丙醇,加入体积为上清液体积的0.8倍,然后在
‑
20℃中放置30min,进行dna沉淀。
28.根据本发明一种典型的实施方式,提取方法包括以下步骤:s1,将植物组织转移到已放入陶瓷研磨珠且预冷后的2ml研磨管中,随后加入样植物组织重量1/10
‑
1/2的交联聚乙烯吡咯烷酮粉末,用研磨器将植物组织研磨成粉末状;s2,向研磨管中加入漂洗液,混匀后,2500g~3000g离心10~15min,弃上清液;重复漂洗3~5次;s3,向研磨管中加入65℃预热的2~5%ctab裂解液,混匀,使植物组织悬浮,65℃水浴30~60min;取出后,室温静置1min,离心后转移上清到新管;s4,向s3中得到的上清中加入上清液体积1/5
‑
1/2的3m醋酸钾溶液ph=4.8,混匀,
‑
20~
‑
15℃放置10~20min,离心后取上清;s5,向s4中得到的上清中加入等体积苯酚/氯仿/异戊醇抽提后取上清、然后加入等体积氯仿/异戊醇抽提后取上清;s6,向s5中得到的上清中加入上清液0.8倍体积的异丙醇,混匀,
‑
20℃放置30min进行dna沉淀,离心后弃上清;s7,利用75%乙醇清洗dna沉淀两次;s8,dna沉淀干燥后加入洗脱缓冲液溶(本发明中使用的洗脱缓冲液溶是本领域常规的试剂,例如:cat.no./id:19086,qiagen)溶解dna沉淀,加入10mg/ml rnase a酶放置在37℃金属浴上消化rna。
29.在本发明一优选的实施例中,提取方法包括以下步骤:s1,将0.05g植物组织加入到已放入陶瓷研磨珠且预冷后的2ml研磨管中,加入0.025g的交联聚乙烯吡咯烷酮粉末,用研磨器将植物组织研磨成粉末状;s2,向研磨管中加入1ml漂洗液,混匀后,4℃下2500g离心
10min,弃上清液;重复漂洗3次;s3,向研磨管中加入800μl 65℃预热的5%ctab裂解液、20μl 20mg/ml蛋白酶k和20μl巯基乙醇,混匀,使植物组织悬浮,65℃水浴60min;取出后,室温静置1min,在4℃下12000rpm离心8min,取600μl上清液至新的2.0ml无菌离心管中;s4,向s3中得到的上清中加入300μl 3m醋酸钾溶液ph=4.8,混匀,
‑
20℃放置15min,4℃下12000rpm离心8min,取上清至新的2ml无菌离心管中;s5,向s4中得到的上清中加入800μl苯酚/氯仿/异戊醇上下颠倒混匀,4℃下12000rpm离心8min,取上清至新的2ml无菌离心管中;然后加入800μl氯仿/异戊醇上下颠倒混匀,4℃下12000rpm离心8min,取上清至新的2ml无菌离心管中;s6,向s5中得到的上清中加入上清液0.8倍体积的异丙醇,混匀,
‑
20℃放置30min进行dna沉淀,4℃下12000rpm离心8min,弃上清,瞬时离心,吸弃残留液体;s7,利用75%乙醇清洗dna沉淀两次,4℃下12000rpm离心2min,弃上清;瞬时离心,吸弃残留液体,室温干燥至dna沉淀呈半透明状;s8,dna沉淀干燥后加入洗脱缓冲液溶解dna沉淀,加入10mg/ml rnase a酶放置在37℃金属浴上消化rna;s9,根据dna沉淀量加入适量洗脱缓冲液溶,然后加入1μl 10mg/ml rnase a酶消化rna,37℃孵育15min。
30.本发明对常规ctab提取法的改良之处操作简单、试剂配制容易、经济方便等优点,改良后的dna提取方法得率高、纯度高、重复性好,可直接应用于下游建库。
31.下面将结合实施例进一步说明本发明的有益效果。
32.实施例1
33.狼毒花干燥叶片基因组dna提取(狼毒花干燥叶片含有多糖、生物碱、黄酮类化合物、萜类化合物等高含量复杂次生代谢物)
34.1.将0.05g狼毒花干燥叶片转移到已放入陶瓷研磨珠预冷后的2ml研磨管中,并且加入0.025g的pvpp(交联聚乙烯吡咯烷酮)粉末,液氮速冻后用研磨器将组织充分研磨成粉末状;
35.2.立即加入1ml 1
×
漂洗液,充分混匀,1在4℃下2500g离心10min,弃上清液,重复漂洗至上清液不粘稠;
36.3.漂洗后向沉淀中加入800μl 65℃预热的5%ctab裂解液,20μl蛋白酶k(20mg/ml)和20μl巯基乙醇,充分混匀,使样品完全悬浮,65℃水浴锅中水浴60min;取出后,室温静置1min,在4℃下12000rpm离心8min,取600μl上清液至新的2.0ml无菌离心管中;
37.4.加入300μl 3m kac(ph=4.8),充分混匀,
‑
20℃静置15min,4℃下12000rpm离心8min,取上清至新的2ml无菌离心管中;
38.5.加入800μl苯酚/氯仿/异戊醇抽提液(25:24:1),缓慢上下颠倒充分混匀,4℃下12000rpm离心8min,取上清至新的2ml无菌离心管中;
39.6.加入800μl氯仿/异戊醇(24:1)抽提液,缓慢上下颠倒充分混匀,4℃下12000rpm离心8min,取上清至新的1.5ml无菌离心管中;
40.7.加入0.8倍体积预冷后的异丙醇,迅速混匀,
‑
20℃静置30min,4℃下12000rpm离心8min,弃上清,瞬时离心,吸弃残留液体;
41.8.加入1ml 75%乙醇清洗沉淀两次,4℃下12000rpm离心2min,弃上清;瞬时离心,吸弃残留液体,室温干燥至dna沉淀呈半透明状;
42.9.根据dna沉淀量加入适量洗脱缓冲液溶(cat.no./id:19086,qiagen),然后加入1μl rnase a酶(10mg/ml)消化rna,37℃孵育15min。
43.对比例1
44.本对比例采用经典的2%ctab提取法(2%ctab提取液包括如下成分:100mmol/l tris
‑
hcl(ph8.0),20mmol/l edta(乙二胺四乙酸二钠),1.4mol/l nacl,2%ctab(w/v),1%β
‑
琉基乙醇)与实施例1采用同一样品。
45.核酸定量仪检测结果见表1和图1:
46.表1 nanodrop 2000(thermo)和qubit4.0(invitroge)检测浓度
[0047][0048]
结合表1和图1结果表明:传统2%ctab提取法提取的狼毒花叶片dna溶液粘稠,od值也不合格,提取的得率很低;本实施例提取的dna溶液不粘稠,dna各方面质量都高于传统2%ctab提取法,符合二代建库质量要求。
[0049]
实施例2
[0050]
黄麻叶片基因组dna提取(黄麻叶片为多糖高含量样品)
[0051]
1.将0.5g黄麻叶片转移到已放入陶瓷研磨珠预冷后的2ml研磨管中,并且加入0.25g的pvpp粉末,液氮速冻后用研磨器将组织充分研磨成粉末状;
[0052]
2.立即加入1ml 1
×
漂洗液,充分混匀,1在4℃下2500g离心10min,弃上清液,重复漂洗至上清液不粘稠;
[0053]
3.漂洗后向沉淀中加入800μl 65℃预热的5%ctab裂解液(同实施例1),20μl蛋白酶k(20mg/ml)和20μl巯基乙醇,充分混匀,使样品完全悬浮,65℃水浴锅中水浴60min;取出后,室温静置1min,在4℃下12000rpm离心8min,取600μl上清液至新的2.0ml无菌离心管中;
[0054]
4.加入300μl 3m kac(ph=4.8),充分混匀,
‑
20℃静置15min,4℃下12000rpm离心8min,取上清至新的2ml无菌离心管中;
[0055]
5.加入800μl苯酚/氯仿/异戊醇抽提液(25:24:1),缓慢上下颠倒充分混匀,4℃下12000rpm离心8min,取上清至新的2ml无菌离心管中;
[0056]
6.加入800μl氯仿/异戊醇抽提液(24:1),缓慢上下颠倒充分混匀,4℃下12000rpm离心8min,取上清至新的1.5ml无菌离心管中;
[0057]
7.加入0.8倍体积预冷后的异丙醇,迅速混匀,
‑
20℃静置30min,4℃下12000rpm离心8min,弃上清,瞬时离心,吸弃残留液体;
[0058]
8.加入1ml 75%乙醇清洗沉淀两次,4℃下12000rpm离心2min,弃上清;瞬时离心,吸弃残留液体,室温干燥至dna沉淀呈半透明状;
[0059]
9.根据dna沉淀量加入适量洗脱缓冲液溶(cat.no./id:19086,qiagen),然后加入1μl rnase a酶(10mg/ml)消化rna,37℃孵育15min。
[0060]
对比例2
[0061]
本对比例采用经典的2%ctab提取法,与实施例2采用同一样品。
[0062]
核酸定量仪检测结果见表2、图2a和图2b:
[0063]
表2 nanodrop 2000(thermo)和qubit4.0(invitroge)检测浓度
[0064][0065]
结合表2、图2a和图2b结果表明:传统2%ctab法提取的黄麻叶片dna溶液粘稠,得率不高,od值不合格,而本实施例提取的dna溶液符合二代和三代建库质量要求。
[0066]
实施例3
[0067]
棉花叶片基因组dna提取(棉花叶片为多酚、多糖、单宁等高含量次生代谢物的样品)
[0068]
1.将0.05g棉花叶片转移到已放入陶瓷研磨珠预冷后的2ml研磨管中,并且加入0.025g的pvpp粉末,液氮速冻后用研磨器将组织充分研磨成粉末状;
[0069]
2.立即加入1ml 1
×
漂洗液,充分混匀,1在4℃下2500g离心10min,弃上清液,重复漂洗至上清液不粘稠;
[0070]
3.漂洗后向沉淀中加入800μl 65℃预热的5%ctab裂解液,20μl蛋白酶k(20mg/ml)和20μl巯基乙醇,充分混匀,使样品完全悬浮,65℃水浴锅中水浴60min;取出后,室温静置1min,在4℃下12000rpm离心8min,取600μl上清液至新的2.0ml无菌离心管中;
[0071]
4.加入300μl 3m kac(ph=4.8),充分混匀,
‑
20℃静置15min,4℃下12000rpm离心8min,取上清至新的2ml无菌离心管中;
[0072]
5.加入800μl苯酚/氯仿/异戊醇抽提液(25:24:1),缓慢上下颠倒充分混匀,4℃下12000rpm离心8min,取上清至新的2ml无菌离心管中;
[0073]
6.加入800μl氯仿/异戊醇抽提液(24:1),缓慢上下颠倒充分混匀,4℃下12000rpm离心8min,取上清至新的1.5ml无菌离心管中;
[0074]
7.加入0.8倍体积预冷后的异丙醇,迅速混匀,
‑
20℃静置30min,4℃下12000rpm离心8min,弃上清,瞬时离心,吸弃残留液体;
[0075]
8.加入1ml 75%乙醇清洗沉淀两次,4℃下12000rpm离心2min,弃上清;瞬时离心,吸弃残留液体,室温干燥至dna沉淀呈半透明状;
[0076]
9.根据dna沉淀量加入适量洗脱缓冲液溶(cat.no./id:19086,qiagen),然后加入1μl rnase a酶(10mg/ml)消化rna,37℃孵育15min。
[0077]
对比例3
[0078]
本对比例采用经典的2%ctab提取法,与实施例3采用同一样品。
[0079]
核酸定量仪检测结果见表3、图3a和图3b:
[0080]
表3 nanodrop 2000(thermo)和qubit4.0(invitroge)检测浓度
[0081][0082]
结合表3、图3a和图3b结果表明:传统2%ctab提取的棉花叶片dna溶液有轻微淡褐色,od值偏低甚至不合格,并且dna存在中度降解,dna总量偏低;本实施例提取的棉花叶片dna溶液没有杂色,od值和dna长度及总量都符合二代和三代建库要求。
[0083]
实施例4
[0084]
狼毒花干燥叶片基因组dna提取,实验方法与实施例1相同,除了实施例1中狼毒花叶片采用了5%ctab裂解液,本实施例中裂解液为2%ctab。结果见表4和图4:
[0085]
表4 nanodrop 2000(thermo)和qubit4.0(invitroge)检测浓度
[0086][0087]
与5%ctab裂解液对比,2%ctab只是在得率上偏低,其他能够正常满足合格dna质量要求,符合二代建库要求。
[0088]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

